促甲状腺素( TSH )免疫测定用国家标准品使用说明书
促甲状腺激素(TSH)测定试剂盒(电化学发光免疫分析法)产品技术要求lianzhongtaike

促甲状腺激素(TSH)测定试剂盒(电化学发光免疫分析法)组成:适用范围:本试剂盒用于体外定量测定人体血清样本中促甲状腺激素(TSH)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.01μIU/mL。
2.3 准确度用TSH国家标准品(150530)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[0.01,100.0]μIU/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(5.0±1.0μIU/mL)和(30.0±6.0μIU/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(5.0±1.0μIU/mL)和(30.0±6.0μIU/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性2.6.1 与促卵泡生成激素(FSH)浓度不低于200mIU/mL促卵泡生成激素(FSH)样品,在本试剂盒测定结果应不大于0.01μIU/mL;2.6.2 与促黄体生成素(LH)浓度不低于200mIU/mL促黄体生成素(LH)样品,在本试剂盒测定结果应不大于0.01μIU/mL;2.6.3 与人绒毛促性腺激素(HCG)浓度不低于1000mIU/mL人绒毛膜促性腺激素(HCG)样品,在本试剂盒测定结果应不大于0.01μIU/mL。
2.7 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
促甲状腺激素(TSH)测定试剂(荧光免疫层析法) 产品技术要求万孚

1.性能指标
1.1外观检查
外观应平整,材料附着应牢固,各组分应齐全、完整,标签清晰,卡固定紧密,液体无渗漏。
1.2物理检查
膜条宽为 4.0±0.5mm ;液体移行速度应不低于10mm/min。
1.3准确性
对于没有配备系列校准品的试剂盒,可在试剂盒规定的测量范围内检测国家标准品,其实测值与理论值之比应在0.850~1.150 之间。
1.4最低检出限
应不高于0.1 mIU/L。
1.5剂量-反应曲线的线性
在(0.1~100)mIU/L 区间内,用双对数或其他适当的数学模型拟合,剂量- 反应曲线线性相关系数(r)应不小于0.9900。
1.6精密度
1.6.1分析内精密度
手工操作试剂盒参考品测定结果的变异系数(CV)应不大于15%。
1.6.2批间精密度
在多个不同批次产品之间,参考品测定结果的变异系数(CV)应不大于20%。
1.7特异性
1.7.1与促卵泡生成素(FSH)
浓度不低于200mIU/mL 的FSH,在本试剂盒上的测量结果应不高于本试剂盒的最低检出量水平。
1.7.2与促黄体生成素(LH)
浓度不低于200mIU/mL 的LH,在本试剂盒上的测量结果应不高于本试剂盒的最低检出量水平。
1.7.3与人绒毛膜促性腺激素(hCG)
浓度不低于1000mIU/mL 的hCG,在本试剂盒上的测量结果应不高于本试剂盒的最低检出量水平。
1.8分析间精密度
在 3 次独立分析之间,参考品测定结果的变异系数(CV)应不大于20%。
人促甲状腺激素放射免疫分析药盒

= B/B0×100
标准或样品(STD or Samples)(CPM)—NSB(CPM) ×100
A 标准(STD)(CPM)—NSB(CPM)
剂量-反应曲线按“对数剂量-结合率对数”(Log(dose-Log(B/Bmax))数学模型或四参数
【使用目的】
用于人血清样本中促甲状腺激素(TSH)的定量测定
【实验原理】
促甲状腺激素(TSH)是含 211 个氨基酸的糖蛋白类激素,分子量约为 28,000D,由 α 和 β 两个亚基组成。TSH 主要受下丘脑分泌的促甲状腺激素释放激素(TRH)和血液 中游离的甲状腺激素(T3、T4)的调节。TRH 可促进 TSH 的分泌,T3、T4 对 TSH 的分泌起负反馈调节作用。另外,下丘脑分泌的生长激素释放抑制激素(SS)和肾上 腺皮质分泌的糖皮质激素可降低 TSH 的分泌,而雌激素可增加其分泌。 本品采用了第二抗体+聚已二醇沉淀法放射免疫分析试验原理:含促甲状腺激素(TSH) 的样品和 125I 标记的促甲状腺激素(TSH)与相应的抗体反应形成抗原抗体复合物。反 应后加入二抗及 PEG,使免疫复合物沉淀,离心,测沉淀放射性计数。通过标准曲线 得到样本中促甲状腺激素(TSH)的浓度。
3、取每个浓度的标准品、质控血清和样本 200µl 加入相应编号的试管中;
4、每管均各加入 200µl 标记物工作液;
5、除 T、NSB 管外,每管均各加入 200µl 抗体工作液,充分混匀;
6、室温(20~25℃)放置 12~16 小时;
7、每管均各加入 500µl 分离剂后,充分混匀;
8、离心 3500 转/分,20 分钟后,吸去或倾倒掉上清液;
促甲状腺激素测定试剂盒产品技术要求国赛

促甲状腺激素测定试剂盒产品技术要求国赛摘要:促甲状腺激素(TSH)测定试剂盒是一种通过化学发光免疫分析法来测定人体内促甲状腺激素水平的产品。
本文将从试剂盒的基本原理、技术指标、操作方法、结果判断等方面进行详细介绍,并提出了一些改进方案,以进一步提高其准确性和可靠性。
1.试剂盒的基本原理2.技术指标(1)测定范围:0.1-100mIU/L(2)灵敏度:0.1mIU/L(3)精密度:CV≤10%(4)准确度:与国家标准方法比较,差异不超过±10%3.操作方法(1)样品准备:采集血清样本,离心去除红细胞沉淀。
(2)试剂盒开封:将试剂盒从冰箱取出,放置室温下30分钟使其恢复平衡。
(3)标准曲线制备:用不同浓度的标准品配制标准曲线,按照试剂盒使用说明进行操作。
(4)样品测试:取适量血清样本,按照试剂盒使用说明进行操作,加入发光试剂后进行混匀,开始计时。
(5)数据处理:根据标准曲线上的吸光度值,计算出样品中促甲状腺激素的浓度。
4.结果判断(1)阳性结果:样品中促甲状腺激素浓度超过设定的参考范围上限。
(2)阴性结果:样品中促甲状腺激素浓度在参考范围内。
(3)结果异常:样品中促甲状腺激素浓度超过参考范围上下限,需要进一步检测。
5.改进方案(1)优化抗体:选择更具特异性的抗体,提高试剂盒的选择性。
(2)增加质控品:引入质控品,增加结果的稳定性和可靠性。
(3)提高灵敏度:通过改进试剂盒中的光学材料和化学试剂,提高试剂盒的灵敏度。
(4)缩短操作时间:优化操作流程,减少操作时间,提高实验效率。
(5)降低价格:通过技术改进和成本优化,降低试剂盒的价格,提高产品的竞争力。
总结:促甲状腺激素(TSH)测定试剂盒是一种重要的医学检验试剂,可以用于评估甲状腺功能的正常与否。
本文对其技术要求进行了详细介绍,并提出了一些改进方案,以进一步提高其准确性和可靠性。
希望上述内容能够为促甲状腺激素(TSH)测定试剂盒的开发和优化提供参考。
TSH 贝克曼说明书

超敏人促甲状腺素检测步骤用ACCESS®免疫分析系统对人血清中促甲状腺激素(hTSH) 的定量检测内容表原理 2 标本采集 3 试剂和必须品 3 定标 5 质控 6 步骤 6 结果 6 操作说明7 检测注意事项7 参考文献8Beckman Instruments, Inc. • Chaska, MN 55318原理检测原理Access超敏hTSH检测采用双位点酶免法检测 (“双抗体夹心法”)。
样品、标记了碱性磷酸酶的羊抗hTSH抗体(酶结合物)、蛋白缓冲液以及包被了羊抗大鼠抗体-大鼠抗hTSH抗体复合物的磁性颗粒被一起加入到反应管中,样品中的hTSH和固相在磁性颗粒表面的抗体以及游离的酶结合物在不同的抗原位点上同时发生反应。
而后,反应管被传送到磁性分离区域进行多次冲洗,去处未和固相结合的其它成分。
最后在反应管中加入化学发光底物(Lumi-Phos* 530), 已与固相结合的碱性磷酸酶会使该底物发出光子并被光电比色计所检测。
最后,对照仪器中储存的多点定标曲线中所描述的光量子与标准品hTSH的对应关系而计算出样品中的hTSH浓度。
概述人促甲状腺激素(hTSH) 是几种由两条不对称肽链组成的糖蛋白类激素中的一种,一个α-链,几乎所有激素都一样,一个β-链,在免疫学和生物学上具有特异性,这些相似的结果是对不同的抗血清表现出不同程度的交叉反应性。
Access 超敏hTSH 分析是基于固相的酶免疫反应,被确信不与其它肽类激素发生交叉反应,该反应的特异性和灵敏性使区分甲亢和甲减病人变得简单。
由垂体分泌的TSH是甲状腺功能的关键调节因子,下丘脑分泌的促甲状腺激素释放激素(TRH或TRF)控制着TSH的分泌。
接着,该系统调节了T3和T4的分泌。
外周血中甲状腺激素,T3和T4的浓度受下丘脑监控,形成了激素释放的负反馈机制。
轴控制着甲状腺激素合成、释放和功能,促甲状腺释放激素从下丘脑释放刺激合成和分泌促甲状腺素(TSH),接着,TSH刺激甲状腺激素的合成、储存、分泌和T3、T4的代谢。
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求爱康试剂

促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)1.性能指标1.1试剂条性能指标1.1.1外观试剂盒各组分应齐全、完整,液体无渗漏,包装标签应清晰、准确、牢固;试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
1.1.2空白限应不大于0.005μIU/mL。
1.1.3准确度1.1.3.1在试剂盒规定的线性区间内,检测促甲状腺素国家标准品,测定结果的相对偏差应在±10%范围内。
1.1.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差应在±10%范围内。
1.1.4线性区间试剂盒在0.02μIU/mL~100μIU/mL区间内,其线性相关系数(r)应不小于0.9900。
1.1.5分析内精密度变异系数(CV)应不大于8.0%。
1.1.6批间精密度变异系数(CV)应不大于15.0%。
1.1.7特异性a)含浓度不低于200 mIU/mL的FSH的零浓度TSH样本,检测结果应不高于0.005μIU/mL;b)含浓度不低于200 mIU/mL的LH的零浓度TSH样本,检测结果应不高于0.005μIU/mL;c)含浓度不低于1000mIU/m L的HCG的零浓度TSH样本,检测结果应不高于0.005μIU/mL。
1.2校准品性能指标1.2.1外观校准品应为无色或浅黄色透明液体。
1.2.2装量装量偏差应在±10%之内。
1.2.3准确度Cal 1、Cal 2实测值与标示值的偏差应在±10%以内。
1.2.4均一性对同一瓶校准品1、校准品2分别重复10次检测,对同一批次10瓶校准品1、校准品2进行检测,检测校准品1、校准品2瓶内差CV应≤10%,批内瓶间差CV应≤10%。
1.3质控品性能指标1.3.1外观质控品应为无色或浅黄色透明液体。
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求taige

促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒主要用于体外定量测定人血清中的促甲状腺激素(TSH)含量。
1.1 包装规格48人份/盒,96人份/盒。
1.2 主要组成成分2.1 外观液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量装量不少于标示值。
2.3 准确度试剂盒校准品与国家标准品(编号:150530)同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t-检验);以TSH国家标准品(编号:150530)为对照品,试剂盒校准品的实测效价与标示效价之比应在0.900~1.100范围内。
2.4 剂量-反应曲线线性相关系数在[0.25,50]mIU/L范围内,用双对数数学模型拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度2.5.1 重复性以同批次试剂盒,高低两种浓度的质控血清平行测定10次,求其平均值和标准差(SD),批内精密度(CV%)=SD/平均值×100%,重复性(CV%)应不高于15.0%;2.5.2 批间差三种不同批次试剂盒,对同一样品进行重复测定10次,计算各组测定结果的平均值和标准差(SD),批间精密度(CV%)=SD/平均值×100%,批间差(CV%)应不高于20.0%。
2.6 最低检出量应不高于0.1mIU/L。
2.7 质控血清测定值应在允许的范围之内。
2.8 特异性与浓度为80mIU/L 的促卵泡生成激素(FSH)反应,测定结果应小于0.1 mIU/L;与浓度为2000mIU/L 的人绒毛膜促性腺激素(HCG)反应,测定结果应小于0.1 mIU/L。
2.9 稳定性2.9.1 热稳定性37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 效期稳定性成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
促甲状腺激素测定试剂盒产品技术要求深圳华迈兴微医疗

促甲状腺激素测定试剂盒产品技术要求深圳华迈兴微医疗一、产品介绍促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)是一种用于测定人体血清或血浆中促甲状腺激素(TSH)含量的试剂盒。
该产品采用化学发光免疫分析法,具有高灵敏度、高特异性和高准确性等特点,能够快速、准确地检测血液中的TSH水平,帮助医生进行甲状腺相关疾病的诊断和治疗。
二、技术要求1.试剂盒的组成及规格:-试剂一:免疫固相吸附板(96孔板)。
-试剂二:TSH标准品。
-试剂三:酶标抗体。
-试剂四:酶标底物。
-试剂五:洗涤缓冲液。
-试剂六:稀释缓冲液。
-试剂七:停止液。
-试剂八:试剂盒说明书。
2.试剂盒的性能要求:-灵敏度:试剂盒能够检测到血液中TSH浓度为0.1mIU/L的含量。
-特异性:试剂盒与其他甲状腺相关激素无交叉反应。
-线性范围:试剂盒应能够检测到血液中TSH浓度在0.5-100mIU/L的范围内。
-准确性:试剂盒测定结果与国际标准物质的测定结果相符合。
-稳定性:试剂盒的试剂在储存期限内应稳定,且取用后能够保持一定的稳定性。
3.试剂盒的使用方法:-试剂盒应包含详细的试剂使用说明书,以保证临床使用人员可以正确操作。
-试剂盒应包含标注清晰的试剂混合比例和操作流程。
4.试剂盒的保存要求:-试剂盒应在2-8℃的条件下保存,避免阳光直射和高温。
-试剂盒的有效期应标注在产品包装上,并应在有效期内使用。
5.试剂盒的质量控制:-试剂盒应包含质量控制品,以保证试剂盒的准确性和稳定性。
三、检验方法要求1.血样采集和处理方法:-血样采集应遵循规范化的操作流程,确保血样的准确性和可靠性。
-血样处理方法应包含清除杂质、离心等步骤。
2.检测方法:-试剂盒的检测方法应简单、快捷、准确,并能满足临床诊断的需要。
-试剂盒应配套合适的检测仪器,以保证检测结果的可靠性。
四、质量控制要求1.试剂盒应提供质量控制品,并标注质量控制的方法和范围。
2.试剂盒的试剂和质控品应具有稳定性,以保证在有效期内使用。
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求国赛

2.性能指标2.1试剂条性能指标2.1.1外观试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
试剂条中第7孔内组分为棕色含固体微粒的液体;其余皆为透明液体。
无悬浮物、无沉淀、无絮状物。
2.1.2装量溶液装量应不少于标示值。
其中试剂条第2孔为酶工作液孔,装量不少于80μL;第3、4、5孔为清洗液孔,装量均不少于380μL;第7孔为磁珠工作液孔,装量不少于45μL;第10孔为样本稀释液孔,装量不少于85μL;第12孔为底物孔,装量不少于130μL。
2.1.3空白限应不大于0.05mIU/L。
2.1.4准确性在试剂盒规定的测量范围内检测国家校准品,其实测值与理论值之比应在0.900-1.100之间。
2.1.5剂量-反应曲线的线性在0.1-100mIU/L区间内,其剂量-反应曲线线性相关系数(r)应不小于0.9900。
2.1.6精密度2.1.6.1分析内精密度变异系数(CV)应不大于8.0%。
2.1.6.2批间精密度变异系数(CV)应不大于15.0%。
2.1.7特异性浓度不低于200IU/L的FSH,在本试剂盒上的测定结果应不高于最低检出量水平0.05mIU/L。
浓度不低于200IU/L的LH,在本试剂盒上的测定结果应不高于最低检出量水平0.05mIU/L。
浓度不低于1000IU/L的hCG,在本试剂盒上的测定结果应不高于最低检出量水平0.05mIU/L。
2.2校准品性能指标2.2.1外观校准品CAL1、CAL2为冻干块。
加入纯水后在10min内溶解,无沉淀或絮状物。
2.2.2校准品准确性校准品CAL2,相对偏差应在±10%以内。
校准品CAL1为零浓度校准品除外。
2.2.3校准品均匀性校准品CAL2均匀性CV应≤10%。
校准品CAL1为零浓度校准品除外。
2.3质控品性能指标2.3.1外观质控品为冻干块。
加入纯水后在10min内溶解,无沉淀或絮状物。
2.3.2质控品准确性质控品测试结果应在靶值范围内。
促甲状腺激素测定试剂盒(荧光免疫层析法)产品技术要求danda

促甲状腺激素测定试剂盒(荧光免疫层析法)
组成:
适用范围:该产品用于体外定量检测人血清、血浆或全血中促甲状腺激素(TSH)的含量。
2.1 外观
试剂盒外观应整洁,文字符号标识清晰,液体无渗漏,测试卡完整无破损, 质控品为冻干疏松体,复溶后为无色至淡黄色液体。
2.2装量
样本缓冲液装量与理论装量偏差不超过±10%。
2.3检出限
应不高于0.1μIU/mL。
2.4线性范围
在[0.1,100] μIU/mL内,相关系数R≥0.990。
2.5 重复性
重复测试(5±1)μIU/mL和(20±4)μIU/mL的样本,所得结果的变异系数(CV)应不大于15%。
2.6批间差
测试(5±1)μIU/mL和(20±4)μIU/mL的样本,批间相对极差(R)应不大于15%。
2.7准确度
测定国家标准物质150530,相对偏差不超过±15%。
2.8质控品
2.8.1预期结果
试剂盒内的质控品,检测结果均在质控范围内。
2.8.2均匀性
瓶间差≤15%。
2.8.3复溶稳定性
质控品复溶后在2℃~8℃密封避光保存24h。
检测复溶后的质控品,检测结果均在质控范围内。
2.9效期稳定性
试剂有效期为18个月。
取到效期后3个月内试剂盒进行检测,测定结果应符合2.3、2.4、2.5、2.7、2.8项要求。
2.10溯源性
根据GB/T21415-2008的要求,校准曲线可溯源至国家标准物质150530。
促甲状腺激素(TSH)校准品产品技术要求北京华科泰生物
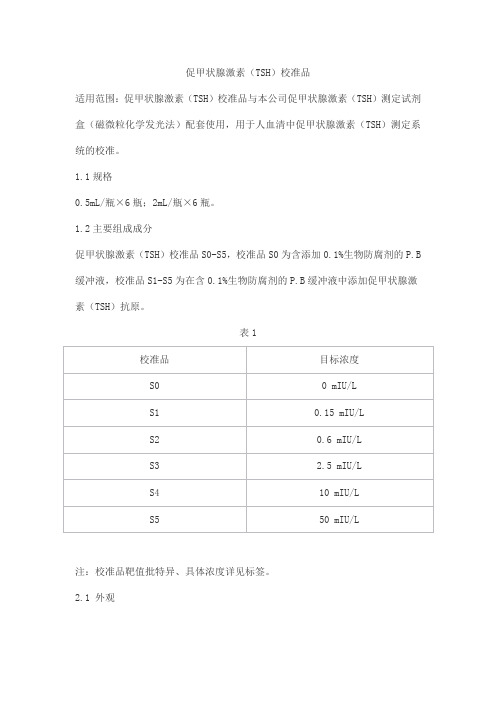
促甲状腺激素(TSH)校准品
适用范围:促甲状腺激素(TSH)校准品与本公司促甲状腺激素(TSH)测定试剂盒(磁微粒化学发光法)配套使用,用于人血清中促甲状腺激素(TSH)测定系统的校准。
1.1规格
0.5mL/瓶×6瓶;2mL/瓶×6瓶。
1.2主要组成成分
促甲状腺激素(TSH)校准品S0-S5,校准品S0为含添加0.1%生物防腐剂的P.B 缓冲液,校准品S1-S5为在含0.1%生物防腐剂的P.B缓冲液中添加促甲状腺激素(TSH)抗原。
表1
注:校准品靶值批特异、具体浓度详见标签。
2.1 外观
校准品包装标签应清晰,无磨损;呈澄清透明的液体,无沉淀或絮状物,液体无渗漏。
2.2 装量
装量应不少于标示值。
2.3 溯源性
根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至中国食品药品检定研究院提供的标准品(编号:150530)。
2.4 准确度
检测中国食品药品检定研究院所提供的TSH标准品(编号:150530),其测量结果的相对偏差应在±10%范围内。
2.5 均匀性
2.5.1 瓶内均匀性
各浓度点(除零外),变异系数(CV)应不高于10.0%。
2.5.2 瓶间均匀性
各浓度点(除零外),变异系数(CV)应不高于15.0%。
2.6 稳定性
2.6.1 首次开封后稳定性
校准品开瓶后,2℃~8℃储存,有效期15天,在效期内赋值结果的变化趋势不显著。
2.6.2 效期稳定性
校准品原包装2℃~8℃储存,有效期12个月,在效期内赋值结果的变化趋势不显著。
促甲状腺素测定标准操作规程

促甲状腺素测定标准操作规程1 检验申请单独检验项目申请:促甲状腺素测定(缩写hTSH);组合检验项目申请:甲状腺检查组合;临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约2ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5 下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml的全血标本,或少于0.1ml 的血清或血浆。
2.1.5.2对于测定和吸样有干扰的标本:如近期使用鼠源性单克隆抗体诊断后采取。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清, 避免溶血。
离心必须达到4000rpm×15min,离心后的血清中不能含有颗粒物或微量纤维蛋白。
2.2.2标本保存时间:室温(15~25℃)下可稳定8h,普通冰箱中(2~8℃)稳定48h。
需较长时间保存应将血清存放于-20℃。
冰冻标本仅可冻融一次。
2.2.3已完成测试的标本保持完整的识别号,置2~8℃冰箱内保存7d。
2.3标本采集的注意事项2.3.1采血前使受检者保持平静、松弛、避免剧烈活动。
2.3.2采血后应使血液充分凝固,离心后的血清中不能含有颗粒物或微量纤维蛋白;可使用选用肝素、EDTA抗凝的血液标本。
3 方法原理采用夹心型酶免疫发光分析法。
标本与羊抗TSH-ALP结合物、含有缓冲液的蛋白溶液以及包被了鼠抗TSH单克隆抗体的磁性微粒子共同反应,(羊抗鼠抗体用于固定鼠抗TSH抗体)。
血清TSH与固相化的抗TSH单克隆结合,而羊抗TSH-ALP结合物与血清TSH上的不同的抗原位点反应,形成微粒子-TSH-羊抗体-ALP免疫复合物。
促甲状腺激素操作规程

促甲状腺素测定标准操作规程1 检验申请单独检验项目申请:促甲状腺素测定(缩写TSH);组合检验项目申请:甲状腺检查组合;临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约2ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5 下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2对于测定和吸样有干扰的标本:如近期使用鼠源性单克隆抗体诊断后采取。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清, 避免溶血。
离心必须达到4000rpm×15min,离心后的血清中不能含有颗粒物或微量纤维蛋白。
2.2.2标本保存时间:室温(15~25℃)下可稳定8h,普通冰箱中(2~8℃)稳定48h。
需较长时间保存应将血清存放于-20℃。
冰冻标本仅可冻融一次。
2.2.3已完成测试的标本保持完整的识别号,置2~8℃冰箱内保存7d。
2.3标本采集的注意事项2.3.1采血前使受检者保持平静、松弛、避免剧烈活动。
2.3.2采血后应使血液充分凝固,离心后的血清中不能含有颗粒物或微量纤维蛋白;可使用选用肝素、EDTA抗凝的血液标本。
3 方法原理促甲状腺素测定采用双位点加心化学发光免疫分析法,其检测原理来如下:第一步:将标本与包被着抗甲状腺激素抗体的超顺磁性磁珠以及另外抗甲状腺激素抗体-碱性磷酸结合物添加到反应管中,经过孵化,标本中的促甲状腺激素与固定在磁珠上的促甲状腺激素抗体结合,同时促甲状腺激素抗体-碱性磷酸结合物与样本中促甲状旁腺素另一位点结合。
促甲状腺素测定试剂盒(酶联免疫吸附法)产品技术要求xieheluoke

促甲状腺素测定试剂盒(酶联免疫吸附法)适用范围:用于体外定量检测人全血中促甲状腺素(TSH)的浓度。
1.1产品规格:96人份/盒、192人份/盒和480人份/盒1.2主要组成成分注:校准血片浓度具有批特异性,每批靶值详见瓶签;质控血片质控范围靶值批特异详见产品试剂盒中‘靶值单’2.1外观试剂盒中液体组分无渗漏,标识清晰易识别。
2.2准确度用TSH国家标准品进行检测,其相对偏差应不超过±15%。
2.3最低检测限不大于2.2µU/ml。
2.4线性线性范围为(0,150)µU/ml,其相关系数r值不低于0.9900。
2.5重复性用至少2个浓度水平的样本各重复检测10次,其变异系数(CV)不大于12%。
2.6批间差用3个批号试剂盒检测同一份样本,则3个批号试剂盒之间变异系数(CV)应不大于15%。
2.7特异性a)HCG浓度为100,000 µU/L.时TSH浓度与本底的差值不大于2.2µU/ml;b)FSH浓度为250mU/L时TSH浓度与本底的差值不大于2.2µU/ml;c)LH 浓度为250mU/L 时TSH浓度与本底的差值不大于2.2µU/ml。
2.8稳定性试剂盒在2~8℃储存,有效期为12个月,取到效期后产品进行检测,检测结果应符合2.1~2.5、2.7项要求。
2.9校准品溯源性企业应根据GB/T21415-2008及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,试剂盒的校准品应溯源至企业工作校准品,企业工作校准品根据制造商选定测量程序,溯源至国家标准品(编号:150530)。
促甲状腺素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求beifang

促甲状腺素(TSH)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中促甲状腺素(TSH)的含量。
试剂盒包装规格为96人份/盒,具体组成见表1:表1 试剂盒主要组成成分2.1外观和物理检查试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
各组分装量不少于表1中要求。
2.2准确性试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用双对数(Log-Log)数学模型拟合,要求两条剂量-反应曲线不显著偏离平行;以TSH国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.3剂量-反应曲线的线性在0.10~50mIU/L范围内,用Log-Log数学模型拟合,剂量-反应曲线相关系数(r)应不小于0.9900。
2.4精密度2.4.1分析内精密度:质控品测定结果的变异系数(CV)应不大于15.0%。
2.4.2分析间精密度:在三次独立分析之间,质控品测定结果的变异系数(CV%)应不大于20.0%。
2.4.3批间精密度:在三个不同批次产品之间,质控品测定结果的变异系数(CV%)应不大于15.0%。
2.5最低检出限应不高于0.05mIU/L。
2.6特异性检测浓度为200IU/L的促卵泡生成素(FSH)结果不高于0.05mIU/L。
检测浓度为200IU/L的促黄体生成素(LH)结果不高于0.05mIU/L。
检测浓度为1000IU/L的人绒毛膜促性腺激素(hCG)结果不高于0.05mIU/L。
2.7稳定性2.7.1 效期末稳定性试剂盒在2~8℃放置12个月,检验结果应符合上述2.1、2.2、2.3、2.4.1、2.4.2、2.5要求。
2.7.2 热稳定性试剂盒在37℃条件下放置7天,检验结果应符合上述2.1、2.2、2.3、2.4.1、2.4.2、2.5要求。
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)产品技术要求dacheng
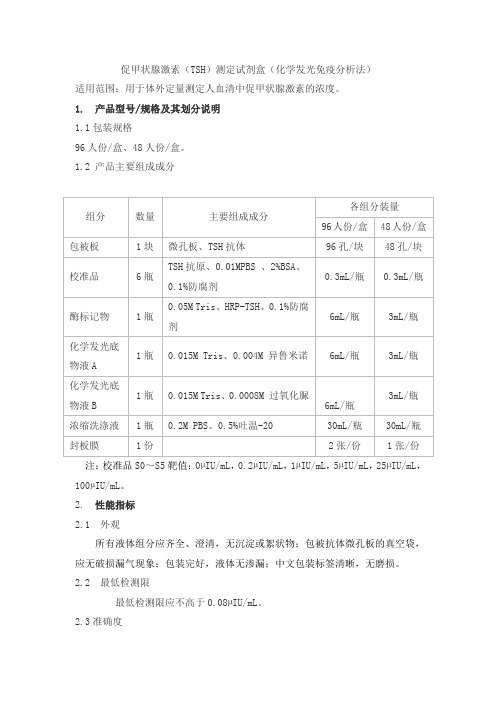
促甲状腺激素(TSH)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中促甲状腺激素的浓度。
1. 产品型号/规格及其划分说明1.1包装规格96人份/盒、48人份/盒。
1.2 产品主要组成成分注:校准品S0~S5靶值:0µIU/mL,0.2µIU/mL,1µIU/mL,5µIU/mL,25µIU/mL,100µIU/mL。
2. 性能指标2.1 外观所有液体组分应齐全、澄清,无沉淀或絮状物;包被抗体微孔板的真空袋,应无破损漏气现象;包装完好,液体无渗漏;中文包装标签清晰,无磨损。
2.2 最低检测限最低检测限应不高于0.08µIU/mL。
2.3准确度试剂盒内校准品与相应浓度的国家标准品(编号:150530)同时进行分析测定,用双对数数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以TSH国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.4 线性[0.2,100]µIU/mL浓度范围内,相关系数(r)绝对值应不低于0.9900。
2.5 重复性用高低两个浓度的样本,各重复检测10次,变异系数(CV)应不大于15%。
2.6 批间差用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的批间变异系数(CV)应不大于20.0%。
2.7 特异性特异性应符合如下要求:a)不低于浓度为200IU/L的促卵泡生成激素(FSH),在本试剂盒上的测定结果应不高于试剂盒的最低检测限水平;b)不低于浓度为200IU/L的促黄体生成激素(LH),在本试剂盒上的测定结果应不高于试剂盒的最低检测限水平;c)不低于浓度为1000IU/L的人绒毛膜促性腺激素(HCG),在本试剂盒上的测定结果应不高于试剂盒的最低检测限水平。
2.8 稳定性2℃~8℃放置8个月后,测定结果应符合2.1~2.5各项要求。
促甲状腺激素TSH标准操作程序SOP文件

自动控制试剂温度和开/关试剂瓶盖。
定标:
每批TSH试剂有一条形码标签,含有该批试剂定标所需的特殊信息。应用TSH CalSet定标液定标。
定标频率:
每批试剂必须用新鲜试剂(试剂经仪器注册24小时以内)标定一次,
如再次标定即根据下列要求:
ABCD医院
免疫实验室
文件编号:
ABCD-02-10
促甲状腺激素TSH
版序:ABCD
页码:第1页,共4页
用途:
用免疫学方法定量测定人血清或血浆中的促甲状腺激素(thyrotropin,TSH)含量。电化学发光免疫测定试剂,适用于罗氏Elecsys、2010免疫测定分析仪。
概述:
TSH是一种分子量为30kD的蛋白质,由二种亚单位组成。β亚单位携带TSH特异的免疫学和生物学信息;α亚单位携带种族特异性信息,与LH、FSH和hCG的α链上的某些氨基酸组成的肽段有一致性。TSH在垂体前叶的特异性嗜碱细胞内生成。垂体释放TSH是机体发挥甲状腺素生理作用的中枢调节机制,刺激甲状腺素的生成和分泌,并有增生效应。TSH检测是查明甲状腺功能的初筛试验。游离甲状腺浓度的微小变化就会带来TSH浓度向反方向的显著调整。因此,TSH是测试甲状腺功能的非常敏
ABCD医院
免疫实验室
文件编号:
ABCD-02-10
促甲状腺激素TSH
版序:ABCD
页码:第4页,共4页
检测范围:
0.005-100μIU/ml
稀释:
高于检测范围的标本可用通用稀释液稀释。建议1:10稀释。稀释后的标本TSH含量必须高于10μIU/ml。如用手工稀释,结果应乘上稀释倍数。如果是机器自动稀释,机器会自动计算结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
促甲状腺素(TSH)免疫测定用国家标准品使用说明书
1.促甲状腺素(TSH)免疫测定用国家标准品(批号:150530-0312)是以人垂体源TSH 为原料制备,供TSH免疫分析使用。
2.本标准品为冻干品,每支安瓿内含TSH约0.333μg,人血清白蛋白(HAS)10mg,磷酸盐微量。
3.以TSH国际标准品(80/558)为对照品,经协作标定,本标准品每支安瓿内免疫活性为600μIU。
4.使用时应以一定量含蛋白的磷酸盐缓冲液(PH=7.2-7.4)或其他含蛋白的中性缓冲体系将内容物完全溶解,充分混合后使用。
5.本标准品长期保存应在-20℃以下;复融后如需多次使用可分装小瓶。
密封,-20℃保存,避免反复冻融。
中国药品生物制品检定所
2003.12。
