有机合成-概念与方法(下)
大学有机化学有机合成全面总结

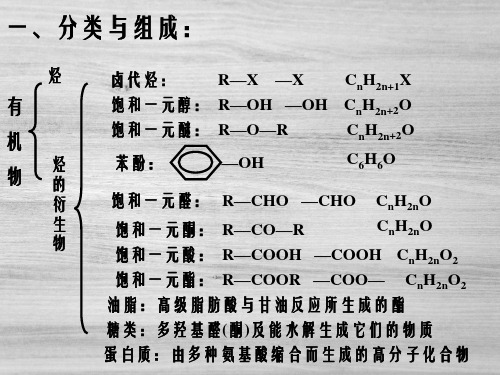
OH
α -氰 醇
α -羟 基 酸
应用范围:醛、甲基脂肪酮 、C8以下环酮
2. 增加二个碳原子的反应
R MgX + CH2 CH2 O
R CH2CH2 H3O+ RCH2CH2OH OMgX
3. 增加多个碳原子的反应
① R-C CH NaNH2 R-C CNa R/X R-C C-R/
其中:R/ 为伯卤代烃 X 为Cl、Br、I
H2O / OH- PX3 Mg
NH3 R-NH2
R-MgX
R-X
① ②
CO2 H3O+
R-COOH
H3O+
NaCN
R-CN
R-NH2 R-NHR
[H]
R-CH2NH2
R-X
R-NR2
2. 羧酸及其衍生物的转换
R-COCl
NH3
R-CONH2
R/OH
R-COOH
NH3
R-COOR/
R/OH
(RCO)2O
H2SO4 H2O
① (BH3)2 ② H2O2 /
OH-
R-CH-CH3(符合马氏规则) OH
R-CH2CH2OH(反马氏规则)
[H]
② R-C=O H(R/) [ O ]
R-CH-OH H(R/)
[ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
③ R-COOR/ [ H ] R-CH2OH + R/OH [ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
R-NH2
● 碳环的合成
① 双烯合成(D-A反应)
X△
-X
有机合成单晶培养经验与技巧总结

有机合成单晶培养经验与技巧总结所谓单晶,即结晶体内部的微粒在三维空间呈有规律地、周期性地排列,或者说晶体的整体在三维方向上由同一空间格子构成,整个晶体中质点在空间的排列为长程有序。
单晶整个晶格是连续的,具有重要的工业应用。
在有机合成中,培养单晶主要是为了通过X-RAY确认结构。
一、长单晶经验总结1、低温缓慢挥发。
一般保持在-20度,用微量真空缓慢抽去溶剂。
通常24~48小时里就可以见到结果,成不成。
这个方法需要注意添加液氮和干冰。
此方法适于室温和空气中不太稳定的化合物。
2、高温溶解缓慢降温。
通常采取高沸点的溶剂溶解样品,然后用铝薄膜包住整个油浴,停止加热,令其温度缓慢下降到室温,再保持1到2天,让过饱和的溶液尽量结晶出来。
这个方法需要注意,降温不能太快,还要注意溶液的浓度。
此方法适合于化合物溶解度差异比较大,而且对无水无氧要求的化合物比较合适。
3、混和溶剂挥发。
用易挥发良溶剂溶解样品,然后小心加入不良溶剂,尽量保持分层状态,令其自我缓慢扩散。
这个方法需要注意溶剂搭配选择。
4、简单挥发。
也就是用溶剂溶解之后,用septum封住,然后插根细针头,令其缓慢挥发。
5、浓缩。
样品溶解于溶剂之后,加一个90度弯管和一个接受瓶。
整个体系稍微抽一点点真空,接受瓶用干冰冷却,令溶剂蒸气在接受瓶里面缓慢冷凝下来,直到有单晶形成。
这个方法需要注意冷凝速度,太快不能得到单晶。
6、溶剂扩散。
这是上面(3)的变通。
加工一底下细瓶颈的带teflon stopper的长管。
用良溶剂把少量样品溶解,转入长管,体积大概1~2 mL,加的量刚好在细瓶颈中间。
然后直立长管,在上面加入不良溶剂直到接近上面的出口,堵死。
之后,小心令长管直立绑在没有振动的地方,让溶剂缓慢相互扩散。
此方法适合于少量样品,无水无氧操作。
7、核磁管办法。
这个跟上面的(4)差不多,量少而且需要耐心等待。
8、冰箱冷冻。
通常比较难于结晶的样品,室温下配成接近饱和溶液之后,放入冰箱,令其缓慢结晶。
第二章 5精细有机合成的基本反应(氨解、胺化和酰化、酯化反应)

R—N(CH3)2
直接合成二甲 叔胺的方法
10
R=C8H17 ,C12H25 ,C16H33
羟基化合物的氨解 ⑵ 工业合成法: 工业合成法: ① 气固相接触催化氨解法
(1)应用: 应用:甲醇氨解制二甲胺; 甲醇氨解制二甲胺; (2)催化剂: 催化剂:SiO2/Al2O3(主催化剂); 主催化剂); (3)温度: 温度:350~500℃; (4)压力: 压力:0.5~5MPa。
25
2.8 酰化和酯化反应
2.8.1 概 述 2.8.2 N-酰化反应 2.8.3 酯化反应
26
概 述
2.8.1 概 述
问题: 问题:常用的酰基化试剂有哪 些?最活泼的酰化试剂是什么? 最活泼的酰化试剂是什么?
一、酰基化反应的含义: 酰基化反应的含义:
酰化反应指的是有机分子中与碳原子 酰化反应指的是有机分子中与碳原子、 指的是有机分子中与碳原子、氮原子、 氮原子、磷原子 、氧原子或硫原子相连的氢 氧原子或硫原子相连的氢被酰基( 酰基(>C=O)所取代的 反应。 反应。 氨基氮原子上的氢被酰基所取代的反应称N-酰化, 酰化,生成 的产物是酰胺。 的产物是酰胺。 羟基氧原子上的氢被酰基取代的反应称O-酰化, 酰化,生成的 产物是酯, 产物是酯,故又称酯化。 故又称酯化。 碳原子上的氢被酰基取代的反应称C-酰化, 酰化,生成产物是 醛、酮或羧酸。 酮或羧酸。
第二章 精细有机合成的基本反应
2.1 概 述 2.2 磺化/硫酸化反应 2.3 硝化和亚硝化反应 2.4 卤化反应 2.5 氧化反应 2.6 氢化和还原反应 2.7 氨解和胺化反应 2.8 酰化和酯化反应 2.9 水解反应
1
2.7 氨解和胺化反应
2.7.1 概 述 2.7.2 羟基化合物的氨解 2.7.3 加成胺化 2.7.4 取代氨解 2.7.5 直接氨化
有机化学知识的基本概念第一节有机化合物的组成和结构
强极性键:如C—O、O—H、C—X等键,一般性质活泼, 较易断裂而发生化学反应。
三、结构与性质的关系:
1、结构与物理性质: (1)熔、沸点:分子量越大;分子中支链越少;分子极
性越大的熔沸点越高。 (2)、溶—解C性H:O只等有官分能子团中的含低有级—化O合H物、可—溶N于H2水、。—其CO余O的H
反应基团:C=C、C=O、C≡C、苯环上的键等
C=O + H—H → H—C—O—H (加氢)
C=C + H—CN → H—C—C—CN (加氢氰酸)
C=C + H—X → H—C—C—X (加卤化氢) C=C + H—OH → H—C—C—OH (加水)
加成反应的规律
. 1mol双键需1molH2 ; 1mol叁键需2molH2 .加成反应发生后,碳链结构不变,一般碳原子数目不 变,但加氢氰酸(HCN)后,碳原子数增加一个。
单体分子中一般应含有至少两个可以发
缩
生缩合反应的官能团
聚 特 反应通常发生在官能团上
反 点 高分子链中一般要通过氧、氮等原子相
·能发生银镜反应的物质有:醛、甲酸、甲酸酯、甲酸盐
有机物燃烧的规律: ⑴ N→有N机2、物X燃→烧H时X,各元素的最终产物:C→CO2、H→H2O、 ⑵烃和烃的含氧衍生物完全燃烧后,产物均为CO2和H2O ⑶烃的含氧衍生物燃烧的耗氧量可转化为烃燃烧的耗氧量
⑷1molC消耗1molO2,4molH消耗1molO2 ⑸ Cn符H2合nO通z的式有C机nH物2nO完z全的燃有烧机,物其完产全物燃C烧O规2和律H:2O(符g)合的通体式积相等。 ⑹100℃以上,有机物完全燃烧前后气体体积不变化的规律。
第九章有机化学基础第7讲有机合成与推断(基础课)-2025届高考化学一轮复习(人教版)配套课件

高考真 题
课时作业
高考总复习·化学
(2)碳链减短的反应 ①烷烃的裂化反应; ②酯类、糖类、蛋白质等的水解反应; ③利用题目信息所给反应,如:烯烃、炔烃的氧化反应,羧酸及其盐 的脱羧反应……
课程标 准
基础知 识
高考真 题
课时作业
高考总复习·化学
(3)常见由链成环的方法 浓硫酸
①二元醇成环:如:HOCH2CH2OH――△→ ____________________; 浓硫酸
②羟基酸酯化成环:如:HOCH2CH2CH2COOH △
______________________________________;
课程标 准
基础知 识
高考真 题
课时作业
③氨基酸成环:如:H2NCH2CH2COOH―→
______________________________; 浓硫酸
④二元羧酸成环:如:HOOCCH2CH2COOH ――△→ ;
高考总复习·化学
课程标 准
基础知 识
高考真 题
课时作业
高考总复习·化学
第7讲 有机合成与推断(基础课)
课程标 准
基础知 识
高考真 题
课时作业
高考总复习·化学
1.根据合成路线图学会推断有机物的结构,判断反应条件及熟练书写 化学方程式。
2.根据信息能设计有机化合物的合成路线。
课程标 准
基础知 识
高考真 题
课程标 准
基础知 识
高考真 题
课时作业
高考总复习·化学
已知 起始原料制备
参照上述合成路线,设计一条由苯和乙酸为 的合成路线。
CH3COOH―SO―C→l2 ________________________________________________________
有机合成化学第一章绪论

Nobel Prizes
生化 结构 方法 理论 高分子 反应 天然产物
15 3
6
3
4
8
19
科学研究至高无上的荣誉。自 1901年开始至2012年 应有112届,其中8届未公布, 即有104届,其中58届与 有机化学有关: 与有机化学有关的Nobel奖 与有机合成有关:31项
1.2 现代有机合成化学的 01 添 加 标 题
1958-1965,9月, 汪猷、邢其毅合作,
经7年努力,于1965年9月合成成功。
1970-1981年, 王德宝,汪猷 1981 年11月合成了第一个具有完整生理活性
的酵母丙氨酸转移核糖核酸。
非天然产物的合成--有独特结构兴趣
●富勒烯C60:碳的新同素异形体;亲双烯试剂;亲偶极试剂;自由基储存体。
聚四氟乙烯 “塑料王”
合成纤维
合成橡胶的用途
合成橡胶与天然橡胶相比,具有高弹性,绝缘性、耐油和耐高温 等性能,因而广泛应用于工农业、国防、交通及日常生活中。
防水透气材料 玻璃钢材料 防臭鞋垫 隐形眼镜 功能性材料
高分子时代
1
添加标题
石器时代
2
添加标题
青铜器时代
3
添加标题
铁器时代
4
添加标题
钢铁时代
用途广泛,可用来合成“涤纶”(的确良)等高分 子化合物,还可用作薄膜、橡胶、增塑剂、干燥剂、 刹车油等原料,又是常用的高沸点溶剂。
乙二醇经加热后产生的蒸气可用作舞台烟幕,乙二 醇的硝酸酯是一种炸药。
有机合成
●贡献卓越:人类物质文明进
◆ 1996年,美国斯坦福大学Wender教授对
步与生活水平提高。
合成材料显神威 神九飞天
有机合成:第六章 开环和关环

6.1.4 中环和大环的形成 要形成中环(8~11元环)和大环(≥12元环),必须应
用特殊的方法——通常为高度稀释技术:非环前体非常慢 地加到反应介质中,以致于其浓度很低(10 -3 ≤ M),使 分子间反应的可能性大大减少,同时分子内的各种构象互 变更容易,有利于分子内反应。
从反应类型分,形成中环和大环的反应主要有: (1)缩合反应; (2)偶姻反应; (3)有机金属化合物反应。
hv
(1)
+ CH2N2
(2)
21
6.5 总结 环状化合物的合成方法 (一)非芳香环化合物 (1)饱和的“五元”、“六元”环:可通过一般的亲 电试剂和亲核试剂相互作用得到(可参见第四、第五章的 方法)。 (2)饱和中环和大环:使用特殊方法①高度稀释技术, ②偶姻反应。 (3)部分饱和环:①上述(1)、(2)的方法,②周 环反应,③不饱和状态通过消除反应产生,④芳香化合物 或其它物种的部分氧化。
反应特点:
(a)在单环化合物的合成中,闭环步骤常包括碳-杂 原子键的形成;
(b)如果系统中含有2个相邻的杂原子,则在闭环步骤 中很少涉及杂原子-杂原子键的形成;
(c)如果目标分子是双环的,并具有与苯环稠合的杂原 子,则原料几乎总是预先形成苯的衍生物。分有: (I)单环化合物的形成; (Ⅱ)苯并稠环化合物的形成。
O C
O C O
O
AlCl3
O C
HO2C
H2, 压 力
催化剂
O
O C
CO2H
(返回)
37
单环(杂芳香环)化合物的形成 含氧的芳杂环的形成,闭环过程常涉及到烯醇作亲核试
剂, 而质子化的羰基则作亲电试剂,反应过程:
H2C
CH2
有机化学基础知识点整理酸与酰肼的酰肼化反应

有机化学基础知识点整理酸与酰肼的酰肼化反应酸与酰肼的酰肼化反应酰肼化反应是有机化学中一种常见的反应类型,其主要通过将酸与酰肼反应生成酰肼酯或酰肼酮。
在本文中,我们将整理酸与酰肼的酰肼化反应的基础知识点。
一、酸与酰肼的基本概念1. 酸(Acid):指能够提供H+离子或接受了一个电子对的化合物,即能够donate H+离子的物质。
2. 酰肼(Hydrazide):由肼或肼的衍生物与酸反应得到的化合物,通常含有-NHNH2基团。
二、酰肼化反应的机理酰肼化反应是指酸与酰肼之间的反应,生成酰肼酯或酰肼酮的过程。
其反应机理如下:1. 核心步骤:在酸性条件下,酸中的酸性质子攻击酰肼中的肼基氮原子,形成酰肼酯或酰肼酮。
2. 生成方式:根据酰肼所处的位置,酰肼化反应可分为α-酰肼化反应和β-酰肼化反应两种类型。
- α-酰肼化反应:酰肼中的肼基氮原子与酸中的酸性质子相结合,形成α-酰肼酯或α-酰肼酮。
- β-酰肼化反应:酰肼中的肼基氮原子与酸中的碳原子相结合,形成β-酰肼酯或β-酰肼酮。
三、酸与酰肼的常见反应条件1. 反应溶剂:酸与酰肼的酰肼化反应可以在多种溶剂中进行,如醚类、酮类、醇类等。
2. 温度:通常在室温下或微温下(0-10℃)反应即可进行。
3. 酸性条件:为了促进反应的进行,常常需要在酸性条件下进行反应,常用的酸有无水乙酸、稀硫酸等。
四、酸与酰肼的应用1. 药物合成:酰肼化反应在药物合成中得到广泛应用,可用于构建酰肼酯或酰肼酮骨架,进一步合成具有生物活性的分子。
2. 有机合成:酰肼化反应可以用于构建碳-碳键和碳-氮键,为有机合成提供了一种重要的方法。
3. 杂环化合物合成:酰肼化反应可用于杂环化合物的构建,以及中间体的制备。
结论通过本文的整理,我们对酸与酰肼的酰肼化反应有了更深入的了解。
酸与酰肼反应生成酰肼酯或酰肼酮,该反应在药物合成和有机合成中具有重要的应用价值。
通过进一步研究与实践,我们可以更好地掌握酸与酰肼的反应条件和应用方法,为有机化学领域的发展做出贡献。
有机合成方法
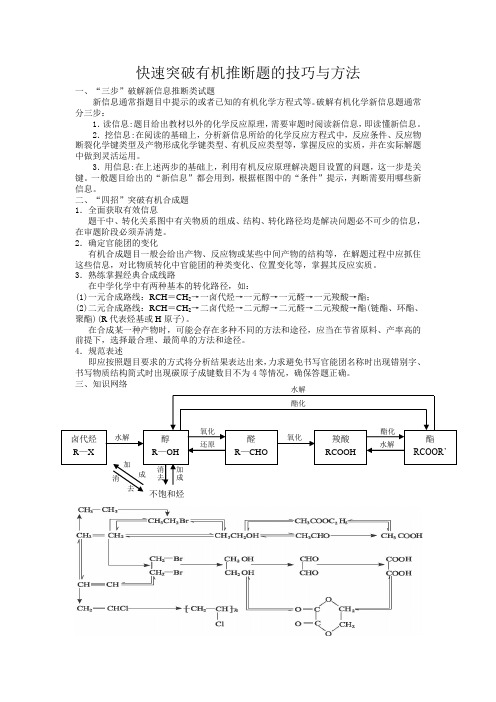
快速突破有机推断题的技巧与方法一、“三步”破解新信息推断类试题新信息通常指题目中提示的或者已知的有机化学方程式等。
破解有机化学新信息题通常分三步:1.读信息:题目给出教材以外的化学反应原理,需要审题时阅读新信息,即读懂新信息。
2.挖信息:在阅读的基础上,分析新信息所给的化学反应方程式中,反应条件、反应物断裂化学键类型及产物形成化学键类型、有机反应类型等,掌握反应的实质,并在实际解题中做到灵活运用。
3.用信息:在上述两步的基础上,利用有机反应原理解决题目设置的问题,这一步是关键。
一般题目给出的“新信息”都会用到,根据框图中的“条件”提示,判断需要用哪些新信息。
二、“四招”突破有机合成题1.全面获取有效信息题干中、转化关系图中有关物质的组成、结构、转化路径均是解决问题必不可少的信息,在审题阶段必须弄清楚。
2.确定官能团的变化有机合成题目一般会给出产物、反应物或某些中间产物的结构等,在解题过程中应抓住这些信息,对比物质转化中官能团的种类变化、位置变化等,掌握其反应实质。
3.熟练掌握经典合成线路在中学化学中有两种基本的转化路径,如:(1)一元合成路线:RCH=CH2→一卤代烃→一元醇→一元醛→一元羧酸→酯;(2)二元合成路线:RCH=CH2→二卤代烃→二元醇→二元醛→二元羧酸→酯(链酯、环酯、聚酯)(R代表烃基或H原子)。
在合成某一种产物时,可能会存在多种不同的方法和途径,应当在节省原料、产率高的前提下,选择最合理、最简单的方法和途径。
4.规范表述即应按照题目要求的方式将分析结果表达出来,力求避免书写官能团名称时出现错别字、书写物质结构简式时出现碳原子成键数目不为4等情况,确保答题正确。
三、知识网络卤代烃R—X醇R—OH醛R—CHO羧酸RCOOH酯RCOOR’水解酯化氧化还原氧化酯化水解不饱和烃加成消去消去加成四、有机推断题的突破口1.牢记特殊反应条件与反应类型的关系①NaOH水溶液,加热:卤代烃水解反应生成醇(醛、羧酸),酯类的水解反应。
有机合成中有机物官能团的引入、消除和转化方法

有机合成中有机物官能团的引进、与消战转移要领之阳早格格创做1.官能团的引进2.官能团的消去(1)通过加成反应与消没有鼓战键.(2)通过消去反应、氧化反应或者酯化反应与消羟基(—OH).(3)通过加成反应或者氧化反应与消醛基(—CHO).(4)通过消去反应或者火解反应与消卤素本子.3.官能团的转移(1)利用衍变闭系引进官能团,如卤代烃火解与代伯醇(RCH2OH)氧化还本醛――→氧化羧酸.(2)通太过歧的反应道路减少官能团的个数,如(3)通太过歧的反应,改变官能团的位子,如有机合成中碳架的构修1.有机成环反应(1)有机成环:一种是通过加成反应、散合反应去真行的;另一种是通过起码含有二个相共或者分歧官能团的有机物脱去小分子物量去真行的.如多元醇、羟基酸、氨基酸通太过子内或者分子间脱去小分子火等而成环.(2)成环反应死成的五元环或者六元环比较宁静.2.碳链的删少有机合成题中碳链的删少,普遍会以疑息形式给出,罕睹的办法如下所示.(1)与HCN的加成反应(2)加散或者缩散反应,如n CH2(3)酯化反应,如CH3CH2OH+CH3COOH浓 CH3COOCH2CH3+H2O.3.碳链的减短(1)脱羧反应:R —COONa +NaOH ――→CaO △R —H +Na 2CO 3.(3)火解反应:主要包罗酯的火解、蛋黑量的火解战多糖的火解.(4)烃的裂化或者裂解反应:C 16H 34――→下温C 8H 18+C 8H 16;C 8H 18――→下温C 4H 10+C 4H 8.合成门路的采用1.中教罕睹的有机合成门路(1)一元合成门路:卤代烃――→NaOH/H2O △一元醇―→一元醛―→一元羧酸―→酯(2)二元合成门路:――→NaOH/H2O 二元醇―→二元醛―→二元羧酸―→⎩⎪⎨⎪⎧ 链酯环酯下散酯(3)芳香化合物合成门路:2.有机合成中罕睹官能团的呵护(1)酚羟基的呵护:果酚羟基易被氧化,所以正在氧化其余基团前不妨先使其与NaOH 反应,把—OH 形成—ONa(或者—OCH 3)将其呵护起去,待氧化后再酸化将其转移成—OH.(2)碳碳单键的呵护:碳碳单键也简单被氧化,正在氧化其余基团前不妨利用其与HCl 等的加成反应将其呵护起去,待氧化后再利用消去反应转移成碳碳单键.(3)氨基(—NH 2)的呵护:如正在对于硝基甲苯――→合成对于氨基苯甲酸的历程中应先把—CH3氧化成—COOH之后,再把—NO2还本为—NH2.预防当KMnO4氧化—CH3时,—NH2(具备还本性)也被氧化.有机合成中有机物官能团的引进、与消战转移要领训练【例1】工业上用甲苯死产对于羟基苯甲酸乙酯( ),其历程如下:据合成门路挖写下列空黑:(1)有机物A的结构简式:____________________________________________________,B的结构简式:_____________________________________________________________.(2)反应④属于__________反应,反应⑤属于____________反应.(3)③战⑥的手段是__________________________________________________________.(4)写出反应⑥的化教圆程式:_________________________________________________.【例2】由环己烷可造备1,4-环己醇二醋酸酯.底下是有闭的8步反应(其中所有无机产品皆已略去).(1)正在上述8步反应中,属于与代反应的有________,属于加成反应的有________,反应④属于________反应.(2)写出下列化合物的结构简式.B:__________________,C:________________.(3)写出反应④、⑤、⑥的化教圆程式.④________________________________________________________________________,⑤________________________________________________________________________,⑥________________________________________________________________________.(4)写出正在NaOH 溶液中火解的化教圆程式:______________________.【例3】 乙醇正在与浓硫酸混同共热的反应历程中,受反应条件的效率,可爆收二类分歧的反应典型:1,4-二氧六环是一种罕睹的溶剂.它不妨通过下列合成门路造得: 烃类A ――→Br2B ――→NaOH 火溶液C ――→浓H2SO4-H2O 其中的A 大概是A .乙烯B .乙醇C .乙二醇D .乙酸【例4】肉桂酸甲酯M ,时常使用做调造具备草莓、葡萄、樱桃等香味的食用香粗.M 属于芳香化合物,苯环上只含一个曲收链,能爆收加散反应战火解反应.测得M 的摩我品量为162 g·mol -1,只含碳、氢、氧三种元素,且本子个数之比为5∶5∶1.(1)肉桂酸甲酯的结构简式是.(2)G 为肉桂酸甲酯的一种共分同构体,其分子结构模型如图所示(图中球与球之间连线表示单链或者单键).G 的结构简式为.(3)以芳香烃A 为本料合成G 的门路如下:①化合物E 中的含氧官能团有________(挖称呼).②E ―→F 的反应典型是__________,F ―→G 的化教圆程式为_______________________.③写出切合下列条件的F 的共分同构体的结构简式(只写一种):____________________.ⅰ.分子内含苯环,且苯环上惟有一个收链;ⅱ.正在催化剂效率下,1 mol 该物量与脚量氢气充分反应,消耗 5 mol H 2;ⅲ.它没有克没有及爆收火解反应.【例5】食品增加剂必须庄重依照食品仄安国家尺度(GB2760-2011)的确定使用.动做食品增加剂中的防腐剂G 战W ,可经下列反应门路得到(部分反应条件略).(1)G 的造备①A 与苯酚正在分子组成上出进一个CH 2本子团,它们互称为__________;常温下A 正在火中的溶解度比苯酚的______(挖“大”或者“小”).②经反应A→B 战D→E 呵护的官能团是__________.③E→G 的化教圆程式为_____________________________________________________.(2)W 的造备①J→L 为加成反应,J 的结构简式为__________________________________________.②M→Q 的反应中,Q 分子中产死了新的____________(挖“C—C 键”或者“C—H 键”).③用Q 的共分同构体Z 造备 ,为预防R —OH +HO —R ――→催化剂△R—O—R+H2O爆收,则合理的造备道路为酯化、______、________(挖反应典型).④应用M→Q→T的本理,由T造备W的反应步调为第1步_________________________________________________________________ ____;第2步:消去反应;第3步:_____________________________________________________________(第1、3步用化教圆程式表示)【例6】利用从冬青中提与出的有机物A合成抗结肠炎药物Y及其余化教品的合成门路如下:提示:根据上述疑息回问:(1)D没有与NaHCO3溶液反应,D中官能团的称呼是________,B→C的反应典型是________.(2)写出A死成B战E的化教反应圆程式:______________________________________.(3)A的共分同构体I战J是要害的医药中间体,正在浓硫酸的效率下,I战J分别死成战,鉴别I战J的试剂为________.(4)A的另一种共分同构体K用于合成下分子资料,K可由造500 ℃得,写出K 正在浓硫酸效率下死成的散合物的结构简式:________________________________.【例7】狄我斯-阿德耳(Diels-Alder)反应也称单烯合成反应.试回问下列问题:(1)Diels-Alder 反应属于______反应(挖有机反应典型).(2)某真验室以 战 合成,请用合成反应的过程图,表示出最合理的合成规划(证明反应条件).提示: ①RCH 2CH====CH 2+Cl 2――――→RCHClCH ====CH 2+HCl ②合成历程中无机试剂任选.③合成反应过程图可表示为A ――→反应物反应条件B ――→反应物反应条件C ―→……―→H【例8】据《华夏造药》报导,化合物C 是用于合成抗“非典”药品(盐酸袪炎痛)的中间体,其合成门路为已知:(1)写出下列物量的结构简式B :__________________,C :__________________(反应②产品HCl 中的H 元素去自于氨基).(2)A→D 的转移中波及的反应典型有________(挖字母序号).A .加成B .与代C .散合D .氧化E .还本(3)反应①②中属于与代反应的是______(挖数字序号).(4)请您安排由甲苯→…→D 的反应过程图(有机物用结构简式表示,必须证明反应条件).提示:①合成历程中无机试剂任选.②反应过程图表示要领示比圆下:甲苯――→反应物反应条件……――→反应物反应条件D有机合成中有机物官能团的引进、与消战转移要领训练问案【例1】 (2)氧化 酯化(或者与代)(3)呵护酚羟基,预防被氧化【例2】(1)①⑥⑦③⑤⑧ 消去【例3】A【例4】 【例5】(1)①共系物 小 ②—OH(或者酚羟基)【例8】【例6】(1)醛基与代反应【例7】(1)加成(2)如图所示:。
化学有机光伏材料的合成和性质研究

化学有机光伏材料的合成和性质研究一、化学有机光伏材料的概念化学有机光伏材料是一类以有机化合物为主要组分的半导体材料,用于光伏器件的制备。
这类材料通常具有较高的吸收系数、良好的电荷传输性能和稳定的光伏特性,因此在太阳能电池、光电探测器和有机发光二极管等领域具有广泛的应用前景。
二、化学有机光伏材料的合成方法1.有机小分子光伏材料的合成:有机小分子光伏材料主要通过有机合成反应制备,如氧化还原反应、缩合反应、聚合反应等。
2.高分子光伏材料的合成:高分子光伏材料主要通过聚合反应制备,包括溶液聚合、乳液聚合、离子型聚合等。
三、化学有机光伏材料的性质1.光学性质:化学有机光伏材料具有较高的吸收系数,可以吸收太阳光谱中的大部分光能。
2.电学性质:化学有机光伏材料具有良好的电荷传输性能,可以实现光生电荷的有效分离和传输。
3.稳定性:化学有机光伏材料在长时间的光照和环境条件下,能够保持稳定的光伏特性。
四、化学有机光伏材料的研究进展1.高效的光伏性能:研究者通过结构优化、组成调控和界面修饰等手段,不断提高化学有机光伏材料的光伏性能。
2.稳定的光伏器件:研究者通过优化器件结构、界面修饰和封装技术等手段,提高化学有机光伏器件的稳定性。
3.应用领域拓展:化学有机光伏材料在太阳能电池、光电探测器和有机发光二极管等领域具有广泛的应用前景。
五、化学有机光伏材料的发展趋势1.高性能化学有机光伏材料的研究:研究高性能的化学有机光伏材料,以提高光伏器件的效率和稳定性。
2.低成本化学有机光伏材料的制备:开发低成本的化学有机光伏材料和制备工艺,降低光伏器件的成本。
3.功能化化学有机光伏材料的研究:研究具有特殊功能的化学有机光伏材料,拓展其在光电子领域的应用。
4.环境友好型化学有机光伏材料的研究:开发环境友好型化学有机光伏材料,减少对环境的影响。
习题及方法:1.习题:化学有机光伏材料的主要组分是什么?方法:根据知识点,化学有机光伏材料的主要组分是有机化合物。
有机化学PPT完整全套教学课件

有机化合物种类繁多,结构复杂 ,具有独特的物理和化学性质。
有机化学的历史与发展
01
02
03
早期历史
有机化学的起源可以追溯 到古代,但真正的发展始 于18世纪。
近代发展
19世纪以后,随着化学理 论的不断完善和实验技术 的进步,有机化学得到了 迅速发展。
现代有机化学
20世纪以来,有机化学在 理论、实验方法和应用领 域等方面都取得了巨大进 展。
通过有机合成制备具有特定功能的材料, 如光电材料、催化剂等。
合成具有生物活性的化合物,如酶抑制剂、 受体配体等,并进行生物活性评价。
05
有机化合物的鉴定与分析
Chapter
有机化合物的分离与纯化技术
蒸馏法
利用物质沸点的差异进行分离, 包括简单蒸馏、分馏、减压蒸馏
等。
萃取法
利用物质在两种不互溶溶剂中的 溶解度差异进行分离,包括液-
有机化合物的化学性质
• 取代反应:有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应,如卤代烃的水解反应、 酯的水解反应等。
• 加成反应:有机化合物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合生成新的化合 物的反应,如烯烃与氢气的加成反应、炔烃与卤素的加成反应等。
对已知化合物进行结构修饰和改造, 优化其性能,满足特定需求。
有机合成的基本策略与方法
逆合成分析
从目标分子出发,逆向分析其结 构,设计合理的合成路线。
保护与去保护策略
在合成过程中,对某些官能团进 行保护,以避免不必要的副反应 ,合成完成后再进行去保护。
01 02 03 04
合成子的选择与连接
选择合适的合成子,通过化学键 的连接形成目标分子。
有机化学基础知识碳酸酯的合成和反应

有机化学基础知识碳酸酯的合成和反应有机化学基础知识:碳酸酯的合成和反应碳酸酯是一类重要的有机化合物,具有广泛的应用领域。
它们可通过多种方法进行合成,并且在反应中表现出多样的特性和性质。
本文将介绍碳酸酯的合成方法以及其在反应中的一些重要应用。
一、碳酸酯的合成方法碳酸酯的合成方法主要分为以下几种:酸催化醇和酸酐的缩合、酸催化醇和碳酸二酯的缩合、碱催化醇和酸酐的缩合等。
1. 酸催化醇和酸酐的缩合酸催化醇和酸酐的缩合是一种常见的合成碳酸酯的方法。
在酸的作用下,醇与酸酐发生酯化反应,生成碳酸酯和酯化副产物(酸)。
2. 酸催化醇和碳酸二酯的缩合酸催化醇和碳酸二酯的缩合是另一种常用的合成碳酸酯的方法。
在酸的催化下,醇和碳酸二酯反应生成碳酸酯和酯化副产物(二酸酯)。
3. 碱催化醇和酸酐的缩合碱催化醇和酸酐的缩合是一种常见的碳酸酯合成方法之一。
在碱的催化下,醇和酸酐反应生成碳酸酯和盐(一般为金属盐)。
二、碳酸酯的反应性质碳酸酯是一类具有活泼性的有机化合物,其具有多样化的反应性质。
1. 酸碱水解碳酸酯在酸性或碱性条件下可发生水解反应。
在酸性条件下,碳酸酯水解生成相应的酸和醇;而在碱性条件下,碳酸酯水解生成相应的盐和醇。
2. 醇解碳酸酯在醇的作用下,经醇解反应生成相应的酸和醇。
3. 重排反应碳酸酯在一定条件下,可发生重排反应,产物为相应的醇和酸酐。
4. 还原反应碳酸酯可被还原剂还原为相应的醛和醇。
三、碳酸酯的应用碳酸酯由于其结构和性质的特殊性,被广泛应用于多个领域。
1. 增塑剂碳酸酯是一类常用的增塑剂,可以提高塑料的柔韧性和可加工性。
2. 溶剂碳酸酯具有良好的溶解性,可作为溶剂在化学工业中广泛应用。
3. 医药领域碳酸酯作为一种重要的药物原料中间体,广泛应用于药物合成领域。
4. 高分子材料碳酸酯可用于合成聚碳酸酯等高分子材料,具有优异的性能和广泛的应用领域。
总结:碳酸酯是一类重要的有机化合物,其合成方法有酸催化醇和酸酐的缩合、酸催化醇和碳酸二酯的缩合、碱催化醇和酸酐的缩合等。
有机化学中的醛与酮的还原合成方法

有机化学中的醛与酮的还原合成方法在有机化学中,还原合成方法是一种常用的合成有机化合物的手段。
其中,醛和酮的还原合成方法尤为重要。
本文将介绍几种常见的醛与酮的还原合成方法,并探讨它们的适用范围以及机理。
一、金属催化还原法金属催化还原法是最常见的醛与酮还原合成方法之一。
常用的金属催化剂包括铂、钯、铑等。
在反应中,醛或酮与氢气在催化剂的存在下进行反应,生成相应的醇。
这种方法具有反应温和、产率高的特点。
例如,用铂催化剂将醛还原为相应的醇的反应可以表示为:RCHO + H2 -> RCH2OH这种金属催化还原法适用于各种不同结构的醛和酮。
二、氢化钠还原法氢化钠还原法是一种常用的醛与酮还原合成方法。
在该反应中,醛或酮与氢化钠在醇的存在下反应,生成相应的醇。
这种方法适用于酮和醛中没有其他容易发生副反应的官能团的情况。
例如,用氢化钠将醛还原为相应的醇的反应可以表示为:RCHO + NaBH4 -> RCH2OH氢化钠还原法在实验室中得到了广泛应用,反应温和,选择性好。
三、氢化铝锂还原法氢化铝锂还原法是一种高效的醛与酮还原合成方法。
在该反应中,醛或酮在乙醚或四氢呋喃等有机溶剂中与氢化铝锂反应,生成相应的醇。
这种方法适用于各种醛和酮,且反应选择性高。
例如,用氢化铝锂将酮还原为相应的醇的反应可以表示为:RCOR' + LiAlH4 -> RCHR'OH氢化铝锂还原法常用于合成活性较高的羟基化合物。
四、羰基还原法羰基还原法是一种常用的醛与酮还原合成方法。
在该反应中,醛或酮与铝醇ate或硼醇ate等试剂反应,生成相应的醇。
这种方法适用于醛和酮中没有其他容易发生副反应的官能团的情况。
例如,用硼醇ate将醛还原为相应的醇的反应可以表示为:RCHO + BH3 -> RCH2OH羰基还原法具有反应速度快、产率高等优点。
综上所述,有机化学中的醛与酮的还原合成方法有金属催化还原法、氢化钠还原法、氢化铝锂还原法以及羰基还原法等。
3.5.3有机合成路线的设计与实施(教学教学设计)高二化学同步备课系列(人教版2019选择性必修3)

6. 培养学生的证据推理与创新意识,通过分析评价和优化有机合成路线,培养学生的逻辑思维和创新意识。
7. 培养学生的科学态度与价值观,激发学生对有机化学知识的兴趣和热情,形成积极的科学态度和价值观。
8. 培养学生的沟通与协作能力,通过团队合作完成有机合成路线的设计与实施,提高学生的沟通协作能力。
1. 合成效率:目标产物的产率。
2. 选择性:目标产物与副产物的比例。
3. 成本:原料、催化剂、能量消耗等。
四、实际应用案例
1. 案例一:XX化合物的合成路线设计。
2. 案例二:XX药物的合成路线优化。
```
板书设计应根据实际教学情况进行调整和优化,以满足学生的学习需求和提高教学效果。
教学反思与改进
鼓励学生提出自己的观点和疑问,引导学生深入思考,拓展思维。
技能训练:
设计实践活动或实验,让学生在实践中体验有机合成路线的设计与实施知识的应用,提高实践能力。
(四)巩固练习(预计用时:5分钟)
随堂练习:
布置随堂练习题,让学生在课堂上完成,检查学生对有机合成路线的设计与实施知识的掌握情况。
鼓励学生相互讨论、互相帮助,共同解决有机合成路线的设计与实施问题。
4. 提供充足的练习题和实验操作机会,让学生在实践中巩固所学知识和技能。
学具准备
多媒体
课型
新授课
教法学法
讲授法
课时
第一课时
步骤
师生互动设计
二次备课
教学资源
软硬件资源:
1. 教室内的多媒体投影仪和屏幕。
2. 学生实验桌和实验仪器。
3. 有机合成路线设计软件或应用程序。
丁基锂拔氢和锂卤交换-概述说明以及解释

丁基锂拔氢和锂卤交换-概述说明以及解释1.引言1.1 概述丁基锂拔氢和锂卤交换是重要的有机合成方法,在有机合成中有广泛的应用。
丁基锂是一种强酸性有机试剂,可以与许多有机物发生反应,其中最常见的反应就是丁基锂拔氢和锂卤交换反应。
通过这两种反应,可以实现有机分子中氢原子的替换和卤素原子的置换,从而得到具有不同化学性质和功能的有机化合物。
丁基锂拔氢是一种常见的有机合成方法,其原理是在丁基锂的作用下,有机化合物中的氢原子被丁基基团替换的过程。
通过这种方法,可以将有机化合物中的氢原子替换为丁基基团,从而增加化合物的空间位阻和碱性。
丁基锂拔氢反应是以丁基锂作为试剂,反应温度和反应时间是影响反应结果的关键因素,通常在低温下进行,以避免附加副反应的发生。
丁基锂拔氢反应在有机合成中广泛应用于合成多种有机化合物,如醇、醚、酮和酸等。
而锂卤交换是另一种重要的有机合成方法,其原理是在锂与卤素化合物的反应中,锂离子取代卤素原子的过程。
通过锂卤交换方法,可以将有机化合物中的卤素原子替换为锂离子,从而制备出具有锂离子基团的有机化合物。
锂卤交换反应的反应条件和选择性可以通过调节反应物的比例和反应温度来控制,常用的锂来源有丁基锂和碱金属锂等。
锂卤交换反应在有机合成中被广泛应用于制备多种有机化合物,如有机金属试剂、有机锂试剂和天然产物的合成等。
因此,丁基锂拔氢和锂卤交换是有机合成中常用的重要方法,可以实现有机分子中氢原子的替换和卤素原子的置换,从而得到具有不同化学性质和功能的有机化合物。
这两种方法在有机合成中广泛应用,为研究人员提供了丰富多样的工具和途径,促进了有机合成领域的发展。
1.2文章结构文章结构部分:本文主要通过对丁基锂拔氢和锂卤交换的研究进行详细阐述,以探究这两种化学反应的原理和应用。
文章将分为引言、正文和结论三个部分进行论述。
在引言部分,将对丁基锂拔氢和锂卤交换的概述进行介绍,为读者提供一个整体了解的视角。
同时,引言部分还将阐明本文的目的,即通过对这两种反应的探究来增进对相关领域的认识和理解。
高考化学有机合成的常规方法与解题思路(附答案)

高考化学有机合成的常规方法与解题思路(附答案)如何从原料出发去合成有机物呢?一种是通过对比,找出原料与目标产物的区别点,区别点就是变化点,然后从原料出发去合成目标产物。
还可以从目标产物入手。
分析若得到此产品,最后一步应是什么反应,这步反应的反应与原料又有什么样的关系,这样从后往前将原料与产品联系起来。
记住合成题的正确解答必须有扎实的有机基础知识作前提。
一、总的解题思路 关键在于:1. 选择出合理简单的合成路线。
2. 熟练掌握好各类有机物的组成、结构,性质,相互衍变关系以及重要官能团的引入和消去等基础知识。
合成路线的推导,一般有两种方法:“直推法”和“反推法”,而“反推法”较常用,该方法的思维途径是:(1)首先确定所要合成的有机物属于何类型,以及题中所给定的条件与所要合成的有机物之间的关系。
(2)以题中要求的最终产物为起点,考虑这一有机物如何从另一有机物甲经过一步反应而制得。
如果甲不是所给的已知原料,再进一步考虑甲又是如何从另一有机物乙经一步反应而制得,一直推导到题目中所给定的原料为终点,同时结合题中给定的信息。
(3)在合成某一产物时,可能会产生多种不同的方法和途径,应当在兼顾原料省、产率高的前提下选择最合理、最简单的方法和途径。
二、解题的基本规律和基本知识 1.掌握有机合成路线有机合成往往要经过多步反应才能完成,因此确定有机合成的途径和路线时,就要进行合理选择。
选择的基本要求是原料价廉,原理正确,路线简捷,便于操作、条件适宜、易于分离,产率高,成本低。
中学常用的合成路线有四条。
(1)一元合成路线(官能团衍变)R —CH═CH 2 →卤代烃→一元醇→一元醛→一元羧酸→酯 (2)二元合成路线OHH C OH H C ClH C Cl H C CHCHOH CH CH 2|2|OH 2|2|Cl22OH 23222-−−→−-−−→−=−−→−++-水解加成消去(3)芳香化合物合成路线⑷改变官能团的位置3|3HBr23HBr 223CH BrH C CHCHCH CH Br CH CH CH +-−−→−=−−→−加成消去2. 官能团的引入⑴引入羟基(—OH )方法: 、 、 、 等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机合成-概念与方法(下)氨基和硫醇:伯胺和仲胺对涉及N-H键的氧化反应和取代反应是敏感的。
在肽的合成过程中,人们已经发现许多保护N-H键的保护基,共五种:1.三氟乙酸酐2.偶氮甲酸叔丁酯3.氯甲酸-2,2,2-三氯乙酯4.氯甲酸苄酯(苄氧甲酰氯)5.N-乙酰氧基邻苯二甲酰亚胺在所有这些保护试剂中,一个离去基团(CF3COO-,N3-,Cl-,H2NCOOEt)都能在温和的条件下顺利地被亲核性的氨基所取代,生成酰胺且产较高。
分别用以下五种方法是上述五种保护的酰胺衍生物脱去相应的氨基保护基:1.氢氧化钡水溶液;2.25%三氟乙酸的氯仿溶液,3.Zn/AcOH 4.H2/Pd 5.AcOHorN2H4溶液中的HBrTfac RNHCOCF3Tfac2/Py Ba(OH)2ap,NaHCO3apNH3aporNaBH4/MeOHBoc(box ) RNHCOOCMe3N3COOBu t TFA/CHCl3,THF ap:CO2CH2=CMe2Tceoec RNHCOOCH2CCl3 Tceoc Zn/AcOH;阴极还原:CO2,CH2=CCl2Cbz(Z) RNHCOOCH2Ph ClCOOCH2PhHBr/AcOH;H2/PdPhthNOO RPhthNCOOEtHBr/AcOH;N2H4.H2OOxON PhPhO ROO OPhPhH 2[Pd];Na/NH 3液就与亲核试剂的反应而言,三氟乙酰胺比相应的酯更稳定,且它可通过三氟乙酐与胺反应得到。
三氟乙酰基(Tfac )可通过水溶液或甲醇溶液中的HCl ,NH 3或Ba(OH)2溶液以及甲醇中的NaBH 4等缓慢脱去。
O AcOAcO AcO+H 3N 1.Tfac 2O/Py,00C ,CH 2Cl 2,20min 0C ,CH 2Cl 2+3h,rtOAcO AcO AcOTfacHN Cl -NN OOMe 3Si Me 3Si 1.2/MeOH,1h,rtO AcOAcOAcO NH 22.NH 3/MeOH,N HNO O叔丁氧甲酰基(Boc,t-Box )已被广泛应用于肽的合成中,许多氨基酸的Boc 衍生物是商业试剂。
这些衍生物的制备方法通常是在水、二氧六环/水、DMSO 或DMF 中用叠氮甲酸叔丁酯与相应的胺反应。
用中等强度的酸度里,则可使其断裂失去异丁烯和二氧化碳。
O O N HRBocTFA/CHCl 3orHF/H 2O +H +CO 2+H 3有相应的氯甲酸酯与胺反应可制备胺的2,2,2-三卤乙氧甲酰基衍生物,已应用于β-内酰胺抗生素的合成。
使用Zn/AcOH 或电极还原法可以脱去三卤乙氧甲酰基保护基。
胺的苄氧甲酰基(Cbz )衍生物是在碱性或其他极性溶剂中由氯甲酸苄基酯与胺制备的。
他们对还原剂的稳定性比2,2,2-三卤乙氧甲酰基衍生物高。
许多被Cbz保护的氨基酸和肽是商业试剂。
脱去苄氧甲酰保护基最常用的方法是用HBr 溶剂解和Pd 催化下进行氢解。
Cbz 基中的酯键对碱性水解是非常稳定的。
Cl 3CO ClO+RNH 23RHNTceoc Zn/AcOHor阴极还原+2e+H +Cl -+Cl Cl+RNH 2OCl O NaOH+RNH 2+HBrAcOH+H 2Pd-C+RNH 2BrCH 3++CO2CO 2胺与N-乙氧甲酰基邻苯二甲酰亚胺反应生成胺的邻苯二甲酰基(Phth )衍生物,它是一种耐酸酰亚胺,用亲核试剂(常用肼)处理,很容易脱去保护基。
N OOCOOEt +RNH 2,Na 2CO 3/H 2O 15-30min,rtO -H 2NCOOEtN O OR苯偶姻与光气反应生成本偶姻的环状碳酸酯,即4,5-二苯基-1,3二氧杂环戊烯-2-酮,它可以保护伯胺中的两个氢原子。
脱水后生成对酸稳定且易于结晶的“Sheehan 恶唑啉酮”,后者也称为Ox 衍生物。
在1mol 盐酸存在下,用Pd/c 催化氢解可定量脱去该氨基保护基。
RNH 2+N O Ph Ph OOx 衍生物OO Ph Ph1.DMF,0.5h,rt Ph Ph O O HNOR H +OH Ph Ph O R TFA,1-2h,rt-H 2OH 2[Pd/C],1molHCl <EtOHorDMF>,1d,rtRNH 2+CO 2++PhCH 2CH 2Ph Na/NH 3液RNH 21.MCPBA//TFA/CH 2Cl 2,12h,rt2.HCl/EtOHRNH +CO +PhCOCOPh在Pd(0)催化剂存在下,烯丙基上的酰氧基可以被氨基所取代。
对于取代的环己烯衍生物,产物的非对应宣泄;在很大程度上依赖于钯催化剂的结构。
若使用高分子-钯催化剂,则产物中的氨基在离去基团酰氧基的同一侧,因为反应过程中的氨基区域选择性的进攻中间体η3-烯丙基配合物中空间位阻较小的位置。
COOMeAcOEt2NH,THF,heat聚苯乙烯-钯(0)COOMeEt2COOMeAcOCH2PPh2Pd(PPh3)COOMe2OAc2RNH;C H,+THF,heatCH2OA CPdL32CH2OAcNHRR=CH2Ph87%R=CH2CH2NH100%由于酰基很难除去,所以常用碳酸酯来保护硫醇基。
反映中二聚化生成S-S过硫化物会降低S的亲核性,而硼氢化钠又可使S-S键断裂,重新生成硫醇。
保护基保护后硫醇的结构脱保护剂OO SR1酸水溶液PhCH2SCH2ClPh3CClp-MeOC6H4CH2OCOCl EtNCO R1SCH2SCH2PhR1SCPh3R1SCOOCH2C6H4POMe-pR1SCONHEtHg(OAc)2AgNO3/吡啶甲醇溶液MeOHPh>8羧基:羧基的保护和脱保护与上述羟基及氨基的保护和脱保护反应类似。
羧基被保护的衍生物中,最重要的是叔丁基酯、苄基酯和甲基酯。
用三氟乙酸、氢解和强酸或强碱分别脱去相应的保护基,这与Tbeoc 和Tceoc保护的羟基和氨基脱保护的方法一样。
甲基酸相对于酸很稳定,但是它在碱的水溶液中只能存在几分钟。
硅烷基酯对胺和氧化剂是稳定的,但乙醇可使其断裂。
叔丁基酯对于碱催化的水解反应特别稳定,但在酸作用下很容易断裂。
苯甲酰甲酯和三氯乙基酯可用Zn/AcOH还原而脱去保护基。
恶唑啉对Grignaed试剂和氢化物是稳定的,但是对酸不稳定。
邻硝基苯甲酰甲基衍生物可用紫外光分解。
醛基和酮基:最常用的保护醛酮的衍生物是1,3-二氧戊环和1,3-氧硫戊环。
在非质子溶剂中,在催化剂(如BF3或TsOH)和脱水剂(原酸酯)存在下,羰基化合物与1,2-乙二醇或2-巯基乙醇反应可以得到这些戊环衍生物。
酸催化下,低沸点酮(如丙酮)的二氧戊环发生“交换二氧戊环”反应,也可以得到戊环衍生物,其中丙酮可在过程中被蒸馏出来。
α,β-不饱和酮发生缩酮化反应的速率比饱和酮慢。
而2-巯基乙醇发生缩酮化的速率比1,2-乙二醇快。
H O HOCH2CMe2CH OH[TsOH,C6H6,heat]共沸除水HOOO1.3-ClBzOOH,CH22加热2.DIBAL(CH2)HOOHOCHOH OO OOO OOO OHOOHTsOH 苯,10h,加热共沸蒸馏脱水40mmol30mmol+12mmol,乙二醇TsOH,苯,1d,加热OOAcOH HHH1.巯基乙醇[ZnCl 2/Na 2SO 4]二恶烷,20h,rt2.LiAlH 4/Et 2O,20min,加热3.Raney Ni/Me 2CO,2h,加热HOH H HHHO50%1,3-二氧戊环和1,3-二氧硫戊环在多数碱性及中性条件下是稳定的但可被有机金属化合物分解。
强酸脱保护,最好是在丙酮存在下。
位阻大的酮生成缩酮需要在沸腾的无机酸中进行。
1,3-二氧硫戊环更活泼,甚至在中性或弱碱性的丙酮或乙醇溶液中即可脱保护,,最有效的方法是使用Raney 镍。
常用于“极性变换”和脱羰基的1,3-二氧硫戊环也可用作羰基保护试剂。
在所有的羰基保护基中,二氰基亚基是唯一的一个耐酸保护基,它是用丙二腈经过Knoevenagel 缩合反应形成的。
Friedel-Crafts 酰化反应、热的无机酸以及磺酰氯的氯化反应都不影响这个保护基。
然而,用浓碱溶液深度处理,也可脱去保护基。
ArCHOCNCN 甘氨酸水/乙醇,加热ArCH=CCN 2+CH 2N 2-N 2<Et 2O>rt.ArC(Me)=CCN 2NaOH,H 2O,50C ArCOCH 3R=COOEt,CH2CH2COOH,CH2CH3H N CHORCN CNEt 2NH/EtOH,1-2min,rt HN RNCCN磷酸酯基:如果磷酸分子中的三个羟基要成功地与三种醇进行酯化反应,则必须对磷酸中的羟基进行保护。
2-氰基乙醇(3-羟基丙腈活水化烯丙腈)是磷酸保护中一个广泛应用的保护试剂。
DCC 存在下,它与瞵酸酯缩合,即可对磷酸进行保护。
用弱碱处理,可定量地将2-氰基乙基(Ce )以丙烯腈的形式脱去。
同样,2,2,2-三氯乙醇也可用于保护磷酸中的羟基。
在50℃的DMF 中,用铜-锌合金还原可以脱去2,2,2-三氯乙醇。
HO P O OOOHNNHO OPyHHOCN/DCC,Py,1d,rt+3d,rt,(H 2O/Py)+18h,rt,(NH 3/H 2O).pH=9Ce O P O OO胸腺嘧啶HO脱保护,浓氨水100%,2d,rtCl 3COH /DCC(Py),1d,rtTceO P O OO O 胸腺嘧啶HO脱保护:Zn-Cu/80%AcOH,5h,rt 或DMF,1h,500C 第四章 杂环和芳烃化合物药物中的含氮杂环化合物和芳烃芳烃和杂环化合物能够在药物领域有所应用,最主要的原因是它们具有刚性结构、很容易实现亲水性和疏水性的平衡、极易形成氢键且偶极距很容易改变。
苯环的存在能使他们更好地键合在蛋白质表面上,能够进入狭窄的疏水间隙从而有助于膜间传递作用,带有卤素取代基的化合物膜溶性更好,且能够延迟微生物和细胞色素P450催化氧化引起的老化。
多数含氮杂环化合物的合成包括含氮亲核试剂与双官能团卤化物或羰基化合物的取代和(或)缩合反应。
常用的含氮试剂有以下几种:N:NH 3,R-NH 2,NH 2OH,RSO 2NH 2RCOCH 2R',RCOCH 2COR' 1.HONO,RONO 2.Zn/AcOH RR 'OO 2R-N=N=N 2+]-N[R-N>]氮烯N 2:H 2N-NH 2,RNHNH 2,Tos-NH-NH 2,H 2NCONH 2,H 2NC(SH)=NH ,H 2NC(R)=NH, H 2NCH 2CH 2NH 2,邻二苯胺N 3:RN 3杂环化合物中最长的碳链通常是可能的开链前提。
