第七章分子结构
分子结构与晶体结构

分⼦结构与晶体结构第七章分⼦结构与晶体结构第⼀节离⼦键⼀、离⼦键的形成和特征1、离⼦键的形成电负性I1或Y1(KJ/mol)电离能很⼩的⾦属原⼦:Na 0.9 496K 0.8 419电⼦亲合能很⼤的⾮⾦属原⼦:Cl 3.0 -348.8O 3.5 -141电负性相差⼤的元素相遇,⼀失电⼦,⼀得电⼦,它们之间以静电引⼒相结合,形成离⼦键。
④:阳阴离⼦间具有静电引⼒,两原⼦的电⼦云间存在排斥⼒,两原⼦核间存在相互排斥⼒,当两原⼦接近到⼀定距离,引⼒=斥⼒,(此时整个体系能量最低),形成离⼦键。
2、离⼦键的特征①本质:阴、阳离⼦间的静电引⼒②⽆⽅向性、饱和性只要空间允许,尽可能多地吸引带相反电荷的离⼦(任何⽅向,尽可能多)。
但总体来说,有⼀定⽐例。
⼆、离⼦的特性1、离⼦的电荷离⼦化合物AmBn:A n+,B m-+n﹥+3,很少见2、离⼦的电⼦层结构简单阴离⼦的电⼦构型,⼀般与同周期希有⽓体原⼦电⼦层构型相同。
简单的阳离⼦构型:3、离⼦半径将阴阳离⼦看成是保持着⼀定距离的两个球体。
d = r+ + r-单位:pm(10-12m)规律:①同⼀元素:负离⼦半径>原⼦半径>正离⼦半径低价负离⼦半径>⾼价负离⼦半径低价正离⼦半径>⾼价正离⼦半径例:②同⼀周期从左到右,阳离⼦:正电荷数↑,半径↓阴离⼦:负电荷数↓,半径↓③同⼀主族电荷数基本相同,从上到下,半径↑(∵电⼦层增加)离⼦半径↓,离⼦间引⼒↑,离⼦键强度↑,熔、沸点↑,硬度↑第⼆节共价键理论1916年,路易斯提出共价键理论。
靠共⽤电⼦对,形成化学键,得到稳定电⼦层结构。
定义:原⼦间借⽤共⽤电⼦对结合的化学键叫作共价键。
对共价键的形成的认识,发展提出了现代价键理论和分⼦轨道理论。
⼀、价键理论(电⼦配对法)1、氢分⼦共价键的形成和本质(应⽤量⼦⼒学)当两个氢原⼦(各有⼀个⾃旋⽅向相反的电⼦)相互靠近,到⼀定距离时,会发⽣相互作⽤。
每个H原⼦核不仅吸引⾃⼰本⾝的1s电⼦还吸引另⼀个H原⼦的1s电⼦,平衡之前,引⼒>排斥⼒,到平衡距离d,能量最低:E0﹤2E,形成稳定的共价键。
分子结构4 PPT课件

第七章 化学键与分子结构
二、氢键的形成
如 HF分子之间的氢键,F - H ····F - H 又如水分子之间的氢键
氢键的形成有两个条件: 有与电负性大且半径小的原子 ( F,O, N ) 相连的H ; 在附近有电负性大,半径 小的原子 ( F,O,N ) 。
第四节 分子间作用力和氢键
5、为什么常温下Cl2是气体,Br2是液体,I2是固体?
第四节 分子间作用力和氢键
F-H···F E/kJ ·mol-1 28.0
O-H···O 18.8
N-H···N 5.4
第四节 分子间作用力和氢键
第七章 化学键与分子结构 氢键有分子间氢键和分子内氢键
H OO
N O
分子间氢键
OH
N
O
O
分子内氢键
第四节 分子间作用力和氢键
第七章 化学键与分子结构
四、氢键对化合物性质的影响 1、对分子熔沸点的影响
取向力 诱导力 色散力
第四节 分子间作用力和氢键
第七章 化学键与分子结构
一、取向力
两个永久偶极间存在的同极相斥、异极相吸的定向作用
+
+_ +_
+_
_
分子离得较远
取向
取向力只存在于极性分子之间。
第四节 分子间作用力和氢键
第七章 化学键与分子结构
二、诱导力
由于诱导偶极-永久偶极之间相互作用所产生的。
第四节 分子间作用力和氢键
第七章 化学键与分子结构 3、永久偶极------极性分子本身所固有的
极性分子放入电场中
第四节 分子间作用力和氢键
第七章 化学键与分子结构
7-4-2 分子间作用力
无机化学(周祖新)习题解答 第七章

第七章分子结构和晶体习题解答(7)思考题1.举例说明下列概念的区别:离子键与共价键、共价键与配位键、σ键和Л键、极性键和非极性键、极性分子与非极性分子、分子间力与氢键。
1.离子键是得到电子的阴离子与失去电子的阳离子的强烈静电吸引作用;共价键是原子间通过共用电子对(或电子云重叠)而形成的相互吸引作用,无阴、阳离子;配位键也是共价键中的一种,只不过共用的一对电子有一个原子提供。
σ键是各自电子云用密度最大的一头相互重叠,以使重叠体积最大,两原子间形成共价键时首先肯定以σ键成键,但两原子间只能形成σ键一次。
Л键是在原子间已形成一根σ键后,其余原子轨道以“肩并肩”在侧面重叠的成键方式,其重叠体积比σ键要小,但两原子间根据各自的单电子数可形成几个Л键。
极性键是两不同原子间形成共价键时,由于两原子的电负性不同,吸引公用电子对的作用不同,使某一端带有部分正电荷,另一端带有部分负电荷,这就是极性键;若两相同的原子间形成共价键,由于彼此电负性相同,吸引共用电子对的能力相同,公用电子对不偏向任何一个原子,两原子不带“净”电荷,没有“正”或“负”的一端,即非极性键。
极性分子是整个分子中正、负电荷重心不重合,使分子一端带部分正电荷,为正极,另一端带部分负电荷,为负极。
分子之间由于偶极间的相互作用力为分子间力。
氢键是氢原子与电负性大、半径小的原子形成共价键后,由于氢原子唯一的电子被其他原子吸引到离氢原子核较远的地方,氢原子几乎成了“裸露”的质子,有很强的正电场,吸引另一电负性大、半径小的原子的孤对电子,形成了一种作用力,这个作用力本质上还是分子间作用力,但比一般的分子间力强。
2.离子键是怎样形成的?离子键的特征和本质是什么?为什么离子键无饱和性和方向性?2.离子键是失电子的金属阳离子和德电子的非金属阴离子通过静电引力形成的。
离子键的特征是无方向性、无饱和性。
其本质是正、负点电荷间的静电引力。
点电荷产生的电场向空间各个方向均匀传播,每一个在其电场中的异号电荷都会受到它的吸引作用,在理论上它可吸引无数个异号电荷,所以离子键无饱和性;由于点电荷产生的电场向空间各个方向的传播是均匀的,只要距离相等,不管在哪个方向,受到的作用里是一样的,这就是离子键的无方向性。
高分子的结构习题与思考题

第七章高分子的结构习题与思考题1.高分子的结构有何特点高分子结构可以分为哪些结构层次各结构层次包括哪些内容它们对聚合物的性能会产生什么影响特点:①链式结构:结构单元103-105数量级②链的柔顺性:内旋转产生非常多的构象③多分散性,不均一性,长短不一。
④结构单元间的相互作用对其聚集态结构和物理性能有着十分重要的影响。
⑤凝聚态结构的复杂性:包括晶态、非晶态,球晶、串晶、单晶、伸直链晶等。
⑥可填加其它物质改性。
分为:链结构和聚集态结构。
内容:链结构分为近程结构和远程结构。
近程结构主要涉及分子链化学组成、构型、构造;远程结构主要涉及分子链的大小以及它们在空间的几何形态。
聚集态结构包括晶态、非晶态、液晶态、取向态结构及织态结构等。
影响:高分子结构中各个结构层次不是孤立的,低结构层次对搞结构层次的形成具有较大影响,近程结构决定了高分子的基本性能,而聚集态结构直接影响高分子的使用性能。
2.写出线型聚异戊二烯的各种可能构型。
顺式1,4-加成反式1,4-加成 1,2-加成全同立构 1,2-加成间同立构1,2-加成无规立构 3,4-加成全同立构 3,4-加成间同立构 3,4-加成无规立构3.名词解释(1)构型:是指分子中由化学键所固定的原子在空间的几何排列。
(2)构象:由于分子中的单键内旋转而产生的分子在空间的不同形态(3)链柔性:高分子链能够通过内旋转作用改变其构象的性能(4)内聚能密度::单位体积的内聚能,CED = ?E/Vm。
内聚能是克服分子间作用力,把1mol 液体或固体分子移至分子引力范围之外所需的能量(5)结晶形态:试样中结晶部分所占的质量分数(质量结晶度xcm)或者体积分数(体积结晶度xcv)。
(6)取向:聚合物取向是指在某种外力作用下分子链或其他结构单元沿着外力作用方向择优排列(7)液晶:一些物质的结晶结构受热熔融或被溶剂溶解后,表观上虽然变成了具有流动性的液体物质,但结构上仍然保持着晶体结构特有的一维或二维有序排列,形成一种兼有部分晶体和液体性质的过渡状态4.聚合物的构型和构象有何区别假若聚丙烯的等规度不高,能否通过改变构象的方法来提高其等规度全同立构聚丙烯有无旋光性构型是指分子中由化学键所固定的原子在空间的几何排列。
分子结构

配位数为6。
如:NaI,NaBr,MgO,CaO
NaCl的晶胞
ZnS晶胞
c、ZnS型 ZnS晶体也属面心立方晶格,在ZnS晶胞中,晶胞结构较复杂,
每个Zn2+离子周围有4个S2-离子,每个S2-离子周围有4个Zn2+离子, 配位比为4:4,配位数为4。
如:ZnO,HgS,CuCl,CuBr
第10页/共119页
第8页/共119页
二、离子晶体
在离子晶体的晶格结点上交替排列着正、负离子。由于正、负 离子间有很强的离子键,所以离子晶体有较高的熔点和较大的硬 度。在晶体中,离子不能自由移动,只能在结点附近振动,因此不 导电。而在融化时,离子可以自由的移动,就能导电。离子晶体有 以下几种类型:
1、离子晶体的分类
(1)、AB型离子晶体: AB型离子晶体指组成晶体中正负离子的 比例为1:1的离子晶体。 a、CsCl型
离子的变形性:离子的变形性主要是决定于离子半径,离子半径大, 核电荷对电子云的吸引力较弱,因此离子的变形性大。例如:
I- > Br- > Cl- > F-; 对于离子的电荷相等、半径相 (18+2)e 2e > (917)e > 8e 负离子主要表现出变形性;正离子主要表现出极化力。
CsCl的晶胞是立方体,每个Cs+周围有8个Cl-离子,每个Cl-周 围有8个Cs+离子。原子比为1:1,配位比为8:8,配位数为8。
第9页/共119页
Cl-
如:CsCl
Cs+
TiCl
b、NaCl型
NaCl的晶胞也是立方体,是面心立方晶格。Na+离子周围有6
个Cl-离子,Cl-离子周围有6个Na+, 离子配位比为6:6,原子比1:1。
分子结构的测定方法的原理及应用

第七章 分子结构的测定方法的原理及应用7.1 分子光谱基本内容分子光谱乃是对分子所发出的光或被分子所吸收的光进行分光所得到的光谱。
原子光谱为线状光谱,而分子光谱为带状光谱。
一. 分子光谱的分类极其所在的波段 1. 分子内部运动的三种方式及能量1).电子相对于原子核的运动 能量为Ee,能级差为1~20eV 2). 各原子核的相对振动运动 能量为Ev 能级差为0.05~1eV 3). 整个分子的转动 能量为ErE 级差为1×10-4~0.05eV 分子从低能E”跃迁到高能级E’时吸收电磁波产生谱线,其波数为~'"'"'"υλ==-+-+-1Ee Ee hc Ev Ev hc Er Er hc当分子的价电子能级发生跃迁是,常伴随着振动能级和转动能级的跃迁,故价电子在两个能级之间的跃迁所对应的能量差往往不是一个确定的值而是多个彼此相差很小的数值。
2. 当只有转动能级发生跃迁时所对应的分子光谱称为转动光谱。
波数介于0.8~0.81cm -1,波长为1.25~0.012cm,相当于微波和远红外波段。
3. 当振动能级发生跃迁时,总是伴随着转动能级的跃迁,所以对应的光谱称为震动-转动光谱。
波数为400~8000cm -1波长为2.5×10-3~1.25×10-4cm,相当于红外光谱区,故称分子的振动-转动光谱为红外光谱。
4. 分子的电子光谱结构比较复杂,波数为8000~160000cm -1波长为1250nm~62.5nm,相当于近红外到远紫外波段。
二. 分子的转动光谱:(双原子) 1. 双原子分子AB 的刚性转子模型(1).把两个原子看着体积可以忽略不计的质点,质量为m A m B (2)认为原子间的平衡核间距离Req 在转动过程中,保持不变。
2.求绕质心以角速度ω转动时的能量及能级:ε转=h I228πJ(J+1),J=0,1,2,............能级的间隔为: ∆E(J,J+1)=h I 228π[(J+1)(J+2)-J(J+1)]=h I228π2(J+1)或∆E(J,J+1)=2Beh(J+1)=2Bhc(J+1)其中 B=h IC228π (cm -1)B 为转动常数。
第七章 分子结构

2.原子轨道要有效地线性组合成分子轨道, 必须遵循三条原则: , , ,
§7-7 分子的极性和分子间力
分子间力:
分子之间弱的相互作用
一、分子的极性
• 正电荷与负电荷中心不重合 • 正电荷与负电荷中心重合 键的极性与分子的极性:
极性分子
非极性分子
• 同种元素原子间: 所成化学键:电负性相同 所形成分子:
C
O
§ 7- 3
杂化轨道理论
一、轨道杂化理论的基本要点
价键理论较好地解释了共价键的形成和本质,初步解释了 共价键的饱和性和方向性。但不能解释键角和共价键的数目。 1931年 Pauling 和 Slater 提出杂化轨道理论,补充和发展 了现代价键理论。 H 例:
CH4分子的结构: H
C H
H
杂化轨道概念:
y y z z
py- py
x x
p z- p z
x x
多重键:形成 键外,同时还可以形成 键,从而构成多重键
例:
N2分子的结构:
三重键
z
y
2px-2px
2py-2 py
2pz- 2pz
x
配位共价键
共用电子对由一方原子提供
例:
CO分子的结构:
C: O: 2s22px12py13pz 2s2 2px12py1 2pz2
(1)苯和四氯化碳分子之间(只有色散力) (2)乙醇和水分子之间(氢键、定向力、诱 导力和色散力) (3)氧气和水分子之间(诱导力和色散力) (4)氯化氢和溴化氢分子之间(定向力、诱 导力和色散力
二、杂化轨道的类型
1、sp 杂化 同一原子中 ns-np 杂化成新轨道;一个 s 轨道和一个 p 轨 道杂化组合成两个新的 sp 杂化轨道。 例:
第七章 最新分子结构与性质

总之,杂的能量变了
轨道的形状变了
结果当然是更有利于成键!
26
2. 杂化形式——几个原子轨道杂化就可以得到几个杂化轨道
sp3杂化——四面体型
2p 2s 2s 2p
sp3
激发
杂化
四个 sp3 杂化轨道
杂化轨道
基态碳原 子的结构 CH4中共价 键形成
27
sp2杂化——平面三角形型
定义 1mol 的离子晶体解离为自由气态离子时所吸收 的能量,以符号U 表示。 MX (S) M+ (g) + X- (g) 作用 度量离子键的强度。晶格类型相同时,U与正、 负离子电荷数成正比,与离子间距离r0成反比。 化合物
NaF NaCl NaBr NaI MgO CaO SrO BaO
离子电荷
+1,-1 +1,-1 +1,-1 +1,-1 +2,-2 +2,-2 +2,-2 +2,-2
ro/pm ΔU/kJ· -1 t (m. p.)/℃ mol
231 282 298 323 210 240 257 256 923 786 747 704 3 791 3 401 3 223 3 054 993 801 747 661 2 852 2 614 2 430 1 918
正、负离 子的性质
正离子通常只由金属原子形成,其电荷等于中性原 子失去电子数目。 负离子通常只由非金属原子组成,其电荷等于中性 原子获得电子的数目;出现在离子晶体中的负离子
2 还可以是多原子离子(SO 4 ) 。
14
2. 离子半径 (radius)
严格讲,离子半径无法确定(电子云无明确边界) 核间距(nuclear separation)的一半
武汉大学分子模拟实验作业第七章分子结构模型创建和优化计算
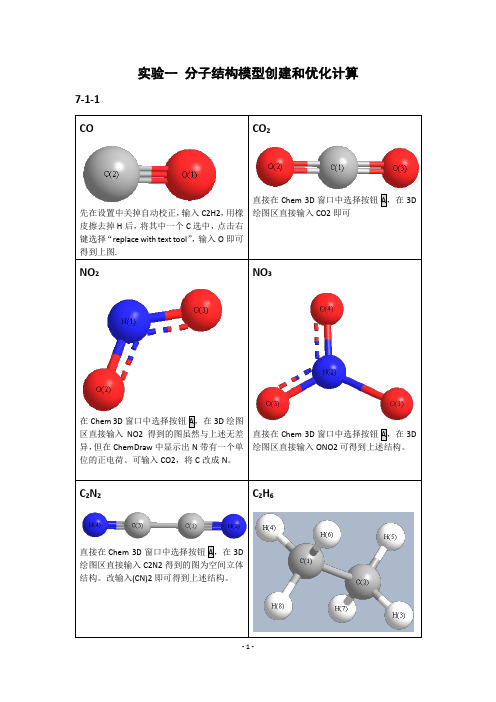
实验一分子结构模型创建和优化计算7-1-1绘图区直接输入C2H6即可。
HCOOH直接在Chem 3D窗口中选择按钮A,在3D绘图区直接输入HCOOH即可。
3DH3PO47-2-1-7-3-1 MM2O 和O 距离为2.765AE 1=-5.4331Kcal/Mol E 2= 0.0289 Kcal/Mol D=E 1-2E 2=-5.3753 Kcal/MolHF/6-31++GO 和O 距离为3.0 ÅE1= -95408.4 Kcal/mol (-152.04313 Hartrees) E2== -47701.8 Kcal/mol (-76.01774 Hartrees) D=E1-2E2=-4.8 Kcal/mol = (-0.00765 Hartrees) MP2/6-31++GO 和O 距离为2.9 ÅE1=-95650.8 Kcal/mol (-152.42932 Hartrees) E2=-47822.3 Kcal/mol (-76.20978 Hartrees) D=E1-2E2=-6.2 Kcal/mol (-0.00976 Hartrees) DFT= B3LYPO 和O 距离为2.8 ÅE1= -95870.8 Kcal/mol (-152.77997 Hartrees) E2= -47932.5 Kcal/mol (-76.38545 Hartrees) D=E1-2E2=-5.8 Kcal/mol (-0.00907 Hartrees)MOPAC-PM3O 和O 距离为3.0 ÅE1= -108.7 Kcal/molE2=-53.4 Kcal/molD=E1-2E2=-1.9 Kcal/mol7-4-2”化学意义”:RuClClPNN简介:第二代Grubbs催化剂是Grubbs在1999年对第一代催化剂的改进。
Grubbs 通过系统地对催化剂结构-性能关系进行研究,发现催化剂的活性与其中一个膦配体的解离有关,认为催化循环过程中经过一个高活性的单膦中间体,然后才与烯烃发生氧化加成。
chap7-1 分子结构_204203182

nNaCl
nCl-(3s23p6)
由离子键形成的化合物叫离子型化合物,它们以离子晶体 形 式 存 在 , 而 不 是 “ 离 子 型 分 子 ” 存 在 。 通 常 , IA 、 IIA(除Be外)的碱金属或碱土金属的氧化物和氟化物及某些 氯化物等是典型的离子型化合物。
8
(4)离子键性质
离子键本质是静电引力,在离子键的模型中,可以近似将 正负离子的电荷分布看成为球形对称的。根据库仑定律,两 种带相反电荷的离子间的静电引力与离子的电荷的乘积成正 比,而与离子间距离的平方成反比。当离子的电荷越大,在 一定范围内离子间的距离越小,则离子间的引力越强。 f q(+)·(-) q r2
负离子由于负电场占优势,电子间的屏蔽作用增加,核 对价电子的吸引力减弱,所 以 负 离 子 的 半 径 较 大, 为 130~250pm之间,正离子半径较小,为10~170pm。如: K+ 、Cl- 离子构型相同,均为3s23p6 ,但r(K+)为133pm, r(Cl-)为181pm。
周期表中处于相邻的左上方和右下方对角线上的正离子 半 径 近 似 相 等 。 如 : Li+(60pm)—Mg2+(65pm) ; 12 Na+(95pm)—Ca2+(99pm)。
20
1 价键理论(VB法——现代共价键理论) (1) 共价键的形成和本质
15
3 离子键强度——晶格能
离子型化合物的性质与离子键的强度有关。在离子晶体中 常以晶格能来表示离子晶体中离子键的强度,离子晶体由 于有较大晶格能才能稳定存在。 晶格能(焓)——在100kPa和0K(298K)时气态正离子和气 态负离子结合形成1mol固态离子化合物时所放出的能量. 意义:晶格能大小标志着离子型晶体中离子键的强弱,晶 格能越大,离子键越强,离子晶体越稳定,该晶体熔、沸 点越高,硬度越大。 晶格能可用玻恩-哈伯循环法通过热化学计算求得,或利 用理论计算求得。
第七章分子结构

Ψ1s+ψ1s
E + + 原子轨道重叠图
HH
电子云重叠图
(2)当含有2个自旋方向相同的电子的氢原子相互
靠近时,两个原子轨道两核间电子云密度ψ2减小, 体系能量上升,好像在自旋平行的电子间产生了一 种排斥作用,因而不能成键.这是符合保里不相容 原理——在每一个原子轨道中不可能出现2个自 旋平行的电子。
=-767.5( kJ·mol-1 ) 和实验值很接近,但用晶格能计算时,当相互离子极 化显著的情况下,有误差。
U的意义:晶格能是离子晶体的重要性质,晶格能的大小 反映离子晶体中离子键的强弱,即反映离子晶格的牢固 程度。U越大,离子晶体的熔点越高,硬度越大。
从晶格能理论公式分析: 决定晶格能大小: 1、离子电荷 2、离子半径 3、配位数(反应在A上)
Ti4+、Zr4+、Hf 4+
F-、Cl-、Br-、I阴离子
O2-、S2-、Se2-、Te2-
ⅠA
ⅡA ⅢA、 ⅢB ⅣB ⅦA ⅥA
然而,有相当多的阳离子具有非8电子的排布。例 如:周期表中ⅠBⅡB族中有些离子具有外层为18e构型.
Cu+、Ag+
ⅠB
18电子构型 Zn2+、Cd2+、
(ns2np6nd10)
Hg原子上的1个s轨道和1个p轨道若分别和1个Cl 原子的3p轨道重叠,将得到2个重叠程度不同的Hg -Cl键,1个是sp重叠,1个是p-p重叠,事实上这 二个键的性质完全一样,且对称分布在Hg原子的两 边。
杂化轨道理论认为:
在HgCl2分子中Hg原子参与成键的轨道已不是原 来的6s和6p轨道。在成键过程中,已经“混和”起
B原子 外层电子构型:2S2P1
7分子结构

能量相近:ns,np
ns,np,nd
(n-1)d,ns,np
成键能力变大:轨道形状发生了变化
杂化轨道的数目=参加杂化的原子轨道数目
不同类型的杂化,杂化轨道空间取向不同
二、杂化轨道的类型
1、sp 杂化 (BeCl2)
同一原子ns-np 杂化;一个 s 轨道和一个 p 轨道杂 化组合成两个新的 sp 杂化轨道。
没有方向性:正负离子可近似地看成一个弥 漫着电子云的圆球体,电荷分布球形对称,离 子能从任何方向吸引带相反电荷的离子
没有饱和性:只要空间许可,一个离子周围 可同时和几个电荷相反的离子相互吸引
离子键的离子性大小取决于电负性差值大小
电负性差值越大,电子的偏向越明显,相互作 用越强。
例如 CsF:离子性: 92%,共价性:8%
NaCl 晶体示意图
二、决定离子型化合物性质的因素
1、离子半径
离子半径:根据离子晶体中正、负离子的核间距测出 的,并假定正、负离子的平衡核间距为阴、阳离子的 半径之和。 离子半径具有规律: (1)同一种元素的负离子半径大于原子半径而正离 子半径小于原子半径,且正电荷越多,半径越小。 例如: r (F ) r (F) r(Fe3 ) r(Fe2 ) r(Fe) (2)同一周期电子层结构相同的正离子的半径, 随离子电荷增加而减小;而负离子的半径随离子电 荷增加而增大。例如:
4、sp3d , sp3d2杂化
sp3d:同一个原子的一 个 ns 轨道与三个 np,一个 nd 轨道杂化组合为 sp3d 杂 化轨道。sp3d 杂化轨道分子 的几何构型为三角双锥。 sp3d2:同一个原子的一个 ns 轨道与三个 np,两个nd 轨 道杂化组合为 sp3d2 杂化轨道。 sp3d2 杂化轨道分子的几何构型 为正八面体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
固体 气体
晶体
Electrical
极强 极弱
conductivity
极弱 熔融导电
上边三种物质的性质的不同是由什么引起的? 反 映出什么问题?
不同的外在性质反映了不同的内部结构
各自内部的结合力不同
化学键定义:如果两个原子(或原子团)之间的作 用力强得足以形成足够稳定的、可被化学家看作独立 分子物种的聚集体,它们之间就存在化学键。简单地 说,化学键是指分子内部原子之间的强相互作用力。
具有离子键的物质称为离子化合物。
2. 离子键的形成条件
1) 元素的电负性差要比较大 但离子键和共价键之间, 并非严格截然可以区分的。
可将离子键视为极性共价键的一个极端, 而另一极端为 非极性共价键。 如图所示:
化合物中不存在百分之百的离子键, 即使是 NaF 的化学键之中, 也有共价键的成分, 即除离子间靠静电 相互吸引外, 尚有共用电子对的作用。 2)易形成稳定离子
通过共用一对电子, 每个H均成为 He 的电子构型, 形成共价键。又如:
Lewis的贡献在于提出了一种不同于离子键的新 的键型, 解释了ΔX (电负性差)比较小的元素之间原子 的成键事实。但Lewis没有说明这种键的实质, 适应性 不强。在解释BCl3, PCl5 等未达到稀有气体结构的分 子时, 遇到困难。
化学键理论可以解释:
● 分子的形成与稳定性 ● 共价键的本质及饱和性 ● 分子的几何构型和共价键的方向性 ● 化学键与分子的物化性质间的关系
§7-1 离子键
一、 离子键理论的基本要点 1916 年德国科学家Kossel(科塞尔)提出离子键理论。 1. 形成过程 以 NaCl 为例:
1) 电子转移形成离子
二、决定离子化合物性质的因素-离子特征
离子化合物是由离子构成的,因此离子的性质必定 在很大程度上决定离子化合物的性质。分别对几种 特征作一简要介绍。
1、离子半径
将离子晶体中的离子看成是相切的球体, 正负离子的 核间距 d 是r+ 和r- 之和:
从原子结构的观点可得离子半径变化的一 些规律:
1) 同主族, 从上到下, 电子层增加, 具有相同电荷数 的离子半径增加。
§7-2 共价键
一、价键理论
路易斯理论: Lewis G. N. 在1916年假定化学键所
涉及的每一对电子处于两个相邻原子之间为其共享,用 A—B表示。双键和叁键相应于两对或三对共享电子。 分子的稳定性是因为共享电子对服从“八隅律”(octet rule)。 称之为经典共价键理论
原子通过共用电子对而形成的化学键称为共价键。
离子达到稀有气体稳定结构。 3)形成离子键, 释放能量大。
在形成离子键时, 以放热的形式, 释放较大的能量。
二 、离子键的特征 1、 作用力的实质是静电引力
2、 离子键无方向性, 无饱和性
因为是静电吸引, 所以无方向性; 且只要是正负离 子之间, 则彼此吸引, 即无饱和性。
3、键的极性与元素的电负性有关
r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+) r(F-)<r(Cl-)<r(Br-)<r(I-)
2) 同周期正离子半径随离子电荷增加而减小,而负离 子半径随离子电荷增加而增大。如:
r(Na+)>r(Mg2+)>r(Al3+) r(F-) < r(O2-)
3) 同一元素负离子半径大于原子半径,正离子半径 小于原子半径,且正电荷越高,半径越小,如:
3. 离子的电子构型
简单负离子(如F-、Cl-、S2-)的外电子层都是稳定 的稀有气体结构,因最外层有8个电子,故称8 电子构型。但正离子的情况较复杂。
三 、晶格能
1. 键能和晶格能 以 NaCl 为例: 键能: 1mol 气态 NaCl 分子, 离解成气体原子时, 所 吸收的能量。用Ei 表示:
B:2s22p1
P:3s23p3
有关共价键的许多疑问都无法得到回答:
● 电子对的享用与提供电子的原子轨道间存在什么 关系? ● 怎样解释形成双键和叁键的原子间共享 2 对、3 对电子? ● 能否用原子轨道在空间的取向解释分子的几何形 状?
解决了这些问题才能揭示成键本质
1927年, Heitler 和 London 用量子力学处理氢分子 H2, 解决了两个氢原子之间化学键的本质问题, 使共价 键理论从典型的Lewis理论发展到今天的现代共价键理 论。
第 七 章 分子结构
共价键的本质与特点
化学键: 分子或晶体中相邻原子(或离子) 之
间强烈的吸引作用。
化学键 理论:
离子键理论 共价键理论 金属键理论
1. 价键理论 2. 分子轨道理论
ቤተ መጻሕፍቲ ባይዱ
化学键的定义
什么是化学键?
2Na (s) + Cl2 (g) → 2NaCl (s)
Color
银灰色 黄绿色
无色
State
r(S2-)>r(S) r(Fe3+) <r(Fe2+)< r(Fe)
离子半径是决定离子化合物中正、负离子之间吸引 力的重要因素。一般来讲,离子半径越小,离子间 吸引力越大,相应化合物的熔点也越高。
2. 离子的电荷
离子电荷是影响离子化合物性质的重要因 素。离子电荷高,对相反电荷的离子静电引力 强,因而化合物的熔点也高。
ΔH=Ei 键能Ei越大,表示 分子越稳定
晶格能: 气态的正负离子, 结合成 1mol 离子晶体 时, 放出的能量。用 U 表示: 例:
晶格能 U 越大, 则形成离子键时放出的能量越多, 离子键越强。
2. 玻恩-哈伯循环 ( Born-Haber Circulation)
Born 和 Haber 设计了一个热力学循环过程, 从已知 的热力学数据出发, 计算晶格能。
图中可见:
r > r0 , 当 r 减小时, 正负离子靠 静电相互吸引, V减小, 体系稳定。
r = r0 时, V有极小值, 此时体系 最稳定,表明形成了离子键。
r < r0 时, V 急剧上升, 因为 Na+ 和 Cl- 彼此再接近时, 相互之间 电子斥力急剧增加, 导致势能骤 然上升。
这种靠正负离子的静电引力而形 成的化学键叫做离子键。
分别达到 Ne 和 Ar 的稀有气体原子的结构,形成稳 定离子。
2)靠静电吸引, 形成化学键。 体系的势能与核间距之间的关系如图所示:
横坐标: 核间距r 纵坐标: 体系的势能 V; 纵坐标的零点: 当 r 无穷 大时, 即两核之间无限远 时, 势能为零。 下面来考察 Na+ 和 Cl- 彼 此接近时, 势能V的变化:
