认证收费标准及审核人日
国家认监委关于备案认可收费标准中认可评审人日数核算方法的函

国家认监委关于备案认可收费标准中认可评审人日数核算方法的函文章属性•【制定机关】国家认证认可监督管理委员会•【公布日期】2013.06.06•【文号】•【施行日期】2013.06.06•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】标准化正文国家认监委关于备案认可收费标准中认可评审人日数核算方法的函国家发展和改革委员会:根据《国家发展改革委关于调整认可收费标准及有关问题的通知》(发改价格〔2012〕3904号)要求,现将认可收费中涉及收取评审费的5个人日数核算方法报你委备案。
5个人日数核算方法分别为:对认证机构实施管理体系认证的认可评审人日数核算方法(见附件1)、对认证机构实施产品认证的认可评审人日数核算方法(见附件2)、对人员认证机构的认可评审人日数核算方法(见附件3)、对其他类认证机构的认可评审人日数核算方法(见附件4)、对实验室和检查机构的认可评审人日数核算方法(见附件5)。
上述5个人日数核算方法均已向社会进行了公布。
附件:1.对认证机构实施管理体系认证的认可评审人日数核算方法2.对认证机构实施产品认证的认可评审人日数核算方法3.对人员认证机构的认可评审人日数核算方法4.对其他类认证机构的认可评审人日数核算方法5.对实验室和检查机构的认可评审人日数核算方法国家认监委2013年6月6日附件1对认证机构实施管理体系认证的认可评审人日数核算方法1文件审查1.1初评1.1.1单一场所认证机构1.1.1.1 单领域初评时的文件审查一般为2~3个人日,对于规模较大、组织结构较复杂的认证机构初次文件审查将增加1~2个人日。
1.1.1.2 多领域1)对于认证机构已经将多个领域的认可规范要求整合为一套管理体系的结合评审。
初评时的结合文件审查一般为3~4个人日。
超过5个领域的整合将根据各领域认可所依据认可规范文件之间的差异程度适当增加。
2)对于认证机构多个领域多套管理体系的结合评审。
各领域文件审查的收费分别按照本附件条款1.1.1.1执行。
认证收费标准及审核人日

认证收费标准及审核人日1 目的与使用范围为加强对认证组织收费的管理,规范认证收费行为,保护双方的利益,促进认证工作的发展,特制订本办法。
本办法适用于CMC所开展YY/T0287-2017和GB/T19001-2016的认证服务收费。
2 基本原则收费项目和标准按照国家主管部门的规定制订。
(产品认证见国家计委、国家质量技术监督局计价格【1999】1610 号文;质量管理体系认证见国家计委、国家技术监督局计价格【1999】212号文)。
认证审核的工作量(审核人日)按照CNAS-CC0《1 管理体系认证机构认可要求》、CNAS-CC02:201《产品、过程和服务认证机构要求》、CNAS-CC105:201《管理体系审核时间(QMS EMS OHSMS》的规定执行,综合考虑客户组织的规模、产品风险程度、审核使用语言、产品种类和数量、其他认证机构的认证结果等因素制定,总体收费水平执行CCAA 中认协监〔2013〕102号《认证机构公平竞争规范一一认证价格自律规定》。
定义3.1 审核时间各类审核的审核时间是指按审核人日度量的实施审核活动所需的有效时间。
3.2 审核人日一个审核人日通常为8 小时,不包括旅途时间或午饭时间。
在策划阶段不应通过增加每个工作日的工作小时数来减少审核人日数3.3有效人数有效人数包括认证范围内涉及的所有全职人员(含每个班次的人员)。
审核时将在场的非固定人员(季节性人员、临时人员和分包商人员和合同人员)和兼职人员也应包括在有效人数内。
注:多场所审核时,每个拟审核场所的审核时间基于该场所有效人数计算。
3.4临时场所临时场所是组织为在有限的时期内进行特定工作或服务而设立的,且不会成为常设场所的场所(例如施工现场)。
3.5审核时间覆盖所有的业务范围,包括正常工作时间之外的审核或者是和倒班的工作模式。
4 认证收费 4.1产品认证收费4.2管理体系认证收费质量管理体系认证收费标准初次审核费、监督审核费、再认证审核费按审核人日计算;初次、再认证时免费提供中英文证书 1套,证书副本或换证每套收取 200元工本费。
管理体系收费办法
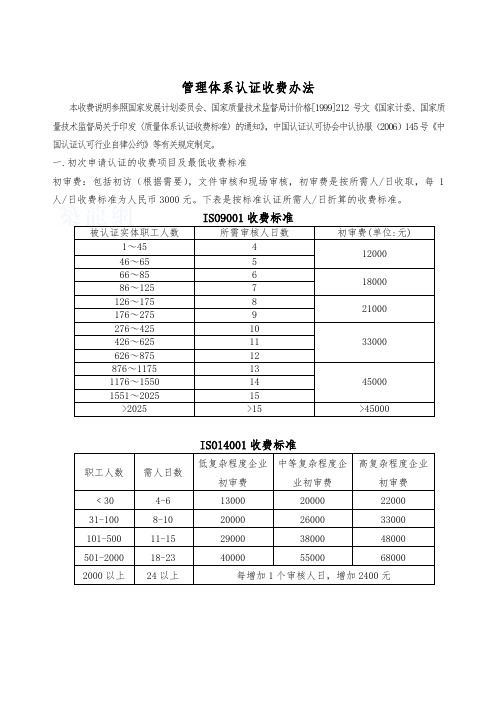
管理体系认证收费办法本收费说明参照国家发展计划委员会、国家质量技术监督局计价格[1999]212号文《国家计委、国家质量技术监督局关于印发〈质量体系认证收费标准〉的通知》,中国认证认可协会中认协服(2006)145号《中国认证认可行业自律公约》等有关规定制定。
一.初次申请认证的收费项目及最低收费标准初审费:包括初访(根据需要),文件审核和现场审核,初审费是按所需人/日收取,每1人/日收费标准为人民币3000元。
下表是按标准认证所需人/日折算的收费标准。
被认证实体职工人数所需审核人日数初审费(单位:元)1~45 41200046~65 566~85 61800086~125 7126~175 821000176~275 9276~425 1033000426~625 11626~875 12876~1175 13450001176~1550 141551~2025 15>2025 >15 >45000职工人数需人日数低复杂程度企业初审费中等复杂程度企业初审费高复杂程度企业初审费﹤30 4-6 13000 20000 22000 31-100 8-10 20000 26000 33000 101-500 11-15 29000 38000 48000 501-2000 18-23 40000 55000 68000 2000以上24以上每增加1个审核人日,增加2400元两体系结合审核时,初审的最低限价为相应的两个单体系最低价格之和的75%;三体系结合审核时,初审的最低限价为相应的三个单体系最低价格之和的65%二.预审费:被认证方要求预审时,预审费按每1人/日3000元收取。
三.其他费用1、审核现场分散在不同地点(同类性质的生产现场),每多一处增加1个人.日,不同性质的另议。
2、所有因审核发生的差旅费用(包括初审、预审、监督审核及复评)由受审核方承担。
3、如需加印证书另收工本费,每套证书200元。
认证收费标准及审核人日

认证收费标准及审核人日1目的与使用范围为加强对认证组织收费的管理,规范认证收费行为,保护双方的利益,促进认证工作的发展,特制订本办法。
本办法适用于CMD所开展YY/T0287-2017和GB/T19001-2016的认证服务收费。
2基本原则收费项目和标准按照国家主管部门的规定制订。
(产品认证见国家计委、国家质量技术监督局计价格【1999】1610号文;质量管理体系认证见国家计委、国家技术监督局计价格【1999】212号文)。
认证审核的工作量(审核人日)按照CNAS-CC01《管理体系认证机构认可要求》、CNAS-CC02:2013《产品、过程和服务认证机构要求》、CNAS-CC105:2016《管理体系审核时间(QMS、EMS、OHSMS)》的规定执行,综合考虑客户组织的规模、产品风险程度、审核使用语言、产品种类和数量、其他认证机构的认证结果等因素制定,总体收费水平执行CCAA中认协监〔2013〕102 号《认证机构公平竞争规范——认证价格自律规定》。
3定义3.1审核时间各类审核的审核时间是指按审核人日度量的实施审核活动所需的有效时间。
3.2审核人日一个审核人日通常为8 小时,不包括旅途时间或午饭时间。
在策划阶段不应通过增加每个工作日的工作小时数来减少审核人日数.3.3有效人数有效人数包括认证范围内涉及的所有全职人员(含每个班次的人员)。
审核时将在场的非固定人员(季节性人员、临时人员和分包商人员和合同人员)和兼职人员也应包括在有效人数内。
注:多场所审核时,每个拟审核场所的审核时间基于该场所有效人数计算。
3.4临时场所临时场所是组织为在有限的时期内进行特定工作或服务而设立的,且不会成为常设场所的场所(例如施工现场)。
3.5审核时间覆盖所有的业务范围,包括正常工作时间之外的审核或者是和倒班的工作模式。
4认证收费4.1产品认证收费4.2管理体系认证收费4.3各项费用说明4.3.1申请费、审定与注册费、年金为固定费用;4.3.2初次审核费、监督审核费、再认证审核费按审核人日计算;4.3.3初次、再认证时免费提供中英文证书1套,证书副本或换证每套收取200元工本费。
CMD-CR-010认证收费标准及审核人日100415

认证收费标准及审核人日1目的与使用范围为加强对认证组织收费的管理,规范认证收费行为,保护双方的利益,促进认证工作的发展,特制订本办法。
本办法适用于CMD所开展的认证服务收费。
2基本原则收费项目和标准按照国家主管部门的规定制订。
(产品认证见国家计委、国家质量技术监督局计价格【1999】1610号文;质量管理体系认证见国家计委、国家技术监督局计价格【1999】212号文)认证审核的工作量(审核人日)按照CNAS-CC01《管理体系认证机构认可要求》、CNAS-CC21《产品认证机构通用要求》、CNAS-CC15《管理体系审核时间(QMS、EMS、OHSMS)》的规定执行,综合考虑客户组织的规模、产品风险程度、审核使用语言、产品种类和数量、其他认证机构的认证结果等因素制定,总体收费水平执行CCAA中认协监(2009)51号《认证机构公平竞争规范——管理体系认证价格暂行规定》。
3定义3.1审核时间各类审核的审核时间是指按审核人日度量的实施审核活动所需的有效时间。
3.2审核人日一个审核人日通常为8 小时,不包括旅途时间或午饭时间。
3.3有效人数有效人数包括认证范围内涉及的所有全职人员(含每个班次的人员)。
审核时将在场的非固定人员(季节性人员、临时人员和分包商人员)和兼职人员也应包括在有效人数内。
注:多场所审核时,每个拟审核场所的审核时间基于该场所有效人数计算。
3.4临时场所临时场所是组织为在有限的时期内进行特定工作或服务而设立的,且不会成为常设场所的场所(例如施工现场)。
4认证收费4.1产品认证收费4.2管理体系认证收费4.3各项费用说明4.3.1申请费、审定与注册费、年金为固定费用;4.3.2初次审核费、监督审核费、再认证审核费按审核人日计算;4.3.3初次、再认证时免费提供中英文证书1套,证书副本或换证每套收取200元工本费。
如果组织需要其他国家文字证书,则加收翻译费和证书工本费;4.3.4各种费用的具体金额和付款时间见双方签订的《认证合同》或《认证协议》;4.3.5现场审核的交通、食宿费由申请方承担。
WSC管理体系认证收费标准

根据国家发展和改革委员会、国家质量监督检验检疫总局文件(计价格[1999]212号及中国认证认可协会(CCAA)第一届常务理事会第二次会议通过的《认证机构公平竞争规范—管理体系认证价格暂行规定》,经本中心理事会批准,制订以下收费标准:一、质量管理体系(QMS)、医疗器械质量管理体系(MDQMS)、食品安全管理体系认证(HACCP)认证收费标准:2、申请组织产品/服务形成过程比较复杂或覆盖产品/服务专业类别评定在2个小类以上时或审核地点在1个城市以上的多场所审核时则收费标准增加10%~20%。
3、如需要预审核时,预审核认证收费为初审认证收费的50%。
4、认证组织在证书有效期三年内原则上应进行三次监督审核,每次定期监督审核收费为初次认证审核费的1/3;如果监督审核为两次,则每次定期监督审核收费为初次认证审核费的1/2。
5、认证组织证书有效期满进行复评时认证费用为初次认证审核费的2/3,监督审核费用同注4。
扩大认证范围审核根据实际评审应增加的审核人日数适当增加收费。
二、环境管理体系(EMS)、职业健康安全管理体系(OHSMS)认证收费标准:及食宿费用。
2、复杂程度及级别的解释:(以EMS为例,OHSMS参考确定,具体的界定依据中心及CNAS相关文件规定)高–具有多个性质重大且影响重大的环境因素(典型的有:多个环境因素都伴随重大环境影响的生产或加工类型组织);如采矿与采石、纺织品与服装的染色、化学品与药品、民用建筑的建设与拆除污水处理、煤电、纸张生产、油和气的开采等中–中等数量的环境因素伴随中等程度环境影响(典型的有:生产型组织某些环境因素中包括重大环境影响);如电子工业用印刷线路板的生产、食品与烟草—加工、交通与运输、技术试验与试验室、水的汲取、净化与供给、非煤的发电与电的输送等低 - 少量的环境因素伴随的环境影响程度低(典型的有:具有少量重要环境影响的组装类型组织);如批发与零售、一般机械加工组装、不包括印刷、纸浆的生产与纸张制造的纸制品等3、认证组织在证书有效期三年内原则上应进行三次监督审核,每次定期监督审核收费为初次认证审核费的1/3;如果监督审核为两次,则每次定期监督审核收费为初次认证审核费的1/2。
商品售后服务评价体系认证收费标准及人日数对照表

商品售后服务评价体系认证收费标准及人日数对照表商品售后服务评价体系认证收费标准及人日数对照表(试行)全国商品售后服务评价达标认证委员会参照国家发展和改革委员会颁发的《收费许可证》(证号B11320011),制定认证收费标准如下:1.申请费:1000元;2.审定与注册费(含证书费):2000元;3.年金(含标志使用费):2000元(每年交纳一次);4.评审费:按所需评审工作人?日总数收取,每人?日收费标准为人民币3000元;5.初审、监审、复评评审人·日数表:注1:表中提到的“雇员”是指企业的所有人员(含企业在编人员及售后服务管理、监督、服务操作、联络等兼职人员),包括评审时将在场的非长期(季节性的、临时的和分包的)雇员。
注2:雇员人数的确定执行行业实施细则。
注3:一个“评审人·日”通常指8小时完整的正常工作日,不能通过增加每天的工作时间来减少要使用的评审员天数。
允许增加评审员时间的因素,可以是:a) 复杂的后勤条件,涉及到不止一座建筑物或一处工作地点;b) 雇员使用多种语言(需要翻译人员或妨碍评审员个人独立工作);c) 相对雇员数量、工作现场很大;d) 法规要求高(食品和药品、航空、核动力,等等);e) 体系覆盖了高度复杂的过程或相对数量大的彼此不同的活动;f) 产品涉及到硬件、软件、流程性材料和服务的组合。
允许减少评审员时间的因素,可能是:a) 无/低风险产品/过程;b) 对组织体系的前期了解(例如,组织已经按照其它标准被同一机构认证);c) 相对雇员数量、工作现场很小(例如,只有综合办公楼);d) 客户的认证准备状态(例如,组织已经被另一个第三方机构认证或承认);e) 过程涉及到单一的基本活动;f) 成熟的管理体系;g) 大量雇员从事相同的简单工作。
注4:考虑到所有因素,对减少某个组织初次评审人·日的调整总量不能大于评审员人·日时间表中要求的评审员人·日时间的30%。
赛宝认证中心ITSMS认证人日规定及收费标准说明v1.0(试行)

赛宝认证中心ITSMS认证人日规定及收费标准说明(试行)根据国家的有关规定,规范管理体系认证收费行为,维护认证企业的合法权益,参照国际惯例,特制定本规定:ITSMS认证的收费项目申请费RMB 1000元审定注册名录费RMB 2000元审核费(包括审核策划、计划编制、文件审核、现场审核、文件跟踪验证和审核报告编制等)审核费=审核人天数人天收费标准①审核人天数本规定中表1的审核总人日数,②每个人天收费标准为RMB 5000元③每个人天的定义为每人每天工作时间不少于8小时差旅费(包括交通费、食宿费)按合同规定执行,如无注明,(按国际惯例)由受审核方支付。
预审(预审是非强制性的审核) (差旅费另计)预审费=实际发生人天数人天收费标准年金(含每年标志使用费),在每年监督审核时支付RMB 2000元每增加一份证书正本/证书附件(包括中英文版本):RMB 50元/份现场验证费,指现场审核结束后需对不符合项进行现场跟踪验证时发生的费用(差旅费另计)现场验证费=实际发生人天数人天收费标准初次审核收取申请费、审定注册名录费、审核费;每年监督审核收取监督审核费、及年金;其他收费规定如一套人马,两块牌子(特指工商注册),取同一种认可证书,申请费、审定注册名录费分别收取,审核费增加1个人天;如获证后,在证书有效期内扩大体系覆盖产品范围/注册地址迁移时,应重新签订认证合同,申请费和审定注册名录费、年金、差旅费与初次认证时收费相同,审核费按实际情况确定的审核人天数收取,重新注册发证,在证书有效期内,用原证书注册号及有效期;如获证后,在证书有效期内扩大体系覆盖产品范围/扩大注册地址/注册地址迁移,重新签订认证合同,申请费和审定注册名录费、年金、差旅费与初次认证时收费相同,审核费按实际情况确定的审核人天数收取,重新注册发证,在证书有效期内,用原证书注册号及有效期。
企业扩大体系覆盖产品/活动范围时应尽量要求其选择与监督审核或复评审核时同时进行;(实际情况分为如下两种情况:如果变更不涉及人员的增加时,可在监督审核或复评时的审核人天数基础上增加1-2天;如果变更涉及人员的增加时,审核人天数为新增加人员数所需的初次认证审核人天数与监督审核或复评时的审核人天数之和,但不超过企业人员总数所需的初次认证审核人天数);如同时申请多类认证(申请QS-9000、TL9000、TS16949认证按各自的收费规定文件执行),审核费均按初次认证或复评时审核人天数的80%计算,其它费用不变;未尽事宜与客户协商解决。
节能认证收费标准

节能认证收费标准一、认证注册有关费用:申请费:2000元;审查费:3000元′人日数;评定与注册:3000元;年金:5000元;产品检验费:由检验机构按规定收取;二、监督审查费监督审查费:初次审查费'30%;监督检验费:由检验机构按规定收取。
三、复评费:审查费'80%;其它收费项目及标准与初次认证相同。
证书及标志管理1. 适用范围为加强对认证证书和标志的使用管理,保证认证证书和标志的正确使用,维护证书持有者的合法权益,同时维护CSC认证和CSC的信誉,特制定本办法。
本文件适用于CSC与通过认证注册并获得认证证书和允许使用标志的获证组织。
2. 引用文件CNAB-AG01-2004 认证证书管理实施指南CNAB-AR04-2004 认可标志和国际互认标识使用规则CSC/K02-2005认证批准、保持、扩大、缩小、暂停和撤销的规定3. 工作程序3.1CSC发布认证标志图形式样,并对通过认证的组织颁发认证证书。
管理委员会监督管理认证证书和标志的使用。
3.2认证证书是证明符合认证要求的法定证明文件。
3.3认证标志是表示已经符合认证要求的图形标识。
节能产品认证标志和节水产品认证标志均为蓝色“节”字标志,环保产品认证标志和质量管理体系认证标志(亦为CSC标志)为彩色图形,其中节能、节水和环保产品认证标志已经通过国家工商行政管理总局商标局注册成为国家节能/节水/环保产品认证的专用标志,质量管理体系认证标志通过注册为CSC实施质量管理体系认证的专用标志。
见附录A、B、C。
3.4认证证书及使用规定3.4.1认证证书由中国认证机构国家认可委员会(以下简称:“认可委”)授权,CSC统一印制。
3.4.2认证证书采用中、英文对照形式,当对英文内容发生争议时,以中文为准。
如果境外企业的地址无法译成中文,则可使用英文或当地邮政能识别的字母或代码的写法。
3.4.3产品认证证书镶嵌“节”字标志/环保产品认证标志图形,证书内容应包括:a)证书名称(中国节能产品认证证书/中国节水产品认证证书/中国环保产品认证证书)b) 认证证书编号c) 获证组织的名称d) 制造商的名称及地址e) 生产厂的名称及地址(如果包括几个工厂,证书中要写明每个工厂的地址)f) 认证依据的标准及补充技术要求g) 获证产品名称、规格型号、必要的技术参数f) 产品认证模式g) 发证日期、换证日期和有效期的起止年月日h) 认证机构的名称或授权人的签章i) 国家认可标志及CSC通过国家认可的注册编号(认可项目)3.4.4质量管理体系证书镶嵌“CSC”标志图形,证书内容应包括:证书名称(质量管理体系认证证书)获证组织的名称依据的质量管理体系标准和/或其他引用文件的编号与版次质量管理体系认证覆盖的产品(或服务)的类别及涉及的过程适当时,相应产品所依据的法规、产品标准或其他引用文件发证日期、换证日期和有效期的起止年月日注册号认证机构的名称及其标志认证机构的印章或授权人的签章国家认可标志及国际互认标志(认可项目)3.4.5认证证书及其副本具有同等的法律效力。
电力行业能源管理体系认证审核收费标准及人天表【最新范本模板】

电力行业能源管理体系认证审核收费标准及人天表ICAS英格尔上海中山西路2368号华鼎大厦801室~200235能源体系认证审核人天表及收费标准Tel:+86 21 51114700 Fax:+86 21 54253541电力行业能源管理体系认证审核收费标准及人天表Energy management system certificate audit charging standards and man/day form能源管理体系认证价格Energy management certificate price人数初评价监审费/年人数初评价监审费/年Number Initial audit Surveillance audit Number of people Initial audit Surveillance of fee/Annual auditpeople fee/Annual24000 12000 501—1000 84000 42000 50以下Below5051-100 42000 21000 1001-2000 96000 48000101—200 55500 27800 2001—3000 117000 585000201—300 61500 30800 3001—4000 126000 63000301—500 72000 36000 4001以上应根据能源核算边界的情况考Above 4001 虑规模增加而应增加的人天费The man/day fee that need to beincreased due to the enlarging ofthe scale should be based on thesituation of energy calculationboundary注:以上不包含增加分场所所需增加的认证费,分场所人天参见附表2Note: The certificate fee that should be increased due to the adding of attached sites isnot included above, see appendix 2 to get the man/day form of attached site.备注: 证书有效期两年~监督审核每季度一次。
质量认证收费标准

国家计委国家技术监督局
关于印发《质量体系认证收费标准》的通知
计价格〔1999〕212号
各省、自治区、直辖市物价局(委员会),技术监督局:
鉴于国家计委、原国家技术监督局1997年4月印发的《质量体系认证收费标准(试行)》(计价费〔1997〕689号)规定的试用期已满。
最近,国家计委、国家质量技术监督局对《质量体系认证收费标准》重新进行了核定。
现将核定后的《质量体系认证收费标准》印发给你们,请遵照执行。
附件:质量体系认证收费标准
国家计
委国家质量技术监督局
一九九九年三月一日附件
质量体系认证收费标准
注:1.人日数是审核所需的人员天数(即人数×天数),具体由中国质量体系认证机构国家认可委员会按国际惯例规定,报国家发展计划委员会价格司备案后执行。
2.深圳特区的审核费与监督审核费可在上述收费标准的基础上上浮30%。
CRCC产品认证收费标准
CRCC产品认证收费标准
一、收费标准
根据国家计委、国家质量技术监督局“关于印发产品质量认证收费管理办法和收费标准的通知”(计价格[1999]1610号)精神,中铁铁路产品认证中心开展第三方产品认证拟执行以下收费标准:
产品认证收费标准
注:
1.申请两种及两种以上产品/产品单元认证时,申请费为:3000元/两种,4000元/三种, 5000元/三种以上;
2.审核总人日数按申证企业的生产场所、生产规模、生产过程以及认证模式确定,并可根据申证产品的单元数量、产品之间差异程度等因素酌情增加人日数;
3.人日数包括文件评审、审查组专业知识的准备、现场审核和最终报告的时间,不包括路途时间、预审核等所花费的时间;
4.认证监督和认证复评时的工厂检查审核费用可在初次认证基础上酌情减少。
二○一二年十月三十日。
CNAS认证认可办理需要多少钱

众所周知,实验室申请CNAS认证认可是一个复杂且较长的流程,那么,办理该证认可需要多少钱呢?下边,我们一起来了解一下吧。
一、明确收费项目:
1、收费项目:
申请费、评审费(包括文件评审费及现场评审费)、审定与注册费和年金。
2、收费标准:
申请费:500元;
评审费:2500元×人•日数;
审定与注册费(含证书费):600元;
年金:1000元;
对境外申请人或获准认可机构的认可收费,依据国际惯例,由双方协商并在合同中约定。
评审所需的人日数由CNAS根据申请人或获准认可机构的规模和评审范围的大小,以保证评审工作质量为原则来确定。
二、非明确收费项目
1、评审人员的交通费、食宿费。
该费用由申请人或获准认可机构承担。
(目前CNAS发布了《认可评审人员在评审期间交通食宿安排的指南》供参考执行)
2、评审人员劳务费。
(非公开)
以上就是有关CNAS认证认可办理需要多少费用的一些简单介绍,大家可根据以上内容来进行预估,但由于不同地域,不同认证机构以及项目等,费用也会不同,所以,以上仅供参考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页共 2 页认证收费标准及审核人日一、产品认证收费项目和标准(依据国家计委、国家质量技术监督局、计价格[1999]1610号文)产品认证收费标准序号收费项目收费标准(单位:元)备注 1 申请费1000 初次、复评认证收取 2 初次审查费3000×人.日数按CMD 规定的人.日数执行 3 加印证书副本,另收费200元/套审定与注册费(含证书费)2000 4 监督审查费 3000×人.日数初次人.日数的1/3 5 产品检测费按国家规定收取由检测机构收取 6 年金(不含标志使用费)2000 第二年开始交纳,每年一次 7 复评审查费3000×人.日数初次人.日数的2/3 二、质量管理体系认证收费项目和标准(依据国家计委、国家质量技术监督局、计价格[1999]212号文)质量管理体系认证收费标准序号收费项目收费标准(单位:元)备注 1 申请费 1000 初次、复评认证收取 2 初次审核费 3000×人.日数按CMD规定的人.日数执行 3 加印证书副本,另收费 200元/套审定与注册费(含证书费) 2000 4 监督
审核费3000×人.日数初次人.日数的1/3 5 年金 2000 第二年开始交纳,每年一次 6 复评审核费3000×人.日数初次人.日数的2/3 7 备注: 1、申请费、审定与注册费、年金为固定费用。
2、初次审核费、监督审核费、复评审核费按人.日数计算。
3、表中“人.日数” 即人数×天数。
4、质量体系扩大,按产品单元收费,具体金额以双方签订的《认证协议》为准。
5、各种费用的具体金额和付款时机见双方签订的《认证合同》。
6、现场审核的交通、食宿费由申请方承担。
发布日期:2005年04月01日实施日期:2005年
04月01日
第 2 页共 2 页三、审核人日表质量管理体系认证初次审核人.日数体系认证+产品认
证单独申请产品认证认证种类GB/T19001-初次审核人.日数
初次审查人.日数GB/T19001-ISO9001 ISO9001和(适用1个
认证单元)(适用1个认证单元)或单一经营组织YY/T0287-ISO13485 员工人数 A C D B 1-10 2 3 3.5 11-25 3 4 4.5 3 26-45 4 5 5.5 46-65 5 6 7 66-85 6 7 8 4 86-125 7 8 9 126-175 8 9 10.5 176-275 9 10 11.5 5 276-425 10 11 12.5 426-625 11 12 13.5 626-875 12 13 14.5 6 876-1175 13 14 15.5
1176-1550 14 15 16.5 7 1551-2025 15 16 17.5 >2026 依此类推说明: 注1: 表中提到的“员工”是指工作活动在质量管理体系的认证范围内的所有人员。
包括审核时将在场的非长期(季节性的、临时的和分包的)人员。
注2: “审核人.日数”包括:非现场文件审核,撰写报告的时间;“审核人.日”指完整的8小时。
注3: 表中 A 指仅申请GB/T19001-ISO9001标准的非医疗器械组织或仅申请经营范围的医疗器械组织;B 指申请YY/T0287-ISO13485(含GB/T19001-ISO9001)标准的医疗器械组织;C 指申请体系+产品认证的医疗器械组织;D 指仅申请产品认证的医疗器械组织。
注4: 监督审核的总时间约是初评时间的1/3。
注5: 复评的总时间对约是同一组织(人数不变)初评时间的
2/3。
——需要增加审核人.日的因素,如:涉及到不止一座建筑物或一处工作地点;雇员使用多种语言;相对于雇员数量,工作现场很大;法规要求高(如三类医疗器械);
体系覆盖了高度复杂的过程或相对数量大的彼此不同的活动。
过程涉及到硬件、软件、流程性材料和服务的组合。
——允许减少审核人日的因素,如:组织不负有设计责任和/或不覆盖标准的某些要素;产品生产过程较简单,风险较低。
组织已经被另一经国家认可的认证机构认证;大量雇员从事相同的简单工作。
发布日期:2005年04月01日实施日期:2005年04月01日。
