第三章饱和烃(环烷烃)讲解
饱和烃烷烃和环烷烃课件

目前对烷烃和环烷烃的结构与性质关系仍有许多未知领域,深入研究这些关系有助于发现新的应用领 域和性能优化的可能性。
对未来发展的建议
加强基础研究与应用研究的结合
为了推动烷烃和环烷烃领域的发展,需要加强基础研究与应用研究的结合,促进科技成 果的转化和应用。
培养高素质人才
高素质人才是推动学科发展的关键,应重视人才培养,加强学术交流与合作,提高研究 水平和创新能力。
烃化反应和裂化反应是烷烃合成的常用方法,其中烃化反应可以生成高纯度的烷烃,但需要 使用大量的卤代烃或醇类物质,成本较高;裂化反应虽然可以大量生产烷烃,但副产物较多 ,产率较低。
环化反应和烷基化反应是环烷烃合成的常用方法,其中环化反应可以生成多种类型的环烷烃 ,但需要使用大量的烯烃或炔烃物质;烷基化反应虽然可以大量生产环烷烃,但需要使用卤 代烃或醇类物质,成本较高。
03
烷烃和环烷烃的性质比 较
物理性质比较
沸点
随着分子量的增加,烷烃和环烷 烃的沸点都逐渐升高。但在相同 分子量下,由于环烷烃的分子结 构更加紧凑,其沸点往往高于相
应的直链烷烃。
熔点
环烷烃的熔点通常比直链烷烃高 ,因为环烷烃的分子间作用力更
强。
密度
在常温常压下,烷烃和环烷烃的 密度都随着分子量的增加而增大
饱和烃烷烃和环烷烃课 件
目录 CONTENT
• 饱和烃烷烃概述 • 环烷烃概述 • 烷烃和环烷烃的性质比较 • 烷烃和环烷烃的合成方法 • 烷烃和环烷烃的工业生产 • 烷烃和环烷烃的前沿研究与展望
01
饱和烃烷烃概述
定义与分类
定义
饱和烃烷烃是只含有碳、氢两种 元素的化合物,且碳原子之间只 通过单键相互连接。
环烷烃

+ HBr
(主)
2013-11-18 30
四、氧化反应
环丙烷与烯烃既类似又有区别,环丙烷
有抗氧化能力,不使KMnO4水溶液褪色。
应用:环丙烷和不饱和烃
2013-11-18
31
空气 钴盐 OH
+
O
O
O2
O
+
O
2013-11-18
32
3.5 环烷烃的稳定性
椅式
2013-11-18
50
1 3 4 5 2 6
半椅式
2013-11-18 51
4
5
6
1
3
2
船式
2013-11-18 52
扭船式
2013-11-18 53
1. 椅式
5 4 3
6 2
1
2013-11-18
54
4
5
6
3
2
C3
1
碳1、2、4、5在同一平面上,是椅座。 碳1、5、6在同一平面上,是椅背。 碳2、3、4在同一平面上,是椅腿。
转角,并且环越大,偏转角越大,张力越大。
这一推论不正确。这是由于张力学说前提
不合理,即环中碳原子在同一平面内不合理。 拜尔张力学说存在于小环中。
2013-11-18 38
二、分子中的张力
现代理论认为:分子能量的升高,都是分
子中存在张力的结果。有机分子中可能存在 的张力主要有4种。 (1)Van der Waals张力——非键作用力。Enb (2)键张力——键长偏离正常值引起的张力。El
CH3 CH3
1,1-Dimethylcyclohexane
第三章饱和烃环烷烃讲解

Cl + HCl
+ Cl2 光或热
Cl + HCl
(2) 氧化反应 ?据此室可温区下别,环C烷=烃C和不C能≡使C。KM例n:O4褪色,
CH2=CH2 KMnO4
紫色退去 不退色
? 在加热或催化剂存在下,环烷烃可 被氧化,产物因反应条件而异:
环烷酸钴
+ O2
OH
O
+
环己醇 环己酮
浓硝酸 + O2
? 实验事实: 环的稳定性:三元环<四元环<五元、六元环
? why? 结构所致!环张力所致!
? 环烷烃的环张力越大,表明分子的能量越高, 稳定性越差,越容易开环加成。
? 可用环烷烃每个 CH 2单位的燃烧热来表明环 张力的大小。
一些环烷烃的燃烧热如下所示 :
以上的数据说明: 环越小,每个 CH 2的燃烧热越大,环张力越大。
? 根据环上碳原子的饱和程度不同,可将脂环烃分为 环烷烃、环烯烃、环炔烃等。
饱和脂环烃
环烷烃 如
... ...
脂环烃
环烯烃 如
... ...
不饱和脂环烃
环二烯烃 如
... ...
环炔烃 如
... ...
? 根据脂环烃分子中所含的碳环数目不同,分为单环、 二环和多环脂环烃。
(二) 脂环烃的命名
(1) 单环脂环烃 (2) 二环脂环烃
环丙烷的结构 物理方法测得,环丙烷分子中三个碳原子共平面。
显然,环丙烷中没有正常的 C-C键,而是形成“弯曲 键”:
? 由于环丙烷分子中的 C-C键不是沿 轨道对称轴实现头对头的最大重叠,而 重叠较少,张力较大,具有较高的能量。
? 根据结构与性能的关系,环丙烷的 化学性质应该活泼,容易开环加成。
有机化学-烷烃和环烷烃

成键的电子云并不沿轴向重叠,而是形成一种弯曲键。 造成重叠程度小, 键能下降,产生角张力。
开链或较大脂环化合物 中轨道可达到最大重叠
Banana bond
环丙烷分子中 轨道部分重叠
H
H
C
105.5°
H
60°
H
C
C
CH2
亚甲基
CH
次甲基
系统命名法
关键是如何确定主链和处理取代基的位置
分三步:一选主链、二编号、三写全称。 1.选主链(母体):选取代基最多的最长碳链 2.编号: 从靠近取代基一端开始 3.写全称:按先小后大,把取代基的位次、数
目及名称列在母体前。
在英文命名中,取代基按词首的字母排列顺序先后列出
烷烃系统命名法的要点:
张力学说:
1885年,Baeyer AV 假定,环烷烃具有平面正多边形的结构 :
60° 90° 108° 120°
128.6 135°
• 环上C-C之间的键角偏离正常键角109°28′,
•环丙烷每个键必须向内偏转24.75°,就会产生角张力。
•环丁烷、环己烷分别向内偏转9.75°, 0.75°。
•环己烷每个键向外偏转5.25°。
第二节、烷烃的命名
(一)普通命名法 (二)系统命名法(IUPAC法)
(一)普通命名法
• 1~10以内的碳原子数用天干字表示:
甲、乙、丙、丁、戊、己、庚、辛、 壬、癸。从十一个碳原子开始用中文数
字表示。
• 直链的烷烃称“正某烷”,“正”(n-)一般 略去。如:
CH3CH2CH3
丙烷
CH3(CH2)10CH3 十二烷
烷烃、环烷烃

烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的一类有机化合物。
烷烃分子里的碳原子之间以单键结合成链状(直链或含支链)外,其余化合价全部为氢原子所饱和。
烷烃分子中,氢原子的数目达到最大值,它的通式为CnH2 n+2。
分子中每个碳原子都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体(tetrahedro n)。
甲烷是标准的正四面体形态,其键角为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长烷烃还可能发生光学异构现象。
当一个碳原子连接的四个原子团各不相同时,这个碳就叫做手性碳,这种物质就具有光学活性。
烷烃失去一个氢原子剩下的部分叫烷基[1],一般用R-表示。
因此烷烃也可以用通式RH来表示。
烷烃最早是使用习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使用。
于是有人提出衍生命名法,将所有的烷烃看作是甲烷的衍生物,例如异丁烷叫做2-一甲基丙烷。
现在的命名法使用IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
第三章 环烷烃
如何鉴别: 如何鉴别:
CH3-CH=CH2 CH3-CH2-CH3
褪褪 Br2/H2O
褪褪 KMnO4
×
褪褪
×
在强烈条件下,环烷烃也能被氧化。 在强烈条件下,环烷烃也能被氧化。 如:
OH
O
+ O2 (air)
环烷酸钴 140~180℃ ℃ 1-2.5MPa
+
氧化
HOOC
COOH
工业生产己二酸 锦纶-66单体 单体) (锦纶-66单体)
总之: 总之: 三元环的稳定性最小,最易开环; 三元环的稳定性最小,最易开环; 四元环的稳定性次之;也易开环; 四元环的稳定性次之;也易开环; 五元、六元环等,较稳定,不易开环。 五元、六元环等,较稳定,不易开环。 作业 : P73 二(4、5、6) 、 、 )
Ni + H2 200
+ 开环 加
Pt H2 300
CH3-CH2-CH2-CH2-CH3
(2)加成卤素 ) +
常温 Br2 CCl4
Br-CH2-CH2-CH2-Br
+ Br2
CCl4
Br-CH2-CH2-CH2-CH2-Br
棕红色褪去,用以鉴定环丙烷及环丁烷 鉴定环丙烷及环丁烷。 使Br2/CCl4棕红色褪去,用以鉴定环丙烷及环丁烷。
(3)加成卤化氢 )
+ HBr
CH3
CH3CH2CH2Br
+
HBr
CH3CHCH2CH3 Br
带有取代基的小环烷烃加成HX或 带有取代基的小环烷烃加成HX或Br2时,环 HX 的断裂是在取代基最多与最少的两个环碳原子 的断裂是在取代基最多与最少的两个环碳原子 加到含H多的碳上。( P67有错误 。(书 有错误!) 之间, 之间,且H加到含H多的碳上。(书P67有错误!)
胡宏纹第四版有机化学-第三章 环烷烃(上下)(完整版)
1,5-二甲基螺 [3,5]壬烷
7
6
12
2
54
3
2,7,7-三甲基二环[2,2,1]庚烷
CH3
1
56
4
3
9
7 8
2,8-二甲基-1-乙基二环[3,2,1]辛烷
1,8-二甲基-2-乙基-6-氯-双环[3,2,1]辛烷
8
1
7
2
8
71
6
2
1 8
2 10
97
3
Cl 6 5 4
3
5
43
65 4
三环[3,3,11,5 ,13,7 ]癸烷
Br
Br + HBr
CH2CH2Br
+ Br2
rt
Br
FeBr3
C: 与卤化氢加成
+ HBr
CH3CH2CH2Br
+ HBr
CH3CHCH2CH3
Br
规律:环丙烷衍生物与HX加成时,环的破裂处发生在
连接烷基最多的和最少的碳原子间,加成时产
物符合马氏规则,卤素加在含H较少的C上,H
加
在含H较多的C上。
7
6
1
5
32
4
9 10 1
2 8
5
3
7
64
CH3
螺[2, 4]庚烷
7-甲基螺[4, 5]癸烷
9 10 1
5 8
母体为:螺[3,4]辛烷
65 3
5-甲基螺[3,4]辛烷
7 8
4 2
1 9
CH3
2
1-甲基螺[3,5]-5-壬烯
螺[4,5]-1,6-癸二烯
3
76 4
有机化学第三章饱和烃

根据烃分子中碳原子间连接方式可分为:
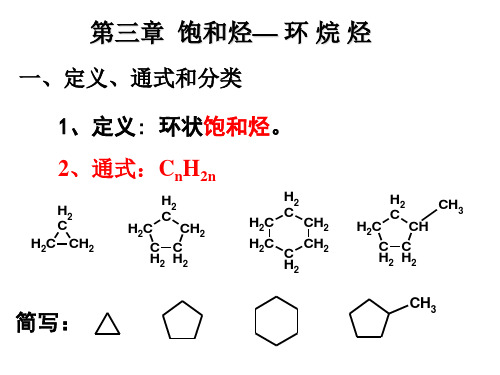
饱和烃:链烷烃 链烃 不饱和烃: 烯烃 炔烃 饱和烃:环烷烃 不饱和烃:环烯烃 环炔烃
芳香烃: 苯,萘,蒽,菲等
烃
环状烃
烃:只由C、H两种元素组成的有机化合物。 烷烃:包括链烷烃和环烷烃
cubane adamantane
甾族化合物:
甾族化合物的结构特征是包含一个四环稠合的碳环骨架, 同时还有三个侧链。 CH
3
甾环结构:
1 2 3
H3C
11 9 B 6
12
H3C
R
17 D 16 15
HO H3C H
H3C H H
CH CH2 CH2 CH2 CH CH3 H CH3
C
13 14
A 10 4 5
0
60
120
180
240
300
360
degrees of rotation
CH 3 H H CH 3 H H
CH3 H3C H H H H
3. 其它烷烃的构象
例:画出化合物
H 3C H Br
2
CH3 Br 的 全 交叉式 和 全重 叠 式 构 象
3
H
H H3C Br
H3C H3C
Br Br
Br H
2、
(CH3CH2)2CHCHCH2CH3
3-甲基-4-乙基己烷
CH3
3、
(CH3)2CHCH2CH2CHCHCH2CH3 CH3
CH3
2,5,6-三甲基辛烷
4、
CH3CH2CHCH2CHCHCH2CH2CH2CH(CH3)2 CH3 CH2CH(CH3)2
环烷烃知识讲解ppt课件

电子云偏
向环平面外 侧,容易受 等亲电试剂 进攻,故似 烯烃进行加 成反应。
弯曲键(香蕉键)
共价键的形成是由于原 子轨道相互交盖的结果,交 盖程度越大,键越稳定。
CH3
CH2 109。28′
CH3
10
燃 烧 热------指化合物燃烧时所放出的热量(它
的大小反映出分子内能的高低。 比较单位CH2燃烧热( H) kJ/mol
+ H2
Pt 300 0C
CH3CH2CH2CH2CH3
+ H2
Pt >300 0C
CH3CH2CH2CH2CH2CH3
18
2. 加HX 、X2
CH2 CH2 + Br2
常温
CH2
CH2-CH2-CH2
Br
Br
CH2 CH2 + HBr CH2
CH2-CH2-CH2
H
Br
H3C— CH CH2 + HBr CH2
双环烃
分子的碳架中含有两个碳环的烃。
联环
桥环 螺环
稠环
4
2、螺环烃的命名 螺环烃:两个碳环共用一个碳原子的化合物。
螺原子:两个碳环共用的碳原子
螺原子
2
1
6
7
1 5 6
5
8
3
4
10 9
螺[4.5]癸烷
2
7
4
8
3
5-甲基- 螺 [3.4] 辛烷
1、确定成环碳原子的数目。 7-庚烷 , 9-壬烷
2、从小环中螺原子旁的一个碳原子开始编号,编完小环,再 编螺原子,最后编大环。
1-甲基-3-乙基环戊烷 1
③ 若环烃中有双键时,编号应从双键开始,且使编号的数 值最小。
(完整版)胡宏纹第四版有机化学-第三章-环烷烃(上下)

环己烷的构象 椅式、半椅式、船式和扭船式
(a)椅式 (b)半椅式 (d)船式 (c)扭船式
半椅式:张力最大,势能最高 椅式构象是优势构象:势能最低,占环己烷全部构象的
99.99%
❖环己烷构象的势能关系:
半椅式
E
46kJ·mol-1
扭船式 30kJ·mol-1
23kห้องสมุดไป่ตู้·mol-1
❖半椅式构象:
H
CH3CH2CH2CH3
+
H2
Pt 3300C以上
CH3(CH2)3CH3
B:与卤素加成
三元环与X2, HX在常温下即可发生开环反应, X2, HX于常温下不
使四,五员环开环,但加热后,可发生取代反应。
CH2CH2CH2
+ Br2
rt
Br Br
FeBr3
光照 + Br2
+ Br2
3000C
+ HBr
Br
Br + HBr
CH2CH2Br
+ Br2
rt
Br
FeBr3
C: 与卤化氢加成
+ HBr
CH3CH2CH2Br
+ HBr
CH3CHCH2CH3
Br
规律:环丙烷衍生物与HX加成时,环的破裂处发生在
连接烷基最多的和最少的碳原子间,加成时产
物符合马氏规则,卤素加在含H较少的C上,H
加
在含H较多的C上。
香蕉键
环丙烷分子中 轨道部分重叠
开链或较大脂环化合物 中轨道可达到最大重叠
❖环丙烷分子相邻碳上的碳氢键都是重叠式构象。 扭转张力:试图恢复交叉式构象的力。
2 其他环烷烃
饱和烃知识点总结

饱和烃知识点总结烷烃是一类碳氢化合物,分子中只含有碳和氢两种元素,结构上是由碳原子通过共价键连接而成的链状结构。
烷烃的分子中没有含有任何官能团,是一类非常稳定的有机化合物。
在化学反应中,它们往往是比较不活泼的物质,不容易发生化学反应。
烷烃有很多种类,按照碳原子链的不同长度可分为甲烷、乙烷、丙烷等。
此外,烷烃的结构可以是直链烷、支链烷,也可以是环状结构,不同的结构对其化学性质和用途都有所不同。
环烷烃,也称脂环烷烃或环状烷烃,是一种由碳原子构成封闭环状结构的烷烃类化合物。
由于其特殊的结构,环烷烃在化学性质和用途上与直链或支链烷烃有所不同。
环烷烃的分子结构稳定,通常比直链或支链烷烃具有更优异的物化性质和更广泛的应用前景。
环烷烃可以通过氢化、裂解、重整和重排等反应来制备,广泛应用于石油、化工和精细化工等领域。
饱和烃是天然气和石油中的重要成分,天然气主要是甲烷和小量的乙烷、丙烷和丁烷等烷烃混合物,而石油中主要是长链烷烃。
饱和烃是重要的燃料,烷烃在石油加工和化工生产中也有广泛的应用。
在石油加工中,烷烃是重要的裂解原料,也是重要的燃料和燃料添加剂。
在化工领域,烷烃是许多有机物的原料,例如可以通过氧化反应得到醇、醛、酮、酸等,也可以通过氯代反应制备卤代烷烃等。
饱和烃具有较高的稳定性和低的反应性,这使得它们不易发生化学反应或不容易形成复杂的分子结构。
因此,饱和烃在燃料、润滑剂、溶剂、塑料、化妆品和医药等领域有广泛的应用。
值得注意的是,饱和烃燃烧时会释放大量的热能,使其成为重要的燃料来源。
饱和烃还可以通过裂解和氢化等反应获得不饱和烃和环烷烃,为有机合成和化工生产提供了重要的原料。
总的来说,饱和烃是一类重要的有机化合物,具有稳定性高、反应性低、燃烧热值高等特点,因此在石油加工、化工生产和生活用品制造中有广泛的用途。
随着石油和化工工业的发展,对饱和烃的需求将会不断增加,同时也需要开发更加环保和高效的生产方法,以应对日益增长的市场需求。
第三章--环烷烃PPT课件

Cyclohexane
船 式 构 象 球 棒 模 型
32
Cyclohexane
船 式 斯 陶 特 模 型
33
转环作用中的能量变化
半椅式
船式
扭船式
椅式
34
环己烷的椅式构象最稳定
✓ 角张力为0
✓ 采取邻位交叉式构象,扭转张力最小
✓
1,3-二a键相互作用小。因为H原子 范德华半径小,所以范德华张力为0
环数:使环状化合物 变成开链化合物所需 打破的碳碳键的数目
单环: 如
C
H
C
2
H
2
C
H
2
(
环
丙
烷
)
、
(环 己 烷 )
二环:如
(十 氢萘) 又叫二 环[4.4.0]癸烷
多环:二环以上。 如 金刚烷
螺环:共有1个碳 如 按环的连接方式 稠环:共有2个碳 如十氢萘
桥环:共有2个以上碳原子 如
3
二. 单环烷烃的命名
1,1-二甲基-4-乙基环己烷
4-Ethyl-1,1-dimethylcyclohexane 7
例3
CH3
CH3 CH CH3
CH 3 CH 2 C CH 2 CH 3 CH 3
1-甲基-2-异丙基环己烷 1-甲基-2-(1-甲基乙基)环己烷
3-甲基-3-环丁基环戊烷 (长链作母体) 8
环烷烃顺反异构
h
C H 2 H 2 CC H C l+ H C l
甲基环己烷+氯r
+Br2
Br
3. 环烯烃的氧化
O 3 Z n /H 2 O C H 3 C O C H 2 C H 2 C H (C H 3 )C H O
高二化学饱和烃知识点总结

高二化学饱和烃知识点总结饱和烃是有机化合物的一种,其中所有碳碳键都是单键,并且碳原子与氢原子饱和连接。
在化学中,饱和烃的理解对于学习有机化学以及石油化工等领域具有重要意义。
本文将对高二化学中的饱和烃进行知识点总结,以帮助读者更好地理解和掌握该概念。
一、饱和烃的命名法饱和烃的命名法主要有以下几种:直链烷烃、支链烷烃、环烷烃等。
1. 直链烷烃是指所有碳原子按照一条直链排列的烷烃。
例如,甲烷(CH4)、乙烷(C2H6)等。
2. 支链烷烃是指其中存在一些支链的烷烃。
支链通常由取代基(alkyl group)表示,例如,异丙基(isopropyl)、叔丁基(tert-butyl)等。
支链烷烃的命名需要确定主链、编号、选择取代基位置等。
3. 环烷烃是指具有环状结构的烷烃,环烷烃也可以存在支链。
例如,环己烷(C6H12)。
二、饱和烃的物理性质1. 饱和烃的密度较小,大多数饱和烃是气体或液体,少数是固体,例如甲烷是无色无臭的气体,蜡烷是白色固体。
2. 饱和烃的沸点随着碳原子数的增加而增加,烷烃的沸点比相应的烯烃和炔烃高。
3. 饱和烃通常不溶于水,但可以溶于非极性溶剂,如非极性有机溶剂和石油醚。
三、饱和烃的化学性质1. 碳碳单键的特性使得饱和烃相对稳定,不容易发生化学反应。
饱和烃通常只参与燃烧反应,燃烧反应是指饱和烃与氧气反应,产生二氧化碳和水,并释放大量能量。
2. 饱和烃可以通过加氢反应与氢气反应,例如,烯烃可以加氢生成相应的饱和烃。
3. 饱和烃在适当条件下可发生取代反应,取代反应是指饱和烃中的一个氢原子被其他原子或基团取代的反应。
例如,甲烷可以与氯气发生取代反应,生成氯代甲烷(CH3Cl)。
四、应用与实际意义1. 饱和烃是石油和天然气的主要成分之一,研究饱和烃有助于研究石油和天然气的产生、提取和利用。
2. 饱和烃是化学工业中的重要原料,广泛应用于制造塑料、合成纤维、燃料等领域。
3. 饱和烃的燃烧反应是我们日常生活中炉灶、汽车等燃烧设备的基础,研究饱和烃的燃烧有助于提高能源利用效率和环境保护。
理学饱和烃

重叠式(顺叠式)构象
H
H
H
交叉式(反叠式)构象
交叉式构象最稳定, 重叠式构象最不稳定。
二、 丁烷的构象
正丁烷沿C2和C3之间的σ键键轴旋转有四种典型构象。
CH3
H
H
H
ห้องสมุดไป่ตู้
H
CH3
对位交叉式 (反错式)
HCH3
H H3C
H H
部分重叠式 (反叠式)
CH3
H3C
H
H
H
H
邻位交叉式 (顺错式)
H3CCH3
H H
反应①加氢②加卤素; 3、烷烃的结构(1)乙烷的构想,(2)丁烷
的构想,(3)环己烷的构想。
三甲基甲烷
二甲基乙基甲烷
四甲基甲烷
例2、下列物质属于同位素的是:
属于同系物的是: (1) 属于同分异构体的是:(2) (1)CH3CH3和CH3CH2CH2CH3 (2)CH3CH2CHCH(CH3)CH(CH3)CH3和
CH3CH2CH(CH3)CH(CH3)CH3
• 8.下列物质属于同系物的一组是 ( C )
CH2CH2CH3
1 2 3 45 6 7 8 9
CH3 CH2 CH2 CH CH CH2 CH2 CH2 CH3
CH CH3 CH3
5-丙基-4-异丙基壬烷
9
CH3
8
CH2
76
CH CH2
CH3
54
CH2 CH CH2 CH3
321
CHCH2CH3
3,7-二甲基-4-乙基壬烷 CH3
(4) 支链的命名
CH3
CH3
CH3
1, 3-二甲基环戊烷
有机化学 第三章 环烷烃

环丙烷的结构:
弯曲键
纽蔓投影式
环丁烷和环戊烷的构象:
折 叠 式 构 象
信 封 式 构 象
扭 曲 式 构 象
3.3.2 环己烷的构象 椅式构象和船式构象:
椅式构象是无张力环,稳定
船式构象存在扭转张力 和非键张力,不稳定
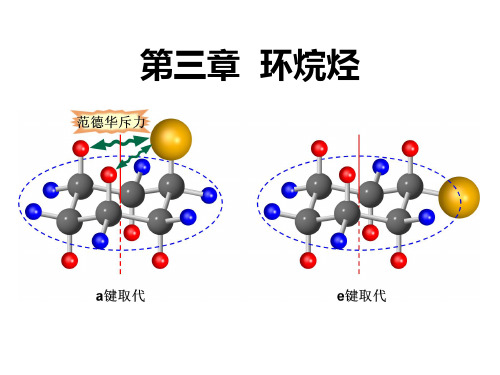
直立键 (a键) 和平伏键(e键)
直立键
平伏键
直 立 键 『 键 』
顺反异构:
——当环上有两个碳原子各连有不同的原子或 基团时就存在顺反异构.
例如:n=5时单环烷烃的构造异构
单环烷烃命名:
① “环”字 ② 取代基的位次和最小 ③ 小的号码表示小的取代基
顺反异构的命名:
双环烷烃:
通式CnH2n-2 根据两个碳环的位置关系分为:
命名:
隔离型双环烷烃: 联环烷烃:
立体透视式
锯架式
例:1,2-二甲基环己烷
顺式:
a,e
反式:
e,e
a,a
稳 定
反式
顺式
顺-1-甲基-4-叔丁基环己烷
稳 定
优势构象
顺-4-叔丁基环己醇
稳 定
优势构象
顺-1-甲基-3-氯环己烷
多取代环己烷:
全顺式-1,2,4-三甲基环己烷
十氢化萘的结构:
稳 定
第三章
环烷烃
环烷烃的定义、分类、异构和命名 环烷烃的性质 环烷烃的环张力和稳定性 环己烷的构象
3.1 脂环烃的定义、分类、异构和命名
脂环烃——具有环状碳骨架,而性质上与脂肪
烃相似的烃类。分为饱和脂环烃和不饱和脂环烃.
环烷烃——饱和脂环烃
环烷烃分类: 单环烷烃 双环烷烃 多环烷烃
有机化学-环烷烃

1、单环烷烃
单环烷烃是指分子结构中含有一个环的饱和烃类化合物。最简单的脂环烃是 环丙烷。
脂环烃是不少重要药物的主要成份。
2、分类和命名
2.1环烷烃的分类: (1)按碳数的多少分 环上碳原子数为3~4时, 称为小环;为5~6时,称为普通环;为7~12时,称为 中环;大于12时,称为大环。 (2)按环的多少分 分子中只有一个环的称为单 环;两个环的称为双环;有三个或以上环的称为多环。 (3)按环的结合方式分 两个环共用一个碳原 子——螺环;两个环共用两个碳原子——稠环;两个 环共用两个以上碳原子——桥环。
2.2 命名:
单环 在相应的开链烃名称前加一个“环”字即可,若有官能 团就使其位次号最小或尽可能的使取代基有最低的系列编号。
练习
环戊烷 甲基环丁烷 乙基环丙烷 1.1-二甲基环丙烷 1.2-二甲基-1-乙基环丙烷
二、环烷烃的物理性质பைடு நூலகம்1、在常温常压下,环丙烷与环丁烷为气体,环戊烷、环己烷为 液体。 2、环烷烃不溶于水,易溶于有机溶剂,比水轻。环烷烃的沸点、 熔点、相对密度都比同碳原子数的烷烃高
第二节 环烷烃
一、环烷烃 环烷烃(huán wán tīng),含有脂环结构的饱和烃。 有单环脂环和稠环脂环。 含有1个脂环且环上无取代烷基的环烷烃,
。环戊烷、环己烷及它们的烷基取代衍生物是石 油产品中常见的环烷烃。稠环环烷烃存在于高沸点石油 馏分中。环烷烃有很高的发热量,凝固点低,抗爆性介 于正构烃和异构烃之间。化学性质和烷烃相似。其中以 五碳脂环和六碳脂环的性质较稳定。
三、环烷烃的化学性质
乙二酸是合成尼龙的单体
第三章 饱 和 烃

烷烃的熔点曲线
3、相对密度 烃类都比水轻,共相对密度都小于1 4、溶解度 烃类都不溶于水,能溶于有机溶剂。
20
六、 烷烃的化学性质 1、氧化反应 1)、完全氧化反应 作为燃料 CnH2n+2+
3 n+1 2
O2→ nCO2+(n+1)H2O + 热
2)、部分氧化反应 工业上制备含氧有机化学品 甲烷在一定的条件下可以制备甲醛:
10
三 烷烃的构型
构型: 具有一定构造的分子中的原子在空间的排布。
1、碳原子的四面体概念及分子模型 1874范特霍夫和勒贝尔同时提出了碳原子的四面体概念。
甲烷正四面体构型
11
2、碳原子的SP3杂化
碳原子的基态电子排布: 1S2、2S2、2Px1、2Py1、2Pz 按未成键电子的数目,碳原子应是二价的,但在烷烃 分子中碳原子确是四价的,且四个价键是完全相同的。 原因: 在有机物分子中碳原子都是以杂化轨道参与 成键的 ,在烷烃分子中碳原子是以SP3杂化轨 道成键的。
非键张力小
306
16
2、正丁烷的构象 丁烷绕C2及C3之间的σ键旋转的四种极限构象:
CH3 H H CH3 H H
CH3 H H CH3 H H
H3C CH3 H H H H
HCH3 H CH3 H H
全交叉式(反叠式)
斜交叉式(顺错式) 全重叠式(顺叠式) 部分重叠式(反错式)
扭转张 小 非键张力小
十一个碳原子以上用汉文表示,称“多少烷“ C12H26 十二烷 C20H42 二十烷 对于有异构体的烷烃,常以正、异、新来标记。 正己烷(n) CH3 CH2 CH2 CH2 CH2 CH3
CH3 CH CH2 CH2 CH3 异 CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl + HCl
+ Cl2 光或热
Cl + HCl
(2) 氧化反应 据此室可温区下别,环C烷=烃C和不C能≡使C。KM例n:O4褪色,
CH2=CH2 KMnO4
紫色退去 不退色
在加热或催化剂存在下,环烷烃可 被氧化,产物因反应条件而异:
环烷酸钴
+ O2
OH
O
+
环己醇 环己酮
浓硝酸 + O2
CH3
5-甲基-1,3-环戊二烯
(2) 二环脂环烃 分子中含有两个碳环的是双环化合物。
联二环己烷 (联环烃)
螺[4,4]壬烷 二环[4,4,0]癸烷 二环[2,2,1]庚烷
(螺环烃)
(稠环烃)
(桥环烃)
两环共用一个碳原子双环化合物的叫做螺环化合物; 两环共用两个或更多个碳原子的叫做桥环化合物。
第三章 脂环烃 -cycloalkane
(一) 脂环烃的分类 (二) 脂环烃的命名 (三) 脂环烃的性质 (四) 环烷烃的结构与稳定性 (五) 环己烷及其衍生物的构象 (六) 脂环化合物的立体异构 (七) 脂环烃的主要来源和制法 (八) 环戊二烯 (九) 萜类和甾族化合物
(一) 脂环烃的分类
脂环烃——由碳原子相互连接成环,性质与开链烃相 似的环状碳氢化合物。
ÒÎ ÐÍ ÎÈ ¶¨
´¬ ÐÍ ²» ÎÈ ¶¨
两种构象通过C-C单键的旋转,可相互转变;
室温下,环己烷主要在椅型构象存在(99.9%以上)。 为什么椅型构象稳定?
椅型构象:(动画)
3 45
2
6
1
6
4
5
1
3
2
①所有两个相邻的碳原子的碳氢键都处于 交叉式位置;
②所有环上氢原子间距离都相距较远,无 非键张力。
由于环丙烷分子中的C-C键不是沿 轨道对称轴实现头对头的最大重叠,而 重叠较少,张力较大,具有较高的能量。
根据结构与性能的关系,环丙烷的 化学性质应该活泼,容易开环加成。
环丁烷的结构:
C:sp3杂化, 轨道夹角109.5° 若四个碳形成正四边形,内角应为90°
角 张 力 : 109.5 - 90 = 19.5° < 109.5 - 60 = 49.5° 环丁烷中的C-C键也是“弯曲键”,但弯曲 程度较小。
1
6
2
7
5
3
4
双环[2.2.1]-2-庚烯
7
2
1
6 3 45
CH3
5-甲基双环[2.2.1]-2-庚烯
(乙) 螺环烷烃的命名
固定格式: 螺[a.b]某烃 (a≤b)
先找螺原子,编号从与螺原子相连的碳开始, 沿小环编到大环。例:
H3C 5
4
1
3 2
6
7
5-甲基螺[2.4]庚烷
6
5
CH3 1
7
(甲) 桥环烃的命名
固定格式:双环[a.b.c]某烃 (a≥b≥c)
先找桥头碳(两环共用的碳原子),从桥头碳 开始编号。沿大环编到另一个桥头碳,再从该 桥头碳沿着次大环继续编号。分子中含有双键 或取代基时,用阿拉伯数字表示其位次:
21
36
7
4
5
双环[3.1.1]庚烷
21
3 45
双环[2.1.0]戊烷
(甲) 桥环烃 (乙) 螺环烃
(二) 脂环烃的命名
(1) 单环脂环烃
CH2 CH2 CH2
CH3
即
CH2 CH2
环戊烷
甲基环丁烷
CH3 CH3
1,2-二甲基环戊烷
CH3
即
CH
H3C
CH3
H CH3
H CH3
CH3 H
即
CH3 H
1-甲基-4-异丙基环己烷
反-1,4-二甲基环己烷
CH3
3-甲基-1-环己烯
例:
Cl Cl
Cl Cl
Cl Cl
¹¹ ¨
Cl Cl
Cl Cl
Cl
¹¹¹ à ¹
Cl
CH3
H3C H
CH(CH3)2
H CH(CH3)2
¹¹ ¨
CH3
H
H
¹¹¹ ¨ CH(CH3)2
CH3 Cl
C(CH3)3
Cl
H
C(CH3)3 CH3 H
优势构象
CH3 C2H5
CH3
H
C2H5
H
优势构象
(六) 脂环烃的主要来源和制法
船型构象:(动画)
1
246
3
5
4H
5
H1
6
3
2
①C2-C3及C5-C6间的碳氢键处于重叠式位置; ② 船头和船尾上的两个碳氢键向内伸展, 相距较近,比较拥挤,存在非键张力。
∴我们重点掌握椅型构象。
• 椅式构象的特点
①六个碳原子分布在相互平行的两个平面 上(上三,下三):
②十二个碳氢键分为两种类型:a-键(直 立键)和e-键(平伏键),每个碳原子上都 有一个a键和和一个e键:
∴环丁烷较环丙烷稳定,但仍有相当大的张力, 属不稳定环,比较容易开环加成。
事实上,环丁烷中四个 碳原子不共平面,这样可 使部分张力得以缓解。(动 画)
环戊烷的结构:
C:sp3杂化, 轨道夹角109.5° 正五边形内角为108° 角张力:109.5-108=1.5°
可见,环戊烷分子中几乎没有什么角张力,故五元环 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
2
43
CH3
1,3-二甲基螺[3.5]-5-壬烯
(三) 脂环烃的性质
(1) 取代反应 (2) 氧化反应 (3) 加成反应
(甲) 加氢 (乙) 加卤素 (丙) 加卤化氢
(4) 环烯烃的反应
(三) 脂环烃的性质
(1) 取代反应 五元、六元环易发生取代反应。
¹¹ ò ¹
+ Cl2
Cl + HCl
+ Cl2 光或热
事实上,环戊烷分子中的五 个碳原子亦不共平面,而是 以“信封式”构象存在,使 五元环的环张力可进一步得 到缓解。 (动画)
(五) 环己烷及其衍生物的构象
• 椅式构象和船式构象 • 椅式构象的特点
• 椅式构象和船式构象
环己烷分子中的六个碳不共平面,且六元环是无张力 环,键角为109.5°。
环己烷有两种构象(动画,船式与椅式的翻转):
环烷烃的环张力越大,表明分子的能量越高, 稳定性越差,越容易开环加成。
可用环烷烃每个CH2单位的燃烧热来表明环 张力的大小。
一些环烷烃的燃烧热如下所示:
以上的数据说明: 环越小,每个CH2的燃烧热越大,环张力越大。
环丙烷的结构 物理方法测得,环丙烷分子中三个碳原子共平面。
显然,环丙烷中没有正常的C-C键,而是形成“弯曲 键”:
COOH COOH
(己二酸)
(3) 加成反应
(甲) 加氢
+ H2
N£i¡
80 C
CH3CH2CH3
+ H2
Ni
200 £¡C
CH3CH2CH2CH3
²» Ò×
+
H2
Pt
300 £¡C
CH3(CH2)3CH3
¿ª »·
(乙) 加卤素 (区分环丙烷与开链烷烃)
+ Br2 CCl4
¹¹
+ Br2 D
BrCH2CH2CH2Br Ò׿ª »·
根据环上碳原子的饱和程度不同,可将脂环烃分为 环烷烃、环烯烃、环炔烃等。
饱和脂环烃
环烷烃 如
... ...
脂环烃
环烯烃 如
... ...
不饱和脂环烃
环二烯烃 如
... ...
环炔烃 如
... ...
根据脂环烃分子中所含的碳环数目不同,分为单环、 二环和多环脂环烃。
(二) 脂环烃的命名
(1) 单环脂环烃 (2) 二环脂环烃
② 环丙烷的结构、弯曲键的不稳定性; ③ 环己烷的构象:
a. 通过C-C键的自由旋转形成椅式构象,消除张力; b. 椅式构象中的a键、e键,a、e键的相互转换,e键
取代稳定。
环己烷的椅式构象
环己烷的船式构象
船式与椅式翻转,环己烷二种椅式构象互换
取代环己烷的构象1
主要来源:石油。
制法: (1) 芳香族化合物催化氢化 (2) 分子内关环 (3) 其它方法
(1) 芳香族化合物催化氢化
OH + 3H2
Ni DP
(2) 分子内关环
Br
Br + Zn
NaI,乙醇 D 80%
(3) 其它方法
+
CHO
。
30 C
100%
OH
+ ZnBr2 CHO
本章重点:
① 环的大小与其稳定性(三元、四元环不稳定, 易开环加成;五元、六元环稳定,不易开环加 成);
Br(CH2)4Br (¹¹¹¹¹·¹!)
+ Br2 + Br2
¹ú¹¹ ú ¹ ¹ú¹¹ ú ¹
²» Ò׿ª »·
(丙) 加卤化氢
× Ò ¿ª »· ²» Ò׿ª »·
+ HBr H2O CH3CH2CH2Br
+ HBr + HBr
¹· ¹¹ ¹· ¹¹
(4) 环烯烃的反应
环烯烃的性质与开链烯烃类似,易加成、氧化等。
CH3
H2/Ni
Br CH3
HBr
CH3
Br2
Br CH3 Br
KMnO4
CH3
O COOH
