4.4与电极电势有关的图表及其应用
标准电极电势表

标准电极电势表标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。
本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L,气体分压为100kPa,温度为298K,所有离子的数据都在水溶液中测得。
[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。
注:(s) –固体;(l) –液体;(g) –气体;(aq) –水溶液;(Hg) –汞齐。
E°(V)[注半反应来源1](g) + 4 H2O + 2 e−2 NH2OH(aq) + 2 OH−−3.04 [6]NCs++e−Cs(s) −3.026 [5] (s) + 2 e−Ca(s) + 2 OH−−3.02 [11]Ca(OH)Rb++e−Rb(s) −2.98 [4]K++e−K(s) −2.931 [5] Mg++e−Mg(s) −2.93 [10] Ba2++ 2 e−Ba(s) −2.912 [5]La(OH)(s) + 3 e−La(s) + 3OH−−2.90 [5]Fr++ e−Fr(s) −2.9 [11]E°(V)[注半反应来源1]Sr2++ 2 e−Sr(s) −2.899 [5] (s) + 2 e−Sr(s) + 2 OH−−2.88 [11]Sr(OH)Ca2++ 2 e−Ca(s) −2.868 [5] Eu2++ 2 e−Eu(s) −2.812 [5] Ra2++ 2 e−Ra(s) −2.8 [5] Yb2++ 2 e−Yb(s) −2.76 [11][1] Na++e−Na(s) −2.71 [5][9] Sm2++ 2 e−Sm(s) −2.68 [11][1] No2++ 2 e−No(s) −2.50 [11]E°(V)[注半反应来源1](s) + H2O + 4 e−Hf(s) + 4 OH−−2.50 [11]HfO(OH)Th(OH)(s) + 4 e−Th(s) + 4 OH−−2.48 [11]Md2++ 2 e−Md(s) −2.40 [11] La3++ 3 e−La(s) −2.379 [5]Y3++ 3 e−Y(s) −2.372 [5] Mg2++ 2 e−Mg(s) −2.372 [5] (s) + H2O + 4 e−Zr(s) + 4OH−−2.36 [5]ZrO(OH)Pr3++ 3 e−Pr(s) −2.353 [11] Ce3++ 3 e−Ce(s) −2.336 [11]E°(V)[注半反应来源1]Er3++ 3 e−Er(s) −2.331 [11] Ho3++ 3 e−Ho(s) −2.33 [11]−+ 3 e−Al(s) + 4 OH−−2.33Al(OH)Al(OH)(s) + 3 e−Al(s) + 3OH−−2.31Tb3++ 3 e−Tb(s) −2.28(g) + 2 e−2 H−−2.25HAc3++ 3 e−Ac(s) −2.20Be++e−Be(s) −2.12 [10] Cf2++ 2 e−Cf(s) −2.12 [11]E°(V)[注半反应来源1]Am3++ 3 e−Am(s) −2.048 [11] Cf3++ 3 e−Cf(s) −1.94 [11] Am2++ 2 e−Am(s) −1.9 [11] Be2++ 2 e−Be(s) −1.85Rf4++ 4 e−Rf(s) −1.67 [12]U3++ 3 e−U(s) −1.66 [7]Al3++ 3 e−Al(s) −1.66 [9]Ti2++ 2 e−Ti(s) −1.63 [9]Bk2++ 2 e−Bk(s) −1.6 [11]E°(V)[注半反应来源1]ZrO(s) + 4 H++ 4 e−Zr(s) + 2 H2O −1.553 [5]Hf4++ 4 e−Hf(s) −1.55 [11] Zr4++ 4 e−Zr(s) −1.45 [5]Ti3++ 3 e−Ti(s) −1.37 [13] TiO(s) + 2 H++ 2 e−Ti(s) + H2O −1.31TiO3(s) + 2 H++ 2 e−2 TiO(s) + H2O −1.23−+ 2 e−Zn(s) + 4 OH−−1.199 [14]Zn(OH)Mn2++ 2 e−Mn(s) −1.185 [14]−+ 6 H++ 2 e−Fe(s) + 4HCN(aq) −1.16 [15]Fe(CN)E°(V)[注半反应来源1]V2++ 2 e−V(s) −1.175 [2] Te(s) + 2 e−Te2−−1.143 [2] Nb3++ 3 e−Nb(s) −1.099Sn(s) + 4 H++ 4 e−SnH4(g) −1.07 (s) + 3 e−In(s) + 3 OH−−0.99 [11]In(OH)SiO(s) + 4 H++ 4 e−Si(s) + 2 H2O −0.91(aq) + 3 H++ 3 e−B(s) + 3 H2O −0.89B(OH)Fe(OH)(s) + 2 e−Fe(s) + 2 OH−−0.89 [15]FeO3(s) + 3 H2O + 2 e−2Fe(OH)2(s) + 2 OH−−0.86 [15]E°(V)[注半反应来源1]TiO2++ 2 H++ 4 e−Ti(s) + H2O −0.86O+ 2 e−H2(g) + 2 OH−−0.8277 [5]2 HBi(s) + 3 H++ 3 e−BiH3−0.8 [14] Zn2++ 2 e−Zn(Hg) −0.7628 [5]Zn2++ 2 e−Zn(s) −0.7618 [5] O5(s) + 10 H++ 10 e−2 Ta(s) + 5 H2O −0.75TaCr3++ 3 e−Cr(s) −0.74[Au(CN)]−+e−Au(s) + 2 CN−−0.60Ta3++ 3 e−Ta(s) −0.6E°(V)[注半反应来源1]O + 2 e−Pb(s) + 2 OH−−0.58PbO(s) + H(s) + 2 H++ 2 e−Ti2O3(s) + H2O −0.562 TiOGa3++ 3 e−Ga(s) −0.53U4++e−U3+−0.52 [7] PO2(aq) + H++e−P(白磷[16]) + 2 H2O −0.508 [5]HHPO3(aq) + 2 H++ 2 e−H3PO2(aq) + H2O −0.499 [5]HPO3(aq) + 3 H++ 3 e−P(红磷)[16]+ 3H2O −0.454 [5]Fe2++ 2 e−Fe(s) −0.44 [9](g) + 2 H++ 2 e−HOOCCOOH(aq) −0.432 COE°(V)[注半反应来源1]Cr3++e−Cr2+−0.42Cd2++ 2 e−Cd(s) −0.40 [9] SeO32−+ 4e−+ 3H2O⇌Se + 6OH−−0.37 [17] (s) + 2 H++ 2 e−GeO(s) + H2O −0.37GeOO(s) + H2O + 2 e−2 Cu(s) + 2 OH−−0.360 [5]CuPbSO(s) + 2 e−Pb(s) + SO42−−0.3588 [5]PbSO(s) + 2 e−Pb(Hg) + SO42−−0.3505 [5]Eu3++e−Eu2+−0.35 [7]In3++ 3 e−In(s) −0.34 [2]E°(V)[注半反应来源1]Tl++e−Tl(s) −0.34 [2] Ge(s) + 4 H++ 4 e−GeH4(g) −0.29Co2++ 2 e−Co(s) −0.28 [5] PO4(aq) + 2 H++ 2 e−H3PO3(aq) + H2O −0.276 [5]HV3++e−V2+−0.26 [9]Ni2++ 2 e−Ni(s) −0.25As(s) + 3 H++ 3 e−AsH3(g) −0.23 [2] AgI(s) + e−Ag(s) + I−−0.15224[14] MoO(s) + 4 H++ 4 e−Mo(s) + 2 H2O −0.15E°(V)[注半反应来源1]Si(s) + 4 H++ 4 e−SiH4(g) −0.14Sn2++ 2 e−Sn(s) −0.13(g) + H++e−HO2•(aq) −0.13OPb2++ 2 e−Pb(s) −0.13 [9] WO(s) + 4 H++ 4 e−W(s) + 2 H2O −0.12P(红磷) + 3 H++ 3 e−PH3(g) −0.111 [5] CO(g) + 2 H++ 2 e−HCOOH(aq) −0.11Se(s) + 2 H++ 2 e−H2Se(g) −0.11E°(V)[注半反应来源1]CO(g) + 2 H++ 2 e−CO(g) + H2O −0.11SnO(s) + 2 H++ 2 e−Sn(s) + H2O −0.10 (s) + 2 H++ 2 e−SnO(s) + H2O −0.09SnO(aq) + 6 H++ 6 e−W(s) + 3 H2O −0.09 [2]WOP(白磷) + 3 H++ 3 e−PH3(g) −0.063 [5]Fe3++ 3 e−Fe(s) −0.04 [15] HCOOH(aq) + 2 H++ 2 e−HCHO(aq) + H2O −0.032 H++ 2 e−H2(g)0.00 ≡0 AgBr(s) + e−Ag(s) + Br−+0.07133[14]E°(V)[注半反应来源1]O62−+ 2 e−2 S2O32−+0.08S4FeO4(s) + 8 H++ 8 e−3 Fe(s) + 4 H2O +0.085 [8]N(g) + 2 H2O + 6H++ 6 e−2 NH4OH(aq) +0.092O + 2 e−Hg(l) + 2 OH−+0.0977HgO(s) + H)42++e−Cu(NH3)2++ 2 NH3+0.10 [2]Cu(NH)63++e−Ru(NH3)62++0.10 [7]Ru(NHH4(aq) + 4 H2O + 2 e−2 NH4++ 4 OH−+0.11 [6]NMoO4(aq) + 6 H++ 6 e−Mo(s) + 4 H2O +0.11HGe4++ 4 e−Ge(s) +0.12半反应E ° (V)[注1] 来源C(s ) + 4 H+ + 4 e − CH 4(g ) +0.13 [2] HCHO(aq ) + 2 H+ + 2 e − CH 3OH(aq ) +0.13 S(s ) + 2 H+ + 2 e − H 2S(g ) +0.14 Sn4+ + 2 e − Sn 2+ +0.15 Cu2+ + e − Cu + +0.159 [2] HSO4− + 3 H + + 2 e − SO 2(aq ) + 2 H 2O +0.16 UO22+ + e − UO 2+ +0.163 [7] SO42− + 4 H + + 2 e − SO 2(aq ) + 2 H 2O +0.17 TiO2+ + 2 H + + e − Ti 3+ + H 2O +0.19E°(V)[注半反应来源1]Bi3++ 2e−Bi++0.2SbO++ 2 H++ 3 e−Sb(s) + H2O +0.20AgCl(s) + e−Ag(s) + Cl−+0.22233[14] AsO3(aq) + 3 H++ 3 e−As(s) + 3 H2O +0.24HGeO(s) + 2 H++ 2 e−Ge(s) + H2O +0.26+ 4 H++e−U4++ 2 H2O +0.273 [7]UO+e−2 At-+0.3 [11]AtRe3++ 3 e−Re(s) +0.300Bi3++ 3 e−Bi(s) +0.32E°(V)[注半反应来源1]VO2++ 2 H++e−V3++ H2O +0.34Cu2++ 2 e−Cu(s) +0.340 [2] ]3−+e−[Fe(CN)6]4−+0.36[Fe(CN)Tc2++ 2 e−Tc(s) +0.40 [11](g) + 2 H2O + 4 e−4 OH−(aq) +0.40 [9]OHMoO4+ 6 H++ 3 e−Mo3++ 2 H2O +0.43Ru2++ 2 e−Ru(s) +0.455 [11]Bi++e−Bi(s) +0.50CHOH(aq) + 2 H++ 2 e−CH4(g) + H2O +0.50半反应E ° (V)[注1] 来源SO2(aq ) + 4 H + + 4 e − S(s ) + 2 H 2O +0.50 Cu+ + e − Cu(s ) +0.520 [2] CO(g ) + 2 H+ + 2 e − C(s ) + H 2O +0.52 I3− + 2 e − 3 I − +0.53 [9] I2(s ) + 2 e − 2 I − +0.54 [9][AuI4]− + 3 e − Au(s ) + 4 I − +0.56 H3AsO 4(aq ) + 2 H + + 2 e − H 3AsO 3(aq ) + H 2O +0.56[AuI2]− + e − Au(s ) + 2 I − +0.58 MnO4− + 2 H 2O + 3 e − MnO 2(s ) + 4 OH − +0.59半反应E°(V)[注1]来源Rh++e−Rh(s) +0.600 [11]S2O32 −+ 6 H++ 4 e−2 S(s) + 3 H2O +0.60Fc++ e−Fc(s) +0.641 [18]+ e−Ag +−+0.643 [11]H2MoO4(aq) + 2 H++ 2 e−MoO2(s) + 2 H2O +0.65+ 2 H++ 2 e−+0.6992 [14] O2(g) + 2 H++ 2 e−H2O2(aq) +0.70Tl3++ 3 e−Tl(s) +0.72半反应E ° (V)[注1] 来源PtCl62− + 2 e − PtCl 42− + 2 Cl − +0.726 [7] H2SeO 3(aq ) + 4 H + + 4 e − Se(s ) + 3 H 2O +0.74 Rh3+ + 3 e − Rh(s ) +0.758 [11] PtCl42− + 2 e − Pt(s ) + 4 Cl − +0.758 [7] Fe3+ + e − Fe 2+ +0.77 Ag+ + e − Ag(s ) +0.7996 [5] Hg22+ + 2 e − 2 Hg(l ) +0.80 NO3−(aq ) + 2 H + + e − NO 2(g ) + H 2O +0.80 FeO42− + 5 H 2O + 6 e − Fe 2O 3(s ) + 10 OH − +0.81 [15]半反应E ° (V)[注1] 来源H2(g ) + 2 OH − 2 H 2O + 2 e − +0.828 [19][AuBr4]− + 3 e − Au(s ) + 4 Br − +0.85 Hg2+ + 2 e − Hg(l ) +0.85 MnO4− + H + + e − HMnO 4− +0.90 2 Hg2+ + 2 e − Hg 22+ +0.91 [2] Pd2+ + 2 e − Pd(s ) +0.915 [7][AuCl4]− + 3 e − Au(s ) + 4 Cl − +0.93 MnO2(s ) + 4 H + + e − Mn 3+ + 2 H 2O +0.95[AuBr2]− + e − Au(s ) + 2 Br − +0.96半反应E ° (V)[注1] 来源[HXeO6]3− + 2 H 2O + 2 e − +[HXeO 4]− + 4 OH − +0.99 [20]HNO 2 + H + + e - = NO (g) + H2O +0.996 H6TeO 6(aq ) + 2 H + + 2 e − TeO 2(s ) + 4 H 2O +1.02 [21] Br2(l ) + 2 e − 2 Br − +1.07 Br2(aq ) + 2 e − 2 Br − +1.09 [9] NO 2(g) + H + + e - = HNO 2 +1.093 IO3− + 5 H + + 4 e − HIO(aq ) + 2 H 2O +1.13[AuCl2]− + e − Au(s ) + 2 Cl − +1.15半反应E ° (V)[注1] 来源HSeO4− + 3 H + + 2 e − H 2SeO 3(aq ) + H 2O +1.15 Ir3+ + 3 e − Ir(s ) +1.156 [11] Ag2O(s ) + 2 H + + 2 e − 2 Ag(s ) + H 2O +1.17 ClO3− + 2 H + + e − ClO 2(g ) + H 2O +1.18[HXeO6]3− + 5 H 2O + 8 e − Xe(g ) + 11 OH − +1.18 [20] Pt2+ + 2 e − Pt(s ) +1.188 [7] ClO2(g ) + H + + e − HClO 2(aq ) +1.19 2 IO3− + 12 H + + 10 e − I 2(s ) + 6 H 2O +1.20 ClO4− + 2 H + + 2 e − ClO 3− + H 2O +1.20E°(V)[注半反应来源1](g) + 4 H++ 4 e−2 H2O+1.229 [9]O(s) + 4 H++ 2 e−Mn2++ 2H2O +1.23MnO[HXeO]−+ 3 H2O + 6 e−Xe(g) + 7 OH−+1.24 [20]Tl3++ 2 e−Tl++1.25O72 −+ 14 H++ 6 e−2 Cr3++ 7 H2O +1.33Cr(g) + 2 e−2 Cl−+1.36 [9]Cl(s) + 4 H++e−Co3++ 2 H2O +1.42CoO2 NHOH++ H++ 2 e−N2H5++ 2 H2O +1.42 [6]2 HIO(aq) + 2 H++ 2 e−I2(s) + 2 H2O +1.44半反应E ° (V)[注1] 来源Ce4+ + e − Ce 3+ +1.44 BrO3− + 5 H + + 4 e − HBrO(aq ) + 2 H 2O +1.45 β-PbO2(s ) + 4 H + + 2 e − Pb 2+ + 2 H 2O +1.460 [2] α-PbO2(s ) + 4 H + + 2 e − Pb 2+ + 2 H 2O +1.468 [2] 2 BrO3− + 12 H + + 10 e − Br 2(l ) + 6 H 2O +1.48 2ClO3− + 12 H + + 10 e − Cl 2(g ) + 6 H 2O +1.49 HO2 + H + + e − H 2O 2 +1.495 [11] MnO4− + 8 H + + 5 e − Mn 2+ + 4 H 2O +1.51 HO2• + H + + e − H 2O 2(aq ) +1.51半反应E ° (V)[注1] 来源Au3+ + 3 e − Au(s ) +1.52 NiO2(s ) + 4 H + + 2 e − Ni 2+ + 2 OH − +1.59 2 HClO(aq ) + 2 H+ + 2 e − Cl 2(g ) + 2 H 2O +1.63 Ag2O 3(s ) + 6 H + + 4 e − 2 Ag + + 3 H 2O +1.67 HClO2(aq ) + 2 H + + 2 e − HClO(aq ) + H 2O +1.67 Pb4+ + 2 e − Pb 2+ +1.69 [2] MnO4− + 4 H + + 3 e − MnO 2(s ) + 2 H 2O +1.70 AgO(s ) + 2 H+ + e − Ag + + H 2O +1.77半反应E ° (V)[注1] 来源 H2O 2(aq ) + 2 H + + 2 e − 2 H 2O +1.776 Co3+ + e − Co 2+ +1.82 Au+ + e − Au(s ) +1.83 [2] BrO4− + 2 H + + 2 e − BrO 3− + H 2O +1.85 Ag2+ + e − Ag + +1.98 [2] S2O 82− + 2 e − 2 SO 42− +2.07 O3(g ) + 2 H + + 2 e − O 2(g ) + H 2O +2.075 [7] HMnO4− + 3 H + + 2 e − MnO 2(s ) + 2 H 2O +2.09 XeO3(aq ) + 6 H + + 6 e − Xe(g ) + 3 H 2O +2.12 [20]半反应E ° (V)[注1] 来源H4XeO 6(aq ) + 8 H + + 8 e − Xe(g ) + 6 H 2O +2.18 [20] FeO42− + 3 e − + 8 H + Fe 3+ + 4 H 2O +2.20 [22] XeF2(aq ) + 2 H + + 2 e − Xe(g ) + 2HF(aq ) +2.32 [20] H4XeO 6(aq ) + 2 H + + 2 e − XeO 3(aq ) + H 2O +2.42 [20] F2(g ) + 2 e − 2 F − +2.87 [2][9] F2(g ) + 2 H + + 2 e − 2 HF(aq ) +3.05 [2] Tb4+ + e − Tb 3+ +3.05 [11]Welcome To Download !!!欢迎您的下载,资料仅供参考!。
最全最实用的电极电势表

最全最实用的电极电势表新年快到了想写一篇化学方面的文章作为总结吧但是要查很多资料事情也多拖到现在。
其实这个电极电势标准电极电势表我读化学的时候就比较感兴趣因为可以用它来判断元素和化合物在标准状况下氧化性还原性的强弱当时有些地方是不懂的比如gs都是什么意思那个氟的标准电极电势是怎么来的老师没有多讲只是让我们记住常用的氧化剂还原剂的电极电势数值就行了。
电极电势表许多化学书包括网上有很多的当然数据来源不同数值有差别也是正常的不能说谁对谁错。
我自己动手做个电极电势表我的目的是实用元素周期表118个元素化合物更是成千上万我们不可能一个一个去记住知道常见的即可有些数据化学家那里也是没有的。
另外既然标题有这个最字就要满足学生以及化学爱好者的愿望比如目前最强的氧化剂是什么最强的还原剂是什么最实用的氧化剂是什么等等对于有异议的给予说明。
我列出的电极电势表将去除不常用的氧化剂和还原剂对于零度以下不能存在的不在列出比如二氟化二氧虽然它在零下100度就有极强的氧化能力如:在零下100度将钚迅速氧化到6价而氟三氟化氯常温甚至加热也不能将钚氧化到6价氟只能将钚氧化到4价6价需要700摄氏度用强紫外线照射才能发生反应将氙氧化到6价氟需要加压加热。
但它在零下95度就会显著分解零下57度迅速分解完。
大家只要知道它即使在极低温下氧化性也比氟强即可关于自由基只列出羟基自由基OH-其他象OFXeFKrF自由基这些都属于很少见瞬间存在的东西这几个自由基的氧化性以KrF 最强XeF最弱我看到有些化学书籍上说XeF自由基的电极电势数值为3.4这个数值应该是估计值XeF在普通条件下是不存在的只是在加热或者强光照射合成二氟化氙四氟化氙六氟化氙的时候瞬间存在。
羟基自由基这个是常见的自由基水溶液里就有。
如果把XeF列上那么氦离子也可以列上。
大家知道α粒子实际就是氦原子失去两个电子的原子核就是He2在做物理实验大气层的电离层都常常碰到它不算是罕见的吧。
2020高中化学图解法讨论电极电势

例: E Ө B / V
0.88 O2 ———— HO2- ———— OH-
0.40
( 1 )计算说明 H2O2 在酸性介质中氧化性的强弱, 在碱性介质中还原性的强弱。
( 2 )计算说明 H2O2 在酸性介质中和碱性介质中的 稳定性的强弱。
( 3 )计算 H2O 的离子积常数 Kw 。 ( 0.86 10-14 )
从碘元素的碱式图中,可以进一步看出在 pH = 14 的条件下,将电离出两个氢离子,以 H3IO62- 形式存在。
2 电对的电极电势
例如,下图是酸性体系中碘元素电势图的一部分:
+ 1.14 V
+ 1.45 V
IO3 - ——— HIO ——— I2
可以从图中直接得到 IO3-/ HIO 和 HIO / I2 两个 已知电对的电极电势。现在的问题是,如何求得不相邻的
二 自由能 — 氧化数图
1 自由能 - 氧化数图的做法
在某 pH 下某种元素作图。横坐标为各种氧化数;
纵坐标为由单质分别氧化或还原成各种氧化态时的自由能
rG
Ө m
。 经常用到的是
pH =
0
或
pH =
14 ,它们
对应的分别是 [ H+ ] = 1 moldm-3 和
[OH-] = 1 moldm-3 ,正对应于在酸介质和碱介质中讨
电对 H3IO62 - / I2 EӨ = 0.34 V H3IO62-+ 3 H2O + 7e -=1/2 I2 + 9OH - (1)
rGӨm (1) = - 230 kJ·mol-1
2) 横坐标,氧化数 = 5 ,
电对 IO3 - / I2
EӨ = 0.20 V
IO3 -+3 H2O + 5e-=1/2 I2 + 6 OH -
电极电势及元素电势图在元素化学教学中的应用

电极电势及元素电势图在元素化学教学中的应用
周期表中的元素都有两种或两种以上的价态。
讲述其化学性质时,就要涉及到它们的氧化性、还原性等,此时利用元素电势图,既直观又系统,效果好。
氧化还原反应是一类很普遍而且也是比较复杂的化学反应,它在生产实践中具有十分广泛的应用。
在中学教学中也占有重要的地位.然而这部分内容在中学教学中亦会遇到一些不大容易解释的问题。
如用什么标准判断氧化剂和还原剂的强弱,用什么标准去判断氧化还原反应进行的方向以及能否歧化等问题.
当某种元素具有多种氧化态时,可以把该元素的各种氧化态从高到低排列起来,每两者之间用一条短直线连接,并将相应电对的标准电极电势写在短线上,这样构成的表明元素各氧化态之间标准电极电势关系的图,称为元素的标准电极电势图,简称元素电势图。
元素电势图及其应用一种元素的不同氧化数物种按照其氧化数由低到高从左到右的顺序排成图式,并在两种氧化数物种之间标出相应的标准电极电势值。
判断元素各种氧化数的相对稳定性(判断是否能发生岐化)对某一元素,其不同氧化数的稳定性主要取决于相邻电对的标准电极电势值。
求未知电对的电极电势利用Gibbs函数变化的加合性,可以从几个相邻电对的已知电极电势求算任一未知的电对的电极电势。
判断元素处于不同氧化数时的氧化还原能力根据某一电对的电
极电势越大,则其氧化型的氧化能力越强,相应的还原型的还原性越弱的原理。
元素电势图是大—《无机化学》重要教学内容,我们在教学中大胆尝试,以辩证法为指导,遵循科学性,知识性,逻辑性和实践性的教学准则,推进了教学改革,收到了明显的教学效果。
电极电势的应用(课堂PPT)

(
M
n
O4/
M
n2
)
0
.
05 5
9
2lgx8
(Cl2
/
Cl
)
0.0592 . 2
lg
1 x2
x≥0.1mol/L25
3. 氧化还原反应进行程度的衡量
(1)电动势与K的关系
∵ ΔG =ΔG + RyTlnQ
当ΔG =0 时Q= K 反应达平衡 有-ΔrGm y = RTlnK y 和 nFE y= RT lnK y
φ /V 1.51 > 1.3583 > 0.771
氧化能力:KMnO4 > Cl2 > FeCl3
.
18
判断氧化剂、还原剂的相对强弱
φ 越大,电对中氧化型物质的氧化能力越强 还原型物质的还原能力越弱
φ 越小,电对中还原型物质的还原能力越强 氧化型物质的氧化能力越弱
例3:试比较 SnCl2、Zn、H2S 在酸性 介质中的还原能力
Fe3+/Fe2+ 0.771
若有一种氧化剂,如KMnO4,Mno
4
/
M
n2
1.51V
反应顺序:I-- Fe2+ -Br-
若有一种还原剂,如Zn,(Zn2+/Zn)=-
反应顺序:Br.2 - F0e.73+61-8IV2
20
*在原电池中的应用 ① 判断正负极
正极:发生还原(+e-)反应,
∴是 大的电对;
例: 当pH=7,其他离子浓度皆为1.0
mol.dm-3时,下述反应能否自发进行:
2MnO4-+16H++10Cl-
元素电极电势图及其应用

φ0 B
BrO3-
?
0.5B2 rO-
0.45
Br2
1.09
Br-
?
解 :φ 0(BrO3-/Br-)= =
5φ 0(BrO3-/Br2)
5×0.52
1.069
6
φ 0(Br2/Br-)
= 0.62V
φ 0(BrO3-/BrO-)=
5φ0(BrO3-/Br2)
4
φ(0BrO/Br2)
. =
5 ×0.52
B → A+C
右 < 左 则会发生反岐化反应
A+C→B
二、元素电极电势图的应用
Cu+能否发生歧化反 应?
φ0 A
Cu2+ 0.153
C0.3u3+7 0.521
Cu
故Cu+能发生歧化反应。
二、元素电极电势图的应用
(3)求算某电对未知的标准电极电势
通过已知相邻的标准电极电势,可以计算另一个电对的标准电极电势
0.1 Mn(OH)2 -1.55 Mn
0.59
-0.05
在酸性介质中,MnO4-, MnO42- ,MnO2,Mn3+,都是较强的氧化剂。
MnO42-的值最大,是最强的氧化剂,Mn的值最小,是最强的还原剂。
二、元素电极电势图的应用
(2) 判断元素某氧化态能否发生歧化反应
A
左
B
右
C
右 > 左 氧化态B会发生岐化反应
Cu |
A表示酸性条件下的元素电势图, B表示碱性条件下元素电势图。
二、元素电极电势图的应用
(1)比较元素各氧化态的氧化还原能力
A/V
1.51
MnO4- 0.56 MnO42- 2.26 MnO2 0.95 Mn3+ 1.51 Mn2+ -1.18 Mn
课件:电极电势

2
• (ii) 电极电势是如何产生的---双电层模型 • 金属表面的两过程:
• 金属溶解, 阳离子进入溶液, 电子留在金 属表面, 形成金属表面带负电荷、邻近溶 液带正电荷的“双电层”,金属还原性强、 Mn+(aq)浓度小,这种倾向大
它电极的电极电势的。 H2(g) (1 p )
(i)〔标准氢电极〕
• Pt|H2(100 kPa)|H+(1 mol·dm-3),
Pt H+(aq) (a = 1)
H2气泡
• IUPAC 规 定 , 以 标 准 氢 电 极 (Pt),
H2(1pө)H+(1mol·dm-3) 的 电 势 作 为 电 极 电 势的相对标准,规定其电极电势φө =0 V
20
• 298 K, [H+] = 10.0 mol·dm-3时, 电对Cr2O72- / Cr3+的电极电势
[解]电极反应:
Cr2O72- + 14 H+ + 6 e- = 2 Cr3+ + 7 H2O
E (Cr2O72-
/
Cr3 )
E O (Cr2O72-
/
Cr3 )
0.059 6
V
lg
(Cr2O72- )(H )14 (Cr3 )2
φө (Zn2+/Zn)=-0.76 18 V,
当Zn2+浓度c=0.001 M时,
φ(Zn2+/Zn)=φө(Zn2+/Zn)+(0.05917/2)×lgc
= -0.76 18 - (0.05917/2)×3=-0.8506 V
标准电极电势表(全)
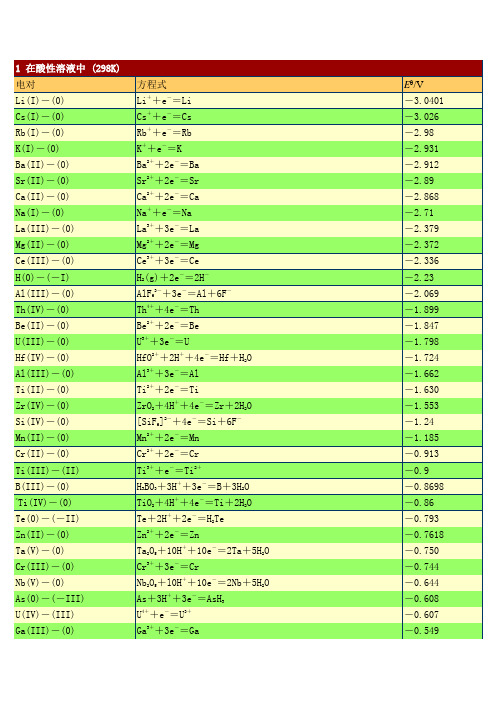
1电对方程式E /VLi(I)-(0) Li++e-=Li -3.0401 Cs(I)-(0) Cs++e-=Cs -3.026 Rb(I)-(0) Rb++e-=Rb -2.98 K(I)-(0) K++e-=K -2.931 Ba(II)-(0) Ba2++2e-=Ba -2.912 Sr(II)-(0) Sr2++2e-=Sr -2.89 Ca(II)-(0) Ca2++2e-=Ca -2.868 Na(I)-(0) Na++e-=Na -2.71 La(III)-(0) La3++3e-=La -2.379 Mg(II)-(0) Mg2++2e-=Mg -2.372 Ce(III)-(0) Ce3++3e-=Ce -2.336 H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069 Th(IV)-(0) Th4++4e-=Th -1.899 Be(II)-(0) Be2++2e-=Be -1.847 U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724 Al(III)-(0) Al3++3e-=Al -1.662 Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24 Mn(II)-(0) Mn2++2e-=Mn -1.185 Cr(II)-(0) Cr2++2e-=Cr -0.913 Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793 Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644As(0)-(-III) As+3H++3e-=AsH3-0.608 U(IV)-(III) U4++e-=U3+-0.607 Ga(III)-(0) Ga3++3e-=Ga -0.549P(I)-(0) H3PO2+H++e-=P+2H2O -0.508P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499*C(IV)-(III) 2CO2+2H++2e-=H2C2O4-0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.407 Cd(II)-(0) Cd2++2e-=Cd -0.4030 Se(0)-(-II) Se+2H++2e-=H2Se(aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0.365 Eu(III)-(II) Eu3++e-=Eu2+-0.36Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382 Tl(I)-(0) Tl++e-=Tl -0.336 Co(II)-(0) Co2++2e-=Co -0.28P(V)-(III) H3PO4+2H++2e-=H3PO3+H2O -0.276Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675 Ni (II)-(0) Ni2++2e-=Ni -0.257 V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=Ge+3H2O -0.182Ag(I)-(0) AgI+e-=Ag+I--0.15224 Sn(II)-(0) Sn2++2e-=Sn -0.1375 Pb(II)-(0) Pb2++2e-=Pb -0.1262*C(IV)-(II) CO2(g)+2H++2e-=CO+H2O -0.12P(0)-(-III) P(white)+3H++3e-=PH3(g) -0.063Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037 H(I)-(0) 2H++2e-=H20.0000 Ag(I)-(0) AgBr+e-=Ag+Br-0.07133S(II.V)-(II) S4O62-+2e-=2S2O32-0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142 Sn(IV)-(II) Sn4++2e-=Sn2+0.151Sb(III)-(0) Sb2O3+6H++6e-=2Sb+3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153 Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583S(VI)-(IV) SO42-+4H++2e-=H2SO3+H2O 0.172Sb(III)-(0) SbO++2H++3e-=Sb+H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22233As(III)-(0) HAsO2+3H++3e-=As+2H2O 0.248Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl-(饱和KCl) 0.26808Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327C(IV)-(III) 2HCNO+2H++2e-=(CN)2+2H2O 0.330V(IV)-(III) VO2++2H++e-=V3++H2O 0.337 Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=Re+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+CrO42-0.4470S(IV)-(0) H2SO3+4H++4e-=S+3H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=HAsO2+2H2O 0.560Sb(V)-(III) Sb2O5+6H++4e-=2SbO++3H2O 0.581Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O(0)-(-I) O2+2H++2e-=H2O20.695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl-0.755*Se(IV)-(0) H2SeO3+4H++4e-=Se+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+0.771 Hg(I)-(0) Hg22++2e-=2Hg 0.7973 Ag(I)-(0) Ag++e-=Ag 0.7996Os(VIII)-(0) OsO4+8H++8e-=Os+4H2O 0.8N(V)-(IV) 2NO3-+4H++2e-=N2O4+2H2O 0.803Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N2O2+2H2O 0.86Hg(II)-(I) 2Hg2++2e-=Hg22+0.920N(V)-(III) NO3-+3H++2e-=HNO2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO2++3H2O 1.00Au(III)-(0) [AuCl4]-+3e-=Au+4Cl- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=TeO2+4H2O 1.02N(IV)-(II) N2O4+4H++4e-=2NO+2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HNO21.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1.0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl(V)-(IV) ClO3-+2H++e-=ClO2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=ClO3-+H2O 1.189I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HClO2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO21.277N(III)-(I) 2HNO2+4H++4e-=N2O+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e-=2Cr3++7H2O 1.33Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35827Cl(VII)-(-I) ClO4-+8H++8e-=Cl-+4H2O 1.389Cl(VII)-(0) ClO4-+8H++7e-=1/2Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br-+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl-+3H2O 1.451Pb(IV)-(II) PbO2+4H++2e-=Pb2++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2Cl2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2Br2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.5415Cl(III)-(-I) HClO2+3H++4e-=Cl-+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(aq)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO+H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.6913Au(I)-(0) Au++e-=Au 1.692 Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2O 1.766O(-I)-(-II) H2O2+2H++2e-=2H2O 1.776Co(III)-(II) Co3++e-=Co2+(2mol·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H2O 2.076O(II)-(-II) F2O+2H++4e-=H2O+2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=Fe3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532电对方程式E /VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99La(III)-(0) La(OH)3+3e-=La+3OH--2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36Al(III)-(0) H AlO-+H O+3e-=Al+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3-1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3-0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34 *Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13*Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3-0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH30.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607。
四原电池电极电势PPT课件

教学要求: 了解电极电势的产生原因,正确书写电极
反应,电池反应及原电池符号; 用能斯特方程作有关计算; 应用电极电势分析氧化还原反应中的问
题; 了解电解基本原理,能正确判电解产物; 了解金属腐蚀及防护原理.
-
1
复习氧化还原反应
-
2
主要内容
4.1原电池及其电动势 4.2电极电势及其应用 4.3电解 4.4金属腐蚀及其防止 4.5化学电源
因此: 平衡常数Kθ只与Eθ有关,而与浓度和E无关。 n—是指反应得失电子数,与方程书写有关.
-
26
计算举例
电池:(-)Zn∣Zn2+(c=?)‖Ni2+(1mol/l)∣Ni(+) 25℃时测得原电池电动势为0.54V,计算原
电池中Zn2+离子浓度?并求电池反应的△rGm ?
(已知φθ(Zn2+/Zn)= - 0.7621V, φθ(Ni2+/ Ni)= - 0.2363V)
Fe3+(aq)+e= Fe2+(aq) ;
Sn2+(aq)= Sn4+(aq)+2e
上述电池的电池符号为:
(-)C∣Sn4+(c1),Sn2+(c2)‖Fe3+(c3),Fe2+(c4)∣C(+) 例:氢电极作为负极,甘汞电极作为正极。
组成原电池,电池符号如下:
(-)Pt∣H2(p)∣H+(c1)‖Cl- (c2)∣Hg2Cl2∣Hg∣Pt(+)
用已知电极组成原电池,计算电动势。 方法1:①能斯特方程计算两个电极的电极电势值φ ;
②φ值大的是正极, φ值小的是负极; ③电动势E= φ正- φ负
氧化还原反应之元素标准电极电势图及其应用课件

谢谢
THANKS
05 总结与展望
CHAPTER
氧化还原反应的重要性和应用前景
总结:氧化还原反应是化学反应中的重要类 型,涉及到电子的转移过程。元素标准电极 电势图是研究氧化还原反应的重要工具,可 以预测反应的可能性及方向。在能源、环境 、生物和材料科学等多个领域,氧化还原反 应都发挥着关键作用。
在能源领域,氧化还原反应可用于燃料电池 、太阳能电池等新能源的开发和利用。在环 境科学中,氧化还原反应有助于处理污染物 ,实现环境净化。在生物体内,氧化还原反 应参与能量代谢、物质合成等生命活动,对 维持生物体的正常生理功能至关重要。此外 ,在材料科学中,通过控制氧化还原反应可
电极电势图的绘制
选取标准氢电极作为参考点, 规定其电势为0。
选取其他电极,测量其在标准 压力下的电极电势,并绘制成 图。
标明各电极的氧化型和还原型 物质。
电极电势图的解读
根据电极电势的大小判断氧化还原反 应的方向。
电极电势图可以用来预测不同物质之 间的反应可能性。
根据电势差计算电动势,进一步计算 氧化还原反应的平衡常数和反应速率 。
04 氧化还原反应的实际应用
CHAPTER
金属的冶炼和提纯
金属冶炼
利用氧化还原反应将金属元素从矿石 中还原出来,如炼铁、炼铜等。
金属提纯
通过控制氧化还原反应条件,除去金 属中的杂质,提高金属的纯度。
有机合成中的氧化还原反应
氧化反应
通过氧化还原反应将有机物中的氢、 碳等元素氧化成更高级的化合物,如 醇氧化成醛、醛氧化成羧酸等。
还原反应
通过还原反应将有机物中的氧、氮等 元素还原成更低级的化合物,如醛还 原成醇、羧酸还原成酮等。
环境保护中的氧化还原反应
大学化学课件:电极电势的应用

氧化
Ag(s)+H+(aq)+I-(aq)=AgI(s)+1/2H2(g)
第五章 氧化还原反应与电化学
5.4 电极电势的应用
5.4.1 判断氧化剂和还原剂的相对强弱 标准电极电势的代数值愈大,水溶液中电
对的氧化型物质的氧化能力越强;电对中的还 原型物质的还原能力就越弱。
标准电极电势的代数值愈小,水溶液中电 对的还原型物质的还原能力越强;电对中的氧 化型物质的氧化能力就越弱。
反应到达平衡时,E+=E-
E O
0.05916 n1
lg
c(Red1 ) c(Ox1 )
=
E O
0.05916 n2
lg
c(Red2 ) c(Ox2 )
lg[( cRed1 )n2( cOx2 )n1 ] (EO EO )n1n2
cOx 1
cRed2
0.05916
zE O lg K O
0.05916
1.034V
5.4.2 判断氧化还原反应的方向
氧化还原反应之所以能够自发进行时由于 组成氧化还原的两个电对中,电极电势代数值 较大的电对中氧化性物质具有较强的得电子倾 向,而电极电势代数值较小的电对中还原型物 质具有较强的供电子倾向。
Cu2++Zn=Cu+Zn2+
无机化学 4.4元素的标准电极电势图及其应用

2Cu+ → Cu2+ + Cu 歧化反应
元素处于中间氧化数时,它一部分向高的氧 化数变化(被氧化),另一部分向低的氧化数 变化(被还原),这类反应称为歧化反应。
应用 :2 判断能否发生歧化反应
EA/V
Fe3+ 0.77 Fe2+ -0.44 Fe
E (Fe2+/Fe)=-0.44V < E (Fe3+/Fe2+)=0.77V
E=
z1E1+ z2 E2+ z3 E 3 z
应用 :1 计算电对的标准电极电势
例1
E=
z1E + z2 E + z3 E z
EB/V BrO-3
? z1
BrO-
0.61 z
? z2
Br2
1.065 z3
Br-
0.76
z4
E
(BrO-/Br2)= z4E
(BrO-/Br-)
z2
-z3 E
(Br2/Br-)
mol·L-1Mg2+的溶液与 100 mL 0.080 mol·L-1
NH3·H2O溶液混合, (1)能否生成Sn(OH)2和 Mg(OH)2沉淀, 或能否将两种金属离子分离 完全?(2)若要使这两种离子分离完全, 溶液
pH 值 应 控 制 在 什 么 范 围 ? (Kb(NH3·H2O)= 1.710-5, Ksp(Sn(OH)2)=5.510-28, Ksp(Mg(OH)2) =5.610-12)
电 MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
极 反
AgCl + e- → Ag + Cl-
拉蒂迈尔图(标准电极电势)

Latimer diagram
由于正表中空间的限制,每个元素只列出了 一个重要的还原电位反应及其值。明显的,标准 电极电势是常用的重要用表之一。常用表格式的 数据在一般的手册和教科书中均可查到。为了大 家使用方便和教学中使用,本块给出了图形表示 中 最 简 单 的 一 种 ─ 拉 蒂 麦 尔 图 (Latimer diagram) ,并按照周期表上 s、p、d、f 4个区的 顺序安排,括号中表示不确定的数据。
— 图是将同一元素不同氧化态物种的标准电极 电势相互关联起来的一种表达系统, 因而又叫元素电势图。 以酸性溶液(pH=0)中氯元素为例说明构筑拉蒂麦尔图的 方法:
ClO +7
Cl2 Cl — 0 -1 各物种按氧化数降低的方向自左至右顺序排列(有些教材采 用相反的方向,使用中必须特别谨慎);元素的氧化数标在 各物种的下方(有时也标在上方);横线上方的数字表示两 物种构成的电对的Eθ(Ox/Red)值。
总反应式的标准电势为: Eθ池 = (+0.52 V)-(+0.16 V) = +0.36 V
则反应的平衡常数可计算得: Kθ =1.3×106 算得的Eθ池为正值表明反应可以自发进行, 平衡常数说明 反应几乎能进行到底。 由此可得出一条一般性规律: 如果拉蒂麦尔图中物种左边的标准电极电势低于右边 的标准电极电势(即Eθ左 < Eθ右),该物种则可歧化为与 其相邻的物种。前面提及某些教科书按氧化数升高方向自 左至右构成拉蒂麦尔图,这种情况下学生应该能够知道如 何判断歧化反应的自发性。
拉蒂麦尔图还可用来判断歧化过程(disproportionation) 发生的可能性。 例如Cu+在溶液中发生的歧化反应: 2Cu+(aq) Cu2+(aq) + Cu(s) 或 Cu+(aq) + Cu+(aq) Cu2+(aq) + Cu(s) 反应中一个Cu+氧化数升高,另一个Cu+氧化数降低,与之 有关的两个半反应和Eθ(Ox/Red)分别为: Cu2+(aq) + e Cu+(aq) + e Cu+(aq) Cu(s) Eθ = +0.16 V Eθ = +0.52 V
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8 4.4与电极电势有关的图表及其应用
4.4.1元素电势图
按元素氧化数从高到低的顺序把某元素各物种排列起来,在构成电对的两物种之间用一条横线或折线连接,在横线上标明该电对的标准电极电势值,就构成了元素电势图,也叫拉特默尔图(Latimer diagram )。
可以根据需要选择部分物种构成的元素电势图。
A ϕ图:酸性介质中(pH=0)
B ϕ图:碱性介质中(pH=14)
以氯的
A ϕ图为例加以说明。
信息:电对、电极反应(注意介质)、电极电势
如:相连两物种电对的半反应和标准电极电势是:
ClO -4 1.189 ClO -
3:
ClO -
4+2H ++2e -ClO -3+H 2O 189.134/ClO ClO =--
ϕV
Cl 2 1. 35827 Cl -:
Cl 2+2e -2Cl - 1.35827/Cl Cl 2=-
ϕV
ClO -
4 1. 39 Cl 2:
ClO -
4+8H ++7e -21Cl 2+4H 2O 39.124/Cl ClO =-
ϕV。
