有机物还原剂
常见氧化剂还原剂和催化剂的应用
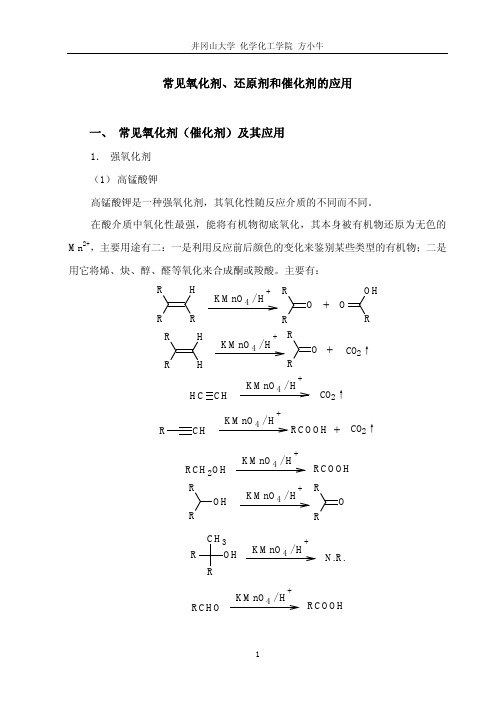
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。
基础有机化学表解(最详细的有机化学知识内容)

.基础有机化学表解师学院化学与材料科学学院有机教研室编著:韩雪峰有机化合物还原方法(Ⅰ)还原剂作用物催化氢化(解)负氢(H-)还原剂金属还原剂特殊还原法H2/Ni,Pt,Pd LiAlH4四氢铝锂NaBH4硼氢化钠M+H+Zn+HClNa+EtOH烯H HC C(顺)炔C C-CH2-CH2-(顺式)(反式)芳烃EtNaOH+N OHH3Na Et脂环卤烃R CH2X R-CH3R-CH33。
Ar-X不反应R-CH3Ar-X不反应R-CH3其他还原剂:Mg-Hg/H2O、HI醛R C H=O RCH2OH(1。
醇)RCH2OH(1。
醇)RCH2OH(1。
醇)RCH2OH(1。
醇)(可缩合)R C H CH3R=O(三种方法)C=C酮RC=OR H RCORH(2。
醇)H RCORH(2。
醇)H RCORH(2。
醇)H RCORH(2。
醇)H RCORH(2。
醇)有机化合物还原方法(Ⅱ)还原剂作用物H2/Ni,Pt,Pd 1.LiAlH4/2. H3+O1.NaBH4/2.H3+OFe,Zn,Sn+HClNa+EtOH 特殊还原法RCH2OHRCH2OH+ R‘OHRCH2OH+ R‘OHRCH2OH+R‘OH羧酸可转化为酯后还原(RCHO)RCH2OHRCH2OH RCH2OHRCH2NH2RCH2NH2RCH2NH2R C N RCH2NH2(RCHO)RCH2NH2RCH2NH2RCH2NH2控制等当量可停止于RCHO阶段R N CHRNHCH3RCH=N-OH RCH2NH2RCH2NH2RCH2NH2RCH2NH2(Ar)RNO2RNH2RNH2ArN=NArArNHNHAr(Ar)RNH2RNH2R COXH2 Pd_BaSO4RCHO喹啉Ar-NO 21.二硝基物的部分还原,还原剂:(NH 4)2S ,NH 4HS ,NH 4HS X ,Na 2S/H 2O ,SnCl 2/HCl 2. SnCl 2/HCl 优先还原R 邻位的-NO 2,不还原-CHO , 3. NH 4HS 优先还原R 对位的-NO 2ArN 2X N 2ClHNNH 2(H)还原剂:Na 2SO 3,SnCl 2/HCl ,Zn/HAc有机化合物氧化方法各类有机物的鉴别备注O ()==O OO+OO ====白△室温下□加热后 取代碘化钠丙酮试法(S N 2) 1°RCl.RBr 快、 2°3°慢、 CHCl 3、RCH=CHX 、苯卤不反应HIO 4/AgNO 3 AgIO 3(白色沉淀) =OH N ==OH H O H H 2O O O O 正反应Ca(OH)2鲜红色 多元醇正反应。
精细有机合成技术:水合肼还原

感谢观看
可以发生催化还原,能使硝基和亚硝基化合物还原成相应 的氨基化合物,而对硝基化合物中所含羰基、氰基、非活 化碳碳双键不具备还原能力。该方法只需将硝基化合物与 过量水合肼溶于甲醇或乙醇中,然后在催化剂存在下加热, 还原反应即可进行,无需加压,操作方便,反应速度快且 温和,选择性好。
• 水合肼在不同贵金属催化剂上的分解过程,取决于介质 的pH值,1mol肼所产生的氢随着介质pH值的升高而增 加,在弱碱性或中性条件下可以产生1mol氢:
此反应是在高温下于管式反应器或高压釜内进行的,这使 其应用范围受到限制。我国有机化学家黄鸣龙对该反应方法进行 了改进,采用高沸点的溶剂如乙二醇替代乙醇,使该还原反应可 以在常压下进行。此方法简便、经济、安全、收率高,在工业上 的应用十分广泛,因而称为Wolff-Kishner黄鸣龙还原法。例如:
2. 水合肼催化还原 水合肼在Pd-C、Pt-C或骨架镍等催化剂的作用下,
精细有机合成技术 邹静
水合肼还原 肼的水溶液呈弱碱性,它与水组成的水合肼是较强的
还原剂。
水合肼作为还原剂的显著特点是还原过程中自身被氧 化成氮气而逸出反应体系,不会给反应产物带来杂质。同 时水合肼能使羰基还原成亚甲基,在催化剂作用下,可发 生催化还原。
1.W-K-黄鸣龙还原
水合肼对羰基化合物的还原称为Wolff-Kishner还原:
在碱性条件下如果加入氢氧化钡或碳酸钙则可以产生 2mol氢:
芳香族硝基化合物用水合肼还原时,可以用三价铁盐和 活性炭作为催化剂,反应条件较为温和。
2 ArNO2 + 3N2H4 Fe3+ -C 2ArNH2 + 4H2O + 3N2
• 间硝基苯甲腈在三氯化铁和活性炭催化作用下,用水合 肼还原制得间氨基苯甲腈。
有机化合物氧化还原反应机制解析

有机化合物氧化还原反应机制解析有机化合物氧化还原反应是有机化学中非常重要的一类反应,是有机化学研究的基础。
它们可以用来合成有机化合物、分析化合物结构以及了解化合物的反应路径。
本文将对有机化合物氧化还原反应的机制进行解析。
有机化合物是由碳和氢以及其它元素如氧、氧化物、氮等组成的化合物。
氧化还原反应是指化学物质中的电子在反应过程中的转移或转化。
在有机化学中,氧化还原反应指的是有机化合物中碳的价态发生改变,其原子所带的电荷数和氧化态发生改变。
一般来说,氧化反应指的是有机物中碳原子氧化态增加,而还原反应指的是有机物中碳原子氧化态减少。
氧化还原反应的机制主要包括电子转移和质子转移。
电子转移是指在反应过程中,电子从一个物质转移到另一个物质,从而改变其氧化态。
质子转移是指质子从一个分子转移到另一个分子,从而改变其净电荷。
这两个过程经常同时发生,相互影响。
在有机化学中,氧化还原反应的机制可以通过一系列的步骤来解析。
首先,氧化剂与还原剂之间发生电子转移,将电子从还原剂转移到氧化剂上。
然后,氧化剂会与有机化合物中的氢原子发生反应,形成水。
而还原剂会与有机化合物中的氧原子发生反应,形成水。
氧化还原反应机制还受到溶液条件和反应物结构的影响。
溶液条件可以通过调节溶剂的酸碱性、温度、反应物浓度等来实现。
反应物结构主要包括有机官能团和取代基的类型等。
不同的溶液条件和反应物结构会导致不同的反应机制和产物生成。
有机化合物氧化还原反应的应用十分广泛。
它们可以用于合成有机化合物,如合成药物、染料等。
氧化还原反应还可以用于分析化合物结构,例如使用电化学方法测定有机化合物的氧化还原电位,从而推测其结构。
此外,有机化合物的氧化还原反应也可以用于了解化合物的反应路径,从而帮助设计和优化反应条件。
总之,有机化合物的氧化还原反应是有机化学中的重要内容。
了解这些反应的机制和应用是有机化学研究和应用的基础。
通过解析有机化合物氧化还原反应的机制,可以更好地理解其反应过程和产物生成,从而推动有机化学的发展。
有机合成 还原反应

O H
O (1) LiAlH(OEt)3
OH
OH Br
(2) H3O
HO H Br
7-1-3 双(甲氧乙氧基)铝氢化物(RED-AL)
2O
N a, A l, H 2 O H
HO N a A l
toluene,>100de HO
O O
O H
Red-Al,0.5 eq 5-15de
Red-Al, 1.1eq
OH OH
HO
(1)Red-Al,140deHO (2) H3O CHO
(芳香醛酮,先还原成苄醇,再氢解)
R e d - A l
C H 2 = C ( C H 2 ) 8 C O O C H 3
C H 2 = C ( C H 2 ) 8 C H 2 O H
C O O C 2 H 5 R e d -A l
NaBH4(Sodium tHetrahydridoborateH)
H Al Li
H B Na
HH
HH
4LiH + AlCl3
LiAlH4 + 3LiCl
NaBH4和LiAlH4是最常用的两种还原剂:
4NaH + B(OMe)3
NaBH4 + 3CH3ONa
是还原极性官能团最有效的还原剂,能还原大部分的 羰基化合物(醛、酮、羧酸、酸酐、酯等)。还原过 程是通过氢化锂铝的负氢离子的转移实现。铝结合的 氢减少,其氢化物的还原活性降低。
原时易发生氢解,如采用Rh、Ru催化剂,在温和的条件下即可使苯环 优先氢化,不发生氢解反应
HO CHCOOH H2/Pd-C
CH2COOH
HO CHCOOH H2/Rh-Al2O3
液相还原剂

液相还原剂1. 什么是液相还原剂?液相还原剂是一种在溶液中可发生氧化还原反应的物质。
它们通常由两个部分组成:一个是可氧化的物质,也称为还原剂;另一个是可被还原的物质,也称为氧化剂。
当这两种物质在溶液中接触时,会发生电子转移反应,从而实现氧化和还原的过程。
2. 液相还原剂的分类根据其化学性质和用途,液相还原剂可以分为多种类型。
以下是几种常见的分类:2.1 无机液相还原剂无机液相还原剂主要由金属离子组成,如铁、锌、铝等。
这些金属离子能够将其他物质中的金属离子还原为金属。
例如,铁离子可以将铜离子还原为铜金属。
2.2 有机液相还原剂有机液相还原剂通常含有活泼的氢、碳、氮等元素,并且具有较高的电子亲和力。
它们可以与其他物质发生氧化还原反应,从而实现还原的过程。
常见的有机液相还原剂包括丙酮、乙醇、甲醛等。
2.3 氧化剂和还原剂液相还原剂可以根据其化学性质进一步分为氧化剂和还原剂。
氧化剂能够接受电子并被还原,而还原剂则能够提供电子并被氧化。
这两种物质通常是反应中必不可少的组成部分。
3. 液相还原剂的应用液相还原剂在许多领域都有广泛的应用,以下是几个常见的应用领域:3.1 化学分析在化学分析中,液相还原剂常用于检测金属离子的含量。
通过将待测溶液与适当的液相还原剂反应,可以观察到颜色变化或沉淀形成等现象,从而确定金属离子的存在与浓度。
3.2 电镀工艺在电镀工艺中,液相还原剂起到了重要的作用。
它们可以将金属离子转化为可沉积在电极上的金属,从而实现电镀的过程。
常用的液相还原剂包括铜、镍、铬等。
3.3 污水处理液相还原剂在污水处理中也有广泛的应用。
通过添加适量的液相还原剂,可以将废水中的有害物质还原为无害物质,从而达到净化水质的目的。
3.4 有机合成在有机合成中,液相还原剂常用于还原醛、酮等官能团。
例如,乙醇可以作为一种液相还原剂,在化学反应中将酮转化为醇。
4. 液相还原剂的安全性虽然液相还原剂在很多领域都有重要应用,但它们也存在一定的安全风险。
精细有机合成技术:还原反应概述

• ③金属氢化物。它们的还原作用都很强,如NaBH4、 LiAlH4、LiBH4等。常用的有机还原剂有烷基铝、有机 硼烷、甲醛、乙醇、葡萄糖等。
(3)电解还原法 即有机化合物从电解槽的阴极上获得电 子而完成的还原反应。电解还原是一种重要的还原方法。
精细有机合成技术 邹静
还原反应概述
一、还原反应及其重要性
还原反应在精细有机合成中占有重要的地位。广义的讲,在还原剂的作 用下,能使某原子得到电子或电子云密度增加的反应称为还原反应。狭义地 讲,能使有机物分子中增加氢原子或减少氧原子的反应,或者两者兼而有之 的反应称为还原反应。
通过还原反应可制得一系列产物。如,由硝基还原得到的各种芳胺,大 量被用于合成染料、农药、塑料等化工产品;将醛、酮、酸还原制得相应的 醇或烃类化合物;由醌类化合物还可得到相应的酚;含硫化合物还原是制取 硫酚或亚硫酸的重要途径。
二、还原方法的分类
(1)催化加氢法 即在催化剂存在下,有机化合物与氢发 生的还原反应。 (2)化学还原法 使用化学物质作为还原剂的还原方法。 常用的无机还原剂有: • ①活泼金属及其合金。如Fe、Zn、Na、Zn-Hg(锌汞齐)、
Na-Hg(钠汞齐)等。 • ②低价元素的化合物。它们多数是比较
三乙基硅烷还原剂的应用

三乙基硅烷还原剂的应用
1. 前言
三乙基硅烷在有机合成中具有非常广泛的用途,是常见的重要合成试剂之一。
它通常被定义为温和的还原试剂。
一般还原反应都是在碱性环境下进行,但三乙基硅烷能在TFA等酸性环境下做还原剂使用是它最大的特点。
常被用于芳基酮或二芳基酮的还原,苄位羟基脱除,以及系列保护基团的脱除。
一般使用Et3SiH/TFA, LiAlH4/AlCl3, NaBH4/TFA 等试剂脱去羟基,羟基碳必须与芳环相连。
2. 三乙基硅烷还原剂的应用 2. 1 苄位羟基的脱除2.1.1 Et3SiH/TFA脱羟基应用示例
羟基(-OH)作为一个活性基团,在有机合成的官能团转化过程中往往起到桥梁作用。
一般情况下,羟基可通过还原羰基化合物获得。
有时,在有机合成化学中会遇到需要将某个位置上的羟基直接脱除得到想要的中间体或目标产物的情况,这时就需要借助合适的化学方法将羟基脱除。
首先,芳香苄位上的羟基在TFA(或Lewis acid)条件下生成氧鎓盐,酸性条件下离去一分子H2O得到稳定的苄位碳正离子,然后Et3SiH中的氢负离子进攻苄位碳正离子,从而得到目标产物。
与该方法类似的有:
2.1.2 羰基还原应用示例
2.1.2 Et3SiH/BF
3.Et2O还原羰基应用示例
2.1.3 Et3SiH/BF
3.Et2O脱羟基应用示例。
有机化学基础知识点整理有机化合物的氧化还原反应

有机化学基础知识点整理有机化合物的氧化还原反应有机化学基础知识点整理有机化合物的氧化还原反应一、氧化还原反应概述在有机化学中,氧化还原反应是指有机化合物中的某个原子或基团与氧、氢或其它氧化剂和还原剂发生电子转移的化学反应。
氧化反应是原子或基团失去电子,还原反应是原子或基团获得电子。
二、常见的氧化还原反应1. 氧化反应(1) 氧化还原反应中最常见的就是醇的氧化反应。
醇可以被氧化成醛或酮。
例如,乙醇可以在氧气或者氧化剂如酸性高锰酸钾(KMnO4)的作用下被氧化为乙醛或乙酸。
(2) 异丙醇也可以被氧化为酮,例如氧化剂CuO或者CrO3的作用下,异丙醇可以被氧化为丙酮。
2. 还原反应(1) 酮的还原反应。
酮可以通过还原反应得到醇。
还原剂常用的有金属氢化物如氢气和催化剂铝氢化钠(NaBH4)或锂铝氢化物(LiAlH4)。
(2) 羰基化合物的还原反应。
醛和酮可以通过催化剂如氢气和铂催化下还原为醇。
(3) 脱氧还原反应。
一些含有什么基的有机化合物可以通过与氢气或还原剂作用发生脱氧还原反应。
例如,邻苯二酚可以被氢气还原为苯酚。
三、氧化还原反应中的常见试剂1. 氧化剂(1) 高锰酸钾(KMnO4):可将醇氧化为醛、酮或羧酸。
(2) 高氯酸(HClO4):常用于氧化烷基苯和芳烃。
(3) 高碘酸(HIO4):可将醛氧化为酸。
(4) 三氯化铬(CrCl3):可将醇氧化为醛、酮。
(5) 硝酸:可将醛氧化为酸。
(6) 原子氧(O):可以去除有机化合物中的氢原子。
2. 还原剂(1) 氢气(H2):常用于将醛或酮还原成醇。
(2) 氢化钠(NaBH4):常用于酮的还原。
(3) 锂铝氢化物(LiAlH4):常用于酮的还原。
(4) 异丙基锂(i-BuLi):可将卤代烃还原为烃。
(5) 二氯硅烷(DCM):可将酮还原为烯烃。
四、氧化还原反应中的条件1. 氧化反应的条件(1) 氧化剂:常见的有氧气、高锰酸钾(KMnO4)、高氯酸(HClO4)等。
常用硼还原剂 -回复

常用硼还原剂-回复什么是硼还原剂?硼还原剂是一类化学物质,可以将其他化合物中的氧原子还原成水或氢气,从而发挥还原作用。
常用硼还原剂包括硼氢化钠(NaBH4)、四乙基硼(Et4B)、三甲基硼(Me3B)等。
它们在有机合成、催化反应和材料科学等领域中广泛应用。
首先,我们来介绍一下常用硼还原剂的结构和性质。
硼氢化钠是最常用的硼还原剂之一,其化学式为NaBH4。
它是一种白色晶体,可溶于水和大多数有机溶剂。
NaBH4在室温下稳定,但容易与氧气和水反应,因此在操作时需要注意保护。
四乙基硼(Et4B)和三甲基硼(Me3B)也是常用的硼还原剂,它们的分子结构含有硼-碳键,可提供还原反应所需的电子。
硼还原剂的使用主要有两个方面的优势。
首先,硼还原剂是一种温和的还原剂,适用于对氧气敏感或容易受到其他强还原剂损害的化合物。
其次,硼还原剂可以选择性地还原氧原子,而不影响其他官能团。
在有机合成中,硼还原剂可用于还原酮、醛、羧酸和酯等化合物。
以酮为例,当酮与硼氢化钠反应时,硼氢化钠提供电子给酮中的氧原子,生成相应的醇化合物。
这种反应通常在醇性溶剂中进行,如乙醇或异丙醇。
相比于其他常用的还原剂(如锂铝氢化物,LAH),硼还原剂反应条件较为温和,并且具有较好的选择性。
此外,硼还原剂还可以催化取代反应、加成反应和不对称反应等。
硼还原剂在材料科学中的应用也非常广泛。
它们通常用于合成金属纳米颗粒和金属氧化物纳米颗粒。
通过控制硼还原剂的使用量和反应条件,可以调控纳米颗粒的形貌和尺寸。
此外,硼还原剂还可以用于制备硼化物、硼氮化物和含硼陶瓷材料等。
总之,硼还原剂是一类重要的化学试剂,用于有机合成和材料科学研究中的还原反应。
它们具有反应温和、选择性好等优点,在化学研究和工业生产中发挥着重要的作用。
然而,硼还原剂在操作时仍需注意安全性,避免与氧气和水接触。
在今后的研究中,可以进一步探索硼还原剂的反应机理和优化反应条件,以发展更加高效、环保的合成方法和材料制备技术。
硝基加氢还原 -回复

硝基加氢还原 -回复
硝基加氢还原,简称硝基还原,是一种化学反应,常用于有机合成中。
硝基还原过程中,通过还原剂将有机化合物中的硝基基团(NO2)转化为氨基基团(NH2)。
该反应通常使用金属还原剂或氢气作为还原剂。
常用的还原剂有铁粉、亚铁离子、亚砷酸
钠等。
硝基还原反应通常在酸性条件下进行,以促进反应的进行。
在适当的酸性条件下,硝
基基团与还原剂发生氢化反应,生成氨基基团。
反应结果通常是硝基基团被氢原子取代,
生成相应的胺化合物。
硝基还原反应在有机合成中具有广泛的应用。
它可以用于合成各种胺类化合物,如芳
香胺、脂肪胺等。
硝基还原反应也可以用来合成其他有机官能团,如氧化胺、硫醚等。
硝基还原是一种重要的有机合成方法,可以用于合成各种有机化合物。
它具有简单、
高效、具有广泛适用性等优点,因此被广泛地应用于有机化学研究和工业生产中。
羧基还原成醛基

羧基还原成醛基羧基还原成醛基是有机化学中一个重要的反应过程,常用于合成和转化有机物。
本文将详细介绍羧基还原成醛基的原理、方法和应用。
一、原理羧基还原成醛基是通过还原剂的作用将羧基转化为醛基。
常用的还原剂有金属铝、金属锌、氢气等。
在反应中,还原剂与羧基发生氧化还原反应,羧基上的氧原子失去一个电子形成醛基。
二、方法羧基还原成醛基的方法多种多样,以下是几种常见的方法:1. 邻氨基苯甲酸酯还原法:将邻氨基苯甲酸酯与还原剂反应,生成相应的醛。
2. 羧酸与亲核试剂反应:将羧酸与亲核试剂如硫酸亚铁、亚砜等反应,生成相应的醛。
3. 羧酸与无机还原剂反应:将羧酸与无机还原剂如亚硫酸钠、亚硫酸氢钠等反应,生成相应的醛。
4. 羧酸与金属还原剂反应:将羧酸与金属还原剂如铝、锌等反应,生成相应的醛。
三、应用羧基还原成醛基的反应在有机合成中有着广泛的应用。
以下是几个典型的应用案例:1. 羧基还原合成醛类化合物:羧酸经过还原反应可以得到相应的醛类化合物,这是一种常用的合成方法。
醛类化合物在有机合成中具有重要的地位,广泛用于制药、农药、香料等行业。
2. 羧基还原制备醇类化合物:羧酸经过还原反应可以得到相应的醇类化合物。
醇类化合物是有机合成中常见的中间体,可用于进一步合成其他有机化合物。
3. 羧基还原制备醚类化合物:羧酸经过还原反应可以得到相应的醚类化合物。
醚类化合物在药物合成和有机合成中有着重要的应用。
四、总结羧基还原成醛基是一种重要的有机化学反应,广泛应用于有机合成中。
通过不同的方法和还原剂,可以有效地将羧基转化为醛基。
羧基还原成醛基的反应具有方便、高效、选择性好等优点,对于有机化学研究和工业生产具有重要意义。
以上是关于羧基还原成醛基的详细介绍,希望可以对读者有所帮助。
通过了解羧基还原的原理、方法和应用,可以更好地理解有机化学中的反应过程,并应用于实际的合成和转化中。
有机物参与的氧化还原方程式的配平

有机物参与的氧化还原方程式的配平一、概述有机化合物是碳原子与氢、氧、氮、硫、磷等元素形成的化合物,是生物体内和地球上两种基本物质之一。
有机物参与氧化还原反应是化学中常见的一种反应类型,而氧化还原方程式的配平则是这一过程中的重要环节。
本文将就有机物参与的氧化还原反应和方程式配平展开深入讨论。
二、有机物参与的氧化还原反应有机物作为一类碳氢化合物,在氧化还原反应中能够发生氧化反应和还原反应。
一些含有酒石酸结构的有机醇,可以在氧化条件下被氧化为相应的羧酸,而这就是一个典型的有机物的氧化反应。
另外,有机物也参与到还原反应中,例如醛酮在还原条件下可以还原为相应的醇。
有机物参与的氧化还原反应在化学反应中是极为常见的。
三、氧化还原方程式的配平1. 氧化还原反应的基本概念氧化还原反应是指物质发生氧化和还原的反应。
氧化是指物质失去电子,而还原是指物质获取电子。
在氧化还原反应中,参与反应的物质往往存在着电子的转移,从而形成氧化还原的现象。
2. 有机物氧化还原方程式的配平有机物参与的氧化还原反应往往需要进行方程式的配平。
在配平过程中,首先需要分析反应物和生成物中元素的种类和数量,然后根据氧化还原反应的基本原理,进行电子数目相等的配平,最后得到平衡的氧化还原方程式。
四、具体案例分析1. 乙二醇的氧化反应乙二醇(C2H6O2)在氧化条件下可以氧化为乙二酸(C2H4O4)。
C2H6O2 → C2H4O42. 乙醛的还原反应乙醛(C2H4O)在还原条件下可以还原为乙醇(C2H6O)。
C2H4O + H2 → C2H6O五、个人观点和理解有机物参与的氧化还原反应及其方程式的配平是化学中的重要内容。
通过学习和掌握这一知识点,不仅可以深入理解有机物的性质和化学反应,还可以为进一步学习有机化学奠定坚实的基础。
化学反应中的配平过程也是一种训练逻辑思维和化学计算能力的有效方法,对于提升化学学习的质量和深度具有重要意义。
六、总结有机物参与的氧化还原方程式的配平是化学中的重要内容,对于深入理解有机物的性质和化学反应具有重要意义。
二硫键还原成巯基的方法

二硫键还原成巯基的方法二硫键是指两个硫原子之间的化学键。
在有机化学中,二硫键的还原是一种常见的反应。
二硫键还原成巯基的方法有多种,下面将分别介绍几种常见的方法。
1. 还原剂法通过使用还原剂可以将二硫键还原成巯基。
常用的还原剂有氢气、亚砜、硫代乙酸钠等。
以亚砜为例,反应方程式如下:R-S-S-R + 2R'SH -> R-SH + R'-SH + R-S-S-R'其中R和R'分别代表有机基团。
2. 光化学法通过光照可以将二硫键还原成巯基。
在紫外光照射下,二硫键会发生光解反应,生成两个巯基。
这种方法可以在光照条件下进行,无需使用其他还原剂。
3. 高温法将含有二硫键的化合物加热至较高温度,二硫键会断裂,生成巯基。
这种方法常用于无法通过其他方法进行还原的化合物。
4. 电化学法通过电化学反应可以将二硫键还原成巯基。
常用的电化学方法有电解、电还原等。
电解是将含有二硫键的化合物溶解在适当的电解质溶液中,通过电流的作用将二硫键还原成巯基。
以上是几种常见的二硫键还原成巯基的方法。
不同的方法适用于不同的化合物和实验条件。
在实际应用中,需要根据具体情况选择合适的方法。
二硫键的还原反应在有机化学合成、药物研发等领域有着广泛的应用,对于研究人员来说是一项重要的技术。
通过掌握不同的还原方法,可以实现对二硫键的高效还原,为有机化合物的合成和研究提供了有力的工具。
总结起来,二硫键还原成巯基的方法主要包括还原剂法、光化学法、高温法和电化学法。
每种方法都有其适用的条件和优缺点,研究人员可以根据具体需要选择合适的方法进行实验。
掌握这些方法可以为有机化学研究和合成提供重要的技术支持,推动科学研究的发展。
常用还原剂----锌-乙酸

常用还原剂----锌-乙酸【英文名称】 Zinc-CH3CO2H【分子式】 Zn,C2H4O2【分子量】 65.39(Zn),60.06(C2H4O2)【CA 登录号】 [7440-66-6](Zn),[64-19-7] (C2H4O2)【结构式】 Zn-HOAc【物理性质】有多种形式金属锌,在该试剂中一般使用金属锌粉即可。
mp 419.5 oC, d 7.140g/cm3。
在该试剂中使用的乙酸一般为冰醋酸,bp 117~118 oC, mp 16.2 oC, d 1.049 g/cm3。
【制备和商品】商品金属锌粉是灰色的粉末;商品冰醋酸在常温下为无色的液体。
国内外试剂公司均有销售。
使用前原位将锌粉加入到乙酸中生成的悬浮液即可使用。
【注意事项】乙酸对呼吸道具有强烈的刺激作用。
在反应中金属锌粉与乙酸接触后释放出氢气,所以该试剂一般在通风橱中进行使用。
--------------------------------------------------------锌-乙酸组合试剂 (Zn-AcOH) 是有机化学中传统还原试剂之一,还原条件温和而且具有选择性。
该试剂目前仍然在有机合成中官能团转变中起着重要作用。
烯烃在臭氧化反应中首先生成双烷基取代的过氧化合物中间体,一般不用分离直接经 Zn-AcOH 处理后发生分解,生成相应的醛或者酮。
最近有人用 Zn-AcOH 处理单烷基取代的过氧化合物也获得满意的结果 (式 1)[1]。
Zn-AcOH 另一个重要用途是还原除去分子中的卤原子。
1,2-二取代的卤化物或者邻位杂原子取代的卤化物与 Zn-AcOH 发生还原消去反应生成相应的烯烃 (式 2)[2~6]。
Zn-AcOH 可以方便地除去 α-卤代羰基化合物 (式 4)[7] 或者α,α-二卤代羰基化合物 (式 3)[8] 中的卤原子。
Zn-AcOH 最具特色的一个反应是高产率地影响 α-碘内酯化反应的逆反应。
降冰片甲酸的制备一般生成 endo-和 exo-两种异构体,α- 碘内酯化反应可以将 endo-异构体转化成 α-碘内酯而使两者分离。
柠檬酸还原性

柠檬酸还原性柠檬酸是一种自由基还原剂,它可以还原一个系统中的多种有机物质,从而改变物质的性质。
它是绿色化学工艺中常用的一种有机自由基还原剂。
柠檬酸是一种氢原子携带者,能够与氧化剂反应,使氧化物转化为原子或分子形式的氢。
柠檬酸的反应特性是令人印象深刻的,它是一种非常有效的还原剂,它能还原大多数金属和非金属的氧化物,由此可以知道,在化学工作中,柠檬酸的还原性是非常重要的一个环节。
柠檬酸还原性的概念:柠檬酸还原性是指柠檬酸作为还原剂,能够使氧化剂被还原,经历一系列变化,从而改变物质性质的一种能力。
柠檬酸还原性也涉及到柠檬酸还原性的定义、分类和评价等内容。
柠檬酸的还原性可以用不同的方法来描述,以便合理地控制柠檬酸在化学合成过程中的作用,促进化学反应的顺利进行。
柠檬酸还原性的特性:柠檬酸作为一种强大的还原剂,它有着许多特性,这些特性将使柠檬酸在化学合成中发挥重要作用。
首先,柠檬酸有极强的还原能力,它能够有效地还原大多数金属氧化物;其次,柠檬酸具有良好的抗氧化性,可以有效抑制氧化反应;第三,柠檬酸具有良好的可控性,反应的反应时间、反应温度以及还原产物的水溶性都可以通过添加柠檬酸来调节。
柠檬酸还原性的应用:柠檬酸作为一种自由基还原剂,在化学领域有着广泛的应用,它能够对多种有机物质进行还原作用,从而改变物质性质。
在化学研究中,柠檬酸的还原性常常用来还原氧化物。
比如,在以不饱和醇为原料的馏分过程中,柠檬酸可以被用来还原不饱和醇的氧化物,从而促进馏分的顺利进行;在以取代酚为原料的取代反应中,柠檬酸还可以被用来还原取代酚的氧化物,促进取代反应的顺利进行;在制备有机还原剂中,柠檬酸也可以被用来实现有机还原剂的稳定。
因此,柠檬酸还原性是化学工艺非常重要的一部分,它能够有效帮助化学反应朝着预期方向发展,从而促进物质性质的改变,为化学研究提供有利条件。
羧基被LiAlH4还原方程式

羧基被LiAlH4还原方程式
羧基是一种含有碳氧双键和羟基的有机官能团,通常表示为-COOH。
它是许多生物分子的重要组成部分,如脂肪酸、氨基酸和糖酸等。
羧基的还原是有机化学中的一个重要反应,可以通过还原剂LiAlH4来实现。
LiAlH4是一种强还原剂,可以将羧基还原为相应的醇。
在反应中,LiAlH4会与羧基中的氧原子发生反应,生成一个中间体AlH3和一个氢离子。
然后,AlH3会与LiAlH4中的铝原子发生反应,生成一个还原剂AlH4-和一个铝离子Li+。
最后,还原剂AlH4-会与中间体AlH3发生反应,生成相应的醇和AlH2OH。
羧基的还原反应可以用以下方程式表示:
R-COOH + LiAlH4 → R-CH2OH + LiAl(OH)4
其中,R代表羧基所连接的碳链。
羧基的还原反应在有机合成中具有广泛的应用。
它可以用于合成醇、醛、酮等有机化合物。
此外,羧基的还原反应还可以用于制备一些药物和天然产物,如维生素C、激素和抗生素等。
羧基的还原反应是有机化学中的一个重要反应,可以通过强还原剂LiAlH4来实现。
这种反应可以用于合成醇、醛、酮等有机化合物,具有广泛的应用价值。
液相还原剂

液相还原剂
液相还原剂是一种在化学反应中起到还原作用的溶液或液体。
它在有机合成、金属加工和分析化学等领域中广泛应用。
液相还原剂的主要作用是将氧化剂中的氧原子或电子转移给其他物质,使其还原。
它可以通过释放电子或氢离子来实现还原反应。
液相还原剂的选择取决于所需的反应条件和反应物的特性。
在有机合成中,液相还原剂常用于还原醛、酮、酸和酯等有机官能团。
一些常用的液相还原剂包括氢气、金属钠、金属铝、亚磷酸和亚砜等。
它们可以在适当的条件下将有机官能团还原为相应的醇、烷烃或烯烃。
液相还原剂的选择要考虑反应的速度、选择性和副反应等因素。
在金属加工中,液相还原剂常用于去除金属表面的氧化层和杂质。
例如,酸性还原剂可以将金属表面的氧化物还原为金属,从而提高材料的表面质量和机械性能。
此外,液相还原剂还可以用于金属的脱脂、除锈和清洗等工艺。
在分析化学中,液相还原剂常用于还原滴定和还原电位法等分析方法。
例如,亚硫酸盐可以作为还原滴定中的标准溶液,用于测定氧化剂的浓度。
液相还原剂还可以用于测定金属离子的浓度和还原电位的测定。
液相还原剂在化学反应中起到重要的作用,但在使用过程中也需要注意安全性。
一些液相还原剂具有强还原性和腐蚀性,需要在适当的条件下操作,避免与空气、水或其他物质发生反应。
此外,液相还原剂的储存和处理也需要特别注意,避免造成环境污染和人身伤害。
液相还原剂是化学反应中不可或缺的重要物质。
它在有机合成、金属加工和分析化学等领域中具有广泛应用。
正确选择和使用液相还原剂可以实现预期的反应目标,并确保反应的安全性和高效性。
