大学有机化学第11章
有机化学 第十一章 醛酮(1)

E1
E2
19
四. 化学性质(C.P.)
结构分析 讨论1: 比较苯酚C-O与醛酮C=O的结构? C杂化形式 苯酚 醛酮 sp2 sp2 O杂化形式 sp2 sp2(国外)
H H
C O
H
C O
H
20
结构分析 讨论1: 比较苯酚C-O与醛酮C=O的结构?
H
H
C O
H
+
-
C O
H
C
H
O
H
O O CH3 C CH2 C CH3
14
2. 命名
普通命名法
醛:αβγδ… 标记取代基位置
CH3CHCH2CHO CH3 CH3OCH2CH2CH2CHO CH=CHCHO
-甲基丁醛
γ-甲氧基丁醛
-苯基丙烯醛
酮:某某基酮(与醚相似)
O CH 3 C HC CH 3
O CH2 CH C CH3
O C CH3
CH3
甲基异丙基酮
甲基乙烯基酮
苯基甲基酮 15
2. 命名
系统命名法
脂肪醛酮:选含羰基(位次小)的最长C链为母体,称某醛(酮);
O CH3CH2CHCH2C CH2CH3 CH3
5-甲基-3-庚酮
当主链中有 C=C 时,称烯醛或烯酮;
O CH2 CH C CH3
O (CH3)2CHCHCH=CHCCH3 Cl 6-甲基-5-氯-3-庚烯-2-酮
加酸反应速率减小,加入大量酸,放许多天也不反应。
● 反应条件:碱催化
● 增碳的反应:制备增1个C的羧酸
● 范围: 醛、大多数甲基酮
28
(一) 羰基的亲核加成 1. 与氢氰酸加成
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
O C
羰基
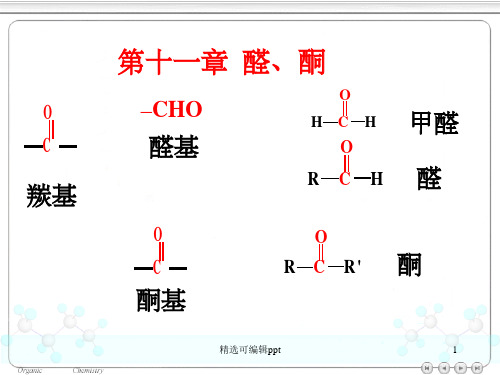
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
高等有机化学第十一章 卡宾

第十一章卡宾11.1 卡宾的定义C:表示,卡宾(carbene),又称碳烯,一般以R2指碳原子上只有两个价键连有基团,还剩两个未成键电子的高活性中间体。
卡宾的寿命远低于1秒,只能在低温下(77K以下)捕集,在晶格中加以分离和观察。
它的存在已被大量实验所证明。
卡宾的两个未成键电子既能自旋方向相反,处于单线态,也可自旋方向平行,处于三线态。
取哪种状C:的两种态应视取代基和制备方法而异。
下式为H2状态:单线态和三线态卡宾11.2 卡宾的轨道1CH2H f=110.856KCAL/MOL3CH2H f=80.809KCAL/MOL11.3 卡宾的立体结构烷基卡宾三线态卡宾的结构,最简单是用中心碳原子sp杂化来描述。
两个sp杂化轨道和两个氢原子成键,两个没有杂化的p轨道,每一个容纳一个电子。
这是形成两个σ键和最大程度降低所有六个电子的电子与电子之间相互排拒的最有效的形式。
三线态卡宾的分子构型是线性的。
由于每一个p轨道只容纳了一个电子,因而可以把三线态卡宾看作是一个双游离基。
事实上,它们在许多方面的表现也确是如此。
单线态卡宾最简单是用中心碳原子sp2杂化来描述。
在这三个sp2杂化轨道中,有两个和氢原子成键,第三个容纳孤电子对。
没有杂化的p轨道保持是空的。
这是对三个电子对的最大程度减少电子与电子之间排拒作用的最有效的形式。
单线态的几何构型是弯的,由于孤电子对对C-H 键的排拒作用,键角小于120°。
单线态卡宾同时显示了碳负离子的独电子对和碳正离子的空p轨道。
实际上,这样考虑的单线态和三线态的结构是过于简单化的。
最近的计算和测定的结果:单线态卡宾的键角约为103°,三线态键角约为136°。
单线态和三线态之间的能量差别也曾经见诸报导,三线态比单线态稳定,能量差约为8∼9千卡/摩尔。
芳基卡宾电子自旋共振谱表明芳基卡宾的基态是三线态。
反应物光解首先形成单线态卡宾,然后自旋反转,形成三线态卡宾。
大学有机化学第11章__醛和酮

O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
有机化学第十一章

羰基化合物的活性次序(电子效应和空间效应): 羰基化合物的活性次序(电子效应和空间效应):
HCHO > CH3CHO > ArCHO > CH3COCH3 > CH3COR> CH3COAr > RCOR' > ArCOAr'
O 2N CHO > CHO
>
H 3C
CHO
1、与HCN的加成 、 的加成
维纶
4、与金属有机试剂的加成 、
(1)格氏试剂 )格氏试剂: H2CO +
MgCl 无水 乙醚
CH2OH 64-96%
H2O CH2OMgCl H SO 2 4
CH3 无水 乙醚 CH3COPh + PhCH2MgCl PhCH2 C OMgCl Ph CH3 H2O PhCH2 C OH NH4Cl Ph 92% Grignard: 1912 Nobel Prize
异 丙 醇 铝 ,丙 酮 丙 苯,回流
80%
CHCH CCH CH2 CH3
CH3 C CH CHCH CCH CH2 CH3 O
Oppenauer氧化: 异丙醇铝是催化剂 反应中双键不受影响。 氧化: 异丙醇铝是催化剂, 反应中双键不受影响。 氧化
脱氢:醇在适当的催化剂条件下脱去一分子氢 生成醛酮。 脱氢:醇在适当的催化剂条件下脱去一分子氢,生成醛酮。
CH3OH 浓H2SO4
COOCH3
CH2 C COOCH3 CH3 90%
过氧化苯甲酰
CH2 C CH3
n
甲基丙烯酸甲酯
聚甲基丙烯酸甲酯 (有机玻璃) 有机玻璃)
2、与NaHSO3的加成 、
加成生成a-羟基磺酸钠 羟基磺酸钠: 醛和甲基酮与饱和的NaHSO3加成生成 羟基磺酸钠: 醛和甲基酮与饱和的
有机化学-第十一章

第十一章 胺的分类命名和结构本章要点1、分类命名结构2、化性(1)胺:碱性,霍夫曼消除,与H NO 2反应,烃基/酰基化,兴斯堡反应,氧化,苯胺环上亲电取代(2)腈:水解,还原(3)尿素:碱性,水解,与HNO 2反应 ,酰基化,缩二脲反应 (4)重氮/偶氮:取代(放N 2),偶联(不放N 2)(5)硝基化合物:还原,定位效应及对酸性的影响 一、胺的分类主要掌握伯胺、仲胺、叔胺和季铵的判别,掌握什么是胺的盐、季铵盐以及季铵碱:-NH 2 NH 2R NHRR ’ NRR ’R ’’R 4N +Cl - R 4N + OH - R 3HN +Cl -氨基 伯胺 仲胺 叔胺季铵盐 季铵碱 胺的盐二、命名 (一)脂肪胺1、一烃基取代直接称“某胺”;2、相同二烃基取代,称“二某胺”;3、不同二烃基取代,称“某某胺(小前大后)”;4、相同三烃基取代,称“三某胺”;……,以此类推;5、多元胺称“某二胺”、“某三胺”……;6、复杂取代的胺,则将氨(胺)基作取代基命名。
(二)芳胺以胺为母体,氮上有取代时要标注“N-某基”。
(三)季铵盐、季铵碱类似于无机盐和碱的命名。
例题:1、N(CH 3) 32、NH(C 2H 5)23、H 2NCH 2CH 2NH 24、Ph-NH 25、Ph -NH 3+Cl -6、CH 3NHC 2H 57、Ph-N(CH 3)28、Ph-N(CH 3)Et9、CH 2(CH 2)3CHCOOHNH 2NH 210、[NH(CH 3)3] +Cl -11、[(CH 3)2NEt 2]+OH -12、NH 2NH 213、N(CH 3)214、CH 3NH 2解:1、三甲胺 2、二乙胺 3、乙二胺 4、苯胺5、氯化苯铵6、甲乙胺7、N ,N-二甲基苯胺8、N -甲基-N -乙基苯胺9、2,6-二氨基己酸(赖氨酸) 10、氯化三甲铵 11、氢氧化二甲基二乙基铵 12、对苯二胺 13、N ,N-二甲基环己胺 14、5-甲基-2-萘胺 三、胺的结构 (一)脂肪胺1、脂肪胺中的N为sp3不等性杂化,键角大小可变;2、N具有孤对电子,因此胺具有碱性和亲核性。
有机化学 第11章 羧酸

R/OH NH3
酯在酸催化下水解是酯化反应的逆过程,水解不完 全。在碱作用下产物为羧酸盐和相应的醇。酯在碱 性溶液中的水解又称皂化反应。
(二)醇解
O O H3C C CH2 C OCH2CH3
2.与金属钠作用放出氢气得到类似醇钠的化合物; 能与五氯化磷作用生成3-氯-2-丁烯酸乙酯;能使溴 的四氯化碳溶液褪色;遇氯化铁显紫红色。 这些性质说明乙酰乙酸乙酯具有烯醇式构造。
OH H3C C C H O C OCH2CH3
(二)酮式和烯醇式互变异构
C ONa O
(三)酰胺脱水反应
酰胺与强脱水剂(P2O5、PCI5、POCI3、SOCI2或 乙酸酐)共热脱水生成腈。
O (CH3)2CH C NH2 P2O5 △ (CH3)2CH C N + H2O
三、酯与格利雅试剂反应及酯的还原
(一)酯与格利雅试剂反应(制备叔醇和仲醇)
O CH3 C OC2H5 + MgBr OMgBr ①干醚 CH3 C OC2H5
O R R R R C O C O C O C O OR NH2 Cl O C R + HOR/ R O C OR/ + R HCl O C OH
ROH NH3
反应较酰氯温和,生成单酯。
酯的醇解——酯交换反应:酯的醇解生成新
的酯和新的醇反应,又称酯交换反应。
酯交换反应是可逆的,受酸、碱催化,要使反应趋 于完成,需用过量的醇R′OH及蒸出低沸点的醇 ROH或酯RCOOR′。
有机化学第11章 波谱(核磁)

一般有机物中质子的δ值在0 ~ 10之间(见P462表11-8)。
4、影响化学位移的因素 1)δ伯H < δ仲H < δ叔H; 2) δ值随邻近原子电负性的增加而增加,随电负性大的 原子数目的增多而增加;
E
h
2
H0
E h
2
H0
实现核磁共 振的条件
CH3CH2OH
二、化学位移 1、定义
CH3CH2OH
由于化学环境的不同而引起的NMR吸收峰位置的不同,
称为化学位移。
2、化学位移的产生原因——屏蔽效应
屏蔽效应是有机化合物分子中的氢核与独立质子相比较, 由于分子中的电子对氢核有屏蔽作用,其核磁共振信号 出现在高磁场。
1HNMR谱图s(3H)为CH3
q(2H)为CH2
O CH3 CH2 C CH3
由于屏蔽效应,外加磁场的强度要略为增加,才能产生 核磁共振信号。显然,核周围的电子云密度越大,屏蔽 效应亦愈大,共振信号将移向高磁场区。
3、化学位移的表示方法——δ值 由于屏蔽效应所造成的磁场强度的改变数量很小,通常
难以准确地测出其绝对值,因此需要一个参考标准来对比。 常用的标准物质是四甲基硅烷,(CH3)4Si,简写为TMS, 它只有一个峰,而且一般质子的吸收峰都出现在它的左边
第十一章 有机波谱分析(2)
11.4 核磁共振谱(Nuclear Magnetic Resonance 简称 NMR)
一、基本原理
核磁共振是由原子核的自旋运动引起的。目前应用广
泛的是氢原子核(质子)的核磁共振谱,称为1HNMR。
浙江大学有机化学课件讲义11

OH
CH3(CH2)14CO2H 棕榈酸
HO2CCH OH
CHCO2H OH
安息香酸
水杨酸
酒石酸
对于比较复杂的羧酸,常用系统命名法命名。选含有羧基的最长碳链为主链,从羧基碳
原子开始编号,称为“某酸”,如有取代基,将取代基的名称与位次放在前面。例如:
CH3CHCH2CHCH2CO2H CH3 CH2CH3
吸收在 1640 和 1600 cm-1 处,是伯酰胺的另一特征吸收。图 11-1、11-2、11-3 分别是乙酸乙
4
酯、苯甲酸、乙酸酐和 N, N-二甲基甲酰胺(DMF)的红外光谱图。 图 11-1 乙酸乙酯的红外光谱 图 11-2 苯甲酸的红外光谱
5
图 11-3 乙酸酐的红外光谱
图 11-4 N, N-二甲基甲酰胺的红外光谱 羧基上的质子因受羰基的去屏蔽作用以及氧电负性的影响,其化学位移出现在低场δ 10~12ppm 处。伯酰胺和仲酰胺氮上的质子在δ 5~8ppm(通常是一个宽峰)。羧酸及其衍生 物的α-位质子因受羰基的吸电子作用影响,化学位移稍向低场移动,一般在δ 2~3ppm 处。
H
CO2H
CH3
CH2CH3
5-甲基-3-乙基己酸
(E)-2-乙基-2-丁烯酸
环直接与羧基相连称为环烷酸,编号从羧基所连接的碳原子开始,例如:
CO2H
CO2H
CO2H H
CH3
H
CO2H
4-甲基环己烷甲酸
2-环戊烯甲酸
反-1, 3-环戊烷二甲酸
芳香酸则常用苯甲酸作为母体,加上取代基的名称与位置,例如:
酰胺是由酰基和“胺”组成其名称的,如果氮上有取代基,则在取代基名称前加“N”
标出,例如:
有机化学 11
氧与二个1 相连 发生S , 相连, 氧与二个 oC相连,发生 N2, 氧与2 、 相连, 氧与 oC、 3oC相连,发生 N1。 相连 发生S 。
烷基芳基混合醚: 烷基芳基混合醚: 一起加热生成碘代烷和酚 与HI一起加热生成碘代烷和酚,酚不与氢碘酸作用 。 一起加热生成碘代烷和酚,
O
CH3 + HI
O
-
Cl
-Cl-
O
Cl
Cl
+ HOCl
OH
NaOH
O-
分子内S 分子内 N2
O
Cl OH H
NaOH E2
HO
(4) 冠谜的合成
HO-CH2-CH2-OH + 2
O
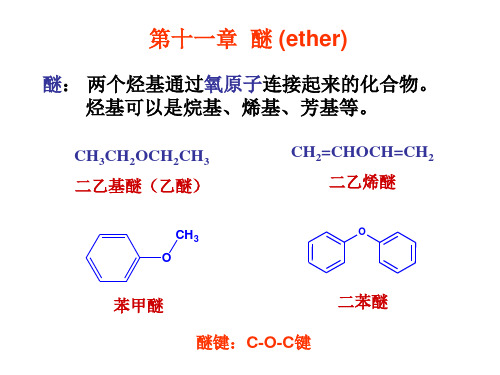
苯甲醚 醚键: 醚键:C-O-C键 键
二苯醚
醚的结构、 第一节 醚的结构、命名和物理性质 1. 分类
开链醚:没有环的醚。 开链醚:没有环的醚。
CH 3 O
CH2=CHOCH=CH2
O O O
15 16 17 14 18 O 13 O1 2 12 O 11 O 10 9 O 8 7 6 O4 3 5
链增长: 链增长:
• (CH3)2COCH3 + O2
优先形成稳定 的自由基。 的自由基。
(CH3)2COCH3 OO •
(CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
关键中间体
3. 醚的碳氧键断裂反应
CH3OCH3 + HI (1mol)
RO
- ...
... CH2
X
取代
ROCH2CH2R' + X-
有机化学课件:第11章 配位化合物
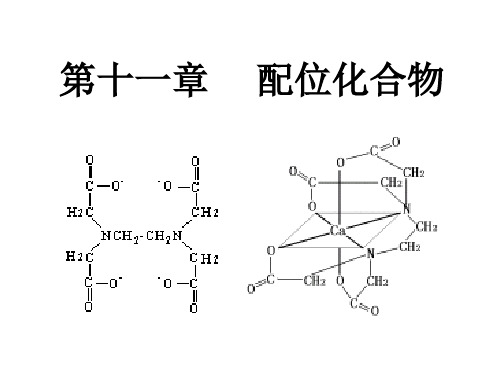
如:NH3 , H2O , Cl-, SCN- , CN- , CO 等
配位原子:配体中直接向中心原子提供孤对 电子的原子。常见的有: F、Cl、Br、I、O、S、N、C 八种元素。
另有:P S As Se Sb Te
单基配体和多基配体 (1 )单基配体:含有一个配位原子的配体 (如:NH3、H2O、F-、Cl- 、 SCN- 等)
(可形成两个及两个以上的配位键)
如: 乙二胺 H2NCH2CH2NH2
(en)
二基配体
乙二胺四乙酸
(HOOCCH2)2 NCH2CH2N (CH2COOH)2 (EDTA)
六基配体
多基配体和螯合物 单基配体:只有一个配位原子的配体(NH3,H2O); 双基配体:含有二个配位原子的配体 (C2O42- ,en)等; 多基配体:含有多个配位原子的配体 (EDTA)。
第十一章 配位化合物
11-1 配位化合物的基本概念 11-2 配位化合物的价键理论 11-3 配位化合物的晶体场理论 11-4 配位化合物的稳定性
配位化合物的发展史
19世纪末期,德国化学家发现一系列令人难以回答 的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不 同的物质。经分析它们的分子式分别是CoCl3∙6NH3、 CoCl3∙5NH3、CoCl3∙5NH3∙H2O、CoCl3∙4NH3。同是氯化 钴,但它的性质不同,颜色也不一样。为了解释上述情况, 化学家曾提出各种假说,但都未能成功。直到1893年,瑞 士化学家维尔纳(A.Werner)发表的一篇研究分子加合 物的论文,提出配位理论和内界、外界的概念,标志着配 位化学的建立,并因此获得诺贝尔化学奖。
有机化学 第十一章 醛和酮

酮羰基约在1715cm-1。
羰基与芳环或烯键共轭,频率降低。
1HNMR
O C H 9~10ppm
O CH2 C H 2.0~2.5ppm
MS
O R C R + C6H5C O m/z = 105
C6H5C O
C6H5 + CO m/z = 77
第三节
醛酮的化学性质
醛酮的结构与反应性
羰基亲核加成 及氢化还原
酸催化
C=O + H
+
C=OH
+
-H+ H2N-Z,
H+
H2O
+
H
C----N-Z
C=N-Z + H2O + H+
反应需在弱酸性的条件下进行。
应用:
a 提纯、鉴别醛酮
重结晶 稀酸
C=O + H2N-Z
C=N-Z
C=O
b 保护羰基
A B C=O + H2NR
A B
C=NR
参与反应
稀酸
A' B'
C=O
Nu C OH
[
+ C=OH
+ ] C-OH
Nu-
醛、酮的反应活性:
R H
R C=O > R'
C=O >
Ar R'
C=O
1. 与氢氰酸的加成反应
OH C=O
+ H
CN
C CN
α -羟基腈
例:
O CH 3CCH 3
N aCN , H 2 SO 4
OH CH 3CCH 3 CN
α -羟基腈是很有用的中间体,由它可
有机化学第十一章羧酸衍生物

肪 硬脂酸(十八碳酸)Fra bibliotek酸 花生四烯酸(二十碳酸)
棕榈油酸(9-十六碳烯酸)
结构式 CH3(CH2)10COOH CH3(CH2)12COOH CH3(CH2)14COOH CH3(CH2)16COOH CH3(CH2)18COOH
CH3(CH2)5CH=CH(CH2)7COOH
不 油酸(9-十八碳烯酸)
② 酸酐的氨(胺)解 酸酐与胺反应,除产生酰胺外,还有一分子羧 酸,因此反应中经常加入三级胺,以中和反应产生的酸。
③ 酯的氨(胺)解 酯可以与氨或胺反应形成酰胺。氨或胺本身作 为亲核试剂,进攻酯羰基碳。
④ 酰胺的氨(胺)解 酰胺与氨(胺)反应是一个胺的交换反应。
2.异羟肟酸铁盐反应 除酰卤外,酸酐、酯和酰伯胺均能与羟胺反应生成异羟肟酸,异 羟肟酸与三氯化铁作用,得到紫红色的异羟肟酸铁盐,这一反应常用 来鉴别酸酐、酯和酰胺,称为异羟肟酸铁盐反应。
有机化学
第十一章 羧酸衍生物
学习目标
1. 掌握羧酸衍生物的结构特征、分类、命名方法及主要化学性质; 2. 理解不同羧酸衍生物在化学性质上的异同; 3. 了解常见羧酸衍生物的性质和用途; 4. 学会油脂和类脂化合物的鉴别方法。
第十一章 羧酸衍生物
羧酸分子中的羟基被其它原子或基团取代所生成的化合物,主要 有酰卤、酸酐、酯、酰胺,其分子结构中均含有酰基,因而也被称为 酰基化合物。
1.水解反应
在酸、碱或酶的作用下,油脂可发生水解反应。在酸性条件下,
油脂水解生成高级脂肪酸和甘油,该反应为可逆反应。
在碱性条件(如NaOH或KOH)下,油脂水解生成甘油和高级脂肪
酸钠(钾)盐。高级脂肪酸钠盐俗称肥皂。因此,把油脂在碱性溶液
中的水解反应称为皂化反应。
有机化学:第十一章 羧酸和取代羧酸亲核加成-消除反应

3. 酸酐的生成
脱水剂:乙酰氯、乙酸酐、P2O5
O R—C—OH
O R—C—OH
例如:
P2O5
或强热
酐键
OO R—C C—R
O
+ H2O
2
COOH (CH3CO)2O
O
O
COC
+ 2 CH3COOH
甲酸与脱水剂共热,分解为一氧化碳和水。
HCOOH
H2SO4 60-80℃
CO + H2O
酸酐也可由羧酸盐与酰氯反应加热得到,此方法可以 制备混合酸酐。
羧酸的酸性强弱受整个分子结构的影响:
电子效应 场效应
凡能降低羧基电子云密度的基 团将使酸性增大。反之亦然。
取代基对RCOOH的酸性的影响:
G COOH
G
COO- + H+
酸性增强
G COOH
G COO- + H+
酸性减弱
(1)
CH3COOH < ClCH2COOH< Cl2CHCOOH < Cl3CCOOH
p,p-共轭体系
共平面
R—
O
—
H R—C O·· H
·
羰 基 和 羟 基 通 过 p,p- 共 轭 构 成 一 个 整 体 ,
故羧基不是羰基和羟基的简单加合。
O
R—C
P-π共轭的结果:
··O H ·
❖ 键长平均化; ❖ 羰基的正电性— 降低,亲核加成变难; ❖ 羟基 H 的酸性—增加; ❖ a-H 的活性—— 降低
HOOC-CH—CH-COOH OH OH
2,3-二羟基丁二酸 酒石酸
CH2-COOH HO— C—COOH
大学有机化学第11章 含氮化合物

p K b 1 3 .0
E.
N
F . (C H 3 ) 3 N
G. CH3
NH2
p K b 1 9 .0
p K b 4 .2 1
p K b 8 .9 0
H.
O 2N
NH2
I.
NH C H 2C H.4 6 p K b 8 .8 8 p K b 4 .7 6
NH3
SO3
5/26/2013
8.胺在缩合反应中的应用 1) Mannich(满氏)反应
O CH3 C CH3 + H C H O + (C 2 H 5 ) 2 N H • H C l O CH3 C C H 2 C H 2 N (C 2 H 5 ) 2 + H 2O
5/26/2013
2) 烯胺的反应
O N+ Cl C R C H 2O R N H O H+ O O C R +
O .. N + X C H 2C H CH2 N
+
H+ H 2O
O CH2 CH C R
O N+ O H+ H 2O R
O
R
5/26/2013
9.胺的制备及反应 (1) S. Gabriel (盖布瑞尔)合成法
O + O NK O + 2 .N a O H /H 2 O Br O NH NH O ONa ONa
+ H 3P O 3 + H C l + H C O O N a + N aC l + H 2O
5/26/2013
N 2 + C lH 3P O 2 H 2O
(此方法可以利用氨基的定位基效应引入其它基团,然后脱掉氨基)
有机化学第三版 第十一章醛酮

NO2
三.α-氢的反应
H C C =O
1.卤代反应
α
醛酮在酸催化下被卤素取代生成一取代产物 例如:
含有α -甲基的醛酮在碱溶液中与卤素反应,很 难停留在一元取代阶段,而生成卤仿。
O O (R)H C CX3 OH O (R)H C O O
=
(R)H C CX3 + OH
若X2用Cl2则得到氯仿 ( CHCl3 ) 液体 若X2用Br2则得到溴仿 ( CHBr3 ) 液体 若X2用I2则得到碘仿 ( CHI3 ) 黄色结晶 该反应 称其为碘仿反应。
OMgX H3O+ R''
H H C
OH R''
1° 醇
H H
C =O
H + R''MgX H C
OMgX H3O+ R''
H H C
OH R''
2° 醇
R R
C =O
R + R''MgX R C
OMgX H3O+ R''
R R C
OH R''
3° 醇
例如:
(1)Mg/Et2O Cl Br (2)CH3CHO (3)H3O+ Cl CHCH3 OH
第三节 醛、酮的化学性质
亲核加成反应和α -H的反应是醛、酮的两类主要 化学性质 醛、酮的反应与结构关系一般描述如下:
α - H反应 碱和亲核试剂进攻部位
δ δ
H
α
亲核加成
C
C H
O:
酸和亲电试剂进攻部位
:
醛基的特殊反应
亲核加成反应:由亲核试剂进攻而发生的加成反应
有机化学-第十一章考点

(CH3)4N+Cl– 氯化四甲铵
(CH3)3N+CH2CH3Cl– 氯化三甲基乙基铵
三、胺的化学性质
能接受质子,显碱性
1、胺的碱性
N
R
R'' R'
接受H+
R-NH2 + HCl RN+H3Cl- + NaOH
RN+H3Cl- (胺的鉴定) R-NH2 + NaCl+ H 2O(胺的提纯)
综合烷基的给电子诱导效应和空间位阻效应: 脂肪胺碱性排序:仲胺>伯胺>叔胺
7、写出由苯为原料制备氯化重氮苯的各步反应试剂、反应条件及产物;以及氯化重氮苯 中重氮基分别被-Cl、-CN、-OH、-H取代的反应试剂、反应条件及产物。根据这些总
8、写出氯化重氮苯发生偶联反应的反应试剂、反应条件及产物;偶联产物如何命名?根 据这些总结完成课后习题2(8);3(10);7(6); 第二节 酰胺
Br
NH 2
NH 2
Br
Br
N2Cl
Br
Br
Br
Br
Br2/CCl4
NaNO2/HCl
<5℃
Br
H3PO2
Br
H2O
Br
白色
苯胺 的鉴定
重氮盐的偶联反应
N2Cl +
湖南大学_有机化学及实验-第十一章教学课件

十一章 生物有机化合物一 基本要求掌握:糖、氨基酸、蛋白质、核酸的基本结构与性质 熟悉:糖、氨基酸、蛋白质基本性质与生理功能的关系 了解:蛋白质、核酸的结构与性质及功能11.1 碳水化合物碳水化合物(即糖类),按其能否水解和水解的产物情况可分为以下三类:(1) (1) 单 糖:不能水解的多羟基醛或多羟基酮。
例如葡萄糖、果糖和核糖。
(2) (2) 低聚糖: 水解后能生成2~10个分子单糖的化合物。
其中最重要的是二糖,例如蔗糖、麦芽糖、纤维二糖等。
(3) (3) 多 糖:水解后生成10个以上单糖分子的化合物。
例如淀粉、纤维素等。
11.1.1 单 糖11.1.1.1 单糖的结构通过对单糖化学性质的研究得知单糖既有开链式结构,又有环状结构。
1、开链式结构化学事实得知葡萄糖的开链式结构为:CH 2OHCH CH OHOHCH OHCH OHCHO用类似的化学方法证明果糖的开链式结构为五羟基-2-己酮。
CH 2OH CH CH OH OH CH OH C O CH 2OH在书写单糖的开链式结构时,一般将碳链竖写,羰基位于上端,碳链的编号从靠近羰基的一端开始。
单糖的开链式结构常用Fischer 投影式或更简单的式子表示。
右旋葡萄糖的结构可用Fischer 投影式或更简单的式子表示如下:或H CHO *OH *H HO *OH H *OHHCH 2OH CHO *OH*HO*OH *OHCH 2OHCHO****CH 2OH 或2、 2、 构型和标记法在碳水化合物中存在立体异构体,为了确定其构型一般采用D 、L 相对标记法和R 、S 绝对标记法。
D-(+)-甘油醛D-(+)-葡萄糖D-(-)-果糖L-(-)-甘油醛L-(-)-葡萄糖L-(+)-阿拉伯糖3、环状结构D-葡萄糖的两种正位异构体分别为α-D-(+)-葡萄糖和β-D-(+)-葡萄糖。
在溶液中环状结构与开链结构之间存在动态平衡。
HCHOOHHO HH OHH OHCH2OH6α-D-(+)-葡萄糖β-D-(+)-葡萄糖-葡萄糖在溶液中有α-和β-两种半缩醛结构,所以D-葡萄糖与甲醇生成两种苷,它们是α-D-(+)-甲基葡萄糖苷和β-D-(+)-甲基葡萄糖苷。
有机化学---第11章 酚和醌

h
10
1、酚羟基上的反应 (1)酚羟基的酸性
OH + NaOH
+ ONa
H2O
乙醇 水
苯酚 碳酸
pKa 17
15.7
10
6.38
注意:苯酚不能与NaHCO3反应; 应用:分离或鉴别醇或酚与羧酸。
+ + ONa
H2O
CO2
h
+ OH
NaHCO3
11
苯酚具有酸性的原因:
当苯酚形成苯氧负离子后, 该离子的共轭程度比苯酚还 要大,因此更稳定,故使酚 羟基显示出酸性。 取代酚的酸性:当苯环上连有强吸电子基时,会使苯 氧负离子中氧上的负电荷更分散,则结构就更稳定, 相应的取代苯酚的酸性比苯酚的酸性更强。反之则反。
CO CH3
OH
OH
OH O
+CH3COOH BF3
+
C CH3
O C CH3
h 95%
痕量
21
(5)与羰基化合物的缩合反应
苯酚活性位(邻、对位)上的氢可与羰基化合物
(醛、酮等)发生缩合反应。
OH
OH +HCHO 酸或碱
+ C H 2 O H
CH2OH
OH
反应历程:
O
+
H
HCH
OH
HC +
-H+
H
H2 / Ni 120~200℃,1~2MPa
制备尼龙-6、尼龙-66的原料
h
27
五、重要的酚 1、苯酚——俗名“石炭酸”
纯品为无色晶体,熔点45℃,易溶于65℃以上 的热水和有机溶剂中;有腐蚀性、杀菌性。工业上 可用于制树脂、染料和炸药。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-COOH, -SO3H, -COOR, -COX, -CONH2, -CN, -CHO, >C=O, -OH(醇), -OH(酚), -SH, -NH2, R烷基, -OR, -SR
OH
如:
称为对羟基苯磺酸
SO3H
第十一章 酚和醌
大学有机化学第11章
•要求深刻理解和熟练掌握的内容: 酚的构造和命名; 酚的化学性质。
•要求一般理解和掌握的内容: 酚的物理性质; 酚的制法。
难点: 苯环上不同取代基对苯酚酸性的影响。
大学有机化学第11章
11.1 酚的结构和命名
• 酚 —羟基(-OH)直接连在苯环上的化合物称为酚。
• 二苯基醚可用酚金属与芳卤衍生物作用而得
• 酚醚与氢碘酸作用,分解而得到原来的酚
大学有机化学第11章
有机合成中用来保 护酚羟基 P493
(3)酯的生成 • 酚与酸酐或酰氯作用可得
酚与羧酸直接 酯化困难
大学有机化学第11章
11.4.2 芳环上的亲电取代反应 • 羟基是强的邻对位定位基,使苯环活化。 (1)卤化反应—酚很容易发生卤化。
• 酚具有酸性的原因——氧原子以SP2(与醇醚不同)杂化轨道
参与成键,它的一对未共用电子的P轨道与苯环的6个P轨道平行, 并且共轭,氧原子的负电荷分散到整个公轭体系中,氧的电子云 密度降低,减弱了O-H键,氢原子容易离解成为质子。
• 酚具有极高的亲电反应活性的原因——氧原子的P电子分
散到苯环上,增加了苯环的大电学有子机云化学密第1度1章,加强了亲电反应活性。
大学有机化学第11章
•苯环上取代基对苯酚酸性的影响
吸电子基团(硝基)使 羟基氧上负电荷更好地 离域移向苯环(诱导和 共轭效应),生成更稳 定的对硝基苯氧负离子, 酸性增强。
pKa
吸电子基团的硝基愈 多,酸性愈强。
pKa
大学有机化学第11章
(2)酚醚的生成 (已学—威廉森合成p237) • 酚金属与烷基化剂在弱碱性溶液中作用可得
大•(学有注机意化学:第温11章度和氯用量,不用溶剂)
•2,4,6 -三氯苯酚的 生成
(水溶液)
•三氯化铁存在下 2,4,6 -三氯苯酚能 进一步氯化成五 氯苯酚
大学有机化学第11章
五氯苯酚是橡胶制品 的杀虫剂,药物
除草剂 (2,4-二氯苯氧基乙酸)的合成
由P257合成
作业:9(5)
大学有机化学第11章
多 硝 基 芳 卤
• 硝基活化氯原子的原因——分散中间体的负电荷:
大学有机化学第11章
11.2.3 从芳磺酸制备
碱 熔 法
• 成本高;当环上已有-COOH、-Cl、-NO2等基团时,
则副反应多。
大学有机化学第11章
补充1:间二酚的制备
补充2: -萘酚及其衍生物
165℃
大学有机化学第11章
11.3 酚的物理性质
羟基苯磺酸
4-羟基-1,3-苯二磺酸 2,4,6-三硝基苯酚
大学有机化学第11章
由苯酚合成:2,6-二溴苯酚
比较:作业P271:9(9)
大学有机化学第11章
(4)烷基化和酰基化反应 由于酚羟基的活化,酚比芳烃容易进行傅-克反应。注
•苯 酚 与 溴 水 作 用 , 生 成 2,4,6三溴苯酚白色 沉淀
白色沉淀 (~100%)
•溴水过量,生成黄色 的四溴苯酚析出
黄色沉淀
•邻、对位上有磺酸基 团时,可同时被取代
大学有机化学第11章
• 一元取代物对溴 苯酚的生成
(低温,非极性溶剂)
•对氯苯酚、邻氯 苯酚和2,4-二氯 苯酚的生成
2,4-二氯苯酚
大学有机化学第11章
11.2 酚的制法
11.2.1 从异丙苯制备
CH3 CH CH3
+ CH3CH=CH2 H2SO4
CH3 CH3 C O-O-H
绿色的合成 路线
OH
O2空气,110~120℃ 过氧化物
稀H2SO4 75~78℃
氢过氧化异丙苯
+CH3COCH3
1:0.6
反应历程:(1)自由基反应
•酚大多数为结晶固体。 • 酚的沸点和溶点高于质量相近的烃——氢键。 • 酚微溶于水,能溶于酒精,乙醚等有机溶剂。 酚的氢键
酚与水分子之间的氢键
酚与酚分子之间的氢键
大学有机化学第11章
11.4 酚的化学性质 11.4.1 酚羟基的反应 (1)酚的酸性——O-H键容易离解 • 极高的亲电反应活性——O-H基对苯环的供电性。
(2)硝化反应——酚很容易硝化
• 稀硝酸,室温
•浓硝酸,室温
因酚羟基和环易被浓硝酸氧化,产率很低,所以在氧化 时要对酚羟大基学有进机化行学第保11章护(P493)
•邻硝基苯酚和对硝基苯酚可 用水蒸气蒸馏 方法分开 注意这 种结构
•邻 硝 基 苯 酚 分 子 形成分子内六元环 的螯和物,对硝基 苯酚只能通过分子 间的氢键缔和。
• 醇与酚不同,没有电子的离域现象
• 苯酚的离域
大学有机化学第11章
酸性
苯酚:pKa=10 乙醇:pKa=17 环己醇:pKa=18 碳酸:pKa=6.4
• 苯酚能溶解于氢氧化钠水溶液
工业上利用苯酚能溶 于碱,而又可用酸分 离的性质来处理和回 收含酚废水。
• 通入二氧化碳,苯酚即游离出来
苯酚溶于NaOH, 不溶于NaHCO3
• 酚的分类 —按照酚类分子中所含羟基的数目多少,分 为一元酚和多元酚。
•酚的命名 —以苯酚作为母体,苯环上连接的其他基团 作为取代基。根据分子中羟基的数目,分为:一元酚、 二元酚、三元酚等。
大学有机化学第11章
一元酚
大学有机化学第11章
二元酚
三元酚
大学有机化学第11章
*带有优先序列取代基的命名:
大学有机化学第11章
11.2.2 从芳卤衍生物制备
Cl
O Na
注意反应 条件!
350~370℃,20MPa
+2NaOH
Cu催化剂
+NaCl +H2 O
ONa
OH
+ HCl
+NaCl
• 当卤原子的邻位或对位有强的吸电子基时,水解反应 容易进行。
单
硝
基
比较硝基对苯的
芳
亲电()取代反应
卤
难易的不同?
大学有机化学第11章
大学有机化学第11章
• 下列化合物哪些能形成分子内氢键?
(Ⅰ) 邻硝基苯酚; (Ⅱ)对羟基苯乙酮; (Ⅲ)邻氯苯酚 (Ⅳ) 间溴苯酚; (Ⅴ)邻氨基苯酚; (Ⅵ)邻羟基苯甲酸 (Ⅶ) 邻氯甲苯; (Ⅷ)邻羟基苯甲醛
解: (Ⅰ)、(Ⅲ)、(Ⅴ)、(Ⅵ)、(Ⅷ)能形成分子内氢键
大学有机化学第11章
(3)磺化反应
