药品经营质量管理规范28号令
药品经营质量管理规范(GSP)

药品经营质量管理规范2016年07月20日发布(2000年4月30日原国家药品监督管理局局令第20号公布2012年11月6日原卫生部部务会议第一次修订2015年5月18日国家食品药品监督管理总局局务会议第二次修订根据2016年6月30日国家食品药品监督管理总局局务会议《关于修改<药品经营质量管理规范>的决定》修正)第一章总则第一条为加强药品经营质量管理,规范药品经营行为,保障人体用药安全、有效,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范.第二条本规范是药品经营管理和质量控制的基本准则。
企业应当在药品采购、储存、销售、运输等环节采取有效的质量控制措施,确保药品质量,并按照国家有关要求建立药品追溯系统,实现药品可追溯。
第三条药品经营企业应当严格执行本规范。
药品生产企业销售药品、药品流通过程中其他涉及储存与运输药品的,也应当符合本规范相关要求.第四条药品经营企业应当坚持诚实守信,依法经营。
禁止任何虚假、欺骗行为.第二章药品批发的质量管理第一节质量管理体系第五条企业应当依据有关法律法规及本规范的要求建立质量管理体系,确定质量方针,制定质量管理体系文件,开展质量策划、质量控制、质量保证、质量改进和质量风险管理等活动。
第六条企业制定的质量方针文件应当明确企业总的质量目标和要求,并贯彻到药品经营活动的全过程。
第七条企业质量管理体系应当与其经营范围和规模相适应,包括组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统等.第八条企业应当定期以及在质量管理体系关键要素发生重大变化时,组织开展内审.第九条企业应当对内审的情况进行分析,依据分析结论制定相应的质量管理体系改进措施,不断提高质量控制水平,保证质量管理体系持续有效运行。
第十条企业应当采用前瞻或者回顾的方式,对药品流通过程中的质量风险进行评估、控制、沟通和审核。
第十一条企业应当对药品供货单位、购货单位的质量管理体系进行评价,确认其质量保证能力和质量信誉,必要时进行实地考察.第十二条企业应当全员参与质量管理。
最新版《药品经营质量管理规范》(28号令)与旧版(13号令)区别

(十)药品退货的管理; (十一)药品召回的管理; (十二)质量查询的管理;
(十三)质量事故、质量投诉的管理; (十四)药品不良反应报告的规定; (十五)环境卫生、人员健康的规定;
第五十七条 企业应当建立能够符合经营全过程管理 及质量控制要求的计算机系统,实现药品可追溯 第六十二条 对首营企业的审核,应当查验加盖其公章原印章的以下资料,确认真实、有 ((一二))《营药业品执生照产、许税可务证登》记或、者组《织药机品构经代营码许的可证证件》复复印印件件,;及上一年度企业年度报告公示情 况 (三)《药品生产质量管理规范》认证证书或者《药品经营质量管理规范》认证证书复印件; (四)相关印章、随货同行单(票)样式; (五)开户户名、开户银行及账号;
(二)从事验收、养护工作的,应当具有药学或者医学、生物、化学等相关专业中专以上 2 学历或者具有药学初级以上专业技术职称;
(三)从事中药材、中药饮片验收工作的,应当具有中药学专业中专以上学历或者具有中 药学中级以上专业技术职称;从事中药材、中药饮片养护工作的,应当具有中药学专业中 专以上学历或者具有中药学初级以上专业技术职称;直接收购地产中药材的,验收人员应 当具有中药学中级以上专业技术职称。 经营疫苗的企业还应当配备2名以上专业技术人员专门负责疫苗质量管理和验收工作,专业 技术人员应当具有预防医学、药学、微生物学或者医学等专业本科以上学历及中级以上专 业技术职称,并有3年以上从事疫苗管理或者技术工作经历。 第三十六条 质量管理制度应当包括以下内容: (一)质量管理体系内审的规定; (二)质量否决权的规定; (三)质量管理文件的管理; (四)质量信息的管理; (五)供货单位、购货单位、供货单位销售人员及购货单位采购人员等资格审核的规定; (六)药品采购、收货、验收、储存、养护、销售、出库、运输的管理; (七)特殊管理的药品的规定; (八)药品有效期的管理; (九)不合格药品、药品销毁的管理; (十)药品退货的管理; 3 (十一)药品召回的管理; (十二)质量查询的管理; (十三)质量事故、质量投诉的管理; (十四)药品不良反应报告的规定; (十五)环境卫生、人员健康的规定; (十六)质量方面的教育、培训及考核的规定;
《药品经营质量管理规范》2016年最新版

《国家食品药品监督管理总局关于修改〈药品经营质量管理规范〉的决定》(国家食品药品监督管理总局令第28号)已于2016年6月30日经国家食品药品监督管理总局局务会议审议通过,现予公布,自公布之日起施行。
第一章总则第一条为加强药品经营质量管理,规范药品经营行为,保障人体用药安全、有效,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
第二条本规范是药品经营管理和质量控制的基本准则。
企业应当在药品采购、储存、销售、运输等环节采取有效的质量控制措施,确保药品质量,并按照国家有关要求建立药品追溯系统,实现药品可追溯。
第三条药品经营企业应当严格执行本规范。
药品生产企业销售药品、药品流通过程中其他涉及储存与运输药品的,也应当符合本规范相关要求。
第四条药品经营企业应当坚持诚实守信,依法经营。
禁止任何虚假、欺骗行为。
第二章药品批发的质量管理第一节质量管理体系第五条企业应当依据有关法律法规及本规范的要求建立质量管理体系,确定质量方针,制定质量管理体系文件,开展质量策划、质量控制、质量保证、质量改进和质量风险管理等活动。
第六条企业制定的质量方针文件应当明确企业总的质量目标和要求,并贯彻到药品经营活动的全过程。
第七条企业质量管理体系应当与其经营范围和规模相适应,包括组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统等。
第八条企业应当定期以及在质量管理体系关键要素发生重大变化时,组织开展内审。
第九条企业应当对内审的情况进行分析,依据分析结论制定相应的质量管理体系改进措施,不断提高质量控制水平,保证质量管理体系持续有效运行。
第十条企业应当采用前瞻或者回顾的方式,对药品流通过程中的质量风险进行评估、控制、沟通和审核。
第十一条企业应当对药品供货单位、购货单位的质量管理体系进行评价,确认其质量保证能力和质量信誉,必要时进行实地考察。
第十二条企业应当全员参与质量管理。
各部门、岗位人员应当正确理解并履行职责,承担相应质量责任。
药品经营质量管理规范28号令GSP管理(共67张PPT)

03
0 2
药品经营企业应 当坚持诚实守信, 依法经营。禁止 任何虚假、欺骗 行为。
质量管理体系
依据有关法律法规及本规范的要 求建立质量管理体系,确定质量 方针,制定质量管理体系文件, 开展质量策划、质量控制、质量 保证、质量改进和质量风险管理 等活动。
质量管理体系
企业制定的质量方针文件应当明 确企业总的质量目标和要求,并 贯彻到药品经营活动的全过程。
第十七条 质量管理部门应当履行以下职责: (一)督促相关部门和岗位人员执行药品管理的法律法规及本规范; (二)组织制订质量管理体系文件,并指导、监督文件的执行; (三)负责对供货单位和购货单位的合法性、购进药品的合法性以及供货 单位销售人员、购货单位采购人员的合法资格进行审核,并根据审核内容 的变化进行动态管理; (四)负责质量信息的收集和管理,并建立药品质量档案; (五)负责药品的验收,指导并监督药品采购、储存、养护、销售、退货、 运输等环节的质量管理工作; (六)负责不合格药品的确认,对不合格药品的处理过程实施监督; (七)负责药品质量投诉和质量事故的调查、处理及报告; (八)负责假劣药品的报告; (九)负责药品质量查询; (十)负责指导设定计算机系统质量控制功能; (十一)负责计算机系统操作权限的审核和质量管理基础数据的建立及更 新; (十二)组织验证、校准相关设施设备; (十三)负责药品召回的管理; (十四)负责药品不良反应的报告; (十五)组织质量管理体系的内审和风险评估; (十六)组织对药品供货单位及购货单位质量管理体系和服务质量的考察 和评价; (十七)组织对被委托运输的承运方运输条件和质量保障能力的审查; (十八)协助开展质量管理教育和培训; (十九)其他应当由质量管理部门履行的职责。
冻药品的储存与运输管理;药品经营企业计算机系统;温湿度自 动监测;药品收货与验收;验证管理)
国家市场监督管理总局令第28号——药品生产监督管理办法

国家市场监督管理总局令第28号——药品生产监督管理办法文章属性•【制定机关】国家市场监督管理总局•【公布日期】2020.01.22•【文号】国家市场监督管理总局令第28号•【施行日期】2020.07.01•【效力等级】部门规章•【时效性】现行有效•【主题分类】药政管理正文国家市场监督管理总局令第28号《药品生产监督管理办法》已于2020年1月15日经国家市场监督管理总局2020年第1次局务会议审议通过,现予公布,自2020年7月1日起施行。
局长肖亚庆2020年1月22日药品生产监督管理办法(2020年1月22日国家市场监督管理总局令第28号公布)第一章总则第一条为加强药品生产监督管理,规范药品生产活动,根据《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国中医药法》、《中华人民共和国疫苗管理法》(以下简称《疫苗管理法》)、《中华人民共和国行政许可法》、《中华人民共和国药品管理法实施条例》等法律、行政法规,制定本办法。
第二条在中华人民共和国境内上市药品的生产及监督管理活动,应当遵守本办法。
第三条从事药品生产活动,应当遵守法律、法规、规章、标准和规范,保证全过程信息真实、准确、完整和可追溯。
从事药品生产活动,应当经所在地省、自治区、直辖市药品监督管理部门批准,依法取得药品生产许可证,严格遵守药品生产质量管理规范,确保生产过程持续符合法定要求。
药品上市许可持有人应当建立药品质量保证体系,履行药品上市放行责任,对其取得药品注册证书的药品质量负责。
中药饮片生产企业应当履行药品上市许可持有人的相关义务,确保中药饮片生产过程持续符合法定要求。
原料药生产企业应当按照核准的生产工艺组织生产,严格遵守药品生产质量管理规范,确保生产过程持续符合法定要求。
经关联审评的辅料、直接接触药品的包装材料和容器的生产企业以及其他从事与药品相关生产活动的单位和个人依法承担相应责任。
第四条药品上市许可持有人、药品生产企业应当建立并实施药品追溯制度,按照规定赋予药品各级销售包装单元追溯标识,通过信息化手段实施药品追溯,及时准确记录、保存药品追溯数据,并向药品追溯协同服务平台提供追溯信息。
药品经营质量风险评估控制管理制度

1.目的:对可能影响到公司药品经营质量的风险因素进行分析评估和控制,保证经营过程中药品质量;指导公司规避质量事故或危害事件的发生,及遇到类似事故时应采取的应急保障措施;依据GSP以及《质量风险管理Q9(R1)》制定本制度。
2.适用范围:本制度适用于公司质量管理体系内的质量风险管理。
3.责任:质管部:负责组织进行质量风险评估、控制、沟通管理工作。
各部门:负责本部门质量风险点识别排查、评估,并制定控制措施。
4.工作内容:4.1质量风险管理:是对药品在整个经营管理活动中采用前瞻或回顾的方式进行风险排查、危害源识别、风险分析、评价、控制、沟通的过程。
4.1.1前瞻式:假设某环节出现问题,预估发生的可能性,后果的严重程度;应该采取什么措施防范;预计采取措施后风险能降低到什么程。
4.1.2回顾式:每年根据上年度风险评估控制列表情况,检查上年度质量风险实际发生情况(含新引出的质量风险问题),后果情况,综合决策评价是否修订风险控制措施。
4.2质量风险启动:及时识别并控制潜在的质量风险,降低其发生概率。
4.2.1质量风险点排查:公司各部门应该根据风险管理方案风险项目对本部门风险点认真排查,要求每一位员工均应具有药品经营质量风险意识。
4.2.2风险项目:包括质量管理体系关键要素、企业基本经营情况以及药品采购、收货、验收、储存养护、出库复核、销售、运输配送等药品经营环节。
4.2.3可能存在的质量风险范围4.2.3.1公司基本经营情况:超范围经营、挂靠经营、经营不合格药品;4.2.3.2质量管理体系:组织机构设置及人员配备不全、不合格药品确认及处理不符合要求、质量管理体系文件不适用、未按规定组织内审、未对经营过程中质量风险进行评估;4.2.3.3人员、培训、健康体检:企业负责人学历不够未经过药学专业培训;质量负责人与许可证内容不一致、从业资格从业年限不够、不具备正确判断和保障实施能力、兼职;质管部长职业资格从业年限不符合要求、不能独立解决质量问题、未注册在本公司;质量管理人员不熟悉制度、操作规程、岗位职责、兼职;未按要求进行岗前、转岗、继续、专业培训、直接接触药品人员未进行体检、体检不合格仍在原岗位进行工作;4.2.3.4计算机系统:计算机系统与经营不适应、未对采购、收货、验收、储存养护、销售、出库复核等进行质量控制、硬件及网络配置不符合要求、系统登录操作不符合要求、数据修改未经过质管部审核、数据未按规定进行备份安全存放;4.2.3.5设施设备:仓储场所与经营规模相适应、是否安装有温湿度调控设备、温湿度自动监测系统、存放区域布局是否合理、运输设备是否与经营规模相适应、是否封闭等;4.2.3.6温湿度监控系统:安装位置数量是否符合要求、数据自动采集、记录、传输、报警功能是否符合要求;4.2.3.7验证和校准:未按验证方案实施验证,验证不符合要求,未根据验证确定的参数及条件,正确、合理使用相关设施设备;4.2.3.8药品采购、收货、验收、储存养护、出库复核、销售、运输等环节各种风险因素。
药品经营质量管理规范GSP培训

药学或相关专业中专学历或药 学初级职称;从事中药材、中 药饮片验收的,应具中药学中 专或中药学中级技术职称
药学或相关专业中专或药学初 级职称;从事中药材、中药饮 片养护工作的,应具有中药学 专业中专或中药学初级职称
企业负责人 质管部负责人
04
02
审批职责
对供货、购货单位和购进药品 的合法性以及购销人员合法资 格进行审核。
03
计算机权限
负责指导设定计算机系统质量 控制功能及操作权限的审核和 基础数据的建立及更新
报告职责
负责药品质量投诉和质量事故的调查、 处理及报告;假劣药品的报告;不良 反应的报告。
第三节:人员要求
大专或中级职称,经过基本的 药学专业知识培训,熟悉有关 药品管理的法律法规及本规范。
操作
*03201
文件的起草、修订、审核、批准、分发、保管,以及修改、撤销、 替换、销毁等应当按照文件管理操作规程进行,并保存相关记录。 文件应当标明题目、种类、目的以及文件编号和版本号。文字应当 准确、清晰、易懂。已失效的文件不得在工作现场出现。
质量体系文件类型
01
质量管理 制度
02
部门及岗 位职责
药品经营质量管理规范(GSP)
01 GSP的概述 发展历程、指导思想、管理理念
目录
CONTENTS
02 GSP的内容 药品经营质量管理法规条款 03 GSP存在的缺陷 飞行检查中发现的缺陷问题 04 解决问题的对策 企业该如何解决问题
我国实施药品GSP的简要回顾
GSP是Good Supply Practice的缩写 意思是良好的供应规范
人员培训要求
药品经营质量管理规范(2016最新版)

药品经营质量管理规范(2000年4月30日原国家药品监督管理局局令第20号公布 2012年11月6日原卫生部部务会议第一次修订 2015年5月18日国家食品药品监督管理总局局务会议第二次修订根据2016年6月30日国家食品药品监督管理总局局务会议《关于修改〈药品经营质量管理规范〉的决定》修正)第一章总则第一条为加强药品经营质量管理,规范药品经营行为,保障人体用药安全、有效,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
第二条本规范是药品经营管理和质量控制的基本准则.企业应当在药品采购、储存、销售、运输等环节采取有效的质量控制措施,确保药品质量,并按照国家有关要求建立药品追溯系统,实现药品可追溯。
第三条药品经营企业应当严格执行本规范。
药品生产企业销售药品、药品流通过程中其他涉及储存与运输药品的,也应当符合本规范相关要求。
第四条药品经营企业应当坚持诚实守信,依法经营。
禁止任何虚假、欺骗行为。
第二章药品批发的质量管理第一节质量管理体系第五条企业应当依据有关法律法规及本规范的要求建立质量管理体系,确定质量方针,制定质量管理体系文件,开展质量策划、质量控制、质量保证、质量改进和质量风险管理等活动。
第六条企业制定的质量方针文件应当明确企业总的质量目标和要求,并贯彻到药品经营活动的全过程。
第七条企业质量管理体系应当与其经营范围和规模相适应,包括组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统等.第八条企业应当定期以及在质量管理体系关键要素发生重大变化时,组织开展内审。
第九条企业应当对内审的情况进行分析,依据分析结论制定相应的质量管理体系改进措施,不断提高质量控制水平,保证质量管理体系持续有效运行。
第十条企业应当采用前瞻或者回顾的方式,对药品流通过程中的质量风险进行评估、控制、沟通和审核。
第十一条企业应当对药品供货单位、购货单位的质量管理体系进行评价,确认其质量保证能力和质量信誉,必要时进行实地考察。
《药品经营质量管理规范》第13号令与第28号令 修改内容对比
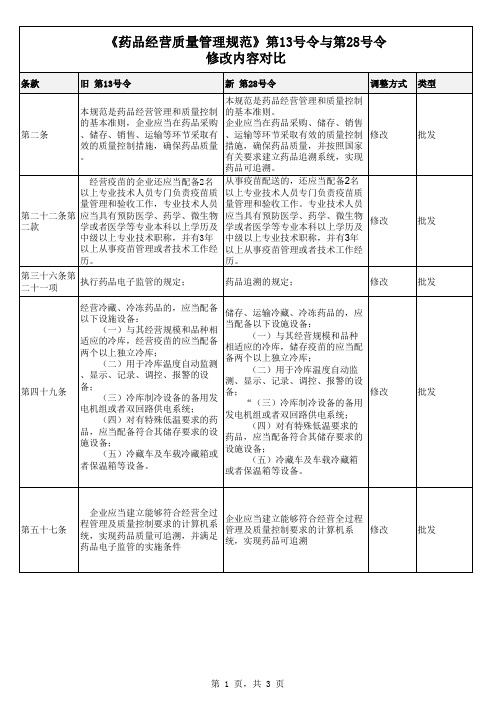
第二条
批发
经营疫苗的企业还应当配备2名 以上专业技术人员专门负责疫苗质 量管理和验收工作,专业技术人员 第二十二条第 应当具有预防医学、药学、微生物 二款 学或者医学等专业本科以上学历及 中级以上专业技术职称,并有3年 以上从事疫苗管理或者技术工作经 历。 第三十六条第 执行药品电子监管的规定; 二十一项 经营冷藏、冷冻药品的,应当配备 以下设施设备: (一)与其经营规模和品种相 适应的冷库,经营疫苗的应当配备 两个以上独立冷库; (二)用于冷库温度自动监测 、显示、记录、调控、报警的设 备; (三)冷库制冷设备的备用发 电机组或者双回路供电系统; (四)对有特殊低温要求的药 品,应当配备符合其储存要求的设 施设备; (五)冷藏车及车载冷藏箱或 者保温箱等设备。
批发
第一百三十ቤተ መጻሕፍቲ ባይዱ 执行药品电子监管的规定; 条
药品追溯的规定;
零售
第 2 页,共 3 页
《药品经营质量管理规范》第13号令与第28号令 修改内容对比
条款 旧 第13号令 新 第28号令 调整方式 类型
企业应当建立能够符合经营和质量 企业应当建立能够符合经营和质量 改为第一 第一百四十九 管理要求的计算机系统,并满足药 管理要求的计算机系统,并满足药 百四十六 条 品电子监管的实施条件。 品追溯的要求。 条 验收合格的药品应当及时入库或 者上架,实施电子监管的药品,还 验收合格的药品应当及时入库或者 改为第一 第一百六十一 应当按照本规范第八十一条、第八 上架,验收不合格的,不得入库或 百五十八 条 十二条的规定进行扫码和数据上 者上架,并报告质量管理人员处理 条 传,验收不合格的,不得入库或者 上架,并报告质量管理人员处理。 第一百七十六 对实施电子监管的药品,在售出 条 时,应当进行扫码和数据上传。 删除
药品验收管理制度

4.冷藏药品验收应向运输员索要运输的冷链记录,查看温湿度是否符合要求,并经双方签字存档。
5.实货验收完毕,要进行计算机验收并保存验收记录。
药品验收管理制度
目的:
保证进入门店的药品质量。依据:《药品经营量管理规范》(总局第28号令)
内容:
1.待验收的药品放于待验收位置,并作明显标记。
待验药品要按温度存储,验收普通药品应在待在24小时内按规定抽样验收,冷藏药品的验收要在30分钟内完成。
2.验收人员依照准以及随货同行凭证等,对所调拨药品进行逐批验收,做到票、帐、货相符。
药品经营质量管理规范28号令

药品经营质量管理规范2022 年 07 月 20 日发布(2000 年 4 月 30 日原国家药品监督管理局局令第 20 号发布 2022 年 11 月6 日原卫生部部务会议第一次修订 2022 年 5 月 18 日国家食品药品监督管理总局局务会议第二次修订根据 2022 年 6 月 30 日国家食品药品监督管理总局局务会议《关于修改〈药品经营质量管理规范〉的决定》修正)第一条为加强药品经营质量管理,规范药品经营行为,保障人体用药安全、有效,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
第二条本规范是药品经营管理和质量控制的基本准则。
企业应当在药品采购、储存、销售、运输等环节采取有效的质量控制措施,确保药品质量,并按照国家有关要求建立药品追溯系统,实现药品可追溯。
第三条药品经营企业应当严格执行本规范。
药品生产企业销售药品、药品流通过程中其他涉及储存与运输药品的,也应当符合本规范相关要求。
第四条药品经营企业应当坚持诚实守信,依法经营。
禁止任何虚假、欺骗行为。
第五条企业应当依据有关法律法规及本规范的要求建立质量管理体系,确定质量方针,制定质量管理体系文件,开展质量策划、质量控制、质量保证、质量改进和质量风险管理等活动。
第六条企业制定的质量方针文件应当明确企业总的质量目标和要求,并贯彻到药品经营活动的全过程。
第七条企业质量管理体系应当与其经营范围和规模相适应,包括组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统等。
第八条企业应当定期以及在质量管理体系关键要素发生重大变化时,组织开展内审。
第九条企业应当对内审的情况进行分析,依据分析结论制定相应的质量管理体系改进措施,不断提高质量控制水平,保证质量管理体系持续有效运行。
第十条企业应当采用前瞻或者回顾的方式,对药品流通过程中的质量风险进行评估、控制、沟通和审核。
第十一条企业应当对药品供货单位、购货单位的质量管理体系进行评价,确认其质量保证能力和质量信誉,必要时进行实地考察。
冷藏药品管理制度

冷藏药品管理制度
目的:通过冷藏药品的个质量环节管理,保证冷藏药品的质量。
依据:根据《药品管理法》及《药品经营质量管理规范》(总局第28号令)等
范围:适用本公司门店冷藏药品的存放全过程。
责任:门店所有上岗人员。
内容:
1.冷藏药品的收货应在冷藏或阴凉环境中进行,不得置于露天、阳光直射或周围影响环境温度的位置。
2.请调人员调拨冷藏药品,调拨药品时应与供货方约定冷藏药品的发货时间、运输方式、预计到达时间,并通知收货人员准备收货。
3.收货前应查看并确认运输过程中温度符合要求后才可接收货物,收货时药品要放入冷藏柜,索要查验在途温度记录合格。
移入冷藏柜待验区验收,收货应在药品到达后15分钟内进行。
拒收药品不能当时运走的要存放在冷柜中待处理并作明显标记。
4.冷藏药品验收要在到货30分钟内完成,验收人员须按照冷藏药品的温度要求及外观质量情况进行验收;如对质量有疑问要及时上报质量管理员进行夫查。
5.冷藏药品要存放于2-8℃温度的冷柜中,按种类分开摆放整齐。
6.销售冷藏药品时,营业员应在顾客结账并核对销售小票信息无误后,再将所售冷藏药品从冰箱中取出、交予顾客,并提醒顾客冷藏保存。
7. 冷藏药品在陈列检查时要重点检查。
8.冷藏设备出现故障时要在30分钟内通知配送中心,将药品返回配送中心暂存。
药品销售管理制度

目的:
加强药品销售环节的质量管理,按规定销售药品。
依据:
《药品经营质量管理规范》(总局第28号令)
内容:
1.在营业场所的显著位置悬挂《药的名称、规格、数量、价格核对无误后,将药品交与顾客。
3.在营业时间内,应有执业药师或药师在岗,所有从业人员应佩戴标明照片、姓名、岗位、从业资格等内容的胸卡。
7.药品拆零销售按照《药品拆零销售操作程序》执行。
8.不得采用有奖销售、附赠药品或礼品销售等方式销售药品。
9.不得销售国家规定不得零售的药品。
10.销售药品开具有药品名称、生产厂家、批号、规格、价格等内容的销售凭证。
11.严格执行先进先出,近期销出,易变先出的原则。
12. 销售的药品属于冷藏药品的,明确告知顾客。
4.顾客凭处方购药,按照药品处方调配管理要求执行,处方必须经药师审核签章后,方可调配,调配后进行复核无误方可交予顾客。
5.销售非处方药,可由顾客按说明书内容自行判断购买和使用,如果顾客提出咨询要求,药师应负责对药品的购买和使用进行指导。
6.销售近效期药品应当向顾客告知,销售的数量应在有效期前能正常使用完毕。
13.销售出的药品无质量问题,不得退货,应在店堂明示.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品经营质量管理规范2016年07月20日发布(2000年4月30日原国家药品监督管理局局令第20号公布 2012年11月6日原卫生部部务会议第一次修订 2015年5月18日国家食品药品监督管理总局局务会议第二次修订根据2016年6月30日国家食品药品监督管理总局局务会议《关于修改〈药品经营质量管理规范〉的决定》修正)第一章总则第一条为加强药品经营质量管理,规范药品经营行为,保障人体用药安全、有效,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。
第二条本规范是药品经营管理和质量控制的基本准则。
企业应当在药品采购、储存、销售、运输等环节采取有效的质量控制措施,确保药品质量,并按照国家有关要求建立药品追溯系统,实现药品可追溯。
第三条药品经营企业应当严格执行本规范。
药品生产企业销售药品、药品流通过程中其他涉及储存与运输药品的,也应当符合本规范相关要求。
第四条药品经营企业应当坚持诚实守信,依法经营。
禁止任何虚假、欺骗行为。
第二章药品批发的质量管理第一节质量管理体系第五条企业应当依据有关法律法规及本规范的要求建立质量管理体系,确定质量方针,制定质量管理体系文件,开展质量策划、质量控制、质量保证、质量改进和质量风险管理等活动。
第六条企业制定的质量方针文件应当明确企业总的质量目标和要求,并贯彻到药品经营活动的全过程。
第七条企业质量管理体系应当与其经营范围和规模相适应,包括组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统等。
第八条企业应当定期以及在质量管理体系关键要素发生重大变化时,组织开展内审。
第九条企业应当对内审的情况进行分析,依据分析结论制定相应的质量管理体系改进措施,不断提高质量控制水平,保证质量管理体系持续有效运行。
第十条企业应当采用前瞻或者回顾的方式,对药品流通过程中的质量风险进行评估、控制、沟通和审核。
第十一条企业应当对药品供货单位、购货单位的质量管理体系进行评价,确认其质量保证能力和质量信誉,必要时进行实地考察。
第十二条企业应当全员参与质量管理。
各部门、岗位人员应当正确理解并履行职责,承担相应质量责任。
第二节组织机构与质量管理职责第十三条企业应当设立与其经营活动和质量管理相适应的组织机构或者岗位,明确规定其职责、权限及相互关系。
第十四条企业负责人是药品质量的主要责任人,全面负责企业日常管理,负责提供必要的条件,保证质量管理部门和质量管理人员有效履行职责,确保企业实现质量目标并按照本规范要求经营药品。
第十五条企业质量负责人应当由高层管理人员担任,全面负责药品质量管理工作,独立履行职责,在企业内部对药品质量管理具有裁决权。
第十六条企业应当设立质量管理部门,有效开展质量管理工作。
质量管理部门的职责不得由其他部门及人员履行。
第十七条质量管理部门应当履行以下职责:(一)督促相关部门和岗位人员执行药品管理的法律法规及本规范;(二)组织制订质量管理体系文件,并指导、监督文件的执行;(三)负责对供货单位和购货单位的合法性、购进药品的合法性以及供货单位销售人员、购货单位采购人员的合法资格进行审核,并根据审核内容的变化进行动态管理;(四)负责质量信息的收集和管理,并建立药品质量档案;(五)负责药品的验收,指导并监督药品采购、储存、养护、销售、退货、运输等环节的质量管理工作;(六)负责不合格药品的确认,对不合格药品的处理过程实施监督;(七)负责药品质量投诉和质量事故的调查、处理及报告;(八)负责假劣药品的报告;(九)负责药品质量查询;(十)负责指导设定计算机系统质量控制功能;(十一)负责计算机系统操作权限的审核和质量管理基础数据的建立及更新;(十二)组织验证、校准相关设施设备;(十三)负责药品召回的管理;(十四)负责药品不良反应的报告;(十五)组织质量管理体系的内审和风险评估;(十六)组织对药品供货单位及购货单位质量管理体系和服务质量的考察和评价;(十七)组织对被委托运输的承运方运输条件和质量保障能力的审查;(十八)协助开展质量管理教育和培训;(十九)其他应当由质量管理部门履行的职责。
第三节人员与培训第十八条企业从事药品经营和质量管理工作的人员,应当符合有关法律法规及本规范规定的资格要求,不得有相关法律法规禁止从业的情形。
第十九条企业负责人应当具有大学专科以上学历或者中级以上专业技术职称,经过基本的药学专业知识培训,熟悉有关药品管理的法律法规及本规范。
第二十条企业质量负责人应当具有大学本科以上学历、执业药师资格和3年以上药品经营质量管理工作经历,在质量管理工作中具备正确判断和保障实施的能力。
第二十一条企业质量管理部门负责人应当具有执业药师资格和3年以上药品经营质量管理工作经历,能独立解决经营过程中的质量问题。
第二十二条企业应当配备符合以下资格要求的质量管理、验收及养护等岗位人员:(一)从事质量管理工作的,应当具有药学中专或者医学、生物、化学等相关专业大学专科以上学历或者具有药学初级以上专业技术职称;(二)从事验收、养护工作的,应当具有药学或者医学、生物、化学等相关专业中专以上学历或者具有药学初级以上专业技术职称;(三)从事中药材、中药饮片验收工作的,应当具有中药学专业中专以上学历或者具有中药学中级以上专业技术职称;从事中药材、中药饮片养护工作的,应当具有中药学专业中专以上学历或者具有中药学初级以上专业技术职称;直接收购地产中药材的,验收人员应当具有中药学中级以上专业技术职称。
从事疫苗配送的,还应当配备2名以上专业技术人员专门负责疫苗质量管理和验收工作。
专业技术人员应当具有预防医学、药学、微生物学或者医学等专业本科以上学历及中级以上专业技术职称,并有3年以上从事疫苗管理或者技术工作经历。
第二十三条从事质量管理、验收工作的人员应当在职在岗,不得兼职其他业务工作。
第二十四条从事采购工作的人员应当具有药学或者医学、生物、化学等相关专业中专以上学历,从事销售、储存等工作的人员应当具有高中以上文化程度。
第二十五条企业应当对各岗位人员进行与其职责和工作内容相关的岗前培训和继续培训,以符合本规范要求。
第二十六条培训内容应当包括相关法律法规、药品专业知识及技能、质量管理制度、职责及岗位操作规程等。
第二十七条企业应当按照培训管理制度制定年度培训计划并开展培训,使相关人员能正确理解并履行职责。
培训工作应当做好记录并建立档案。
第二十八条从事特殊管理的药品和冷藏冷冻药品的储存、运输等工作的人员,应当接受相关法律法规和专业知识培训并经考核合格后方可上岗。
第二十九条企业应当制定员工个人卫生管理制度,储存、运输等岗位人员的着装应当符合劳动保护和产品防护的要求。
第三十条质量管理、验收、养护、储存等直接接触药品岗位的人员应当进行岗前及年度健康检查,并建立健康档案。
患有传染病或者其他可能污染药品的疾病的,不得从事直接接触药品的工作。
身体条件不符合相应岗位特定要求的,不得从事相关工作。
第四节质量管理体系文件第三十一条企业制定质量管理体系文件应当符合企业实际。
文件包括质量管理制度、部门及岗位职责、操作规程、档案、报告、记录和凭证等。
第三十二条文件的起草、修订、审核、批准、分发、保管,以及修改、撤销、替换、销毁等应当按照文件管理操作规程进行,并保存相关记录。
第三十三条文件应当标明题目、种类、目的以及文件编号和版本号。
文字应当准确、清晰、易懂。
文件应当分类存放,便于查阅。
第三十四条企业应当定期审核、修订文件,使用的文件应当为现行有效的文本,已废止或者失效的文件除留档备查外,不得在工作现场出现。
第三十五条企业应当保证各岗位获得与其工作内容相对应的必要文件,并严格按照规定开展工作。
第三十六条质量管理制度应当包括以下内容:(一)质量管理体系内审的规定;(二)质量否决权的规定;(三)质量管理文件的管理;(四)质量信息的管理;(五)供货单位、购货单位、供货单位销售人员及购货单位采购人员等资格审核的规定;(六)药品采购、收货、验收、储存、养护、销售、出库、运输的管理;(七)特殊管理的药品的规定;(八)药品有效期的管理;(九)不合格药品、药品销毁的管理;(十)药品退货的管理;(十一)药品召回的管理;(十二)质量查询的管理;(十三)质量事故、质量投诉的管理;(十四)药品不良反应报告的规定;(十五)环境卫生、人员健康的规定;(十六)质量方面的教育、培训及考核的规定;(十七)设施设备保管和维护的管理;(十八)设施设备验证和校准的管理;(十九)记录和凭证的管理;(二十)计算机系统的管理;(二十一)药品追溯的规定;(二十二)其他应当规定的内容。
第三十七条部门及岗位职责应当包括:(一)质量管理、采购、储存、销售、运输、财务和信息管理等部门职责;(二)企业负责人、质量负责人及质量管理、采购、储存、销售、运输、财务和信息管理等部门负责人的岗位职责;(三)质量管理、采购、收货、验收、储存、养护、销售、出库复核、运输、财务、信息管理等岗位职责;(四)与药品经营相关的其他岗位职责。
第三十八条企业应当制定药品采购、收货、验收、储存、养护、销售、出库复核、运输等环节及计算机系统的操作规程。
第三十九条企业应当建立药品采购、验收、养护、销售、出库复核、销后退回和购进退出、运输、储运温湿度监测、不合格药品处理等相关记录,做到真实、完整、准确、有效和可追溯。
第四十条通过计算机系统记录数据时,有关人员应当按照操作规程,通过授权及密码登录后方可进行数据的录入或者复核;数据的更改应当经质量管理部门审核并在其监督下进行,更改过程应当留有记录。
第四十一条书面记录及凭证应当及时填写,并做到字迹清晰,不得随意涂改,不得撕毁。
更改记录的,应当注明理由、日期并签名,保持原有信息清晰可辨。
第四十二条记录及凭证应当至少保存5年。
疫苗、特殊管理的药品的记录及凭证按相关规定保存。
第五节设施与设备第四十三条企业应当具有与其药品经营范围、经营规模相适应的经营场所和库房。
第四十四条库房的选址、设计、布局、建造、改造和维护应当符合药品储存的要求,防止药品的污染、交叉污染、混淆和差错。
第四十五条药品储存作业区、辅助作业区应当与办公区和生活区分开一定距离或者有隔离措施。
第四十六条库房的规模及条件应当满足药品的合理、安全储存,并达到以下要求,便于开展储存作业:(一)库房内外环境整洁,无污染源,库区地面硬化或者绿化;(二)库房内墙、顶光洁,地面平整,门窗结构严密;(三)库房有可靠的安全防护措施,能够对无关人员进入实行可控管理,防止药品被盗、替换或者混入假药;(四)有防止室外装卸、搬运、接收、发运等作业受异常天气影响的措施。
第四十七条库房应当配备以下设施设备:(一)药品与地面之间有效隔离的设备;(二)避光、通风、防潮、防虫、防鼠等设备;(三)有效调控温湿度及室内外空气交换的设备;(四)自动监测、记录库房温湿度的设备;(五)符合储存作业要求的照明设备;(六)用于零货拣选、拼箱发货操作及复核的作业区域和设备;(七)包装物料的存放场所;(八)验收、发货、退货的专用场所;(九)不合格药品专用存放场所;(十)经营特殊管理的药品有符合国家规定的储存设施。
