菲布力说明书
盐酸非索非那定片说明书

核准日期:2021年4月12日修改日期:2021年6 月8日盐酸非索非那定片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:盐酸非索非那定片英文名称:Fexofenadine Hydrochloride Tablets汉语拼音:Yansuan Feisuofeinading Pian【成份】本品主要成份为盐酸非索非那定。
化学名称:2-[4-[(1RS)-1-羟基-4-(4-羟基二苯甲基)–哌啶-1-基)丁基]苯基]-2-甲基丙酸盐酸盐化学结构式:分子式:C32H39NO4·HCl分子量:538.13【性状】本品为浅红色胶囊型薄膜包衣片,一面刻有数字“012”,另一面刻有字母“e”,除去包衣后显白色。
【适应症】适用于缓解成人和12岁及12岁以上儿童的季节性过敏性鼻炎的相关症状。
如打喷嚏,流鼻涕,鼻、上腭、喉咙发痒,眼睛发痒、潮湿、发红。
【规格】120mg【用法用量】成人、12岁及12岁以上儿童:口服,一日一次,一次120mg,用水送服。
肾功能不全患者的推荐起始剂量为60mg,一日一次。
【不良反应】以下列出的不良反应的发生率采用如下定义:十分常见(≥10%);常见(≥1%,<10%);偶见(≥0.1%,<1%);罕见(≥0.01%,<0.1%);十分罕见(<0.01%);未知(依据现有数据而不能确定)。
在对季节性过敏性鼻炎等适应症进行的安慰剂对照临床研究中,与安慰剂相比,报告了以下不良事件,其发生率与安慰剂相当:各类神经系统疾病:常见:头痛(>3%),嗜睡(1-3%),头晕(1-3%)胃肠系统疾病:常见:恶心(1-3%)在对季节性过敏性鼻炎等适应症进行的所有对照临床研究中,报告了以下不良事件,其发生率低于1%且与安慰剂相似:胃肠系统疾病:未知:口干全身性疾病及给药部位各种反应:偶见:疲乏在成人中,在上市后监测期间报告了以下不良事件。
发生率未知,无法从现有数据中确定。
免疫系统疾病:已报告过敏反应,包括面部和颈部突然肿胀(血管神经性水肿),胸闷,呼吸困难,潮热和其它全身性速发过敏反应。
抗痛风新药菲布力
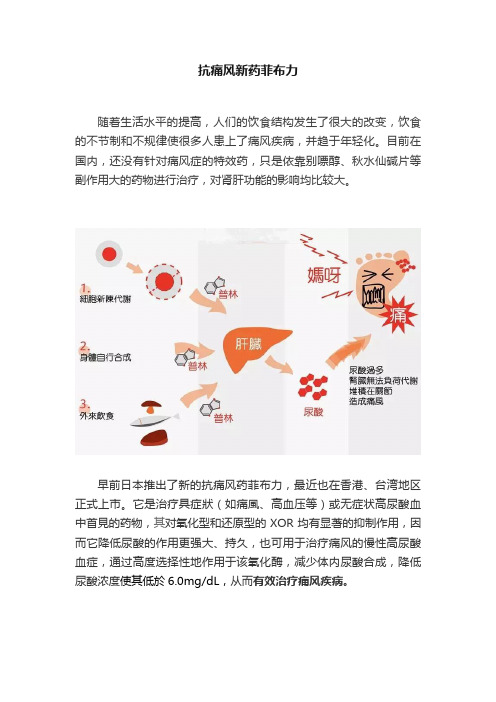
抗痛风新药菲布力随着生活水平的提高,人们的饮食结构发生了很大的改变,饮食的不节制和不规律使很多人患上了痛风疾病,并趋于年轻化。
目前在国内,还没有针对痛风症的特效药,只是依靠别嘌醇、秋水仙碱片等副作用大的药物进行治疗,对肾肝功能的影响均比较大。
早前日本推出了新的抗痛风药菲布力,最近也在香港、台湾地区正式上市。
它是治疗具症狀(如痛風、高血压等)或无症状高尿酸血中首見的药物,其对氧化型和还原型的XOR均有显著的抑制作用,因而它降低尿酸的作用更强大、持久,也可用于治疗痛风的慢性高尿酸血症,通过高度选择性地作用于该氧化酶,减少体内尿酸合成,降低尿酸浓度使其低於6.0mg/dL,从而有效治疗痛风疾病。
与别嘌醇相比,菲布力具有明显的优势:(1)别嘌醇只对还原型的XOR有抑制作用,而菲布力对氧化型和还原型的XOR均有显著的抑制作用,因而其降低尿酸的作用更强大、持久;(2)由于别嘌醇为嘌呤类似物,不可避免的造成涉及嘌呤及吡啶代谢其他酶活性的影响。
因此别嘌醇治疗中,需要重复大剂量给药来维持较高的药物水平。
由此也带来由于药物蓄积所致的严重甚至致命的不良反应。
而菲布力为非嘌呤类XOR抑制剂,所以具有更好的安全性。
一项多中心、双盲、随机Ⅱ期临床研究评价了菲布力的安全性和对痛风的疗效。
总共有136名男性和17名女性痛风病人随机接受安慰剂或本品(40、80或120mg/d),4周后检测发现,本品各剂量组病人血清尿酸浓度较治疗前均显著降低,按剂量由低至高各组分别平均降低37%、44%和59%,而安慰剂组病人仅降低了2%;绝大多数病人坚持完成了试验,本品和安慰剂组不良反应发生率相近,并且这些不良反应大多轻微,具有自限性,常见的有腹泻、疼痛、背痛、头痛和关节痛。
维安医生提醒:服用治疗痛风的新药,必须在医生的指导下进行,根据体质和病情状况给予合理的处方和使用方法,定期复诊,合理调整剂量,避免造成不必要的伤害,以到达最佳的治疗效果。
盐酸纳布啡注射液说明书

其他症状:吐字不清、尿急、视物模糊、面部潮红;
过敏反应:在使用纳布啡过程中可出现过敏反应。严重过敏反应也有报道,若出现了过敏反应应立即采取药物支持治疗。严重过敏反应包括休克、呼吸抑制、呼吸暂停、心动过缓、心跳骤停、低血压、喉头水肿。一些过敏反应可能危及生命。其他报道的典型的过敏反应有喘鸣、支气管痉挛、哮喘、水肿、皮疹、瘙痒、恶心、呕吐、发汗、乏力和寒战。
企业名称:宜昌人福药业有限责任公司
生产地址:湖北省宜昌开发区大连路18号
【儿童用药】目前还没有关于对18岁以下人群用药的安全性、有效性资料
【老年用药】目前还没有关于老年用药的安全性、有效性资料
【药物相互作用】尽管纳布啡有麻醉拮抗剂效应,但对于非依赖性病人,注射盐酸纳布啡不会很快就产生其麻醉镇痛拮抗作用。故麻醉性止痛剂、全麻药、苯二氮卓类或其他镇静、催眠药或其他中枢神经系统抑制药物(包括酒精)与本品同时给药时,会产生协同效应。当考虑联合用药时,应该减少其中一种或同时减少两种药物的剂量。
【药理毒理】药理作用
盐酸纳布啡是一种强效镇痛剂,以质量单位计,盐酸纳布啡的镇痛效果与吗啡基本相当。受体研究显示,纳布啡能与μ、κ和δ受体结合,而不与σ受体结合,纳布啡为κ受体激动剂/μ受体部分拮抗型镇痛药。盐酸纳布啡的阿片拮抗效应为烯丙吗啡的1/4,为喷它佐辛的10倍。盐酸纳布啡本身在剂量等于或低于其镇痛剂量时具有很强的阿片受体拮抗作用。
2.对从事有潜在危险性的工作,如驾驶、操作机器者,纳布啡会对其精力、体力带来一定影响。因此对上述工作者,使用本品时应慎重,避免产生危险。
3.急症用药应长期观察患者至完全康复,而不至因使用纳布啡而影响其驾驶或从事其他有潜在危险性的工作。
4.在脑损伤、颅内损伤或存在颅内压增高时用药,可致呼吸抑制作用和使用镇痛剂提高颅内压的效果(由于co2潴留所致的血管扩张)明显增强。此外,止痛剂的效应可掩盖临床脑外伤患者的病情。所有在此种情况下,仅在必要时才使用本药,且要十分谨慎。
Philips HeartStart FR2-Series Defibrillator 说明书

Philips HeartStart FR2-Series DefibrillatorSupplies and accessoriesProducts and services,maximizing defibrillator performanceQuick Reference GuideItem #M3860-97800The Quick Reference Guide is a briefinstruction guide for defibrillator operators.Its short captions and straightforward drawings break down each step of the defibrillation process.Carry CasesThere are four carry cases available for the HeartStart FR2-Series Defibrillator:the Standard Carry Case,either semi-rigid cordora or vinyl;the Temperature Control Carry Case;and the hard-shell waterproof case.FR2-Series Carry CaseSemi-rigidItem #M3868AA red cordura,semi-rigid carrying case(M3868A) holds the device as well as its main accessories and supplies.VinylItem #M3869AAn easy-to-clean vinyl carrying case (M3869A) is also available.Both the cordura and vinyl carrying cases are intended for use in environments where the defibrillator is protected from moisture and harsh treatment.Dimensions:9.5" (24 cm) w X 8.5" (21 cm) h X 4.8" (12 cm) dFast Response KitItem #68-pchatThe Fast Response Kit contains tools and supplies typically needed for patient care and personal protection:2 pairs of hypoallergenic nitrile gloves,a pocket breathing mask,paramedic scissors,a chest hair razor,and a large extra-absorbent paper towel.These items are housed in a zippered pouch which attaches securely to the handle of either the semi-rigid or vinyl carry case.Dimensions:9.5" (24 cm) w X 5.5" (14 cm) hTemperature Control Case Item #989803133171With the T emperature Control Carrying Case (989803133171),you can safely store your HeartStart FR2-Series Defibrillator in the trunk or storage compartment of a vehicle during extreme winter and summer temperatures.It provides protection from temperatures as low as –20°F (-29ºC) and as high as 140°F(60ºC),perfect for utility trucks,police cruisers and other vehicles in which heating or air conditioning isn’t always available.The case’s thermostat-regulated heater can be powered by a 12-volt vehicle battery.The built-in cut-off module turns off the heater before it depletes the battery.And a thick foam insulation layer slows the heating effect of hot summer days.Dimensions:9.5" (24 cm) w X 8.5" (21 cm) h X 3.5" (9 cm) dHard-shell Carry Case Item #YCOur waterproof carry case made of hard-shell plastic (product code YC)is suited for more rigorous use,particularly in wet outdoor settings.It can also accommodate the contents of the Fast Response Kit.Dimensions:13.5" (34 cm) w X 12" (30 cm) h X 6" (15 cm) d*The Americans with Disabilities Act requires that objects not protrude more than 4 inches into foot traffic areas of openaisles and walkways unless the object’s bottom edge is no higher than 27 inches from the ground.Premium Surface Mounted Cabinet Item #PFE7024DDimensions:16" (41 cm) w X 22.5" (57 cm) h X 6" (15 cm) dPremium Semi-recessed Cabinet Item #PFE7023DDimensions:Recessed Compartment –14" (36 cm) w X 22" (56 cm) h X 6" (15 cm) d Footprint on wall –16.5" (42 cm) w X 24.5" (62 cm) h X 2.5" (6 cm) dBasic Surface Mounted Cabinet Item #989803136531Dimensions:16.5" (42 cm) w X 15" (38 cm) h X 6" (15 cm) dWall Mounting SolutionsPhilips Wall Mount Bracket and Defibrillator Cabinets let you strategically place defibrillators for fast access and response.Wall Mount Bracket Item #M3857ADimensions:10.6" (270 mm) w X 8" (204 mm) h X 5" (126 mm) d Weight:19 ounces (.5 kg)Item #M3859A Secure-pull SealWall Mount BracketThe Wall Mount Bracket (M3857A) is designed specifically for housing a Philips HeartStart Defibrillator and its accessories.Thedefibrillator’s carry case can be tethered to the Wall Mount Bracket with a breakaway Secure-Pull Seal (M3859A),to discourage tampering.A broken seal indicates that the defibrillator has been removed from the Wall Mount and accessories may need to be replenished.Defibrillator CabinetsT o mobilize an emergency medical response or deter AED theft,Philips offers 3 different battery-operated,alarmed wall cabinets.The basic cabinet has a simple audible alarm.Also available are two premium cabinets:a wall surface mounted cabinet and a semi-recessed cabinet* that is inserted into a wall cut-out for a less obtrusive look.The premium cabinets feature combination audible and flashing light alarms.They are made of sturdy heavy-gauge steel,and are large enough to accommodate additional medical supplies,such as oxygen.Y ou can also connect the premium cabinets’alarms to your internal security system so that a more coordinated emergency response can be mobilized centrally.AED Wall Sign Item #M3858AAn AED Wall Sign (M3858A) hanging above a Wall Mount Bracket or Defibrillator Cabinet gives even greater visibility to the defibrillator.Dimensions:7" (18 cm) w X 10" (25.5 cm) hPads and AdaptersHeartStart Adult AED Defibrillator Pads Item # DP2/DP6HeartStart Adult AED Defibrillator Pads (DP2 and DP6),recommended for patients 8years and older,or above 55 pounds (25kg),are optimized for use with Philips FR2-series defibrillators.Constructed of a thin flexible conductor sandwichedbetween a protective polymer backing and a hydro-gel adhesive,these pads withstand the rigors of CPR and harsh conditions.Soft,flexible and oval-shaped,HeartStart Adult AED Pads conform to body contours for ample surface contact and adhesion.For smooth handoff to advanced life support (ALS) personnel,the pads connector is compatible with the hands-free cable of HeartStart manual defibrillators which have advanced capabilities.Once attached,these multifunction electrode pads can provide ECG monitoring,external pacing,and synchronized cardioversion,in addition to defibrillation.FR2 Infant/Child Reduced-Energy Defibrillator Pads Item # M3870AHeartStart FR2 Infant/Child Defibrillator Pads (M3870A) are for treating infants and children under 8 years of age or 55 pounds with an FR2-series defibrillator.These special infant/child pads contain electronics that attenuate,or reduce,the energy of the defibrillator’s shock from 150to 50 Joules,a more appropriate dosage of SMART Biphasic therapy for infants and small children.1And the FR2-seriesdefibrillator can evaluate children’s heart rhythms with outstanding accuracy.2The pads’ design was carefully thought out to ensure that,even for the most inexperienced user under the most stressful circumstances,it is instantly obvious that these pads are for children and infants only.This helps ensure that the correct pads are chosen when you need to be prepared to treat both adults and children.The packaging,graphics,and pink teddy bear-shaped connector clearly communicate pediatric use.1.T ang,et al.Pediatric Fixed Energy Biphasic Waveform Defibrillation Using a Standard AED and Special Pediatric Electrodes.Supplement to Circulation,Vol 102,No 18,October 31,2000,II-437.2.Cecchin,et al.Is Arrhythmia Detection by Automatic External Defibrillator Accurate for Children?Sensitivity and Specificity of an AED Algorithm in 696 Pediatric Arrhythmias.Circulation 2001;103:2483-2488,May 22,2001.HeartStart AdaptersHeartStart Adult AED Defibrillator Pads may also be used with defibrillators from other manufacturers,using Philips HeartStart Adapters,whether defibrillators are biphasic or monophasic,manual or automated.The adapters allow ALScaregivers to connect the pads to their manual defibrillator.Adapters cannot be used with FR2 Infant/Child Defibrillator Pads.Permanent ConfigurationRemovable ConfigurationAdapter Model 05-10200Fits Philips hands-free cables M3507A or M1750A/B for connection to Hewlett-Packard CodeMaster 100,XE,XL,and XL+;PhilipsHeartstream/HeartStart XL and XLT;HeartStart MRx and Laerdal Heartstart 4000 defibrillator/monitorsAdapter Model 05-10000Removable adapter for Medtronic Physio-Control Quik-Combo LifePak 9,10C,11,12,20,and 500 defibrillatorsAdapter Model 05-10100Removable adapter for Zoll 1200,1400,1600 and M-Series defibrillatorsFR2-Series Standard Battery Item #M3863AFR2-series defibrillators come with adisposable lithium manganese dioxide battery (M3863A),which has a shelf life of 5 years,plus typical standby life of 5 years (4 years minimum).**U.S.airline customers should order the FAA-certified version of this battery (989803136291).Power SuppliesFR2+ Rechargeable Battery Item #M3848AIn hospital and EMS environments,where the useful life of a defibrillator’s disposable battery can be consumed in a relatively short period of time,the FR2+ Rechargeable Battery(M3848A) provides a cost-effective option for frequent-use applications,such as back-to-back sudden cardiac arrest responses and monitoring patients during transport.This Lithium-Ion battery fully charges(using the Charger M3849A) in just 3 hours to provide 100 shocks (typical) or 5 hours (typical) of ECG display time.The “fuel gauge”on the FR2+ displays the battery’s remaining power.Under normal conditions,the FR2+Rechargeable Battery withstands 300 charge-discharge cycles or 2.5 years of use.** Use of the defibrillator,additional battery insertion tests,or exposure to temperature extremes may shorten the battery life.*** FR2+ ECG screen is not suitable for diagnostic and ST -segment interpretation.FR2+ ECG Assessment ModuleIdeal where manual defibrillators and monitors are impractical,the Philips FR2+ ECGAssessment Module enables the professional responder to use the HeartStart FR2+Defibrillator with ECG to assess the heart rhythms of conscious and/or breathing patients who may be in cardiac distress.With this reusable unit,caregivers knowledgeable in ECG rhythms can use the defibrillator’s display to view the Lead II ECG rhythm of a patient who may be experiencing dizziness,chestdiscomfort,or becomes unconscious but is still breathing.***If arrhythmias are observed or the patient’s status changes,the responder can proactively determine next steps.And if the patient goes into cardiac arrest,the responder can react immediately by switching to defibrillation pads.The FR2+ ECG Assessment Module,compatible with most standard snapmonitoring electrodes,including M2202A (radioluscent foam),is available in two configurations:Item #M3873AAAMI color convention with red,white and black leadwire connections.Item #M3874AIEC color convention with green,red and yellow leadwire connections.Training SolutionsTraining and Administration Pack When equipped with the rechargeable training and administration pack (M3864A),the FR2-series defibrillator acts as a trainer.Its shock delivery capability is disabled while you train with nine realistic scenarios.And whenconnected to a simulator or a special training manikin capable of producing an ECG rhythm,the FR2+ with training and administration pack will produce realistic responses to various heart rhythms.In addition to training,the pack allows you to reconfigure the defibrillator’s behavior to your specific cardiac arrest protocol.*AED Trainer 2For training many responders simultaneously,HeartStart AED T rainer 2 (M3752A) is a more flexible and economical solution.AED T rainer 2 helps your responders learn to use FR2-series defibrillators in simulated sudden cardiac arrest episodes for an extremely realistic training experience.AED T rainer 2looks and behaves like the FR2-series defibrillators,but cannot deliver an actual defibrillation shock.It is pre-configured with 10 realistic training scenarios,developed in accordance with internationally recognized emergencyresponder training programs.Voice prompts in various languages and additional customscenarios can be configured using the optional programming kit (M3754A).An optional remote control (M3753A) lets the instructor adjust the T rainer’s volume,select a scenario,pause and then resume the scenario in progress to give instruction,and override the scenario to test how students respond to a variety of situations they may encounter.The AED T rainer 2 comes equipped with one set of adult-size reusable training pads (07-10900),a quick reference instruction card,a user guide,and a carrying case.HeartStart AED Trainer 2Item # M3752ARemote Control Item # M3753ATraining and Administration Pack with ChargerItem # M3864A with M3855AProgramming Kit Item # M3754AHeartStart Training PadsItem #07-10900*Changes to default values should be done only by authorized personnel under the oversight of a medical professional.FR2 infant/Child Training Pads Item # M3871AAED Little Anne Training System Also available is the all-in-one AED Little Anne T raining System (M3756A),for added realism.In addition to the AED T rainer 2, quick reference card,user guide,and carrying case,this total training solution also includes the remote control,special training pads (M3755A) and a Laerdal AED Little Anne training manikin.The T rainer,AED Little Anne manikin,and special training pads work together to provide feedback on the quality of pads placement.Instructor's Training Toolkit The training toolkit (M5066-89100) includes instructional aids,such as a videotape and CD with a PowerPoint presentation,for teaching groups of people to operate the HeartStart FR2-series defibrillator.Data Collection and StorageData Card and TrayItem #M3854AThe data card (M3854A) holds approximately 8 hours of incident and ECG information,or one hour with voice recording.One card can hold data from multiple cases.A flash data card reader enables data transfer from the card to a personal computer for use with HeartStart Event Review data management software.Event ReviewItem #M3834A (single PC)or 989803141811 (organization-wide)Event Review allows you to download patient data from your defibrillator,and view it on your PC screen,annotate it with your comments,and add basic response and patient status information. Y ou can save the case to a file or to a database,allowing ad hoc case queries and case reports.It is available with single PC pricing or unlimited organization-wide pricing.Event Review ProItem #861276 Opt A01Event Review Pro is our comprehensive case management tool for the most demanding data managers and medical directors,with even more detailed data entry screens to record every aspect of the response, including detailed response times,interventions,and patient observations.In addition to the individual case reports,you get Utstein reporting and graphical summaries of your system’s overall response times to help you manage your service levels more efficiently.Philips Medical Systems is part of Royal Philips Electronics/heartstart*******************Philips Medical Systems3000 Minuteman RoadAndover,MA 01810-1085+1800 934-7372©Koninklijke Philips ElectronicsN.V.2005.All rights reserved.Reproduction in whole or in partis prohibited without prior writtenconsent of the copyright holder.Philips Medical Systems NorthAmerica Corporation reservesthe right to make changes inspecifications or to discontinue anyproduct at any time without noticeor obligation and will not be liablefor any consequences resultingfrom the use of this publication.Philips is a registered trademark ofKoninklijke Philips Electronics N.V.Printed in The Netherlands.4522 962 06871/861 * AUG 2005HeartStart EssentialsPhilips helps implement a comprehensive program with most everything you and your medical director will need to help save a life from sudden cardiac arrest.We’ll get you started with pre-implementation consulting and site assessments.We can help manage your everyday needs including medical direction from a licensed physician,web-based program management,data management software,and responder and instructor training.Philips offers ongoing support with a five-year warranty,optional extended warranty and continued customer support from supplies ordering to technical assistance.Philips Medical SuppliesPhilips is committed to producing and supporting the finest quality medical equipmentand supplies.Our supplies are thoughtfully designed,tested and manufactured todeliver reliable and accurate results from your HeartStart Defibrillators.For a completelist of supplies,please visit .。
非布司他片的说明书与用法

非布司他片的说明书与用法
非布司他片是一种常用的药物,以下是关于非布司他片的说明书和使用方法。
非布司他片是一种用于治疗高血压的药物。
它属于一类称为ARB(血管紧张素Ⅱ受体拮抗剂)的药物。
非布司他片通过阻断血管紧张素Ⅱ受体,可以舒张血管,降低血压。
它还可以减轻心脏的负担,改善血液循环。
非布司他片的使用方法是口服。
通常建议每天固定时间服用一次,可以选择早晨或晚上,最好在餐后服用。
服药时,可以用水将片剂吞服,不建议咀嚼或咬碎药片。
服药的剂量根据患者的具体情况而定,应由医生根据患者的血压和健康状况来决定。
在使用非布司他片期间,应遵循以下注意事项。
首先,患者不应停止使用非布司他片,除非得到医生的指导。
如果在使用过程中出现副作用或其他不适症状,应及时告知医生。
此外,患者还应注意定期到医院复查血压,确保药物的疗效。
使用非布司他片期间,应避免过量饮酒和食用盐分过多的食物,以保持血压的稳定。
非布司他片虽然对大部分患者是有效且安全的,但并不适用于所有人。
孕妇、哺乳期妇女、严重肝功能受损的患者、幼儿和儿童等特殊人群需要遵循医生的特定建议。
非布司他片是一种有效且常用的药物,用于治疗高血压。
正确遵循医生的指导,在合适的剂量下使用,可以帮助控制血压、改善心血管健康。
如果在使用非布司他片中有任何不适或疑问,应及时咨询医生。
(凯纷) 氟比洛芬酯注射液说明书

氟比洛芬酯注射液药品名称:通用名称:氟比洛芬酯注射液英文名称:Flurbiprofen Axetil Injection商品名称:凯纷成份:氟比洛芬酯适应症:术后及癌症的镇痛。
规格:5ml:50mg用法用量:通常成人每次静脉给予氟比洛芬酯50mg,尽可能缓慢给药(1分钟以上) ,根据需要使用镇痛泵,必要时可重复应用。
并根据年龄、症状适当增减用量。
一般情况下,本品应在不能口服药物或口服药物效果不理想时应用。
不良反应:1.严重不良反应:罕见休克、急性肾衰、肾病综合征、胃肠道出血、伴意识障碍的抽搐。
2.在氟比洛芬的其他制剂的研究中还观察到以下严重不良反应:罕见再生障碍性贫血、中毒性表皮坏死症(Lyell综合症) 、剥脱性皮炎。
3.一般的不良反应:1.注射部位:偶见注射部位疼痛及皮下出血;2.消化系统:有时出现恶心、呕吐,转氨酶升高,偶见腹泻,罕见胃肠出血;3.精神和神经系统:有时出现发热,偶见头痛、倦怠、嗜睡、畏寒;4.循环系统:偶见血压上升、心悸;5.皮肤:偶见瘙痒、皮疹等过敏反应;6.血液系统:罕见血小板减少,血小板功能低下。
禁忌:1.已知对本品过敏的患者。
2.服用阿司匹林或其他非甾体类抗炎药后诱发哮喘、荨麻疹或过敏反应的患者。
3.禁用于冠状动脉搭桥手术(CABG)围手术期疼痛的治疗。
4.有应用非甾体抗炎药后发生胃肠道出血或穿孔病史的患者。
5.有活动性消化道溃疡/出血,或者既往曾复发溃疡/出血的患者。
6.重度心力衰竭患者、高血压患者。
7.严重的肝、肾及血液系统功能障碍患者。
8.正在使用依诺沙星、洛美沙星、诺氟沙星的患者。
警告:以下患者禁用:1.已知对本品过敏的患者。
2.服用阿司匹林或其他非甾体类抗炎药后诱发哮喘、荨麻疹或过敏反应的患者。
3.禁用于冠状动脉搭桥手术(CABG)围手术期疼痛的治疗。
4.有应用非甾体抗炎药后发生胃肠道出血或穿孔病史的患者。
5.有活动性消化道溃疡/出血,或者既往曾复发溃疡/出血的患者。
非布司他片说明书

非布司他片说明书【药品名称】通用名称:非布司他片商品名称:_____英文名称:Febuxostat Tablets【成份】本品主要成份为非布司他。
【性状】本品为薄膜衣片,除去包衣后显白色或类白色。
【适应症】适用于痛风患者高尿酸血症的长期治疗。
不推荐用于无临床症状的高尿酸血症。
【规格】_____mg/片【用法用量】推荐起始剂量为 40mg,每日 1 次。
如果 2 周后血尿酸水平仍不低于 6mg/dl(约360μmol/L),建议剂量增至 80mg,每日 1 次。
给药时,无需考虑食物和抗酸剂的影响。
【不良反应】常见的不良反应包括肝功能异常、恶心、关节痛、皮疹等。
1、肝功能异常:可能会出现转氨酶升高、黄疸等情况。
如果发现肝功能异常,应及时就医并进行相关检查。
2、恶心:部分患者在用药后可能会感到恶心、呕吐,通常症状较轻,可自行缓解。
3、关节痛:可能会出现原有痛风症状的短暂加重,这是由于血尿酸水平的变化引起的,一般会逐渐减轻。
4、皮疹:少数患者可能会出现皮疹,如症状严重或持续不缓解,应停止用药并就医。
【禁忌】1、对本品成份过敏者禁用。
2、正在接受硫唑嘌呤、巯嘌呤治疗的患者禁用。
【注意事项】1、开始应用本品治疗后,可观察到痛风发作增加。
这是由于血尿酸水平的改变导致尿酸盐活动引起的。
为预防治疗初期的痛风发作,建议同时服用非甾体抗炎药或秋水仙碱。
2、在使用本品期间,如果出现胸痛、呼吸急促、心跳过快或不规则、身体一侧麻木或无力、头晕、说话困难、突然剧烈头痛等症状,应立即就医,因为这些可能是心血管疾病的症状。
3、用药期间应定期监测血尿酸水平、肝功能、血常规等指标。
4、轻至中度肾功能损害患者无需调整剂量,但严重肾功能损害患者(肌酐清除率低于 30ml/min)应慎用,需要在医生的指导下调整剂量。
5、有心血管疾病病史或新诊断的心血管疾病患者,应谨慎使用,并密切监测心血管事件。
6、孕妇及哺乳期妇女用药:孕妇:尚未有充分的研究证明本品在孕妇中的安全性,只有在确认潜在益处大于对胎儿的潜在风险时,方可在孕期使用。
博力飞粘度计说明书pdf

cP 872.0 10.0 RPM %
图6
S01 87.2
注意 1. 在选择转子或转速的时候 DV-I+就根据新设定的转子和转速计算粘度值 即刻显示出来
2. 当电源关掉时 DV-I+粘度计会将当前使用的转速保存下来
Brookfield Engineering Labs., Inc.
Page 6
Manual No. M/92-021-L1199
Manual No. M/92-021-L1199
II.2 SELECT SPINDLE
选择转子
LVDV-I+粘度计提供 4 个一套的转子和一个窄的护腿 RVDV-I+粘度计提供 7 个一套的 转子和一个宽的护腿 HADV-I+和 HBDV-I+粘度计都提供 7 个一套的转子 没有护腿 参 阅附录 E 部分了解关于护腿的更详细的资料
DV-I+型粘度计采用液晶显示 显示信息包括粘度 扭矩 转子号/转速 温度 用可选 件 RTD 温度探针时有显示 等 0-10mV 和 0-1V 的模拟信号输出端口可用于连接外部显示器 件和图表绘制仪
Brookfield Engineering Labs., Inc.
Page 1
Manual No. M/92-021-L1199
所显示的数值会因所选择的的计算单位 CGS 或 SI 而异 1 粘度 可以显示 cP 或 mPa.s 值 2 扭矩 以最大弹簧扭矩的百分比表示
计算单位互换
粘度 扭矩
国际单位
1mPa.s
=
1 Newton-m =
CGS
1cP 107dyne-cm
I.3 组件
名称 DV-I+粘度计 S 型实验室用支架
蛋白琥珀酸铁口服溶液(菲普利)的说明书

蛋白琥珀酸铁口服溶液(菲普利)的说明书合理饮食,正常的作息时间,这是保持健康身体的首要条件。
如今的生活质量提高了,许多人在饮食方面喜欢偏食,这样是不利于身体健康的。
因此,我们需要用药物来不充体内的微量元素。
今天我们就为您介绍一种叫做蛋白琥珀酸铁口服溶液(菲普利)的药物,它可以有效不充各种人体所需的微量元素。
【药品名称】通用名称:蛋白琥珀酸铁口服溶液商品名称:蛋白琥珀酸铁口服溶液(菲普利)英文名称:Iron Proteinsuccinylate Oral Solution拼音全码:DanBaiHuPoSuanTieKouFuRongYe(FeiPuLi)【主要成份】本品主要成份为蛋白琥珀酸铁800毫克(相当于三价铁40毫克)。
【性状】本品为深红色液体;气芳香,味甜。
【适应症/功能主治】绝对和相对缺铁性贫血的治疗,由于铁摄入量不足或吸收障碍、急性或慢性失血以及各种年龄患者的感染所引起的隐性或显性缺铁性贫血的治疗,妊娠与哺乳期贫血的治疗。
【规格型号】15ml*10瓶【用法用量】本品均由口服。
成人:每天1-2瓶(相当于三价铁40-80毫克),遵医嘱分两次在饭前口服。
儿童:每天按体重1.5毫升/公斤(相当于每天三价铁4毫克/公斤体重),应遵医嘱分两次于饭前口服。
【不良反应】偶有发生。
尤其用药过量时易发生胃肠功能紊乱(如腹泻、结肠痉挛、恶心、呕吐、上腹部疼痛),在减量或停药后可消失。
【禁忌】对本药品过敏者以及含铁血黄素沉着、血色素沉着、再生障碍性贫血、溶血性贫血、铁利用障碍性贫血、慢性胰腺炎合肝硬化患者禁用。
【注意事项】在开始治疗前,应先找出产生贫血的原因。
本品尤其适用于妊娠与哺乳期妇女贫血的治疗。
本品不会影响病人的反应(驾驶及机器的操作)。
本品不会引起成瘾性,除了持续性出血、月经过多及怀孕外,不应服用本品超过六个月。
【儿童用药】儿童每天按体重1.5毫升/公斤(相当于每天三价铁4毫克/公斤体重),应遵医嘱分两次于饭前口服。
氟苯丙胺说明书

氟苯丙胺说明书
【别名】安德力减肥丸;芬美啉片;盐酸氟苯丙胺 ,盐酸芬氟拉明
【外文名】Fenfluramine
【适应症】除用于单纯性肥胖症外,可用于患有高血压、糖尿病、冠心病及焦虑的肥胖病人服药后病人均能适应饮食控制,有明显减少脂肪积聚的效果,般服药12周后平均腹围可减少10cm,平均体重减轻6kg。
【用量用法】口服:第1周每日40mg,早、晚餐0.5~1小时服用;第2、3周每日60mg,早、中、晚餐前0.5~1小时服;以后根据疗效与耐受程度可继续维持原量,或逐渐增至每日80~100mg(每日100mg限用于较重的肥胖者),8~12周1疗程。
【注意事项】
1.治疗期间不要间歇性服药,疗程最后4或6周内逐渐减量而至停药,不宜突然停服。
连续服药时间不应超过6月,否则易发生耐药性及依赖心理。
2.不良反应主要有非腹泻性便次增、轻度腹痛、头晕、乏力、口干等,但一般均能耐受,持续用药可逐渐消除。
尚可有嗜睡,抑郁及夜尿增多。
不能耐受者应减量。
3.精神抑郁症、癫痫病人及孕妇忌用。
严重心律失常、高空作业者及驾驶员慎用。
4.对肥胖伴有高血压和糖尿病病人,如合并使用降压药或降糖药,可产生协同作用。
【规格】片剂:每片20mg。
索菲布韦详细说明书2013中文版

SOVALDITM (sofosbuvir)片,为口服使用美国初次批准:2013适应证和用途SOVALDI是一种丙型肝炎病毒(HCV)核苷酸类似物NS5B聚合酶抑制剂适用为慢性丙型肝炎(CHC)感染的治疗作为组合抗病毒治疗方案的一个组分。
(1)(1)SOVALDI疗效已在有HCV基因型1,2,3或4感染受试者中被确定,包括有肝细胞癌符合米兰[Milan]标准(等待肝移植)和有HCV/HIV-1共-感染受试者。
(1)剂量和给药方法(1)一片400 mg片每天1次有或无食物服用。
(2.1)(2)应与利巴韦林[ribavirin]联用或与聚乙二醇化干扰素[pegylated干扰素]和利巴韦林联用为CHC的治疗。
建议联合治疗:(2.1)(3)SOVALDI与利巴韦林联用共24周干扰素不合格可被考虑为被基因型1感染CHC 患者。
(2.1)(4)在有肝细胞癌等待肝移植直至48周或直至肝移植患者应被与联用利巴韦林为CHC 的治疗,以先发生为准。
(2.1)(5)对有严重肾受损或肾病终末期患者不能建议剂量。
(2.4,8.6)剂型和规格片:400 mg。
(3)禁忌证(1)当与聚乙二醇干扰素α/利巴韦林或单独利巴韦林联用时,对聚乙二醇干扰素α和/或利巴韦林的所有禁忌证也都应用于SOVALDI联合治疗。
(4)(2)因为利巴韦林可能引起出生缺陷和胎儿死亡,在妊娠妇女和男性其女性伴侣妊娠时禁忌SOVALDI与聚乙二醇干扰素α/利巴韦林或利巴韦林联用。
(4)警告和注意事项妊娠:利巴韦林可能致出生缺陷和胎儿死亡和动物研究已证明干扰素有流产效应;女性患者和男性患者的女性伴侣避免妊娠。
治疗开始前患者必须有一个阴性妊娠测试,使用至少2种有效非激素避孕方法和每月妊娠测试。
(5.1)不良反应SOVALDI与利巴韦林联用观察到最常见不良事件(发生率大于或等于20%,所有级别)是疲乏和头痛。
SOVALDI与聚乙二醇干扰素α和利巴韦林联用观察到最常见不良事件是疲乏,头痛,恶心,失眠和贫血。
非布司他片(风定宁)说明书

非布司他片(风定宁)说明书非布司他片(风定宁)本品为黄嘌呤氧化酶(XO)抑制剂,适用于具有痛风症状的高尿酸血症的长期治疗。
下面是店铺整理的非布司他片(风定宁 )说明书,欢迎阅读。
非布司他片(风定宁 )商品介绍非布司他片(风定宁 )通用名:非布司他片生产厂家: 杭州朱养心药业有限公司批准文号:国药准字H20130009药品规格:40mg*12片非布司他片(风定宁 )说明书【通用名称】非布司他片【商品名称】非布司他片(风定宁 )【英文名称】FebuxostatTablets【拼音全码】FengDingNingFeiBuSiTaPian【主要成份】风定宁非布司他片主要成份为非布佐司他,其化学名为2-[(3-氰基-4-异丁氧基)苯基]-4-甲基-5-噻唑羧酸。
分子式:C16H16N2O3S分子量:316.37【性状】风定宁非布司他片为白色片剂。
【适应症/功能主治】风定宁非布司他片为黄嘌呤氧化酶(XO)抑制剂,适用于具有痛风症状的高尿酸血症的长期治疗。
【规格型号】40mg*12片【用法用量】推荐风定宁非布司他片剂量为40mg或80mg,每日一次。
【不良反应】虚弱、胸痛/不适、水肿、疲劳、情绪异常、步态障碍、流行性感冒症状、痞气、疼痛、口渴。
【禁忌】正在服用硫唑嘌呤、巯嘌呤或胆茶碱的患者禁用风定宁非布司他片。
【注意事项】1.开始应用风定宁非布司他片治疗后,可观察到痛风发作增加。
这是由于变化的血清尿酸水平减少导致沉积的尿酸盐活动引起的。
为预防给药风定宁非布司他片时发生痛风发作,推荐同时给药非甾体抗炎药或秋水仙碱。
2.随机对照研究中,使用风定宁非布司他片[0.74per100P-Y(95%CI0.36-1.37)]的患者比给药别嘌醇[0.60per100P-Y(95%CI0.16-1.53)]患者更易发生心血管血栓事件(心血管死亡、非致命性心肌梗塞、非致命性中风)相关原因尚未明确。
应对心肌梗塞(MI)及中风的体征和症状进行监测。
菲布力说明书

1.成份:本品主要成份为非布佐司他,其化学名为2-[(3-氰基-4-异丁氧基)苯基]-4-甲基-5-噻唑羧酸。
结构式:分子式:C16H16N2O3S分子量:316.372.性状:本品为白色粉末3.适应症:本品为黄嘌呤氧化酶(XO)抑制剂,适用于具有痛风症状的高尿酸血症的长期治疗。
不推荐本品用于治疗无症状性高尿酸血(症)。
4.剂型:胶囊剂、片剂5.规格:40mg/粒或片;80mg/粒或片6.用法用量:推荐剂量用于治疗有痛风症状的高尿酸血症患者时,推荐本品剂量为40mg或80mg,每日一次。
推荐本品的起始剂量为40mg,给药本品时无需考虑食物或抗酸剂的影响。
特殊人群轻或中度肾功能损伤患者服用本品时不必调整剂量。
推荐本品的起始剂量为40mg,每日一次。
给药剂量40mg,持续两周后,对血清尿酸水平(sUA)仍高于6 mg/dl的患者,推荐给药剂量80mg。
轻中度肝功能损伤患者服用本品无需剂量调整。
对严重肝功能损伤患者使用本品尚无研究,因此给药本品应谨慎。
尿酸水平 使用本品治疗2周后即可进行血清尿酸的再检验。
治疗目标是降低和维持血清尿酸水平使其低于6 mg/dl 。
预防痛风急性发作推荐至少用药6个月(见【注意事项】)。
痛风发作 变化的血清尿酸水平会导致沉积的尿酸盐活动,因此开始给药本品后会导致痛风发作。
推荐使用本品时,同时给药非甾体抗炎药(NSAID )或秋水仙碱,以预防痛风发作。
预防痛风急性发作推荐至少用药6个月。
如果在给药治疗期间发生痛风,不需要停药。
对个别患者的痛风应相应给予治疗。
续发性高尿酸血症对继发性高尿酸血症患者(包括器官移植患者)给药本品尚无研究;尿酸盐生成率增加的患者不推荐使用本品(例如恶性病及其治疗、莱-萘二氏综合征)。
稀有病例的尿中黄嘌呤的浓度会显着增加,在尿路中沉积。
7.不良反应:临床试验中,共对2757例患高尿酸血症和痛风患者给药本品,每天40mg 或80mg 。
对559例患者给药本品40mg ,持续≥ 6个月。
Feiba(抗抵抗血小板抗凝因子复合物)(阴性)说明书

Hemophilia Products – Anti-Inhibitor Coagulant Complex: Feiba(Intravenous)Document Number: IC-0337 Last Review Date: 06/01/2023Date of Origin: 12/16/2014Dates Reviewed: 12/2014, 4/2015, 5/2015, 09/2015, 12/2015, 03/2016, 06/2016, 12/2016, 06/2017, 09/2017, 11/2017, 11/2018, 03/2019, 02/2020, 06/2021, 06/2022, 06/2023I.Length of AuthorizationCoverage is provided for 3 months and may be renewed thereafter, unless otherwise specified* Note: The cumulative amount of medication the patient has on-hand will be taken into account for authorizations.*Initial and renewal authorization periods may vary by specific covered indicationII.Dosing LimitsA.Quantity Limit (max daily dose) [NDC unit]:−Feiba 500 IU (Orange) single-dose vial: 293 vials per 30-day supply−Feiba 1000 IU (Green) single-dose vial: 147 vials per 30-day supply−Feiba 2500 IU (Purple) single-dose vial: 59 vials per 30-day supplyB.Max Units (per dose and over time) [HCPCS Unit]:−146,625 billable units per 30 day supplyIII.Initial Approval Criteria 1-3,7-10Coverage is provided in the following conditions:Hemophilia A (congenital factor VIII deficiency) † Ф•Diagnosis of congenital factor VIII deficiency has been confirmed by blood coagulation testing; AND•Confirmation the patient has inhibitors to Factor VIII; AND•Used as treatment in at least one of the following:o Control and prevention of acute bleeding episodes (episodic treatment of acute hemorrhage); OR(*Authorizations valid for 1 month); ORo Routine prophylaxis to prevent or reduce the frequency of bleeding episodes; AND ▪Patient has at least two documented episodes of spontaneous bleeding intojoints; ORo Patient has a documented trial and failure of Immune Tolerance Induction (ITI);AND▪Patient has a documented trial and failure or contraindication toemicizumab-kxwh therapy.Hemophilia B (congenital factor IX deficiency aka Christmas disease) † Ф•Diagnosis of congenital factor IX deficiency has been confirmed by blood coagulation testing; AND•Confirmation the patient has inhibitors to Factor IX; AND•Used as treatment in at least one of the following:o Control and prevention of acute bleeding episodes (episodic treatment of acute hemorrhage); ORo Perioperative management(*Authorizations valid for 1 month); ORo Routine prophylaxis to prevent or reduce the frequency of bleeding episodes; AND ▪Patient has at least two documented episodes of spontaneous bleeding intojoints; ORo Patient has documented trial and failure of Immune Tolerance Induction (ITI) † FDA Approved Indication(s); ‡ Compendia Recommended Indication(s); Ф Orphan Drug IV.Dispensing Requirements for Rendering Providers (Hemophilia Management Program)−Prescriptions cannot be filled without an expressed need from the patient, caregiver or prescribing practitioner. Auto-filling is not allowed.−Monthly, rendering provider must submit for authorization of dispensing quantity before delivering factor product. Information submitted must include:▪Original prescription information, requested amount to be dispensed, vial sizes available to be ordered from the manufacturer, and patient clinical history (includingpatient product inventory and bleed history)▪Factor dose should not exceed +1% of the prescribed dose and a maximum of three vials may be dispensed per dose. If unable to provide factor dosing within therequired threshold, below the required threshold, the lowest possible dose able to beachieved above +1% should be dispensed.Prescribed dose should not be increased tomeet assay management requirements.−The cumulative amount of medication(s) the patient has on-hand should be taken into account when dispensing factor product. Patients should not have more than 5 extra doseson-hand for the treatment of acute bleeding episodes.−Dispensing requirements for renderings providers are a part of the hemophilia management program. This information is not meant to replace clinical decision makingwhen initiating or modifying medication therapy and should only be used as a guide.V.Renewal Criteria 1-3,7Coverage can be renewed based upon the following criteria:•Patient continues to meet indication-specific relevant criteria identified in section III; AND •Absence of unacceptable toxicity from the drug. Examples of unacceptable toxicity include: symptoms of allergic-anaphylactic reactions (anaphylaxis, dyspnea, rash, etc.),thromboembolic events (venous thrombosis, pulmonary embolism, myocardial infarction,stroke, etc.), development of neutralizing antibodies (inhibitors), etc.; AND •Any increases in dose must be supported by an acceptable clinical rationale (i.e. weight gain, half-life study results, increase in breakthrough bleeding when patient is fully adherent totherapy, etc.); AND•The cumulative amount of medication(s) the patient has on-hand will be taken into account when authorizing. The authorization will allow up to 5 doses on-hand for the treatment ofacute bleeding episodes as needed for the duration of the authorization; AND Control and prevention of acute bleeding episodes•Renewals will be approved for a 6 month authorization periodPerioperative management of surgical bleeding•Coverage may NOT be renewedRoutine prophylaxis to prevent or reduce the frequency of bleeding episodes•Renewals will be approved for a 12 month authorization period; AND•Patient has demonstrated a beneficial response to therapy (i.e., the frequency of bleeding episodes has decreased from pre-treatment baseline)Dosage/Administration1-3Control and prevention of bleeding Congenital Hemophilia A / Hemophilia B with inhibitors Joint hemorrhageAdminister 50—100 units/kg IV every 12 hours until pain and acute disabilities are improvedMucous Membrane BleedingAdminister 50—100 units/kg IV every 6 hours for at least 1 day or until bleeding is resolvedSoft tissue hemorrhageAdminister 100 units/kg IV every 12 hours until resolution of bleedOther severe hemorrhageAdminister 100 units/kg IV every 6—12 hours until resolution of bleed Routine ProphylaxisCongenitalHemophilia A/Hemophilia B withinhibitorsAdminister 85 units/kg IV every other dayPerioperative management Congenital Hemophilia A / Hemophilia B with inhibitors PreoperativeAdminister 50—100 units/kg IV administered as a 1 time dose immediately prior to surgeryPostoperativeAdminister 50 – 100 units/kg IV administered every 6 – 12 hours postoperatively until resolution of bleed and healing is achievedVI.Billing Code/Availability Information HCPCS Code & NDC:Feiba Baxalta US Inc J7198 1 IU 500 units 64193-0426-xx 1000 units 64193-0424- xx 2500 units 64193-0425- xxVII.References1.Feiba [package insert]. Lexington, MA; Baxalta US Inc. March 2023. Accessed May 2023.2.MASAC Recommendations Concerning Products Licensed for the Treatment of Hemophiliaand Selected Disorders of the Coagulation System. Revised May 2023 National HemophiliaFoundation. MASAC Document #276; May 2023. Available at: .Accessed May 2023.3.Guidelines for the Management of Hemophilia. 3rd Edition. World Federation ofHemophilia. 2020. Available at: https:///publications/files/pdf-1863.pdfAccessed May 2023.4.Graham A1, Jaworski K. Pharmacokinetic analysis of anti-hemophilic factor in the obesepatient. Haemophilia. 2014 Mar;20(2):226-9.5.Croteau SE1, Neufeld EJ. Transition considerations for extended half-life factor products.Haemophilia. 2015 May;21(3):285-8.6.Mingot-Castellano, et al. Application of Pharmacokinetics Programs in Optimization ofHaemostatic Treatment in Severe Hemophilia a Patients: Changes in Consumption,Clinical Outcomes and Quality of Life. Blood. 2014 December; 124 (21).7.MASAC Recommendation Concerning Prophylaxis for Hemophilia A and B with andwithout Inhibitors. 2022 National Hemophilia Foundation. MASAC Document #267; April 2022. Available at: . Accessed May 2023.8.Sjamsoedin LJ, Heijnen L, Mauser-Bunschoten EP, et al. The effect of activatedprothrombin-complex concentrate (FEIBA) on joint and muscle bleeding in patients withhemophilia A and antibodies to factor VIII. A double-blind clinical trial. N Engl J Med. 1981 Sep 24;305(13):717-21.9.Hilgartner M, Knatterud G, and the FEIBA Study Group. The Use of Factor Eight InhibitorBy-Passing Activity (FEIBA Immuno) Product for Treatment of Bleeding Episodes inHemophiliacs With Inhibitors. Blood, Vol 6. No. 1 (January). 1983.10.Stasyshyn S, Antunes S, Mamonov V, et al. Prophylaxis with anti‐inhibitor coagulantcomplex improves health‐related quality of life in haemophilia patients with inhibitors:results from FEIBA NF Prophylaxis Study. Haemophilia, 03 March 2014.https:///10.1111.hae.12390.11.First Coast Service Options, Inc. Local Coverage Article: Billing and Coding: HemophiliaClotting Factors (A56482). Centers for Medicare & Medicaid Services Inc. Updated on10/28/2022 with effective date 10/01/2022. Accessed May 2023.12.Palmetto GBA. Local Coverage Article: Billing and Coding: Guidance for Anti-InhibitorCoagulant Complex (AICC) National Coverage Determination (NCD) 110.3 (A56065).Centers for Medicare & Medicaid Services Inc. Updated on 11/14/2022 with effective date11/24/2022. Accessed May 2023.13.Novitas Solutions, Inc. Local Coverage Article: Billing and Coding: Hemophilia FactorProducts (A56433). Centers for Medicare & Medicaid Services Inc. Updated on 10/14/2022 with effective date 10/01/2022. Accessed May 2023.Appendix 1 – Covered Diagnosis CodesD66Hereditary factor VIII deficiencyD67Hereditary factor IX deficiencyAppendix 2 – Centers for Medicare and Medicaid Services (CMS)Medicare coverage for outpatient (Part B) drugs is outlined in the Medicare Benefit Policy Manual (Pub. 100-2), Chapter 15, §50 Drugs and Biologicals. In addition, National Coverage Determination (NCD), Local Coverage Determinations (LCDs) and Local Coverage Articles (LCAs) may exist and compliance with these policies is required where applicable. They can be found at: https:///medicare-coverage-database/search.aspx. A dditional indications may be covered at the discretion of the health plan.Medicare Part B Covered Diagnosis Codes (applicable to existing NCD/LCD/LCA):Jurisdiction(s): J,M NCD/LCD Document (s): A56065https:///medicare-coverage-database/new-search/search-results.aspx?keyword=a56065&areaId=all&docType=NCA%2CCAL%2CNCD%2CMEDCAC%2CTA%2CMCD%2 C6%2C3%2C5%2C1%2CF%2CPJurisdiction(s): H,L NCD/LCD Document (s): A56433https:///medicare-coverage-database/new-search/search-results.aspx?keyword=a56433&areaId=all&docType=NCA%2CCAL%2CNCD%2CMEDCAC%2CTA%2CMCD%2 C6%2C3%2C5%2C1%2CF%2CPJurisdiction Applicable State/US Territory ContractorE (1) CA, HI, NV, AS, GU, CNMI Noridian Healthcare Solutions, LLCF (2 & 3) AK, WA, OR, ID, ND, SD, MT, WY, UT, AZ Noridian Healthcare Solutions, LLC5 KS, NE, IA, MO Wisconsin Physicians Service Insurance Corp (WPS)6 MN, WI, IL National Government Services, Inc. (NGS)H (4 & 7) LA, AR, MS, TX, OK, CO, NM Novitas Solutions, Inc.8 MI, IN Wisconsin Physicians Service Insurance Corp (WPS) N (9) FL, PR, VI First Coast Service Options, Inc.J (10) TN, GA, AL Palmetto GBA, LLCM (11) NC, SC, WV, VA (excluding below) Palmetto GBA, LLCL (12) DE, MD, PA, NJ, DC (includes Arlington &Novitas Solutions, Inc.Fairfax counties and the city of Alexandria in VA)K (13 & 14) NY, CT, MA, RI, VT, ME, NH National Government Services, Inc. (NGS)15 KY, OH CGS Administrators, LLC。
琥珀酸亚铁片(速力菲)的说明书

琥珀酸亚铁片(速力菲)的说明书关于《琥珀酸亚铁片(速力菲)的说明书》,是我们特意为大家整理的,希望对大家有所帮助。
日常生活我们都了解,挑食的人通常非常容易让人体缺乏维生素和矿物等营养元素,那样针对我们的身心健康是很不好的,很多人了解服食药品能够做到修复人体营养元素均衡的目地。
因而,今日我们为您强烈推荐一种称为琥珀酸亚铁片(速力菲)的药品,它是一种对身体彻底沒有副作用的药品,您能够安心挑选和应用。
生产药品名称疫苗通用性名字:琥珀酸亚铁片产品名称:琥珀酸亚铁片(速力菲)拼音字母全码:ZuoZuoSuanYaTiePian(SuLiFei)生产关键成分疫苗关键特异性成份为琥珀酸亚铁。
生产性状疫苗本产品为塑料薄膜糖衣片,去除塑料薄膜衣后显暗黄色。
生产适用范围/功效与作用疫苗缺铁性贫血的防止及医治用。
生产型号规格疫苗100mg*20s生产使用方法使用量疫苗内服。
用以防止:成年人一日1片,孕妇一日2片,少年儿童一日0.5片。
用以医治:成年人一日2~4片,少年儿童一日1~3片,分次服食。
生产副作用疫苗1 由此可见消化道副作用,如恶心想吐、呕吐、上腹疼痛、便秘2 本产品可降低胃肠功能,造成便秘,并列大便发黑。
生产禁忌疫苗 1 肝肾功能比较严重危害,尤其是伴随没经医治的尿道感染禁止使用;2 铁负载过高、血色病或含铁血黄素沉着冷静症病人禁止使用;3 非缺铁性贫血如地中海贫血)病人禁止使用。
生产常见问题疫苗1.用以平时补钙时,应选用防止量。
2.医治使用量不可长期性应用,应在医生诊断为缺铁性贫血后应用,且医治期内应定期维护血象和血清铁水准。
3.以下状况谨慎使用:酒精中毒、肝炎、亚急性感染、肠道炎症、胰腺炎、胃与十二指肠溃疡、溃疡性肠炎。
4.本产品不可与浓茶水同屏。
5.本产品宜在餐后或饭时服食,以缓解胃里刺激性。
6.如服食过多或出現比较严重副作用,应该马上就诊。
7.对本产品过敏症状禁止使用,过敏性体质者谨慎使用。
8.本产品特性产生改变时严禁应用。
非布司他片(菲布力)中文说明书

非布司他片(菲布力)中文说明书非布司他片菲布力 FebuxostatTab1.ets FeibusitaPian【成份】本品主要成份为非布司他。
辅料包括:乳糖水合物、部分预胶化淀粉、羟丙基纤维素、交联羟甲纤维素钠、硬脂酸镁、羟丙甲纤维素、聚乙二醇6000o 化学名称:2-[3-制基-4-(2-甲基丙氯基)苯基]-4-甲基噬哗-5-较酸 化学结构式:分子式:Ci 6Hi 6N 2O 3S 分子量:316.37【性状】本品为薄膜衣片,除去包衣后显白色。
【适应症】适用于痛风患者高尿酸血症的长期治疗。
不推荐用于无临床症状的高尿酸血症。
【规格】20mg>40mg o【用法用量】在降尿酸药物治疗初期可能导致血尿酸值急速降低诱发痛风性关节炎(痛风发作),故推荐本品初始剂量为20mg 每日1次,且可在给药开始4周后根据血尿酸值逐渐增加用量,每次增量20mg 。
每日最大剂量为80mg 。
血尿酸值达标(<6mg∕d 1.或<360UmO1./1.)后,维持最低有效剂量。
给药时,无需考虑食物和抗酸剂的影响。
特殊人群肝损害患者:轻、中度肝损害(ChiId-PughA.B 级)的患者无需调整剂量。
尚未进行重度肝损害患者(Chi1.d-PUghC 级)使用非布司他的疗效及安全性研究,因此此类患者应慎用非布司他。
肾损害患者:轻、中度肾损害(CICr30-89m1.∕min )的患者无需调整剂量。
尚无严重肾损害(CIer<30m1.∕min )患者的充足研究数据,因此此类患者应慎用非布司他。
痛风发作由于本品为降尿酸药物,在痛风性关节炎(痛风发作)发作时使用本品可使血尿酸值降低,加重痛风性关节炎(痛风发作),故在使用本品前有痛风性关节炎的患者,在症状稳定前,不可使用本品。
另外,在使用本品过程中发现有痛风性关节炎(痛风发作)时,可不改变本品用量继续用药,亦可根据具体症状合用秋水仙碱、非类固醇抗炎药、肾上腺皮质激素等药物。
非布丙醇软胶囊使用说明书

非布丙醇软胶囊使用说明书
请仔细阅读说明书并在医师指导下使用非布丙醇软胶囊使用说明书
【药品名称】
通用名称:非布丙醇软胶囊
英文名称:Hydrocortisone Soft Capsules
汉语拼音:Feibubingchun Ruanjiaonang
【成份】苯丁氧丙醇。
【性状】本品为无色或微黄色的透明的稍带油状的液体;有刺激性辣味。
【适应症】
胆囊炎、胆石症、胆管结石术后带有T型引流管者、胆道术后高脂血症、脂性消化不良、急性及慢性肝炎等。
【规格】每粒重50mg。
【用法用量】口服,一次0.1g~0.2g,一日0.3~0.6g。
【不良反应】偶有胃部不适,用药初期会发生腹泻。
【禁忌】肝功能不全或胆道梗阻的患者禁用、胃肠肿瘤、消化性溃疡肠道急性炎症禁用。
【注意事项】用药初期会发生腹泻,此时应减量或停药数日,重新用药时由低剂量开始逐渐增加至所需剂量。
【孕妇及哺乳期妇女用药】孕妇尤其妊娠前三月及哺乳期妇女禁用。
【儿童用药】儿童用药应根据体重年龄酌情减量。
【老年用药】老年患者慎用。
【药物相互作用】尚不明确。
【药物过量】尚缺乏此方面资料。
【药理毒理】本品有利胆作用,动物实验证明,无论肝实质是否损伤,均可使胆汁分泌增加,此外尚具有松弛胆管平滑肌及奥狄括约肌、降低血中胆固醇的作用。
【药代动力学】口服易吸收,可透过胎盘,可分泌至乳汁。
【贮藏】避光,密闭凉处保存。
【包装】塑料瓶装,30粒/瓶。
【有效期】24个月
说明书字数:701。
“痛风神药”菲布力在中国上市 痛风的症状有哪些

“痛风神药”菲布力在中国上市痛风的症状有哪些*导读:痛风神药菲布力在中国上市,痛风的症状有哪些?痛风神药菲布力在中国上市,为痛风患者带来全新化治疗选择。
痛风神药菲布力在中国上市,痛风的症状有哪些?一起看看吧。
*痛风神药菲布力在中国上市3月14日,在菲布力中国产品上市媒体沟通会上宣布,将已在全球70多个国家和地区上市的日本原研治疗痛风药物菲布力引入中国,经过国家药品监督管理总局批准后近日正式进入中国市场,这将为中国痛风患者带来全新的个性化治疗选择。
菲布力(非布司他片)由日本研发生产,目前已经在美国、欧洲、日本以及中国香港、澳门和台湾等超过70个国家和地区上市,获得中国大陆市场的独家销售权。
菲布力于2018年9月4日被国家药品监督管理局批准在中国市场上市,各方经过密切合作,供应中国市场的菲布力在日本工厂生产,之后远渡重洋并完成首批产品的进口检验,经由沈阳工厂完成了药品的包装。
目前,首批日本原研原产的菲布力已来沈阳的生产基地发往全国各地的医疗机构和零售药店,将于近日陆续到达国内痛风患者的手中。
菲布力被批准适用于痛风患者高尿酸血症的长期治疗,在中国批准上市的剂型有20毫克和40毫克两种规格。
目前在中国市场独有的20毫克规格,不但满足了临床治疗过程中剂量调整的需求,也为中国痛风患者的个体化治疗提供了更为多样和灵活的治疗选择。
痛风是很多中老年人的常犯疾病,而且要根治就目前来说还是比较困难的,这次在中国上市的痛风神药菲布力,究竟能不能为中国痛风患者提供良好的治疗效果呢?还未可知。
那么痛风神药菲布力在中国上市,痛风的症状有哪些?下面一起来看看吧。
*痛风的症状有哪些1、间歇期痛风:这一时期的痛风,症状通常表现为血尿酸浓度偏高。
所谓的间歇期是指痛风两次发病的间隔期,一般为几个月至一年。
如果没有采用降尿酸的方法,发作会频繁,痛感加重,病程延长。
2、慢性期痛风:该阶段的痛风,通常会出现痛风石,而且,此时痛风频繁发作,身体部位开始出现痛风石,随着时间的延长痛风石逐步变大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.成份:本品主要成份为非布佐司他,其化学名为2-[(3-氰基-4-异丁氧基)苯基]-4-甲基-5-噻唑羧酸。
结构式:分子式:C16H16N2O3S分子量:316.372.性状:本品为白色粉末3.适应症:本品为黄嘌呤氧化酶(XO)抑制剂,适用于具有痛风症状的高尿酸血症的长期治疗。
不推荐本品用于治疗无症状性高尿酸血(症)。
4.剂型:胶囊剂、片剂5.规格:40mg/粒或片;80mg/粒或片6.用法用量:推荐剂量用于治疗有痛风症状的高尿酸血症患者时,推荐本品剂量为40mg或80mg,每日一次。
推荐本品的起始剂量为40mg,给药本品时无需考虑食物或抗酸剂的影响。
特殊人群轻或中度肾功能损伤患者服用本品时不必调整剂量。
推荐本品的起始剂量为40mg,每日一次。
给药剂量40mg,持续两周后,对血清尿酸水平(sUA)仍高于6 mg/dl的患者,推荐给药剂量80mg。
轻中度肝功能损伤患者服用本品无需剂量调整。
对严重肝功能损伤患者使用本品尚无研究,因此给药本品应谨慎。
尿酸水平使用本品治疗2周后即可进行血清尿酸的再检验。
治疗目标是降低和维持血清尿酸水平使其低于6 mg/dl。
预防痛风急性发作推荐至少用药6个月(见【注意事项】)。
痛风发作变化的血清尿酸水平会导致沉积的尿酸盐活动,因此开始给药本品后会导致痛风发作。
推荐使用本品时,同时给药非甾体抗炎药(NSAID)或秋水仙碱,以预防痛风发作。
预防痛风急性发作推荐至少用药6个月。
如果在给药治疗期间发生痛风,不需要停药。
对个别患者的痛风应相应给予治疗。
续发性高尿酸血症对继发性高尿酸血症患者(包括器官移植患者)给药本品尚无研究;尿酸盐生成率增加的患者不推荐使用本品(例如恶性病及其治疗、莱-萘二氏综合征)。
稀有病例的尿中黄嘌呤的浓度会显著增加,在尿路中沉积。
7.不良反应:临床试验中,共对2757例患高尿酸血症和痛风患者给药本品,每天40mg或80mg。
对559例患者给药本品40mg,持续≥ 6个月。
给药本品80mg的患者中,1377例患者持续≥ 6个月,674例患者治疗≥1年,515例患者治疗≥2年。
常见不良反应三项随机、对照临床研究(研究1、2、3),持续6-12个月,报道了由于药物引起的不良反应。
表1 概述了本品给药组至少1%发生率的不良反应和比空白对照组发生率至少高0.5%的不良反应*根据肾功能损伤,给药别嘌呤醇患者组中,10例给药100mg,145例给药200mg,1122例给药300mg。
导致治疗过程中停药的最常见不良反应为肝功能异常,本品40mg给药组1.8%,80mg 组1.2%,别嘌呤醇给药组0.9%。
除了表1列出的不良反应,本品给药组中报道的头晕不良反应也大于1%,但与空白对照组相比低于0.5%。
较少发生的不良反应2期和3期临床研究中,以下不良反应发生率低于1%,而本品给药范围为40mg-240mg 时更高些。
下列包括注意事项中器官系统的不良反应(低于1%)。
血液和淋巴系统:贫血、特发性血小板减少性紫癜、白细胞增多/减少嗜中性白血球减少症、全血细胞减少症、脾大、血小板减少症。
心脏疾患:心绞痛、心房纤维性颤动、心杂音、ECG异常、心悸、窦性心动过缓、心动过速。
耳朵和内耳方面的异常:耳聋、耳鸣、眩晕。
眼部疾病:视觉模糊。
胃肠道病症:腹胀、腹痛、便秘、口干燥、消化不良、肠胃气胀、频便、胃炎、胃食管返流疾病、胃肠不适、龈痛、呕血、胃酸过多、便血、口腔溃疡形成、胰腺炎、消化性溃疡、呕吐。
一般病症和给药情况:虚弱、胸痛/不适、水肿、疲劳、情绪异常、步态障碍、流行性感冒症状、痞气、疼痛、口渴。
肝胆管病症:胆石病/胆囊炎、肝脂肪变性、肝炎、肝肿大。
免疫系统疾病:超敏反应。
传染及感染:带状疱疹。
并发症:挫伤。
新陈代谢病症:厌食症、食欲减退/增强、脱水、糖尿病、高胆固醇血症、高血糖、高脂血症、高甘油三酸酯血症、低钾血、体重减少/增加。
肌骨骼和结缔组织病症:关节炎、关节僵直、关节肿胀、肌肉痉挛/肌肉颤搐/紧缩/无力、肌骨骼疼痛/四肢强直、肌痛。
神经系统病症:味觉改变、平衡紊乱、中风综合征、Guillain-Barré综合症、头痛、轻偏瘫、感觉迟钝、嗅觉减退、腔隙梗塞、瞌睡、精神损害、偏头痛、感觉异常、瞌睡、短暂性缺血发作、震颤。
精神病症:激动、焦虑、抑郁、失眠、易怒、性欲降低、神经过敏、恐慌发作、人格变化。
肾脏、泌尿系统病症:血尿、肾石病、尿频、蛋白尿、肾衰竭、肾机能不全、尿急、失禁。
生殖系统和乳腺变化:乳房痛、勃起机能障碍、男子女性型乳房。
呼吸、胸部及纵膈病症:支气管炎、咳嗽、呼吸困难、鼻出血、鼻发干、鼻窦分泌物过多、咽水肿、呼吸道充血、喷嚏、咽喉刺激、上呼吸道感染。
皮肤和皮下组织病症:脱发、血管性水肿、皮炎、皮肤划痕现象、淤斑、湿疹、头发变色、毛发生长异常、多汗、皮肤脱皮、瘀点、光过敏、瘙痒、紫癜、皮肤变色、皮肤病损、皮肤气味异常、荨麻疹。
血管病症:面红、热潮红、高血压、低血压。
实验室参数:活化部分凝血激酶时间延长、肌酸增加、重碳酸盐减少、钠增加、EEG 异常、葡萄糖增加、胆固醇增加、甘油三酯增加、淀粉酶增加、钾增加、TSH增加、血小板计数计数减少、血细胞比容减少、血红素减少、MCV增加、RBC减少、肌酸酐增加、血尿素增加、BUN/肌酸酐比率增加增加、肌酸磷酸激酶(CPK)增加、碱性磷酸(酯)酶增加、LDH 增加、PSA增加、尿排出量增加/减少、淋巴细胞计数减少、中性白细胞计数减少、WBC增加/减少、检尿蛋白质异常、低密度脂蛋白(LDL)增加、凝血酶原时间延长、尿管型、尿液白细胞及蛋白质阳性。
心血管安全随机对照长期扩展研究中,心血管事件及死亡属于APTC事件(心血管死亡、非致命性心肌梗塞、非致命性中风)一项预定义终末点指标。
3期随机对照研究中,报道的100例患者APTC事件发病率:空白对照组0(95% CI 0.00-6.16)、本品40mg组0(95% CI 0.00-1.08)、本品80mg组1.09(95% CI 0.44-2.24)、别嘌呤醇0.60(95% CI 0.16-1.53)。
一项长期扩展研究中,报道的APTC事件发病率为:本品80mg组0.97 (95% CI 0.57-1.56)、别嘌呤醇0.58(95% CI 0.02-3.24)。
研究发现,本品APTC事件发病率高于别嘌呤醇给药组患者。
相关机制尚不确定。
应监测MI和中风的体征和症状。
8.注意事项:痛风发作开始应用本品治疗后,可观察到痛风发作增加。
这是由于变化的血清尿酸水平减少导致沉积的尿酸盐活动引起的。
为预防给药本品时发生痛风发作,推荐同时给药非甾体抗炎药或秋水仙碱(见【用法用量】)。
心血管病症随机对照研究中,使用本品[0.74 per 100 P-Y (95% CI 0.36-1.37)]的患者比给药别嘌醇[0.60 per 100 P-Y (95% CI 0.16-1.53)]患者更易发生心血管血栓事件(心血管死亡、非致命性心肌梗塞、非致命性中风)(见【不良反应】)。
相关原因尚未明确。
应对心肌梗塞(MI)及中风的体征和症状进行监测。
肝脏酶增加随机对照研究中,观察到转氨酶水平比正常上限的3倍还高(给药本品及别嘌呤醇患者分别提高,AST:2%,2%、ALT:3%,2%)。
未发现转氨酶的提高具有量效关系。
肝功能实验室分析推荐,应用本品治疗2月和4月,此后周期性治疗。
9.禁忌:正在服用硫唑嘌呤、巯嘌呤或胆茶碱的患者禁用本品。
10.特殊用药:孕妇及哺乳期妇女用药1.孕妇C类药物:对孕妇尚无足够充分的对照研究。
只有在对婴儿的潜在益处与风险相当的情况下,孕妇才能服用本品。
在器官生成期对大鼠和兔子口服给药非布佐司他,剂量达到48mg/kg(按照体表面积计算分别为人给药80mg/天的40和50倍)时,无致畸性。
在器官生成期及泌乳期,对怀孕期大鼠口服给药本品,剂量达到48mg/kg(为人给药80mg/天的40倍),发现新生儿死亡率增加,新生儿体重增加减少。
2.哺乳期妇女非布佐司他经大鼠乳汁分泌。
非布佐司他是否经人体乳汁分泌尚未知。
由于很多药物通过人乳汁分泌,故对哺乳期妇女给药本品时应谨慎。
儿童用药18以下儿童患者使用本品的安全性及有效性尚未确定。
老年用药老年患者使用本品无需剂量调整。
与其他年龄组相比,在安全性及有效性方面无临床显著差异,但不排除有些老年患者对本品较敏感。
老年患者(≥65岁)多剂量口服给药非布佐司他后的Cmax及AUC24与年轻患者(18-40岁)相似。
11.药物相互作用:巯嘌呤/硫唑嘌呤等非布佐司他是黄嘌呤氧化酶(XO)抑制剂。
虽然本品与通过XO代谢药物(例如胆茶碱、巯嘌呤、硫唑嘌呤)的相互作用尚无研究,但本品对XO的抑制作用会这些药物在血浆中浓度的增加从而产生毒性。
正在服用硫唑嘌呤、巯嘌呤或胆茶碱患者禁止使用本品。
细胞毒素化疗药物本品与细胞毒素化疗药物的相互作用尚未进行研究。
本品在细胞毒素化疗期间的安全性尚无可靠数据。
体内药物相互作用研究根据健康受试者的药物相互作用研究,本品与秋水仙碱、萘普生、吲哚美辛、氢氯噻嗪、华法林、地昔帕明无显著临床意义的相互作用。
因此,本品可以与这些药物联用。
12.药物过量:对健康受试者给药本品剂量达到每天300mg,持续7天,无剂量限制性毒性。
没有药物过量的病例报道。
药物过量患者应进行对症和支持疗法。
13.药理毒理:作用机制非布佐司他是黄嘌呤氧化酶抑制剂,通过减少血清尿酸达到疗效。
本品在治疗浓度下不会抑制嘌呤和嘧啶的合成及代谢过程中的其他酶。
毒理研究以比格犬进行的为期12个月的毒性研究发现,15mg/kg剂量时(约为人给药80mg/天的4倍)在肾脏中发现黄嘌呤沉积物结晶和结石。
对大鼠给药48mg/kg(约为人给药80mg/天的35倍),为期6个月的研究中,由于黄嘌呤结晶沉积也发现了类似的结石形成。
致癌性:以F344大鼠和B6C3F1小鼠进行为期两年的致癌性研究。
对雄性大鼠和雌性小鼠分别给药24 mg/kg (为人推荐最大给药剂量80mg/天的25倍)、18.75 mg/kg (为人给药剂量80mg/天的12.5倍),分别发现移行细胞乳头状瘤及膀胱癌增加。
膀胱肿瘤是肾脏和膀胱结石形成的。
致突变性:本品在有或无代谢活化剂时,中国仓鼠肺成纤维细胞体外染色体畸变试验结果为阳性。
以本品进行埃姆斯试验和人外周血淋巴细胞及L5178Y小鼠淋巴瘤细胞染色体畸变试验等体外研究、小鼠微核试验、大鼠程序外DNA合成、大鼠骨髓细胞等体内研究,研究结果均显阴性。
生殖毒性:对雄性和雌性大鼠口服给药本品,剂量达到48mg/kg/天(约为人给药80mg/天的35倍)对生育生殖能力无影响。
14.药代动力学:在健康受试者中,非布佐司他10mg~120mg的单剂量或多剂量给药后,Cmax和AUC 呈剂量依赖性地增加。
