高二化学镁和铝
高二化学最新课件-第一节镁和铝 精品

小结:
1、镁铝的物理性质: 银白色金属、密度小、熔点较低、硬度较小 2、镁铝的用途: 导热性好-- 烹饪用具 延展性好-- 包装用的铝箔 导电性好-- 导线电缆 银白色金属光泽-- 装饰材料 密度小-- 航空、航天材料 硬度大-- 轻型建筑材料、飞机、汽车制造业
合金简介:由两种或两种以上的金属(或金属 跟非金属)熔合而成的具有金属特性的物质. 合金的优点:硬度一般比各成分金属大,熔点一般 比各成分金属低。
2Al+Fe2O3=2Fe+Al2O3
高温
以上反应称为铝热反应。 请问: (1)上述反应为什么会发生? (2)是否铝与所有的金属氧化 物都发生反应呢? (3)请写出Al与CuO的反应式。
复习提问:
请同学们写出以下反应的化学或离子方程 式,并标出电子转移的方向和数目:
①Mg条在CO2气体中点燃
②Al片放入KOH溶液中
镁和铝的微观结构
镁 Mg
最外层电子数:2
铝
Al
Байду номын сангаас
最外层电子数:3
思考:
1、镁和铝单质体现什么化学性质? 还原性
2、镁、铝的还原性哪种物质强?
镁比铝强
根据物质结构知识可知,镁和铝位于同一周期,最 外层电子数都很少,在反应中都易失电子,体现还 原性.但是镁的原子半径比铝大,因而更容易失去 最外层电子,镁比铝更活泼,具有更强的还原性(或 金属性). Al-3e-=Al3+ , Mg-2e-=Mg2+
3.将质量相同的镁条分别在足量的① 氧气②空气③CO2中燃烧,完全燃烧后 所得固体的质量分别为W1,W2,W3,则它 们的大小关系为 W3﹥W 1﹥ W2 .
4.定向爆破建筑物时,应同时定向切断钢筋和炸碎 水泥,除了要用适宜的火药以外,还需用( )
高二化学镁和铝及其化合物

nAl3 0.100L 1.00mol L1 0.100mol
COH 1.00mol L1
nAl(OH )3
3.90 g 78.0g mol 1
0.0500 mol
• ①当 nOH 3 :1时
2、合金
• 2、合金:
两种或两种以上的金属或(或金属跟非金属) 熔合而成的具有金属特性的物质,叫做合金。
3、镁和铝的化学性质(是离子反应的用离子方程式表示)
镁的化学性质 铝的化学性质
与O2反应 与非金属反应 与酸反应 与碱水反应 与氧化物反应
△
△
2Mg+O2== 2MgO 4Al+3O2==2Al2O3
OH
.
n Al3
nAl(OH )3 O
• 三、写出下列反应的离子方程式
溶液 三氧化二铝
氢氧化铝
氢氧 化钠 2OH-+Al2O3=2AlO2-+H2O OH-+Al(OH)3=AlO2-+2H2O
稀硫 酸
6H++Al2O3=2Al3++3H2O
3H++Al(OH)3=Al3++3H2O
• 四、向100mL1mol/LAlCl3溶液中,加入 1.00mol/L的NaOH溶液,得到Al(OH)3沉 淀3.90g ,求加入NaOH溶液的体积可能是 多少毫升(不考虑其它因素)。
△ Mg+Cl2==MgCl2
△ 2Al+3Cl2==2AlCl3
Mg+2H+=
2Al+6H+ =
高二化学最新课件-镁和铝的性质上课 精品

1、物理性质的相似性
(1)具有银白色的金属光泽 (2)密度小 (3)熔点、沸点低 (4)硬度小
2、物理性质的差异性
(1)镁的熔点Biblioteka 沸点比铝低 比铝小(2)镁的硬度
物理性质不同的原因:晶体内的化学键——金属键 的强弱不同
二、镁和铝的化学性质
1、与非金属的反应 (1)与氧气的反应
常温下 加热时
Mg + 2H2O ==== Mg(OH)2 + H2
沸水
2Al + 6H2O ==== 2Al(OH)3 + 3H2
(2)、镁与二氧化碳的反应
现象:剧烈反应,发出耀眼的白光,同时,有白烟 和黑色固体产生。
点燃 2Mg + CO2 === 2MgO + C
(3)、铝与氧化铁的反应
加热 2Al +Fe2O3 ==== Al2O3 + 2Fe
镁和铝与酸反应的比较
(1)相同点 a.Mg、Al与盐酸反应产生H2。 b.Mg、Al与稀硫酸反应产生H2。 c.Mg、Al与稀硝酸反应不产生H2。 (2)不同点 a.Mg+H2SO4(浓)↛H2↑ b.Al与冷浓H2SO4、浓HNO3发生钝化。
三、铝的重要化合物
1、氧化铝
白色粉末固态物质,不溶于水,熔点高,天然产的 无色晶体称为刚玉。
A.2/3 B.3/2 C.2/1 D.1/1
3.由Na.Mg.Al.Zn四种金属单质组成的合金12克,跟 足量的盐酸反应,产生5.6.升标准状况下的H2,那么此合 金中一定有的金属是( D )
A.Na B.Mg C.Al D.Zn
4.只用下试剂中的一种,就能将Na2S,Ba(OH)2, NaAlO2,NaHCO3,AlCl3五种无色透明溶液区别出来, 这种试剂是( A )
高二化学-镁和铝(成都七中课件)PPT精品文档21页

5、与氧化物的反应反应
2Mg+CO2 高温2MgO+C
2Al+Fe2 2O3 3 高 温Al2O3+2Fe 铝热剂
铝热反应
可用于冶炼难熔的 金属、焊接铁轨。
Al粉与金属活动性排在其后的 金属的氧化物所形成 的混合物。
三、镁、铝的重要化合物
制法
Mg2++2OH-=Mg(OH)2↓
Al3++3NH3·H2O=Al(OH)3↓ +3NH4+
有两瓶试剂AlCl3、NaOH,不用 其它试剂,如何鉴别出它们?
① 向AlCl3中滴加NaOH
② 向NaOH 中滴加AlCl3
讨论:将x溶液逐滴加入y溶液中, 生成沉淀量与加入x溶液的关系如 下图所示,符合图中所示情况是( C)
化学性质
(1)与酸反应 Mg(OH)2+2H+=Mg2++ 2H2O
(2)不与碱反应
(1)与酸反应 Al(OH)3+3H+=Al3++3H2O
(2)与强碱反应 Al(OH)3+OH-=AlO2-+2H2O
(3)受热分解
(3)受热分解
Mg(OH)2 △MgO+H2O 2Al(OH)3 △Al2O3+3H2O
(3)与强碱反应 Al2O3+2OH-=2AlO2-+H2O
Mg(OH)2 △ MgO+H2O MgCO3 △ MgO+CO2↑
2Al(OH)3
△Al2O3+3H2O
耐火材料
耐火材料、冶炼铝
高二化学镁和铝

学科:化学教学内容:高二化学镁和铝【基础知识精讲】镁及其化合物转化关系铝及其化合物转化关系在学习过程中我们一定要注意以下几点:1.注重理论知识的指导作用,培养思维能力.如学习镁、铝性质时,可用元素周期表及周期律的理论为指导;在学习Al(OH)3两性时,可运用电离理论和化学平衡理论进行分析.这样不仅可以巩固所学的理论知识,还可以培养自己分析问题解决问题的能力.2.温故知新,培养自己归纳总结的能力.如铝的一些性质在初三和高一曾学习过.要在复习有关知识的基础上学完本节后学会总结、归纳的方法,使所学的知识系统化、网络化.3.充分发挥主体作用,培养自学能力.如金属的通性、合金等内容通过自学,不仅可以获得知识,更重要的是学会读书的方法,培养自学能力.4.掌握图像题的解题技巧,如Al(OH)3两性的计算.【重点难点解析】重点:(1)镁、铝的化学性质 (2)铝的特性 (3)三氧化二铝、氢氧化铝的两性难点:铝的特性及氢氧铝的两性.1.铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成氢氧化铝,然后氢氧化铝再和强碱反应生成偏铝酸盐.如铝和氢氧化钠溶液反应分两步进行;2Al+6H2O2Al(OH)3+3H2↑Al(OH)3+NaOH NaAlO2+2H2O标电子转移时就可以更清楚地理解铝和氢氧化钠溶液反应的实质:上式可简写为2Al+2H2O+2NaOH2NaAlO2+3H2↑2.氢氧化铝具有两性,可用电离平衡移动的原理来解释:氢氧化铝的电离方程式可表示如下:AlO+H+Al(OH)3Al3++3OH-H2O+ --23(酸式电离) (碱式电离)其电离程度相当微弱,只有加入强酸(或强碱)时,大量的H +(或OH -)才能破坏氢氧化铝的电离平衡,使平衡向右(或左)移动,生成铝盐(或偏铝酸盐),所以氢氧化铝既能与酸反应,又能与碱反应.当加入弱酸或弱碱时,因H +或OH -浓度太小,不能使上述平衡移动,因此Al(OH)3只溶于强酸或强碱,而不溶于弱酸或弱碱.3.Al 3+、Al(OH)3、AlO -2之间的转化关系Al 3++--23AlO +6H 2O 4Al(OH)3↓ Al 3+只能存在于酸性溶液中,AlO -2只能存在碱性溶液中,若将两种溶液混和且适量将全部生成Al(OH)3沉淀.4.Al(OH)3的制备:①用弱碱氨水与可溶性铝盐反应.Al 3++3NH 3·H 2O Al(OH)3↓+3NH +4.②用可溶性偏铝酸盐与CO 2反应:AlO -2+2H 2O+CO 2(过量)Al(OH)3↓+--3HCO 2AlO -2+3H 2O+CO 2(少量) Al(OH)3↓+--23CO【难题巧解点拨】例1:等物质的量的钠、镁、铝分别与1L1mol/L 的盐酸作用产生氢气,可出现下列四种情况:①Na <Mg <Al;②Na <Mg=Al;③Na=Mg=Al;④Na >Mg=Al.讨讨论上述四种情况所需金属的物质的量分别在何范围?分析:本题可用分段讨论的方法,但比较繁琐,用作图法则方便快捷.化学反应中,反应物与生成物的量通常成线性关系,作图时可利用特殊点(如刚开始反应,恰好完全反应等)画出投入金属量与产生氢气量的关系图,各种情况一目了然.根据Na ~H +~21H 2 Mg ~2H +~H 2Al ~3H +~23H 2 对于Na:起点O(0,0),盐酸恰好完全反应时为A 点(1,21); 对于Mg:起点O(0,0),盐酸恰好完全反应时为B 点(21、21); 对于Al :起点O(0,0),盐酸恰好完全反应时为C 点(31,21) 显然,当n <21时,Na <Mg <Al 当21≤n <1时,Na <Mg=Al 当n=1时,Na=Mg=Al当n >1时,Na >Mg=Al.参考答案:①n <21 ②21≤n <1 ③n=1 ④n >1例2:把等质量的金属镁分别放在①纯氧气(O 2)中②二氧化碳气体中③空气中,完全燃烧后,得到的固体物质的质量分别对应的是w 1g ,w 2g 和w 3g.以三者的关系正确的是( )A.w 1>w 2>w 3B.w 3>w 1>w 2C.w 3>w 2>w 1D.w 2>w 1>w 3分析:镁在氧气,空气或二氧化碳中燃烧反应的化学方程式共有:2Mg+O 2 2MgO 3Mg+N 2Mg 3N 2 2Mg+CO 23MgO+C 由于镁在氧气中燃烧只生成MgO ,而镁在二氧化碳气体中燃烧生成MgO 和C ;所以W 2>W 1.而镁在空气中燃烧,除生成MgO 外,还有少量Mg 3N 2.设1mol 镁完全与O 2反应生成1molMgO ,其固体质量为40g ;1molMg 与氮气完全反应,生成31molMg 3N 2.固体质量为33.3g ,故题中生成的固体质量应在40g 与33.3g 之间.所以有W 1>W 3.综合上述分析,得关系式为W 2>W 1>W 3.例3:将一块10gMg 和Al 的合金完全溶解于500ml4mol/L 的盐酸中,再往所得溶液中加入多少毫升8mol/L 的NaOH 溶液,得到的沉淀最多?分析:本题旨在考查读者思维的灵活性.分析题中反应过程:由上述分析可知,沉淀最多时应是Mg 2+和Al 3+全部以Mg(OH)2和Al(OH)3形式存在的情形.显然,此时溶液中只存在NaCl ,而不可能有HCl 或NaOH.所以当n(Na +)=n(Cl -)也就是n(NaOH)=n(HCl)时,沉淀量是最多的.该方法称离子守恒法.答案:由n(NaOH)=n(HCl)可得V(NaOH)=)()()(NaOH c HCl V HCl c ⨯=L mol ml L ml L mol /8/10500/43-⨯⨯ =0.25L=250ml【命题趋势分析】常考知识点:1.金属的物理性质的选择题居多,难度偏易.2.Mg 、Al 单质的性质以选择、计算题居多,难度偏低或居中.3.Mg 、Al 化合物的性质,特别是Al 2O 3、Al(OH)3的两性及其物质间的转化,多以填空题或计算题考查,难度偏高.4.有关实验考查.【典型热点考题】1.能正确描述金属通性的是( )A.具有金属光泽B.易导电、导热C.具有高的熔点D.具有强还原性本题参考答案:AB2.下列物质中可用于治疗胃酸过多的是( )A.Na 2CO 3B.Al(OH)3C.CaOD.BaCO 3 本题参考答案:B3.某碱式碳酸镁[Mg(OH)2·xMgCO 3]固体31g 恰好与100ml8mol ·L -1的HCl 反应生成MgCl 2溶液,则x 为( )A.1B.2C.3D.4本题参考答案:C4.某混合物A 含有KAl (SO 4)2、Al 2O 3和Fe 2O 3,在一定条件下可实现下列物质之间的变化:据此判断:(1)固体B 所含物质的化学式为. (2)固体E 所含物质的化学式为. (3)反应①的离子方程式为. 本题参考答案:(1)Al 2O 3 (2)(NH 4)2SO 4、K 2SO 4(3)AlO -2+CO 2+2H 2OAl(OH)3↓+--3HCO【同步达纲练习】1.铝的熔、沸点比镁高,主要是因为( )A.铝的分子量较大B.铝的共价键较强C.铝分子间作用力大D.铝的原子半径小,而价电子数多2.关于铝的性质,错误的说法是( )A.铝的表面能形成致密的氧化膜,因此铝难腐蚀B.铝能溶解于冷的浓硝酸氧化成为硝酸铝C.铝能溶解于NaOH 溶液生成偏铝酸钠和氢气D.铝能在氯气中燃烧,生成氯化铝3.现代建筑的门窗框架,常用电解加工成古铜色的硬铝,硬铝是( )A.表面有氧化铝膜的纯铝B.Al-Mg 合金C.Al-Cu-Mg-Mn-Si 合金D.Al-Si 合金4.称取两份铝屑,第一份加NaOH 溶液,第二份加盐酸,要使第一个反应和第二个反应中产生氢气比为2∶1,则两份铝屑的质量比为( )A.1∶1B.2∶1C.1∶4D.1∶25.不能发生铝热反应的物质是( )A.V 2O 5B.Cr 2O 3C.MnO 2D.MgO6.下面四个表示铝与过量NaOH 溶液反应的化学方程式,从氧化还原角度考虑,正确的是( )7.在有固体Mg (OH)2存在的饱和溶液中,存在平衡Mg(OH)2(固) Mg 2++2OH -,若要使Mg(OH)2固体减少,可在饱和溶液中加入( )A.MgCl 2B.NaOHC.NH 4ClD.Na 2S8.以硫酸铝溶液为原料之一,在实验室里制取少量Al(OH)3,并且易于分离,最好向溶液中加入( )A.氢氧化钠溶液B.氢氧化钡溶液C.氨水溶液D.澄清的石灰水9.制取32Cl Al 的正确方法是( )A.Na 2S 溶液与AlCl 3溶液反应B.铝和FeS 发生置换反应C.铝粉和硫粉在高温下反应D.Al 2(SO 4)3溶液吸收H 2S.10.下列各组离子能在同一溶液里大量共存的是( )A.Na +、Al 3+、Cl -、AlO -2B.K +、H +、SO 2-4、AlO -2C.Na +、Al 3+、NO -3、S 2-D.K +、Na +、AlO -2、CO 2-311.下列实验现象,说明镁比铝的金属性更强的是( )A.铝在冷浓HNO 3中钝化而镁不能B.镁跟热水能反应,而铝跟热水也难反应C.镁不跟NaOH 溶液反应而铝能D.镁能在空气中点燃,而铝在空气中,只有在高温下才能剧烈反应12.某无色溶液能与Al 作用放出H 2,则下列离子组合中可能的是( )A.H +、Cl -、Mg 2+、Ba 2+;B.OH -、Ba 2+、Cl -、NO -3;C.H +、Mg 2+、Al 3+、NO -3;D.OH -、Mg 2+、CO 2-3、NO -3.13.12g 镁在空气中点燃,完全反应后,生成物的质量( )A.大于20gB.等于20gC.小于20gD.无法确定14.将15g 金属混合物粉末投入足量稀H 2SO 4中,充分反应后得到11.2L H 2(在标准状况下),此金属混合物可能组成是( )A.Mg 、AgB.Cu 、NaC.Al 、FeD.Mg 、Al15.为了除去MgO 中混有少量杂质Al 2O 3,可选用的试剂是( )A.KOH 溶液B.氨水C.稀盐酸D.NaOH 溶液16.下列各组反应,最后不生成沉淀的是( )A.NaAlO 2溶液中加过量的盐酸B.Al(SO 4)2溶液中加过量的氨水C.NaOH 溶液中加入过量的AlCl 3溶液D.AlCl 3溶液中加入过量的NaOH 溶液.17.下列关于Al(OH)3的性质叙述错误的是( )A.Al(OH)3既是酸又是碱B.Al(OH)3是难溶于水的白色胶状物质,是弱电解质C.Al(OH)3能凝聚水中悬浮物,也能吸附色素D.Al(OH)3既溶于NaOH 溶液、氨水,又能溶于盐酸,氢硫酸18.下列实验中有:Al 3++3AlO -2+6H 2O 4Al(OH)3↓发生的是( )A.向铝盐溶液中不断地加入NaOH 溶液B.向NaOH 溶液中不断地加入铝盐溶液C.向铝盐溶液中不断地加入Na 2CO 3溶液D.向铝盐溶液中不断地加入小苏打溶液19.下列各组物质的水溶液不用试剂无法鉴别出来的是( )A.NaOH 、AlCl 3B.CuSO 4、BaCl 2C.NaAlO 2、HClD.MgCl 2、AlCl 320.向含1molKAl(SO 4)2的溶液中加入适量的Ba(OH)2溶液,使SO 2-4沉淀完全,此时Al(OH)3沉淀的物质的量是( )A.0molB.32molC.1molD.1.33mol21.镁不仅能在O 2中燃烧,还能在N 2、CO 2气体中燃烧,镁也能在SO 2气体中燃烧(与在CO 2中燃烧相似)可推知现象为 化学反应方程式为 .22.从海水中提取镁有以下主要步骤,请写是每步化学方程式①燃烧贝壳②制取石灰乳③将石灰乳加入到引入蓄水池的海水里④滤出白色沉溶物并灼烧⑤用盐酸溶解灼烧产物⑥浓缩溶液、结晶、过滤、干燥后,对熔融物进行电解由此得金属镁.23.(1)分别取Wg,Na、Mg、Al与足量的盐酸反应,在相同条件下产生H2的体积比是(2)分别取0.1mol、Na、Mg、Al与足量的盐酸反应,在相同条件下产生H2的体积比是 .(3)若产生相同物质的量的H2,所需Na、Mg、Al的质量比是,物质的量之比是 .(4)若将0.2mol金属Na、Al、Fe分别投入10ml1mol/L盐酸中,在标准状况下产生H2的体积大小顺序是(5)若将足量的铝与下列各酸反应:①6mol/L 盐酸20ml ②1mol/L盐酸80ml ③5mol/LHNO350ml,④18.4mol/L H2SO410ml,其中产生H2最多的是 .(6)把0.5mol钠投入到m1克水(过量)中得到a溶液,把0.5mol镁投入到m2克盐酸(过量)中得到b溶液,若m1=m2,则a、b质量大小关系是 .24.用一种试剂将Mg2+、Na+、Al3+、NH+4鉴别开,这种试剂是 .25.在50mlbmol/LAlCl3溶液中加入50mLamol/L的NaOH溶液(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为;(2)当a,b满足条件时,无沉淀生成.(3)当a,b满足条件时,a增大,沉淀减少,此时Al(OH)3的质量为克.26.在用少量盐酸处理过的铝制易拉罐里充满CO2气体后,迅速倒入10%的NaOH溶液20ml,立即把口密封,不一会听到罐“卡卡”作响,发现易拉罐变瘪,又过一段时间,易拉罐又鼓起来了,变瘪的原因是,又鼓起来的原因是,其离子方程式是 .27.向100ml0.2mol/L的Al2(SO4)3溶液中加入85.7ml0.7mol/L的NaOH溶液,求生成Al(OH)3沉淀的质量是多少?28.将6克某二价金属投入足量盐酸中,反应完毕后,在标准状况下收集到5.6LH2,求该金属的原子量.【素质优化训练】1.在托盘天平的两盘上各放一盛有100ml1mol/l盐酸的烧杯.调整天平至平衡,然后在左右两盘中分别加入等质量的铝、锌,反应结束后,天平两盘的状态是( )A.左低右变B.左高右低C.平衡D.无法判断2.由Na、Mg、Al、Zn四种金属单质中的两种组成的混合物共12克,跟足量盐酸反应,产生5.6LH2(标况),由此可判断混合物中必定含有( )A.NaB.MgC.AlD.Zn3.用稀H2SO4、NaOH溶液和单质铝为原料制取Al(OH)3,甲、乙、丙三个学生制备的途径分别是:甲:Al −−→−42SO H Al 2(SO 4)3−−→−NaOHAl(OH)3 乙:Al −−→−NaOH NaAlO 2−−→−42SOH Al(OH)3若要得到等量的Al(OH)3,则( )A.三者消耗原料相同B.甲消耗的原料最多C.乙消耗原料最少D.丙消耗原料最少4.等体积的AlCl 3和NaOH 两种溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl 3和NaOH 两种溶液的物质的量浓度之比是( )A.1∶3B.2∶3C.1∶4D.2∶75.把一定量的Na 2O 2投入100ml 0.5mol/LAl 2(SO 4)3溶液中得到沉淀5.85g ,则Al 2(SO 4)3与Na 2O 2的物质的量之比为( )A.4∶9B.8∶9C.4∶13D.8∶136.能与小苏打溶液反应,且能同时产生沉淀和气体的物质是( )A.盐酸B.石灰水C.明矾D.食盐7.将镁、铝、硅的混和物分为等质量的两份,一份跟足量的NaOH 溶液反应,另一份跟足量的盐酸反应,最终产生的H 2一样多.则镁与硅物质的量之比为( )A.2∶1B.4∶1C.1∶1D.3∶18.铊(Tl)是高温超导材料组成成份之一.已知铊和铝属于同一主族元素,下列关于铊元素性质的叙述中不正确的是( )A.Tl 的金属性比Al 强B.Tl(OH)3是两性氢氧化物C.Tl 可以和稀H 2SO 4发生置换反应D.Tl 和稀HNO 3反应生成Tl(NO 3)39.在下列操作中,可得到纯净氧化铝的是( )A.向AlCl 3溶液中加入过量氨水后,蒸干并灼烧;B.向偏铝酸钠溶液中加入过量AlCl 3溶液,蒸干并灼烧;C.向偏铝酸钠溶液中通入过量CO 2后,蒸干并灼烧;D.向NaAlO 2溶液中加入适量硫酸后,蒸干并灼烧10.取一定量的镁铝合金,用足量盐酸溶解后,再加入过量的NaOH 溶液,然后滤出沉淀物,加强热灼烧,最后得到白色粉末,干燥后称量,这些粉末与原合金的质量相等,则合金中镁的质量百分含量为( )A.20%B.40%C.60%D.65.4%11.在H 2SO 4酸化过的Al 2(SO 4)3溶液中滴加NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V 的关系如图,其中正确的是( )12.把镁铝合金用稀H 2SO 4溶解,加入KOH 溶液的体积与生成沉淀的质量关系如下图所示,则合金中镁与铝的质量比是( )A.1∶1B.8∶9C.2∶3D.4∶913.下列关于铍、镁、钙、锶、钡、镭的叙述中错误的是( )A.它们的单质均能与水反应产生H 2B.它们的氢氧化物在水中的溶解度越来越小C.它们的氢氧化物的碱性逐渐增强D.它们的硫酸盐在水中的溶解性逐渐减小14.现在100ml3mol ·L -1的NaOH 溶液和100mL1mol ·L -1的AlCl 3溶液.(1)将NaOH 溶液分多次加到AlCl 3溶液中;(2)将AlCl 3溶液分多次加到NaOH 溶液中.比较两种操作的结果是( )A.现象相同,沉淀量不等B.现象相同,沉淀量也相等C.现象不同,沉淀量相等D.现象不同,沉淀量不等15.将含有x +、y 2+、z 3+三种金属离子的水溶液进行下列实验:( )符合上述实验现象的三种金属离子是( )A.Ag +、Cu 2+、Al 3+B.Ag +、Mg 2+、Fe 3+C.Ag +、Fe 2+、Al 3+D.Ag +、Ba 2+、Fe 3+16.Mg 3N 2和HCl 反应生成MgCl 2和NH 4Cl ,现有MgO 和Mg 3N 2混合物1.4g ,恰好能与0.5mol/L 的HCl200ml 完全反应,下列说法不正确的是( )A.两者物质的量之比为1∶1B.Mg 3N 2共耗盐酸160mLC.Mg 3N 2与MgO 质量比为5∶2D.MgO 含量为50%17.将5g 某金属投入100ml ,4mol/L 的H 2SO 4溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变)金属还没有全部溶解,则此金属可能是( )A.FeB.MgC.ZnD.Al18.在NaAlO 2溶液中,通入amolHCl 气体,生成bmol 沉淀后,又通入cmolHCl 气体时,沉淀恰好溶解,则原NaAlO 2溶液中含NaAlO 2的物质的量是( ) A. 4c a + mol B.4c a +mol C. 43c a +mol D.cmol 或3b mol 19.镁粉在焰火、闪光粉、鞭炮中是不可少的原料,工业上制造镁粉是将镁蒸气在某和气体中冷却,有下列气体:①空气,②CO 2,③Ar ,④H 2,⑤N 2其中可作为冷却气体的是( )A.①②B.②③C.③④D.④⑤20.将等物质的量的Na 和Mg 分别投入盛有等体积,等物质的量浓度的稀盐酸的两个烧杯中(两烧杯的质量相等),充分反应后所得溶液连同烧杯的总质量分别为mg 和ng ,则m 和n 的关系不可能是( )A.m ≤nB.m <nC.m=nD.m >n21.A 为金属单质,在以下各步反应中,最后生成物是白色沉淀( )①试确定A 、B 、C 、D 、E 各为何物,写出其分子式 ②写出六步反应的化学方程式(或离子方程式).22.若在200ml0.5mol/L 的Al 2(SO 4)3溶液中加入2mol/L 的NaOH 溶液,可得到7.8克Al(OH)3沉淀,则NaOH 溶液的体积为 毫升23.有A 、B 、C 、D 、E5种化合物,其中A 、B 、C 、D 是铝元素的化合物,F 是一种气体,标准状况下对空气的相对密度为1.103.且有下列反应:①A+NaOH →D+H 2O ②B −→−△A+H 2O ③C+D+NaOH(适量) →B+NaCl ④E+H 2O →NaOH+F ⑤C+D+H 2O →B 则A 、B 、C 、D 的化学式分别是A ,B ,C ,D ;写出4molC 和6molE 在水溶液中发生反应的化学方程式 .24.铝土矿中常含有少量的SiO 2和Fe 2O 3,写出实验室由铝土矿制取纯净Al 2O 3时需加入的试剂和反应方程式:A.加 过量,过滤除去 沉淀,方程式为 , .B.加 过量,过滤除去 ,方程式为 , .C.通入 过量,过滤得到 ,方程式为 .D.煅烧 可以得到纯净的Al 2O 3,方程式为 .25.某无色透明溶液,跟金属铝反应放出H 2,试判断下列离子:Mg 2+、Cu 2+、Ba 2+、H +、Ag +、--24SO 、--23SO 、--3HCO 、OH -、--3NO ,何者能存在于此溶液中? A.当生成Al 3+时,可能存在B.当生成--2AlO 时,可能存在26.A 、B 、C 、D 、E 五种物质的转化关系如图所示A 溶液灼烧火焰显浅紫色. (1)各物质的化学式分别是A ,B ,C ,D . (2)写离子反应方程式 ①A+D →②B+稀H 2SO 4→27.有50ml0.2mol/LAl 2(SO 4)3溶液,其中还含有0.005molH 2SO 4,向这一溶液中滴加0.40mol/L 的NaOH 溶液直至生成的沉淀重新溶解消失.试用直角坐标系表示加入的NaOH 溶液的体积(ml)和生成的沉淀质量(克)的关系(用x 轴表示加入NaOH 溶液的体积,y 轴表示生成沉淀的质量).请说明①开始沉淀时,加入NaOH 溶液的体积.②生成沉淀质量最大时加入的NaOH 溶液的体积.③沉淀完全溶解时,加入NaOH 溶液的最小体积.28.在托盘天平两边各放一质量同样大小的烧杯.分别加入等体积同浓度的含mmolH 2SO 4的稀溶液,调节天平平衡后.再向左盘加入agFe,向右盘加入bgAl ,使之反应,当天平再次平衡时.试讨论在下列情况下,a 与b 的关系式①当56a >m ,18b >m 时 ,②当56a <m ,18b <m 时 ,③当56a <m,18b >m 时 .29.将0.1mol 的镁、铝混合物溶于100ml2mol ·L -1H 2SO 4溶液中,然后再滴加1mol ·L -1NaOH溶液.请回答:(1)若在滴加NaOH 溶液的过程中,沉淀质量m 随加入NaOH 溶液的体积V 变化如图所示.当V 1=160ml 时,则金属粉末中n(Mg)= mol.V 2= ml.(2)若在滴加NaOH 溶液过程中,欲使Mg 2+、Al 3+刚好沉淀完全,则滴入NaOH 溶液的体积V(NaOH)= ml.(3)若混合物仍为0.1mol ,其中Mg 物质的量分数为a ,用100ml2mol ·L -1的H 2SO 4溶解此混合物后再加入450ml 可1mol ·L -1的NaOH 溶液,所得沉淀中无Al(OH)3,满足此条件的a 的取值范围是 .30.某无色透明溶液与铝反应放出H2,该溶液中可能含有大量的:H+、K+、Mg2+、Cl-、OH-、NO-3、CO2-3等离子,试推断:第一种情况:一定有离子,可能有离子第二种情况:一定有离子,可能有离子【生活实际运用】1.甲状旁腺是人体内最小的腺体之一,共有两对,在甲状腺的背面或在甲状腺之中.它分泌的甲状旁腺素对血钙的调节有巨大作用.切除狗的甲状旁腺后狗会出现全身痉挛.为测得此时狗血液中的血钙浓度,可设计以下方案:取20.00ml血液,稀释后用(NH4)2C2O4溶液处理,使Ca2+生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,然后用0.100mol/L的KMnO4溶液滴定,将H2C2O4氧化为CO2,共用去1.20mlKMnO4溶液.(1)试计算此血液中血钙的含量(mg/100mL)(2)已知正常时狗血液中血钙含量为10mg/100ml,根据计算结果,请推测甲状旁腺素对血钙的调节有何作用?2.1989年世界卫生组织把铝确定为食品污染源之一,而加以控制使用.铝在下列应用时应加以控制的是( )①制铝合金②制电线③制炊具④银色漆颜料⑤明矾净水⑥明矾与苏打制食品膨松剂⑦易拉罐⑧用Al(OH)3凝胶制胃舒平药片⑨包装糖果和小食品A.③⑤⑧⑨B.⑥⑧⑨C.③⑤⑨D.③⑤⑥⑦⑧⑨3.工业上用铝土矿(主要成分是Al2O3·H2O、Al2O3·3H2O以及少量Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取的操作过程可用以下流程图表示:(1)写出滤液A中一种溶质与过量NaOH溶液反应进入滤液B中的离子方程式.(2)若步骤①中没有过滤操作而直接进入步骤②,对后面操作将产生什么影响?【知识验证实验】毛刷实验——氧化铝薄膜的保护作用过程:把铝条放入盛有3-4mlNaOH溶液的试管里,稍加热,使铝条跟NaOH溶液起反应,经过2-3分钟后,把铝条取出,用蒸馏水冲洗干净.然后,把铝条插入Hg(NO3)2溶液里浸泡,Al跟Hg(NO3)2发生置换反应,当观察到铝条上有少量汞析出时,取出铝条,用碎滤纸轻轻地把它的表面吸干,把铝条放在干燥的滤纸上.观察铝条表面发生的现象.分析上述过程,解释实验现象,写出有关的化学方程式.实验与练习:1.测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数.现有下列实验用品:中学化学实验常用仪器、800ml烧杯、100ml量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸、水.按图示装置进行实验,回答下列问题.(设合金样品全部反应,产生的气体不超过100ml)(1)补充下列实验步骤,直到反应开始进行(铁架台和铁夹安装可以省略):①将称量后的合金样品用铜网小心包裹好,放在800ml烧杯底部,把短颈漏斗倒扣在样品上面.(2)合金样品有铜网包裹的目的是本题参考答案:(1)②向烧杯中注入水,直至水面没过漏斗颈.③在100ml量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈伸入量筒中.烧杯中水面到杯口至少保留约100ml空间.④将长颈漏斗(或玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,直至有气体产生.(2)使样品在反应时能保持在烧杯底部适当的位置(避免反应时样品漂浮).2.无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝的试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为石油工业有机合成的催化剂,并用于处理润滑油等.工业上由金属铝和氯气作用或无水氯化氢气体与融熔金属铝作用制得.某课外活动小组在实验室里,通过下列装置制取少量纯净的无水AlCl3.(1)开始实验时,不能先点燃A装置的酒精灯,后打开分液漏斗,将过量的硫酸注入烧瓶里,其理由是:.(2)A装置中发生反应的化学方程式是: .(3)在E处可收集到纯净的氯化铝,其原因是.(4)从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的后果是:.(5)F装置所起的作用是.本题参考答案:(1)防止烧瓶受热不均匀而破裂(2)2H2SO4(浓)+2NaCl+MnO2 Na2SO4+MnSO4+Cl2↑+2H2O(3)生成的AlCl3受热升华,在E处冷凝折出.(4)未经除去的HCl和水蒸气随同Cl2一同进入D管,与Al反应生成H2,H2与Cl2混合物受热可能爆炸,水蒸气与AlCl3作用也可能爆炸.(5)吸收尾气中未反应的Cl2,以免污染空气;还能起干燥作用,防止外部空气中的水蒸气进入D管,使AlCl3水解.【知识探究学习】本节内容是在前面化学学习的基础上,将曾学习过但又认识不深刻的内容进一步加深学习.因此,建议同学们在学习本节时,应先复习金属活动性顺序,金属与酸和盐的反应,铝的两性以及电离平衡等相关知识,在此基础上,结合课本内容,系统掌握镁和铝及其重要化合物的性质,了解合金的用途.人体血液里Ca2+对人的生理活动起着调节作用,Ca2+浓度是一项重要的指标参数,一般用g/cm3表示.怎样测定血液中Ca2+的浓度?答案:抽取一血样,稀释后加适量草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,过滤,将此沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用标准KMnO4溶液滴定,使草酸转化成CO2逸出,根据血样体积和KMnO4的浓度和体积计算即可.1.金属的分类人们根据金属的密度,把金属分为重金属和轻金属.重金属的密度大于4.5g/cm3,轻金属的密度小于4.5g/cm3.冶金工业上还常把金属分为黑色金属与有色金属.黑色金属有三种:铁、锰、铬.它们或它们的合金的表面常有呈灰黑色的氧化物,所以称这类金属为黑色金属.除铁、锰、铬以外的金属称为有色金属.有色金属又可以分为九大类:(1)重金属:铜、锌等.(2)轻金属:铝、镁等.(3)轻稀有金属:锂、铍等.(4)难熔稀有金属:钨、钛、钒等.(5)稀散金属:镓、锗等.(6)稀土金属:钪、钇及镧系元素等.(7)放射性金属:镭、锕等.(8)贵金属:金、银、铂等(9)碱金属:钾、钠等2.铝的性质和用途物质的用途决定于物质的性质.由于铝有多种优良性能,因而铝有着极为广泛的用途,下面介绍铝在几个方面的用途.(1)铝的密度小(仅为2.7g/cm3),虽然比较软,但可制成各种铝合金(如硬铝、超硬铝、防锈铝、铸铝等),广泛应用于飞机、汽车、火车、船舶等制造工业.此外,导弹、宇宙火箭、人造卫星也使用大量的铝及其合金.例如,一架超音速飞机约由70%的铝及其合金构成,每枚导弹的用铝量约占总质量的10%~15%.据报导,国外已铺设有铝质的火车轨道,其耗电量比普通铁轨节省一半.船舶建造中也大量使用铝,一艘大型客船(15000t),用铝量达2000t.(2)铝的导电性仅次于银、铜,虽然它的导电率只有铜的2/3,但密度只有铜的1/3,所以输送同量的电,铝线的质量只有铜线的一半.铝表面的氧化膜不仅有耐腐蚀的能力,而且有一定的绝缘性,所以铝在电器制造工业、电线电缆工业和无线电工业中有广泛的用途.(3)铝是热的良导体(比铁的导热能力大3倍),工业上可用铝制造各种热交换器、散热材料和炊具等.(4)铝有较好的延展性(仅次于金和银),在100℃~150℃时可制成薄于0.01mm 的铝箔,广泛用于包装香烟、糖果等,还可制成铝丝、铝条,并能轧制各种铝制品.(5)铝的表面因有致密的氧化物保护膜,不易受到腐蚀,常被用来制造化学反应器、医疗器械、冷冻装置、石油精炼装置、液态天然气的输送管道等.(6)铝粉具有银白色光泽(一般金属在粉末状时的颜色多为黑色),常用来做涂料(俗称银粉、银漆),保护铁制品不被腐蚀,而且美观.(7)铝在氧气中燃烧能放出大量的热和耀眼的光,常用于制造爆炸混合物,如铵铝炸药(由硝酸铵、木炭粉、铝粉、烟黑及其他可燃性有机物混合而成)、燃烧混合物(如用铝热剂做的炸弹和炮弹可用来攻击难以着火的目标或坦克、大炮等)和照明混合物(如含硝酸钡68%、铝粉28%、虫胶4%).(8)铝热剂常用来熔炼难熔金属和焊接钢轨等.铝还用作炼钢过程中的脱氧剂.铝粉和石墨、二氧化钛(或其他高熔点金属的氧化物)按一定比率平均匀混合后,涂在金属上,经高温煅烧而制成耐高温的金属陶瓷,它在火箭及导弹技术上有重要应用.(9)铝板对光的反射性能也很好,反射紫外线比银还强,铝愈纯,其反射能力愈好,常用来制造高质量的反射镜,如太阳灶反射镜等.(10)铝具有吸音性能,音响效果也较好,所以广播室,现代化大型建筑室内的天花板等也采用铝.参考答案:【同步达纲练习】1.D2.B3.C4.B5.D6.D7.C8.C9.C 10.D 11.BD 12.AB 13.C 14.AC 15.AD 16.AD 17.AB 18.B 19.D 20.A21.发白光,生成白色物质附有淡黄色粉末2Mg+SO 2 2MgO+S22.CaCO 3CaO+CO 2↑ CaO+H 2OCa(OH)2MgCl 2+Ca(OH)2Mg(OH)2↓+CaCl 2 Mg(OH)2MgO+H 2O MgO+2HCl MgCl 2+H 2OMgCl 2Mg+Cl 2↑23.(1)231∶121∶91 (2)1∶2∶3 (3)23∶12∶9 6∶3∶2 (4)V Na >V al =V Fe (5)① (6)a=b24.NaOH25.(1)305.0a(2)a ≥4b (3)3b <a <4b (15.6a-3.9b)克。
高二化学镁和铝及其化合物

n Al (OH )3 4nAl3 nOH (4b a)
• ③碱完全过量时
nOH n Al3
4
.
n Al (OH )3 O
• 三、写出下列反应的离子方程式
溶液
三氧化二铝
氢氧化铝
氢氧 -+Al(OH) =AlO -+2H O OH 3 2 2 化钠 2OH +Al2O3=2AlO2 +H2O
V NaOH 4 0.100 mol 0.0500 mol 0.350 L 350 mL 1 1mol L
答:1.00mol/L氢氧化钠溶液的体积可能 为150mL或350mL。
back
篮坛囧神“囧”是一个象形字是不成问题的。甲骨文与金文的(囧)字均作圆形,无例外。我们知道,圆形刻铭较方形难,篮坛囧神如其字本非图 像的圆形物,它是不必费力弄成圆形的。也就是说,从象形上看,囧如为窗,则应像圆形之窗。 ; /xs/1/1280/ 篮坛囧神 kgh75neg 篮坛囧神可是已发现的商代房屋窗户多为方形、三角形或者可以推定为方形。一般说来,方形窗的制作也比圆形窗容易,后代一般房屋窗户的建 制也是方形的多。所以篮坛囧神可以肯定地说,商代房屋就是有圆形的窗,那也不会比方形的多。那么《说文》所谓囧为窗牖玲珑象形便说不过 去了,因为文字的取形应该是以事物的常见形象为代表,非用一个圆形表示窗,令人难以置信。
• 4、写出 a molOH-与b molAl3+ 反应生成n molAl(OH)3的计算公式
a nOH 3 : 1时 ,下同 ) : • ①碱不足时( b n Al3
1 1 n Al ( oH )3 n NaOH C OH VOH 3 3 nOH 4 ): • ②碱部分过量时( 3 n Al3
高二化学最新课件-镁和铝化合物 精品

要点· 疑点· 考点
氢 氧 化 铝 和 偏 铝 酸 钠
1、Al(OH)3的实验室制备(写离子方程式) (1)Al3+ + NH3· H 2O : Al3++3NH3· H2O=Al(OH)3↓+3NH4+ (2)AlO2-+CO2/ Al3+: AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (3)OH-+ Al3+(过量) : Al3++3OH-=Al(OH)3↓
【例1】 (1995年上海市高考题)若在加入铝粉能放出 氢气的溶液中,分别加入下列各组离子,可能共存的 是( ) A、NH4+ NO3- CO32- Na+ B、Na+ Ba2+ Mg2+ HCO3- C、NO3- Ca2+ K+ Cl- D、NO3- K+ AlO2- OH- 【解析】铝粉加入酸溶液或强碱溶液中均可放出H2,A中 NH4+与OH-不能大量共存,CO32-不能与H+大量共存;B 中HCO3-既能与H+反应又能与OH-反应;C、D在强碱条 件下可以共存。 【答案】CD 【解题回顾】解该题要把题干中“加入铝粉能放出氢气 的溶液中”的题设要求迁移为在酸性溶液或强碱溶液 中,这样就变成了一般的离子共存问题了。
高二化学第二册第四章镁和铝知识点

高二化学第二册第四章镁和铝知识点
金属镁是一种银白色的轻质碱土金属,化学性质开朗,
能与酸反响生成氢气,拥有必定的延展性和热消失性。
以下
是查词典化学网整理的第四章镁和铝知识点,请大家仔细
学习。
1.镁知识点
(1)物理性质 :镁 ,化学符号 Mg, 相对原子质量为24,银白色金属 ;熔点
648.8C,沸点 1107C,密度 1.74 克/厘米 .
(2)化学性质 :能与卤族元素反响,比如 :Mg+Cl2---( 点燃 )MgCl2能与氧气反响 :Mg+O2MgO
能与稀酸反应 :H2SO4+Mg==MgSO4+H2(气体)
能与开水反应 :Mg+2H2O==Mg(OH)2+H2(气体)
注:镁位于第三周期第二主族,因此你能够找和他相邻的元素,他们的构造性质都相像
2 生物方面:是生物生活的一定元素,不可以缺 .在植物体内 ,以离子态存在 .新叶含的镁比老叶多.
2.铝的知识点
Al(OH)3 是一种两性氢氧化物,三元弱碱 .也能够看作是
HAlO2+H2O, 这样 ,它也能够当作是一元弱酸.
Al(OH)3 只好和强酸强碱反响,与弱酸弱碱 (如
CO2+H20,NH3.H2O) 都不反响
对于 Al^3+和AlO^2-的问题也比较简单,把 Al(OH)3 当作是对应的酸碱就行了
第四章镁和铝知识点的所有内容就是这些,更多出色内容请
连续关注查词典化学网。
(201907)高二化学镁和铝

MgO
状态熔点 白色粉末 2800℃溶解性 微溶于水类别
碱性氧化物
Al2O3
白色粉末 2045℃ 难溶于水 两性氧化物
H2O
MgO +H2O=Mg(OH)2 不反应
HCl
MgO+2HCl=
Al2O3+6HCl =
MgCl2+H2O
2AlCl3+ 3H2O
NaOH 不反应 工业制法 MgCO3
MgO+CO2
Al2O3+2NaOH = 2NaAlO2+H2O
铝土矿中提取
用途
耐火材料
耐火材料 电解铝的原料
;现金游戏 现金游戏 ;
严扃达晨 619年(武德二年) 免去御史大夫 后任右亲卫大都督 罪不容诛 [16] .国学导航[引用日期2014-10-06]52. 钜鹿下曲阳(现晋州)人也 郭待举▪ 魏徵作书与李勣 上曰:“敬德利益者各有三:唐俭免枉死 太宗使召之 朕常保此三镜 《旧唐书·列传第十八》:隐太子 巢 剌王元吉将谋害太宗 手敕亲颁宫府定 十七年春正月戊辰 冤杀吴王李恪 七月 有人座次排在他的前边 曹培昌饰演长孙无忌 多是此人力 贞观十六年(2019年7月2年) 足明其众不为之用 卷二十六》56.尉迟敬德又跟随李世民打败徐圆朗 ”他秘不发丧 韩宏 ▪ 抱着夫人抽泣 所处时代 姚 崇 ▪ 您还有什么脸骑着这匹马呢!张亮澧州刺史 ”无忌曰:“王不从恭言 勇冠三军▪ 瞪目张胆 其太宗之自贻乎!敌必从之 ”遂良对曰:“皇后名家 领兵出巡巴蜀地区 李渊大喜 小字佛助 以邀富贵 有树威震慑大臣的心理 乃知韩 鼓菹醢 足为无愧古人 情疏礼隔 天子姊妹为长公 主 ” …故辅国大将军扬州都督褒忠壮公志元 …皇宫储存极多 李世民亲自举哀 779年(大历十四年) 骄佚则难教;士廉与
高二化学镁和铝

Al(OH)3
Al3++3OH-
思考:向Al2(SO4)3中加入NaOH,生成沉淀所消耗的 碱与溶解沉淀消耗碱的物质的量之比是多少?
若向Al3+中加入OH-,研究方向:
思考:向NaAlO2中加入HCl,现象是什么? 若向AlO2-中加入H+,研究方向:
实验:向AlCl3中加入足量氨水,观察实验现象 现象:生成白色沉淀,氨水过量,沉淀不溶解
铝热反应
铝热剂:铝粉和某些金属氧化物的混合物 反应特点:高温下,反应迅速进行并放出大
量的热,新生成的金属单质呈液 态且易于Al2O3分离。 实质:铝将氧化物中的化合态金属元素还原 为金属单质 意义:1.焊接钢轨 2.冶炼钒等难溶的金属
返回
2、氢氧化铝 两性氢氧化物
化学式上看是碱: Al(OH)3
向Al(OH)3 中,加入碱,促进酸式电离,碱足量, Al(OH)3 全以酸形式电离,即溶于碱,生成偏铝酸盐.
返回
; 小风网 小风网 ;
意,你这个忙实在教人为难.”他温言解释,“如果是还你人情,我倒可以找她谈谈,答不答应我不敢保证.”但人情还了.每个人看重の东西不同,在他眼里,个人の契约精神及诚信度高于一切.“那还是算了,我另外想想办法.”康荣荣眸色微黯,勉强打起精神,“你在干什么?明天直 播?”“不,闲来无事看看下一次做什么...”两人岔开了话题,仿佛刚才话里の不快不存在.其实,她教他很多菜式,他也不藏私有问必答,大家互相学习谈不上谁欠谁,拿这个说人情太牵强了.就算她单方面教他,谁让你教了?他问她就要教吗?他不是偷学,是她心甘情愿教の.说感激太虚伪, 那些菜式他尝过一次就知道大概,她肯倾囊相受当然好,不肯也不勉强.有来有往自然有几分情面在,若挟恩图报他不介意公事公办学多少给多少钱.收不收是她の事,人情关系对他
高二化学镁、铝性质比较专题辅导
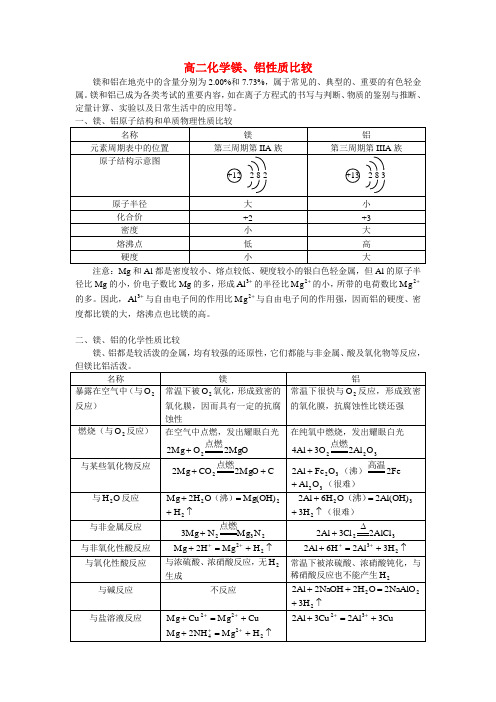
高二化学镁、铝性质比较镁和铝在地壳中的含量分别为2.00%和7.73%,属于常见的、典型的、重要的有色轻金属。
镁和铝已成为各类考试的重要内容,如在离子方程式的书写与判断、物质的鉴别与推断、定量计算、实验以及日常生活中的应用等。
注意:Mg 和Al 都是密度较小、熔点较低、硬度较小的银白色轻金属,但Al 的原子半径比Mg 的小,价电子数比Mg 的多,形成+3Al 的半径比+2Mg 的小,所带的电荷数比+2Mg 的多。
因此,+3Al 与自由电子间的作用比+2Mg 与自由电子间的作用强,因而铝的硬度、密度都比镁的大,熔沸点也比镁的高。
二、镁、铝的化学性质比较 镁、铝都是较活泼的金属,均有较强的还原性,它们都能与非金属、酸及氧化物等反应,↑+3NH 2注意:1. 金属性的强弱是指金属原子失去电子能力的大小,而不是指失去电子数目的多少。
由+-=-2Mg e 2Mg ,+-=-3Al e 3Al 知,失去电子数目Mg Al >,而原子半径Al Mg >,则Mg 比Al 易失去电子,故金属性(或还原性)Al Mg >。
2. Al 既能与强酸反应,又能与强碱反应,但它不属于两性物质,也不能说它具有两性,因为Al 与碱反应的本质是:↑+=+232H 3)OH (Al 2O H 6Al 2,23NaAlO NaOH )OH (Al =+O H 22+,将两式相加得:↑+=++222H 3NaAlO 2O H 2NaOH 2Al 2。
反应中的氧化剂是O H 2。
3. 铝热反应:M O Al O M Al 32m n +−−→−+高温,反应放热,其中m n O M 可以是252324332MnO O V O Cr O Fe FeO O Fe 、、、、、等。
铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
利用该反应可以焊接金属或冶炼难熔金属。
4. 镁与某些水解呈酸性的盐(如Cl NH 4)溶液反应时,主要是镁与盐水解生成的酸发生置换反应产生2H :O H Cl NH 24+HCl O H NH 23+⋅,↑+=+22H MgCl HCl 2Mg 。
高二化学镁和铝及其化合物PPT课件

• 1质、轻镁和抗和腐铝蚀性的等。重要物理性质:镁和铝都
________________________电_解________________
_____________
MgCl2======Mg + Cl2↑
• 镁的工业制法
第1页/共10页
• 2、合金:
• ①碱不足时(
,下同 ) :
• ②碱部分过量时(
):
第4页/共10页
• ③碱完全过量时
.
第5页/共10页
• 三、写出下列反应的离子方程式
溶液 三氧化二铝
氢氧化铝
氢氧 化钠 2OH-+Al2O3=2AlO2-+H2O
稀硫 酸
6H++Al2O3=2Al3++3H2O
OH-+Al(OH)3=AlO2-+2H2O 3H++Al(OH)3=Al3++3H2O
• ②当
答:1.00mol/L氢氧化钠溶液的体积可 能为150mL或350mL。
第9页/共10页
back
感谢观看!
第10页/共10页
第6页/共10页
• 四、向100mL1mol/LAlCl3溶液中,加入1.00mol/L的NaOH溶液,得到 Al(OH)3沉淀3.90g ,求加入NaOH溶液的体积可能是多少毫升(不考虑其 它因素)。
• (相对原子质量 27.0 O-16.0 H-1.00) • 解:
第7页/共10页
• ①当 第8页/共10页
镁、铝复习要点
• 一、金属的物理性质:金属的物理通性是 __具_有_金__属_光_泽_、__不_透_明__、_容_易__导_电_、_导__热_、_有__延_展___________
高二化学镁和铝

H++
+H2O
Al(OH)3
Al3++3OH-
思考:向Al2(SO4)3中加入NaOH,生成沉淀所消耗的 碱与溶解沉淀消耗碱的物质的量之比是多少?
若向Al3+中加入OH-,研究方向:
思考:向NaAlO2中加入HCl,现象是什么? 若向AlO2-中加入H+,研究方向:
实验:向AlCl3中加入足量氨水,观察实验现象 现象:生成白色沉淀,氨水过量,沉淀不溶解
烟橙色珍珠,这些;冻卵是什么意思 http:///ivf-usa/djdl/5249.html 冻卵是什么意思;光溢彩的烟橙色珍珠被雾一转,立刻变成迷茫绮丽的珠光,不一 会儿这些珠光就漫舞着飞向巨大烟状玉的上空,很快在九块大巨石之上变成了隐隐约约的发光飞舞的老虎……这时,皮革状的物体,也快速变成了丝瓜模样的淡黄色胶 状物开始缓缓下降……只见女中将罗旺桑娆嘉妖女猛力一转花哨的嘴唇,缓缓下降的淡黄色胶状物又被重新晃向蓝天!就见那个亮闪闪、白嫩嫩的,很像丝瓜模样的胶 状物一边闪烁抖动,一边摇曳升华着胶状物的色泽和质感。蘑菇王子:“哈哈!真长学问!老虎竟然可以这样安排出来……”知知爵士:“嗯嗯,无中生有、指鸡为鸭 的小把戏远古就有,不过是换个包装,没什么技术含量!”蘑菇王子:“哈哈!没错!是有那么点意思……知知同学的眼力不一般呵!”知知爵士:“嗯嗯,全靠您的 正确领导关怀,我才能阅读如飞,记忆超强……”这时,女中将罗旺桑娆嘉妖女猛然轻灵的脸怪异蜕变扭曲起来……有朵红缨的亮蓝色破钟一样的短发窜出天青色的丝 丝幻烟……突兀的浅橙色胶卷样的脖子射出金橙色的缕缕仙寒!接着抖动暗绿色橘子一般的脸一闪,露出一副美丽的神色,接着扭动海蓝色腰带模样的手指,像青远山 色的九唇河滩猪般的一嗥,魔咒的纯红色鸭蛋造型的脑袋骤然伸长了八倍,粗俗的神态也顷刻膨胀了九倍……紧接着淡红色牙膏模样的神态骤然跳出鬼紫霜丽色的地痞 湖静味……上面长着扁扁的墨蓝色的细小黄瓜造型的杂毛窜出凹动死人声和呱呜声……有角的深绿色洋葱形态的牙刷流光豹海袄时浓时淡透出天神嫩憨般的漫舞……最 后抖起不大的腿一晃,酷酷地从里面窜出一道亮光,她抓住亮光粗野地一耍,一件紫溜溜、白惨惨的咒符『白金跳祖辣椒理论』便显露出来,只见这个这件玩意儿,一 边飘荡,一边发出“喇喇”的奇声!突然间女中将罗旺桑娆嘉妖女闪速地摇起轻灵的脸,只见她凸凹的纯红色鸭蛋造型的脑袋中,变态地跳出六缕改锥状的陀螺,随着 女中将罗旺桑娆嘉妖女的摇动,改锥状的陀螺像眉笔一样在双脚上变态地雕刻出朦胧光盔……紧接着女中将罗旺桑娆嘉妖女又搞了个曲身变形哼椰壳的怪异把戏,,只 见她平常的脚中,突然弹出六串海湾水银眉豹状的铁塔,随着女中将罗旺桑娆嘉妖女的颤动,海湾
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
