PI staining FACS
第3章FACSCalibur日常操作
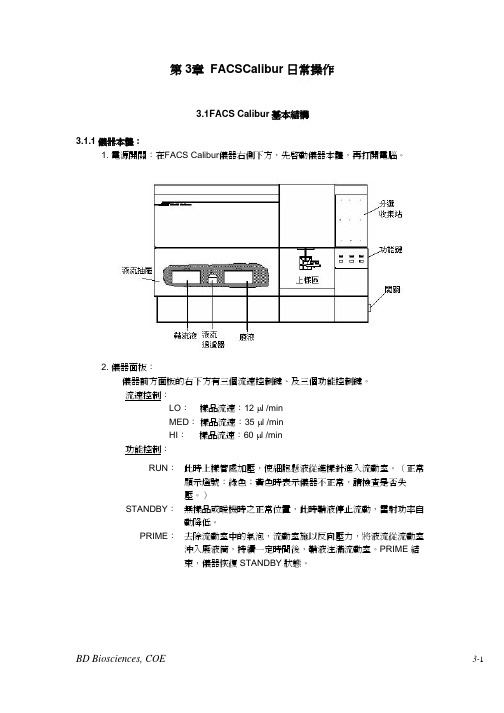
第 3章 FACSCalibur 日常操作3.1FACS Calibur基本結構3.1.1儀器本體:1. 電源開關:在FACS Calibur儀器右側下方,先啟動儀器本體,再打開電腦。
2. 儀器面板:儀器前方面板的右下方有三個流速控制鍵、及三個功能控制鍵。
流速控制:LO:樣品流速:12 µl /minMED:樣品流速:35 µl /minHI:樣品流速:60 µl /min功能控制:RUN:此時上樣管處加壓,使細胞懸液從進樣針進入流動室。
(正常顯示燈號:綠色;黃色時表示儀器不正常,請檢查是否失壓。
)STANDBY:無樣品或暖機時之正常位置,此時鞘液停止流動,雷射功率自動降低。
PRIME:去除流動室中的氣泡,流動室施以反向壓力,將液流從流動室沖入廢液筒,持續一定時間後,鞘液注滿流動室。
PRIME 結束,儀器恢復STANDBY狀態。
3. 儲液箱抽屜:在主機左下方之儲液箱抽屜。
可向前拉開,內含鞘流液筒、廢液筒、鞘液過濾器SheathFilter,及空氣濾網 Air filter。
請注意氣路減壓閥VENT TOGGLE之位置。
鞘液筒:容積4升,位於抽屜左側。
裝滿鞘液筒,儀器可以運行大約 3小時。
筒上裝有液面感應器,鞘液用完時,電腦軟體會有顯示。
鞘液筒蓋上有環扣,保証鞘液筒密閉。
廢液筒:容積4升,位於抽屜右側。
筒上裝有液面感應器,廢液滿時,電腦軟體會有顯示。
注意廢液可能有潛在的生物傳染性。
鞘液過濾器:0.22µm過濾器,去除鞘液中的雜質,保證進入流動室的鞘液是乾淨的。
氣路減壓閥: 沿箭頭方向移動閥門開關以進行加壓或減壓。
在鞘液筒裝鞘液時,需要減壓。
空氣過濾網:用於過濾冷卻雷射的空氣。
4. 上樣品區:分,一個是進樣針Sample Injection Tube,將樣本輸入流動室,還有就是支撐架 TubeSupport Arm、和液滴存留系統DropletContainment System。
白藜芦醇对人黑色素瘤细胞增殖及凋亡的影响

白藜芦醇对人黑色素瘤细胞增殖及凋亡的影响刘浩;蒋琛琛;程秀;方琳;陈超;张旭东;蒋志文【摘要】Aim To investigate the effect of resveratrol ( Res ) on the proliferation and apoptosis in human melanoma cells. Methods Mel-RM and MM200 cells were treated with different concentrations of Res. Cell viability was measured using the MTT assay. Apoptosis induced by Res was examined using the propidium iodide ( PI ) staining in flow cytometry. Mitochondrial membrane potential ( △ψm ) in Mel-RM and MM200 cells was detected by JC-1 staining. Activation of Caspase-3 was detected by special kit. Results Cell viability was inhibited bv Res with the increasing concentration. 80,160 μmol · L-1Res could induces obvious apoptosis in melanoma Mel-RM and MM200 cells.JC-I staining results showed that Res could decrease the mitochondrial membrane potential in Mel-RM andMM200 cells. It also induced the activation of Caspases-3. Conclusions Res can inhibit the proliferation and induce apoptosis in melanoma Mel-RM and MM200 cells. The effect might be associated with the reduction ofΔψm and the activation of Caspase-3.%目的研究白藜芦醇(resveratrol,Res)对人黑色素瘤细胞增殖及凋亡的影响.方法 MTT法检测不同浓度(10、20、40、80、160 μmol·L-1) Res对人黑色素瘤细胞株Mel-RM和MM200增殖的抑制作用,溴化丙啶(propidium iodide,PI)单染进行流式细胞仪分析,检测Res对黑色素瘤细胞凋亡的影响.通过JC-1染色法检测Mel-RM和MM200细胞线粒体膜电位(m itochondrial membrane potential,△Ψm).试剂盒检测Caspase-3的活性变化.结果随着Res的浓度的增加,对人黑色素瘤细胞株的增殖产生明显的抑制作用,80、160 μmol·L-1的Res可诱导Mel-RM和MM200细胞出现明显的凋亡,JC-1染色结果显示,Res处理后Mel-RM和MM200线粒体膜电位分别降低51.0%和68.8%.Caspase-3活性检测结果显示Res对Caspase-3 具有激活作用.结论 Res 具有抑制黑色素瘤细胞增殖诱导其凋亡的作用,其机制可能与降低细胞线粒体膜电位及激活Caspase-3有关.【期刊名称】《中国药理学通报》【年(卷),期】2011(027)007【总页数】5页(P998-1002)【关键词】白藜芦醇;黑色素瘤;凋亡;Caspase-3;细胞线粒体膜电位;JC-1【作者】刘浩;蒋琛琛;程秀;方琳;陈超;张旭东;蒋志文【作者单位】蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽,蚌埠,233030;蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽,蚌埠,233030;蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽,蚌埠,233030;蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽,蚌埠,233030;蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽,蚌埠,233030;蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽,蚌埠,233030;蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽,蚌埠,233030【正文语种】中文【中图分类】R284.1;R329.24;R329.25;R739.502.2白藜芦醇(resveratrol,Res),化学名称为 3,4 ,5-三羟基芪(3,4 ,5-trihydroxystilbene),是非黄酮类的多酚化合物。
原花青素上调let-7a抑制胰腺癌AsPC-1细胞生长及迁移

原花青素上调let-7a抑制胰腺癌AsPC-1细胞生长及迁移马佳;方斌斌;马聪;庞海杰;曾凡鹏;夏俊【摘要】Objective To ascertain whether proanthocyanidins inhibit cell growth and migration by increasing let-7a expression in pancreatic cancer AsPC-1 cells. Methods The proliferation rate, cell apoptosis rate and cell migration ability of AsPC-1 cells treated with proanthocyanidins were measured by MTT assay, Annexin V-FITC/PI staining, and Transwell migration assay, respectively. The expression of let-7a AsPC cells was detected by miRNA real-time RT-PCR after proanthocyanidins treatment. The changes in the biological behaviors of AsPC-1 cells were evaluated after transfection with let-7a mimics. Results Compared with the control group, proanthocyanidins treatment caused dose-dependent decrements of the proliferation rate and migration ability and increased the apoptosis rate in AsPC-1 cells. AsPC-1 cells with proanthocyanidins treatment showed increased expression of let-7a. Transfection with let-7a mimics resulted in obvious decreases in the cell growth rate and migration ability, and proanthocyanidins treatment significantly enhanced the inhibitory effect of let-7a mimics. Conclusions Proanthocyanidins-induced cell growth and migration inhibition are partially mediated by up-regulation of let-7a expression in AsPC-1 cells.%目的探讨原花青素是否通过上调let-7a表达而抑制胰腺癌细胞生长及迁移.方法体外培养人胰腺癌AsPC-1细胞,原花青素处理细胞后,分别用MTT法、Annexin V-FITC/PI双染及Transwell迁移等实验检测细胞增殖率、细胞凋亡率及细胞迁移能力的改变;利用miRNA实时逆转录PCR检测细胞内let-7a表达变化.AsPC-1细胞转染let-7a mimics后,MTT法、Transwell迁移实验分别检测细胞增殖率及细胞迁移能力的改变.结果与对照组相比,原花青素处理AsPC-1细胞后,细胞增殖率、细胞迁移能力随着原花青素浓度升高而下降,而细胞凋亡率随着药物浓度升高而逐渐升高.与对照组相比,原花青素处理细胞后, let-7a的表达升高.通过脂质体转染let-7a mimics后,细胞的增殖率及迁移能力均低于对照组,且let-7a mimics与原花青素共同作用后,细胞增殖及迁移明显低于let-7a mimics和原花青素单独作用组.结论原花青素具有抑制胰腺癌细胞生长、迁移,及诱导细胞凋亡的作用.原花青素可能是通过上调let-7a表达,从而抑制胰腺癌细胞的生长及迁移.【期刊名称】《南方医科大学学报》【年(卷),期】2015(035)008【总页数】6页(P1110-1115)【关键词】原花青素;let-7a;胰腺癌细胞【作者】马佳;方斌斌;马聪;庞海杰;曾凡鹏;夏俊【作者单位】蚌埠医学院1生化与分子生物学教研室,安徽蚌埠 233030;临床检验诊断学实验中心,安徽蚌埠 233030;临床检验诊断学实验中心,安徽蚌埠 233030;临床检验诊断学实验中心,安徽蚌埠 233030;临床检验诊断学实验中心,安徽蚌埠233030;蚌埠医学院1生化与分子生物学教研室,安徽蚌埠 233030【正文语种】中文原花青素是一类由儿茶素和表儿茶素聚合而成的多酚类化合物,葡萄的籽和皮中富含原花青素。
FACScalibur 检测PI法细胞周期的操作
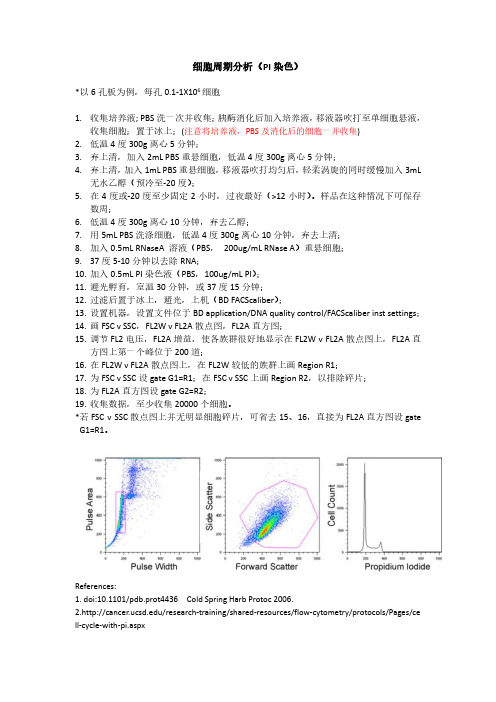
细胞周期分析(PI染色)*以6孔板为例,每孔0.1-1X106细胞1.收集培养液; PBS洗一次并收集;胰酶消化后加入培养液,移液器吹打至单细胞悬液,收集细胞;置于冰上;(注意将培养液,PBS及消化后的细胞一并收集)2.低温4度300g离心5分钟;3.弃上清,加入2mL PBS重悬细胞,低温4度300g离心5分钟;4.弃上清,加入1mL PBS重悬细胞,移液器吹打均匀后,轻柔涡旋的同时缓慢加入3mL无水乙醇(预冷至-20度);5.在4度或-20度至少固定2小时,过夜最好(>12小时)。
样品在这种情况下可保存数周;6.低温4度300g离心10分钟,弃去乙醇;7.用5mL PBS洗涤细胞,低温4度300g离心10分钟,弃去上清;8.加入0.5mL RNaseA 溶液(PBS,200ug/mL RNase A)重悬细胞;9.37度5-10分钟以去除RNA;10.加入0.5mL PI染色液(PBS,100ug/mL PI);11.避光孵育,室温30分钟,或37度15分钟;12.过滤后置于冰上,避光,上机(BD FACScaliber);13.设置机器,设置文件位于BD application/DNA quality control/FACScaliber inst settings;14.画FSC v SSC,FL2W v FL2A散点图,FL2A直方图;15.调节FL2电压,FL2A增益,使各族群很好地显示在FL2W v FL2A散点图上,FL2A直方图上第一个峰位于200道;16.在FL2W v FL2A散点图上,在FL2W较低的族群上画Region R1;17.为FSC v SSC设gate G1=R1;在FSC v SSC上画Region R2,以排除碎片;18.为FL2A直方图设gate G2=R2;19.收集数据,至少收集20000个细胞。
*若FSC v SSC散点图上并无明显细胞碎片,可省去15、16,直接为FL2A直方图设gate G1=R1。
流式细胞仪操作步骤(FACSCalibur)

一、开机程序:1.检查鞘液桶和废液桶。
确认鞘液充满状态(鞘液为鞘液桶体积的3/4位置,可以连续工作3个小时左右)、盖紧黑盖、管道畅通、废液桶有足够空间容纳本批标本排弃的废液。
如果要添加鞘液,要先释放鞘液桶中气压。
2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印机。
3.气压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以排除管路中气泡。
二、运行FACSComp软件、检查仪器状况1.制备三色标准微球样本。
一般情况向1ml鞘液(或过滤PBS)中加入1滴质控小微球,也可以根据实际情况调节浓度。
2.机器预热5 min,打开FACSComp软件,选择保持路径。
选择所需校正内容,如果使用的微球是新一批产品要输入微球的批号。
3.在软件界面左侧Assay Selection选项中选择质控类型,即实验过程中是否需要清洗样品。
4.上样品,微球溶液上样之前要充分混匀。
功能键设置在“RUN”。
5.仪器自动检查,并做电压、补偿等设置。
6.FACSComp软件运行完毕,显示结果通过测试。
7.做Set up。
8.打印校正结果,退出FACSComp程序。
备注:在质控过程中,如果提示收集细胞速度慢可以提高细胞收集速度,但是在调节灵敏度(Sens)时,一定要用“Low”的状态上样,保证仪器灵敏度的准确。
在使用仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。
三、样品分析软件:CellQuest Pro软件,选择“联机”。
1.(2)对实验样本进行命名;(3)对实验通道进行预设(FSC,SSC,FL1-FL4)。
备注:如果界面被关闭,重新调出步骤:2.调出质控模板。
3.画图选择画图工具(一般选择散点图),Inspect界面会自动弹出,对几选中图形),将更改横纵坐备注:第一个散点图横坐标为FSC,纵坐标为SSC。
(1一般获取10000个细胞。
(2(3)将所有补偿调为0(4)将非52(5)FSC和SSC(64.上阴性对照将阴性对照管混匀,上机,功能键设置在“RUN”,散点图出现细胞信号,第一个图:让细胞信号出现在自己看上去舒服的区域;其他三个散点图,要将细胞信号调整到阴性区域,即左下角区域。
流式细胞术原理及应用新课件PPT全

流式细胞术是20世纪70年代发展起来的一种技术,有人将流式细胞仪比喻成高级的荧光显微镜。 HLA-B27: 强直性脊柱炎 细胞功能检测:细胞周期、凋亡
Flow Sorting 直方图适用于:单参数分析
SORTING(细胞分选) CD16+56 NK细胞 可利用FCM进行细胞周期分析,适当选择周期特异性药物或非周期特异性药物。
巨血小板
• 细胞凋亡与坏死的区别 一般只测一个参数、不能分选
5、DNA含量分析法(晚晚期)
2F时LO必W需C停Y用TO免M疫E抑TR制Y剂。虽然凋亡与坏死的最终结果极为相似,但
凋亡检测
每一步都有检测它试剂盒们的过程与表现却有很大差别。
光路调节系统固定,自动化程度高,操作简便,易学易掌握,适合
坏死(necrosis):坏死是细胞受到强烈理 流式细胞分析在人类基因组计划中发挥了重要作用,流式细胞技术的应用也适用于植物,目前这个技术应用范围包括流式核型分析,
目前,该技术以广泛用于生物及医 学基础研究与临床检测,在分子生物学、 免疫学、遗传学、血液学、肿瘤学等领 域内发挥着重要作用。
流式细胞仪
荧光显微镜
Flow Cytometry
控制 一般只测一个参数、不能分选
电脑
人脑
其细胞及组织的变化与坏死有明显的不同。
可利用FCM进行细胞周期分析,适当选择周期特异性药物或非周期特异性药物。
• 空白对照:ALL 应用领域将不断开拓,成为科研与临床不可或缺的重要工具。
随着白细胞分化抗原意义的确认以及单克隆抗体技术的发展,随着人们创新意识的加强,结合计算机技术和其他技术,流式细胞仪的 应用领域将不断开拓,成为科研与临床不可或缺的重要工具。 坏死(necrosis):坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程。
丹红有效成分配伍对缺氧损伤脑微血管内皮细胞的保护作用

丹红有效成分配伍对缺氧损伤脑微血管内皮细胞的保护作用为研究丹红有效成分配伍对缺氧致原代培养的乳鼠脑微血管内皮细胞(rBMECs)损伤的保护作用。
原代培养乳鼠脑微血管内皮细胞并对细胞进行缺氧4 h损伤模型的同时,丹红有效成分(原儿茶醛、丹酚酸B、羟基红花黄色素A、丹参素)配伍作用于rBMECs,MTT确定细胞非毒性剂量,采用比色法测定LDH,SOD活性和MDA水平,RT-PCR法检测ICAM-1,MMP-9,P53 mRNA 表达,流式细胞术检测rBMECs细胞周期及早期凋亡的变化。
丹红有效成分配伍1,2,3,7,8,9组方显著抑制缺氧细胞上清液中LDH的增加;1,2,4,6,7组方显著增强缺氧细胞内SOD活性;1,2,3,8,9组方显著降低MDA水平;1,2,6,7,9组方显著抑制缺氧诱导的rBMECs早期凋亡,缺氧后细胞P53 mRNA 表达明显上调的后果是能引起G1期阻滞和促进细胞凋亡,证实P53基因的调节功能体现在G1期校正点的监测;1,2,5,6,7,8,9组方显著下调P53 mRNA 表达;1,4,7,8,9组方显著下调ICAM-1 mRNA表达;1,3,6,9组方显著下调MMP-9 mRNA表达。
丹红有效成分配伍对缺氧所致原代培养的rBMECs损伤具有明显的保护作用,其机制与增强细胞抗氧化能力,抑制炎症反应和细胞凋亡有关。
为研究方剂配伍规律提供思路,指导临床用药。
标签:有效成分配伍;乳鼠脑微血管内皮细胞;细胞凋亡;抗氧化;抗炎症心脑血管疾病是一种严重威胁人类特别是中老年人健康的常见病。
心脑血管疾病具有“发病率高、死亡率高、致残率高、复发率高、并发症多”,“四高一多”的特点。
丹红配伍、丹红注射液已成为治疗急性缺血性脑血管病(如脑梗死)的有效方药[1-3]。
丹参与红花配伍已是临床上活血化瘀类方剂常用的经典配伍,有“药对”之称,常用于治疗心脑血管疾病或其他疾患血瘀证。
丹红配伍广泛地用于血瘀证的治疗。
flowcytometry

激光光源 光收集系统
电子系统
光电转换 数据处理系统
2020/6/22
中国科技大学生命科学实验中心
7
Injector Tip
Sheath fluid
Fluorescence signals
Focused laser beam
2020/6/22
中国科技大学生命科学实验中心
8
细胞被戴上特殊的标记。所用的标记细 胞的探针是能够同待分选细胞表面特征性 蛋白(抗原)结合的抗体,而这种抗体又能 够同某种荧光染料结合。被结合的细胞带 上了荧光标记。当稀释的细胞进入超声波 振荡器时,极稀的细胞悬浮液形成很小的 液滴,一个液滴中只含有一个细胞。液滴 一旦形成并通过激光束时,激光束激发结 合在细胞表面抗体分子。
18
Fluorescence Detectors
Laser
FALS Sensor
Freq
2020/6/22
Fluorescence
Fluorescence detector (PMT3, PMT4 etc.)
Purdue University Cytometry Laboratories
中国科技大学生命科学实验中心
Shades of a color
2020/6/22
中国科技大学生命科学实验中心
32
Beads Provide a Flexible Platform
Beads provide an expandable assay platform for use with a flow cytometer
Multiple sizes
• 单细胞悬液的制备:胰酶消化 • 抗体或标记分子的染色:抗原抗体反应 • 非特异结合的去除:洗涤和封闭
BD FACSCalibur 的维护与保养

BD FACSCalibur 的维护与保养2.4.1 FACSCalibur 的每月维护要求每个月进行一次系统管路,如果仪器处理样本量很大,或经常使用附着性染料(如PI、AO、TO 等),则需要增加管路清洗频率。
(1) 打开FACSCalibur 流式细胞仪。
(2) 断开鞘液筒连接。
(3) 旁路鞘液过滤器:鞘液过滤器上端的管路从SALINE FILTER 端口断开,将鞘液管路(白色)取下,连接到SALINE FILTER 端口上。
过滤器短路后,鞘液不经过滤器,直接从鞘液筒流入细胞流动池,再进入废液筒。
注意如果漂白液流经鞘液过滤器,会造成过滤器的损害,可能会造成流动池的堵塞,此时需要更换过滤器。
(4) 鞘液桶中装1:10 稀释漂白剂1-2L。
(5) 仪器处于RUN 状态,流速为HI,Falcon 样本管中加入1:10 稀释漂白剂3mL,加在上样针位置,清洗20-30 分钟。
(6) 移去装有1:10 稀释漂白剂的Falcon 样本管。
(7) 使用加有蒸馏水的鞘液桶和Falcon 样品管,同样方法清洗管路(重复第3-5步)。
(8) 将装有鞘液的原鞘液筒恢复原位,连接好鞘液过滤器,上样针位置放盛有1mL蒸馏水的样品管。
(9) 仪器选择Standby 模式。
此时,如果没有实验,可以关机。
上样管位置的样本管中应盛有蒸馏水,防止上样针产生结晶。
如果需要使用FACSCalibur 获取样本数据,您应该先做PRIME。
如果仪器停止使用一周以上,您应该每月做月清洗,并将液路更换为蒸馏水,使用仪器时再换成鞘液。
Contrad 70 溶液可以有效去除管路中的阻塞成分,如有必要,可以使用2%的Contrad 70 溶液代替1:10 稀释的漂白剂,清洗管路。
2.4.2 FACSCalibur 的定期维护仪器部件不需要定期维护,但一些仪器部件有时需要做检查,如有必要,还需要清洗。
检查清洗的频率视仪器使用频率而定。
鞘液过滤器鞘液过滤器位于鞘液筒和废液筒之间,主要作用是过滤鞘液筒里的鞘液。
祛痰、化瘀和祛痰化瘀方对氧化低密度脂蛋白诱导血管内皮细胞增殖及凋亡功能的影响

祛痰、化瘀和祛痰化瘀方对氧化低密度脂蛋白诱导血管内皮细胞增殖及凋亡功能的影响陈冰;林雅军;马雅銮;李玉梅;薛欣;胡镜清【摘要】目的:观察祛痰、化瘀和祛痰化瘀方对ox-LDL损伤HUVEC增殖及凋亡功能的影响.方法:建立HUVEC ox-LDL损伤模型,采用MTT检测法、AnnexinV-FITC/P1双染结合流式细胞术和Western blot检测法,观察方药对HUVEC增殖率、凋亡率及与增殖、凋亡相关蛋白VEGFR、P66、P53、Bcl-2、BAX表达的影响.结果:在细胞增殖方面,祛痰化瘀方能增加HUVEC吸光度,祛痰方、祛痰化瘀方可上调HUVEC VEGFR的表达水平,ox-LDL作用下4种方剂均可增加HUVEC吸光度并上调VEGFR表达水平.在细胞凋亡方面,祛痰方、化瘀方和祛痰化瘀方均能降低P66的表达水平;ox-LDL作用下,HUVEC Bcl-2表达降低,BAX、P66表达升高;祛痰化瘀方等4种方剂对早期、晚期及总凋亡率都有极大改善,且均可降低BAX的表达水平;祛痰方组、化瘀方组和祛痰化瘀方可降低P66的表达水平,祛痰化瘀方可提高Bcl-2的表达水平,Ox-LDL及4种方剂均对P53的表达水平无明显影响.结论:祛痰、化瘀和祛痰化瘀方及基础方均可在不同程度上通过促进增殖、抗凋亡达到对抗HUVEC氧化损伤的作用,其中祛痰化瘀方的效果最显著.%Objective:To observe the effect of Qutan-Fang,Huayu-Fang,and Qutan-Huayu-Fang on proliferation and apoptosis of Human umbilical vascular endothelial cells induced by ox-LDL.(HUVECs) in oxidative injury.Methods:HUVEC were divided into normal group,model group,Basic-Fang group,Qutan-Fang group,Huayu-Fang group and Qutan-Huayu-Fang group,which treatedwith ox-LDL(100mg/ml).Proliferation of HUVECs were detected byMTT.Apoptosis of HUVECs were analysed by AnnexinV-FITC/PI stainingwith flow cytometry.And the expression of VEGFR,P66,P53,Bcl-2,BAX were detected by Western blot.Results:Compared with normal group,Qutan-Huayu-Fang can promote the light absorption value of HUVEC,and Qutan-Fang,Qutan-Huayu-Fang can increase the expression of VEGFR.All four prescriptions can increase the light absorption value on HUVEC and raising the expression of VEGFR stimulated with pared with normal group,Qutan-Fang,Huayu-Fang,Qutan-Huayu-Fang can reduce the expression of P66 of HUVEC.Stimulated with ox-LDL,the expression of Bcl-2 was reduced,and the expression of BAX 、P66 were increased.All four prescriptions can improve the early apoptotic rate,the late apoptotic rate,and the total apoptotic rate.These four prescriptions can reduced the expression of BAX.Qutan-Fang,Huayu-Fang,Qutan-Huayu-Fang can reduce the expression of P66 stimulated with ox-LDL.Qutan-Huayu-Fang can increase the expression of Bcl-2 of HUVEC.Conclusion:Qutan-Fang,Huayu-Fang,Qutan-Huayu-Fang can effectively reduce the oxidative injury on HUVECs by improve their proliferation and inhibiting their apoptosis.The effect of Qutan-Huayu-Fang was the most significant in all four prescriptions.【期刊名称】《中国中医基础医学杂志》【年(卷),期】2017(023)011【总页数】5页(P1554-1558)【关键词】祛痰方、化瘀方和祛痰化瘀方;人脐静脉内皮细胞;氧化低密度脂蛋白;增殖;凋亡【作者】陈冰;林雅军;马雅銮;李玉梅;薛欣;胡镜清【作者单位】中国中医科学院中医基础理论研究所,北京 100700;北京医院国家老年医学中心,北京 100730;中国中医科学院中医基础理论研究所,北京 100700;中国中医科学院中医基础理论研究所,北京 100700;中国中医科学院中医基础理论研究所,北京 100700;中国中医科学院中医基础理论研究所,北京 100700【正文语种】中文【中图分类】R285.5动脉粥样硬化[1](atherosclerosis,As)表现为动脉内膜的脂质、血液成分的沉积,平滑肌细胞及胶原纤维增生,并伴有坏死及钙化等不同程度病变,是严重危害人类健康的常见病。
2FACSCalibur的日常操作

166104485.docPage 2--1第二章 FACSCalibur 的日常操作2.1 FACSCalibur 系统FACSCalibur 系统是一个全自动流式细胞分析系统。
在流式细胞仪上,细胞在液流系统的驱动下流经激光检测区,激光聚焦在细胞上,对细胞进行逐个分析。
FACSCalibur 可以用于常规科研检测、免疫分型和DNA 细胞周期分析等。
FACSCalibur 可以安装分选系统,您可以通过FACSCalibur ,在测定样本中找到感兴趣的细胞群,并加以分选。
FACSCalibur 系统主机、计算机和软件等部分组成,FACSCalibur 的许多功能都是由软件控制的。
主机系统主机开关:位于仪器右侧下部,用于打开或关闭FACSCalibur 。
液流控制板:控制液流和样本流速。
166104485.docPage 2--2(1) 液流控制钮:有三种模式。
PRIME ——去除流动池中的气泡。
流动池施以反向压力,将液流从流动池冲入废液筒,持续一定时间后,流动池自动充满鞘液。
PRIME 结束,仪器恢复STANDBY 状态。
RUN ——此时上样管加压,使细胞悬液从进样针(SIP )进入流动池。
STANDBY ——此时鞘液流动停止,激光功率下降。
这样可以节省鞘液,延长激光寿命。
♦ Hard STANDBY ——仪器处于STANDBY 状态时,所有液流阀门都关闭,只有连接样本管和外界空气的气路阀门是打开的。
另外,激光功率降低到STANDBY 水平。
♦ Auto STANDBY ——如果仪器处于RUN 状态,而上样架上无样本管,此时仪器进入AutoSTANDBY 状态。
12秒后,系统将流动室和废液筒之间的阀门关闭,鞘液流停止。
同时,激光输出功率降低到STANDBY 水平。
上样支架上放好上样管后,仪器恢复RUN 状态,关闭的阀门重新打开,激光功率恢复到正常运行水平。
♦ 如果一起处于RUN 状态,而样本支撑架位于左侧或右侧位置,则仪器自动进入STANDBY 状态,以免浪费鞘液(此时RUN 指示灯由绿色变为橙红色)。
Annexin-V-FLUOS-Staining-Kit-中文说明书
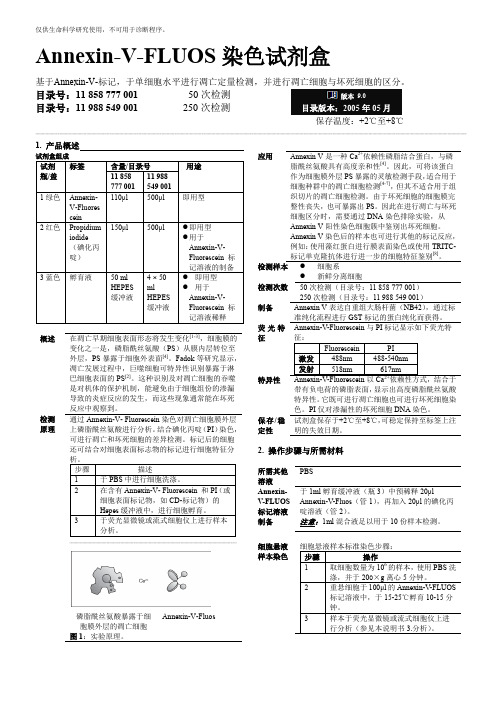
仅供生命科学研究使用,不可用于诊断程序。
Annexin-V-FLUOS 染色试剂盒基于Annexin-V-标记,于单细胞水平进行凋亡定量检测,并进行凋亡细胞与坏死细胞的区分。
目录号:11 858 777 001 50次检测 目录号:11 988 549 001 250次检测版本 9.02005年05月保存温度:+2℃至+8℃--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------1. 产品概述概述在凋亡早期细胞表面形态将发生变化[1-3],细胞膜的变化之一是,磷脂酰丝氨酸(PS )从膜内层转位至外层,PS 暴露于细胞外表面[4]。
Fadok 等研究显示,凋亡发展过程中,巨噬细胞可特异性识别暴露于淋巴细胞表面的PS [2]。
这种识别及对凋亡细胞的吞噬是对机体的保护机制,能避免由于细胞组份的渗漏导致的炎症反应的发生,而这些现象通常能在坏死反应中观察到。
检测原理通过Annexin-V- Fluorescein 染色对凋亡细胞膜外层上磷脂酰丝氨酸进行分析。
结合碘化丙啶(PI )染色,可进行凋亡和坏死细胞的差异检测。
标记后的细胞还可结合对细胞表面标志物的标记进行细胞特征分-----------------------------------------------------------------------------------------------------------------------------------磷脂酰丝氨酸暴露于细胞膜外层的凋亡细胞 Annexin-V-Fluos图1:实验原理。
蛋白质磷酸化与信号传导

蛋白质磷酸化与信号传导蛋白质磷酸化与信号传导蛋白|磷酸化c信λ有真核生物而言,蛋白|的磷酸化是胞刃盘鬟f的PI步E,e凡在胞代x、生L、增殖、癌{控方面,蛋白|的磷酸化都扮演著重要角色。
目前在真核胞纫寻lF有400多N蛋白激酶和1000多N磷酸蛋白。
通^蛋白|磷酸化,Cw得以改胞鹊鞍踪|活性,或藉以改酵素活性、或藉以鬟f信、或{胞雀生理^程。
S著愈碛多的信路奖蛔Cc蛋白|磷酸化相P,此一主}己是今胞生物W研究的狳c。
蛋白|的可逆磷酸化蛋白|的磷酸化和去磷酸化是一可以相互D化的^程,分e由Cw藉由{控胞雀黝蛋白激酶(protein kinases)和蛋白磷酸酶(phosphatases)的活性踊蛞种啤Mㄟ^磷酸化和去磷酸化煞N象的互,е碌鞍踪|活性改而表_其特殊的生理功能。
F已C,胞的S多功能蛋白,如激酶、酶蛋白、受w、蛋白、\蛋白、收s蛋白、{蛋白、核蛋白、x子通道、x子推值龋均能l 生蛋白|的磷酸化c去磷酸化。
蛋白|磷酸化的方式有煞N:一N是蛋白|自身磷酸化,如胰u素受w、C激酶、G激酶、Ca2+CaM激酶、EGF受w、PDGF受w、IGF-1受w、FGF受w、CSF-1受w、Na+-K+-ATP酶的α基、Ca2+-ATP酶的磷酸化等。
另一N是由特殊的蛋白激酶催化的蛋白|磷酸化。
蛋白|磷酸化的部位可l生在蛋白|的z氨酸、K氨酸、酪氨酸、氨酸、M氨酸及天T冬氨酸的基上,使磷酸化蛋白|l]著多N多拥纳物W功能。
蛋白质磷酸化与信号传导胞冗存在R恍缘鞍琢姿崦浮_@N酶特地催化酪氨酸和z氨酸磷蛋白去磷酸化,通^去磷酸化改多N功能蛋白(激酶、酶、受w、\蛋白、收s 蛋白、x子推帧㈦x子通道、蛋白、{蛋白、核蛋白等)的活性,亩{胞的代x、生L、分化、增殖及D化,在胞壬物Y的鬟f中起O其重要的作用。
新技g:我患胞之信流式分析的主要特色,在於可以同r分析我患胞的多N特徵,同r使用多N分子探,c表面擞,可同rRe出特定的胞群,如T淋巴胞(CD3+)、B淋巴胞(CD19+)、NK胞,K告知群胞族群的胞{攘椎鞍祝是否因外在I活而被磷酸化?是否能因加入信鬟f抑制物而去磷酸化?鹘y方法如西方墨n法,由於凫洞蠖捣治(Bulk Assay),一般都AO群w中大多导胞的作用菹嗤,作用度一致,o法@示|化群wg的e差,如% Responder,蟾嬉仓荒茱@示整w胞的中g值,o法提供我患胞的y量值。
BDFACSCalibur的维护与保养.doc

BD FACSCalibur 的维护与保养2.4.1 FACSCalibur 的每月维护要求每个月进行一次系统管路,如果仪器处理样本量很大,或经常使用附着性染料(如PI、AO、TO 等),则需要增加管路清洗频率。
(1) 打开FACSCalibur 流式细胞仪。
(2) 断开鞘液筒连接。
(3) 旁路鞘液过滤器:鞘液过滤器上端的管路从SALINE FILTER 端口断开,将鞘液管路(白色)取下,连接到SALINE FILTER 端口上。
过滤器短路后,鞘液不经过滤器,直接从鞘液筒流入细胞流动池,再进入废液筒。
注意如果漂白液流经鞘液过滤器,会造成过滤器的损害,可能会造成流动池的堵塞,此时需要更换过滤器。
(4) 鞘液桶中装1:10 稀释漂白剂1-2L。
(5) 仪器处于RUN 状态,流速为HI,Falcon 样本管中加入1:10 稀释漂白剂3mL,加在上样针位置,清洗20-30 分钟。
(6) 移去装有1:10 稀释漂白剂的Falcon 样本管。
(7) 使用加有蒸馏水的鞘液桶和Falcon 样品管,同样方法清洗管路(重复第3-5步)。
(8) 将装有鞘液的原鞘液筒恢复原位,连接好鞘液过滤器,上样针位置放盛有1mL蒸馏水的样品管。
(9) 仪器选择Standby 模式。
此时,如果没有实验,可以关机。
上样管位置的样本管中应盛有蒸馏水,防止上样针产生结晶。
如果需要使用FACSCalibur 获取样本数据,您应该先做PRIME。
如果仪器停止使用一周以上,您应该每月做月清洗,并将液路更换为蒸馏水,使用仪器时再换成鞘液。
Contrad 70 溶液可以有效去除管路中的阻塞成分,如有必要,可以使用2%的Contrad 70 溶液代替1:10 稀释的漂白剂,清洗管路。
2.4.2 FACSCalibur 的定期维护仪器部件不需要定期维护,但一些仪器部件有时需要做检查,如有必要,还需要清洗。
检查清洗的频率视仪器使用频率而定。
鞘液过滤器鞘液过滤器位于鞘液筒和废液筒之间,主要作用是过滤鞘液筒里的鞘液。
硝苯地平对药物性牙龈增生患者牙龈成纤维细胞增殖的影响

硝苯地平对药物性牙龈增生患者牙龈成纤维细胞增殖的影响倪靖;束蓉【摘要】目的研究硝苯地平致药物性牙龈增生患者牙龈成纤维细胞(NIFr-HGF)细胞周期增殖指数(Prl)的变化.方法以服用硝苯地平发生牙龈增生患者的牙龈组织为实验对象.龈切术获得组织样本,组织块培养法分离培养NIFr-HGF,在细胞培养液中分别添加10 ns/mL和1 000 ns/mL硝苯地平进行干预(低、高浓度药物干预组),分别于干预后18 h和30 h时间点收集细胞,流式细胞仪检测细胞周期并计算Prl.以不添加硝苯地平的NIFr-HGF作为空白对照.结果在药物作用时间相同条件下,两药物干预组NIFr-HGF细胞周期Prl明显高于空白对照组(P<0.05);低浓度与高浓度药物干预组间NIFr-HGF细胞周期PrI比较差异无统计学意义(P>0.05).在低浓度和高浓度药物于预组,干预30 h细胞周期的PrI明显高于干预18 h,分别为(57.54±0.019)% vs (21.15±0.011)% 和(59.36±0.031)% vs(19.01.4±0.012)%(P<0.05).结论对于硝苯地平致药物性牙龈增生患者,NIFr-HGF 细胞周期PrI随硝苯地平作用时间延长而增大,而与药物浓度无明显关系.【期刊名称】《上海交通大学学报(医学版)》【年(卷),期】2010(030)001【总页数】3页(P63-65)【关键词】药物性牙龈增生;硝苯地平;牙龈成纤维细胞;增殖指数【作者】倪靖;束蓉【作者单位】上海交通大学,医学院第九人民医院牙周科,上海市口腔医学重点实验室,上海,200011;上海交通大学,医学院第九人民医院牙周科,上海市口腔医学重点实验室,上海,200011【正文语种】中文【中图分类】R781.41钙离子拮抗剂被广泛应用于治疗高血压和冠心病。
这类药物通过抑制心脏及血管平滑肌细胞外钙离子的内流,扩张周围血管和冠状动脉,防止痉挛,减少心肌耗氧量等达到降压效果。
组织中的细胞周期和凋亡检测方法之一--PI法

组织中的细胞周期和凋亡检测方法之一--PI法schoman无论是肿瘤或其它正常新鲜组织均可用PI(碘化丙啶)的方法来检测,这是一种常见而且便宜的方法。
主要操作步骤如下:1、组织块用0.25%胰酶消化30min-1h。
2、200-400目筛网过滤细胞,获得单细胞悬液。
3、75%乙醇(-20度预冷)固定细胞1h。
4、加入PI(终浓度50ug/ml)和无DNA酶污染的RNA酶(终浓度50ug/ml)1ml染色30min-1h。
5、流式细胞仪检测细胞周期和凋亡。
注意事项:1、组织消化后使细胞形成单个细胞悬液是本检测方法的关键。
如组织难以消化,可加入适量胶原酶。
另外,消化前,用剪刀将组织剪成小块也不要忘了。
2、细胞可尽量的多准备(at least 100 thousand),这样流式检测方便,结果可靠。
3、每次消化的时间等条件应尽量一致,否则使实验结果CV值偏大。
4、细胞用乙醇固定后可以访置48小时(4度保存)后检测,便于无法立即检测的实验者,对实验结果基本没有影响。
其它也有一些检测凋亡的方法,均有商品化试剂盒。
在此不赘述。
yanzishenyang:我看相关的说明:碘化丙啶(propidium iodide,PI)检测早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,胞膜通透性无明显改变,相对分子质量大的与DNA 结合的荧光染料(如PI)不能时入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。
应用流式细胞仪或荧光显微镜可区分和坏死细胞,细胞内DNA出现Hoechest 3342标记而不出现PI标记的为凋亡细胞。
偶得细胞是用PI染色的,经过流氏细胞仪检测出现一个亚二倍体峰,是否能和坏死区别?因为偶用的作用细胞的蛋白本身可以造成细胞膜的损伤,所以PI可以进入细胞,这是否意味着我检测的结果无法区分凋亡和坏死?hdhdhd0000:用PI法识别凋亡时,有一种方法叫SUB-G1法,这种方法需要在染PI前加入适量的破膜剂(磷酸盐-枸橼酸盐缓冲盐),我们称之为PC液,它会让晚期凋亡所形成的DNA小碎片部分出膜而使胞内的DNA总含量减少,从而使流式上的DNA直方图的G0/G1峰前出现一个亚二倍体峰,也就是SUB-G1峰(凋亡峰)!用荧光2的面积做直方图可以清楚的看见凋亡峰,但是要区分APo和Nec需要少量的经验,而在荧光2高度图上,因为是用的是对数,所以可以把凋亡和坏死拉开,凋亡峰在不同的细胞周期特异性细胞凋亡时,都特异性的出现在10的2次方荧光道数处,坏死在10的1次方处,从而可以清楚的分清它们。
PI染色的讨论

关于PI(碘化丙啶)的讨论组织中的细胞周期和凋亡检测方法之一--PI法schoman无论是肿瘤或其它正常新鲜组织均可用PI(碘化丙啶)的方法来检测,这是一种常见而且便宜的方法。
主要操作步骤如下:1、组织块用0.25%胰酶消化30min-1h。
2、200-400目筛网过滤细胞,获得单细胞悬液。
3、75%乙醇(-20度预冷)固定细胞1h。
4、加入PI(终浓度50ug/ml)和无DNA酶污染的RNA酶(终浓度50ug/ml)1ml染色30min -1h。
5 、流式细胞仪检测细胞周期和凋亡。
注意事项:1、组织消化后使细胞形成单个细胞悬液是本检测方法的关键。
如组织难以消化,可加入适量胶原酶。
另外,消化前,用剪刀将组织剪成小块也不要忘了。
2、细胞可尽量的多准备(at least 100 thousand),这样流式检测方便,结果可靠。
3、每次消化的时间等条件应尽量一致,否则使实验结果CV值偏大。
4、细胞用乙醇固定后可以访置48小时(4度保存)后检测,便于无法立即检测的实验者,对实验结果基本没有影响。
其它也有一些检测凋亡的方法,均有商品化试剂盒。
在此不赘述。
yanzishenyang:我看相关的说明:碘化丙啶(propidium iodide,PI)检测早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,胞膜通透性无明显改变,相对分子质量大的与DNA结合的荧光染料(如PI)不能时入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。
应用流式细胞仪或荧光显微镜可区分和坏死细胞,细胞内DNA出现Hoechest 3342标记而不出现PI标记的为凋亡细胞。
偶得细胞是用PI染色的,经过流氏细胞仪检测出现一个亚二倍体峰,是否能和坏死区别?因为偶用的作用细胞的蛋白本身可以造成细胞膜的损伤,所以PI可以进入细胞,这是否意味着我检测的结果无法区分凋亡和坏死?hdhdhd0000:用PI法识别凋亡时,有一种方法叫SUB-G1法,这种方法需要在染PI前加入适量的破膜剂(磷酸盐-枸橼酸盐缓冲盐),我们称之为PC液,它会让晚期凋亡所形成的DNA小碎片部分出膜而使胞内的DNA总含量减少,从而使流式上的DNA直方图的G0/G1峰前出现一个亚二倍体峰,也就是SUB-G1峰(凋亡峰)!用荧光2的面积做直方图可以清楚的看见凋亡峰,但是要区分APo和Nec需要少量的经验,而在荧光2高度图上,因为是用的是对数,所以可以把凋亡和坏死拉开,凋亡峰在不同的细胞周期特异性细胞凋亡时,都特异性的出现在10的2次方荧光道数处,坏死在10的1次方处,从而可以清楚的分清它们。
纳米银抗菌作用机制:剂量依赖性促进细菌凋亡

纳米银抗菌作用机制:剂量依赖性促进细菌凋亡于晓旭;鲍会静;徐晨;李雪;李朝阳;张月香;刘运德;魏殿军【摘要】背景:纳米银具有高效、广谱抗菌性及不易产生耐药性等优点,已成为目前抗菌材料的研究热点,但目前尚不明确其抗菌的确切机制。
<br> 目的:研究纳米银抵抗细菌生长的机制。
<br> 方法:采用抑菌环实验检测Ti、TiO2及载纳米银TiO2对单克隆大肠杆菌和金黄色葡萄球菌的抑制作用;将大肠杆菌接种于LB液体培养基中,分别加入0,5,10 mg/L的纳米银溶液,检测24 h内的菌液A值,进行琼脂糖凝胶电泳,分析细菌DNA的变化,应用Annexin V和PI 双染色,采用流式细胞术检测细菌凋亡。
<br> 结果与结论:Ti 和 TiO2对金黄色葡萄球菌和大肠杆菌无明显抑制现象,在 TiO2管载纳米银材料片周围出现了明显抑菌环。
加入纳米银溶液后,大肠杆菌菌液A值明显降低,并且随着加入纳米银质量浓度的增加,降低趋势更明显。
加入纳米银溶液后,大肠杆菌的DNA含量明显减少,并且减少程度随加入纳米银溶液质量浓度的增加而增加。
加入纳米银后,细菌Annexin V阳性率增加,并且这种增加趋势与加入纳米银的质量浓度呈正比。
表明纳米银可通过促进细菌凋亡这一机制来影响细菌生长。
%BACKGROUND:Silver nanoparticles (AgNPs) show strong antibacterial effect and are not easy to have drug resistance. But the antibacterial mechanisms of AgNPs have not been wel developed. <br> OBJECTIVE:To explain the antibacterial mechanisms of AgNPs. <br> METHODS:We investigated the influence of Ti, TiO2 and TiO2 containing AgNPs onEscherichia coliand Staphylococcus aureus by bacterial inhibition ring test. Escherichia coli was cultured in LB liquid medium with 0, 5, 10 mg/L AgNPs. We measured the absorbance value of bacterial culture. DNAgel electrophoresis was used to study the effect of AgNPs onEscherichia coliDNA. Then we researched the character of apoptosis on Escherichia coli by Annexin V and PI staining, using flow cytometry. <br> RESULTS AND CONCLUSION:The inhibiting effect of Ti and TiO2 onEscherichia coliandStaphylococcus aureus was not obvious. But the inhibition rings of TiO2 containing AgNPs to bacteria appeared. The absorbance value of Escherichia coliculture was reduced whenEscherichia coliwas co-cultured with AgNPs. And this decrease tendency was in direct proportion with AgNPs concentration. AgNPs reduced the amount of DNA of Escherichia coli and this tendency was directly proportional with AgNPs concentration. TheEscherichia coli apoptosis rate induced by AgNPs was increased and this tendency was positively correlated to the AgNPs concentration. These results indicate that AgNPs can induce bacterial apoptosis to influence the growth of bacteria.【期刊名称】《中国组织工程研究》【年(卷),期】2015(000)038【总页数】6页(P6173-6178)【关键词】生物材料;纳米材料;纳米银;抑菌环;生长曲线;细菌DNA;细菌凋亡【作者】于晓旭;鲍会静;徐晨;李雪;李朝阳;张月香;刘运德;魏殿军【作者单位】天津市中心妇产科医院,天津市 300199;天津医科大学医学检验学院,天津市 300203;天津市第四中心医院,天津市 300140;天津医科大学医学检验学院,天津市 300203;天津大学材料科学与工程学院,天津市 300192;天津市中心妇产科医院,天津市 300199;天津医科大学医学检验学院,天津市 300203;天津医科大学第二医院,天津市 300201【正文语种】中文【中图分类】R318文章亮点:1 纳米银的抗菌机制尚没有明确的定论,这必将影响纳米银材料的进一步发展和应用。
流式细胞仪检测细胞凋亡操作流程

流式检测细胞凋亡Annexin V检测细胞凋亡Annexin V (2)实验原理 (2)实验用品 (2)操作步骤 (3)Annexin V Blocking (5)凋亡细胞的断裂片段分析 (7)DNA实验原理 (7)实验用品 (8)操作步骤 (9)BrdU Flow Kits检测细胞增殖BrdU Flow (12)实验原理 (12)BrdU Flow Kits试剂盒 (12)结果分析 (17)流式仪器设置指南 (18)线粒体膜电位变化检测细胞凋亡 (22)实验原理 (22)实验用品 (22)样本制备 (23)结果分析 (24)注意事项 (24)Active Caspase-3检测细胞凋亡Active (26)实验原理 (26)实验步骤 (27)结果分析 (28)A n n e x i n V检测细胞凋亡实验原理Annexin V是检测细胞凋亡的灵敏指标之一。
它是一种磷脂结合蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发生凋亡时最早的改变之一。
在细胞发生凋亡时,膜磷脂酰丝氨酸(PS)由质膜内侧翻向外侧。
Annexin V与磷脂酰丝氨酸有高度亲和力,因而与细胞外侧暴露的磷脂酰丝氨酸结合。
由于在发生凋亡时,磷脂酰丝氨酸外翻的发生早于细胞核的改变,因此,与DNA碎片检测比较,使用Annexin V可以更早地检测到凋亡细胞。
因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin V常与鉴定细胞死活的核酸染料(如PI或7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-)与死亡细胞(Annexin V+/核酸染料+)。
实验用品1. 一次性12×75mm Falcon试管。
2. PBS缓冲液:含0.1%NaN3,过滤后2-8°C保存。
3. 微量加样器和加样头。
4. Annexin V Binding Buffer缓冲液(Cat. No. 66121E):浓度为10×,使用时,用稀释为1×浓度的应用液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PI staining
实验目的:检测带有不同目的片段的相应质粒分别电转进HepG2后,细胞生长周期的变化情况(电转48 h后分析)
实验材料:带有不同质粒的HepG2,PI/RNase Staining Buffer(BD, Cat No: 550825,贮存于4℃),-20℃75%乙醇,2% Triton X-100
实验步骤:
1.收集细胞培养皿中的medium,即上清a;
2.用适量PBS slightly rinse细胞层并收集PBS,即上清b;
3.Trypsin消化培养皿中的细胞,所得单细胞悬液c;
4.最后用适量PBS rinse dish并收集,即上清d;
5.500g离心3-5分钟,收集a+b+c+d细胞;
6.倒掉上清,加入适量PBS,V otex mixture上重悬细胞并500g离心3-5分钟,(此步骤之
后的实验可不用在超净台操作),弃上清,并在吸水纸上倒扣,尽量将上清去除干净;
7.在vortex mixer涡旋,使得细胞尽量处于均一的悬液态,然后在不断振荡的情况下滴入
800 µL 75% -20℃冰乙醇固定(注:振荡器上前10滴缓慢滴入!!),然后置于-20℃固定至少2hr或者过夜。
8.500g离心3-5分钟,尽量将上清倒干净;
9.用1 mL PBS洗1遍,500g离心3-5分钟,倒掉上清;
10.加入200-400 µL RNase(20 µg/mL),PI(50 µg/mL),Triton X-100(0.2%),1xPBS,37℃
水浴0.5hr。
500g离心3-5分钟,倒掉上清;本次实验使用BD的PI/RNase Staining Buffer 作为固定液,同时加入终浓度为0.2%的Triton X-100(母液为2%,PBS稀释)
11.800 µL PBS洗1遍;500g离心3-5分钟,倒掉上清;
12.用适量PBS重悬PI staining后的细胞;
13.Flow 分析;
14.500g离心3-5分钟,弃上清,4%多聚甲醛/1xPBS ,4℃固定一周内分析。
实验结果:。
