第八章 吸附分离法
吸附分离

9.2 吸附分离基本要求:1、掌握的内容:物理吸附、化学吸附概念,吸附剂的特性,吸附平衡的概念,气相单分子层物理吸附等温线。
2、熟悉的内容:吸附剂的分类,吸附过程与吸附过程速率控制。
3、了解的内容:气相双组分吸附等温线,液相中的吸附平衡,各种吸附操作及强化吸附过程的途径。
9.2.1概述吸附:当流体与多孔固体接触时, 流体中某一组分或多个组分在固体表面处产生积蓄, 此现象称为吸附。
吸附物、吸附剂:在固体表面积蓄的组分称为吸附物或吸附质(adsorbate),多孔固体称为吸附剂(adsorbent)。
吸附操作:利用某些多孔固体有选择地吸附流体中的一个或几个组分,从而使混合物分离的方法称为吸附操作,它是分离和纯净气体和液体混合物的重要单元操作之一。
实际上,人们很早就发现并利用了吸附现象,如生活中用木炭脱湿和除臭等。
随着新型吸附剂的开发及吸附分离工艺条件等方面的研究,吸附分离过程显示出节能、产品纯度高、可除去痕量物质、操作温度低等突出特点,使这一过程在化工、医药、食品、轻工、环保等行业得到了广泛的应用,例如:(1)气体或液体的脱水及深度干燥,如将乙烯气体中的水分脱到痕量,再聚合。
(2)气体或溶液的脱臭、脱色及溶剂蒸气的回收,如在喷漆工业中,常有大量的有机溶剂逸出,采用活性炭处理排放的气体,既减少环境的污染,又可回收有价值的溶剂。
(3)气体中痕量物质的吸附分离,如纯氮、纯氧的制取。
(4)分离某些精馏难以分离的物系,如烷烃、烯烃、芳香烃馏分的分离。
(5)废气和废水的处理,如从高炉废气中回收一氧化碳和二氧化碳,从炼厂废水中脱除酚等有害物质。
吸附的分类物理吸附:也称为范德华吸附,它是吸附质和吸附剂以分子间作用力为主的吸附。
化学吸附:是吸附质和吸附剂以分子间的化学键为主的吸附。
9.2.2吸附剂及其特性1.吸附剂吸附分离的效果很大程度上取决于吸附剂的性能,工业吸附要求吸附剂满足以下要求:(1)具有较大的内表面吸附容量大;(2)选择性高吸附剂对不同的吸附质具有不同的吸附能力,其差异愈显著,分离效果愈好;(3)具有一定的机械强度抗磨损;(4)有良好的物理及化学稳定性耐热冲击,耐腐蚀;(5)容易再生;(6)易得,价廉。
吸附分离

0 .0 0 0 .0 5 0 .1 0 0 .1 5 0 .2 0 0 .2 5
P /F
充压时间对产品罐压力波动的影响
p/MPa
0 .6 2
0 .6 1
0 .6 0 1
2
0 .5 9
3
0 .5 8
0 .5 7 0 .5 6
1 : 1 1 0 s e c 2 : 6 0 s e c 3 : 1 0 s e c
F e e d flo w r a te /s c c m
操作压力的影响
2 2 0 2 0 0 1 8 0 1 6 0 1 4 0 1 2 0 1 0 0
8 0 6 0 4 0
0 .2 0 .3 0 .4 0 .5 0 .6 0 .7 0 .8 0 .9
p /M P a
feed flowrate 216.7 Sccm
吸附技术应用
1 干燥(气/液) 2 除臭、脱色、溶剂回收 3 气体分离 4 污水处理 5 气体存储 应用领域:石化、化工、食品、医药、环保等。
1 吸附分离
基本原理: 吸附平衡差异 吸附动力学差异 位阻效应
分离原理
穿透曲线
1
c/c0
1
2
0
t
1
t
2
分离系数
分离系数定义:
ij
x x
Countercurrent
Pressure of adsorption
MPa 0.6 0.6
0.5 0.5
0.4 0.4
Time of Time of re- Oxygen
adsorption pressurization concentration
s
s
环境工程原理第八章吸附ppt课件

第二节 吸附剂
(2)降低压力
压力高,吸附进行得快,
脱附进行得慢。当压力降低时,脱附现象开始显著。所以操作压力
降低后,被吸附的物质就会脱离吸附剂表面返回气相。有时为了脱
附彻底,甚至采用抽真空的办法。
这种改变压力的再生操作,在变压吸附中广为应用。如吸附
分离高纯度氢,先是在 1.37~4.12 MPa压力下吸附,然后在常压
一、吸附分离操作的分类
• 按作用力性质分类:分物理吸附和化学吸附 • 物理吸附:吸附质分子与吸附剂表面分子间存在的范德华力
所引起的,也称为范德华吸附。 • 吸附热较小(放热过程,吸附热在数值上与冷凝热相当),
可在低温下进行; • 过程是可逆的,易解吸; • 相对没有选择性,可吸附多种吸附质; • 分子量越大,分子引力越大,吸附量越大; • 可形成单分子吸附层或多分子吸附层 。
下脱附,从而可得到高纯度氢,吸附剂也得到再生。
变压吸附 ——根据系统操作压力变化不同,变压吸附循环可
以是常压吸附、真空解吸,加压吸附、常压解吸,加压吸附、真空
解吸等几种方法。
第二节 吸附剂
(3) 通气吹扫 通入吸附剂床层,进行吹扫,以降低吸附剂上的吸附质分 压,从而达到脱附。当吹扫气的量一定时,脱附物质的量 取决于该操作温度和总压下的平衡关系。
第二节 吸附剂
四、吸附剂选择的影响因素
如何选择适宜的吸附剂? ——需要根据被分离对象、分离条件和吸附剂本身的特点 确定 ——需要进行试验研究
第二节 吸附剂
(1)将超细活性炭微粒加入增稠剂后与纤维混纺制成单丝, 或用热熔法将活性炭粘附于有机纤维或玻璃纤维上,也可 以与纸浆混粘制成活性炭纸。
(2)以人造丝或合成纤维为原料,与制备活性炭一样经过炭 化和活化两个阶段,加工成具有一定比表面积和一定孔分 布结构的活性炭纤维。
第八章产物的分离和纯化

6/4/2024
17
3. 凝聚与絮凝
采用凝聚和絮凝技术能有效改变细胞、细 胞碎片及溶解大分子物质的分散状态,使其聚 结成较大的颗粒,便于提高过滤速率。除此之外, 还能有效地除去杂蛋白质和固体杂质,提高滤 液质量。因此,凝聚和絮凝是目前工业上最常用 的预处理方法之一。常用于菌体细小而且粘度 大的发酵液的预处理。
6/4/2024
22
• 工业上常用的过滤分离设备有板框压 滤机、膜过滤机和离心沉降分离机等。
• 这些过滤装置各有其优缺点,根据不 同产品的具体实际加以选择。
6/4/2024
23
6/4/2024
24
6 其它方法
• 1. 高 价 无 机 离 子 的 去 除 ( Ca2+ 、 Mg2+ 、 Fe2+等)
6/4溶/202液4 称为萃取液。
52
• 工业上萃取的操作包括三个步骤:
• 一是混合
• 将料液和萃取剂充分混合形成乳浊液, 让溶质自料液转入萃取剂中,此过程通常 在搅拌罐中进行,也可以在很高速度的管 道内混合。
例如:在枯草芽孢杆菌发酵液中,加入氯化
钙和磷酸氢二钠,两者生成庞大的凝胶,把蛋白 质、菌体及其他不溶性粒子吸附并包裹在其中而 除去,从而可加快过滤速率。
6/4/2024
28
③变性法
蛋白质由有规则的排列到无规则结构的变化过程成为变性。变 性的蛋白溶解性小。
使蛋白质变性的方法有:加热,大幅度调节pH,加酒精等有机 溶剂或表面活性剂等 。
6/4/2024
2
• 2)、培养液是复杂的多相分散体系:
•
是多相体系,一般情况下,分散介质是水。
分散在其中的固体和胶体物质组成复杂,不仅
吸附分离技术

槽式吸附操作适用于外扩散控制的吸附传质过 程。 使用搅拌使溶液呈湍流状态,颗粒外表面的膜 阻力较少。
用于液体的精制,如脱水、脱色和脱臭等。 吸附剂用量S确定: 物料平衡 吸附相平衡
L(c0 c) Sq
从上式可以看出: 分子极性越大,μ增大,作用力也越大;分子的支 链会导致r增大,不利于吸附。 偶极矩与分子对称性、取代基位置等结构因素有关。 吸附作用力还与热力学温度成反比。
范德华力-诱导力
设极性分子的永久偶极矩为μ1,非极性分子的极化度为α2。则它们 间诱导力的能量为:
U诱导
=
2 μ 1 α
6 γ 2
· · · · · N C·
• 当分子间距离减小时,
范德华力增大,但当分 子间距离非常接近时, 就明显地表现出斥力。 • 当距离大于OB时,吸引 力未表示出来。 • 当吸附表面和分子间的 距离减小时,其吸引力 的能量逐渐增加, • 当距离减至分子半径OA 时,达到最大值。 • 当距离再减小时,推斥 力急剧增加。
分类
• 1 Langmuir 等温线 (单分子层) • 2 Freundlich等温线(抗生素/类固醇/甾类激素) • 3 离子交换等温线 单价:在缓冲液中, Langmuir 模拟 多价:Freundlich 模拟 • 4 亲和吸附等温线:类似于Langmuir 表达
吸附平衡常用Langmuir方程(单分子层吸附 等温线方程式)来描述:
2、吸附机理
固体内部分子所受分子间的 作用力是对称的,而固体表 面分子所受力是不对称的。 向内的一面受内部分子的作 用力较大,而表面向外一面 所受的作用力较小,因而当 气体分子或溶液中溶质分子 在运动过程中碰到固体表面 时就会被吸引而停留在固体 表面上。
08第六章-吸附分离法

缺点:
(1)选择性差,收率不高。 (2)一些无机吸附剂性能和吸附条件不稳定。 (3)不能连续操作,劳动强度大 (4)碳粉等吸附剂有粉尘污染
5
第一节 吸附法基本概念和吸附原理 第二节 常用吸附剂 第三节 大孔网状聚合物吸附剂
第一节 吸附法基本概念和吸附原理
一、吸附基本概念:
在等吸附容量情况下,表示温度和压力的关系曲线称为 吸附等容线。
应用最广的吸附等温线。
吸附等温线
如果不考虑溶剂的吸附,当固体吸附剂与溶液 中的溶质达到平衡时,其吸附量m应与溶液中 溶质的浓度和温度有关。 当温度一定时,吸附量只和浓度有关, m=f (c),这个函数关系称为吸附等温线。 吸附等温线表示平衡吸附量,可用来推断吸附 剂结构、吸附热和其他理化特性。
常用吸附剂
按其化学结构可分为两大类 无机吸附剂:白陶土、氧化铝、硅胶、硅藻土、磷酸钙 有机吸附剂:活性炭、淀粉、纤维素、大孔吸附树脂等
一、活性炭(activated carbon )
一种被广泛应用的优良的吸附剂。 是吸附能力很强的非极性吸附剂 对色素、细菌和热原等杂质有很强的吸附能力。 一般用木屑、兽骨、兽血或煤屑等为原料高温
2
典型的吸附过程包括四个步骤:
待分离料液与吸附剂混合、吸附质被吸附到吸附 剂表面、料液流出、吸附质解吸回收等四个过程。
料液与吸附剂 混合
Step1
吸附质被吸附 在吸附剂表面
Step2
料液流出 Step3
吸附质解吸附 吸附剂再生
Step4
4
优点:
(1)设备简单、操作简便、价廉、安全。 (2)少用或不用有机溶剂,吸附过程中pH变化小,
活性炭酸性 中性吸附 碱性洗脱
第八章_吸附与离子交换分离

(2)变压吸附分离。 )变压吸附分离。 利用压力变化实现吸附与解吸。 利用压力变化实现吸附与解吸。 压力变化实现吸附与解吸 较高压力下吸附,常压或低压下解吸、 较高压力下吸附,常压或低压下解吸、同时吸附 剂再生,然后升压到吸附压力,进入下一个循环。 剂再生,然后升压到吸附压力,进入下一个循环。 循环周期短,吸附热来不及散失便供给解吸用, 循环周期短,吸附热来不及散失便供给解吸用, 吸附床层温度变化很小,近似等温过程。 吸附床层温度变化很小,近似等温过程。 用于气体混合物的分离。 用于气体混合物的分离。 气体混合物的分离
3、吸附分类 、 据吸附质、吸附剂之间相互作用力的不同划分: 据吸附质、吸附剂之间相互作用力的不同划分: 物理吸附、 物理吸附、化学吸附 (1)物理吸附:吸附质、吸附剂通过分子间力 )物理吸附:吸附质、吸附剂通过分子间力 (也称“范德华力”)相互吸引,形成吸附现象。 也称“范德华力” 相互吸引,形成吸附现象。 吸附过程可逆,通过改变温度、 值 吸附过程可逆,通过改变温度、PH值、盐浓度等 过程可逆 物理条件可以使被吸附的组分脱附; 物理条件可以使被吸附的组分脱附; 吸附热小; 吸附热小; 活化能低,几乎不需活化能; 活化能低,几乎不需活化能; 吸附和解吸过程都很快。 吸附和解吸过程都很快。 过程都很快
2、吸附分离的特点 、 (1)常用于稀溶液的分离。 )常用于稀溶液的分离。 稀溶液的分离 热敏性物质的分离 (2)操作条件温和,适合于热敏性物质的分离。 )操作条件温和,适合于热敏性物质的分离。 (3)可直接与其它分离过程、反应过程耦合,改 )可直接与其它分离过程、反应过程耦合, 善分离过程的动力学、热力学关系。 分离过程的动力学、热力学关系。 动力学 相互作用有时非常复杂。 (4)溶质与吸附剂之间的相互作用有时非常复杂。 )溶质与吸附剂之间的相互作用有时非常复杂
吸附分离技术

(3)溶液的pH值 由于溶液的pH值直接决定树脂交换基团及交 换离子的解离程度,进而影响树脂对交换的选择 性和吸附容量。对于强酸、强碱性树脂,溶液pH 主要左右交换离子的解离度,决定它带何种电荷 以及电荷量,决定被树脂吸附或吸附的强弱。对 于弱酸、弱碱性树脂,溶液的pH还是影响树脂解 离程度和吸附能力的重要因素。但过强的交换能 力有时会影响到交换的选择性,同时增加洗脱难 度。
应用: 用于分离蛋白质、酶等大分子的生物活性物 质。 缺点: (1)强度较差,流速低; (2)强酸、强碱容易破坏天然多糖的结构; (3)易污染,易被微生物降解。
离子交换剂的类型
强阳 弱阳 强阴 弱阴
阳离子交换剂 离子交换剂 阴离子交换剂
阳离子交换剂
能与阳离子进行交换的离子交换剂。
强阳(强酸性)离子交换剂 活性基团是磺酸基团(-SO3H)或次甲基磺酸 基团-(CH2)2SO3H。都是强酸性基团,其电离程度 大且不受溶液pH的影响,当pH值在1-14范围内时, 均能进行离子交换反应。
顺序号 骨架代号 分类代号 大孔型代号
1 ~ 100 为强酸性阳离子交换树脂 101 ~ 200为弱酸性阳离子交换树脂 201 ~ 300为强碱性阴离子交换树脂 301 ~ 400为弱碱性阴离子交换树脂
如:001 7是凝胶型苯乙烯系强酸性阳离子交换树脂,交联度7%; D201是大孔型苯乙烯系季胺 I 型强碱性阴离子交换树脂
中和: R-N+(CH3)3OH- + H+ClR-N+(CH3)3Cl- + H2O 中性盐分解: R-N+(CH3)3OH- + Na+ClR-N+(CH3)3Cl- + Na+OH复分解: R-N+(CH3)3Cl- + Na2SO42R[N+(CH3)3]2SO42- + 2Na+Cl主要用于制备无盐水(除去SiO2-、CO32-等弱 酸根)及卡那霉素、巴龙霉素、新霉素等的精制。
第八章-吸附分离法PPT课件

第一节 概 述
2021
1
前言
利用适当的吸附剂,在一定的pH条件下,吸 附样品中的目标物质,然后再以适当的洗脱剂 将吸附的物质从吸附剂上解吸下来,达到浓缩 和提纯的目的。
广泛应用在各种生物行业,如酶、蛋白质、核 苷酸、抗生素、氨基酸等的分离纯化中。
2021
2
吸附法的特点
1、可不用或少用有机溶剂
2、操作简便、安全、设备简单
3、生产过程pH变化小,适用于稳定性较差的物质。
缺点:选择性差,收率不高,特别是无机吸附剂 性能不稳定,不能连续操作,劳动强度大。
应用:如需要的成分易吸附,可在吸附后除去不 吸附和不易吸附的杂质,再将样品洗脱;当需要 的成分较难吸附,则将杂质吸附除去,故吸附法 常用来除杂。
D 氢键力 另一种特殊的分子间作用力是氢键力。它是一种 介于库仑引力与范德华引力之间的特殊定向力,比诱导 力、色散力都大。
吸附等温线
固体在溶液中的吸附,是溶质和溶剂分子争夺表 面的净结果,即在固液界面上,总是被溶质和溶剂两 种分子占满,如果不考虑溶剂的吸附,当固体吸附剂 与溶液中的溶质达到平衡时,其吸附量m应与溶浓中 溶质的浓度和温度有关。
q* mc
m为分配系数。
适应条件:在低浓度范围之内 成立。当浓度较高时,上式无 效。
2021
19
吸附等温线
B)、Freundlich type 其经验公式为
q* kc1/n 其 中 , k 和 n 为 常 数 , n 一 般 在 110之间。 Freundlich等温线可以 描述大多数抗生素、类固醇、甾 类激素等在溶液中的吸附过程。
离子的电荷是交换吸附的决定因素,离子所带电荷越多, 它在吸附剂表面的相反电荷点上的吸附力就越强,电荷 相同的离子,其水化半径越小,越易被吸附。
吸附分离

o
0
100
பைடு நூலகம்
200
300
400
500
600
t/Sec
新装置的操作稳定性
0.8 0.7 0.5 0.6 0.6
O2 concentration
0.4
0.4 0.3
0.3
0.2 0.2 0.1 0.1 0.0 0 25 50 75 100 125 150 175 0.0
Cycles
Recovery
0.5
Oxygen recovery 0.300 0.272 0.262 0.215 0.270 0.211
操作压力的影响
105 120 100 105
H2 purity/%
95
90
90
85 75 80
p/MPa:
0.4 0.6 0.8 1.0
60
75
70 5.0
7.5
10.0
12.5
15.0
17.5
20.0
Cycle sequence
EQ2 BD EQ1 PG PP A FR EQ2 EQ2 EQ1 BD EQ1 PG PP A FR EQ2 EQ2
A-Adsorption,EQ1-First pressure-equalization, PP-Co-current pressure release,EQ2-Second pressure-equalization,BD-Countercurrent pressure release, PG-Countercurrent purge,FR-Final pressurization,-Co-current,-Countercurrent
ni nt xi
吸附分离技术
炭质吸附剂
化学吸附
离子交换剂 螯合剂
阳离子交换剂 阴离子交换剂 两性离子交换剂
物理吸附
可再生高分子试剂和催化剂 非极性吸附剂 中极性吸附剂 极性吸附剂
亲和吸附
免疫吸附剂 仿生吸附剂
按形态和孔结构分类
球型树脂(大孔、凝胶、大网) 离子交换纤维与吸附性纤维 无定型颗粒吸附剂
活性炭
炭质吸附剂
碳纤维
按
碳化树脂
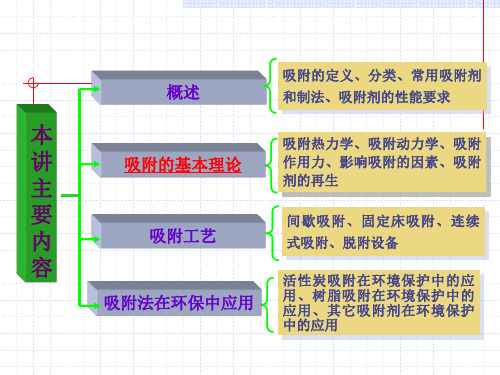
概述
吸附的定义、分类、常用吸附剂 和制法、吸附剂的性能要求
本
吸附热力学、吸附动力学、吸附
讲
吸附的基本理论
作用力、影响吸附的因素、吸附
主
剂的再生
要
间歇吸附、固定床吸附、连续
内
吸附工艺
式吸附、脱附设备
容
活性炭吸附在环境保护中的应
吸附法在环保中应用
用、树脂吸附在环境保护中的 应用、其它吸附剂在环境保护
中的应用
炭化树脂与活性炭纤维的缺点是成本较高,只能用 于高附加值 产业。
(1) 活性炭
与其它吸附剂相比,活性炭具有巨大的比表面积, 通常可达500-1700m2/g,因而形成强大的吸 附能力。微孔的容积约为0.15-0.9mL/g,比表 面积占活性炭总比表面积的95%以上。过渡孔 的容积通常为0.02-0.1mL/g,比表面积一般不 超过总比表面积的5%;大孔的容积为0.20.5mL/g。
吸附树脂与离子交换树脂:
吸附树脂和离子交换树脂都是具有多孔性海绵状 立体网状结构的小颗粒,在整个颗粒内部及外部都 具有表面活性,不溶于一般的酸、碱和溶剂,为不 溶不熔的热固性物质,可在150℃以下使用,它们 都能与外界物质进行可逆的吸附-解吸或离子交换 而达到化学平衡。
第八章 吸附分离法解读
三、吸附力的本质
吸附作用的最根本因素是吸附质和吸附剂之间的作 用力,也就是范德华力,它是一组分子引力的总称, 具体包括三种力:定向力(keesom)、诱导力(Debye) 和色散力(London)。 范德华力和化学力(库仑力)的主要区别在于它的单 纯性,即只表现为互相吸引。
A.定向力 由于极性分子的永久偶极矩产生的分子间的静 电引力称定向力。它是极性分子之间产生的作用力。与温 度有关。 B.诱导力 极性分子与非极性分子之间的吸引力属于诱导 力。极性分子产生的电场作用会诱导非极性分子极化,产 生诱导偶极矩,因此两者之间互相吸引,产生吸附作用。 与温度无关。
物质从流体相(气体或液体)浓缩到固体表面从 而实现分离的过程称为吸附作用。 在表面上能发生吸附作用的固体称为吸附剂, 而被吸附的物质称为根据其相互作用力的不同来分类。 产生吸附效应的力有范德华力、静电作用力以 及在酶与基质结合成络合物时存在的疏水力、 空间位阻等。按照范德华分子间或键合力的特 性,通常可分为以下三种类型。
物理吸附与化学吸附本质上虽有区别,但有 时也很难严格划分,可能在某些过程以物理 吸附为支配作用,而在另一些过程中以化学 吸附为支配作用。两种吸附的比较见下表:
物理吸附
吸附作用力 选择性 所需活化能 吸附速度 吸附分子层 范德华力 较差 低 快 单层或多层
化学吸附
库伦力 较高 高 慢 单层
(三)、交换吸附
1
弗罗因德利希(Freundlich)等温线
弗罗因德利希提出了如下经验公式
其对数形式是:
式中 m为单位质量吸附剂上吸附的吸附质量,c为吸 附质的平衡浓度;K和n为经验参数,可从双对数坐 标图上曲线的截距和斜率求得。
2
兰格缪尔(Langmuir)等温线
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C 色散力 非极性分子之间的引力属于色散力。当分子 由于外围电子运动及原子核在零点附近振动,正负电 荷中心出现瞬时相对位移时,会产生快速变化的瞬时 偶极矩,这种瞬时偶极矩能使外围非极性分子极化, 反过来,被极化的分子又影响瞬时偶极矩的变化,这 样产生的引力叫色散力。
在表面上能发生吸附作用的固体称为吸附剂, 而被吸附的物质称为吸附物。
二、吸附的类型
吸附作用是根据其相互作用力的不同来分类。 产生吸附效应的力有范德华力、静电作用力以 及在酶与基质结合成络合物时存在的疏水力、 空间位阻等。按照范德华分子间或键合力的特 性,通常可分为以下三种类型。
物理吸附 化学吸附 交换吸附
颗粒大小 小
较小 大
表面积 大
较大 小
吸附力 大
较小
吸附量 大
较小
小
小
洗脱 难 难 易
活性炭的选择
根据所分离物质的特性,选择吸附力适当的活 性炭是成功的关键。
当欲分离物质不易被吸附时,选择吸附力强的 活性炭;反之,则选择吸附力弱的活性炭。
首次分离样品时,一般先选用颗粒状活性炭, 如待分离的物质不能被吸附,则改用粉末状活 性炭。如待分离物质吸附后不能洗脱或难洗脱, 则改用锦纶活性炭。
换句话说,在分子间相互作用的总能量中,各种力所占 的相对比例是不同的,主要取决于两个性质,即吸附物 的极性和极化度,极性越大,定向力作用越大;极化度 越大,色散力的作用越大。诱导力是次级效应,计算结 果表明,其能量约为分子间力的总能量的5%。
D 氢键力 另一种特殊的分子间作用力是氢键力。它是一种 介于库仑引力与范德华引力之间的特殊定向力,比诱导 力、色散力都大。
活性炭对物质的吸附规律
活性炭是非极性吸附剂,因此在水溶液中吸附力最强,在有 机溶剂中吸附力较弱。故水的洗脱能力弱,有机溶剂较强。 水>乙醇>甲醇>乙酸乙酯>丙酮>氯仿
活性炭对不同物质的吸附能力有所不同,遵循以下规律: (1)对具有极性基团的化合物吸附力较弱; (2)对芳香族化合物的吸附力大于脂肪族化合物; (3)对相对分子量大的化合物吸附力大于对相对分子量小的
吸附机理
固体表面分子(或原子)与固体内部分子所处的 状态不同,固体内部分子受邻近四周分子的作用 力是对称的,作用力总和为零。
但界面上的分子同时受 到不相等的两相分子的作 用力,作用力总和不等于 零,合力方向指向固体内 部,故能从外界吸附分子、 原子或离子,并在表面形 成多分子层或单分子层。
物质从流体相(气体或液体)浓缩到固体表面从 而实现分离的过程称为吸附作用。
Langmuir吸附等温线
= C KADS / (1 + C KADS)
3 离子交换等温线
单价离子交换吸附也可用 兰格缪尔等温吸附方程描 述
4 亲和吸附等温线
亲和吸附等温线,常类似于兰格缪尔吸附等温线,由
于是生物特异性结合,所以常为单分子层吸附。当然
对每一体系都需用实验证实。
第三节 几种常用的吸附剂
非 对
常 吸
大 附
, 浓
这 度
时游 影响
离 极
小,接近不可逆吸附。
D)、Rectangle type 如在固定化单克隆抗体的免疫 亲和吸附中,一般存在 n > 10。
1 弗罗因德利希(Freundlich)等温线
弗罗因德利希提出了如下经验公式
其对数形式是:
式中 m为单位质量吸附剂上吸附的吸附质量,c为吸 附质的平衡浓度;K和n为经验参数,可从双对数坐 标图上曲线的截距和斜率求得。
(2)颗粒活性炭:其表面积有所减少,吸附力和吸附量 次于粉末状活性炭,流速较快,可控制。
(3)锦纶-活性炭:以锦纶为黏合剂将粉末活性炭制成 颗粒,总表面介于上述两者之间,但吸附力较两者弱, 可用于分离两者吸附力太强不易洗脱的化合物。
活 性 炭(Active carbon)
活性炭种类 粉末活性炭 颗粒活性炭 锦纶活性炭
三、吸附力的本质
吸附作用的最根本因素是吸附质和吸附剂之间的作 用力,也就是范德华力,它是一组分子引力的总称,具 体包括三种力:定向力(keesom)、诱导力(Debye) 和色散力(London)。
范德华力和化学力(库仑力)的主要区别在于它的单 纯性,即只表现为互相吸引。
A.定向力 由于极性分子的永久偶极矩产生的分子间的静电 引力称定向力。它是极性分子之间产生的作用力。与温度有 关。
(一)、物理吸附
吸附剂和吸附物通过分子力(范德华力)产生的吸附称为物理 吸附。
这是一种最常见的吸附现象,其特点是吸附不仅限于一些活 性中心,而是整个自由界面。
分子被吸附后,一般动能降低,故吸附是放热过程。 物理吸附的吸附热较小,物理吸附时,吸附物分子的状态变 化不大,需要的活化能很小,多数在较低的温度下进行。 由于吸附时除吸附剂的表面状态外,其他性质都未改变,所 以两相在瞬间即可达到平衡。 有时吸附速度很慢,这是由于在吸附剂颗粒的孔隙中的扩散 速度是控制步骤的缘故。
(二)、化学吸附
化学吸附是由于吸附剂在吸附物之间的电子转移,发生 化学反应而产生的,属于库仑力范围,它与通常的化学 反应不同的地方在于吸附剂表面的反应原子保留了它或 它们原来的格子不变。
反应时放出大量的热,由于是化学反应,故需要一定的 活化能,需在较高的温度下进行。
化学吸附的选择性较强,即一种吸附剂只对某种或几种 特定物质有吸附作用,因此化学吸附一般为单分子层吸 附,吸附后较稳定,不易解吸,平衡慢。
色散力也与温度无关,且是普通存在的,因为任何系 统中都有电子存在。色散能与外层电子数有关,随着 电子数的增多而增加。
上述各力的数值大小,对于各种物质是不一样的,取决 于吸附物的性质。例如固体吸附剂表面的极性如果不均 匀而吸附物分子具有永久偶极矩,那末在吸附过程中起 主要作用的是定向力,色散力的能量相对较小;如果吸 附物是非极性分子,那未定向力等于零,而在吸附过程 中起主要作用的是色散力。
剂结构、吸附热和其他理化特性。
由于吸附剂与吸附物之间的作用力不同,吸附剂表面 状态不同,则吸附等温线也相应不同。
从现象上来看,生物分离中至少有四种可能的 等温线,如图所示。
吸附等温线
当吸附剂与溶液中的溶质达到
平衡时,其吸附量q*同溶液中
溶质的平衡应与温度有关。当 温度一定时,吸附量只和浓度
有关,q* = f(c) --- 吸附等言
利用适当的吸附剂,在一定的pH条件下,吸 附样品中的目标物质,然后再以适当的洗脱剂 将吸附的物质从吸附剂上解吸下来,达到浓缩 和提纯的目的。
广泛应用在各种生物行业,如酶、蛋白质、核 苷酸、抗生素、氨基酸等的分离纯化中。
吸附法的特点
1、可不用或少用有机溶剂 2、操作简便、安全、设备简单 3、生产过程pH变化小,适用于稳定性较差的物质。 缺点:选择性差,收率不高,特别是无机吸附剂
第二节 吸附过程的理论基础
一、基本概念
固体可分多孔和非多孔两类。 非多孔固体只具有很小的比表面(只有外表面),
可通过粉碎增加其比表面。 多孔性固体由于颗粒内微孔的存在,比表面很大,
可达每克几百平方米。 多孔性固体比表面积由外表面和内表面组成,内
表面积是外表面积的几百倍,并具较大吸附力, 故多用多孔性固体作为吸附剂。
物理吸附
物理吸附是可逆的,即在吸附的同时,被吸附 的分子由于热运动会离开固体表面,分子脱离 固体表面的现象称为解吸。
物理吸附可分成单分子层吸附或多分子层吸附。 由于分子力的普遍存在,一种吸附剂可吸附多
种物质,没有严格的选择性,但由于吸附物性 质不同,吸附的量有所差别。 物理吸附与吸附剂的表面积、孔径分布和温度 等因素密切相关。
二、硅胶
应用最广泛的极性吸附剂。
可用SiO2·nH2O表示,具有多孔性硅氧烷交链
结构。表面具很多硅醇(-Si-OH)基团, 能吸附很多水分,加热即能除去,但高温下 (500℃ )硅胶的硅醇结构被破坏,失去活性。 优点:化学惰性,具较大吸附量,易制备不同 类型、孔径、表面积的多孔性硅胶。
吸附剂通常应具备以下特征:对被分 离的物质具有较强的吸附能力、有较 高的吸附选择性、机械强度高、再生 容易、性能稳定、价格低廉。
一、活性炭
吸附力强、分离效果好,价格低,来源方便。 但不同来源、制法、批号的吸附力不同,故难使其标准 化,结果难以重复。且色黑质轻,易污染环境。
(1)粉末状活性炭:颗粒极细,总表面积大,吸附能力 强,吸附量大,但颗粒太细而影响过滤速度,需加压或 减压,操作麻烦。
2 兰格缪尔(Langmuir)等温线
单分子层吸附等温线方程式是由兰格缪尔建立的。兰 格缪尔方程式以下列假定为基础:吸附是在吸附剂的 活性中心上进行的;这些活性中心具有均匀的能量, 且相隔较远,因此吸附物分子间无相互作用力;每一 个活性中心只能吸附一个分子,即形成单分子吸附层。
[A]为未被吸附的吸附质分子的浓度; A为未被吸附 的吸附质分子。
这种吸附与吸附剂表面化学性质以及吸附物的化学性质 有关。
物理吸附与化学吸附本质上虽有区别,但有 时也很难严格划分,可能在某些过程以物理 吸附为支配作用,而在另一些过程中以化学 吸附为支配作用。两种吸附的比较见下表:
吸附作用力 选择性
所需活化能 吸附速度
吸附分子层
物理吸附 范德华力
较差 低 快 单层或多层
化合物。 (4)一般碱性物质在中性下吸附,在酸性下解吸;酸性物质
在中性下吸附,在碱性解吸。 (5)吸附溶质的量在未达到平衡前随温度提高而增加。
活性炭的活化
活性炭是一种强吸附剂,对气体吸附能力很大, 气体分子占据了活性炭的吸附表面,产造成活 性炭“中毒”,使其活力降低。
故使用前可加热烘干,以除去大部分气体,一 般的活性炭可在160℃加热干燥4~5h;锦纶 受热易变形,可在100℃干燥4~5h。
