必修二 第一章第一节 原子结构
(完整word版)高中化学必修二第一章知识点和习题(含答案),推荐文档

第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子)原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。
必修2第1章原子结构与元素周期律 (1)

必修2第1章原子结构与元素周期律第1讲原子结构、元素周期表[考纲要求]1、了解原子的构成,了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
2、了解元素、核素、同位素的含义。
3.了解原子核外电子的排布。
了解原子结构示意图的表示方法。
4、了解元素周期表(长式)的结构(周期、族)及其应用。
知识点一 原子的构成 1.原子 (1)原子结构原子(AZ X)⎩⎪⎨⎪⎧⎩⎨⎧质子(Z )个中子(A —Z )个 (Z )个2.核素、同位素、元素 概念①核素:具有一定数目________和一定数目________的一种________, 如氢元素有三种核素符号为____________________。
②同位素:________相同而________不同的同一元素的不同________互称同位素。
③元素:具有相同____________的同一类__________的总称。
知识点二 核外电子排布1.电子层的表示方法及能量变化电子层数 由内向外 数字表示法 1 2 3 4 5 6 7 字母表示法离核远近 ――→由 到 电子能量 ――→由 到2.(1)能量最低原理:核外电子总是尽可能先排布在能量________的(离原子核________)的电子层里。
(2)每层最多容纳的电子数为______个。
最外层电子数最多不超过____个(K 层为最外层时不超过____个),次外层电子数最多不超过____个,倒数第三层电子数最多不超过____个。
知识点三 元素周期表 1、编排原则:①把 相同的元素按 递增顺序从左到右排成一横行,共有 个横行。
②把不同横行中相同的元素按递增的顺序从上到下排成一纵行,共有纵行。
2、元素周期表的结构短周期长周期不完全周期序号 1 2 3 4 5 6 7元素种数最多容纳32种元素,目前排了26种元素0族元素原子序数86 ------(2)族主族列序 1 2 13 14 15 16 17族序号副族列序 3 4 5 6 7 11 12族序号第Ⅷ族第________共3列0族第________列(1)过渡元素:元素周期表中部从________族到________族10个纵列共六十多种元素,这些元素都是金属元素。
高中化学选择性必修二 第1章第1节原子结构 第二课时 教案

《原子结构》第二课时教学设计原子结构理论成功的阐述了原子的稳定性,氢原子光谱的产生和不连续性。
1926年,量子力学推翻了玻尔的氢原子模型,指出一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
概率密度:P表示电子在某处出现的概率;V表示该处的体积;求真务实、不断进步的科学精神与社会责任感。
讲授新课第一节原子结构第二课时电子云与原子轨道、泡利原理、洪特规则、能力最低原理一、电子云【问题】图1-7 中的小点是什么呢?是电子吗?小点是1s电子在原子核外出现的概率密度的形象描述。
小点越密,表明概率密度越大。
由于核外电子的概率密度分布看起来像一片云雾,因而被形象的称作“电子云”。
1.电子云概念电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
电子在原子核外一定空间范围内出现的概率统计起来,好似在原子核外笼罩着一团带负电的云雾,形象称为“电子云”。
2.电子云轮廓图电子云图很难绘制,使用不便,我们常使用电子云轮廓图。
为了表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
把电子在原子核外空间出现概率P=90%的空间圈出来,即电子云轮廓图。
【过渡】所有原子的任意能层的s电子的电子云轮廓图都思考认识核外电子的运动特点。
知道电子的运动状态(空间分布及能量)。
是一个球形,只是球的半径不同。
同一原子的能层越高,s 电子云半径越大,是由于电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
就像宇宙飞船必须提供能量推动才能克服地球引力上天,2s电子比1s电子能量高,克服原子核的吸引在离核更远的空间出现的概率就比1s大,因而2s电子云必然比1s电子云更弥散。
二、原子轨道1.定义:电子在原子核外的一个空间运动状态称为一个原子轨道。
2.形状:(1)s电子的原子轨道呈球形,能层序数越大,原子轨道的半径越大。
高中化学必修2第1章第1节原子结构—【教学课件】-最新经典通用版

下: 1s2
1s22s1
1s22s22p1
1s1→
→
→1s22s2→
→1s22s22p2
氢氦
锂
铍
硼
碳
新课探究 ①在书写电子排布式时,一般情况下,能层低的能级要写在左边,而不是按构造原理顺序 写。 书写顺序:1s、2s、2p、3s、3p、3d、4s、4p、4d、4f、5s…… 电子填充顺序(构造原理):1s、2s、2p、3s、3p、4s、3d、4p、5s……
< E(nf)……
新课探究
3.理清能层、能级与最多容纳的电子数、能量之间的相互关系
能层(n)
一二 三
四
五 六七
…
符号
KL M
N
O PQ
…
能级
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s … … …
…
2 2 6 2 6 10 2 6 10 14 2 … … …
…
最多容纳电子数 2 8 18
新课探究
[归纳总结] (1)能层(n)即为电子层,任何能层均含有s能级,但不是任何能层均含有任何能 级;各能层的能级都是从s能级开始,每个能层上能级个数与能层数相等。 (2)同一能层里,各能级的能量按照s、p、d、f……顺序依次递增。 (3)不同能层中同一能级,能层序数越大,能量越高。例如:1s<2s<3s<4s……
新课探究
知识点一 能层与能级
1.能层 (1)含义:核外电子按 能量 不同分成能层(电子层)。 (2)能层序数及符号: 电子的能层由内向外排序,其序号、符号以及所能容纳的最多电子数如下:
能层
一
二
高中化学必修二知识点大全

高中化学必修二知识点大全高中化学必修2知识点归纳总结第一章物质结构、元素周期律一、原子结构原子由质子、中子和电子组成。
其中,质子数量决定了元素的种类,中子数量则决定了同一元素不同核素的存在,而电子则决定了元素的化学性质。
原子序数等于核电荷数等于质子数,也等于核外电子数。
电子按照能量最低的原则排布在不同的电子层中,每个电子层最多容纳2n个电子,最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
二、元素周期表元素周期表是按照原子序数递增的顺序,将元素按照电子层数和最外层电子数的不同排列而成的表格。
周期数等于元素最外层电子层数,主族序数等于元素最外层电子数。
元素周期表中,横行称为周期,纵列称为族,共有7个主族和7个副族,以及三个Ⅷ族和一个零族。
周期表中的元素按照一定的规律排列,能够显示出元素的物理和化学性质的周期性变化。
例如,同一周期内的元素具有相似的电子结构和化学性质,而同一族内的元素具有相同的最外层电子结构和化学性质。
三、元素周期律元素周期律是指元素周期表中元素物理和化学性质的周期性变化规律。
元素周期律包括原子半径、电子亲和能、电离能、电负性等物理和化学性质的周期性变化。
例如,原子半径随着周期数的增加而逐渐减小,而同一周期内原子半径随着原子序数的增加而逐渐减小。
电子亲和能和电离能则相反,随着周期数的增加而逐渐增大,而同一周期内电子亲和能和电离能随着原子序数的增加而逐渐减小。
掌握元素周期律可以帮助我们预测元素的物理和化学性质,从而更好地理解和应用化学知识。
元素周期律是指元素的性质随着核电荷数的递增而呈现周期性变化的规律。
这些性质包括核外电子排布、原子半径、主要化合价、金属性和非金属性。
这种周期性变化实际上是元素原子核外电子排布周期性变化的必然结果。
同一周期内的元素性质也存在递变规律。
以第三周期元素为例,它们的电子排布和原子半径随着核电荷数的增加而发生变化,而主要化合价则依次为+1、+2、+3、-4、+5、-3、+6、-2、+7和-1.此外,金属性和非金属性、单质与水或酸置换、氢化物的化学式、与H2化合的难易、氢化物的稳定性、最高价氧化物的化学式、酸碱性以及变化规律等方面也存在一定的变化规律。
人教版高中化学选择性必修二 第1章第一节 原子结构

能层是楼层
N层
能 量 越能 来层 越 高
M层
能级是楼层的阶梯
同
一
能
层
各
能
级
能
量
越
能 级
来 越 高
L层 K层
01 能层与能级
同一个能层的电子,还会被分成不同能级
任一能层的能级总是从_s_开始,依次_s_、__p_、__d_、__f_._._._ 能级数_等__于__该能层序数 s、p、d、f...可容纳的最多电子数依次为_1_,_3_,_5_,_7_._._._的__2_倍__ 同一能层各能级的能量顺序__E_(_n_s_)_<_E_(_n_p_)_<_E_(_n_d_)_<_E_(_n_f_)_
一个新的科学真理会胜出,通常 不是因为说服了反对者,敦促他们了 解新知,而是因为反对者死掉了,新 的一代成长起来。
——玻尔
对于原子科学家最感兴趣的是——
原子核外的电子是如何运动的? 原子核外的电子是如何排布的?
人类认识原子的历史是漫长的,也是无止境的。
18世纪末,随着工业革命 的发展,对物质化学成分 和化学反应过程的研究需 要深入到物质结构领域
构成物质的最小粒子是原子, 原子是不可再分的实心球体。
1803年
实心球模型
1897年,汤姆生在原子内部 发现了电子,人们终于抛弃 了原子不可分割的陈旧观念。
1904年
葡萄干面包模型
1911年,卢瑟福通过精密的实 验证明在原子中心有一个极小 的核,电子绕核做高速旋转。
1911年
核式模型
丹麦科学家 玻尔
1.原子的组成与结构是怎样的?
核外电子 → 带负电
原子
质子 → 带正电
鲁科版化学必修二课后练习(带答案)

1、据报道,某些花岗岩会产生氡(22286Rn),从而对人体产生伤害。
请回答:(1)该原子的质量数是,质子数是,中子数是。
(2)请补全Rn的原子结构示意图(3)请根据Rn的原子结构预测,氡气的化学性质()A.非常活泼,容易与氧气等非金属单质反应B.比较活泼,能与钠等金属反应C.不太活泼,与氮气性质相似D.很难与其他物质发生反应⑶研究发现,镭能蜕变为22286Rn,故称22286Rn为镭射气;钍能蜕变为22086Rn,故将22086Rn称为钍射气;锕能蜕变为21986Rn,故将21986Rn称为锕射气。
22286Rn、21986Rn是()A.同种元素B.同位素C.同种核素D.同种原子由此可见,决定元素种类,质子数和决定核素种类。
2、请利用原子结构的知识解释下列事实(1)在硫化钠中,钠元素显+1价,硫元素显-2价(2)钠原子和铝原子电子层数相同,但金属钠与氯气的反应要比金属铝与氯气的反应容易而且剧烈。
第二节元素周期律和元素周期表ag jb c f i l me h kd(1)表中所列元素中:属于短周期元素的有________________________________,属于主族元素的有____________________,e元素在周期表中的位置是_________周期,_______族。
(2)下列___________组元素的单质可能都是电的良导体A.b,c,iB.a,g,kC.c,g,lD.d,e,f(3)将元素a,b,c,f,l的原子半径按从小到大的顺序排列:_______________________ (4)i元素属于___________元素,它的最高化合价是____________,最低化合价是_______。
它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出i 的单质与氧气反应的化学方程式:___________________________________________。
鲁科版高一化学必修二第一单元第一节原子结构经典讲义
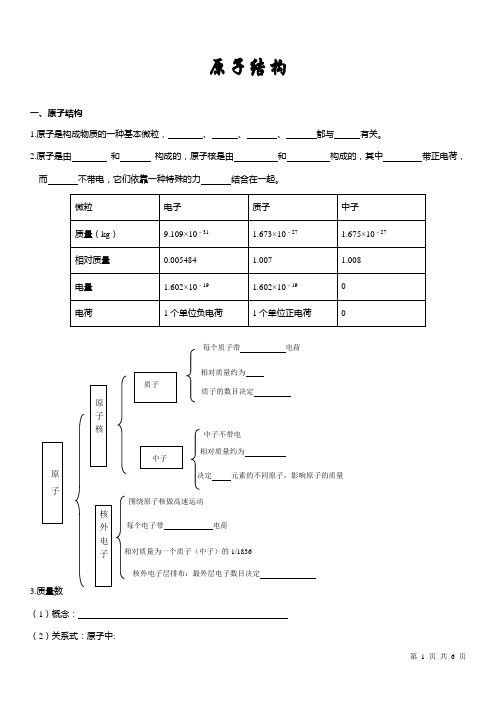
原子结构一、原子结构1.原子是构成物质的一种基本微粒,、、、都与有关。
2.原子是由和构成的,原子核是由和构成的,其中带正电荷,而不带电,它们依靠一种特殊的力结合在一起。
3.质量数(1)概念:(2)关系式:原子中:相对质量约为质子的数目决定中子不带电相对质量约为决定元素的不同原子,影响原子的质量围绕原子核做高速运动每个电子带电荷相对质量为一个质子(中子)的1/1836核外电子层排布:最外层电子数目决定每个质子带电荷核电荷数(Z )= =质量数(A )= ( )+ ( ) 4.原子结构的表示方法:AZX【思考】①阳离子中A Z X n +:核外电子数=质量数(A )= + ②阴离子中A Z X m -:核外电子数= 质量数= + 二、元素、核素、同位素1.元素是 , 元素的种类由 决定。
填写下表并思考:①分别写出氕、氘、氚的原子符号表达式:氕 氘 氚 ②氕、氘、氚的原子结构有什么异同?它们是同一种元素吗?它们是同一种原子吗? ③原子核都是由质子和中子组成的吗?2.核素: 。
几种常见的核素(写出相应的核素符号)氢 ,碳 ,氧 ,氯 ,铀目前已经发现了112种元素,是否表示发现了112种原子?理由是什么?3.同位素: 。
它分为和两种,放射性同位素最常见的应用是制造氢弹原料的是,制造原子弹和核反应堆燃料的是。
三、核外电子排布1.核外电子运动的特征2.核外电子的分层排布看表2总结每层最多可以排布的电子数目?元素的性质与元素原子的最外层电子排布的关系(1)稀有气体原子最外层电子数为8(氦除外),结构稳定,性质;金属原子最外层电子数一般少于4个,易电子;表现性;非金属原子最外层电子数4个,较易获得电子,表现性。
(2)化合价是的一种重要性质。
元素化合价的数值,与特别是有关。
题型一:有关原子结构、元素、核素、同位素练习题例1.对于A Z X 和A+1Z X+ 两种粒子,下列叙述正确的是( ) A .质子数一定相同,质量数和中子数一定不同 B .化学性质几乎相同C .一定都由质子、中子、电子构成D .核电荷数,核外电子数一定相同 例2.、、、H +、H 2是 可以表示为 ( )。
高中化学选择性必修二 第1章第1节 原子结构 讲义

第一章原子结构与性质第一节原子结构一、能层与能级1.能层(1)核外电子按能量不同分成能层并用符号K、L、M、N、O、P、Q…表示。
(2)能层越高,电子的能量越高,能量的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
2.能级(1)定义:根据多电子原子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母s、p、d、f等表示,如n能层的能级按能量由低到高的排列顺序为n s、n p、n d、n f等。
(3)能层、能级与最多容纳的电子数由上表可知:①能层序数等于该能层所包含的能级数,如第三能层有3个能级。
② s、p、d、f 各能级可容纳的电子数分别为1、3、5、7的2倍。
③原子核外电子的每一能层最多可容纳的电子数与能层的序数(n)间存在的关系是2n2。
【注】(1)不同能层之间,符号相同的能级的能量随着能层数的递增而增大。
(2)在相同能层各能级能量由低到高的顺序是n s<n p<n d<n f。
(3)不同能层中同一能级,能层数越大,能量越高。
例如:1s<2s<3s<4s……二、基态与激发态原子光谱1.基态原子与激发态原子(1)基态原子:处于最低能量状态的原子。
(2)激发态原子:基态原子吸收能量,电子会跃迁到较高能级,变为激发态原子。
(3)基态、激发态相互间转化的能量变化吸收能量激发态原子。
基态原子释放能量,主要形式为光2.光谱(1)原子光谱不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱。
(2)原子光谱的成因及分类(3)光谱分析:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
【注】(1)电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量;反之,将吸收能量。
光(辐射)是电子释放能量的重要形式之一。
(2)电子的跃迁是物理变化(未发生电子转移),而原子得失电子时发生的是化学变化。
第一章 原子结构与性质课件 高中化学人教版(2019)选择性必修二

向后
首页
尾页
结束
向前
第一章 原子结构与性质 第一节 原子结构
构造原理
原子核外电子排列
能级
能层
一
二
三
四
五
六
七
符号
K
L
M
N
O
P
Q
最多电子数
2
8
18
32
50
72
98
能层
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
6
2
6
10
2
6
10
14
…
2n2
能量增加
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
6
2
6
10
2
6
10
14
…
第一章 原子结构与性质 第一节 原子结构
Fe(26):
向后
首页
尾页
结束
向前
三 构造原理与电子排布
构造原理
能层
K
L
M
N
…
能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
…
最多电子数
2
2
高中化学选择性必修二 第1章第1节原子结构

新课讲解
2.电子排布式 (1)含义:电子排布式是用核外电子分布的能级及各能级上的电子数来表示电子排布 的式子。 (2)表示方法:
新课讲解
(3)书写方法: 第一步:按照构造原理写出电子填入能级的顺序, 1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s 第二步:根据各能级容纳的电子数填充电子。 第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
元素周期律
提出构造原理
“能层、能级”
完整的构造原理
1936年马德隆
发表了以原子光 谱事实为依据的 完整的构造原理
1869年俄国化学家门捷
列夫发现了元素周期律
1920年丹麦科学家波尔提出了构造原理,即从氢开始,随 核电荷数递增,新增电子填入原子核外“壳层”的顺序, 1925年,波尔 的“壳层”落实为“能层”与“能级”,厘 清了核外电子的可能状态,复杂的原子光谱得以诠释。
新课讲解 复习回顾:1.原子的结构
质子 Z个
原子
A Z
X
原子核
中子(A—Z)个
(几乎集中原子的全部质量)
核外电子 Z个
(其运动空间几乎占据了原子的整个体积)
质量数:对质子和中子的相 对质量取整数相加的数值, 即近似原子量。
①数量关系:
②质量关系:
核电荷数(Z) = 核内质子数 = 核外电子数 质量数(A)= 质子数(Z)+ 中子数(N)
吸收光谱 明亮背景的暗色谱线
基态原子
吸收 能量
释放 能量
激发态原子
发射光谱 暗色背景的明亮谱线
新课讲解
(3)光谱分析: 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素, 称为光谱分析 。
例如:铯(1860年)和铷(1861年),其光谱图中有特征的蓝光和红光,它们的 拉丁文名称由此得名。又如,稀有气体氦的原意是“太阳元素”,是1868年 分析太阳光谱发现的,最初人们以为它只存在于太阳,后来才在地球上发现。
2022-2023学年鲁科版新教材选择性必修二 第1章第1节原子结构模型 课件(52张)

(3)习惯上人们用“原子轨道”来描述原子中单个电子的空间运动状态。
电子层为 n 的状态,有 n2 个原子轨道。
n 值所对应的能级和原子轨道的情况
电子层或 符号
量子数 n
能级
原子轨道
n=1
K
n=2
L
1s 12 _2_s_、__2_p_
1s 2s、 13 __2_p_x、___2_p_y、__2_p_z__
答案
解析 电子云图就是用小黑点疏密程度来表示电子在原子核外某处单 位体积内出现概率大小的一种图形,每个小黑点并不代表一个电子,故 A 错误;由上述分析可知,每个小黑点代表电子出现的概率,不是电子在核 外所处的位置,故 B 错误;对比图 1、图 2 可知,在球体内出现该电子的几 率大,界面外出现该电子的几率小,故 C 错误;1s 轨道呈球形,沿剖面直 径连线,有无数对称轴,故 D 正确。
3.玻尔原子结构模型的基本观点 (1)原子中的电子在 06 ___具__有__确__定__半__径_____的圆周轨道上绕原子核运 动,并且不辐射 07 __能__量__。 (2)在不同轨道上运动的电子具有 08 ___不__同__的__能__量____,而且能量值是 09 __不__连__续___的,这称为能量“ 10 __量__子__化___”。轨道能量依 n 值(1、2、3、…) 的增大而 11 __升__高__,n 称为 12 __量__子__数___。对氢原子而言,电子处于 n=1 的轨道时,能量最低,这种状态称为 13 __基__态__,能量高于基态能量的状态 称为 14 __激__发__态___。 (3)只有当电子 15 _从__一__个__轨__道__跃__迁__到__另__一__个__轨__道__时,才会辐射或吸收 能量,当辐射或吸收的能量以 16 __光__的__形__式____表现出来并被记录时,就形 成了光谱。
必修2第一章第1节__原子结构第一课时

区别与联系: 1、联系:同位素属于同一元素的原子; 同素异形体由同一元素的原子构成的单质。 2、区别:同位素有1800余种,元素只有100多种。
试一试
1. 下列各组物质中,互为同位素的是(D )
(A)O2、、O3 、O4 (B)H2、D2、T2
40
20Ca
2.下列说法正确的是( A )
(C)H2O、D2O、 T2O (D)
原子核 核外电子
质子 中子 个 个
A Z
个
2、核素
【回顾】 元素: 具有相同质子数(核电荷数)的同一类原子的 总称。 元素的种类:由原子核内的质子数决定的。 【质疑】 同种元素原子的质子数相同,那么,中子 数是否也相同呢?
“观察思考” 三种不同的氢原子
【比较】三种氢原子结构的异同。 【质疑】它们是不是同一种元素?
和20 Ca
42
(A)同种元素的质子数必定相同
(B)不同元素原子的质量数必定不同
(C)原子核都是由质子和中子构成的 (D)凡是核外电子数相同的微粒必定属于同一 元素
在 ① 36Li ② 714N ③ 1123Na ④ 24Mg 12 ⑤ 37Li ⑥ 614C,几种核素中 1)( )和( )互为同位素 2) ( )和( )质量数相等,但不能 互称同位素 3) ( )和( )中子数相等,但质子 数不等,所以非同一种元素
鲁科版化学必修2
第一章 原子结构和元素周期律
第一节 原子结构
第一课时:原子核 核素
授课人 黄平
引言:
通过初中学习同学们已经知道原子是 由原子核和核外电子构成的。但 原子核是由什么构成的呢? 电子在原子核外怎样运动的? 元素的性质与原子结构有什么关系? 这是本节教学要解决的问题。
鲁科版必修二第一章第一节原子结构

[难解的谜]
当卢瑟福建立了原子结构的模型之后,遇到了 一个难解的谜──当电子围绕原子核旋转时,它在 辐射电磁波的同时会因失去能量而坠落到原子核 上,原子的结构应该崩溃。
Байду номын сангаас
[大胆质疑] 1913 年,卢瑟福的学生、丹麦物
理学家玻尔将诞生不久的量子理论运 用到原子结构模型之中,他提出:不 同的电子运转轨道是具有一定能级差 的稳定轨道;正常的电子在稳定的轨 道上运转时既不辐射也不吸收能量; 当电子从较高轨道落到较低轨道时才 产生辐射。玻尔因此项成果荣获了 1922年诺贝尔物理学奖。
[实验事实] 英国物理学家汤姆森于 1897年开始研究
阴极射线,发现金属中都存在带负电荷的粒 子,即“电子”。 [科学想象]
当汤姆森发现“电子”后就提出了原子结 构模型,你能否依据原子中有带负电荷的电 子这一事实,来想象一个原子结构的理想模 型呢? [看一看]
你是否具有与“汤姆森”一样的想象力?
汤姆森的原子结构模型
依据:电子能量的高低(离核的远近)
12 3 4 5 6 7 KL MN O P Q
由内到外,能量逐渐升高
排布规律
KLMNOPQ 分
层1234567 n
2 8 18 32 50 最多
容纳 2 2 2 2
的电 × × × ×
2n2
子数 12 22 32 42
排 布 规 律:
� 电子总是尽先排布在能
量最低的电子层里 1→ 2 → 3→ 4→ 5 → 6
微粒数计算 ①
电子总数 质子总数
中子总数
D216O 1×2+8 10 (2-1)×2 +(16-8)
23Na35Cl 11+17
28 (23-11)+(35—17)
第一章第一节原子结构第一课时-2024-2025学年高中化学选择性必修二课件

2.能级
(1)概念:
在多电子原子中,同一能层的电子,能量也可能不同,还可以把它们
分成不同的能级。
(2)表示方法
分别用相应能层的序数和字母 s、p、d、f 等表示,如n能层的
能级按能量由低到高的顺序为E(ns)<E(np)<E(nd)<E(nf)……
(3)能层、能级与容纳的最多电子数
能层
K
能级
1s
核电荷数递增,新增电子填入
原子核外“壳层”的顺序,电
子只能在原子核外具有特定能
量的“壳层”中运动。由此开
启了用原子结构解释元素周期
律的篇章。
➢5年后,玻尔的“壳层”落实
为“能层”与“能级”,厘清
了核外电子的可能状态,复杂
的原子光谱得以诠释。
1936年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造
禾费线实质上是原子的吸收光谱,并一一找到对应的元素。例如,
被夫琅禾费标记为 D 的双线源自钠(如图),后人称为钠双线
科学史话
离散的谱线
项目一
科学
史话
原子光谱为什么是离散的谱线而不是连续的呢?
1913年,玻尔创造性地假设,被束缚在原子核外的电子的能量是
量子化的,只能取一定数值,称为定态,而原子光谱的谱线是不
同定态的电子发生跃迁产生的,因而是离散的而不是连续的谱线。
1925年,德国科学家洪特解释了复杂光谱,得出了过渡元素
(包括铬和铜等)的光谱学基态原子的电子排布,为构造原理
的确立奠定了基础
课堂练习4、下列说法<
不正确<
>
zd
的是( A
>
/zd
8 )。
2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
54
86
氙
氡
Xe
Rn
2
2 2
8
8 8
18
18 18
18
32 32
8
18 ? 8 ?
8
8
各层最多电子数
原子结构示意图
课堂练习
1.下列原子结构示意图中,正确的是 A. B. C. D.
2.某元素原子的原子核外有三个电子 层,最外层有4个电子,该原子核内的质 子数为 A.14 B.15 C.16 D.17
A
B、该原子的质量数为202
C、铂元素的核电荷数为78
D、该原子核内有124个中子
5、填表:
微粒符号 质子数 (Z) N 7
Al Ar Cl H 13 18 17 1
中子数( 质量数 N) (A) 14 7
14 22 18 2 27 40 35 3
用 AX Z 表示
14 7 27 13 40 18 35 17 3 1
A、77 C、120
B、114 D、268
99年上海高考题
1.据报道,上海某医院正在研究用放射性的一
125 种碘 53 I 治疗肿瘤。该碘原子的核内的中子
数与核外电子数之差是(B )
A、72 B、19 C、53 D、125
A n+ 2.某粒子用 Z R 表示,下列关于该粒子的叙述
正确的是(
B )
再
见
6
1H 1
种原子, 、D、T
6 种分子, 2 16O、 17O、 18O 8 8 ; 8
种元素,
属同位素。
3、1735Cl和1737Cl组成Cl,为什么Cl的原子量 ≠(35+37)/ 2 ? 因为Cl原子的丰度不等
【交流与研讨】 生物体在生命存续期间保留的一种碳原子---碳-14 会在其死亡后衰变,测量考古遗址中发现的 遗物里碳-14的数量,可以推断出它的存在年代。 根据课本内容与网上资料:阐述 C-14在考古 上的应用; 【简介】 1.放射性同位素用于疾病的诊断 2.放射性同位素用于疾病的治疗 3.未来的能源一一一核聚变能
核外电子Biblioteka Z个表示原子组成的一种方法
质量数 —— A
核电荷数 —— Z (核内质子数) 请看下列表示
a
b
X
——元素符号
决定元素种类
X
+d
c+ --
a——代表质量数; b——代表核电荷数; a b c d各 代表什么 c——代表离子所带电荷数; d——代表化合价
[练习1]
1、据报道,某些建筑材料会产生放射性 222 核素氡 86 Rn ,从而对人体产生伤害。该 核素的中子数是: A
(1)元素的化学性质: 主要由原子的最外层电子数决定
金属元素的最外层电子数一般<4,较易 失电子,表现出(金属性)还原性 非金属元素的最外层电子数一般>4,较 易得电子,表现出(非金属性)氧化性
(2)化合价
元素的最高正价=最外层电子数 元素的最低负价=最外层电子数-8
【例题】:氯元素的最高正价为+7;
波尔原子模型 电子在原子核外空间的一定轨 道上绕核做高速的圆周运动。
小结:(2)电子的运动特点: ①质量小,速度大(接近光速)。 ②运动空间小,无固定的轨道
核外电子的运动状态:
+
电子云
电子云:是用统计的方法对核外 电子运动规律所作的一种描述。
描述方法:用点的密度大小表示 电子在某处出现机会的多少。 过程:给原子拍照。 结果:很像在原子核外有一层疏 密不等的“云”。
1H
1H
3
氢的三种原子
氕(H)
氘(D)
氚(T)
质子 中子 电子
思考:1、氕、氘、氚的原子结构有什么异同? 2、它们是同一种元素吗?
2、核素
(1)元素: 具有相同质子数(核电荷数)的同一类原子的总称。
(2)核素:
具有一定数目质子和一定数目中子的一种原子。 如:氕 氘 氚
(3)同位素: 质子数相同而中子数不同的同一元素的不同核素 互为同位素。 如:碳的同位素 氯的同位素 铀的同位素
微粒数计算 ①
电子总数 质子总数 D216O
23Na35Cl
中子总数 (2-1)×2 +(16-8) (23-11)+(35—17)
1×2+8 11+17
10 28
高考题回顾
99年全国高考题
1、原计划实现全球卫星通讯需发射77颗卫星, 这与铱(Ir)元素的原子核外电子数恰好相等, 因此称为“铱星计划”。已知铱的一种原子 197 Ir 是 77 ,则其核内的中子数是( C )
2 → 3→ 4→ 5 → 6 L → M→N →O → P
K层为最外层时,最多只 能容纳2个电子 2→
其它各层为最外层时,最 多只能容纳8个电子 次外层最多不超过18个电
8 →18→32→50→ 2n2
子
稀有气体元素原子电子层排布
核电 元素 元素 荷数 名称 符号 2 10 18 36 氦 氖 氩 氪 He Ne Ar Kr 各电子层的电子数 K 2 2 2 2 8 8 8 8 18 8 L M N O P 最外层电 子数 2 8 8 8
[预测]
[卢瑟福实验结果]
矛
盾
第1章
原子结构与元素周期律
第1节
一、原子核 核素
原子结构
1、原子核的构成 质子 原子核 中子 原子 核外电子
原子核半径小于原子半径的万分之一,体 积占原子体积的几千万亿分之一(如同大 型体育场与蚂蚊),但却集中了原子绝大 部分质量。
关系式1:
原子中:
核电荷数=核内质子数=核外电子数
A、136 B、50 C、86 D、222
AD
2、由元素的核电荷数可以推测出原子的: A、质子数 C、原子数 B、中子数 D、核外电子数
3、1994年12月科学家发现了一种元素,它的原子 核内有161个中子,质量数为272,该元素的原子 序数为: A
A、111
B、161 C、272
D、433
4、中国科学家在世界上首次发现铂的一种新的核 202 素 78 Pt ,下列有关铂元素的说法不正确的是: A、铂元素的相对原子质量为202
B、所含中子数=A-Z
A、所含质子数=A-n
C、所含电子数=Z+n
D、质量数=Z+A
试一试
1. 下列各组物质中,互为同位素的是(
40
D
)
(A)O2、、O3 、O4 2.下列说法正确的是(
(B)H2、D2、T2
42 Ca 和20 Ca 20
(C)H2O、D2O、 T2O (D)
A
)
(A)同种元素的质子数必定相同
想一想
化学变化中的最小微粒是什么?
原子
你知道原子内部的结构是怎样的吗?
原子的发现史
公元前5世纪,希腊哲学家德谟克利特等人认 为 :万物是由大量的不可分割的微粒构成的, 即原子。
1.道尔顿原子模型(1803年) 2.汤姆生原子模型(1904年) 3.卢瑟福原子模型(1911年)
[卢瑟福实验示意图]
N Al Ar Cl H
【思考】
1、到目前为止,人类已经发现的元素若有112种,也 就是发现了112种原子(或一种元素对应只有一种原 子),对吗?为什么? 2、什么叫元素、核素和同位素?
填表
微粒
1 1H
2
(科学家发现有三种氢原子)
质量数 质子数 中子数 电子数
1 2 3
1 1 1
0 1 2
1 1 1
(B)不同元素原子的质量数必定不同 (C)原子核都是由质子和中子构成的
(D)凡是核外电子数相同的微粒必定属于同一
元素
第一节 原子结构 第2课时
原子核外电子排布
(2)电子的运动又有何特征?
卢瑟福原子模型
原子中心有 一个带正电荷的 核,它的质量几 乎等于原子的全 部质量,电子在 它的周围沿着不 同的轨道运转, 就象行星环绕太 阳运转一样。
核外电子分层排布
依据:电子能量的高低(离核的远近)
1
K
2
L
3
M
4
N
5
O
6
P
7
Q
由内到外,能量逐渐升高
排 布 规 律
K 分 层 1 L 2 M 3 N 4 O 5 P 6 Q 7
n
最多 容纳 的电 子数
2
2 × 12
8
2 × 22
18
2 × 32
32
2 × 42
50
2n2
排 布 规 律:
电子总是尽先排布在能量 最低的电子层里 1→ 每个电子层最多只能排布 2n2个电子。 K→
3、根据下列叙述,写出元素名称并画出 原子结构示意图。 (1)A元素原子核外M层电子数是L层 硫 电子数的3/4;___________ (2)B元素原子的最外层电子数是次外 硼 层电子数的1.5倍;______ (3)C元素的次外层电子数是最外层电 氖 子数的1/4;________
5、原子核外电子排布与元素的化学性质 及化合价的关系:
12C 35Cl 234U 13C 37Cl 235U 238U 14C
同位素、元素、同素异形体的比较
元素
定义对 广义的原子 象 定义 具有相同核电 荷数的同一类 原子 的总称 实例 H C
同位素
原子 质子数相同,中 子数不同的同一 元素的不同原子
1 2 3 1H、 1H 、 1H
同素异形体
单质 由同种元素组 成的结构和性 质不同的单质 金刚石与石墨 氧气与臭氧
区别与联系: 1、联系:同位素属于同一元素的原子; 同素异形体由同一元素的原子构成。 2、区别:同位素有1800余种,元素只有100多种。
