偶联反应总结
金属催化偶联反应小结

金属催化偶联反应小结一、Buchwald_Hartwig反应,布赫瓦尔德-哈特维希偶联反应(Buchwald-Hartwig cross coupling)Buchwald–Hartwig芳胺化反应是非常常用的由芳基卤代物或芳基磺酸酯制备芳胺的反应。
此反应的主要特点是利用催化量的钯和富电子配体进行催化反应。
另外强碱(如叔丁醇钠)对于催化循环是至关重要的。
二、Cadiot-Chodkiewicz偶联反应一价铜作为催化剂,端基炔和炔基卤化物反应生成非对称性二炔的反应三、羰基化偶联反应 Carbonylative Cross Coupling利用一氧化碳能插入碳-金属键这一特性,在偶联反应中同时引入羰基,生成酯,酰胺,酮,醇等产物。
在有机合成中是一个非常有效率的反应。
常用于钯催化偶联反应。
我们知道一氧化碳很容易插入碳-金属键之间。
用钯催化剂,有基卤化物,一氧化碳,醇一起反应会生成酯。
用胺代替其中的醇会得到酰胺,用氢源替代醇会得到醛,换成有机金属试剂就会得到酮。
四、Castro–Stephens偶联反应(Castro-Stephens Coupling)炔化亚铜与芳卤发生交叉偶联,生成二取代炔及卤化亚铜。
这个反应由 C. E. Castro 和 R. D. Stephens 在 1963 年发现。
现在被大家所熟知的是其改良法Sonogashira偶联.五、Chan–Lam C–X偶联反应,Chan-Lam-Evans偶联反应(Chan-Lam-Evans Coupling)含有NH/OH/SH基团的底物在弱碱条件下,在空气中通过醋酸铜催化,与有机硼酸化合物氧化交叉偶联进行芳基,烯基和烷基化的反应。
六、交叉脱氢偶联反应(Cross Dehydrogenative Coupling (CDC))在两个底物的C-H被活化的情况下,利用氢acceptor(氧化剂)的作用,进行的交叉型C-C偶联反应。
如果氧化剂是分子状的氧气的话,理论上生成的副产物就是水而已,这样这样的反应就是非常优秀的绿色化学。
偶联反应名词解释

偶联反应名词解释偶联反应是有机化学中用于将两种有机化合物联合制备新物质的重要方法,是近代化学研究中常见的一种反应。
偶联反应是经典的有机反应,以其特有的反应机理和广泛的应用范围而闻名。
一般来说,偶联反应涉及将两种不同的有机物,通过一种中间过渡物质形成新的产物物质。
例如,部分偶联反应使用光催化剂当做一种特殊的中间过渡物质来联结反应物,从而产生新的物质。
一般来说,偶联反应使两种不同的有机分子在活性位点发生反应,经过一系列反应步骤后,新的物质产生。
例如,偶联反应可用于合成芳香族烃、含硫化合物和脂肪酸类有机物等。
偶联反应的机理可以分为可分子机理和不可分子机理两大类。
可分子机理也称为海森堡机理,是一种经典机理,通常将偶联反应作为一种可分子机理进行研究。
可分子机理的基本步骤是,反应物分子在相互作用过程中,共价键被强化,由此产生的激发态分子重组,两个原子被从共价键中分离,并产生新的共价键,最后形成反应产物,而反应速率取决于原子间的距离与激发态的能量。
不可分子机理也称为上下机理,是一种以分子像的方式进行研究的机理。
不可分子机理的基本原理是,反应物分子两个活性位点间的距离很近,分子形状接近,可以形成共价键。
中间位置处有一个活性中间物质,可以催化反应物形成活性位点,从而形成新的产物。
在有机合成和自然产物的生物合成中,偶联反应扮演着重要的角色。
偶联反应的发展为有机化学的发展和发现一些新的有机化合物奠定了基础,也加深了人们对有机物分子结构和反应机理的理解。
另外,偶联反应还可以应用于生物反应中,例如抗癌药物的合成、酶催化反应和活性生物分子的合成等。
此外,还可以应用于材料科学中,用于合成一些导电性良好的新型材料,以及其他各种用途。
综上所述,偶联反应是有机化学中的一种重要的反应形式,以其特有的反应机理和广泛的应用范围而闻名。
偶联反应可以用于有机合成,也可用于生物反应,还可以应用于材料科学中,具有广泛的应用前景。
一文汇总常见的芳基—(杂)芳基偶联反应
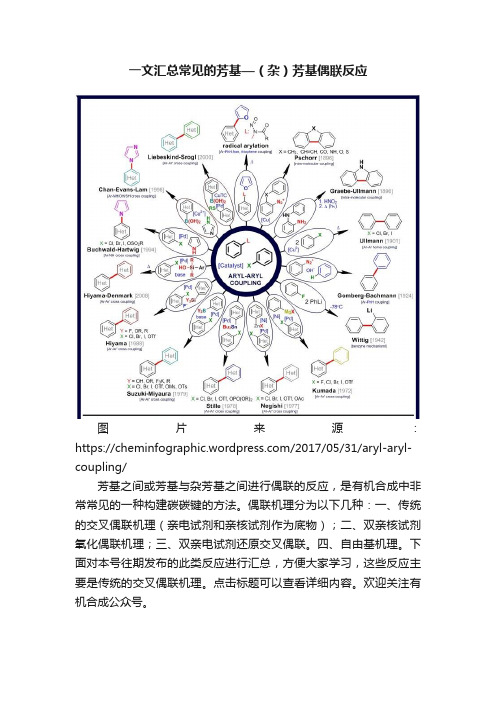
一文汇总常见的芳基—(杂)芳基偶联反应图片来源:https:///2017/05/31/aryl-aryl-coupling/芳基之间或芳基与杂芳基之间进行偶联的反应,是有机合成中非常常见的一种构建碳碳键的方法。
偶联机理分为以下几种:一、传统的交叉偶联机理(亲电试剂和亲核试剂作为底物);二、双亲核试剂氧化偶联机理;三、双亲电试剂还原交叉偶联。
四、自由基机理。
下面对本号往期发布的此类反应进行汇总,方便大家学习,这些反应主要是传统的交叉偶联机理。
点击标题可以查看详细内容。
欢迎关注有机合成公众号。
一、Suzuki–Miyaura反应在碱存在下有机硼试剂和芳香或烯基卤代物(或芳香三氟甲磺酸酯)在零价钯催化下进行交叉偶联的反应。
反应中碱的作用主要是促进金属转移。
Suzuki反应(铃木反应),也称作Suzuki偶联反应、Suzuki-Miyaura反应(铃木-宫浦反应),是一个较新的有机偶联反应,该反应由铃木章在1979年首先报道,在有机合成中的用途很广,具强的底物适应性及官能团容忍性,常用于合成多烯烃、苯乙烯和联苯的衍生物,从而应用于众多天然产物、有机材料的合成中。
铃木章也凭借此贡献与理查德·赫克、根岸英一共同获得2010年诺贝尔化学奖。
二、Buchwald-Hartwig反应Buchwald–Hartwig芳胺化反应是非常常用的由芳基卤代物或芳基磺酸酯制备芳胺的反应。
此反应的主要特点是利用催化量的钯和富电子配体进行催化反应。
另外强碱(如叔丁醇钠)对于催化循环是至关重要的。
一般来说碘化物的活性高于溴化物,溴化物的活性高于氯化物。
氯化物相对于溴化物反应需要更高的温度。
后者有时在常温下即能反应,前者则需要高温。
与溴苯类似,苯基三氟甲磺酸酯和胺也可以反应生成苯胺。
采用和溴苯类似的反应条件,对于中性或富电子的三氟甲磺酸酯都有较好收率。
但对于缺电子的三氟甲磺酸酯收率却较低,原因是叔丁醇钠会水解掉部分三氟甲磺酸酯,用碳酸铯代替叔丁醇钠则可避免水解,也可得到高的收率。
偶联反应小结

+ PhMgX (1 equiv) + PhMgX (1 equiv)
THF, 25 oC
Ph
H
H Ph (32%) DME, -20 oC to rt Ph H H Ph
O O-
(1 equiv)
(90%)
Ph dbm Ph
Reaction condition: Fe(dbm)3 cat., 1-2 h
5 3 8 20 15
6 (1.2 equiv), TMEDA(1.2 equiv), 71 min. additive 30
19
3
Trace
10
Nakamura, E. et. al. J. Am. Chem. Soc. 2004, 126, 3686.
Synthesis of R-(+)-Muscopyridine and immuno suppressive agent FTY720
Catalyst Ni or Pd Pd/CuI
R Aryl, alkyl, vinyl Aryl, alkyl
Negishi (1977)
Ni or Pd
Zn
Aryl, allyl, benzyl, propargyl
Aryl, vinyl,benzyl, alkynyl Aryl, alkyl Aryl
dppp > dmpf > dppe > dmpe > dppc > cis - dpen Ph2P(CH2)nPPh2 Me2P(CH2)2PMe2 cis-Ph2PCH=CHPPh2 n = 2 dppe dmpe cis-dpen n = 3 dppp n = 4 dppb
Ph PR2 Fe PR2 R = Me dmpf R = Ph dppf H10B10 Ph Ph Ph dppc
偶联反应及举例

偶联反应[编辑]偶联反应,也写作偶合反应或耦联反应,是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
在偶联反应中有一类重要的反应,RM(R = 有机片段, M = 主基团中心)与R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'。
[1]由于在偶联反应的突出贡献,根岸英一、铃木章与理查德·赫克共同被授予了2010年度诺贝尔化学奖。
[2]偶联反应大体可分为两种类型:•交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯(PhBr)与氯乙烯形成苯乙烯(PhCH=CH2)。
•自身偶联反应:相同的两个片段形成一个分子,如:碘苯(PhI)自身形成联苯(Ph-Ph)。
反应机理[编辑]偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成。
第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上。
最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂。
不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快。
中间体通常不倾向发生β-氢消除反应。
[3]在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应。
[4]还原消除的速率高低如下:乙烯基-乙烯基> 苯基-苯基> 炔基-炔基> 烷基-烷基不对称的R-R′形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R′-R′的平均值相近,如:乙烯基-乙烯基> 乙烯基-烷基> 烷基-烷基。
另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理。
[5]§催化剂[编辑]偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂。
钯催化剂当中常用的如:四(三苯基膦)钯等。
钯催化的有机反应有许多优点,如:官能团的耐受性强,有机钯化合物对于水和空气的低敏感性。
偶联反应

分子间Heck反应
3.非常用离去基团的 Heck反应
3.2酰氯参与的Heck 反应一般在非极性溶剂中使用弱碱即可,
无需膦催化剂,而且所需钯催化剂用量极少(0.005 mol%)
分子间Heck反应
3.非常用离去基团的 Heck反应
3.3将酸酐应用于Heck 反应20世纪末才发现的,它的优点在
R'
0.1 eq. PPh3
0.1 eq. CuI
R
R' n
iPr2NH/DMF (3:2) r.t. or 60 oC, 4-24 h
Angew. Chem. Int. Ed., 2006, 45, 4019
Sonogashira反应研究进展
3.底物的种类增多
R
Cl
I + 3 eq.
CO2Et
0.1 eq. Pd(PPh3)2Cl2 0.15 eq. CuI
Suzuki偶联优缺点
优点 1.反应对水不敏感;
2.可允许多种活性官能团存在; 3.可以进行通常的区域和立体选择性的反应; 4.硼试剂易于合成,稳定性好; 5.这类反应的无机副产物是无毒的且易于除去,可以保证其适用于 实验室且可以用于工业化生产。
缺点
氯代物(特别是空间位阻大的氯代物)及一些杂环硼酸反应难以进行。
Workshop-偶联反应
报 告 人:xx 报告时间:2016-06-18
2010年诺贝尔化学奖
偶联反应的基本概念
广义的偶联反应:是由两个分子(molecules)进行某种化学反应而得到一个
分子的过程,包括自由基偶联反应、过渡金属催化偶联反应。
狭义的偶联反应:指涉及过度金属催化剂的碳-碳键形成反应。
铜催化C-N偶联反应总结

28
R1SO2NHR2
ArX
X=I,Br
N,N-二甲基甘氨酸
CuI
DMF
100/回流
24-48
K3PO4
50-99
29
PhX
X=I,Br
CuI
DMF
110
36
K2CO3
70-86
30
R1CONHR2
ArI
CuI
DMF/DMSO
110
24
K3PO4
65-98
31
R1CONHR2
R3B(OH)3
K3PO4
10-82
17
X=I,Br,Cl
DMEDA
CuI
二氧六环
THF
68,100
1-12
Cs2CO3
86-99
18
CF3CONH2
ArBr
DMEDA
CuI
二氧六环
45-75
24
K2CO3
6-99
19
BocNH2
DMEDA
CuI
THF
80
16
Cs2CO3
57-96
20
R1CONHR2
R3Cl
[Cu(OH)TMEDA]2Cl2
23-93
5
R1R2NH
ArX
X=Br,I
HOCH2CH2NMe2
CuI
Rt-90
11-48
K3PO4
2-90
6
R1R2NH
ArI
Cu(PPh3)3Br
甲苯
110-175
24
Cs2CO3
10-88
7
RNH2
R=杂环
Chan-Lam偶联反应最全总结

Chan-Lam偶联反应最全总结近年来, 过渡金属催化的氧化交叉偶联反应已经被证明是构建碳-碳键、碳-杂键最有效和最直接的策略之一, 在医药、农药、染料及日用化工品等领域中都起到了非常重要的作用[1,2]. 1998年, Chan、Evans和Lam三个课题组[3]分别独立地报道了铜盐促进下不同杂原子作为亲核试剂与芳基硼酸进行偶联反应构建碳-杂键的方法. 与其它过渡金属(如钯、镍等)参与的偶联反应相比, 此类反应具有铜盐价格便宜(铜金属约0.01美元/克, 而钯金属约350美元/克)、反应条件温和、不需要复杂配体、操作简便、在空气氛围中搅拌就能顺利进行等特点[4]. 因此, 铜盐促进不同原子类型的亲核试剂与有机硼试剂进行的偶联反应被称之为Chan-Evans-Lam偶联反应[5], 此反应由于在空气中就能进行, 又被称为open- flask Chemistry (Eq. 1).普遍认为Chan-Evans-Lam反应的机理是(Scheme1): 芳基硼酸首先与二价铜络合物E发生转金属形成中间体A和硼酸. 中间体A与亲核试剂(RXH)配位得到络合物B. 在氧气存在下, 络合物B被氧化形成三价铜中间体C. 中间体C发生还原消除生成偶联产物(Ar—X—R)和一价铜络合物D. 络合物D在氧气和水的作用下转化成二价铜络合物E, 从而完成催化循环. 另外一种可能的反应机理则认为: 亲核试剂(RXH)进攻有可能发生在二价铜与芳基硼酸转金属之前. 尽管很多有机化学家如Stahl[6], Norrby[7], Das[8]等通过密度泛函理论(DFT)对反应机理做了深入的化学计算研究, 但目前Chan- Evans-Lam反应的机理仍无明确定论.自从反应被发现以来, 引起了很多有机化学家及生物化学家的广泛关注, 在有机合成中不仅被广泛地应用于构建C—N, C—O, C—S, C—C键, 也成功地应用于复杂天然产物的全合成中, 特别是在药物分子的结构修饰中占有重要的地位. Lam 小组[9]在2011年和Wu小组[10]在2012年分别对Chan-Evans-Lam 偶联反应的最新研究进展进行了综述, 而之后这类偶联反应的研究并无相关综述的报道. 但近些年铜参与的Chan-Evans- Lam偶联反应在碳-杂键交叉偶联化学的应用中又取得了很多新的进展. 因此, 本文针对2012 年之后通过Chan-Evans-Lam反应构建C—N, C—O, C—S, C—C键的最新进展进行了综述, 主要涉及不同原子(氮、氧、硫和碳原子)的亲核试剂与有机硼试剂进行偶联反应构建C—N, C—O, C—S和C—C键的新策略, 以及Chan- Evans-Lam反应在复杂天然产物和生物碱全合成中的一些应用.1.1 芳基硼试剂参与的C—N键偶联反应1.2 烯基硼酸参与的C—N键偶联反应1.3 烷基硼试剂参与的C—N键偶联反应2.1 芳基硼试剂参与C—O键偶联反应2.2 烯基硼试剂参与的C—O键偶联反应3.1 硫酚参与的C—S键偶联反应4.1 TMSCF3参与的C—C键偶联反应4.2 丙二酸酯衍生物参与的C—C键偶联反应恶性疟原虫是发展中国家非常普遍引起疟疾的一种致病性寄生物. 2014 年, Bogyo 小组[63]鉴定了一类可以选择性抑制这类疾病的帽型多肽123. 这类帽型多肽具有很好的生物活性(IC50=35 nmol/L). 为了进一步研究这类多肽的生物活性, Bogyo小组以Boc保护的3-溴苯丙氨酸120为起始原料通过9步合成了该多肽. 其中在关键成环步骤化合物121到化合物122合成中, 就使用Chan-Evans-Lam反应进行关环生成二苯醚骨架, 脱除Boc保护基得到目标多肽123。
有机化学基础知识点整理偶联反应与交叉偶联反应

有机化学基础知识点整理偶联反应与交叉偶联反应有机化学基础知识点整理:偶联反应与交叉偶联反应有机化学是研究有机物结构与特性的科学,其中偶联反应和交叉偶联反应是有机合成中常用的重要手段,本文将对这两种反应进行基础知识点整理。
一、偶联反应偶联反应是指两个有机分子中的两个不同官能团在反应条件下发生连接形成新的键,从而生成一个新的有机分子。
常见的偶联反应有Heck反应、Suzuki反应、Stille反应等。
1. Heck反应Heck反应是通过钯催化下的芳香化合物与烯烃发生的偶联反应,生成具有烯烃结构的芳香化合物。
该反应需要碱性条件和适量的氧气存在。
反应机理包括反应前的氧化加成、钯催化下的反应、脱氧等步骤。
2. Suzuki反应Suzuki反应是通过钯催化下的芳香化合物与硼酸酯发生的偶联反应,生成具有芳香环和烷基或芳基基团的化合物。
该反应需有碱性条件和无氧环境。
反应机理包括反应前的亲核加成、钯催化下的反应、脱氧等步骤。
3. Stille反应Stille反应是通过钯催化下的芳香化合物与有机锡化合物发生的偶联反应,生成具有烷基或芳基基团的化合物。
该反应需有碱性条件、无氧环境和适量的溴化物存在。
反应机理包括反应前的亲核加成、钯催化下的反应、脱溴等步骤。
二、交叉偶联反应交叉偶联反应是指两个不同有机物之间的偶联反应,生成具有两个不同基团的化合物。
常见的交叉偶联反应有Negishi反应、Kumada反应、Suzuki-Miyaura反应等。
1. Negishi反应Negishi反应是通过钯催化下的有机锌化合物和卤代化物发生的交叉偶联反应,生成具有不同基团的化合物。
该反应需有碱性条件和适量的酸存在。
反应机理包括反应前的亲核加成、钯催化下的反应、脱卤等步骤。
2. Kumada反应Kumada反应是通过钯催化下的有机镁卤化物和卤代化物发生的交叉偶联反应,生成具有不同基团的化合物。
该反应需有碱性条件和无氧环境。
反应机理与Negishi反应类似。
偶联反应

分子间Heck反应
端基烯烃与卤代芳香烃发生分子间Heck 反应,是研究最早 的一类反应。这类反应已经成为芳烃烷基化重要反应。
1.常规分子间 Heck反应
分子间Heck反应
2.不对称分子间 Heck反应
分子间Heck反应
3.非常用离去基团的 Heck反应
3.1重氮盐参与的Heck反应不需要膦催化剂和胺,条件温和,
于不需要任何碱的存在。
分子间Heck反应
Tips:
1、该类反应在卤代物中,卤素的β位的碳原子上不能有 SP3 杂化的氢原子。主要是因为这类卤代物形成烷基钯络合物时,
氢化钯的消除反应速度大于烯烃的加成反应,因此仅有消除产物。
2、当有强烈供电子基团时,芳基溴参与的反应收率也很 低。其主要原因是在反应中膦配体被季化与卤代物被还原。当使用
有机硼试剂的合成 1.通过金属有机试剂制备单取代芳基硼酸
1.1.通过Grinard试剂制备单取代芳基硼酸
1.2.通过有机锂试剂制备单取代芳基硼酸
有机硼试剂的合成
2.通过二硼烷频哪酯制备芳基硼酸酯
对于分子中带有酯基、氰基、硝基、羰基等官能团的芳香卤代物来说, 无法通过有机金属试剂来制备相应的芳基硼酸。
Suzuki偶联反应的应用
普通操作 在水的存在下,加入催化剂、碱和有机溶剂,加热回流一段合理
的时间完成反应,但反应体系必须全程严格控制在无氧的环境下。
1.普通体系Suzuki偶联反应
Suzuki偶联反应的应用
2.大位阻芳基硼酸参与Suzuki偶联反应
收率低
解决措施:
强碱水溶液如NaOH或Ba(OH)2 苯和DME为溶剂 将大位阻芳基硼酸转化为硼酸酯
间的交叉偶联反应通常被称之为Sonogashira 反应
偶联反应名词解释

偶联反应名词解释
偶联反应是一种常见的化学反应,它是一种由重氮芳香烃和重碳桥联结的有机反应。
联合反应以空气中溶气体二氧化碳为催化剂,使碳氢化合物通过叠合成两个芳香环,形成芳香桥联分子。
事实上,偶联反应是由一个反应和两个活性中间体直接参与的有机反应,反应物在二氧化碳催化剂的作用下,由一个反应同时进行两次反应,在少量能量的作用下获得反应产物,因此又被称为“混合反应”、“复合反应”。
在偶联反应的机理中,反应物的活性中间体是重氮芳香烃和重碳桥联结的碳氢化合物,这些碳氢化合物在二氧化碳催化剂的作用下,先进行活性中间体水解反应,然后进行叠合反应,在叠合反应过程中,二氧化碳被消耗掉,反应物和活性中间体碳氢化合物发生物理聚合,使得原来的活性中间体被消耗掉,最后形成芳香桥联的碳氢化合物。
偶联反应在化学工业中发挥着重要的作用,诸如精制原料,制备颜料,制备香料,生产医药,制备催化剂等应用都是广泛的。
特别是在精细化工中,偶联反应被广泛用于各种重要产品的生产,如粘合剂,涂料,塑料等。
由于偶联反应有着良好的节能性,无毒环保,催化效率高,工艺条件宽松,质量可控等优点,因而得到了化学行业的广泛应用。
在现代工业生产中,偶联反应已经在各个领域中得到了广泛的应用,特别是在精细化工领域,偶联反应的使用更是影响着质量、性能和效率的提高。
因此,偶联反应在现代工业生产中发挥着重要的作用。
总之,偶联反应是一种重要的化学反应,是由重氮芳香烃和重碳桥联结的碳氢化合物参与的芳香桥联分子的形成,它具有节约能源、无毒环保、催化效率高、工艺条件宽松、质量可控等优点,为化学工业和精细化工提供了重要的应用价值。
未来,偶联反应将继续发挥重要作用,为工业生产做出重要的贡献。
碳碳偶联反应总结

碳碳偶联反应总结简介碳碳偶联反应是有机合成中一种重要的反应,通过将两个碳原子连接起来形成碳-碳键。
这种反应具有高效、可重复等特点,被广泛应用于药物合成、材料科学等领域。
本文将对碳碳偶联反应的一些常见机制和应用进行总结。
常见的碳碳偶联反应Suzuki 偶联Suzuki 偶联反应是最为常见的碳碳偶联反应之一。
该反应是通过钯催化剂催化下的芳基硼酸和芳基卤化物之间的偶联反应。
Suzuki 偶联反应具有反应条件温和、底物选择广泛等优点,在制药领域得到广泛应用。
反应机制如下:芳基卤化物 + 芳基硼酸→ 偶联产物 + 钯催化剂 + 鹰嘴酸Heck 偶联Heck 偶联是一种通过钯催化剂催化下烯烃与芳基卤化物之间的偶联反应。
该反应具有高效、选择性高等优点,在有机合成中广泛应用。
Heck 偶联反应可以合成复杂的碳骨架,并且由于其底物选择性广泛,可以适用于不同类型的有机分子。
反应机制如下:烯烃 + 芳基卤化物→ 偶联产物 + 钯催化剂 + 鹰嘴酸Negishi 偶联Negishi 偶联反应是通过钯催化剂催化下的有机锌试剂和有机卤化物之间的偶联反应。
Negishi 偶联反应具有底物适用范围广、官能团兼容性好等特点,被广泛应用于有机合成中。
反应机制如下:有机锌试剂 + 有机卤化物→ 偶联产物 + 钯催化剂 + 锌盐碳碳偶联反应在药物合成中的应用碳碳偶联反应在药物合成中具有重要的应用价值。
通过合理的反应设计和催化体系选择,可以高效地合成药物分子的碳骨架。
以下是一些具体案例:1.使用 Suzuki 偶联反应合成药物 Artesunate 的碳骨架。
该反应在碳-碳偶联的过程中使用了催化的芳基硼酸和卤代芳烃。
2.使用 Heck 偶联反应合成抗癌药物 Erlotinib 的碳骨架。
该反应通过钯催化剂催化下的烯烃与芳基卤化物之间的偶联反应进行。
3.使用 Negishi 偶联反应合成药物 Palbociclib 的碳骨架。
该反应通过钯催化剂催化下的有机锌试剂和有机卤化物之间的偶联反应进行。
suzuki偶联反应总结报告模板

suzuki偶联反应总结报告模板suzuki偶联反应总结报告模板一、引言suzuki偶联反应是有机合成领域中一种重要的金属催化偶联反应。
在过去的几十年里,该反应已成为人们合成有机化合物中不可或缺的工具。
本文将从深度和广度两个层面对suzuki偶联反应进行全面评估,并据此撰写一篇有价值的文章。
二、基础知识概述1. suzuki偶联反应的原理:suzuki偶联反应是通过钯催化下,将含有芳基硼酸酯和卤代芳烃两种物质进行偶联,生成芳香烃的合成方法。
2. suzuki偶联反应的重要性:该反应能够高效实现碳-碳键的构建,为合成复杂有机分子提供了一种可行的途径。
三、反应条件探讨1. 底物选择:首先需要根据目标化合物的结构特点选择合适的底物,包括芳基硼酸酯和卤代芳烃的类型和取代基的位置。
2. 钯配体选择:不同的钯配体对反应的速率和产率有很大影响,需要根据具体需求进行选择。
3. 溶剂选择:溶剂的选择对反应速率和产率也具有重要作用,需要根据反应体系的特点进行选择。
四、反应机理分析1. cis-作用:suzuki偶联反应的反应机理中,cis-作用是合成芳烃的关键步骤之一。
通过分析该步骤的反应路径,可以更好地理解反应的原理。
2. 过渡态的形成:过渡态的形成对于反应速率和产率同样至关重要,本节将详细描述过渡态的生成机制和影响因素。
五、反应优化与改进1. 温度和压力的调节:温度和压力是影响反应速率和产率的重要因素,通过调节反应条件可以得到更好的结果。
2. 醇配体的引入:醇配体的引入可以提高反应的活性和选择性,但具体的影响机制尚待深入研究。
六、个人观点和理解1. suzuki偶联反应在有机合成中的重要性:suzuki偶联反应为有机合成提供了一种高效、可控的合成策略,对于合成药物、天然产物以及功能分子具有重要的应用价值。
2. 钯配体的研究:钯配体的选择和设计是优化suzuki偶联反应的关键,未来的研究中应加强对钯配体的研究,以提高反应的效率和选择性。
偶联反应
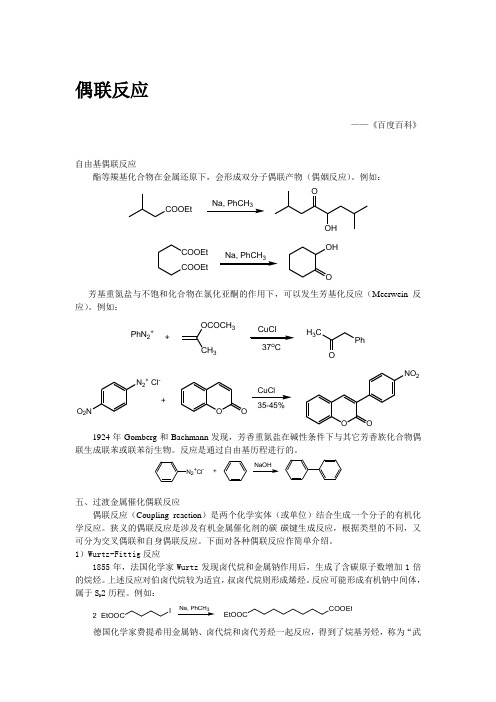
偶联反应——《百度百科》自由基偶联反应酯等羰基化合物在金属还原下,会形成双分子偶联产物(偶姻反应)。
例如:COOEt3OOHCOOEtCOOEt OHO 3芳基重氮盐与不饱和化合物在氯化亚酮的作用下,可以发生芳基化反应(Meerwein 反应)。
例如:PhN 2++OCOCH 3337o CH 3CPhON 2+ Cl-O 2NOOOONO 235-45%+CuCl1924年Gomberg 和Bachmann 发现,芳香重氮盐在碱性条件下与其它芳香族化合物偶联生成联苯或联苯衍生物。
反应是通过自由基历程进行的。
N 2+Cl -+五、过渡金属催化偶联反应偶联反应(Coupling reaction )是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键生成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
下面对各种偶联反应作简单介绍。
1)Wurtz-Fittig 反应1855年,法国化学家Wurtz 发现卤代烷和金属钠作用后,生成了含碳原子数增加1倍的烷烃。
上述反应对伯卤代烷较为适宜,叔卤代烷则形成烯烃。
反应可能形成有机钠中间体,属于S N 2历程。
例如:EtOOCI23COOEtEtOOC德国化学家费提希用金属钠、卤代烷和卤代芳烃一起反应,得到了烷基芳烃,称为“武尔兹-费提希反应”。
本法收率较高,副产物容易分离,是一种重要的制备烷基芳烃方法。
2)Glaser 偶联反应1869年,Glaser 发现末端炔烃在亚铜盐、碱以及氧化剂作用下,可以形成二炔烃化合物。
例如:4260%3)Ullmann 反应Ullmann 偶合反应是有机合成中构建碳—碳键最重要的方法之一。
Ullmann 偶合反应首次报道1901年, 它通常是利用铜作为催化剂, 催化卤代芳烃发生偶合反应生成联苯及其衍生物。
一般反应式为:2 ArXPd(0)或Pd(II)X= Cl 、Br 、I Ar-Ar目前该反应的底物范围、反应条件以及催化剂等都有了较大的改进。
酶偶联反应

酶偶联反应酶偶联反应(enzyme-linked immunosorbent assay,ELISA)是一种常用的实验技术,可以用于检测和量化蛋白质、抗体、抗原等生物分子。
它的原理是利用酶和抗原抗体相互作用产生显色或荧光等信号,从而实现对目标分子的检测。
本文将介绍酶偶联反应的原理、步骤及其应用。
一、酶偶联反应的原理酶偶联反应的原理主要包括三个方面:抗原抗体反应、酶底物反应和酶产物测定。
1.抗原抗体反应:酶偶联反应的第一步是将待测样品中的抗原(或抗体)与含有特异性抗体(或抗原)的试剂进行反应。
在这一过程中,如果待测样品中存在目标抗原(或抗体),则它们与特异性抗体(或抗原)结合形成免疫复合物。
2.酶底物反应:在酶偶联反应中,通常将酶标记在特异性抗体(或抗原)上。
当特异性抗体(或抗原)与目标抗原(或抗体)结合后,酶会被引入到免疫复合物中。
免疫复合物经过洗涤步骤以去除非特异性结合,然后加入含有酶底物的溶液。
在这一步骤中,酶底物与酶结合形成一个酶底物复合物。
3.酶产物测定:在酶底物反应完成后,通过加入酶底物的底物,酶底物复合物可催化底物反应生成可测量的产物。
产物的浓度与目标物的浓度成正比,因此可以通过测量生成的产物的浓度来间接测量目标物的浓度。
二、酶偶联反应的步骤酶偶联反应通常分为直接法、间接法和间接竞争法。
1.直接法:直接法是通过将酶标记在特异性抗体上进行酶偶联反应。
步骤如下:(1)制备用于包被的溶液:将特异性抗体溶解在包涵液中,然后在合适的条件下进行包被反应,使抗体与包被物质结合;(2)洗涤:洗涤针对非特异性结合物质的去除;(3)抗原抗体反应:将待测样品中的抗原与包被后的特异性抗体结合;(4)洗涤:洗涤去除非特异性结合物质;(5)酶底物反应:加入含有酶底物的溶液,使其与酶标记的特异性抗体结合;(6)酶产物测定:测量酶底物反应生成的产物浓度。
2.间接法:间接法是通过酶标记的辅助抗体与特异性抗体结合进行酶偶联反应。
偶联反应及举例资料

偶联反应[编辑]偶联反应,也写作偶合反应或耦联反应,是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
在偶联反应中有一类重要的反应,RM(R = 有机片段, M = 主基团中心)与R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'。
[1]由于在偶联反应的突出贡献,根岸英一、铃木章与理查德·赫克共同被授予了2010年度诺贝尔化学奖。
[2]偶联反应大体可分为两种类型:•交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯(PhBr)与氯乙烯形成苯乙烯(PhCH=CH2)。
•自身偶联反应:相同的两个片段形成一个分子,如:碘苯(PhI)自身形成联苯(Ph-Ph)。
反应机理[编辑]偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成。
第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上。
最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂。
不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快。
中间体通常不倾向发生β-氢消除反应。
[3]在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应。
[4]还原消除的速率高低如下:乙烯基-乙烯基> 苯基-苯基> 炔基-炔基> 烷基-烷基不对称的R-R′形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R′-R′的平均值相近,如:乙烯基-乙烯基> 乙烯基-烷基> 烷基-烷基。
另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理。
[5]§催化剂[编辑]偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂。
钯催化剂当中常用的如:四(三苯基膦)钯等。
钯催化的有机反应有许多优点,如:官能团的耐受性强,有机钯化合物对于水和空气的低敏感性。
格氏试剂偶联反应

格氏试剂偶联反应格氏试剂偶联反应是有机合成中常用的一种重要反应,它是通过格氏试剂与有机化合物发生偶联反应产生新的化学键。
这种反应广泛应用于药物合成、天然产物合成以及材料科学等领域,具有重要的研究和应用价值。
1. 格氏试剂格氏试剂是指一类具有阴离子性的有机锡化合物,通常由有机锡氯化物和有机锡醇酸盐两类衍生物构成。
其中最常见的是有机锡醇酸盐,如Bu3SnOH(丁基锡醇酸盐)。
这些格氏试剂可提供有机阴离子,从而与其他有机化合物发生反应。
2. 格氏试剂偶联反应机理格氏试剂偶联反应一般经历两个关键步骤:氧化与还原。
首先,格氏试剂通过氧化反应被转化为有机锡氧化物,该氧化物能够与其他有机化合物发生反应。
然后,在还原剂(如亚砜或络合剂)的作用下,有机锡氧化物被还原为有机锡化合物,同时与其他有机化合物形成新的化学键。
在格氏试剂偶联反应中,还原剂的选择是至关重要的。
常见的还原剂有亚砜(如二甲基亚砜),它能够促进有机锡氧化物的还原,并且与之反应生成新的键。
而络合剂(如α-硫酮酸酯)则能够形成络合物,从而改变反应的速率和产物选择性。
3. 格氏试剂偶联反应的应用格氏试剂偶联反应在有机合成领域有着广泛的应用。
它可以用于构建碳-碳键和碳-氧键,并且能够在化合物中引入不同的官能团。
在药物合成中,格氏试剂偶联反应可以用来建立复杂分子的骨架以及引入生物活性基团,从而合成新的药物分子。
在天然产物合成中,格氏试剂偶联反应常用于合成天然产物中的酰胺、醇酸、酮等结构基团。
此外,格氏试剂偶联反应还在材料科学中发挥重要作用,用于合成多孔材料和有机/无机杂化材料等。
4. 格氏试剂偶联反应的优势和挑战格氏试剂偶联反应有着许多优势,例如反应条件温和、产率高、底物适用范围广等。
此外,格氏试剂作为一种经济、易得的试剂,对于化学实验室中的有机合成来说具有重要意义。
然而,格氏试剂偶联反应也存在一些挑战,如金属污染、底物选择性、副反应的产生等。
研究人员正在努力开发新的格氏试剂和改进反应条件,以克服这些挑战并提高反应的选择性和效率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应名称--年代--反应物A--反应物B --类型--催化剂--注
Wurtz反应1855 R-X sp³ 自身偶联Na
Glaser偶联反应1869 R-X sp自身偶联Cu
Ullmann反应1901 R-X sp² 自身偶联Cu
Gomberg-Bachmann反应1924 R-N2X sp² 自身偶联以碱作介质
Cadiot-Chodkiewicz偶联反应1957炔烃sp R-X sp交叉偶联Cu 以碱作介质
Castro-Stephens偶联反应1963 R-Cu sp R-X sp² 交叉偶联
Kumada偶联反应1972 R-MgBr sp²;、sp³ R-X sp² 交叉偶联Pd 或Ni
Heck反应1972烯烃sp² R-X sp² 交叉偶联Pd以碱作介质
Sonogashira偶联反应1973炔烃sp R-X sp³ sp² 交叉偶联Pd、Cu 以碱作介质
Negishi偶联反应1977 R-Zn-X sp² R-X sp³ sp² 交叉偶联Pd或Ni
Stille偶联反应1977 R-SnR3 sp² R-X sp³ sp² 交叉偶联Pd
Suzuki反应1979 R-B(OR)2 sp² R-X sp³ sp² 交叉偶联Pd以碱作介质
Hiyama偶联反应1988 R-SiR3 sp² R-X sp³ sp² 交叉偶联Pd以碱作介质
Buchwald-Hartwig反应1994 R2N-R SnR3 sp R-X sp² 交叉偶联Pd N-C偶联Fukuyama偶联反应1998 RCO(SEt) sp2 R-Zn-I sp3 交叉偶联Pd。
