偶联反应
偶联反应在有机合成中的应用研究

偶联反应在有机合成中的应用研究引言:有机合成是研究有机分子之间的化学反应,以构建新的有机化合物,这在药物合成和材料科学领域具有重要的应用价值。
偶联反应是一类常用的有机合成方法,通过连接两个或多个有机分子,形成新的键,构建目标分子的分子骨架。
本文将讨论几种重要的偶联反应及其在有机合成中的应用研究。
一、金属催化的偶联反应金属催化的偶联反应是现代有机合成中最具代表性和广泛应用的方法之一。
其中最著名的是钯催化的偶联反应,如Suzuki偶联、Heck偶联和Negishi偶联等。
这些反应通过利用钯催化剂促使芳环和烯烃之间的偶联反应,具有高效、高选择性和底物广泛适应性的优点。
这些反应在药物合成和材料科学中得到了广泛的应用。
例如,Suzuki偶联反应被用于合成药物、农药和功能材料,而Heck偶联反应则被广泛应用于合成天然产物和聚合物材料。
二、碳-碳键形成反应碳-碳键形成反应是有机合成中另一类重要的偶联反应,其原理是通过碳原子之间的偶联反应来构建目标分子的骨架。
这些反应通常通过碱金属或过渡金属催化剂来实现。
最常用的碳-碳键形成反应是格氏反应和克鲁普斯基反应。
格氏反应通过将硝酚和醛缩合得到苯酚类化合物,而克鲁普斯基反应则通过将已有的碳酸盐与酸酐醇缩合得到β-酮酸盐。
这些反应广泛应用于药物合成和天然产物的合成。
三、氧化还原偶联反应氧化还原偶联反应是一类利用氧化还原反应构建碳-碳键的方法。
这些反应通常通过金属催化剂或有机小分子催化剂来实现。
最常用的氧化还原偶联反应是巴甫洛夫反应和维特igler反应。
巴甫洛夫反应通过将两个醛或酮经过氢转移催化之后结合形成α-羰基酮,而维特igler反应则是通过将亚砜和羧酸酐反应生成α-烯酮。
这些反应在合成脂肪酸、天然产物和有机化学品中具有重要的应用价值。
结论:在有机合成中,偶联反应为构建新的有机化合物提供了强大的工具。
金属催化的偶联反应、碳-碳键形成反应和氧化还原偶联反应是其中最重要和最常用的方法。
偶联反应及举例

偶联反应[编辑]偶联反应,也写作偶合反应或耦联反应,是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
在偶联反应中有一类重要的反应,RM(R = 有机片段, M = 主基团中心)与R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'。
[1]由于在偶联反应的突出贡献,根岸英一、铃木章与理查德·赫克共同被授予了2010年度诺贝尔化学奖。
[2]偶联反应大体可分为两种类型:•交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯(PhBr)与氯乙烯形成苯乙烯(PhCH=CH2)。
•自身偶联反应:相同的两个片段形成一个分子,如:碘苯(PhI)自身形成联苯(Ph-Ph)。
反应机理[编辑]偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成。
第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上。
最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂。
不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快。
中间体通常不倾向发生β-氢消除反应。
[3]在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应。
[4]还原消除的速率高低如下:乙烯基-乙烯基> 苯基-苯基> 炔基-炔基> 烷基-烷基不对称的R-R′形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R′-R′的平均值相近,如:乙烯基-乙烯基> 乙烯基-烷基> 烷基-烷基。
另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理。
[5]§催化剂[编辑]偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂。
钯催化剂当中常用的如:四(三苯基膦)钯等。
钯催化的有机反应有许多优点,如:官能团的耐受性强,有机钯化合物对于水和空气的低敏感性。
偶联反应实验报告

一、实验目的1. 掌握偶联反应的基本原理和操作方法。
2. 了解不同偶联反应条件对反应结果的影响。
3. 学会利用偶联反应合成特定有机化合物。
二、实验原理偶联反应是一种重要的有机合成方法,它涉及两个或多个分子在特定条件下形成新的共价键。
本实验以卡迪奥-肖德凯维奇偶联反应为例,通过末端炔烃与卤代末端炔烃在亚铜盐和碱催化下发生偶联,合成丁二炔的衍生物。
三、实验材料与仪器1. 实验材料:- 末端炔烃(如:1-丁炔)- 卤代末端炔烃(如:2-溴丁炔)- 亚铜盐(如:氯化亚铜)- 碱(如:氨水、一级胺、吡啶、哌啶)- 盐酸羟胺- 甲醇、乙醇、二甲基甲酰胺、四氢呋喃或水- 反应容器(如:圆底烧瓶、锥形瓶)2. 实验仪器:- 热浴搅拌器- 真空泵- 红外光谱仪- 核磁共振波谱仪四、实验步骤1. 准备反应物:将末端炔烃、卤代末端炔烃、亚铜盐、碱和盐酸羟胺按一定比例混合,加入反应容器中。
2. 加入溶剂:根据实验要求,选择甲醇、乙醇、二甲基甲酰胺、四氢呋喃或水作为溶剂,加入反应容器中。
3. 搅拌:使用热浴搅拌器将反应混合物在室温下搅拌一定时间,以确保反应充分进行。
4. 后处理:反应结束后,将反应混合物过滤,收集固体产物。
将固体产物用适量溶剂溶解,进行后续的表征分析。
5. 表征分析:使用红外光谱仪和核磁共振波谱仪对产物进行表征,确定产物的结构和纯度。
五、实验结果与分析1. 反应条件对产率的影响:- 亚铜盐的种类:在实验中,我们比较了氯化亚铜和溴化亚铜对反应的影响。
结果表明,氯化亚铜的催化效果优于溴化亚铜。
- 碱的种类:实验中使用了氨水、一级胺、吡啶和哌啶作为碱。
结果表明,氨水的催化效果最好。
- 溶剂的选择:实验中比较了甲醇、乙醇、二甲基甲酰胺、四氢呋喃和水作为溶剂对反应的影响。
结果表明,甲醇和乙醇的催化效果较好。
2. 反应产物的表征:- 红外光谱分析:产物的红外光谱图显示,在1650 cm^-1、2100 cm^-1和2300 cm^-1处有明显的吸收峰,分别对应于C=C、C≡C和C≡C的伸缩振动。
偶联反应课件

PPT学习交流
16
Suzuki偶联反应的应用
3.含敏感功能团的芳基硼酸(酯)参与Suzuki偶联反应
含有易水解的基团(酯基,氰基等),可以在无水情况下反应
O B
Pd(3)P 4 Ph + ArX
O
K 3P4 O
CHO
PPT学习交流
14
Suzuki偶联反应的应用
普通操作 在水的存在下,加入催化剂、碱和有机溶剂,加热回流一段合理
的时间完成反应,但反应体系必须全程严格控制在无氧的环境下。
1.普通体系Suzuki偶联反应
PPT学习交流
15
Suzuki偶联反应的应用
2.大位阻芳基硼酸参与Suzuki偶联反应
收率低
解决措施:
PPT学习交流
11
有机硼试剂的合成 1.通过金属有机试剂制备单取代芳基硼酸
1.1.通过Grinard试剂制备单取代芳基硼酸
1.2.通过有机锂试剂制备单取代芳基硼酸
PPT学习交流
12
有机硼试剂的合成
2.通过二硼烷频哪酯制备芳基硼酸酯
对于分子中带有酯基、氰基、硝基、羰基等官能团的芳香卤代物来说, 无法通过有机金属试剂来制备相应的芳基硼酸。
Substrate Coupling Partner ......?) Coupling Product Metal Halide
(Organic (Organometallic Electrophile) Nucleophile)
R = Alkyl, aryl, vinyl, allyl, alkynyl, benzyl R' = Alkyl, aryl, vinyl, allyl, alkynyl, benzyl, acyl X = I, Br, Cl, OTf, OTs M = Mg, Zn, Cu, Sn, Si, B,...... Cat. = Pd, Ni, others Cu Fe......
偶联反应的研究历史

偶联反应的研究历史
偶联反应(Coupling Reaction)是有机合成中的一类重要反应。
它是指通过化学键的形成将两个或多个不同分子(通常包含芳香基或烯烃基等亲电性或亲核性官能团)连接在一起,形成更复杂的结构化合物的反应。
偶联反应起源于二十世纪初期,最早由俄国化学家斯托兹哈诺夫发现并研究,在随后的几十年中,科学家们陆续发现了很多新的偶联反应。
历史上,最著名的偶联反应之一是金属催化的偶联反应,也称为金属有机化学。
这种反应中,有机金属试剂与含有卤素基团的有机物在金属催化剂的作用下发生偶联反应,生成新的有机化合物。
这种反应是由日本化学家宫岛龙太和美国化学家理查德·费尔德发明的,并获得了2000年的诺贝尔化学奖。
除了金属催化偶联反应外,另一种重要的偶联反应是“Suzuki偶联反应”。
该反应由日本化学家铃木研发,可用于在含有芳香族卤素基团的化合物中形成新的碳-碳键,被广泛用于药物和材料科学领域。
在近年来的有机合成中,偶联反应已成为多种有机化学反应中不可或缺的重要步骤。
例如,偶联反应可以用于合成有机分子中的乙烯键和炔键,或用于制备含有杂环的复杂有机分子。
因此,偶联反应在有机合成和化学方法学中扮演了非常重要的角色,可以帮助人们开发新的有机合成方法,并合成更加复杂的分子结构。
migita偶联机理

migita偶联机理
Migita偶联反应是一种在有机化学中常见的偶联反应,它利用金属镁和卤代烃在特定条件下反应,生成烃基镁化合物,进而发生偶联生成新的碳碳键。
该反应机理可以分为三个步骤。
首先,金属镁在醚类溶剂中与卤代烃发生反应,生成有机镁试剂。
这一步是整个反应的关键,因为金属镁具有较高的反应活性和选择性,能够与卤代烃的碳卤键进行有效的配位。
其次,生成的有机镁试剂与另一分子卤代烃发生反应,生成烃基镁化合物。
在这一步中,卤代烃的碳卤键发生断裂,同时烃基被转移到金属镁上,形成新的碳碳键。
这一步是整个反应的核心,因为它涉及到碳碳键的形成和转移。
最后,生成的烃基镁化合物与另一分子卤代烃发生偶联反应,生成偶联产物。
在这一步中,烃基镁化合物与另一分子卤代烃发生反应,形成新的碳碳键。
这一步是整个反应的完成阶段,它实现了碳碳键的形成和偶联。
总的来说,Migita偶联反应是一种高效、高选择性的有机合成方法,它利用金属镁和卤代烃的反应,实现了碳碳键的形成和偶联。
该反应具有广泛的应用价值,被广泛应用于有机合成、药物研发和材料科学等领域。
偶联反应名词解释

偶联反应名词解释偶联反应(CouplingReactions)是一种常见的有机化学反应,也被称为杂化反应或偶合反应。
它将两个不同的单宁栅(Grignard reagents)或烷基(alkyl)结合在一起,形成一个更大和更复杂的有机分子。
偶联反应可以利用现有的杂质反应产物(如烷基醋酸酯),而不需要新的起始材料。
偶联反应是一种非常有效的制备烷基醋酸酯的方法。
首先,在液体溶剂中,如甲醇(methanol),乙醇(ethanol),甚至水中,两个不同的杂质反应产物需要添加到容器中。
然后,两种杂质反应产物会通过偶联反应发生变化,而不会产生其他化合物。
为了完成这个反应,反应液将被加热,但不至于蒸发,以保持液体的状态。
经过一定的时间,所得到的反应产物将是一种新的烷基醋酸酯。
在偶联反应中,需要使用的起始物质可以是任何烷基或单宁栅,其中的单宁栅可能是直链烷基(straight-chain alkyl),邻烷基(allyl),或其他烷基。
单宁栅可以是芳基烷基(arylalkyl),有机戊烷(organobutane),有机丙烷(organopropane),有机甲烷(organomethane)等。
通常,偶联反应都是在催化剂的作用下完成的,常用的催化剂有金属氢钝化物(metal hydrides),钴(cobalt),铊(thallium),钯(palladium)等。
偶联反应在有机反应中有很大的应用,它可以把一些简单的有机分子连接起来形成较复杂的有机分子。
这种反应可以用来合成药物,催化剂,农药,抗生素,医疗护理产品,医用材料,食品添加剂等。
此外,偶联反应还常用于制备各种材料,例如形状良好的聚合物,烯烃橡胶,陶瓷和金属材料,以及几十万种有机磷成分的农药,精细化学产品和农药。
偶联反应很容易实现,在实验室及工业生产过程中,偶联反应可以给实验室技术人员提供很大的帮助,它也可以大大改善工业生产的效率,极大地提高生产效率。
偶联反应的机理

偶联反应的机理一、概述偶联反应是有机合成中常用的一类重要反应,通过将两个或多个小分子有机物连接起来,形成一个较大的分子。
偶联反应在药物合成、材料科学等领域具有广泛的应用。
本文将介绍偶联反应的机理及其应用。
二、偶联反应的分类偶联反应可分为以下几类:1. 碳-碳偶联反应碳-碳偶联反应是指通过将两个碳原子连接起来形成新的碳-碳键的反应。
常见的碳-碳偶联反应包括Suzuki偶联、Negishi偶联、Stille偶联等。
2. 碳-氮偶联反应碳-氮偶联反应是指通过将碳原子与氮原子连接起来形成新的碳-氮键的反应。
常见的碳-氮偶联反应包括Ullmann偶联、Buchwald-Hartwig偶联等。
3. 碳-氧偶联反应碳-氧偶联反应是指通过将碳原子与氧原子连接起来形成新的碳-氧键的反应。
常见的碳-氧偶联反应包括Suzuki-Miyaura偶联、Heck偶联等。
4. 碳-硫偶联反应碳-硫偶联反应是指通过将碳原子与硫原子连接起来形成新的碳-硫键的反应。
常见的碳-硫偶联反应包括Chan-Lam偶联、Kumada偶联等。
三、偶联反应的机理偶联反应的机理可以分为以下几个步骤:1. 激活底物偶联反应的第一步是激活底物,通常通过加入催化剂或活化试剂来实现。
催化剂可以提供活化中心,活化试剂可以引入亲核试剂或电子试剂。
2. 形成中间体激活底物后,会形成一个中间体,该中间体具有较高的反应活性。
中间体的形成通常涉及键的断裂和形成。
3. 底物偶联中间体与另一个底物发生偶联反应,形成新的化学键。
偶联反应通常涉及亲核试剂和电子试剂的参与。
4. 氧化还原在偶联反应中,氧化还原反应常常是不可或缺的一步。
通过氧化还原反应,可以改变底物的官能团,从而实现偶联反应。
四、偶联反应的应用偶联反应在有机合成中具有广泛的应用。
以下是一些常见的应用领域:1. 药物合成偶联反应在药物合成中扮演着重要的角色。
通过偶联反应,可以将不同的功能团连接在一起,构建复杂的有机分子结构。
有机化学基础知识点整理偶联反应与交叉偶联反应

有机化学基础知识点整理偶联反应与交叉偶联反应有机化学基础知识点整理:偶联反应与交叉偶联反应有机化学是研究有机物结构与特性的科学,其中偶联反应和交叉偶联反应是有机合成中常用的重要手段,本文将对这两种反应进行基础知识点整理。
一、偶联反应偶联反应是指两个有机分子中的两个不同官能团在反应条件下发生连接形成新的键,从而生成一个新的有机分子。
常见的偶联反应有Heck反应、Suzuki反应、Stille反应等。
1. Heck反应Heck反应是通过钯催化下的芳香化合物与烯烃发生的偶联反应,生成具有烯烃结构的芳香化合物。
该反应需要碱性条件和适量的氧气存在。
反应机理包括反应前的氧化加成、钯催化下的反应、脱氧等步骤。
2. Suzuki反应Suzuki反应是通过钯催化下的芳香化合物与硼酸酯发生的偶联反应,生成具有芳香环和烷基或芳基基团的化合物。
该反应需有碱性条件和无氧环境。
反应机理包括反应前的亲核加成、钯催化下的反应、脱氧等步骤。
3. Stille反应Stille反应是通过钯催化下的芳香化合物与有机锡化合物发生的偶联反应,生成具有烷基或芳基基团的化合物。
该反应需有碱性条件、无氧环境和适量的溴化物存在。
反应机理包括反应前的亲核加成、钯催化下的反应、脱溴等步骤。
二、交叉偶联反应交叉偶联反应是指两个不同有机物之间的偶联反应,生成具有两个不同基团的化合物。
常见的交叉偶联反应有Negishi反应、Kumada反应、Suzuki-Miyaura反应等。
1. Negishi反应Negishi反应是通过钯催化下的有机锌化合物和卤代化物发生的交叉偶联反应,生成具有不同基团的化合物。
该反应需有碱性条件和适量的酸存在。
反应机理包括反应前的亲核加成、钯催化下的反应、脱卤等步骤。
2. Kumada反应Kumada反应是通过钯催化下的有机镁卤化物和卤代化物发生的交叉偶联反应,生成具有不同基团的化合物。
该反应需有碱性条件和无氧环境。
反应机理与Negishi反应类似。
偶联反应

分子间Heck反应
端基烯烃与卤代芳香烃发生分子间Heck 反应,是研究最早 的一类反应。这类反应已经成为芳烃烷基化重要反应。
1.常规分子间 Heck反应
分子间Heck反应
2.不对称分子间 Heck反应
分子间Heck反应
3.非常用离去基团的 Heck反应
3.1重氮盐参与的Heck反应不需要膦催化剂和胺,条件温和,
于不需要任何碱的存在。
分子间Heck反应
Tips:
1、该类反应在卤代物中,卤素的β位的碳原子上不能有 SP3 杂化的氢原子。主要是因为这类卤代物形成烷基钯络合物时,
氢化钯的消除反应速度大于烯烃的加成反应,因此仅有消除产物。
2、当有强烈供电子基团时,芳基溴参与的反应收率也很 低。其主要原因是在反应中膦配体被季化与卤代物被还原。当使用
有机硼试剂的合成 1.通过金属有机试剂制备单取代芳基硼酸
1.1.通过Grinard试剂制备单取代芳基硼酸
1.2.通过有机锂试剂制备单取代芳基硼酸
有机硼试剂的合成
2.通过二硼烷频哪酯制备芳基硼酸酯
对于分子中带有酯基、氰基、硝基、羰基等官能团的芳香卤代物来说, 无法通过有机金属试剂来制备相应的芳基硼酸。
Suzuki偶联反应的应用
普通操作 在水的存在下,加入催化剂、碱和有机溶剂,加热回流一段合理
的时间完成反应,但反应体系必须全程严格控制在无氧的环境下。
1.普通体系Suzuki偶联反应
Suzuki偶联反应的应用
2.大位阻芳基硼酸参与Suzuki偶联反应
收率低
解决措施:
强碱水溶液如NaOH或Ba(OH)2 苯和DME为溶剂 将大位阻芳基硼酸转化为硼酸酯
间的交叉偶联反应通常被称之为Sonogashira 反应
最新偶联反应
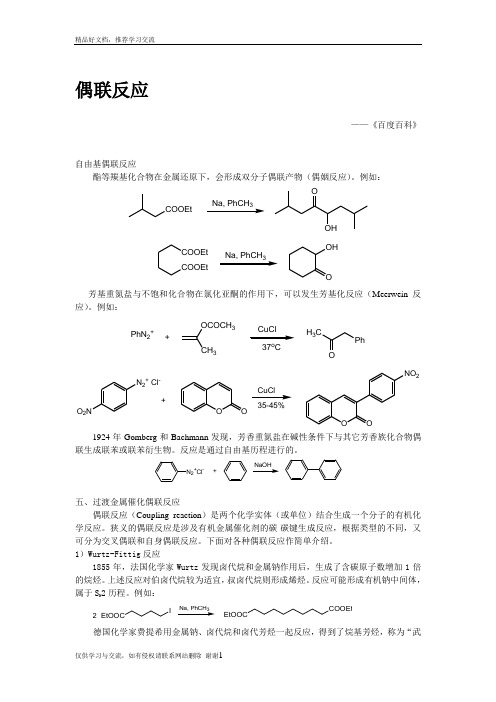
偶联反应——《百度百科》自由基偶联反应酯等羰基化合物在金属还原下,会形成双分子偶联产物(偶姻反应)。
例如:COOEt3OOHCOOEtCOOEt OHO 3芳基重氮盐与不饱和化合物在氯化亚酮的作用下,可以发生芳基化反应(Meerwein 反应)。
例如:PhN 2++OCOCH 3337o CH 3CPhON 2+ Cl-O 2NOOOONO 235-45%+CuCl1924年Gomberg 和Bachmann 发现,芳香重氮盐在碱性条件下与其它芳香族化合物偶联生成联苯或联苯衍生物。
反应是通过自由基历程进行的。
N 2+Cl -+五、过渡金属催化偶联反应偶联反应(Coupling reaction )是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键生成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
下面对各种偶联反应作简单介绍。
1)Wurtz-Fittig 反应1855年,法国化学家Wurtz 发现卤代烷和金属钠作用后,生成了含碳原子数增加1倍的烷烃。
上述反应对伯卤代烷较为适宜,叔卤代烷则形成烯烃。
反应可能形成有机钠中间体,属于S N 2历程。
例如:EtOOCI23COOEtEtOOC德国化学家费提希用金属钠、卤代烷和卤代芳烃一起反应,得到了烷基芳烃,称为“武尔兹-费提希反应”。
本法收率较高,副产物容易分离,是一种重要的制备烷基芳烃方法。
2)Glaser 偶联反应1869年,Glaser 发现末端炔烃在亚铜盐、碱以及氧化剂作用下,可以形成二炔烃化合物。
例如:4O 60%3)Ullmann 反应Ullmann 偶合反应是有机合成中构建碳—碳键最重要的方法之一。
Ullmann 偶合反应首次报道1901年, 它通常是利用铜作为催化剂, 催化卤代芳烃发生偶合反应生成联苯及其衍生物。
一般反应式为:2 ArXPd(0)或Pd(II)X= Cl 、Br 、I Ar-Ar目前该反应的底物范围、反应条件以及催化剂等都有了较大的改进。
偶联反应
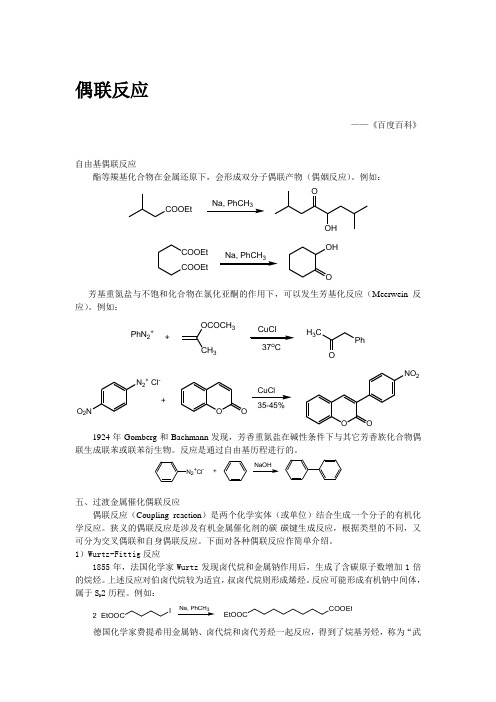
偶联反应——《百度百科》自由基偶联反应酯等羰基化合物在金属还原下,会形成双分子偶联产物(偶姻反应)。
例如:COOEt3OOHCOOEtCOOEt OHO 3芳基重氮盐与不饱和化合物在氯化亚酮的作用下,可以发生芳基化反应(Meerwein 反应)。
例如:PhN 2++OCOCH 3337o CH 3CPhON 2+ Cl-O 2NOOOONO 235-45%+CuCl1924年Gomberg 和Bachmann 发现,芳香重氮盐在碱性条件下与其它芳香族化合物偶联生成联苯或联苯衍生物。
反应是通过自由基历程进行的。
N 2+Cl -+五、过渡金属催化偶联反应偶联反应(Coupling reaction )是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键生成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
下面对各种偶联反应作简单介绍。
1)Wurtz-Fittig 反应1855年,法国化学家Wurtz 发现卤代烷和金属钠作用后,生成了含碳原子数增加1倍的烷烃。
上述反应对伯卤代烷较为适宜,叔卤代烷则形成烯烃。
反应可能形成有机钠中间体,属于S N 2历程。
例如:EtOOCI23COOEtEtOOC德国化学家费提希用金属钠、卤代烷和卤代芳烃一起反应,得到了烷基芳烃,称为“武尔兹-费提希反应”。
本法收率较高,副产物容易分离,是一种重要的制备烷基芳烃方法。
2)Glaser 偶联反应1869年,Glaser 发现末端炔烃在亚铜盐、碱以及氧化剂作用下,可以形成二炔烃化合物。
例如:4260%3)Ullmann 反应Ullmann 偶合反应是有机合成中构建碳—碳键最重要的方法之一。
Ullmann 偶合反应首次报道1901年, 它通常是利用铜作为催化剂, 催化卤代芳烃发生偶合反应生成联苯及其衍生物。
一般反应式为:2 ArXPd(0)或Pd(II)X= Cl 、Br 、I Ar-Ar目前该反应的底物范围、反应条件以及催化剂等都有了较大的改进。
偶联反应卤代物碳原子杂化

偶联反应卤代物碳原子杂化
在有机化学中,偶联反应是一种常见的合成方法,用于将两个有机分子的碳-碳键连接起来。
偶联反应通常涉及到碳原子的杂化状态的变化,特别是在卤代物(卤代烷或卤代烯)参与的情况下。
卤代物一般具有 sp3 杂化的碳原子,这是由于卤素的电性较大,使得碳-卤键具有极性,碳原子需要四个σ 键轨道形成四面体的杂化状态。
在偶联反应中,卤代物的碳原子通常会发生热解或亲核取代等反应,导致其碳原子的杂化状态发生变化。
常见的偶联反应如 Suzuki 偶联、Heck 偶联、Stille 偶联等都涉及到卤代物的使用。
例如,在Suzuki偶联中,卤代物与硼化合物反应,生成新的碳-碳键。
在这个过程中,卤代物的碳原子可能会经历一系列的中间步骤,其杂化状态可能会在反应过程中发生变化,最终形成新的碳-碳键。
总的来说,卤代物在偶联反应中的碳原子杂化状态的变化与其参与的具体反应机理和条件密切相关。
在设计和理解偶联反应时,需要考虑反应的机理和每个中间体的结构。
1/ 1。
偶联反应及举例资料

偶联反应[编辑]偶联反应,也写作偶合反应或耦联反应,是两个化学实体(或单位)结合生成一个分子的有机化学反应。
狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
在偶联反应中有一类重要的反应,RM(R = 有机片段, M = 主基团中心)与R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'。
[1]由于在偶联反应的突出贡献,根岸英一、铃木章与理查德·赫克共同被授予了2010年度诺贝尔化学奖。
[2]偶联反应大体可分为两种类型:•交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯(PhBr)与氯乙烯形成苯乙烯(PhCH=CH2)。
•自身偶联反应:相同的两个片段形成一个分子,如:碘苯(PhI)自身形成联苯(Ph-Ph)。
反应机理[编辑]偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成。
第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上。
最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂。
不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快。
中间体通常不倾向发生β-氢消除反应。
[3]在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应。
[4]还原消除的速率高低如下:乙烯基-乙烯基> 苯基-苯基> 炔基-炔基> 烷基-烷基不对称的R-R′形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R′-R′的平均值相近,如:乙烯基-乙烯基> 乙烯基-烷基> 烷基-烷基。
另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理。
[5]§催化剂[编辑]偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂。
钯催化剂当中常用的如:四(三苯基膦)钯等。
钯催化的有机反应有许多优点,如:官能团的耐受性强,有机钯化合物对于水和空气的低敏感性。
有机实验答案

甲基橙的制备(1)什么叫偶联反应?试结合本实验讨论一下偶联反应的条件。
答:重氮盐在弱酸、中性或碱溶液中与芳胺或酚类作用由偶氮基-N=N-将两个分子偶联起来,生成偶氮化合物的反应,称为偶联反应。
重氮盐与芳胺偶联时,在高pH介质中,重氮盐易变成重氮酸盐,而在低pH介质中,游离芳胺则容易转为铵盐。
只有溶液的pH某一范围内使两种反应物都有足够的浓度时,才能有效地发生偶联反应。
胺的偶联反应,通常在中性或弱酸性介质(pH=4~7)中进行。
(2)在本实验中,制备重氮盐时为什么要把对氨基苯磺酸变成钠盐?本实验如改成下列操作步骤:先将对氨基苯磺酸与盐酸混合,再滴加亚硝酸钠溶液进行重氮化反应,可以这样做吗?为什么?答:对氨基苯磺酸是两性化合物,以酸性内盐的形式存在,内盐的形成使对氨基苯磺酸在水中溶解度很小,故通常先将其制成钠盐,再进行重氮化反应。
由于对氨基苯磺酸在酸性条件下在水中溶解度很小,这样做反应较难进行(非均相反应)。
3、试解释甲基橙在酸碱介质中的变色原因,并用反应式表示。
答:甲基橙在中性或碱性介质中呈黄色,pH=3~。
安息香的辅酶合成为什么加入苯甲酸后,反应混合物的ph要保持在9-10?溶液PH过低有什么不好?答:由于负碳离子的条件必须是在碱性条件下方可成立,如果溶液的pH值保持在中性或偏酸性,都不利于负碳离子的生成。
乙酰水杨酸制备(1)加入浓硫酸的目的是什么?浓硫酸作为催化剂。
①水杨酸形成分子内氢键,阻碍酚羟基酰化作用。
水杨酸与酸酐直接作用须加热至150~160℃才能生成乙酰水杨酸,如果加入浓硫酸(或磷酸),氢键被破坏,酰化作用可在较低温度下进行,同时副产物大大减少。
(2)本实验中可产生什么副产物?本实验的副产物包括水杨酰水杨酸酯、乙酰水杨酰水杨酸酯、乙酰水杨酸酐和聚合物。
副产物中的高聚物如何出去呢?答:用NaHCO3溶液。
副产物聚合物不能溶于NaHCO3溶液,而乙酰水杨酸中含羧基,能与NaHCO3溶液反应生成可溶性盐。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
偶联反应目录偶联反应常见的偶联反应包括偶联反应具体说明偶联反应所需要注意的用途Suzuki反应偶联反应偶联反应(英文:Coupled reaction),也作偶连反应、耦联反应、氧化偶联,是由两个有机化学单位(molecules)进行某种化学反应而得到一个有机分子的过程.这里的化学反应包括格氏试剂与亲电体的反应偶联反应(Grinard),锂试剂与亲电体的反应,芳环上的亲电和亲核反应(Diazo,Addition-Elimination),还有钠存在下的Wutz反应,由于偶联反应 (Coupled Reaction)含义太宽,一般前面应该加定语.而且这是一个比较非专业化的名词. 狭义的偶联反应是涉及有机金属催化剂的碳-碳键生成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。
进行偶联反应时,介质的酸碱性是很重要的。
一般重氮盐与酚类的偶联反应,是在弱碱性介质中进行的。
在此条件下,酚形成苯氧负离子,使芳环电子云密度增加,有利于偶联反应的进行。
重氮盐与芳胺的偶联反应,是在中性或弱酸性介质中进行的。
在此条件下,芳胺以游离胺形式存在,使芳环电子云密度增加,有利于偶联反应进行。
如果溶液酸性过强,胺变成了铵盐,使芳环电子云密度降低,不利于偶联反应,如果从重氮盐的性质来看,强碱性介质会使重氮盐转变成不能进行偶联反应的其它化合物。
偶氮化合物是一类有颜色的化合物,有些可直接作染料或指示剂。
在有机分析中,常利用偶联反应产生的颜色来鉴定具有苯酚或芳胺结构的药物。
常见的偶联反应包括反应名称--年代--反应物A--反应物B --类型--催化剂--注Wurtz反应 1855 R-X sp³ 自身偶联 NaGlaser偶联反应 1869 R-X sp 自身偶联 CuUllmann反应 1901 R-X sp² 自身偶联 CuGomberg-Bachmann反应 1924 R-N2X sp² 自身偶联以碱作介质Cadiot-Chodkiewicz偶联反应 1957 炔烃 sp R-X sp 交叉偶联 Cu 以碱作介质Castro-Stephens偶联反应 1963 R-Cu sp R-X sp² 交叉偶联Kumada偶联反应 1972 R-MgBr sp²;、sp³ R-X sp² 交叉偶联 Pd或Ni Heck反应 1972 烯烃 sp² R-X sp² 交叉偶联 Pd 以碱作介质Sonogashira偶联反应 1973 炔烃 sp R-X sp³ sp² 交叉偶联 Pd、Cu 以碱作介质Negishi偶联反应 1977 R-Zn-X sp² R-X sp³ sp² 交叉偶联 Pd或Ni Stille偶联反应 1977 R-SnR3 sp² R-X sp³ sp² 交叉偶联 PdSuzuki反应 1979 R-B(OR)2 sp² R-X sp³ sp² 交叉偶联 Pd 以碱作介质Hiyama偶联反应 1988 R-SiR3 sp² R-X sp³ sp² 交叉偶联 Pd 以碱作介质Buchwald-Hartwig反应 1994 R2N-R SnR3 sp R-X sp² 交叉偶联 Pd N-C偶联Fukuyama偶联反应 1998 RCO(SEt) sp2 R-Zn-I sp3 交叉偶联 Pd偶联反应具体说明偶联反应是由两个有机化学单位(moiety)进行某种化学反应而得到一个有机分子的过程.这里的化学反应包括格氏试剂与亲电体的反应(Grinard),锂试剂与亲电体的反应,芳环上的亲电和亲核反应(Diazo,Addition-Elimination),还有钠存在下的Wurtz反应,偶联反应所需要注意的进行偶联反应时,介质的酸碱性是很重要的。
一般重氮盐与酚类的偶联反应,是在弱碱性介质中进行的。
在此条件下,酚形成苯氧负离子,使芳环电子云密度增加,有利于偶联反应的进行。
重氮盐与芳胺的偶联反应,是在中性或弱酸性介质中进行的。
在此条件下,芳胺以游离胺形式存在,使芳环电子云密度增加,有利于偶联反应进行。
如果溶液酸性过强,胺变成了铵盐,使芳环电子云密度降低,不利于偶联反应,如果从重氮盐的性质来看,强碱性介质会使重氮盐转变成不能进行偶联反应的其它化合物。
用途偶氮化合物是一类有颜色的化合物,有些可直接作染料或指示剂。
在有机分析中,常利用偶联反应产生的颜色来鉴定具有苯酚或芳胺结构的药物。
Suzuki反应是过渡金属钯或镍催化的偶联反应,一直是合成aryl-aryl 键最有效的方法之一。
在过渡金属催化的芳基偶联反应中,在四个三苯基膦配体配合的钯催化下,芳基硼酸与溴或碘代芳烃的交叉偶联反应被称为芳基偶联反应。
Suzuki 偶联反应的催化循环过程通常认为先是Pd(0)与卤代芳烃发生氧化-加成反应生成Pd(II) 的络合物,然后发生金属转移反应生成Pd(II) 的络合物,最后进行还原-消除而生成产物和Pd(0)。
卤代芳烃与氧化加成后,与等当量的碱生成有机钯氢氧化物中间物种,取代了键极性相对弱的Pd-X键,这种含强极性键Pd一O的中间物种具有较强的亲电性另一当量的碱与芳基硼酸生成四价硼酸盐中间物种,具有较强的富电性,有利于阴离子向Ar'一Pd一OH的金属中心迁移。
由这两方面协同作用形成的有机钯络合物Ar一Pd一Ar',经还原消除生成芳基偶联产物。
有研究发现,在溴代芳烃的偶联反应中,速率决定步骤在于氧化加成,而在碘代芳烃的偶联反应中,芳基阴离子向金属中心迁移过程是速率决定步骤。
格林尼亚试剂简介格林尼亚试剂 Grignard reagent格林尼亚试剂简称“格氏试剂”是含卤化镁的有机金属化合物,由于含有碳负离子,因此属于亲核试剂,由法国化学家维克多·格林尼亚(François Auguste Victor Grignard)发现。
格氏试剂在有机合成上十分有用,因而有多种市售格氏试剂存在。
历史1900年,法国化学家维克多·格林尼亚发现了格氏试剂;[1]1912年,格林尼亚因这一贡献被授予诺贝尔化学奖一同得奖的是他的同事保罗·萨巴蒂尔(Paul Sabatier)。
[2]结构格氏试剂是共价化合物,镁原子直接与碳相连形成极性共价键,碳为负电性端,因此格氏试剂是极强的路易斯碱,能从水及其它路易斯酸中夺取质子,故格氏试剂不能与水,二氧化碳接触,需格氏试剂的制备和引发的反应需要在无水,隔绝空气条件下进行。
制备与应用制备在0℃冷却的格氏试剂格氏试剂一般由卤代烃与镁粉在无水乙醚或四氢呋喃(,THF)中反应制得。
格氏试剂可与醚或四氢呋喃中的氧原子形成络合物,制备过程必须在绝对无水无二氧化碳无乙醇等具有活泼氢的物质(如:水、醇、氨NH3、卤化氢、末端炔等)条件下进行。
由于碘代烷价格较高,一般用溴代烷合成。
溴代烷是最常用于制备格氏试剂的卤代烃,但由于氯、溴甲烷均为气体,使用不便,一般使用碘甲烷合成碘化甲基镁(CH3MgI)。
氯苯在制备格氏试剂时还须控制温度与压力。
烯丙型及苯甲基型格氏试剂,合成后会与尚未反应的卤代烃发生偶合,因而需要严格控制温度。
Grignard反应的仪器用前应尽可能进行干燥。
微量水分的存在抑制反应的引发,而且会分解形成的Grignard试剂而影响产率。
有时作为补救和进一步措施清除仪器所形成的水化膜,可将已加入Mg屑和碘粒的三颈瓶(或者其它反应器)在石棉网上用小火小心加热几分钟,使之彻底干燥。
[3]格林尼亚反应格氏试剂用于增长碳链的反应通称格林尼亚反应,主要包括烷基化反应R-Mg-X + R1-CH2-X -→ R-CH2-R1 + X-Mg-X 羰基加成OMgX∣R-Mg-X + R1-CO-R2 --→R-C-R1∣R2共轭加成R∣R-Mg-X + R1-CH=CH-R2 --→ R1-C=C-R2∣Mg-X路易斯碱反应·制备其它有机金属化合物,尤其是烷基镉试剂·脱去亚胺的α-氢,用于α-烷基醛的合成[4]参见格林尼亚反应(Grignard reaction)性质简称格氏试剂。
一类通式为RMgX的试剂,式中R为脂肪烃基或芳香烃基,X为卤素(C1、Br或I)。
通常用卤代烃和金属镁在无水乙醚或四氢呋喃中制取。
性质极为活泼,可与具有活泼氢的化合物(如H2O,ROH,RC≡CH…)醛、酮、酯、酰卤、腈、环氧乙烷、卤代烷、二氧化碳、三氯化磷、三氯化硼、四氯化硅等反应。
为重要的有机合成试剂。
参考资料1.Victor Grignard, Compt. Rend. Vol. 130, p. 1322 (1900).2.The Nobel Prize in Chemistry 1912:Victor Grignard .3.有机化学实验(第二版)兰州大学复旦大学编高等教育出版社.4.[英]R.K.Mackie, D.M.Smith, R.A.Aitken, 2008年7月:《有机合成指南》孟歌译,北京:化学工业出版社,71~72页.重氮盐重氮盐的化学性质含有重氮基(-N=N+)的盐类。
干燥的重氮盐不稳定,受热或震动易爆炸,但是也有例外,也就是所谓的稳定重氮盐,例如氟硼酸重氮盐,吡唑重氮内盐以及三蝶烯重氮盐。
重氮盐一般用芳香胺经重氮化制得。
反应过程是把芳香胺加入到过量浓盐酸(过量的酸的作用是防止生成的重氮盐与没有反应的芳香胺偶联,生成偶氮化合物)中,再加入适量亚硝酸钠溶液(整个反应过程需控制在0~5℃),用碘化钾淀粉试纸检验亚硝酸钠是否过量(不足需补加,过量加尿素破坏)。
脂肪胺的重氮盐极不稳定,在生成的过程中就会分解,生成醇(分解过程中经过碳正离子,会有重排现象)。
重氮盐可进行多种反应,一如不易引入的一些基团,以重氮苯为例:重氮盐还原成苯肼C6H5N2+ +H3PO2 →C6H6+ N2↑C6H5N2+ +H2O C6H5OH+ N2↑C6H5N2+ +CuCl/HCl→C6H5Cl+ N2↑C6H5N2+ +CuCN/NaCN→C6H5CN+ N2↑C6H5N2+ +KI→C6H5I+ N2↑在碱性环境中,重氮盐与酚、芳香胺发生偶联,生成偶氮化合物,这是制取偶氮化合物的重要方法。
偶联一般在对位发生,对位被占则在临位偶联,临对位都被占则不发生偶联。
