江西丰城中学2013-2014学年上学期高三月考试卷
江西省丰城中学高三上学期第三次月考(语文).doc

江西省丰城中学2011届高三上学期第三次月考语文试题本试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分,共150分,时间150分钟。
第Ⅰ卷(选择题共36分)温馨寄语:今天的一小步,高考的一大步;问鼎天下,非你莫属。
一.基础知识及运用(每题3分,共计15分)1.下列词语中加点的字每对读音都不相同的一组是()A.落.款/落.落大方伺.候/窥伺.时机哥俩./玩弄伎俩.B.送给./家给.户足行.款/行.若无事贝壳./金蝉脱壳.C.纰缪./未雨绸缪.和.谐/和.衷共济露.怯/崭露.头角D.浩.瀚/皓.月当空饶.恕/骁.勇善战不啻./瓜熟蒂.落2.下列词语中有两个错别字的一组是()A.亵黩头晕目眩沉湎以儆效尤矫枉过正B.矫健冥顽不灵不循私情罄竹难书曲突徙薪C.缉私功亏一匮萦怀嘻笑怒骂陈词滥调D.戌边别无长物殉情痉孪偏辟3.下列各句中,加点的成语使用恰当的一项是()A.我的态度很鲜明,我的发言表明了我的立场,我对任何邪教的言论不赞一词....,对他们的行为深恶痛绝。
B.这则笑话因为对漠不关心....人民疾苦的官员讽刺得很有力量,在民间流传很广,影响极大。
C.“9.15”案件发生后,根据知情人提供的线索,公安人员按图索骥....,很快找到了犯罪嫌疑人的巢穴。
D.今年以来,上海市检察机关立案侦查贪污贿赂案件277件313人。
人们感慨,钱真是让人利令智昏....的东西。
4.下列各句中没有语病表意明确的一句是()A.记者问:“刘永行先生,去年美国《福布斯》杂志把你排名为中国第二首富,称刘氏家庭的资产为8亿美元,这个评估准确吗?”B.中共中央政治局常委国务院总理温家宝到上海江苏考察工作,走访了多家高新技术企业和科研院所,就加快转变经济发展方式、产业结构调整和升级等问题进行调研。
C.《语文教学研究》以民族化与现代化兼具、理论性与实践性并举的鲜明风格,赢得了广大读者的喜爱。
这本杂志的阅读主体,主要是面向中学语文教师及其他语文工作者。
D.2009年11月30日,新华网报道,随着武汉火车站等一批节点性工程进入最后冲刺建设,武(汉)广(州)高铁客运专线可望在年内全面建成。
江西省丰城市拖船中学2013届高三第一次月考语文试题

江西省丰城市拖船中学2013届高三第一次月考语文试题第Ⅰ卷(选择题,共36分)一、语言知识及运用(18分,每小题3分)1。
下列词语中加线的字注音全都正确的一项是()A.媛(yuán)女酾(shī) 酒乘(chèng)凉熏陶渐(jiān)染B.混(hùn)沌干(gān)禄隽(jùn)永潜(qiǎn)滋暗长C.茎(jīng)叶蜷(quán)缩愆(qiān)期否(pǐ)极泰来D.纤(qiàn)绳蜕(tuì)变悄(qiāo)然夙(sù)兴夜寐2.下列各组词语中,没有错别字的一组是()A.葱笼没精打采肄业欲盖弥张怨天尤人B.潦草揠苗助长砥砺游目骋怀相形见绌C.勖勉涸辙之鲋镶嵌放浪形骸浅尝则止D.坚忍信誓旦旦影碟杯盘狼藉锋芒必露3.下列各句中,加线的熟语使用不恰当的一句是()A.随着有车族的扩大,越来越多的新手上路了,交通事故发生率日甚一日,人们面临着安全危机。
为此,交管部门采取严格监控措施,从源头堵住“马路杀手”.B.去年年底,政协委员对市里39个部门一一进行调研、评议,当面锣对面鼓地“敲”出48条行风整改意见,“敲"得大家心服口服。
C.近日各地出台的《关于重申禁止洒后驾车的规定》,在当地干部群众中激起一片叫好声。
但是要真正做到令行禁止,还需要在落实上狠下工夫.D.《天龙八部》选入高中语文读本,立即引起了轩然大波,有人担心比比皆是的打斗场面描写会产生负面影响,金庸先生则担心中学生看不懂其中的人生痛苦与悲哀。
4。
下列句子中没有语病的一句是()A.中国网民在“就业"、“增长"、“代表”等词前加上“被”字,表达出没有话语权的弱势一方的无奈。
“被时代”一词的发明无疑夸大和渲染了反抗某些强权压制的情绪,也生动地体现了中国人性格中具有冷幽默的一面.B.深圳市将每年12月7日设为“深圳创意设计日”,与深圳市获得联合国教科文组织授予的“设计之都"称号的2008年12月7日同属一天。
丰城中学上学期高三第五次月考考试试题.docx

高中化学学习材料唐玲出品丰城中学2015-2016学年上学期高三第五次月考考试试题化 学(课改实验班)命题人:罗文丰 2016.1.8可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32一、选择题(每小题3分,共48分。
每小题只有一个正确选项) 1、下列描述中符合化学科学的是( )A .“滴水穿石”说的是物理变化B .“雨后彩虹”和“海市蜃楼”既是自然现象,又是光学现象,也与胶体的知识有关C .“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂D .“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高2、为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。
关于该实验的操作对测定结果的影响判断正确的是( ) A.铁皮未及时取出,会导致测定结果偏小 B.铁皮未洗涤干净,会导致测定结果偏大 C.烘干时间过长,会导致测定结果偏小 D.若把盐酸换成硫酸,会导致测定结果偏大3、下列说法正确的是( )A .相同体积和物质的量浓度的不同溶液里所含溶质的物质的量相同。
B .10 mol/L 的浓盐酸与H 2O 等质量混合所得混合液的浓度为5 mol/L 。
C .溶液中溶质质量分数为w ,密度为ρ g ·cm -3,溶质摩尔质量为M g ·mol -1的溶液的物质的量浓度为ρwMmol/L 。
D .一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大。
4、已知氧化还原反应:2Cu(IO 3)2+24KI +12H 2SO 4 = 2CuI ↓+13I 2+12K 2SO 4+12H 2O 当1 mol 氧化剂参加反应时,被氧化的物质的物质的量为 ( ) A .10 mol B .11 mol C .12 mol D .13 mol5、常温下,下列各组离子在指定溶液中一定能大量共存的是 ( ) A .1.0 mol ·L -1的KNO 3溶液:H +、Fe 2+、Cl -、SO 42- B .饱和氯水中 :NH 4+、SO 32-、SO 42-、Cl -C .与铝反应产生大量氢气的溶液:Na +、K +、CO 32-、NO 3-D .常温下, c(H +)=1.0×10-13mol/L 溶液中:K +、Na +、CH 3COO -、Br - 6、下列离子方程式与所述事实相符且正确的是( ) A .向明矾溶液中加入过量的氢氧化钡溶液:Al 3++2SO 2-4+2Ba 2++4OH -===2BaSO 4↓+AlO -2+2H 2OB .稀HNO 3溶液与难溶于水的FeS 固体:FeS +2H +===Fe 2++H 2S ↑C .碳酸氢镁与少量澄清石灰水反应:Ca 2++2OH -+2HCO -3===CaCO 3↓+CO 2-3+2H 2OD .强碱溶液中,次氯酸钠与Fe(OH)2:3ClO -+2Fe(OH)2===2FeO 2-4+3Cl -+H 2O +4H +7、下列各组物质混合,加热蒸干,并经充分灼烧,得到的是混合物的是( ) A 0.2mol/L NaHCO 3溶液与0.1mol/LNaOH 溶液等体积混合 B 向400mL 、2mol/L 的NaOH 溶液中通入6.72LCO 2(标况) C 在100mL1mol/LNH 4Cl 溶液中,投入0.05mol Na 2O 2 D 在20mL0.01mol/LCa(HCO 3)2溶液中,投入0.2gCaCO 38、一定条件下Cu 2S 与稀HNO 3发生反应,所得还原产物为NO ,氧化产物为Cu 2+和SO 42—。
江西省丰城中学高三第三次月考试卷(英语)

江西省丰城中学高三第三次月考试卷英语第一部分:听力(共两节,满分30分)第一节(共5小题;每小题1.5分,满分7.5分)听下面5段对话。
每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。
听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。
每段对话仅读一遍。
1. What does the man decide to do at last?A. Book a table for 8:00 p.m.B. Book a table for 9:00 p.m.C. Book no table.2. What does the woman want?A. Half of a spoonful of sugar.B. Half of a spoonful of sugar with a little milk.C. One and a half of a spoonful of sugar, with a little milk.3. Where is the man’s new home?A. Near an airport.B. Near a train station.C. In the center of the city.4. What can we know from the dialogue?A. The man liked the Professor’s speech.B. The man disliked the Professor’s speech.C. The man didn’t listen to the Professor’s speec h.5. What’s the weather like in the whole month?A. It’s been rainy for about half a month.B. It’s been sunny for about half a month.C. It’s been rainy for about half a month and sunny for the other half of the m onth.第二节(共15小题;每小题1.5分,满分22.5分)听下面5段对话。
江西省丰城中学2014届高三上学期期中考试数学(理)试卷(无答案)

丰城中学2013-2014学年上学期高三期中考试试卷数 学 (理科)命题人:龚金国 审题人: 张勇刚 2013.11.05本试卷总分值为150分考试时间为120分钟一、选择题:(本大题共10小题,每小题5分,共50分,在每小题给出的四个选项中,只有一项是符合题目要求的,请将答案填在答题卷的表格内。
)1、已知集合{}|||2,A x x x R =≤∈,{|4,}B x x Z =≤∈,则A B ⋂=( )A . (0,2)B . [0,2]C .{0, 2}D .{0,1, 2}2.已知函数3log ,0()2,0x x x f x x >⎧=⎨≤⎩,则A. 4C. -43.平面向量a 与b 的夹角为060, (2,0)a =,||1b =,则|2|a b +=( )B C 4 D 124.函数()ln 26f x x x =+-的零点位于 ( )A .[1,2]B .[2,3]C .[3,4]D .[4,5]5. 已知⎪⎩⎪⎨⎧≥+-=1,1,1)2()(x a x x a x f x 是R 上的增函数,那么a 的取值范围是( )A. )2,1(B. ⎪⎭⎫⎢⎣⎡2,23C. ⎥⎦⎤ ⎝⎛23,1D. ⎪⎭⎫⎝⎛2,23 6.把函数sin()0,||2y A x πωφωφ⎛⎫=+>< ⎪⎝⎭的图象向左平移3π个单位得到()y f x =的图象(如图),则ϕ=( )A .6π-B .6πC . 3π-D .3π 7.定义在R 上的可导函数()()22215f x x xf '=++,在闭区间[0,]m 上有最大值15,最小值-1,则m 的取值范围是( ) A 2m ≥ B 24m ≤≤ C 4m ≥ D 48m ≤≤8.已知)(x f 是定义域为R 的偶函数,且)()1(x f x f -=+,若)(x f 在][0,1-上是减函数,那么)(x f 在][3.1上是 ( )A.增函数B.减函数 C 先增后减得函数 D.先减后增的函数9. △ABC 的外接圆的圆心为O ,半径为1,20OA AB AC ++=且OA AB =,则向量CA在CB 方向上的投影为 ( )A.32-B.2C.32D.2- 10. 已知函数,若关于x 的方程f (x 2+2x )=a (a ∈R )有六个不同的实根,则a 的取值范围是( )A ](8,2B ](9,2C ](9,8D )(9,8二、填空题:(本大题共5小题,每小题5分,共25分,请将答案填在答题卷的题号中的横线上。
丰城中学2013-2014学年上学期高三周练试卷五
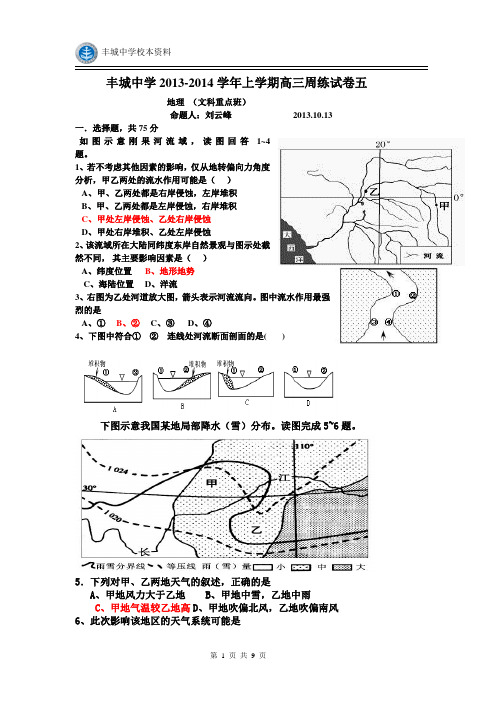
丰城中学2013-2014学年上学期高三周练试卷五地理(文科重点班)命题人:刘云峰2013.10.13一.选择题,共75分如图示意刚果河流域,读图回答1~4题。
1、若不考虑其他因素的影响,仅从地转偏向力角度分析,甲乙两处的流水作用可能是()A、甲、乙两处都是右岸侵蚀,左岸堆积B、甲、乙两处都是左岸侵蚀,右岸堆积C、甲处左岸侵蚀、乙处右岸侵蚀D、甲处右岸堆积、乙处左岸侵蚀2、该流域所在大陆同纬度东岸自然景观与图示处截然不同,其主要影响因素是()A、纬度位置B、地形地势C、海陆位置D、洋流3、右图为乙处河道放大图,箭头表示河流流向。
图中流水作用最强烈的是A、①B、②C、③D、④4、下图中符合①②连线处河流断面剖面的是( )下图示意我国某地局部降水(雪)分布。
读图完成5~6题。
5.下列对甲、乙两地天气的叙述,正确的是A、甲地风力大于乙地B、甲地中雪,乙地中雨C、甲地气温较乙地高D、甲地吹偏北风,乙地吹偏南风6、此次影响该地区的天气系统可能是A.冷锋 B.暖锋 C.气旋 D.反气旋下图为世界某区域等高线地形图。
左图为丙区域的放大图,其中实线为等高线(单位:米),虚线为地层界线。
据此回答7~8题。
7.图中丙地的地质、地貌属于()。
A.背斜成岭B.向斜成谷C.向斜成岭D.背斜成谷8.关于甲、乙两河特征的叙述,正确的是()。
A.甲河东北岸冲刷严重B.甲河的水能一定比乙河的丰富C.与乙河相比,甲河径流量的季节变化更小D.与甲河相比,乙河的航运条件更好读下面两幅图,完成9~10题。
9.图中长粗矢线表示()。
A.墨西哥湾暖流B.千岛寒流C.日本暖流D.加利福尼亚寒流10.关于T岛东西两岸气候的叙述,正确的是()。
A.M—差异明显—东岸受暖流影响,西岸受寒流影响B.N—差异明显—东岸受暖流影响,西岸受寒流影响C.M—差异不明显—东岸受寒流影响,西岸受暖流影响D.N—差异不明显—东岸受寒流影响,西岸受暖流影响下图为四位同学分别绘制的某局部海域8月表面水温图(单位:℃)。
【2014】江西省丰城中学2014届高三上学期月考(二)化学试题(理科重点班)【新课标人教版】

江西省丰城中学2013-2014学年上学期高三月考(二)试卷化学(理科重点班)命题人:鄢玉华2013-11-18可能用到的相对原子质量:H-1 O-16 N-14 S-32 Cl-35.5 Na-23 Mg-24 Al-27 Fe-56一、选择题(每小题只有一个正确选项16小题共48分)1. 常温下,下列各组离子在指定溶液中一定能大量共存的是()A. 1.0 mol·L-1的CaCl2溶液:Na+、K+、Cl-、CO2-3B. 1.0 mol·L-1的HNO3溶液:K+、[Ag(NH3)2]+、Cl-、SO2-4C. 1.0 mol·L-1的KI溶液:Na+、Fe3+、Cl-、SO2-4D. 澄清透明的溶液:Cu2+、SO2-4、Mg2+、Cl-2. 下列有关物质的性质与应用相对应的是()A. 氢氟酸具有酸性,可用于雕刻玻璃B. Na2O2具有强氧化性,可用作自来水的消毒剂C. 氯化铁溶液能氧化铜单质,可用于制作印刷电路板D. SO2具有漂白性,可使酸性高锰酸钾溶液褪色3. 下列有关实验装置进行的相应实验,能达到实验目的的是()图1图2图3图4A. 图1定量测定H2O2的分解速率B. 图2装置制备Fe(OH)2并能较长时间观察其颜色C. 图3装置测量Cu与浓硝酸反应产生气体的体积D. 图4证明CH3CH2OH发生消去反应生成了乙烯4. 设N A为阿伏加德罗常数的值。
下列说法一定正确的是()A. 9.2 g C7H8和C3H8O3的混合物中所含氢原子总数为0.8N AB. 标准状况下,11.2 L SO3所含的分子数为0.5N AC. 将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1N A个Fe(OH)3胶粒D. 0.1 mol Na2O2参加反应转移的电子数目是0.2N A5.下列物质与其用途完全符合的有几条()①Na2CO3—制玻璃;②SiO2—太阳能电池;③AgI—人工降雨;④Fe2O3—红色油漆或涂料⑤Al2O3—焊接钢轨;⑥NaClO—消毒剂;⑦NaCl—制纯碱;⑧MgO—耐火材料A.4 B.5 C.6 D.76.A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法错误的是()A.若X为O2,则A可为硫化氢B.若X为KOH溶液,则A可能为AlCl3C.若X为Fe,则C可能为Fe(NO3)2D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为Na7.在NH4HSO3溶液中逐滴加入Ba(OH)2溶液,下列离子方程式一定错误的是()A.2HSO3-+Ba2++2OH-→Ba SO3↓+ SO32-+ 2H2OB.NH4++ HSO3-+ Ba2++2OH-→Ba SO3↓+ NH3·H2O+ H2OC.NH4++ 3HSO3-+ 2Ba2++ 4OH-→2Ba SO3↓+SO32-+ NH3·H2O + 3H2OD . HSO 3-+ Ba 2++ OH -→Ba SO 3↓+ H 2O8.用惰性电极电解100mL4mol ·L -1的CuSO 4溶液,一定时间后在阳极收集到1.12 L 气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe 2+浓度为(设溶液的体积不变,反应前后均为标准状况)( )A 、2.7 mol· L -1B 、3 mol· L -1C 、4 mol· L -1D 、1 mol· L -19.硫酸铵在强热条件下分解:4(NH 4)2SO 4 = 6 NH 3↑+ N 2↑+3SO 2↑+SO 3↑+7H 2O 若将生成的气体通入氯化钡溶液中,得到的沉淀物是( ) A .BaSO 3和BaSO 4 B .BaS C . BaSO 3 D .BaSO 410.已知:Fe 5O 7可以看作Fe 2O 3和Fe 3O 4的混合物。
江西省丰城中学2013-2014学年高二数学上学期第二次月考试题 理(理科实验班、零班)牛津译林版

丰城中学2013-2014学年上学期高二第二次月考试卷数 学 (理科实验班、零班)2013.12.10选择题(本大题共10小题.共50分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1已知命题p :∀x1,x2∈R ,(f(x2)-f(x1))(x2-x1)≥0,则⌝p 是( ) (A) ∃x1,x2∈R ,(f(x2)-f(x1))(x2-x1)≤0 (B) ∀x1,x2∈R ,(f(x2)-f(x1))(x2-x1)≤0(C) ∃x1,x2∈R ,(f(x2)-f(x1))(x2-x1)<0 (D) ∀x1,x2∈R ,(f(x2)-f(x1))(x2-x1)<02.已知变量,x y 满足约束条件222441x y x y x y +≥⎧⎪+≤⎨⎪-≥-⎩,则目标函数3z x y =-的取值范围是( )(A )3[,6]2- (B )3[,1]2-- (C )[1,6]- (D )3[6,]2- 3. 已知在等差数列{}n a 中2737a a =,10a >,则下列说法正确的是( )A .110a > B .10S 为nS 的最大值 C .0d > D .416S S >4。
已知向量(1,1,0),(1,0,2)a b ==-,且ka b +与2a b -互相垂直,则k 值是( ) A .1 B.15 C.35 D.755 下列命题错误的是 ( )A.命题“若1,0232==+-x x x 则”的逆否命题为“若,1≠x0232≠+-x x 则” B. “2>x ”是“0232>+-x x ”的充分不必要条件 C. 若q p ∧为假命题,则q p ,均为假命题D. 对于命题,01,2<++∈∃x x R x p 使得:则均有,:R x p ∈∀⌝012≥++x x6. 已知数列{}n a满足115,1n n a a a +==+,则10a =( )A. 120B. 121C. 122D. 1237.已知三棱柱111C B A ABC -的侧棱与底面边长都相等,1A 在底面ABC 上的射影D 为BC 的中点,则异面直线AB 与1CC 所成的角的余弦值为( )A .43B .45C .47D .438.在二面角α-l -β 的半平面α内,线段AB ⊥l ,垂足为B ;在半平面β内,线段CD ⊥l ,垂 足为D ;M 为l 上任一点.若AB=2,CD=3,BD=1,则AM +CM 的最小值为 ( )A .26B .23C .21D .199.已知a 、b 、c 成等比数列,且0a >,若a b c m ++=,m 为正常数,则b 的取值范围是( )A .[,0)(0,]33m m -B .[,0)(0,]3m m -C .[,0)(0,]32m m -D .[,0)(0,)2mm -10.椭圆22221,(0)x y a b a b +=>>的四个顶点A 、B 、C 、D 构成的四边形为菱形,若菱形ABCD的内切圆恰好过焦点,则椭圆的离心率是( )A. 352B. 358+ C . 512- D. 514+填空题(本大题共5小题.把答案填在题中横线上)11.椭圆22143x y +=的左焦点为F ,直线x m =与椭圆相交于点A 、B ,当FAB ∆的周长最大时,FAB ∆的面积是 *** .12.如下图所示,在棱长为2的正方体1111D C B A ABCD -内(含正方体表面)任取一点M ,则11≥⋅AM AA的概率=p *** ;如图,矩形nn n n D C B A 的一边nn B A 在x 轴上,另外两个顶点n n DC ,在函数yABD11B 11D M 第12题图())0(1>+=x x x x f 的图象上.若点n B 的坐标为(),0n (2,n ≥且*)n N ∈, 记矩形 n n n n D C B A 的周长为n a ,则=+++1032a a a *** .14.设,,x y z 为正实数,满足230x y z -+=,则2y xz 的最小值是 *** .15.设ABC ∆的内角,,A B C 所对的边为,,a b c ;则下列命题正确的是 *** .①若2ab c >;则3C π<②若2a b c +>;则3C π<③若333a b c +=;则2C π<④若()2a b c ab +<;则2C π>⑤若22222()2a b c a b +<;则3C π>三、解答题(本大题共6小题.解答应写出必要的文字说明、证明过程或演算步骤)16..(本小题满分12分) 已知1:(),3xp f x -=且|()|2f a <;q :集合}0x |x {B },R x ,01x )2a (x |x {A 2>=∈=+++=且∅=⋂B A .若p ∨q 为真命题,p ∧q 为假命题,求实数的取值范围.17.(本大题满分12分)在ABC ∆中,,,A B C 的对边分别为,,a b c 且cos ,cos ,cos a C b B c A 成等差数列. (1)求B 的值;(2)求22sin cos()A A C +-的取值范围.18.(本大题满分12分)在ABC ∆中,已知23AB AC ⋅=o30BAC ∠=.(Ⅰ)求ABC ∆的面积;(Ⅱ)设M 是ABC ∆内一点,定义()(,,)f M m n p =,其中m ,n ,p 分别是MBC ∆,MCA ∆, MAB ∆的面积,若1()(,,)2f M x y =,求14x y +的最小值19.(本大题满分12分) 已知数列{}n a 的前n 项和是nS (*n N ∈),11a =且112n n n S S a -⋅+= (1)求数列{}n a 的通项公式;231111(2):*,1111n n N n S S S +∈⋅⋅>+---求证对任意的不等式成立..20.(本大题满分13分) 如图,在四棱锥P ABCD -中,底面ABCD 为直角梯形,0//,90AD BC ADC ∠=,平面PAD ⊥底面ABCD ,Q为AD 的中点,M 是棱PC 上的点,2PA PD ==,112BC AD ==,CD =(I )求证:平面PQB ⊥平面PAD ;(II )若二面角M BQ C --为30°,设PM tMC =,试确定t 的值.21.(本小题满分14分)已知各项均为正数的数列{}n a 满足12212+++=n n n n a a a a , 且42342+=+a a a ,其中*n N ∈.(1) 求数列{}n a 的通项公式;(2) 设数列{}n b 满足n nn n na b 2)12(⋅+=,是否存在正整数, (1)m n m n <<,使得nm b b b ,,1成等比数列?若存在,求出所有的m 、n 的值;若不存在,请说明理由.(3) 令22(1)1(1)n n n c n n a +++=+,记数列}{n c的前n 项和为*()n S n N ∈,证明:51162n S ≤<.丰城中学2013-2014学年上学期高二第三次月考答题卡 数 学 (理科实验班、零班) PABC D QM11. 12. 13.14. 15.三、解答题:(本大题共6小题,共75分,解答写在对应框内。
江西省丰城中学高三第三次月考试卷(地理) .doc

丰城中学高三、高四第三次月考试卷一、选择题(共30小题,每小题2分)图中阴影部分与其它部分日期不同,且AB 为晨昏线,A 的纬度为0°,B 的纬度70°。
读图回答1-3题。
1.此时,太阳直射点的地理坐标为 A.,45°E B.,45°E C.,135°W D.,135°E2.该日,甲地的昼长是A.6小时B.12小时C.15小时D.18小时3.如果上图中阴影部分为陆地,AB 为等温线,下列说法正确的是A.甲地为亚热带季风气候B.此时控制亚欧大陆的气压中心为亚洲高压C.此时巴西草原的景观特征为一片枯黄D.此时澳大利亚的农民正在播种小麦 读岩石圈物质循环图,回答4~5题。
4.下列选项正确的是A .E 为变质岩B .A 为沉积岩C .D 为岩浆岩 D .C 为岩浆 5.图中各个数码对应的地质作用正确的是 A .⑤为外力作用 B .⑥为变质作用 C .③为重熔再生作用 D .①为冷却凝固作用下图为“某地区等高线地形图”,有一条公路沿河修建,回答6~7题6.若河水暴涨,最可能被水冲毁、使行车受阻的路段是 ( ) A .甲 B .乙 C .丙 D .丁7.若要安排露营活动地点,就地形、水文特征判断,最不适宜的选点是() A.W B.X C.Y D.Z右图为“我国南方某地剖面图”,据图回答8—9题8.水位季节变化最大和最小的水体分别是()A.河流、湖泊B.河流、①中的水体C.河流、②中的水体D.湖泊、②中的水体9.据图中信息,判断图示时期河湖水的补给形式为()A.图中湖泊水此时不能得到潜水补给B.该河流能得到雨水、地表径流和潜水补给C.该河水与湖泊水之间存在直接的互补关系D.该河流既能得到地表水和雨水补给,又能得到①、②两层地下水补给下图为我国某地区一条河流不同河段的X、Y、Z三处截面上的剖面图及其所在地区的典型植被分布图。
据图回答10~11题。
10.X处和Y处河谷形成的原因是()A.均为冰川侵蚀作用B.均为内外力共同作用C.仅为河流侵蚀作用D.均为断裂下陷作用11.近年来,Z处的沉积物增长速度加快,由此造成的后果为()A.X处的森林近年来遭到严重的破坏,水土流失严重B.Y处的森林在近年来被开发为农田,导致入河的泥沙增多C.海岸线向海洋方向凸出,河口三角洲面积增大D.海岸线倒退,河口三角洲面积减小读某地地形剖面图以及气温、降水量随地形分布示意图,回答12-13题。
高三数学月考试题及答案-丰城市2013届高三高考适应性考试试卷4(理)

江西省丰城市2013届高三高考适应性考试数学理科试卷4一、选择题(本大题共10小题,每小题5分,共50分,在每小题给出的四个选项中,只有一项是符合题目要求)1.设A 、B 为非空集合,定义集合A*B 为如图非阴影部分表示的集合,若{|A x y =={|3,0},x B y y x ==>则A*B= ( )A .(0,2)B .[0,1]∪[2,+∞)C .(1,2]D .[0,1]∪(2,+∞) 2.“非空集合M 不是P 的子集”的充要条件是( ) A .P x M x ∉∈∀, B .M x P x ∈∈∀, C .P x M x ∈∈∃11,又P x M x ∉∈∃22,D .P x M x ∉∈∃00,3.若将一个真命题中的“平面”换成“直线”、“直线”换成“平面”后仍是真命题,则该 命题称为“可换命题”下列四个命题,其中是“可换命题”的是( )①垂直于同一平面的两直线平行; ②垂直于同一平面的两平面平行; ③平行于同一直线的两直线平行; ④平行于同一平面的两直线平行. A .①② B .①④ C .①③ D .③④ 4.阴影部分面积s 不可用()()[]⎰-=badx x g x f s 求出的是( )5.在ABC AB BC AB ABC ∆=+⋅∆则中,若,02的形状是( )A .∠C 为钝角的三角形B .∠B 为直角的直角三角形C .锐角三角形D .∠A 为直角的直角三角形6.若复数1a i =-,则1019228101010222a C a C a -+-+= ( ) A .32i - B . 32 C .32i D .32-7.临川二中的某教学楼共五层,甲、乙、丙、丁四人走进该教学楼2~5层的某一层楼上课, 则满足有且仅有一人上5楼上课,且甲不在2楼上课的所有可能的情况有( )种 A .81 B .27 C .54 D .108 8.如图:已知正方体ABCD -A 1B 1C 1D 1中,E 为棱CC 1的中点.如果一只蜜蜂在 正方体ABC -A 1B 1C 1D 1内部任意飞,则它飞入三棱锥A 1-BDE 内部的概率为 ( )A .41 B .31C .21D .529.椭圆)0(1:22221>>=+b a by a x C 的左准线为,左、右焦点分别为21,F F ,抛物线2C 的准线也为,焦点为2F ,记1C 与2C 的一个交点为P ,则AB=-||||||||21121PF PF PF F F ( )A .12B .1C .2D .与a ,b 的取值有关10.已知函数32()31,f x x x =-+21,0()468,0x x g x xx x x ⎧+>⎪=⎨⎪---≤⎩,关于方程[()]0g f x a -= (a 为正实数)的根的叙述有下列四个命题①存在实数a ,使得方程恰有3个不同的实根; ②存在实数a ,使得方程恰有4个不同的实根; ③存在实数a ,使得方程恰有5个不同的实根; ④存在实数a ,使得方程恰有6个不同的实根; 其中真命题的个数是( )A .0B .1C .2D .3二、填空题(每题5分,共25分)11. 在样本的频率分布直方图中,一共有n 个小矩形,若中间一个小矩形的面积等于其余(n-1)个小矩形面积之和的15,且样本容量为240,则中间一组的频数是 12.观察下列几个三角恒等式:①tan10tan 20tan 20tan 60tan 60tan101++=; ②tan13tan35tan35tan 42tan 42tan131++=;③tan5tan100tan100tan(15)tan(15)tan51+-+-=④tan(160)tan(22)tan(22)tan 272tan 272tan(160)1--+-+-=一般地,若tan ,tan ,tan αβγ都有意义,你从这四个恒等式中猜想得到的一个结论为 .13.如图,坐标纸上的每个单元格的边长为1,由下往上的六个点:1,2,3,4,5,6的横纵坐标分别对应数列{}*()n a n N ∈的前12项,如下表所示:按如此规律下去,则200920102011a a a ++= .14.已知正四面体ABCD 的棱长为1,若以的方向为左视方向,则该正四面体的左视图与俯视图面积和的取值范围为 .15.选做题(请考生在两个小题中任选一题做答,如果多做,则按所做的第一题评阅记分).(1)在极坐标系中,过圆6cos ρθ=的圆心,且垂直于极轴的直线的极坐标方程1a 2a 3a 4a 5a 6a 7a 8a 9a 10a 11a 12a 1x 1y 2x 2y 3x 3y 4x 4y 5x 5y 6x 6y为 . (2)若对于任意角θ,都有1sin cos =+ba θθ,则下列不等式中恒成立的是 A. 122≤+b a B. 122≥+b a C. 11122≤+b a D. 11122≥+ba三、解答题(本大题共6小题,计75分.解答应写出必要的文字说明,证明过程或演算步骤,请把答案写在答题卷的指定区域内) 16.(本小题满分12分) 已知向量(2c m x =向量(c s ,3s i nn x =,2220102010()1cot 1tan f x m n x x=⋅++++(1)化简()f x 的解析式,并求函数的单调递减区间;(2)在△ABC 中,c b a ,,分别是角A,B,C 的对边,已知ABC b A f ∆==,1,2012)(的面积为23,求C A c a sin sin )(1005++.17.(本小题满分12分)为了评估天气对大运会的影响,制定相应预案,深圳市气象局通过对最近50多年的气象数据资料的统计分析,发现8月份是本市雷电天气高峰期,在31天中平均发生雷电14.57天如图.如果用频率作为概率的估计值,并假定每一天发生雷电的概率均相等,且相互独立.(1)求在大运会开幕(8月12日)后的前3天比赛中,恰好有2天发生雷电天气的概率(精确到0.01);(2)设大运会期间(8月12日至23日,共12天),发生雷电天气的天数为X ,求X的数学期望和方差.18.(本小题满分12分)一个几何体是由圆柱11ADD A 和三棱锥E ABC -组合而成,点A 、B 、C 在圆O 的圆周上,其正(主)视图、侧(左)视图的面积分别为10和12,如图所示,其中EA ABC ⊥平面, AB AC ⊥,AB AC =,2AE =. (1)求证:AC BD ⊥;(2)求二面角A BD C --的平面角的大小.246819.(本小题满分12分)执行下面框图所描述的算法程序,记输出的一列数依次为1a ,2a ,…,n a ,*N ∈n ,2011≤n .(1)若输入2=λ,写出输出结果;(2)若输入2=λ,求数列}{n a(3)若输入2>λ,令1--=n n n pa pa c ,求常数p (1±≠p ),使得}{n c20.(本小题满分13分)已知抛物线C :y x 42=的焦点为F ,过点F 作直线交抛物线C 于A 、B 两点;椭圆E 的中心在原点,焦点在x 轴上,点F 是它的一个顶点,且其离心率23=e . (1)求椭圆E 的方程;(2)经过A 、B 两点分别作抛物线C 的切线1l 、2l ,切线1l 与2l 相交于点M .证明:MF AB ⊥;(3) 椭圆E 上是否存在一点M ',经过点M '作抛物线C 的两条切线MA''、MB ''(A '、B '为切点),使得直线A B ''过点F ?若存在,求出抛物线C 与切线MA ''、MB ''所围成图形的面积;若不存在,试说明理由.21.(本小题满分14分) 已知函数x b ax x f sin )(+=,当3π=x 时,)(x f 取得极小值33-π.(1)求a ,b 的值;AODE正(主)视图E A侧(左)视图 A 1D 1A D 1A 1EBCO D(2)设直线)(:x g y l =,曲线)(:x F y S =.若直线与曲线S 同时满足下列两个条件:①直线与曲线S 相切且至少有两个切点;②对任意R x ∈都有)()(x F x g ≥.则称直线为曲线S 的“上夹线”. 试证明:直线2:+=x y l 是曲线x b ax y S sin :+=的“上夹线”. (3)记)](5[81)(x f x x h -=,设1x 是方程0)(=-x x h 的实数根,若对于)(x h 定义域中任意的2x 、3x ,当1||12<-x x ,且1||13<-x x 时,问是否存在一个最小的正整数M ,使得32|()()|h x h x M -≤恒成立,若存在请求出M 的值;若不存在请说明理由.参考答案1~10 DDCDD CAABD11.40 12. 90,tan tan tan tan tan tan 1αβγαββγγα++=++=当时13.1005 14. ]422,22[+ 15.(1)3cos =θρ (2)D 16.(1)()f x 的单调递减区间为:2,,()6223k k k k k Z ππππππππ⎡⎫⎛⎤++++∈⎪ ⎢⎥⎣⎭⎝⎦6分(2)由()2012,1,f A b ABC ==∆,2,3A c a π===…9分∴1005()2010sin sin a c A C +==+……………………………………………12分 17(1)设8月份一天中发生雷电天气的概率为p ,由已知47.03157.14==p .…2分 )47.01(47.0223-⨯⨯=C P 351231.0=35.0≈. ……………6分 (2)由已知X ~)47.0,12(B . …………………8分所以,X 的数学期望64.547.012)(=⨯=X E . …………………………10分X 的方差9892.247.0147.012)()=-(⨯⨯=X D . …………………………12分 18.(1)BD 在平面上的射影为AB ,而AC AB ⊥,由三垂线定理得,BD AC ⊥…4分 (2)由已知得:2=AD ,2=OA , 22=AB , 32=BD ………………6分 过A 点作BD AH ⊥于H ,连结CH ,由AC BD ⊥,故AHC ∠为所求二面角的平面角22=AC ∴3tan ==∠AH AC AHC 故3π=∠AHC ,所求二面角平面角的大小为3π…12分 19. 解 (1)输出结果是:0,22,2.……3分(2)(法一)由程序框图知,01=a ,nn a a -λ=+11,*N ∈n ,2010≤n .所2=λnn a a -=+211,… 5分nn n n a a a a --=--=-+2112111,而}{n a 中的任意一项均不为1,(否则的话,由11=+n a 可以得到1=n a ,…,与101≠=a 矛盾),所以,11112111--=--=-+n n n n a a a a ,111111-=---+n n a a (常数),*N ∈n ,2010≤n .故⎭⎬⎫⎩⎨⎧-11n a 是首项为1-,公差为1-的等差数列, ……………………7分所以,n a n -=-11,数列}{n a 的通项公式为n a n 11-=,*N ∈n ,2011≤n .…8分(3)当2>λ时,)(11111222111p p pa p p p a p p a p pa a p p a pa p a c n n n n nn n n n -λ-⎪⎪⎭⎫ ⎝⎛-λ-⋅=+λ-+λ-=--λ--λ=--=+++, 令112=-λp p ,则p p 1+=λ,012=+λ-p p ,242-λ±λ=p . ………10分此时,1122=-⎪⎪⎭⎫ ⎝⎛+=-λp p p p p p , 所以n n c p c 21=+,*N ∈n ,2011≤n ,又01≠=p c ,故存在常数242-λ±λ=p (2>λ),使得}{n c 是以p 为首项,2p 为公比的等比数列. ………12分20. 解:(1)设椭圆E 的方程为 22221(0)x y a b a b+=>>,半焦距为c .由已知条件得)1,0(F ,∴⎪⎪⎩⎪⎪⎨⎧+===222231c b a acb 解得E 1422=+y x . ……………… ……………4分 (2)显然直线的斜率存在,否则直线与抛物线C 只有一个交点,不合题意,故可设直线的方程为 1+=kx y ,112212(,),(,)()A x y B x y x x ≠, 由⎩⎨⎧=+=yx kx y 412消去y并整理得 2440x kx --=,∴421-=x x . ∵241x y =,得12y x '=,………5分∴过抛物线C 上A 、B 两点的切线方程分别是)(21111x x x y y -=-,)(21222x x x y y -=-,即 2114121x x x y -= , 2224121x x x y -=,解得两条切线1l 、2l 的交点M 的坐标为)4,2(2121x x x x +,即)1,2(21-+x x M ,……7分 ∴122121(,2)(,)2x x FM AB x x y y +⋅=-⋅--0)4141(2)(2121222122=---=x x x x ∴MF AB ⊥. ………8分(3)假设存在点M '满足题意,由(2)知点M '必在直线1-=y 上,又直线1-=y 与椭圆E有唯一交点,故M '的坐标为)1,0(-'M ,设过点M '且与抛物线C 相切的切线方程为:)(21000x x x y y -=-,其中点),(00y x 为切点.令1,0-==y x 得,)0(214110020x x x -=--, 解得20=x 或20-=x , ………10分故不妨取)1,2(),1,2(B A '-',即直线B A ''过点F .综上所述,椭圆E 上存在一点)1,0(-'M ,经过点M '作抛物线C 的两条切线A M ''、B M '' (A '、B '为切点),能使直线B A ''过点F .此时,两切线的方程分别为1y x =--和1-=x y . …………11分222320011142(1)2()41223S x x dx x x x ⎡⎤=--=-+=⎢⎥⎣⎦⎰ . …………13分21.(1)1=a ,2-=b …………………………………………3分(2)由1c o s 21)(=-='x x f ,得0c o s =x ,当2π-=x 时,0cos =x 此时221+-=πy ,222+-=πy ,21y y =所以)22,2(+--ππ是直线与曲线S 的一个切点,当23π=x 时,0cos =x ,2231+=πy ,2232+=πy ,21y y =所以)223,23(+ππ是直线与曲线S 的一个切点 所以直线与曲线S 相切且至少有两个切点……6分对任意R x ∈,0sin 22)sin 2()2()()(≥+=--+=-x x x x x F x g所以)()(x F x g ≥,因此直线:2+=x y 是曲线S :x b ax y sin +=的“上夹线” …9分 (3)方法一:4sin 2)(x x x h +=,1x 为04sin 2=+-x x 的根,即01=x ,也即1||3<x ,1||2<x ………10分而04cos 2)(>+='x x x h ∴4sin 21)1()(max x h x h +==,4sin 21)1()(min xh x h --=-=∴221sin 1|)1()1(||)()(|max 23<+=--=-h h x h x h ………………………………13分 所以存在这样最小正整数2=M 使得M x h x h ≤-|)()(|23恒成立.………………14分 方法二:不妨设32x x <,因为0)(>'x h ,所以)(x h 为增函数,所以)()(32x h x h <又因为01)(<-'x h ,所以x x h -)(为减函数,所以3322)()(x x h x x h ->-所以2323)()(0x x x h x h -<-<,………………………………………………………………11分 即2|||||)(||||)()(|121312132323<-+-≤---=-<-x x x x x x x x x x x h x h ………13分 故存在最小正整数2=M ,使得M x h x h ≤-|)()(|23恒成立………………………14分。
丰城中学上学期高三月考试卷.doc

丰城中学2015-2016学年上学期高三月考试卷数 学 理 科(课改实验班)命题人:吴爱龙 审题人:熊海荣 2016.01.08一、选择题(每小题5分,共60分)1. 若集合{|(4)(1)0}M x x x =++=,{|(4)(1)0}N x x x =--=,则M N =( )A .∅B .{}1,4--C .{}0D .{}1,42. 若复数()32z i i =- ( i 是虚数单位 ),则z =( )A .32i -B .32i +C .23i +D .23i -3.已知△ABC 的内角A ,B ,C 所对的边分别为a ,b ,c 且(a +b)2-c 2=4,C =120°,则△ABC 的面积为( ) A .33 B .233C .3D .2 34.已知数组(x 1,y 1),(x 2,y 2),…,(x 10,y 10)满足线性回归方程y ^=b ^x +a ^,则“(x 0,y 0)满足线性回归方程y ^=b ^x +a ^,”是“x 0=x 1+x 2+…+x 1010,y 0=y 1+y 2+…+y 1010”的( )A .充分不必要条件B .必要不充分条件C .充要条件D .既不充分也不必要条件5.从原点向圆x 2+y 2-12y +27=0作两条切线,则该圆夹在两条切线间的劣弧长为( )A .πB .2πC .4πD .6π6.若⎝ ⎛⎭⎪⎫3x -132x n的展开式中含有非零常数项,则这样的正整数n 的最小值是( )A .3B .4C .10D .12 7. 已知实数x >0,y >0,lg 2x +lg 8y =lg 2,则1x +1y 的最小值是( ) A .23 B .43 C .2+3 D .4+238.若双曲线x 2a 2-y 2b 2=1与椭圆x 2m 2+y 2b 2=1(m>b>0)的离心率之积大于1,则以a ,b ,m 为边长的三角形一定是( )A .等腰三角形B .直角三角形C .锐角三角形D .钝角三角形 9.若正项数列{a n }满足lg a n +1=1+lg a n ,且a 2 001+a 2 002+a 2 003+…+a 2 010=2 013,则a 2 011+a 2 012+a 2 013+…+a 2 020的值为( )A .2 013×1010B .2 013×1011C .2 014×1010D .2 014×101110. 已知函数f(x)=sin(x -φ),且⎰320)(πx f dx =0,则函数f(x)的图象的一条对称轴是( )A .x =5π6B .x =7π12C .x =π3D .x =π611. 已知平面区域M ={(x ,y)|x 2+y 2≤4},N =⎩⎨⎧⎭⎬⎫(x ,y )⎪⎪⎪⎩⎪⎨⎪⎧ y ≥mx +2m ,x 2+y 2≤4,在区域M 上随机取一点A ,点A 落在区域N 内的概率为P(N),若P(N)∈⎣⎡⎦⎤12,3π+24π,则实数m 的取值范围为( )A .[0,1]B .⎣⎡⎦⎤-33,0 C .[-1,1] D .[-1,0] 12.已知a =13ln 94,b =45ln 54,c =14ln 4,下列不等式正确的是( )A .a<b<cB .b<a<cC .c<a<bD .b<c<a二、填空题(每小题5分,共20分)13.已知角θ的顶点为坐标原点,始边为x 轴的正半轴,若P (4,y )是角θ终边上一点,且sin θ=-255,则y =________.14. 函数y =⎝⎛⎭⎫14x -⎝⎛⎭⎫12x+1在x ∈[-3,2]上的值域是________.15.某地奥运火炬接力传递路线共分6段,传递活动分别由6名火炬手完成,如果第一棒火炬手只能从甲、乙、丙三人中产生,最后一棒火炬手只能从甲、乙两人中产生,则不同的传递方案共有________种.(用数字作答)16.在抛物线y =x 2上关于直线y =x +3对称的两点M ,N 的坐标分别为________.三、解答题(共70分)17.(本小题满分12分)已知△ABC 中,a ,b ,c 分别为角A ,B ,C 的对边,sin ⎝⎛⎭⎫2C -π2=12,且a 2+b 2<c 2. (1)求角C 的大小;(2)求a +bc的取值范围.18. (本小题满分12分)已知2件次品和3件正品放在一起,现需要通过检测将其区分,每次随机检测一件产品,检测后不放回,直到检测出2件次品或者检测出3件正品时检测结束.(Ⅰ)求第一次检测出的是次品且第二次检测出的是正品的概率;(Ⅱ)已知每检测一件产品需要费用100元,设X 表示直到检测出2件次品或者检测出3件正品时所需要的检测费用(单位:元),求X 的分布列和均值(数学期望).19. (本小题满分12分)如图1,在直角梯形CD AB 中,D//C A B ,D 2π∠BA =,C 1AB =B =,D 2A =,E 是D A 的中点,O 是C A 与BE 的交点.将∆ABE 沿BE 折起到1∆A BE 的位置,如图2.(I )证明:CD ⊥平面1C A O ; (II )若平面1A BE ⊥平面CD B E ,求平面1C A B 与平面1CD A 夹角的余弦值.20.(本小题满分12分)(1)P 为椭圆x 225+y 216=1任一点,F 1,F 2为左、右焦点,若∠F 1PF 2=60°,求|PF 1||PF 2|的值.(2)已知双曲线x 2-y 22=1,过点P(1,1)能否作一条直线l ,与双曲线交于A ,B 两点,且点P 是线段AB 的中点?21. (本小题满分12分)已知函数()1ln 1xf x x+=-.(Ⅰ)求曲线()y f x =在点()()00f ,处的切线方程;(Ⅱ)求证:当()01x ∈,时,()323x f x x ⎛⎫>+ ⎪⎝⎭; (Ⅲ)设实数k 使得()33x f x k x ⎛⎫>+ ⎪⎝⎭对()01x ∈,恒成立,求k 的最大值.22. (本小题满分10分)已知0,0,0a b c >>>,函数()||||f x x a x b c =++-+的最小值为4.(Ⅰ)求a b c ++的值; (Ⅱ)求2221149a b c ++的最小值.丰城中学2015-2016学年上学期高三月考试卷数 学 理 科(课改实验班)参考答案一、选择题(每小题5分,共60分)1. 若集合{|(4)(1)0}M x x x =++=,{|(4)(1)0}N x x x =--=,则MN =( )A .∅B .{}1,4--C .{}0D .{}1,4 【解析】 因为()(){}{}|4104,1M x x x =++==--,()(){}{}|4101,4N x x x =--==,所以MN =∅,故选A .2.若复数()32z i i =- ( i 是虚数单位 ),则z =( )A .32i -B .32i +C .23i +D .23i - 【解析】因为()3223z i i i =-=+,所以z =23i -,故选D .3.已知△ABC 的内角A ,B ,C 所对的边分别为a ,b ,c 且(a +b)2-c 2=4,C =120°,则△ABC 的面积为( ) A .33 B .233C .3D .2 3 解析:将c 2=a 2+b 2-2abcos C 与(a +b)2-c 2=4联立解得ab =4,∴S △ABC =12absin C = 3.答案:C4.已知数组(x 1,y 1),(x 2,y 2),…,(x 10,y 10)满足线性回归方程y ^=b ^x +a ^,则“(x 0,y 0)满足线性回归方程y ^=b ^x +a ^,”是“x 0=x 1+x 2+…+x 1010,y 0=y 1+y 2+…+y 1010”的( )A .充分不必要条件B .必要不充分条件C .充要条件D .既不充分也不必要条件解析:x 0,y 0为这10组数据的平均值,根据公式计算线性回归方程y ^=b ^x +a ^的b ^以后,再根据a ^=y -b ^x(x ,y 为样本平均值)求得a ^.因此(x ,y )一定满足线性回归方程,但满足线性回归方程的除了(x ,y )外,可能还有其他样本点.答案:B5.从原点向圆x 2+y 2-12y +27=0作两条切线,则该圆夹在两条切线间的劣弧长为( )A .πB .2πC .4πD .6π解析:如图,圆x 2+y 2-12y +27=0可化为x 2+(y -6)2=9,圆心坐标为(0,6),半径为3.在Rt △OBC 中,可得∠OCB =π3,∴∠ACB =2π3,∴所求劣弧长为2π. 故选B.6.若⎝ ⎛⎭⎪⎫3x -132x n的展开式中含有非零常数项,则这样的正整数n 的最小值是( )A .3B .4C .10D .12 解析:T r +1=C r n (3x)n -r⎝ ⎛⎭⎪⎫-132x r =C r n (3)n -r ·(-1)r⎝ ⎛⎭⎪⎫132r ·x n -r ·x -r 3 =C r n (3)n -r⎝ ⎛⎭⎪⎫-132r xn -43r , 令n -43r =0,得n =43r .∴ n 的最小值为4.答案:B 7.已知实数x >0,y >0,lg 2x +lg 8y =lg 2,则1x +1y 的最小值是( )A .23B .43C .2+3D .4+23解析:由已知得lg(2x ·8y )=lg 2,所以2x ·8y =2,即2x ·23y =2,容易知道x +3y =1,所以1x +1y =⎝⎛⎭⎫1x +1y (x +3y )=4+3y x +x y ≥4+23, 当且仅当3y x =xy 时等号成立.故选D .8.若双曲线x 2a 2-y 2b 2=1与椭圆x 2m 2+y 2b 2=1(m>b>0)的离心率之积大于1,则以a ,b ,m 为边长的三角形一定是( )A .等腰三角形B .直角三角形C .锐角三角形D .钝角三角形 解析:双曲线的离心率为e 1=a 2+b 2a ,椭圆的离心率e 2=m 2-b 2m,由题可知e 1·e 2>1,得b 2(m 2-a 2-b 2)>0,所以m 2-a 2-b 2>0,即m 2>a 2+b 2,由余弦定理可知三角形为钝角三角形,故选D .9.若正项数列{a n }满足lg a n +1=1+lg a n ,且a 2 001+a 2 002+a 2 003+…+a 2 010=2 013,则a 2 011+a 2 012+a 2 013+…+a 2 020的值为( )A .2 013×1010B .2 013×1011C .2 014×1010D .2 014×1011 解析:由条件知lg a n +1-lg a n =lga n +1a n =1,即a n +1a n=10,所以{a n }是公比为10的等比数列.因为(a 2 001+…+a 2 010)·q 10=a 2 011+…+a 2 020,所以a 2 011+…+a 2 020=2 013×1010. 故选A . 10. 已知函数f(x)=sin(x -φ),且∫2π30f(x)dx =0,则函数f(x)的图象的一条对称轴是( )A .x =5π6B .x =7π12C .x =π3D .x =π6[解析] 由定积分⎠⎜⎛02π3sin(x -φ)dx =-cos(x -φ)=12 cos φ-32sin φ+cos φ=0,得 tan φ=3,所以φ=π3+kπ(k ∈Z),所以f(x)=sin ⎝⎛⎭⎫x -π3-kπ(k ∈Z), 由正弦函数的性质知y =sin ⎝⎛⎭⎫x -π3-kπ与y =sin ⎝⎛⎭⎫x -π3的图象的对称轴相同,令x -π3=kπ+π2,则x =kπ+5π6(k ∈Z),所以函数f(x)的图象的对称轴为x =kπ+5π6(k ∈Z),当k=0时,得x =5π6,故选A. 11. 已知平面区域M ={(x ,y)|x 2+y 2≤4},N =⎩⎨⎧⎭⎬⎫(x ,y )⎪⎪⎪⎩⎪⎨⎪⎧ y ≥mx +2m ,x 2+y 2≤4,在区域M 上随机取一点A ,点A 落在区域N 内的概率为P(N),若P(N)∈⎣⎡⎦⎤12,3π+24π,则实数m 的取值范围为( ) A .[0,1] B .⎣⎡⎦⎤-33,0 C .[-1,1] D .[-1,0] [解析] 平面区域M ={(x ,y)|x 2+y 2≤4}的面积为4π,设平面区域N =⎩⎨⎧⎭⎬⎫(x ,y )⎪⎪⎪⎩⎪⎨⎪⎧ y ≥mx +2m ,x 2+y 2≤4的面积为S ,因为12≤P(N)≤3π+24π, 所以12≤S 4π≤3π+24π,即2π≤S ≤3π+2.因为直线y =mx +2m 过定点(-2,0),斜率为m ,利用数形结合,可知当m =0时,平面区域N 的面积为2π;当m =-1时,平面区域N 的面积为3π+2,所以实数m 的取值范围为[-1,0].故选D.12. 已知a =13ln 94,b =45ln 54,c =14ln 4,下列不等式正确的是( )A .a<b<cB .b<a<cC .c<a<bD .b<c<a[解析] a =13ln 94=13ln ⎝⎛⎭⎫322=23ln 32=ln3232,b =45ln 54=ln5454,c =14ln 4=14×2ln 2=ln 22.构造函数f(x)=ln x x,则a =f ⎝⎛⎭⎫32,b =f ⎝⎛⎭⎫54,c =f(2). 因为f ′(x)=1x ×x -1×ln x x 2=1-ln xx 2,由f ′(x)=0,解得x =e. 故当x ∈(0,e)时,f ′(x)>0,函数f(x)单调递增; 当x ∈(e ,+∞)时,f ′(x)<0,函数f(x)单调递减. 而54<32<2<e ,所以f ⎝⎛⎭⎫54<f ⎝⎛⎭⎫32<f(2),即b<a<c.故选B.二、填空题(每小题5分,共20分)13.已知角θ的顶点为坐标原点,始边为x 轴的正半轴,若P (4,y )是角θ终边上一点,且sin θ=-255,则y =________.解析:由P (4,y )是角θ终边上一点,且sin θ=-255,可知,y <0,|OP |=42+y 2,根据任意角的三角函数的定义,得y 42+y2=-255,化简得y 2=64,解得y =-8. 14. 函数y =⎝⎛⎭⎫14x -⎝⎛⎭⎫12x+1在x ∈[-3,2]上的值域是________.[解析] 因为x ∈[-3,2],若令t =⎝⎛⎭⎫12x ,则t ∈⎣⎡⎦⎤14,8. 则y =t 2-t +1=⎝⎛⎭⎫t -122+34. 当t =12时,y min =34;当t =8时,y max =57.所以所求函数值域为⎣⎡⎦⎤34,57. 15.某地奥运火炬接力传递路线共分6段,传递活动分别由6名火炬手完成,如果第一棒火炬手只能从甲、乙、丙三人中产生,最后一棒火炬手只能从甲、乙两人中产生,则不同的传递方案共有________种.(用数字作答)解析:分两类:第一棒是丙,有C 11·C 12·A 44=48(种);第一棒是甲、乙中一人,有C 12·C 11·A 44=48(种).因此共有方案48+48=96(种).答案:9616.在抛物线y =x 2上关于直线y =x +3对称的两点M ,N 的坐标分别为________. 解析:设直线MN 的方程为y =-x +b ,代入y =x 2中,整理,得x 2+x -b =0,令Δ=1+4b>0,∴b>-14.设M(x 1,y 1),N(x 2,y 2),则x 1+x 2=-1,y 1+y 22=-x 1+x 22+b =12+b ,由⎝⎛⎭⎫-12,12+b 在直线y =x +3上, 即12+b =-12+3,解得b =2,联立⎩⎪⎨⎪⎧ y =-x +2,y =x 2,解得⎩⎪⎨⎪⎧x 1=-2,y 1=4,⎩⎪⎨⎪⎧x 2=1,y 2=1.答案:(-2,4),(1,1) 三、解答题(共70分)17.(本小题满分12分)已知△ABC 中,a ,b ,c 分别为角A ,B ,C 的对边,sin ⎝⎛⎭⎫2C -π2=12,且a 2+b 2<c 2. (1)求角C 的大小; (2)求a +bc的取值范围. 解:(1)解法一:因为a 2+b 2<c 2,由余弦定理,得cos C =a 2+b 2-c 22ab<0,∠C 为钝角.因为sin ⎝⎛⎭⎫2C -π2=12,又π2<2C -π2<3π2,所以2C -π2=5π6,解得∠C =2π3. 解法二:因为a 2+b 2<c 2,由余弦定理,cos C =a 2+b 2-c 22ab<0,∠C 为钝角,所以π<2C<2π,又cos 2C =-sin ⎝⎛⎭⎫2C -π2=-12,所以2C =4π3,∠C =2π3. (2)解法一:由(1),得∠B =π3-∠A,0<A<π3.根据正弦定理,得a +b c =sin A +sin B sin C =sin A +sin ⎝⎛⎭⎫π3-A sin2π3=23⎣⎡⎦⎤sin A +⎝⎛⎭⎫32cos A -12sin A =23sin ⎝⎛⎭⎫A +π3. 又π3<A +π3<2π3, 所以32<sin ⎝⎛⎭⎫A +π3≤1,从而a +b c 的取值范围为⎝⎛⎦⎤1,233. 解法二:由(1)知∠C =2π3,根据余弦定理,得 c 2=a 2+b 2-2abcos2π3=a 2+b 2+ab =(a +b)2-ab ≥(a +b)2-⎝⎛⎭⎫a +b 22=34(a +b)2. 所以⎝⎛⎭⎫a +b c 2≤43,a +b c ≤233. 又a +b>c ,a +b c >1.所以a +b c 的取值范围为⎝⎛⎦⎤1,233.18. (本小题满分12分)已知2件次品和3件正品放在一起,现需要通过检测将其区分,每次随机检测一件产品,检测后不放回,直到检测出2件次品或者检测出3件正品时检测结束.(Ⅰ)求第一次检测出的是次品且第二次检测出的是正品的概率;(Ⅱ)已知每检测一件产品需要费用100元,设X 表示直到检测出2件次品或者检测出3件正品时所需要的检测费用(单位:元),求X 的分布列和均值(数学期望).故X 的分布列为X 200300400P110310610136200300400350101010EX =⨯+⨯+⨯=. 19. (本小题满分12分)如图1,在直角梯形CD AB 中,D//C A B ,D 2π∠BA =,C 1AB =B =,D 2A =,E 是D A 的中点,O 是C A 与BE 的交点.将∆ABE 沿BE 折起到1∆A BE 的位置,如图2.(I )证明:CD ⊥平面1C A O ;(II )若平面1A BE ⊥平面CD B E ,求平面1C A B 与平面1CD A 夹角的余弦值.(II)由已知,平面1A BE ⊥平面CD B E ,又由(I )知,1OA BE ⊥,C BE ⊥O所以1A OC ∠为二面角1--C A BE 的平面角,所以1OC 2A π∠=.如图,以O 为原点,建立空间直角坐标系,因为11B=E=BC=ED=1A A ,//BC ED 所以12222(,0,0),E(,0,0),A (0,0,),C(0,,0),2222B -得22BC(,,0),22- 122A C(0,,)22-,CD BE (2,0,0)==-. 设平面1BC A 的法向量1111(,,)n x y z =,平面1CD A 的法向量2222(,,)n x y z =,平面1BC A 与平面1CD A 夹角为θ,则11100n BC n A C ⎧⋅=⎪⎨⋅=⎪⎩,得111100x y y z -+=⎧⎨-=⎩,取1(1,1,1)n =,2210n CD n A C ⎧⋅=⎪⎨⋅=⎪⎩,得22200x y z =⎧⎨-=⎩,取2(0,1,1)n =, 从而1226cos |cos ,|332n n θ=〈〉==⨯,即平面1BC A 与平面1CD A 夹角的余弦值为63. 20.(本小题满分12分)(1)P 为椭圆x 225+y 216=1任一点,F 1,F 2为左、右焦点,若∠F 1PF 2=60°,求|PF 1||PF 2|的值. 解:由|PF 1|+|PF 2|=10,两边平方,得|PF 1|2+2|PF 1||PF 2|+|PF 2|2=100,①在△F 1PF 2中,由余弦定理,得|PF 1|2+|PF 2|2-2|PF 1||PF 2|cos ∠F 1PF 2=|F 1F 2|2,即|PF 1|2+|PF 2|2-|PF 1||PF 2|=36, ② ①-②,得3|PF 1||PF 2|=64,∴|PF 1|·|PF 2|=643. (2)已知双曲线x 2-y 22=1,过点P(1,1)能否作一条直线l ,与双曲线交于A ,B 两点,且点P 是线段AB 的中点?解:设点A(x 1,y 1),B(x 2,y 2)在双曲线上,且线段AB 的中点为(x 0,y 0),若直线l 的斜率不存在,显然不符合题意.设经过点P 的直线l 的方程为y -1=k(x -1),即y =kx +1-k .由⎩⎪⎨⎪⎧y =kx +1-k ,x 2-y 22=1,得(2-k 2)x 2-2k(1-k)x -(1-k)2-2=0(2-k 2≠0). ①∴x 0=x 1+x 22=k (1-k )2-k 2.由题意,得k (1-k )2-k 2=1,解得k =2. 当k =2时,方程①成为2x 2-4x +3=0.Δ=16-24=-8<0,方程①没有实数解. ∴不能作一条直线l 与双曲线交于A ,B 两点,且点P(1,1)是线段AB 的中点. 21. (本小题满分12分)已知函数()1ln 1xf x x+=-.(Ⅰ)求曲线()y f x =在点()()00f ,处的切线方程;(Ⅱ)求证:当()01x ∈,时,()323x f x x ⎛⎫>+ ⎪⎝⎭; (Ⅲ)设实数k 使得()33x f x k x ⎛⎫>+ ⎪⎝⎭对()01x ∈,恒成立,求k 的最大值.(0,1)x ∀∈,3()2()3x f x x >+成立;(Ⅲ)使()33x f x k x ⎛⎫>+ ⎪⎝⎭成立,()01x ∈,,等价于31()ln ()013x x F x k x x +=-+>-,()01x ∈,; 422222()(1)11kx k F x k x x x +-'=-+=--,当[0,2]k ∈时,()0F x '≥,函数在(0,1)上位增函数,()(0)0F x F >=,符合题意;当2k >时,令402()0,(0,1)k F x x k-'==∈, x0(0,)x0x0(,1)x()F x ' - 0 + ()F x极小值()(0)F x F <,显然不成立,综上所述可知:k 的最大值为2.22. (本小题满分10分)已知0,0,0a b c >>>,函数()||||f x x a x b c =++-+的最小值为4.(Ⅰ)求a b c ++的值; (Ⅱ)求2221149a b c ++的最小值. 【解析】(Ⅰ)因为(x)|x ||x ||(x )(x )||a |f a b c a b c b c =++++?-++=++,当且仅当a xb -#时,等号成立,又0,0a b >>,所以|a b |a b +=+,所以(x)f 的最小值为a b c ++, 所以a b c 4++=.(Ⅱ)由(1)知a b c 4++=,由柯西不等式得()()22222114912+3+1164923a ba b c c a b c 骣骣琪琪++++炒创=++=琪琪桫桫,即222118497a b c ++?. 当且仅当1132231b ac==,即8182,,777a b c ===时,等号成立 所以2221149a b c ++的最小值为87.。
2014届江西省丰城中学高三、高四段考(四月)理综试卷(含答案)

丰城中学2013-2014学年下学期高三、高四段考试卷理科综合命题人:高三理综组 2014.4.16本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
其中第Ⅱ卷第33~40题为选考题,其它题为必考题。
考生作答时,将答案写在答题卡上,在本试卷上答题无效。
第Ⅰ卷(共126分)一、选择题:本题包括13小题。
每小题6分,共78分,每小题只有一个选项符合题意。
1、低等植物细胞中心体移向两极时,下列几种酶最活跃的是( )A.RNA聚合酶和DNA聚合酶B.解旋酶和淀粉合成酶C.纤维素酶和果胶酶D.ATP水解酶和ATP合成酶2、关于高中生物学实验的基本原理,叙述不正确的是A.噬菌体须在活菌中增殖培养是因其缺乏独立的代谢系统B.提取组织DNA是利用不同化合物在溶剂中溶解度的差异C.成熟植物细胞在高渗溶液中发生质壁分离是因为细胞壁具有选择透过性D.PCR呈指数扩增DNA片段是因为上一轮反应的产物可作为下一轮反应的模板3、在机体缺氧时,肾脏产生红细胞生成酶,该酶作用于肝脏所生成的促红细胞生成素原,使其转变成促红细胞生成素(ESF)。
促红细胞生成素一方面刺激骨髓造血组织,使周围血液中红细胞数增加,从而改善缺氧;另一方面又反馈性地抑制肝脏中的促红细胞生成素原的生成(如下图所示)。
以下叙述错误的是( )A.促红细胞生成素抑制肝脏中的促红细胞生成素原的生成这种反馈属于负反馈调节,这种机制保证生物体内物质含量的稳定,不会造成浪费B.骨髓中的造血干细胞还能产生淋巴细胞,参与免疫调节C.促红细胞生成素作用的靶细胞是红细胞,红细胞数量增加可以增加携氧能力,改善缺氧D.血浆中含有较多的蛋白质,血浆渗透压的大小主要与无机盐、蛋白质含量有关4、DNA疫苗是用病原微生物中一段编码抗原的基因制成的,这段基因编码的终产物能诱导机体产生免疫反应。
以下关于DNA疫苗的叙述正确的是( )A.该疫苗能引起人体特异性免疫的原因是DNA作为抗原物质B.DNA疫苗引起免疫反应后淋巴细胞的细胞周期将变长C.DNA疫苗在人体内直接表达为抗体,起到免疫作用D.DNA疫苗引起免疫反应前必须经过转录和翻译过程5、下列为减少实验误差而采取的措施,错误的是选项实验内容减少实验误差采取的措施A 对培养液中酵母菌数量进行计数多次计数取平均值B 探索2,4—D促进插条生根的最适浓度预实验确定浓度范围C 调查人群中红绿色盲发生率调查足够大的群体,随机取样并统计D 比较有丝分裂细胞周期不同时期的时间长短观察多个装片、多个视野的细胞并统计6、下列关于种群的叙述,正确的是( )①种群是进化的基本单位②种群是繁殖的基本单位③种群是群落的基本单位④种群是物种的存在形式⑤种群可以作为研究生态系统能量流动的单位A.①②B.①②③C.①②③④D.①②③④⑤7、下列说法正确的是()A.天然气和液化石油气的主要成分都是甲烷B.甘氨酸和丙氨酸脱水,最多可生成3种二肽C.古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品D.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于自来水的净化和杀菌消毒8、化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语正确的是()A.0.5mol/L氢氧化钙溶液和0.5mol/L碳酸氢镁溶液等体积混合反应:Ca2++ OH-+ HCO3-= CaCO3↓+H2OB.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-= CaSO3↓+2HClOC.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2===2Fe3++4Br2+10Cl-D.某锂电池电极总反应为:4Li+2SOCl2 = 4LiCl+S+SO2↑,则正极反应为:2SOCl2 + 4e-= 4Cl-+S +SO2↑9、分子式为C5H12O的醇与和它相对分子质量相同的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)()种A.15 B.16 C.17 D.1810、下列说法正确的是()A. NaHCO3溶液加水稀释,C(Na+)/ C(HCO3-)的比值保持增大B. 浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:HPE B2c(Na+)=3[c(CO32-)+c(HCO3-)]C.在高锰酸钾溶液中,H+、K+、SO42—、葡萄糖分子可以大量共存D.已知:K sp(AgCl)=1.8×10-10,K sp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl11、常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。
丰城中学高三月考数学试卷

一、选择题(每题5分,共50分)1. 已知函数f(x) = 2x^3 - 3x^2 + 4x + 1,若f(2) = 9,则f(1)的值为:A. 2B. 3C. 4D. 52. 下列命题中正确的是:A. 若a > b,则a^2 > b^2B. 若a > b,则ac > bcC. 若a > b,则log_a b > log_b aD. 若a > b,则1/a < 1/b3. 在直角坐标系中,点P(m, n)在直线y = x + 1上,若m + n = 3,则点P到原点的距离为:A. √2B. √5C. √8D. √104. 若复数z满足|z - 1| = |z + 1|,则复数z的实部为:A. 0B. 1C. -1D. 25. 已知等差数列{an}的前n项和为Sn,若a1 = 2,S10 = 100,则公差d为:A. 1B. 2C. 3D. 46. 在△ABC中,角A、B、C的对边分别为a、b、c,若a = 3,b = 4,c = 5,则角A的余弦值为:A. 1/2B. 1/3C. 2/3D. 3/47. 若函数f(x) = x^2 - 2ax + a^2在区间[1, 3]上单调递减,则a的取值范围为:A. a ≤ 1B. a ≤ 2C. a ≥ 1D. a ≥ 28. 下列函数中,在定义域内连续的是:A. f(x) = |x|B. f(x) = x^2C. f(x) = 1/xD. f(x) = √x9. 已知数列{an}满足an = 2an-1 - 1,且a1 = 1,则数列{an}的通项公式为:A. an = 2^n - 1B. an = 2^nC. an = 2^n + 1D. an = 2^n - 210. 若不等式ax^2 + bx + c > 0对任意x > 0恒成立,则a、b、c的取值关系为:A. a > 0,b > 0,c > 0B. a > 0,b < 0,c > 0C. a < 0,b > 0,c > 0D. a < 0,b < 0,c > 0二、填空题(每题5分,共50分)11. 已知函数f(x) = (x - 1)^2 / (x + 1),则f(1)的值为______。
江西省丰城中学高三语文5月模拟考试试题新人教版

丰城中学2013届高三语文模拟试题本试卷分第I卷(选择题)和第II卷(综合题)两部分,共150分,考试用时150分钟。
第I卷(选择题共36分)一、(18分,每小题3分)1.下列词语中,加点的字读音全都正确的一组是()A.脊.柱(jǐ)混.沌(hùn)切.磋(qiè)装聋.作哑(lóng)B.砧.板(zhēn)宁.愿(nìng)轮毂.(hú) 以儆.效尤(jǐng)C.执拗.(niù媲.美(pì)籼(xiān)米不屈不挠.(ráo)D.褫.夺(chǐ)供.职(gòng)僭.越(jiàn)脸色刷.白(shuà)2.下列各组词语中,没有错别字的一组A.惶急遴选乌蓬船安分耐劳B.央浼绵密陆虞侯平心而论C.流弊翔实缔造者钟南捷径D.惊蛰宫绦掉书袋得鱼忘筌3.下列各句中,加点的词语使用恰当的一句是()A.2013年斯诺克球员巡回赛总决赛上,丁俊晖对阵希金森,在一度1-3落后的情况下,绝地反击,连赢三局,以4-3横扫..对手取胜。
B.让世界人民了解中国文化传统,搭建外国优秀文化展示平台,从而..以合作、理解、沟通作为文化交往的基点,来促进中外文化交流和发展。
C.这份报告详实地列举了我国10年来所取得的成果,平铺直叙....,毫不夸饰,厚重而大气,客观而准确,读来令人叹服。
D.今天表彰大会上,主持人请一位劳动模范介绍自己的事迹,这位劳模却出言无状....,脸憋得通红,只说了一句话:“其实很多同事干得比我更好。
”4.下列各项中,没有语病的一项是A.中国本土作家首获诺贝尔文学奖,不仅代表着蕴含中国特色、风格、气派的中国文学已走向世界,更标志着以莫言作品为代表的中国当代文学登上了世界文学之巅。
B.目前对于公费医疗的改革,中央只是出台了指导意见,具体执行方案由各地政府制定,各地方虽然取消了公费医疗,但也并不彻底,留下了诸多“特区”和“盲点”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
丰城中学2013-2014学年上学期高三月考试卷化 学 (理科重点班)命题人:鄢玉华 审题人:李颖 2013-11-28可能用到的相对原子质量:H-1 O-16 N-14 S-32 Cl-35.5 Na-23 Fe-56 Cu-64一、选择题(每小题只有一个正确选项16小题共48分)1.下列有关化学用语表示正确的是( )A .过氧化钠的电子式:B .氯原子的结构示意图:C .中子数为76、质子数为55的原子Cs7655D .次氯酸的分子式:HClO ;次氯酸的电子式:2.元素R 、X 、T 、Z 、Q 在元素周期表中的相对位置如下表所示,其中R 单质在暗处与H 2剧烈化合并发生爆炸。
则下列判断正确的是( )A .非金属性:Z<T<XB .氧化物的水化物的酸性:T>QC .氢化物的沸点:R <T<QD .R 与Q 原子的电子数相差263.随着科技的进步,研究和制备物质的手段和途径越来越多, H 3、O 2+、C 60、NH 5等已被发现。
下列有关说法错误的是( )A .H 3和H 2互为同素异形体B . O 2+中含有共价键 C .C 60的熔点比金刚石高 D .NH 5中可能含有离子键4.在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是( ) ①滴有石蕊的H 2SO 4溶液 ②滴有酚酞的氨水溶液③滴有酚酞的氢氧化钠溶液④滴有酚酞的饱和氢氧化钙溶液 ⑤滴有酚酞的Na 2CO 3溶液 ⑥溶有SO 2的品红溶液 A .②⑥ B .②④ C .①③⑤ D .②④⑥5.短周期元素M 、W 、X 、Y 、Z 的原子序数依次增大,M 元素的一种核素没有中子,且M 、W 、X 、Y +、Z 的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。
下列关于这些元素的叙述正确的是( )A .X 分别和其它四种元素均可形成至少2种化合物B .M 分别和W 、X 、Y 、Z 形成化合物,均显相同化合价C .M 、X 、Z 三种元素组成的化合物含有离子键D .M 、X 、Y 组成的化合物和Y 、Z 组成的化合物,其等物质的量浓度的水溶液中由水电离出的氢离子浓度相同6. 短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,元素X 的原子半径最小,Y 元素和X 元素在一定条件下能形成YX ,Z 和W 的原子序数相差8,W 原子的电子总数是其电子层数的5倍。
下列叙述正确的是( )A. 原子半径的大小顺序:rW>rZ>rY>rXB. WX 3的沸点高于ZX 3C. W 的最高价含氧酸的酸性强于Z 的最高价含氧酸的酸性D. Y 可用于制造高性能可充电电池H :O: Cl:.. .. .. .. Na +[:O ::O :]2-Na + .. ..7.短周期主族元素A 、B 、C 、D 、E 的原子序数依次递增,A 、B 两元素相邻,B 、C 、E 原子的最外层电子数之和为13,E 原子最外层电子数是B 原子内层电子数的3倍或者C 原子最外层电子数的3倍,B 、D 原子最外层电子数之和等于C 、E 原子最外层电子数之和。
下列说法正确的是( ) A . 元素B 和E 的氧化物对应的水化物均为强酸 B .C 的单质能与A 的氧化物发生置换反应C .元素C 、D 、E 的最高价氧化物对应的水化物之间均可相互反应 D .工业上常用电解元素C 、D 的氯化物来制取它们的单质 8.下列叙述中正确的是( )A .含a mol AlCl 3的溶液和含1.5a mol NaOH 的溶液,无论正滴和反滴,生成的Al(OH) 3质量相等B .含a mol Na 2CO 3的溶液和含1.5a mol HCl 的稀盐酸,无论正滴和反滴,生成的CO 2相等C .等质量的NaHCO 3和Na 2CO 3分别与足量盐酸反应,在同温同压下,生成的CO 2体积相同D .二份质量相等组成不同的铝钠合金分别投入到足量盐酸中,若放出的H 2越多,则铝的质量分数越小 9.右图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系。
该溶液的成分可能是( ) A .NH 4Al(SO 4)2 B .KAl(SO 4)2C .Al 2(SO 4)3D .Na 2SO 4与NaAlO 2组成的混合物10. 如图所示是短周期内八种元素单质的沸点与原子序数的关系图,下列说法正确的是( )A .简单离子的半径依B 、C 、D 的顺序依次减小B .上述元素中,A 的最高价氧化物对应的水化物酸性最强C .工业上可通过电解H 的熔融氯化物的方法制备H 的单质D .F 的简单离子与C 、D 的简单离子构成的化合物都是盐11.铁和氧化铁的混合物共amol ,加盐酸后固体全部溶解,共收集到bmol 氢气,且向反应后的溶液中加入KSCN 溶液不显红色,则混合物中铁的物质的量为( ) A .(a+b)/2 mol B.(a-b) mol C .(a -b)/2 mol C .(a+b) mol12. 取一定质量的均匀固体混合物Cu 、Cu 2O 和 CuO ,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g ,另一份中加入500mL 稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO 气体4.48L ,则所用硝酸的物质的量浓度为( )A .3.6mol/LB .3.2mol/LC .2.8mol/LD .缺数据无法计算13.短周期元素X 、Y 、Z 的原子序数依次递增,其原子的最外层电子数之和为11;Y 、Z 在同一周期;Z 原子最外层电子数是X 原子内层电子数的2倍,也是Y 原子最外层电子数的2倍;下列说法中,正确的是( )A .离子半径:Y>XB .气态氢化物的稳定性:Z>XC .Y 的氧化物中含有离子键D .Z 的氧化物对应的水化物是弱碱14.25℃时,向浓度均为0.1mol.L -1的Fe(NO 3)3和Al (NO 3)3混合溶液中,逐滴加入NaOH 溶液,表示生成Al (OH )3的物质的量与加入的NaOH 溶液的体积的关系如下图所示(已知当离子浓度小于1×10-5mol.L -1时为沉淀完全)。
则下列说法与判断合理的是( )A .25℃时,Fe (OH )3的溶解度大于Al (OH )3的溶解度B .25℃时,Fe (OH )3的溶度积大于Al (OH )3的溶度积C .当生成的Al (OH )3恰好完全溶解时,溶液中的溶质只有NaAlO 2D .图中2a =b =6(c -b )15.几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是()A.A的单质能将E单质从HE3的溶液中置换出来B.A、H、J的离子半径由大到小顺序是A>J>HC.G元素的单质不存在同素异形体D.I在DB2中燃烧生成两种化合物16.下列物质性质的变化规律,与共价键的键能大小无关的是()①F2、Cl2、Br2、I2的熔点、沸点逐渐升高②HF、HCl、HBr、HI的热稳定性依次减弱③金刚石、碳化硅、晶体硅熔点逐渐降低④NaF、NaCl、NaBr、NaI的熔点依次降低A. 仅④B. ①④C. ②④D. ②③二、填空题(共五大题8+8+10+11+15=52分)17. (3+3+2=8分)500mL未知浓度的稀硝酸,向其中加入铁铜的细小粉末。
加入的金属质量与放出的气体体积(已转化为标准状况下的体积)列表如下:则硝酸的物质的量浓度为 ______________, 铁铜粉末中n(Fe):n(Cu)=_________________;若要使1.92g剩余金属完全溶解,至少还需加入1mol/L的H2SO4___________________mL。
18.(1+1+3*2=8分)按要求填空(一)X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最外层电子数相同。
回答下列问题:(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式为____________,化合物ZX的电子式为____________;(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键。
此化合物可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为________________________________; (二)Na2S x在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2S x与NaClO 的物质的量之比为1︰16,则x值是__________________;(三)已知M2O n2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2O n2ˉ的还原产物中,M为+3价,又知c(M2O n2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应, 则n值为___________________.19.( 每空2分,10分)研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,C中发生反应的离子方程式为_________________________________________。
(2)实验中要持续通入氮气,否则测出的x会_______________(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式_____________________________________________________。
(5)装置D球形干燥管的作用________________________________。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x =_____________。
20.(2*4+3=11分)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X; D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4倍;C与E同主族。
