麻腮风联合减毒活疫苗
麻腮风联合减毒活疫苗 上海所 北京北生

麻腮风联合减毒活疫苗【药品名称】通用名称:麻腮风联合减毒活疫苗英文名称:Measles,Mumps and Rubella Combined Vaccine,Live汉语拼音:Ma Sai Feng Lianhe Jiadu Huoyimiao【成分和性状】本品系用麻疹病毒减毒株和腮腺炎病毒减毒株分别接种原代鸡胚细胞、风疹病毒减毒株接种人二倍体细胞,经培养、收获病毒液,按比例混合配制,加入适宜稳定剂冻干制成。
为乳酪色疏松体,复溶后为橘红色澄明液体。
有效成分:麻疹、风疹和腮腺炎减毒活疫苗。
【疫苗稀释剂】灭菌注射用水。
【接种对象】8月龄以上的麻疹、腮腺炎和风疹易感者。
【作用与用途】接种本疫苗后,可刺激机体产生抗麻疹病毒、腮腺炎病毒和风疹病毒的免疫力。
用于预防麻疹、腮腺炎和风疹。
【规格】复溶后每瓶0.5ml。
每1次人用剂量0.5ml,含麻疹和风疹活病毒均应不低于3.0lg CCID50,含腮腺炎活病毒应不低于3.7lg CCID50。
【免疫程序和剂量】(1)按标示量加入所附灭菌注射水,待疫苗复溶并摇匀后使用。
(2)于上臂三角肌下缘附着处皮下注射0.5ml。
【不良反应】常见不良反应:一般接种疫苗后24小时内,在注射部位可出现疼痛或触痛,多数情况下于2~3天内自行消失。
罕见不良反应:(1)一般接种疫苗后1~2周内,可能出现一过性发热反应。
其中为轻度发热反应,一般持续1~2天后可自行缓解,不需要处理,必要时适当休息,多喝开水,注意保暖,防止续发感染;对于重度发热反应或发热时间超过48小时者,可采用物理方法或药物对症处理。
(2)皮疹:一般接种疫苗后3~12天,可能出现散在皮疹,出疹时间一般不超过2天,通常不需要特殊处理,必要时可对症治疗。
(3)可有轻度腮腺和唾液腺肿大,一般在1周内自行好转,必要时可对症处理。
(4)重度发热反应:应采用物理方法及药物对症处理,以防高热惊厥。
极罕见不良反应:(1)过敏性皮疹:一般接种疫苗后72小时内出现荨麻疹,出现反应时,应及时就诊,给予抗过敏治疗。
一苗一训(各疫苗说明、禁忌、要求)

一、皮内注射用卡介苗说明书严禁皮下或肌内注射1、《药品名称》:通用名称:皮内注射用卡介苗2、《成份与性状》本品系用卡介苗菌经培养后收集菌体,加入稳定剂冻干制成。
为白色疏松或粉末,复溶后为均匀悬液。
本品主要成份为卡介菌,辅料包括明胶、蔗糖、氯化钾、味精。
接种对象:出生3个月以内的婴儿或用5IUPPD试验阴性的儿童(PPD 试验后48-72小时局部硬结在5mm以下者为阴性)。
3、《作用与用途》接种本疫苗后,可使机体产生细胞免疫应答,用于预防结核病。
4、《规格》每支5次人用剂量含卡介菌0.25mg.每1mg卡介菌数应不低于1.0*106cfuSSSS5、《免疫程序和剂量》(1)5次人用剂量卡介菌加入0.5ml所附稀释剂,放置约1分钟,摇动使之溶解后必须在半小时内用完。
(2用灭菌的1ml蓝心注射器(25-26号针头)吸取摇匀的疫苗,在上臂外侧三角肌中部略下处皮内注射0.1ml。
6、《不良反应》接种后2周左右,局部可出现红肿浸润,若随后化脓,形成小溃疡,可用1%龙胆紫涂抹,以防感染。
一般8-12周后结痂,如遇局部淋巴结软化形成脓疱,应及时诊治。
7、《禁忌》(1)患结核病、急性传染病、肾炎、心脏病者。
(2)患湿疹或其他皮肤病者。
(3)患免疫缺陷症者8、〈注意事项〉(1)严禁皮下或肌内注射(2)使用前请检查包装容器、标签、外观、效期是否符合要求。
疫苗瓶有裂纹者不得使用。
(3)本品重溶时间应不超过3分钟。
(4)接种对象改须详细登记姓名、性别、年龄、住址、疫苗批号及亚批号、制造单位和接种日期。
(5)接种卡介苗的注射器应专用、不得用作其他注射,以及产生化脓反应。
(6)使用时应注意避光。
9、〈贮藏〉于2-8℃避光保存和运输。
10、〈包装〉棕色安瓿,10支/盒〈有效期〉24个月二、脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞)1、〈药品名称〉通用名称:脊髓灰质炎减毒少疫苗糖丸(人二倍体细胞)2、〈成份和性状〉本品系用脊髓灰质炎病毒一、二三型减毒株分别接种于人二倍体细胞,经培养、收获病毒液后制成。
非免疫规划疫苗接种方案2023版

非免疫规划疫苗接种方案(2023年版)为科学有序开展我省非免疫规划疫苗接种工作,进一步强化规范化管理,根据《中华人民共和国疫苗管理法》等法律法规和相关文件要求,结合我省实际,制定本接种方案。
一、接种原则(一)知情、自愿原则非免疫规划疫苗是居民自愿接种的免疫规划疫苗以外的其他疫苗,接种非免疫规划疫苗是预防传染病的有效手段。
各级疾病预防控制机构和接种单位可根据本接种方案,结合辖区疾病防控需要,做好非免疫规划疫苗可预防疾病防治知识宣传和疫苗接种告知等工作。
接种单位在接种前应向受种者或其监护人充分告知,询问受种者的健康状况以及是否有接种禁忌,核对疫苗和受种者相关信息,由受种者或其监护人知情自愿接种。
(二)同时接种原则1.不同疫苗同时接种:免疫规划疫苗和非免疫规划疫苗如无特殊说明可同时接种。
如无明确证据或特殊规定,非免疫规划疫苗间可同时接种。
除动物致伤、其他外伤等特殊情形外,其他非免疫规划疫苗与免疫规划疫苗的接种时间冲突时,如未选择同时接种,应优先接种免疫规划疫苗。
2.不同疫苗接种间隔:两种及以上的注射类减毒活疫苗,如未同时接种,应间隔≥28天进行接种。
灭活疫苗和口服类减毒活疫苗,如与其他种类疫苗(包括减毒和灭活)未同时接种,原则上对接种间隔不作限制,疫苗说明书中有特别说明的情况除外。
(三)替代免疫规划疫苗原则按照《国家免疫规划疫苗儿童免疫程序及说明(2021年版)》、《非免疫规划疫苗使用指导原则(2020年版)》和我省接种方案所确定的原则,受种者或其监护人可自主选择接种含国家免疫规划疫苗成分的非免疫规划疫苗替代免疫规划疫苗。
(四)常见特殊健康状态人群接种原则常见特殊健康状态人群接种非免疫规划疫苗,参考《国家免疫规划疫苗儿童免疫程序及说明(2021年版)》确定的有关原则。
在制定非免疫规划疫苗使用技术指南和接种方案时,根据需要提供具体指导意见。
(五)记录和报告接种信息原则儿童和成人非免疫规划疫苗接种信息均要在接种单位信息系统中记录,并报告至省级和国家免疫规划信息系统。
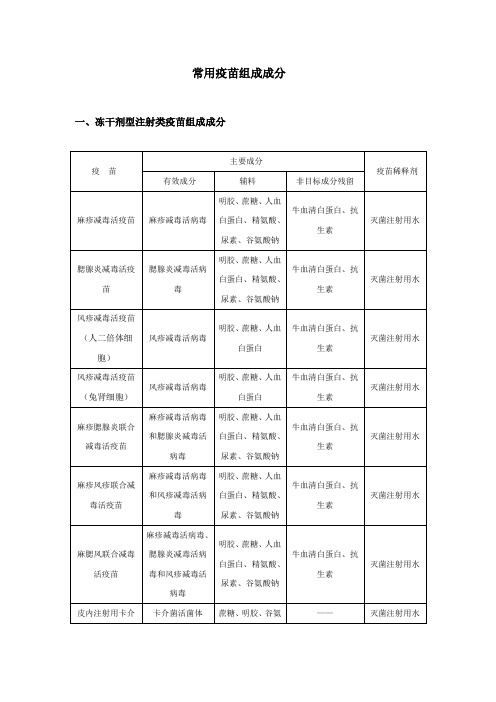
常用疫苗组成分
乳糖
核酸
灭菌、无热原PBS
A群C群脑膜炎球菌多糖疫苗
A群和C群脑膜炎球菌荚膜多糖
乳糖
苯酚
灭菌、无热原PBS
水痘减毒活疫苗
水痘减毒活病毒
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
冻干人用狂犬病疫苗
(Vero细胞)
灭活的狂犬病固定病毒
明胶、蔗糖、
人血白蛋白
Vero细胞DNA残余、宿主细胞蛋白残留、牛血清白蛋白、抗生素
白砂糖、葡萄糖、奶粉、奶油
抗生素
脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)
Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎减毒活病毒
白砂糖、葡萄糖、奶粉、奶油
抗生素
口服脊髓灰质炎减毒活疫苗(猴肾细胞)
Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎减毒活病毒
酚红、氯化镁
抗生素
口服轮状病毒活疫苗
轮状病毒减毒活病毒
蔗糖、乳糖
抗生素
卡介菌活菌体
蔗糖、明胶、谷氨酸钠
——
灭菌注射用水
乙型脑炎减毒活疫苗
乙脑减毒活病毒
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水或灭菌PBS
冻干乙型脑炎灭活疫苗(Vero细胞)
灭活的乙型脑炎病毒P3株
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素、甲醛
灭菌注射用水
冻干甲型肝炎减毒活疫苗
灭菌注射用水
人用狂犬病疫苗
(Vero细胞)
灭活的狂犬病病毒固定毒
蔗糖、硫柳汞、明胶
Vero细胞DNA残余、宿主细胞蛋白残留、牛血清白蛋白、抗生素
灭菌注射用水
人用狂犬病疫苗
(地鼠肾细胞)
麻腮风疫苗

麻腮风联合减毒活疫苗接种告知麻疹、腮腺炎、风疹都是由病毒引起的呼吸道传染病,麻疹临床表现为发热、皮疹、咳嗽、流涕等症状,重者可并发肺炎、心肌炎和脑炎;腮腺炎表现为腮腺非化脓性肿胀、疼痛,可引起脑膜炎、睾丸炎、卵巢炎等并发症,风疹表现为低热、皮疹和淋巴结肿大。
使用麻疹、腮腺炎、风疹三联活疫苗(MMR疫苗)可以有效地预防上述三种传染病的发生;麻腮风疫苗是国家免疫规划规定要求给儿童接种的疫苗。
【疫苗品种】麻腮风联合减毒活疫苗。
【作用】接种后可刺激机体产生抵抗麻疹、腮腺炎、风疹病毒的免疫力。
用于预防麻疹、风疹、流行性腮腺炎三种疾病。
【接种对象】大于8月龄麻疹、腮腺炎和风疹易感者。
【价格】免费【用法剂量】上臂外侧三角肌下缘附着处皮肤皮下注射0.5ml。
【不良反应】注射后一般无局部反应。
少数儿童可能出现一过性发热反应以及散在皮疹,一般不超过2天自行缓解。
成人接种后2-4周个别人可能出现一过性关节痛反应。
通常不需特殊处理,必要时可对症治疗。
【接种禁忌】患严重疾病、急性或慢性感染者、发热者缓种;对鸡蛋有过敏史、妊娠期妇女、对新霉素过敏及既往接种后发生过敏者、免疫力低下者、活动性未经治疗的结核病患者禁用。
为了保证您的孩子能够安全有效地接种,请向医生提供孩子目前的身体状况。
【接种后注意事项】接种后请在接种地点观察15到30分钟;注射当天不要洗澡,防止注射部位的感染;宜多饮白开水:注射后发生任何不适均可与接种医生咨询电话0745-870299。
以上内容已告知儿童家属,儿童家属对此表示理解,确认无以上禁忌症,自愿接种麻腮风联合减毒疫苗,并表示愿意承担接种疫苗可能出现的反应所产生的风险。
预约接种日期:同意接种本疫苗□不同意接种本疫苗□接种儿童姓名家长及监护人签名:接种日期:接种医生接种部位广坪中心卫生院麻腮风联合减毒活疫苗接种告知麻疹、腮腺炎、风疹都是由病毒引起的呼吸道传染病,麻疹临床表现为发热、皮疹、咳嗽、流涕等症状,重者可并发肺炎、心肌炎和脑炎;腮腺炎表现为腮腺非化脓性肿胀、疼痛,可引起脑膜炎、睾丸炎、卵巢炎等并发症,风疹表现为低热、皮疹和淋巴结肿大。
麻腮风疫苗预防接种常见的异常反应及处理方法探讨

麻腮风疫苗预防接种常见的异常反应及处理方法探讨【摘要】目的探讨麻腮风疫苗预防接种常见的异常反应及处理方法探讨。
方法选取2022年2月-2023年2月我院接待的麻腮风疫苗预防接种儿童98例,分为两组,对照组选择常规护理,研究组选择综合护理。
结果研究组不良反应发生率小于对照组(P<0.05);研究组护理满意度高于对照组(P<0.05)。
结论综合护理在麻腮风疫苗预防接种的应用效果更加显著,可以有效降低异常反应的发生频率,提高护理满意度,值得推广。
【关键词】麻腮风疫苗预防接种;异常反应;处理方法;流行性腮腺炎是一种急性呼吸道的传染病症,因为机体腮腺被腮腺炎病毒侵袭造成的,发病人群主要是青少年,一旦发病会严重影响患者的生活质量,甚至威胁其生命安全。
而预防接种是把相关的疫苗接种在健康人群的体内,让机体可以在不发病的前提下产生针对于对应疾病的一个主动免疫或者是被动免疫的过程,但是因为有些家长对预防接种和疫苗的知识缺乏足够的了解以及儿童对于接种的内心恐惧及害怕情绪,就会增加接种异常反应发生率[1]。
本文对我院接待的接种儿童可能出现的异常反应进行分析探讨,并提出有效处理办法,现报告如下。
1资料与方法1.1一般资料选取2022年1月-2022年12月我院接待的预防接种儿童98例,分为两组,对照组49例,年龄1-6岁,平均年龄(3.6±0.3)岁,其中,男28例,女21例。
研究组49例,年龄0-6岁,平均年龄(3.5.±0.2)岁,其中,男29例,女20例。
两组儿童一般资料对比无差异(P<0.05)。
1.2方法对照组选择常规护理。
在注射前帮助家长正确摆放儿童的相关注射体位,并在注射后提醒家长在留观室至少留观半小时,观察儿童是否有异常反应。
研究组选择综合护理。
①技能知识培训:预防接种的护理人员必须要经过全面的培训及考核才可以上岗,并要了解疫苗的基本知识,如疫苗种类以及级别等,还要掌握专业准确的接种技能,清楚相关的禁忌事项和常见的接种不良反应。
免疫接种的分类

免疫接种的分类免疫接种是指通过注射疫苗等方式,让人体获得对某种疾病的免疫力,从而预防该疾病的发生。
根据不同的分类标准,免疫接种可分为多种类型。
一、按接种对象分类1. 儿童免疫接种儿童免疫接种是指对出生后未满18岁的儿童进行的预防性注射。
根据国家规定,我国儿童必须完成九价HPV、脊灰灭活、百白破、麻风、麻腮风、乙肝等多个常规免疫接种。
2. 成人免疫接种成人免疫接种是指对18岁及以上成年人进行的预防性注射。
常见的成人免疫接种包括流感、肺炎球菌、水痘、带状疱疹等。
3. 老年人免疫接种老年人由于身体机能下降,抵抗力减弱,容易感染各类细菌和病毒。
因此老年人也需要进行特殊的免疫接种,如流感、肺炎球菌、带状疱疹等。
二、按接种目的分类1. 预防性免疫接种预防性免疫接种是指为了预防某些传染性疾病而进行的注射。
如乙肝、麻风、百白破等。
2. 紧急免疫接种紧急免疫接种是指在突发公共卫生事件或重大传染性疾病爆发时,为了控制和遏制传染源而进行的注射。
如新冠肺炎、埃博拉等。
3. 补充免疫接种补充免疫接种是指在原有基础上增加一次或多次的注射,以提高人体对某些传染性疾病的抵抗力。
如乙肝、HPV等。
三、按注射方式分类1. 注射剂型根据不同的剂型,可将免疫接种分为水剂和冻干粉剂两类。
水剂需要在使用前加入适量溶液,冻干粉剂则需要在使用前溶解再注射。
2. 注射部位根据注射部位的不同,免疫接种可以分为皮下注射、肌内注射、静脉注射、口服等多种方式。
四、按疫苗类型分类1. 灭活疫苗灭活疫苗是指用化学或物理方法使病原菌失去致病能力后制成的疫苗。
如脊灰灭活疫苗、乙肝灭活疫苗等。
2. 活减毒疫苗活减毒疫苗是指将致病菌经过一定的处理,使其失去致病性但仍保留免疫原性的制剂。
如麻腮风联合减毒活疫苗、水痘减毒活疫苗等。
3. 亚单位或重组蛋白疫苗亚单位或重组蛋白疫苗是指利用生物技术手段,将致敏抗原中与免疫原性相关的部分提取出来进行制备的一类免疫接种。
如九价HPV、流感亚单位等。
儿童接种麻腮风联合减毒活疫苗的安全性及免疫学疗效观察

儿童接种麻腮风联合减毒活疫苗的安全性及免疫学疗效观察作者:于丹汪静来源:《中国当代医药》2017年第30期[摘要]目的观察儿童接种麻腮风联合减毒活疫苗的临床安全性以及免疫学疗效。
方法随机抽取江西省鹰潭市疾病预防控制中心2016年1~12月进行麻疹、腮腺炎以及风疹减毒活疫苗接种的400例儿童作为研究对象,根据疫苗接种情况进行分组,其中100例儿童进行麻疹减毒活疫苗接种,100例儿童进行腮腺炎减毒活疫苗接种,100例患者进行风疹减毒活疫苗接种,100例儿童进行麻腮风联合减毒活疫苗接种。
观察各组儿童接种后30 min内的不良反应(皮疹、发热、恶心呕吐、纳差、腹泻等)发生情况,应用抗体滴度进行免疫学疗效评价,并比较各组儿童的几何平均滴度。
结果麻腮风联合减毒活疫苗接种后的不良反应发生率为9.00%(9/100),与其他组比较,差异无统计学意义(P>0.05)。
麻腮风联合减毒活疫苗组儿童疾病免疫后风疹的几何平均滴度为1∶31,与风疹疫苗组免疫后的几何平均滴度1∶29比较,差异有统计学意义(P0.05)。
结论儿童接种麻腮风联合减毒活疫苗的预防效果确切,与单一麻疹疫苗、腮腺炎疫苗以及风疹疫苗相比,不会提高不良反应发生率,临床用药安全可靠,但从免疫学疗效来看,麻腮风联合减毒活疫苗预防接种会导致风疹的几何平均滴度上升,必须引起临床人员的重视。
[关键词]麻腮风联合减毒活疫苗;疫苗接种;安全性;免疫学[中图分类号] R186 [文献标识码] A [文章编号] 1674-4721(2017)10(c)-0157-04Safety and immunological curative effect observation of measles,mumps,and rubella combined attenuated live vaccination in childrenYU Dan WANG JingCenter for Disease Control and Prevention of Yingtan City in Jiangxi Province,Yingtan 335001,China[Abstract]Objective To observe the clinical safety and immunological curative effect of measles,mumps,and rubella combined attenuated live vaccination in children.Methods A total of 400 children who were vaccinated against measles,mumps and rubella live vaccines were randomly selected from January 2001 to December 2016 in the Center for Disease Control and Prevention of Yingtan City in Jiangxi Province.According to the vaccination grouping,100 cases of children vaccinated against live attenuated measles,100 cases of children with mumps attenuated live vaccination,100 patients were given rubella live attenuated vaccination,100 cases of children were given measles,mumps,and rubella combined attenuated live vaccination.The incidence of adverseevents such as rash,fever,nausea and vomiting,anorexia and diarrhea were observed within 30 min after inoculation.Immunological evaluation was carried out by using antibody titer,and the geometric mean titer of each group was compared.Results The incidence of adverse reactions after inoculation was 9.00% (9/100),compared with other groups,the difference was not statistically significant (P>0.05).The average geometric titers of rubella after immunization in children with measles,mumps,and rubella combined attenuated live vaccination were 1:31,and compared with the average geometric titers of rubella vaccine group (1:29),there was significant difference (P0.05).Conclusion The preventive effect of measles,mumps,and rubella combined attenuated live vaccination is definite,compared with single measles vaccine,mumps vaccine and rubella vaccine,there is no increase in the incidence of adverse reactions,and clinical treatment is safe and reliable,but from the point of view of immunological efficacy,measles,mumps,and rubella combined attenuated live vaccination will lead to rubella geometric mean titer rise,and must pay attention to clinical staff.[Key words]Measles,mumps,and rubella combined attenuated live vaccination;Vaccination;Safety;Immunology麻疹、腮腺炎以及风疹是临床常见的传染性疾病,已有大量临床报道中显示,麻疹、腮腺炎以及风疹属于儿童群体中传播风险较高的病毒性感染疾病,具有传播速度快、病情进展速度快的特点,且麻疹临床症状危重,对患儿生命安全有一定的威胁[1-3]。
麻腮风减毒活疫苗严重异常反应中长期监测研究实施方案(2011.6.14)

50%>48小时,稍影响活动
正常活动减弱>50%,严重影响日常活动不能工作
不能自理,急诊或住院
恶心、呕吐
1~2次/24小时,摄入基本正常且不影响活动
2~5次/24小时,摄入显著降低,或活动受限
24小时内>6次,无明显摄入,需静脉输液
由于低血压休克需要住院或其他途径营养
腹泻
轻微或一过性,2~3次稀便/天,或轻微腹泻持续小于1周
2.转归(填写数字):1.恢复;2.尚未恢复;3.恢复但有后遗症;4.死亡;5.失访
附表3MMR疫苗接种疑似预防接种异常反应观察汇总表(市/县通用)
市县(市、区)乡(镇、街道)年月登记人:
沪MMR(人数)
史克MMR(人数)
合计
1级
2级
3级
4级
合计
1级
2级
3级
4级
完成接种人数累计
接种满1个月的总人数
红肿
九
省疾控中心负责本项目的联系人:何寒青,0571-,hqhe@;严睿,,0571-,ryan@;
请各市负责尽快确定本项目的联系人,发邮件至省疾控中心项目联系人。
浙江省疾病预防控制中心
二○一一年六月
附表1MMR疫苗使用一览表
市县(市、区)乡(镇、街道)
日期
(年/月)
四、进度安排
时间
内容
2011年1~3月
制定研究现场实施方案,完成项目地区的协调和疫苗分发。
2011年4~6月
召开项目启动会议,对工作人员培训;
项目的实施、督导
2011年7~2012年6月
完成疫苗接种后AEFI、严重异常反应等相关数据资料收集
2012年7-10月
完成相关资料整理、分析和总结
麻腮风接种实施方案

衡阳县麻腮风联合减毒活疫苗接种实施方案麻疹、流行性腮腺炎(以下简称腮腺炎)、风疹是分别由麻疹病毒、腮腺炎病毒、风疹病毒所引起的三种急性呼吸道传染病。
今年1-7月,全市麻疹发病较去年同期比较上升100%,风疹发病较去年同期比上升了165%,腮腺炎较去年同期比上升了147.8%,疫情呈现迅速上升趋势,并引发了2起突发公共卫生事件,我县今年也确诊1例麻疹,报告腮腺炎153例,因风疹、腮腺炎引起学校疫情暴发5起。
为遏制全县风疹和腮腺炎疫情迅速上升势头,提高人群免疫水平,缓解2012年消除麻疹鉴别诊断和证实工作压力,确保2012年消除麻疹的工作目标,根据卫生部《2010-2012年全国消除麻疹行动方案》(卫疾控发【2010】65号)和省疾控中心《关于加强流行性腮腺炎防控工作的通知》(湘疾控【2011】5号)、《关于做好疫苗可控重点传染病免疫接种工作的通知》(湘疾控【2011】17号)以及衡阳市卫生局、衡阳市教育局《关于切实做好学校、托幼机构秋冬季节传染病预防控制工作的通知》(衡卫发【2011】188号)要求,经县教育局、卫生局党组研究,决定在全县范围内开展麻腮风三联疫苗预防接种活动。
为确保活动顺利开展,特制定本方案。
一、接种对象2008年7月1日前出生未接种过两剂次含麻疹、风疹、腮腺炎成份疫苗的人群。
2008年7月1日后出生儿童属国家免疫规划疫苗接种对象,如未接种两剂次含麻疹成份疫苗应免费补种,待本次自费补种工作完成后再安排。
二、时间安排8月23日前召开组织动员会、业务培训会。
8月25日前完成上报疫苗定购计划。
8月28日前发放资料。
9月4日前完成村级培训,受种对象、儿童家长或监护人的宣传发动、摸底造册工作,疫苗到乡镇。
9月5至18日完成集中接种。
9月30日前,上报接种情况汇总表与总结和回款。
三、接种方式以村为单位设立接种点,结合秋季儿童入托入学预防接种证查验、补种工作一并进行,各接种单位采取在规定时间、规定地点集中接种的模式。
谈“麻腮风疫苗”色变,一篇了解麻腮风疫苗不良反应

谈“麻腮风疫苗”色变,一篇了解麻腮风疫苗不良反应宝宝出生后,需要不停地接种各种疫苗,如乙肝疫苗、脊灰疫苗等,而其中最让宝爸宝妈害怕的就是麻腮风疫苗。
由于麻腮风疫苗属于减毒活疫苗,宝宝在接种后经常会出现一些不良反应,这也导致很多家长将麻腮风疫苗称之为“毒苗、苗王”,家长一听到麻腮风疫苗就会出现“色变”的情况。
那么麻腮风疫苗究竟有什么作用?它的不良反应到底有哪些?下面进行简单介绍。
1.麻腮风疫苗是什么?有什么作用?麻腮风疫苗的全称为麻疹腮腺炎联合减毒活疫苗(MMR疫苗),是一种可以预防麻疹、风疹、流行性腮腺炎这三种呼吸道传染病的三联疫苗。
麻疹属于儿童最常见的一种急性呼吸道传染疾病,目前还没有治疗麻疹的特效药物,而接种疫苗可以很好的降低麻疹感染率。
腮腺炎是由于腮腺炎病毒引发的急性呼吸道传染疾病,宝宝如果感染了腮腺炎病毒,会出现脸部肿大疼痛。
风疹是由风疹病毒引发的急性呼吸道传染病,目前并没有治疗风疹的良好方案,以接种疫苗预防为主。
通过接种麻腮风疫苗,可以达到预防以上三种疾病的作用,并且预防效果良好,有的父母担心宝宝接种麻腮风疫苗后出现各种不良反应,不愿意让宝宝接种麻腮风疫苗。
而事实上,这种行为属于典型的因噎废食,因为风疹、腮腺炎、麻疹等疾病,不管宝宝感染哪一种,都会对身体造成较大危害,所以及时带领宝宝接种疫苗十分重要。
1.麻腮风疫苗如何接种?我国于2020年6月,将麻腮风疫苗和腮腺炎疫苗接种合并在一起,宝宝可以在8月龄及18月龄免费接种国家的麻腮风疫苗。
第一针麻腮风疫苗建议一般需要在宝宝12月龄前完成接种,而第二针麻腮风疫苗则需要在24月龄前完成接种。
如果家长没有按时带领宝宝接种麻腮风疫苗,还可以按照相应补种程序,在规定时间内带领宝宝补种麻腮风疫苗。
补种麻腮风疫苗时需要特别注意,如果是接种两剂疫苗,中间需要间隔最少一个月;如果接种了新冠病毒疫苗,则需要间隔14天以后进行麻腮风疫苗接种。
在完成麻腮风疫苗接种后,需要留观30分钟后,确认宝宝没有不良反应后离开回家,如果在此期间出现异常情况,应该及时与接种医师进行交流沟通。
麻腮风疫苗
二、腮腺炎病毒
腮腺炎病毒属副黏病 毒科, 为RNA病毒,呈 球形, 直径为100~ 200nm。包膜上有神 经氨酸酶、血凝素及 具有细胞融合作用的F 蛋白。该病毒仅有一 个血清型, 因与副流感 病毒有共同抗原, 故有 轻度交叉反应。
腮腺炎病毒对热极不 稳定, 56 ℃,30min 即被灭活, 具有不耐酸, 易被脂溶剂灭活的特 点。从患者的唾液、 脑脊液、血、尿、脑 和其组织中均可分离 出病毒, 在猴肾、人羊 膜和Hela 细胞中均可 增殖。自然界中人是 其唯一的病毒宿主, 普 遍易感, 易感性随年龄 的增加而下降。
(6)RIT 4385 株 由比利时史克从市售的单价 JL 腮腺炎疫苗, 通过终末稀释法获得的腮腺 炎疫苗病毒株。在CEC 中制备疫苗。
S79株腮腺炎病毒
20 世纪90 年代以来, S79 株腮腺炎疫苗 在中国已被广泛使用, 其临床反应轻微。 上海生物制品研究所建立的S79株腮腺炎 病毒株, 在国内已广泛应用, 特别是20 世纪 90 年代以来, 上海、北京、兰州等生物制品 研究所都用S79株制造疫苗, 该毒株具有病 毒滴度较高, 免疫原性较好,而临床反应轻的 特点, 各地使用后的抗体阳转率达82.6%~ 88.6%。
不同基因型MuV的分布具有地域性,其中 C~E、G、H基因型主要出现在西半球,而B、 F、I、L基因型主要出现在亚洲。中国的 MuV主要流行株为F基因型。
发病机制
腮腺炎病毒感染后, 首先侵入上呼吸道及 眼结合膜, 在局部黏膜上皮组织中大量增殖 后始入血循环( 初次病毒血症) , 经血流累及 腮腺及一些组织, 在这些器官中进行增殖后, 再次入血( 二次病毒血症)波及涎腺、睾丸、 卵巢、胰腺、肝脏及中枢神经系统等。 流行性腮腺炎病毒对腮腺有特别亲合力, 故腮腺的非化脓性炎症为主要病变。
常用疫苗组成成分

海藻糖、谷氨酸钠、精氨酸、抗坏血酸、低分子右旋糖苷、山梨醇、甘露醇
牛血清白蛋白、三氯甲烷、抗生素
灭菌注射用水
甲型肝炎灭活疫苗(人二倍体细胞)
灭活的甲型肝炎病毒
氢氧化铝、注射用氨基酸、磷酸二氢钾、聚山梨醇酯20、氯化钾、氯化钠
牛血清白蛋白、抗生素、甲醛
灭菌注射用水
A群脑膜炎球菌多糖疫苗
风疹减毒活疫苗(人二倍体细胞)
风疹减毒活病毒
明胶、蔗糖、人血白蛋白
牛血清白蛋白、抗生素
灭菌注射用水
风疹减毒活疫苗(兔肾细胞)
风疹减毒活病毒
明胶、蔗糖、人血白蛋白
牛血清白蛋白、抗生素
灭菌注射用水
麻疹腮腺炎联合减毒活疫苗
麻疹减毒活病毒和腮腺炎减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
常用疫苗组成成分
一、冻干剂型注射类疫苗组成成分
疫苗
主要成分
疫苗稀释剂
有效成分
辅料
非目标成分残留
麻疹减毒活疫苗
麻疹减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
腮腺炎减毒活疫苗
腮腺炎减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
灭活的I型和II型肾综合征出血热病毒源自氢氧化铝、硫柳汞、人白蛋白甲醛
双价肾综合征出血热灭活疫苗(沙鼠肾细胞)
灭活的I型和II型肾综合征出血热病毒
氢氧化铝、硫柳汞、人白蛋白
β-丙内酯
三、口服疫苗组成成分
疫苗
主要成分
有效成分
辅料
麻腮风联合减毒活疫苗(天坛生物)

感染腮腺炎的主要危害
(一) 对腺体的危害 腮腺肿大 颌下及舌下腺炎 附睾炎 卵巢炎 胰腺炎 (二) 对神经系统的危害 CSF中淋巴球升高 无菌性脑膜炎 脑炎 耳聋 (三) 其他危害 轻度肾功能不正常 心电图不正常
引自 Bull WHO 1999年 77(1):5
60-70% 10% 25% 5% 4%
13
腮腺炎的控制
英国:数学模型研究,儿童2岁时接种率应超过85-90%,才 能消除流行 研究显示,第二剂MMR接种前27%的人抗体阴转,接种第二 剂使其中97%血清阳转 12岁的儿童腮腺炎病毒抗体阴性率从13%增加到39%,表明 疫苗广泛应用后自然感染减少,有必要进行第二次免疫。
北欧消除腮腺炎
Company Logo
美国消除风疹
风疹报告病例高峰:1969年57686例(58/10万) 1969年:风疹疫苗开始在儿童中使用,发病率迅速下降 但是,儿童免疫大约只保护50%的人群,血清学检测证实 在青年和成人中有12-24%的血清阴性率 开展青少年和成人接种 1989年,儿童免疫采用两剂次MMR 1992年157例;1995年128例;2003年7例 2004年10月,CDC:风疹不再是美国的地方流行病!
12月龄以上 12月龄以上 不能用于初 不能用于初 免 免
特点之二—毒株
麻疹:沪191--上海典型病例儿童分离
国内免疫规划麻疹疫苗毒株 风疹:BRDⅡ--北京典型病例儿童分离 国内使用十一年 腮腺炎:沪S79 --与国外疫苗毒株基因分析同源
Company Logo
1965年后麻疹疫苗的使用
京MMR
默沙东 单价苗
41
38 28
100
《最新整理》麻风腮疫苗

麻风腮疫苗现代人看病少不了吃药和打针。
但是对于某些人来说,总是免不了要胆怯地问到:“可以不打针吗?”对于麻风腮疫苗,也有不少人咨询:麻风腮疫苗必须打吗?想知道答案,请往下看吧!麻风腮疫苗是必须打的。
因为麻疹、风疹和流行性腮腺炎都是呼吸道疾病,可以通过空气传播,传染性很强,在学校这样的人群聚居地非常容易传播开来,一个孩子得了往往会传给很多一起上学的同学。
而且麻疹的并发症多且严重,是造成儿童早期死亡的主要原因之一。
据资料显示,在不发达的国家,麻疹死亡人数占5岁以下儿童死亡原因的第3位,麻疹患儿可能并发肺炎、中耳炎、脑炎。
即使痊愈,有的患儿也会出现智力发育迟缓、耳聋或其他神经系统疾患等后遗症。
另外,麻疹、风疹和流行性腮腺炎在初起阶段和SARS非常相似,也有像高热、白血球突然大量减少等症状,有被当成疑似病例的可能性。
而接种疫苗后,绝大多数的孩子会产生抗体,可以减少进入发热门诊的概率,提高自身的抗病能力。
所以专家建议家长和学校要在接种程序内给孩子们补种疫苗,减少在明年春季发生这些发热类疾病的机会。
麻风腮疫苗,顾名思义,就是针对麻风腮来进行预防与治疗的。
但是,麻风腮疫苗的作用是什么?它具体是怎样起作用的?很多人都说不出来。
我们赶紧来看看吧!“麻风腮”是麻疹、风疹和腮腺炎的简称,“麻风腮疫苗”是一种用于预防麻疹、风疹和腮腺炎的三联疫苗。
这三种病都是传染性疾病,而且都是由病毒引起的呼吸道传染病。
不仅儿童容易传染,就是怀孕妇女在妊娠早期感染了风疹病毒,也可引起胎儿的先天性风疹综合征,使新生儿出现失明、先心病、智力发育障碍等先天畸形;或肾炎、血小板减少性紫癫等后天性障碍;还可能引起早产、流产和胎死腹中等情形。
此外,有些成年人如果得了腮腺炎,可并发腮腺炎脑炎、心肌炎、睾丸炎、卵巢炎、肾炎、糖尿病及淋巴结炎等;还有人如果得了风疹,可引发肺炎、脑膜炎。
这样看来,联合疫苗的应用是预防传染病的有效手段。
我们已经了解了麻风腮疫苗的作用,那么是不是每个人都适宜打麻风腮疫苗呢?不清楚的妈妈们,赶紧看看吧!根据中国麻疹、流行性腮腺炎和风疹的流行情况,建议对以下人群进行接种:1、首先对1~14岁的儿童进行普种。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
麻腮风联合减毒活疫苗
Ma Sai Feng Lianhe Jiandu Huoyimiao
Measles,Mumps and Rubella Combined Vaccine, Live
本品系用麻疹病毒减毒株和腮腺炎病毒减毒株分别接种原代鸡胚细胞、风疹病毒减毒株接种人二倍体细胞,经培养、收获病毒液,按比例混合配制,加入适宜稳定剂冻干后制成。
用于预防麻疹、腮腺炎和风疹。
1 基本要求
生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”有关要求。
2 制造
2.1单价原液制备
2.1.1 麻疹病毒原液制备
应符合“麻疹减毒活疫苗”中2.1-2.3项的规定。
2.1.2 腮腺炎病毒原液制备
应符合“腮腺炎减毒活疫苗”中2.1-2.3项的规定。
2.1.3 风疹病毒原液制备
应符合“风疹减毒活疫苗(人二倍体细胞)”中2.1-2.3项的规定。
2.2 单价原液检定
2.2.1麻疹病毒原液检定
除按“麻疹减毒活疫苗”中3.2项进行外,还应按本标准3.1.1项进行检定。
2.2.2腮腺炎病毒原液检定
除按“腮腺炎减毒活疫苗”中3.2项进行外,还应按本标准3.1.2项进行检定。
2.2.3 风疹病毒原液检定
除按“风疹减毒活疫苗”中3.2项进行外,还应按本标准3.1.3项进行检定。
2.4 半成品
2.4.1配制
将检定合格的麻疹、腮腺炎和风疹单价原液根据病毒滴度按一定比例进行配制,其中麻疹和风疹病毒滴度比例应为1:1,腮腺炎病毒滴度至少是麻疹或风疹病毒滴度的5倍。
加入适宜的稳定剂后即为半成品。
2.4.2 半成品检定
按3.2项进行。
2.5 成品
2.5.1 分批
应符合“生物制品分批规程”规定。
2.5.2 分装及冻干
应符合“生物制品分装和冻干规程”规定。
分装过程中的半成品疫苗应于2-8℃放置。
2.5.3 规格
复溶后每瓶0.5ml。
每1次人用剂量为0.5ml,含麻疹和风疹活病毒均应不
低于3.0Lg CCID
50,含腮腺炎活病毒应不低于3.7Lg CCID
50。
2.5.4 包装
应符合“生物制品包装规程”规定。
3检定
3.1 原液检定
3.1.1麻疹病毒原液检定
3.1.1.1鉴别试验
将麻疹病毒原液进行适当稀释(病毒量为500-2000 CCID
50
/ml),与适当稀释的麻疹病毒免疫血清等量混合后,置37℃中和60分钟,接种FL细胞或Vero 细胞,在适宜的温度下培养7~8天判定结果。
麻疹病毒应被完全中和(无细胞病变);同时设血清和细胞对照,均应为阴性;病毒对照的病毒滴度应不低于500
CCID
50
/ml。
3.1.1.2 牛血清白蛋白残留量
应不高于50ng/ml(附录VIII F)。
3.1.2 腮腺炎病毒原液检定
3.1.2.1 鉴别试验
将腮腺炎病毒原液进行适当稀释(病毒量为500~2000 CCID
50
/ml),与适当稀释的腮腺炎病毒免疫血清等量混合后,置37℃中和60分钟,接种FL细胞或 Vero细胞,在适宜的温度下培养8~10天判定结果。
腮腺炎病毒应被完全中和(无细胞病变);同时设血清和细胞对照,均应为阴性;病毒对照的病毒滴
度应不低于500 CCID
50
/ml。
3.1.2.2 牛血清白蛋白残留量
应不高于50ng/ml(附录VIII F)。
3.1.3 风疹病毒原液检定
3.1.3.1 鉴别试验
将风疹病毒原液进行适当稀释(病毒量为100~500 CCID
50
/ml),与适当稀释的风疹病毒免疫血清等量混合后,置37℃中和60分钟,接种RK-13细胞,置32℃培养7~10天判定结果。
风疹病毒应被完全中和(无细胞病变);同时设血清
和细胞对照,均应为阴性;病毒对照的病毒滴定应不低于100 CCID
50
/ml。
3.1.3.2 牛血清白蛋白残留量
应不高于50ng/ml(附录VIII F)。
3.2 半成品检定
无菌检查
依法检查(附录XII A),应符合规定。
3.3 成品检定
除水分测定外,应按标示量加入灭菌注射用水,复溶后进行其余各项检定。
3.3.1 鉴别试验
鉴别试验应与病毒滴定同时进行。
将适当稀释的麻疹病毒、腮腺炎病毒和风疹病毒免疫血清混合后,与经适当稀释的疫苗供试品(稀释至风疹病毒含量为100~500CCID
50
/ml)混合,于适宜温度中和一定时间后,分别接种Vero细胞和RK-13细胞,再分别于37℃±1℃和32℃±1℃培养7-10天后判定结果。
麻疹、腮腺炎和风疹病毒应被完全中和,不应出现任何细胞病变。
同时设血清和细胞对照,均应为阴性;病毒对照应为阳性。
3.3.2 外观
应为乳酪色疏松体,复溶后为橘红色或淡粉红色澄明液体,无异物。
3.3.3 水分
应不高于3.0%(附录 VII D)。
3.3.4 病毒滴定
取疫苗3~5瓶复溶后混合滴定,并应同时进行病毒参考品滴定。
麻疹病毒滴定:供试品经腮腺炎病毒和风疹病毒免疫血清中和腮腺炎病毒和风疹病毒后,在Vero细胞上滴定麻疹病毒,麻疹病毒滴度应不低于 3.3
LgCCID
50
/ml;
腮腺炎病毒滴定:供试品经麻疹病毒和风疹病毒免疫血清中和麻疹病毒和风疹病毒后,在Vero细胞上滴定腮腺炎病毒。
腮腺炎病毒滴度应不低于 4.0
LgCCID
50
/ml;
风疹病毒滴定:供试品经腮腺炎病毒和麻疹病毒免疫血清中和腮腺炎病毒和麻疹病毒后,在RK-13细胞上进行风疹病毒滴定。
风疹病毒滴度应不低于3.3
LgCCID
50
/ml。
3.3.5 热稳定性试验
疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。
于37℃放置7
天后,按3.3.4项进行,麻疹病毒滴度应不低于3.3 LgCCID
50
/ml,腮腺炎病毒
滴度应不低于4.0 LgCCID
50/ml,风疹病毒滴度应不低于3.3 LgCCID
50
/ml,各
病毒滴度下降均应不高于1.0 Lg。
3.3.6 牛血清白蛋白残留量
应不高于50ng/剂(附录VIII F)。
3.3.7 无菌检查
依法检查(附录XII A),应符合规定。
3.3.8 异常毒性检查
依法检查(附录XII F),应符合规定。
3.3.9抗生素残留量检查
细胞制备过程中加入抗生素的应进行该项检查,采用酶联免疫法,应不高于10ng/ml。
4 保存、运输及有效期
于2-8℃避光保存和运输。
自生产之日起,有效期为18个月。
5 疫苗稀释剂
疫苗稀释剂为灭菌注射用水,应符合对疫苗稀释剂有关要求。
5.1疫苗稀释剂装量
5.2 疫苗稀释剂包装
5.3 疫苗稀释稀释剂有效期
5.4 疫苗稀释剂批准文号
5.5 疫苗稀释剂生产企业
6说明书
(注:本资料素材和资料部分来自网络,仅供参考。
请预览后才下载,期待您的好评与关注!)。
