(完整版)化学方程式的书写专题练习
化学式书写练习
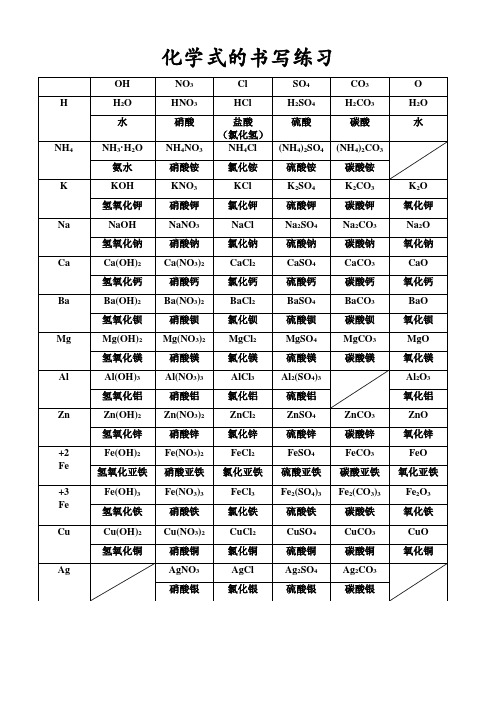
NO3
Cl
SO4
CO3
O
H
H2O
HNO3
HCl
H2SO4
H2CO3
H2O
水
硝酸
盐酸
(氯化氢)
硫酸
碳酸
水
NH4
NH3·H2O
NH4NO3
NH4Cl
(NH4)2SO4
(NH4)2CO3
氨水
硝酸铵
氯化铵
硫酸铵
碳酸铵
K
KOH
KNO3
KCl
K2SO4
K2CO3
K2O
氢氧化钾
硝酸钾
氯化钾
硫酸钾
碳酸钾
氧化钾
Na
NaOH
NaNO3
NaCl
Na2SO4
Na2CO3
Na2O
氢氧化钠
硝酸钠
氯化钠
硫酸钠
碳酸钠
氧化钠
Ca
Ca(OH)2
Ca(NO3)2
CaCl2
CaSO4
CaCO3
CaO
氢氧化钙
硝酸钙
氯化钙
硫酸钙
碳酸钙
氧化钙
Ba
Ba(OH)2
Ba(NO3)2
BaCl2
BaSO4
BaCO3
BaO
氢氧化钡
硝酸钡
氯化钡
硫酸钡
Cu(NO3)2
CuCl2
CuSO4
CuCO3
CuO
氢氧化铜
硝酸铜
氯化铜
硫酸铜
碳酸铜
氧化铜
Ag
AgNO3
AgCl
Ag2SO4
Ag2CO3
硝酸银
氯化银
硫酸银
碳酸银
初中化学书写化学方程式实验题专题训练含答案

初中化学书写化学方程式实验题专题训练含答案姓名:__________ 班级:__________考号:__________一、实验题(共10题)) 中的一种。
根据下图回答问题:1、实验室制取 X 气体,该气体为氢气、氧气、氯气 (Cl2(1) 用高锰酸钾制取并收集氧气:①该反应的化学方程式为 _______ 。
②用 D 装置收集氧气,检验收集满的方法 _______ 。
③改用 E 装置 ( 如图放置 ) 收集氧气,气体应从 _______ 端 ( 填“a” 或“b”) 通入。
(2) ①实验室制取并收集氢气,可选用发生装置 _______ ( 填字母 ) 和收集装置 F 的组合;②实验室常用二氧化锰粉末和浓盐酸在加热条件下制取氯气,可选用的发生装置为 __ ( 填字母 ) 。
2、根据下列装置图,回答问题:(1) 仪器a 的名称是___________ 。
(2) 实验室某小组选取B 装置作为发生装置制取氧气,则反应的化学方程式为___________ 。
(3) 若选取F 装置,采用排空气法收集氧气,氧气应从___________ 端( 填“m” 或“n”) 通入。
3、化学是一门以实验为基础的科学。
根据下图回答问题。
( 1 )仪器 a 的名称是 ___________ 。
( 2 )实验室制取氢气的化学反应方程式为 ______ ,若要获得平稳气流,应选择的发生装置是 ________ ,用 F 装置收集氢气,当观察到 ________ 的现象时再开始收集。
( 3 )写出实验室用 C 装置制取氧气的化学方程式 _______ ,用装置 D 收集氧气时,其验满的方法是 _______ 。
( 4 )甲烷是一种没有颜色、没有气味、难溶于水、密度比空气小的气体。
实验室常用加热碱石灰(氧化钙和氢氧化钠固体的混合物)和醋酸钠固体制取甲烷气体,应选用的发生装置是 ________ (填标号,下同),若用 G 装置收集时,则气体要从 _______ 端通入。
化学方程式的书写练习

化学方程式的书写练习
一、化合反应:
1、碳在氧气中完全燃烧生成二氧化碳、
2、碳在氧气中不完全燃烧生成一氧化碳、
3、一氧化碳在氧气中点燃生成二氧化碳、
4、二氧化碳在灼热的碳中生成一氧化碳、
5、往水中通入二氧化碳,生成碳酸、
6、铁在氧气中点燃生成四氧化三铁、
7、磷在氧气中点燃生成五氧化二磷、
8、铜在空气中加热生成氧化铜、
9、硫在氧气中点燃生成二氧化硫、
10、二氧化硫加水生成亚硫酸、
11、二氧化硫在空气中氧化为三氧化硫、
12、三氧化硫通入水中生成硫酸、
13、无水硫酸铜粉末中加水中生成五水硫酸铜、
14、氢气在空气中点燃生成水、
15、氢气在氯气中点燃生成氯化氢气体、
16、氧化钙加水生成氢氧化钙、
二、分解反应:
17、在二氧化锰的催化作用下加热氯酸钾,生成氯化钾和氧气、
18、加热高锰酸钾,生成锰酸钾、二氧化锰和氧气、
19、电解水,生成氢气和氧气、
20、在二氧化锰的催化作用下分解双氧水,生成水和氧气、
21、加热碳酸,分解为二氧化碳和水、
22、碳酸钙高温生成氧化钙和二氧化碳、
23、加热五水硫酸铜生成硫酸铜和水、
24、碳酸氢钠加热生成碳酸钠、水和二氧化碳、
25、加热碱式碳酸铜,生成氧化铜、水和二氧化碳、。
初中化学方程式书写专题练习

化学方程式的书写练习一、化合反应:1、镁条在氧气中燃烧:2、红磷在氧气中燃烧:3、铁在氧气中燃烧:4、二氧化碳在灼热的碳中生成一氧化碳:5、往水中通入二氧化碳,生成碳酸:6、铁在氧气中点燃生成四氧化三铁:7、磷在氧气中点燃生成五氧化二磷:8、铜在空气中加热生成氧化铜:9、硫在氧气中点燃生成二氧化硫:10、二氧化硫加水生成亚硫酸:11、二氧化硫在空气中氧化为三氧化硫:12、三氧化硫通入水中生成硫酸:13、无水硫酸铜粉末中加水中生成五水硫酸铜:14、氢气在空气中点燃生成水:15、氢气在氯气中点燃生成氯化氢气体:16、氧化钙加水生成氢氧化钙:二、分解反应:17、在二氧化锰的催化作用下加热氯酸钾,生成氯化钾和氧气:18、加热高锰酸钾,生成锰酸钾、二氧化锰和氧气:19、电解水,生成氢气和氧气:20、在二氧化锰的催化作用下分解双氧水,生成水和氧气:21、加热碳酸,分解为二氧化碳和水:22、碳酸钙高温生成氧化钙和二氧化碳:23、加热五水硫酸铜生成硫酸铜和水:24、碳酸氢钠加热生成碳酸钠、水和二氧化碳:25、加热碱式碳酸铜,生成氧化铜、水和二氧化碳:三、置换反应:(1)金属和酸反应,置换出氢气:27、铁和稀硫酸反应,生成硫酸亚铁和氢气:29、镁和稀硫酸反应,生成硫酸镁和氢气:30、铝和稀硫酸反应,生成硫酸铝和氢气:32、锌和稀盐酸反应,生成氯化锌和氢气:(2)金属和盐溶液反应,置换出金属:34、铁和硫酸铜反应,生成硫酸亚铁和铜:38、铜和硝酸银反应,生成硝酸铜和银:四、复分解反应:(1)生成硫酸钡白色沉淀:53、氯化钡和稀硫酸反应,生成硫酸钡沉淀和稀盐酸:54、氯化钡和硫酸铜反应,生成硫酸钡沉淀和氯化铜:55、氯化钡和硫酸钠反应,生成硫酸钡沉淀和氯化钠:56、氢氧化钡和稀硫酸反应,生成硫酸钡沉淀和水:57、氢氧化钡和硫酸铜反应,生成硫酸钡沉淀和氢氧化铜沉淀:58、氢氧化钡和硫酸钠反应,生成硫酸钡沉淀和氢氧化钠:59、硝酸钡和稀硫酸反应,生成硫酸钡沉淀和稀硝酸:60、硝酸钡和硫酸铜反应,生成硫酸钡沉淀和硝酸铜:61、硝酸钡和硫酸钠反应,生成硫酸钡沉淀和硝酸钠:(2)生成氯化银白色沉淀:62、硝酸银和稀盐酸反应,生成氯化银沉淀和稀硝酸:63、硝酸银和氯化钠反应,生成氯化银沉淀和硝酸钠:67、硝酸银和氯化钾反应,生成氯化银沉淀和硝酸钾:68、硝酸银和氯化钙反应,生成氯化银和硝酸钙:69、硝酸银和氯化钡反应,生成氯化银沉淀和硝酸钡:(3)生成碳酸钙白色沉淀:70、氢氧化钙和二氧化碳反应,生成碳酸钙沉淀和水:71、氢氧化钙和碳酸钠反应,生成碳酸钙沉淀和氢氧化钠:72、氯化钙和碳酸钠反应,生成碳酸钙沉淀和氯化钠:(4)生成碳酸钡白色沉淀:74、氢氧化钡和二氧化碳反应,生成碳酸钡沉淀和水:75、氢氧化钡和碳酸钠反应,生成碳酸钡沉淀和氢氧化钠:76、氯化钡和碳酸钠反应,生成碳酸钡沉淀和氯化钠:77、硝酸钡和碳酸钠反应,生成碳酸钡沉淀和硝酸钠:(5)生成氢氧化铜蓝色沉淀:78、氢氧化钠和硫酸铜反应,生成氢氧化铜沉淀和硫酸钠:83、氢氧化钾和氯化铜反应,生成氢氧化铜沉淀和氯化钾:84、氢氧化钙和硫酸铜反应,生成氢氧化铜沉淀和硫酸钙:85、氢氧化钙和氯化铜反应,生成氢氧化铜沉淀和氯化钙:87、氢氧化钡和硫酸铜反应,生成氢氧化铜沉淀和硫酸钡沉淀:88、氢氧化钡和氯化铜反应,生成氢氧化铜沉淀和氯化钡:(6)生成氢氧化铁红褐色沉淀:90、氢氧化钠和氯化铁反应,生成氢氧化铁沉淀和氯化钠:91、氢氧化钾和氯化铁反应,生成氢氧化铁沉淀和氯化钾:92、氢氧化钙和氯化铁反应,生成氢氧化铁沉淀和氯化钙:94、氢氧化钠和硫酸铁反应,生成氢氧化铁沉淀和硫酸钠:96、氢氧化钙和硫酸铁反应,生成氢氧化铁沉淀和硫酸钙:97、氢氧化钡和硫酸铁反应,生成氢氧化铁沉淀和硫酸钡沉淀:(7)生成二氧化碳气体:98、碳酸钙和稀盐酸反应,生成氯化钙、水和二氧化碳:99、碳酸钠和稀盐酸反应,生成氯化钠、水和二氧化碳:101、碳酸钡和稀盐酸反应生,成氯化钡、水和二氧化碳:102、碳酸氢钠和稀盐酸反应,生成氯化钠、水和二氧化碳:(8)酸碱中和反应,生成水:103、氢氧化钠和稀盐酸反应,生成氯化钠和水:104、氢氧化钙和稀盐酸反应生成氯化钙和水:106、氢氧化钡和稀盐酸反应生成氯化钡和水:108、氢氧化钠和稀硫酸反应,生成硫酸钠和水:110、氢氧化钙和稀硫酸反应,生成硫酸钙和水:111、氢氧化钡和稀硫酸反应,生成硫酸钡和水:(9)其他112、氢氧化钙和二氧化碳反应,生成碳酸钙沉淀和水113、氢氧化钠和二氧化碳反应(变质),生成碳酸钠和水:114、氢氧化钠和二氧化硫反应生成亚硫酸钠和水:115、氧化铜和稀盐酸反应,生成氯化铜和水:116、氧化铜和稀硫酸反应,生成硫酸铜和水:117、氧化铁和稀盐酸反应,生成氯化铁和水:118、氧化铁和稀硫酸反应,生成硫酸铁和水:119、氧化铝和稀盐酸反应,生成氯化铝和水:五、氧化还原反应:121、氢气还原氧化铜,加热,生成铜和水:122、碳还原氧化铜,高温,生成铜和二氧化碳:123、一氧化碳还原氧化铜,加热,生成铜和二氧化碳:124、一氧化碳还原氧化铁,高温,生成铁和二氧化碳:。
《如何正确书写化学方程式》练习题(含答案及解析)

《如何正确书写化学方程式》练习题一、单选题(本大题共16小题,共32.0分)1. 下列关于书写化学方程式的原则和步骤,叙述正确的是 ( )A. 必须遵守质量守恒定律B. 凡是气体物质应标上“↑”C. 凡是注明“点燃”条件都可以用“△”符号代替D. 因配平需要可改动化学式中右下角的数字2. 在反应□SO 2+□H 2S =□H 2O +□S 中,方框中各物质的化学计量数应该对应的是( )A. 1,3,3,2B. 1,2,2,3C. 1,2,3,2D. 1,3,2,3 3. 下列描述与化学方程式表示一致的是( )A. 碳在空气中充分燃烧B. 铁丝在纯氧气中燃烧C. 红磷在空气中充分燃烧D. 镁带燃烧4. 下列化学方程式书写正确的是( )A. KClO 3=MnO 2KCl +O 3↑B. H 2O 2=MnO 2H 2↑+O 2↑ C. 3Fe +2O 2=点燃Fe 3O 4D. Mg +O 2=点燃MgO 25. 有一学生写出了下列化学方程式:①Mg +O 2↑=点燃MgO 2;②KClO 3=KCl +O 2↑;;③C +O 2↑=CO 2↑;④CuSO 4+Fe =FeSO 4+Cu 。
下列说法正确的是( )A. 化学式有错误的是①②③B. “↑”或“↓”符号使用不当的是①③C. 未配平的是①②D. 需要注明条件而未注明的是②④ 6. 下列化学方程式书写正确的是( )A. 2P +5O 2P 2O 5B. 4Fe +3O 22Fe 2O 3C. 2Mg +O 2=2MgOD. 2KMnO 4Δ̲̲K 2MnO 4+MnO 2+O 2↑7. 已知甲和乙在一定条件下反应生成丙和丁,结合微观示意图分析,下列结论正确的是( )A. 甲的相对分子质量为34 gB. 乙物质为氧化物C. 参加反应的甲和乙的质量比为17:24D. 反应前后分子种类和数目均不发生改变8. .将汽车尾气中的有毒气体转化为空气中的成分,其微观结构示意图如图,说法不严谨的是A. 反应前有两种物质分子B. 化学变化的本质是:分子分成原子,原子重新组合成新物质的分子C. 在化学变化中,分子分成原子,原子重新组合成新物质D. 其微观结构示意图的化学反应方程式为2NO +2CO =催化剂N 2+2CO 29. 将宏观、微观及化学符号联系在一起是化学学科的特点。
高中化学方程式书写练习 附答案

高中化学方程式书写练习(附答案)1. 氢气与氧气反应生成水:2H2 + O2 → 2H2O2. 氧气与铁反应生成铁(III)氧化物:4Fe + 3O2 → 2Fe2O33. 氧化铝与铁反应生成铁铝合金:2Al2O3 + 3Fe → 3FeAl4. 氯气与钠反应生成氯化钠:2Na + Cl2 → 2NaCl5. 硫酸和钠氢氧化物反应生成氯化钠和水:H2SO4 + 2NaOH → Na2SO4 + 2H2O6. 硫酸和铜反应生成硫酸铜:H2SO4 + Cu → CuSO4 + H27. 碳酸钙分解成氧气和二氧化碳:CaCO3 → CaO + CO28. 硝酸和银反应生成硝酸银和氢氧化银:HNO3 + Ag → AgNO3 + H2O9. 氢氧化钠和盐酸反应生成氯化钠和水:NaOH + HCl → NaCl + H2O10. 氢氧化铝和盐酸反应生成氯化铝和水:Al(OH)3 + 3HCl → AlCl3 + 3H2O11. 氧化铁和硫酸反应生成硫酸铁和水:Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O12. 氧化铜和硝酸反应生成硝酸铜和氧气:2CuO + 4HNO3 → 2Cu(NO3)2 + 2H2O + O213. 氢氧化钾和硫酸反应生成硫酸钾和水:2KOH + H2SO4 → K2SO4 + 2H2O14. 氧化钠和水反应生成氢氧化钠:Na2O + H2O → 2NaOH15. 氧化镁和盐酸反应生成氯化镁和水:MgO + 2HCl → MgCl2 + H2O16. 碳和氧气反应生成二氧化碳:C + O2 → CO217. 硫和氧气反应生成二氧化硫:S + O2 → SO218. 氢和氧气反应生成水:2H2 + O2 → 2H2O19. 氧化铁和氢氧化钠反应生成氢氧化铁:Fe2O3 + 6NaOH → 2Fe(OH)3 +20. 氧化铜和氢氧化铵反应生成铜氢氧化物:CuO + 2NH4OH → Cu(OH)2 + 2NH321. 氢氧化铜和盐酸反应生成氯化铜和水:Cu(OH)2 + 2HCl → CuCl2 + 2H2O22. 二氧化硫和水反应生成亚硫酸和氧气:SO2 + H2O → H2SO3 + O223. 氧化铁和氢氧化钾反应生成氢氧化铁:Fe2O3 + 6KOH → 2Fe(OH)3 + 3K2O24. 氮和氢气反应生成氨:N2 + 3H2 → 2NH325. 硝酸和氢氧化钾反应生成硝酸钾和水:HNO3 + KOH → KNO3 + H2O26. 氧化钠和盐酸反应生成氯化钠和水:Na2O + 2HCl → 2NaCl + H2O27. 氧化铝和盐酸反应生成氯化铝和水:Al2O3 + 6HCl → 2AlCl3 + 3H2O28. 氢氧化钾和硝酸反应生成硝酸钾和水:KOH + HNO3 → KNO3 + H2O29. 氧化铁和氢氧化钠反应生成氢氧化铁:Fe2O3 + 6NaOH → 2Fe(OH)3 + 3Na2O30. 氢氧化钾和氯化铁反应生成氯化钾和氢氧化铁:KOH + FeCl3 → KCl + Fe(OH)331. 氧化钙和水反应生成氢氧化钙:CaO + H2O → Ca(OH)232. 氢氧化铜和硝酸反应生成硝酸铜和氢氧化铜:Cu(OH)2 + 2HNO3 → Cu(NO3)2 + 2H2O33. 氯气和氢气反应生成氯化氢:H2 + Cl2 → 2HCl34. 氧化铝和氢氧化铵反应生成铝氢氧化物:Al2O3 + 6NH4OH → 2Al(OH)3 + 3(NH4)2O35. 氢氧化铝和硝酸反应生成硝酸铝和氢氧化铝:Al(OH)3 + 3HNO3 → Al(NO3)336. 氢氧化钠和硫酸铝反应生成硫酸钠和氢氧化铝:2NaOH + Al2(SO4)3 → 2NaAl(OH)4 + 3H2SO437. 氧化铁和氢氧化铵反应生成铁氢氧化物:Fe2O3 + 6NH4OH → 2Fe(OH)3 + 3(NH4)2O38. 氢氧化钾和硫酸反应生成硫酸钾和水:2KOH + H2SO4 → K2SO4 + 2H2O39. 氧化亚铁和氯气反应生成氯化亚铁:FeO + Cl2 → FeCl2 + O240. 氢氧化铝和盐酸反应生成氯化铝和水:Al(OH)3 + 3HCl → AlCl3 + 3H2O41. 氢氧化锰和盐酸反应生成氯化锰和水:Mn(OH)2 + 2HCl → MnCl2 + 2H2O42. 氢氧化铜和氯化铵反应生成铜氯化物和氢氧化铵:Cu(OH)2 + 2NH4Cl → CuCl2 + 2NH3 + 2H2O43. 氢氧化钠和氯化亚铁反应生成氯化钠和氢氧化铁:2NaOH + FeCl2 → 2NaCl + Fe(OH)244. 氢氧化铜和氯化铁反应生成氯化铜和氢氧化铁:Cu(OH)2 + 2FeCl3 → CuCl2 + 2Fe(OH)345. 氢氧化钠和氯化铜反应生成氯化钠和氢氧化铜:2NaOH + CuCl2 → 2NaCl + Cu(OH)246. 氢氧化铝和硫酸反应生成硫酸铝和水:Al(OH)3 + H2SO4 → Al2(SO4)3 + 3H2O47. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuO48. 氢氧化铁和氯化铵反应生成氯化铁和氢氧化铵:Fe(OH)3 + 3NH4Cl → FeCl3+ 3NH3 + 3H2O49. 氧化亚铁和氢氧化钠反应生成氢氧化铁:2FeO + 2NaOH + H2O → 2Fe(OH)2 + 2NaOH50. 氢氧化铜和氧化亚铁反应生成铜和氢氧化铁:3Cu(OH)2 + 2FeO → Fe(OH)2 + Cu3O + H2O51. 氧化铁和氯化铜反应生成氯化铁和氢氧化铜:Fe2O3 + 6CuCl2 → 2FeCl3 + 6CuO + Cl252. 氢氧化铝和氢氧化钠反应生成氢氧化铝:Al(OH)3 + NaOH → NaAl(OH)453. 氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜:2NaOH + CuSO4 → Na2SO4 + Cu(OH)254. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuO55. 氢氧化铜和氢氧化钡反应生成铜氢氧化物和氢氧化钡:Cu(OH)2 + Ba(OH)2 → Cu(OH)2 + Ba(O H)256. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuO57. 氢氧化铁和氧化铜反应生成铁和氢氧化铜:3Fe(OH)3 + 2CuO → Fe3O4 + 3H2O + 2Cu(OH)258. 氢氧化铝和氢氧化亚铁反应生成铝和氢氧化铁:2Al(OH)3 + Fe(OH)2 → 2Al + 2Fe(OH)3 + 3H2O59. 氧化铁和氢氧化铜反应生成铁氢氧化物和氧气:4Fe2O3 + 3Cu(OH)2 → 8Fe(OH)3 + 3O2 + 3CuOFe3O4 + 3H2O + 3Cu(OH)261. 氢氧化铝和氢氧化钡反应生成铝和氢氧化钡:2Al(OH)3 + 3Ba(OH)2 → 2Al + 3Ba(OH)462. 氢氧化铜和氢氧化锰反应生成铜和氢氧化锰:3Cu(OH)2 + 2Mn(OH)2 → Mn3O4 + 3H2O + 3Cu(OH)263. 氢氧化铝和氢氧化铜反应生成铝和氢氧化铜:2Al(OH)3 + 3Cu(OH)2 → 2Al + 3Cu(OH)464. 氧化铁和氧化锌反应生成铁和氧化锌:3Fe2O3 + 4ZnO → 6FeO + 4ZnO + 3O265. 氢氧化铜和氢氧化铅反应生成铜和氢氧化铅:3Cu(OH)2 + 2Pb(OH)2 → Pb3O4 + 3H2O + 3Cu(OH)266. 氢氧化铝和氢氧化亚铜反应生成铝和氢氧化铜:2Al(OH)3 + 3Cu(OH)2 → 2Al + 3Cu(OH)467. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + 3CuO → 2FeO + 3CuO68. 氢氧化铝和氢氧化铅反应生成铝和氢氧化铅:2Al(OH)3 + 3Pb(OH)2 → 2Al + 3Pb(OH)469. 氧化铁和氧化铜反应生成铁和氧化铜:3Fe2O3 + 4CuO → 6FeO + 4CuO + 3O270. 氢氧化铜和氢氧化钡反应生成铜和氢氧化钡:3Cu(OH)2 + 2Ba(OH)2 → Ba3O4 + 3H2O + 3Cu(OH)271. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + 3CuO → 2FeO + 3CuO+ 2Fe(OH)3 + 3H2O73. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + CuO → 2FeO + CuO74. 氢氧化铜和氢氧化铝反应生成铜和氢氧化铝:3Cu(OH)2 + 2Al(OH)3 → Al2O3 + 3H2O + 3Cu(OH)275. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + CuO → 2FeO + CuO76. 氢氧化铜和氢氧化亚铁反应生成铜和氢氧化铁:3Cu(OH)2 + 2FeO → Fe3O4 + 3H2O + 3Cu(OH)277. 氢氧化铝和氢氧化亚铁反应生成铝和氢氧化铁:2Al(OH)3 + Fe(OH)2 → 2Al + 2Fe(OH)3 + 3H2O78. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + 3CuO → 2FeO + 3CuO79. 氢氧化铝和氢氧化铅反应生成铝和氢氧化铅:2Al(OH)3 + 3Pb(OH)2 → 2Al + 3Pb(OH)480. 氧化铁和氧化铜反应生成铁和氧化铜:Fe2O3 + CuO → 2FeO + CuO。
书写化学方程式统一练习

1.木炭在氧气中燃烧:
2.铁丝在氧气中燃烧:
3.红磷在空气中燃烧:
4.镁在空气中燃烧:
5.氢气燃烧:
6.电解水:
7.过氧化氢(双氧水)制氧气:
8.高锰酸钾制氧气:
9.氯酸钾制氧气:
10.二氧化碳与水反应:
11.碳酸受热分解:
12.二氧化碳使石灰水变浑浊:
13.实验室制取二氧化碳:
(填序号)属于化合反应的有:,属于分解反应的有。
1.木炭在氧气中燃烧:
2.铁丝在氧气中燃烧:
3.红磷在空气中燃烧:
4.镁在空气中燃烧:
5.氢气燃烧:
6.电解水:
7.过氧化氢(双氧水)制氧气:
8.高锰酸钾制氧气:
9.氯酸钾制氧气:
10.二氧化碳与水反应:
11.碳酸受热分解:
12.二氧化碳使石灰水变浑浊:
13.实验室制取二氧化碳:
(填序号)属于化合反应的有:,属于分解反应的有。
(word完整版)高考陌生情景中化学方程式的书写技巧与真题训练

高考陌生情景中化学方程式的书写技巧与真题训练陌生情景中的化学方程式书写,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。
配平要遵循质量守恒定律(原子守恒、元素守恒、物料守恒),对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应还要遵循电荷守恒规律。
【解题技巧】关键结合题目信息、流程图信息并熟记常见的氧化产物和还原产物判断生成物。
1. 熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物2.掌握书写信息型氧化还原反应的步骤(3步法)第1步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第2步:根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
第3步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
3.氧化还原反应方程式的配平:步骤:①标出化合价变化了的元素的化合价。
②列变化:分别标出化合价升高数和化合价降低数③根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
④利用元素守恒,观察配平其他物质4.“补缺”的技巧(1)可能出现的情况:H+→H2O(酸性)、OH-→H2O(碱性)、H2O→H+(中性或酸性)、H2O→OH-(中性或碱性)(2)绝不可能出现的情况:H+→OH- 或者OH-→H+题型1 氧化还原反应型的化学方程式和离子方程式的书写1、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________________。
书写化学方程式练习(带答案 )

↑ 2KMnO4 == K2MnO4 + MnO2+ O2
10.过氧化氢在二氧化锰催化下分解
MnO2
_____2H2O2__==_2H2O_+_O2↑___
11.点燃镁条可以在CO2气体中继续剧烈燃烧,生成碳和氧化镁
点燃
_2Mg + CO2 ==_ C + 2MgO___
12.氢气在氯气中燃烧生成氯化氢
二、配平下列化学方程式 1、 4Al + 3O2 == 2Al2O3 2、 8Al + 3Fe3O4 == 9Fe + 4Al2O3 3、 C2H4 + 3O2== 2H20+2CO2 4、 4Al + 3MnO2 ==3Mn + 2Al2O3 5、 N2 + 3H2==2NH3 6、2Al + 3H2SO4 ==Al2(SO4)3 + 3H2 7、 3CO + Fe2O3 ==2Fe + 3CO2 8、 3C + 2Fe2O3==4Fe + 3CO2 9、3H2 + Fe2O3 ==2 Fe + 3H2O 10、3H2 + WO3== W + 3H2O
一、写出下列反应的化学方程式 1、木炭在氧气中燃烧
点燃
___C + O2 == CO2___________
2、 硫在氧气中燃烧
点燃
____S + == SO2__________
3、 红磷在空气中燃烧
点燃
____4P + 5O2 ==__2P2O5__
4、 镁条在空气中燃烧
点燃
___2Mg + O2 ==_2MgO_
化学方程式书写习题(内含答案)

③4NH3+5O2═4NO+6H2O
④1C2H4+3O2 2H2O+2CO2
16.配平下面方程式:
(1)1Cu2(OH)2CO3﹣﹣2CuO+1CO2+1H2O
(2)2KMnO4﹣﹣1K2MnO4+1MnO2+1O2
(3)8Al+3Fe3O4﹣﹣9Fe+4Al2O3
20.高铁酸钾(K2FeO4)是一种具有紫色固体光泽的粉末,干燥的高铁酸钾在198℃以下是稳定的,受热容易分解、变质。受热后会分解放出氧气,同时生成氧化钾和氧化铁。根据以上信息,请写出高铁酸钾受热分解的的化学方程式。
21.我国可燃冰开采技术世界领先,将可燃冰进行二次能源开发意义重大。甲烷和水在一定条件下可制备合成气(主要成分是一氧化碳和氢气),该反应的化学方程式为。
化学方程式书写习题
一.选择题(共10小题)
1.D。
2.C。
3.C。
4.A。
5.D。
6.A。
7.D。
8.B。
9.D。
10.下A。
二.填空题(共22小题)
11.配平下列化学方程式(化学计量数为1也要填入横线内)
(1)4FeS2+11O2 2Fe2O3+8SO2
(2)2Fe2O3+3C 4Fe+3CO2
(3)2KClO3 2KCl+3O2↑
26.二氧化氯(ClO2)是新一代饮用水的消毒剂,其中氯元素的化合价为。工业上常用氯酸钠(NaClO3)与稀盐酸(HCl)反应制取二氧化氯气体,其产物还有氯气(Cl2)、氯化钠和水。该反应的化学方程式为
。
(完整word版)高中化学方程式书写练习(附答案)

高中化学方程式书写练习一1. 钠块在空气中变暗:____________________________________________2. 钠在空气中燃烧:_______________________________________________3. 钠与熔融四氯化钛(TiCI 4)反应:_________________________________4. 钠与水反应:_______________________________________________离子方程式:__________________________________5. 钠与硫酸反应:_________________________________离子方程式:___________________________6. 钠与硫酸铜溶液:_______________________________________________7. 氧化钠与水反应:__________________________________________ ___8. 氧化钠与盐酸反应:_________________________________离子方程式:___________________________9. 过氧化钠与盐酸反应:__________________________________________离子方程式:_________________ ________10. 过氧化钠与二氧化碳反应:_____________________________________氧化剂:__________ 还原剂:___________11. 过氧化钠与水反应:____________________________________________离子方程式:____________________________12. 过氧化钠与二氧化硫反应:_______________________________________13. 电解熔融氯化钠:_______________________________________________14. NaOH溶液中通入少量CO: _______________________离子方程式:__________________________15. NaOH溶液中通入过量CO: _______________________离子方程式:16. 碳酸钠与氢氧化钙:_________________________________高中化学方程式书写练习一离子方程式:___________________________ __________________________ 17. 碳酸氢钠与盐酸:___________________________________离子方程式:______________ ___________ __________________________ 18. 碳酸氢钠溶液与醋酸溶液混合:_________________________________离子方程式:______________ __________ _______________________ 19. 除去碳酸钠溶液中的碳酸氢钠:_________________________________离子方程式:______________________________________________________20. 除去碳酸钠固体中的碳酸氢钠:_________________________________21. 除去碳酸氢钠溶液中混有的碳酸钠:_____________________________离子方程式:______________ __________ __________________________ 22. 用碳酸钠溶液吸收过量SO: ___________________________________离子方程式:_____________________ ________________________23. 用碳酸钠溶液吸收少量SQ: ___________________________________离子方程式:___________________________ _______________________ 24. 向碳酸钠溶液滴入少量稀盐酸:____________________________________离子方程式:______________________________________________________ 25. 向碳酸钠溶液滴入过量稀盐酸:____________________________________离子方程式:______________________________________________________ 26. 碳酸钙与醋酸反应: ______________________________________________离子方程式:______________________________________________________1. 铝与氧气的反应:____________________________________2. 铝与氧化铁反应(铝热反应):_________________________________氧化剂:____________ 还原剂:______________3. 铝和稀盐酸:_____________________________________________离子方程式:____________________________________________4. 铝和NaOH溶液:___________________________________________离子方程式:____________________________________________5. 氧化铝和稀硫酸:___________________________________________离子方程式:_____________________________________6. 氧化铝和NaOH溶液:_______________________________________离子方程式:_____________________________________7. 氢氧化铝和盐酸:____________________________________离子方程式:_____________________________________8. 氢氧化铝和NaOH溶液:____________________________________离子方程式:____________________________________________9. 氢氧化铝受热分解:_____________________________________10. 硫酸铝与过量氨水反应:____________________________________离子方程式:________________________________________11. AICI 3溶液中加入少量NaOH溶液:_______________________________离子方程式:_______________________________________________12. AICI 3溶液中加入过量NaOH溶液:__________________________________离子方程式:__________________________________________高中化学方程式书写练习一13. 偏铝酸钠溶液中加入少量HCI: ____________________________________19. 明矶溶液中加入少量氢氧化钡溶液:________________________离子方程式:_________________________________________20. 明矶溶液中加入过量氢氧化钡溶液:_________________________________离子方程式:_________________________________________21. 碳酸氢钠溶液与少量石灰水反应:_______________________________离子方程式:_________________________________________22. 碳酸氢钠溶液与过量石灰水反应:_______________________________离子方程式:_________________________________________23. 鉴别碳酸钠和碳酸氢钠溶液:_______________________________________离子方程式:_________________________________________24. 电解熔融氯化镁: _______________________________________________25. 镁与热水反应: _________________________________________________26. 碳酸氢钙溶液与醋酸反应:_________________________________________离子方程式:高中化学方程式书写练习一1. 铁与氧气反应:__________________________________________2. 铁与硫反应:____________________________________氧化剂:__________________ 还原剂:____________________3. 铁在氯气中燃烧:____________________________________________氧化剂:__________________ 还原剂:____________________4. 铁与碘反应:__________________________________5. 铁与盐酸反应:__________________________________________离子方程式:_________________________________6. 铁与氯化铜溶液:____________________________________________离子方程式:_________________________________7. 铁和水蒸气:_____________________________________________氧化剂:_______________ 还原剂:________________8. 氧化亚铁与盐酸反应:___________________________________________离子方程式:_____________________________________ ____ ______9. 氧化铁与盐酸反应:_______________________________________离子方程式:__________________________________________________10. CO 还原氧化铁:_________________________________________________11. 磁铁矿与一氧化碳反应:___________________________________________12. 氯化铁与氢氧化钠溶液:____________________________________离子方程式:_____________________________________12. __________________________________________________ 硫酸亚铁与氢氧化钠溶液:______________________________________________离子方程式:_____________________________________ 14. 氢氧化铁加热分解:离子方程式:15. 氢氧化亚铁在空气中被氧化:________________________________________高中化学方程式书写练习一16. 除去FeCl2 中的FeCb:_____________________________________离子方程式:________________________________氧化剂:_______________ 还原剂:________________17. FeCl 2和Cl 2反应:_________________________________________离子方程式:______________________________________18. FeCl 3和Cu反应: _________________________________________离子方程式:___________________________________氧化剂:_______________ 还原剂:________________19. 氯化铁与硫氰化钾溶液反应:________________________________________20. 氯化铁溶液中滴加少量碘化钾溶液:__________________________________离子方程式:___________________________________21. 氯化铁溶液跟过量氨水反应:________________________________________离子方程式:___________________________________22. 氯化铁溶液跟少量锌粉反应:_________________________________________离子方程式:___________________________________23. 氯化铁溶液跟过量锌粉反应:________________________________________离子方程式:___________________________________24. 镁在二氧化碳中燃烧: ______________________________氧化剂:_______________ 还原剂:________________25. 镁与氮气反应: ________________________________氧化剂:_______________ 还原剂:________________26. 硫酸溶液跟氢氧化钡溶液反应:______________________________________离子方程式:高中化学方程式书写练习一1. 用氯化铁与沸水反应制氢氧化铁胶体:_________________________________2. 硫化氢气体与氯化铁溶液反应:_______________________________________离子方程式:___________________________________________3. 硫化亚铁与盐酸反应:____________________________________________4. 四氧化三铁溶于浓盐酸:_______________________________________离子方程式:________________________________________________5. 硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:______________________离子方程式:________________________________________________6. ____________________________________________________ 硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:_____________________________离子方程式:_____________________________________________________ 7. 氧化铁溶于氢碘酸溶液:________________________________________离子方程式:___________________________________________8. 氯化铁溶液中滴加少量硫化钠溶液:________________________________离子方程式:___________________________________________9. 氯化铁溶液中滴加过量硫化钠溶液:________________________________离子方程式:___________________________________________10. 硅与氧气加热:_______________________________11. 硅与氟气:_____________________________12. 硅单质与氢氟酸反应:________________________________13. 硅与氢氧化钠溶液反应:____________________________________14. 二氧化硅与氢氟酸反应:__________________________________________离子方程式:15. 二氧化硅与氧化钙高温反应:_______________________________________16. 二氧化硅与氢氧化钠溶液反应:_____________________________________离子方程式:___________________________________________17. 二氧化硅与碳反应:____________________________________________氧化剂:_______________ 还原剂:_______________18. 硅酸钠与盐酸反应:____________________________________离子方程式:___________________________________________19. 往硅酸钠溶液中通入少量二氧化碳:_______________________________离子方程式:___________________________________________20. 往硅酸钠溶液中通入过量二氧化碳:_______________________________离子方程式:___________________________________________21. 二氧化硅与纯碱反应:_________________________________________22. 二氧化硅与石灰石反应:____________________________ _ ________23. 加热硅酸: _____________________________ _____24. 向碳酸氢钙溶液中加入过量的氢氧化钠:___________________________离子方程式:___________________________________________25. ___________________________________________ 向碳酸氢钙溶液中加入少量的氢氧化钠:__________________________________离子方程式:___________________________________________26. ________________________________________________________ 碳离子方程式:酸氢铵溶液中加入过量氢氧化钠溶液_____________________________________ 离子方程式:高中化学方程式书写练习五1. 水煤气的制取: ____________________________________________2. 用氢气还原四氯化硅: _______________________________________3. 碳酸氢镁溶液中加少量氢氧化钙:__________________________________离子方程式:_______________________________________4. 碳酸氢镁溶液中加过量氢氧化钙:__________________________________离子方程式:_______________________________________5. 实验室制氯气: ____________________________________________离子方程式:_______________________________________氧化剂:______________ 还原剂: ______________6. 高锰酸钾固体加入浓盐酸:________________________________________离子方程式:___________________________________________7. 钠在氯气中燃烧: __________________________________________8. 铜在氯气中燃烧: __________________________________________9. 氢气在氯气中燃烧: ________________________________氧化剂:______________ 还原剂: ______________10. 磷与少量氯气反应: _____________________________________11. 硅与氯气在高温下反应: ______________________________________12. 氯气和水反应: ___________________________________离子方程式:_______________________________________________氧化剂:______________ 还原剂: ______________13. 次氯酸光照分解: _________________________________________14. 氯水中通入二氧化硫: _____________________________________离子方程式:氧化剂:______________ 还原剂: ______________15. 氯气与冷氢氧化钠溶液: ________________________________________离子方程式:_________________________________________16. 氯气与热的氢氧化钠溶液: ______________________________________离子方程式:____________________________17. 工业生产漂白粉: ________________________________________________18. 向漂白粉溶液中加入稀盐酸: _______________________________________离子方程式:______________________________________19. 次氯酸钙溶液中通入少量二氧化碳: _________________________________离子方程式:______________________________________20. 次氯酸钙溶液中通入过量二氧化碳: __________________________________离子方程式:______________________________________21. 次氯酸钙溶液中通入SO2: _______________________________离子方程式:______________________________________22. 氯气通入碳酸氢钠溶液: ________________________________________离子方程式:______________________________________23. 氯气通入溴化钾溶液: _____________________________________离子方程式:______________________________________24. 氯气通入碘化钾溶液: _____________________________________离子方程式:______________________________________25. 溴水和碘化钾溶液反应: ______________________________________离子方程式:______________________________________26. 一氧化碳和一氧化氮反应: ________________________________________高中化学方程式书写练习一1. 氯化钠和硝酸银溶液: ____________________________________离子方程式:__________________________________2. 溴化钠和硝酸银溶液: __________________________________离子方程式:__________________________________3. 碘化钠和硝酸银溶液: _______________________________离子方程式:__________________________________4. 氟气与水反应: _______________________________________5. 氟气与氢气反应: _______________________________________6. F 2与NaOH溶液反应:_____________________________________离子方程式:__________________________________7. 溴化银分解:____________________________________________8. 氯酸钾与浓盐酸:______________________________________________离子方程式:____________________________________________氧化剂:______________ 还原剂: _____________9. 溴化亚铁溶液通入足量氯气:_________________________________离子方程式:__________________________________10. 溴化亚铁溶液通入少量氯气:________________________________离子方程式:__________________________________11. 等物质的量的溴化亚铁溶液与氯气:__________________________________离子方程式:__________________________________12. 碘化亚铁溶液通入足量氯气:________________________________离子方程式:____________________________________________13. 碘化亚铁溶液通入少量氯气:________________________________离子方程式:___________________________________________14. 硫在空气中燃烧: ________________________________________氧化剂:______________ 还原剂: ______________15. 硫与氢气加热: _______________________________________氧化剂:______________ 还原剂: ______________16. 硫与铜反应: ______________________________________17. 二氧化硫与水: ____________________________________________18. 二氧化硫与氧化钙: ________________________________________19. 少量SO2 与氢氧化钠: ___________________________________离子方程式:______________________________________20. 过量SO2 与氢氧化钠: ___________________________________离子方程式:___________________________________________21. 澄清石灰水通入少量SO2: _______________________________22. 澄清石灰水通入过量SO2: _______________________________23. 二氧化硫与硫化氢: ______________________________氧化剂:______________ 还原剂: ______________24.SO2 的催化氧化:__________________________________________氧化剂:______________ 还原剂: ______________25.Na 2SO3 与氧气反应:________________________________________26. 硫酸铜与氢氧化钡溶液反应:________________________________________离子方程式:___________________________________________高中化学方程式书写练习一1. 亚硫酸钠和硫酸反应: _____________________________________________2. 三氧化硫和水反应: ___________________________________________3. 三氧化硫与氧化钙: _______________________________4. 三氧化硫与氢氧化钙: __________________________________5. 铜与浓硫酸反应: ________________________________________________氧化剂:______________ 还原剂: ______________6. 碳与浓硫酸反应: ________________________________________________氧化剂:______________ 还原剂: ______________7. 硫与浓硫酸反应: ________________________________________8. 硫化氢与浓硫酸反应: _______________________________________________氧化剂:______________ 还原剂: ______________9. 硫酸铜溶液中通入硫化氢:_________________________________________离子方程式:______________________________________10. 锌与稀硫酸: ________________________________________离子方程式:______________________________________11. 锌与浓硫酸: ________________________________________12. 亚硫酸溶液中加入氯水: _________________________________________离子方程式:______________________________________13. 亚硫酸溶液中加入氯化铁: _________________________________________离子方程式:______________________________________14. 亚硫酸溶液中加入双氧水: _________________________________________离子方程式:______________________________________15. 亚硫酸钠溶液中加入溴水: _________________________________________离子方程式:______________________________________16. 亚硫酸钠溶液中加入双氧水:________________________________________离子方程式:______________________________________17. 硫溶于热的氢氧化钠溶液:_______________________________________离子方程式:______________________________________18. 铜屑与稀硫酸和过氧化氢三者反应:__________________________________离子方程式:______________________________________19. 黄铁矿(FeS 2)与氧气反应:______________________________________20. 用氨水吸收少量二氧化硫:__________________________________________离子方程式:______________________________________21. 用氨水吸收过量二氧化硫:__________________________________________离子方程式:______________________________________22. 向饱和碳酸氢钙溶液中加饱和氢氧化钙溶液:__________________________离子方程式:______________________________________23. 等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:离子方程式:______________________________________24. 硫酸氢钠溶液与氢氧化钡反应至中性:________________________________离子方程式:______________________________________25. 硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:______________________离子方程式:______________________________________高中化学方程式书写练习一1. 氮气和氧气反应: __________________________________2. 工业合成氨: _________________________________________氧化剂:______________ 还原剂: ______________3. 一氧化氮与氧气反应: __________________________________4. _______________________________________________ NO2 溶于水: _________________________________________________________氧化剂:______________ 还原剂: ______________5. 氨气和氯化氢: __________________________________________6. 氨的催化氧化: ______________________________________________氧化剂:______________ 还原剂: ______________7. 氯化铵受热分解: ____________________________________________8. 碳酸氢铵受热分解: __________________________________________9. 硝酸铵和NaOH:______________________________离子方程式:_______________________________________10. 实验室制氨气: _____________________________________________11. 浓硝酸与铜反应: _______________________________________离子方程式:_______________________________________12. 稀硝酸与铜反应: ______________________________________________离子方程式:_______________________________________13. 碳与浓硝酸反应: ___________________________________________氧化剂:______________ 还原剂: ______________14. 浓硝酸见光分解: ______________________________________________15. ______________________________________________________ NO2、O2 混合气通入水中无剩余气体:____________________________________ 16. ______________________________________________________ N0、02同时通入水中无剩余气体:_______________________________________17. 少量单质铁溶于稀硝酸中(NO): _____________________________高中化学方程式书写练习一离子方程式:__________________________________________________ 18. 过量单质铁溶于稀硝酸中(NO): _______________________________离子方程式:__________________________________________________ 19. Fe(NO3)3溶液中加入过量HI溶液:____________________________离子方程式:__________________________________________________ 20. Fe 304与稀HNO反应: _______________________________________离子方程式:__________________________________________________ 21. FeS放入稀硝酸溶液中:________________________________________离子方程式:__________________________________________________ 22.SO2通入BaCb和HNO昆合溶液中的反应:________________________离子方程式:__________________________________________________ 23. 将NO和NO的混合气体通入烧碱溶液中: ________________________24. NO2通入氢氧化钠溶液: ______________________________________离子方程式:__________________________________________________ 25. 澄清石灰水通入少量CQ: __________________________________离子方程式:__________________________________________________ 26. 澄清石灰水通入过量CO: __________________________________离子方程式:__________________________________________________16.碳酸钠与氢氧化钙:Na2CO+ Ca(0H)2= CaCO j + 2NaOH1. 钠块在空气中变暗:4Na + Q= 2N@02. 钠在空气中燃烧:2Na + Q 1 Na z Q3. 钠与熔融四氯化钛(TiCI 4)反应:4Na+ TiCI 4 = Ti + 4NaCI4. 钠与水反应:_2Na+ 2H2O=+ H2 f __离子方程式:_2Na+ 2H2Q= 2Na+ + 2QH + H f _5. 钠与硫酸反应:2Na+ H2SQ= NaaSQ+ H2 f离子方程式:2Na+ 2』=2Na+ + H2 f6. 钠与硫酸铜溶液:2Na+ 2H2O+ CuSd N@SQ+ H2 f + Cu(QH)2 J7. 氧化钠与水反应:_ Na2Q+ HaQ= 2NaQH8. 氧化钠与盐酸反应:NaQ>+ 2HCI = 2NaCI+ HQ离子方程式:Na2Q+ 2H+ = 2Na++ H2Q9. 过氧化钠与盐酸反应:2N@Q + 4HCI= 4NaCI+ 2HQ+ Q2f离子方程式:_2N@Q+ 4H+ = 4Na+ + 2fO+ Q f10. 过氧化钠与二氧化碳反应:2N Q Q+ 2CQ = 2N Q CQ+ Q氧化剂:NaO 还原剂:NaO11. 过氧化钠与水反应:2NaO+ 2HzQ= 4NaQ+ Q f离子方程式:_2N@Q+ 2"0= 4Na+ + 4QH + Q f _12. 过氧化钠与二氧化硫反应:N Q Q+ SQ= N Q SQ13. 电解熔融氯化钠:2NaCI(熔融)" 2Na+ C^f14. NaOH溶液中通入少量CQ: 2NaQ+ CQ= Na^CQ + H2Q离子方程式:2QH + CQ= CQ2「+ fQ _15. NaOH溶液中通入过量CQ: NaQF+ CQ= NaHCQ高中化学方程式书写练习一离子方程式:QH + CQ= HCQ16.碳酸钠与氢氧化钙:Na2CO+ Ca(0H)2= CaCO j + 2NaOH离子方程式:2_ 2+CO + Ca = CaCOj17.碳酸氢钠与盐酸:NaHCa HCl = NaCI+ H20+ CO f离子方程式:HCQ + H = H2O+ CO f18. 碳酸氢钠溶液与醋酸溶液混合:NaHCO + CHCOOH= CHCOON住H2O + CO f19.除去碳酸钠溶液中的碳酸氢钠:NaHC硏NaOH= N@CO+ HO离子方程式:HCQ + OH = H2O+ CQ2-20. 除去碳酸钠固体中的碳酸氢钠:2NaHCO - Na2CO+ H2O+ CO f21. 除去碳酸氢钠溶液中混有的碳酸钠:N&CO+ H2O+ CO = 2NaHCO离子方程式:2- -CO3 + HO+ CO = 2HCO22.用碳酸钠溶液吸收过量SO: Na t CO+ H2O+ 2SO= 2NaHS囲CQ离子方程式:2_ _CO3 + H2O+ 2SO = 2HSO + CO23.用碳酸钠溶液吸收少量SO: N Q CO+ SO = N Q SO+ CO离子方程式:2- 2-CO3 + SQ = SO3 + CO24.向碳酸钠溶液滴入少量稀盐酸:NaaCO+ HCI= NaHC硏NaCI离子方程式:CO32+ H+= HCO25.向碳酸钠溶液滴入过量稀盐酸:NazCO+ 2HCI= 2NaCI+ H2O+ CO f离子方程式:2_ + .CO3 + 2H = H2O+ CO f26.碳酸钙与醋酸反应:CaCO+ 2CHCOOI4 (CH3COO2Ca+ HO+ CO f离子方程式:CaCO3+ 2CHCOO= 2CHCO3 Ca i++ HO+ CO f高中化学方程式书写练习一1.铝与氧气的反应: 4AI + 3Q ' " 2AI 2Q高温 2.铝与氧化铁反应(铝热反应): 2AI + Fe 2Q 3 2Fe + Al 2Q 氧化剂:Fe 2O 3 还原剂: AI3.铝和稀盐酸: 2AI + 6HCI = 2AICI 3+ 3H f 离子方程式: 2AI + 6H =2AI + f 22Q 7.氢氧化铝和盐酸: AI(OH) 3+ 3HCI = AICI 3+ 3HQ离子方程式: 3AI(OH) 3 + 3H = AI + 3fO 8.氢氧化铝和 离子方程式: NaOH 溶液: AI(OH) 3 + NaOH= NaAIQ + 2H 2O AI(OH) 3 +Oh -= AIO 2- + 2H 2O 9.氢氧化铝受热分解:_2AI(OH) 3 Al 2Q + 3HO _ 10.硫酸铝与过量氨水反应:Al 2(SO 4)3 + 6NH • H 2O = 2AI(OH) 3 J + 3(NH 4)2SQ离子方程式:Al 3 + + 3NH • HbO= AI(OH) 3 J + 3NT +11.AICI 3溶液中加入少量 NaOH§液:AICI 3+ 3NaOH= AI(OH) 3 J + 3NaCI离子方程式: 3 + - . AI + 3OH = AI(OH) 3 12.AICI 3溶液中加入过量 NaOH 溶液:AICI 3+ 4NaOH= NaAIQ + 3NaCI + 2HO离子方程式: AI 3 + + 4OH = AIO 2- + 2fO13.偏铝酸钠溶液中加入少量 HCI : NaAIO 2+ HCI + fO= AI(OH) 3 J + NaCI离子方程式:AIO 2-+ H + + HkO = AI(OH) 3 J14. 偏铝酸钠溶液中加入过量HCl: NaAIO2+ 4HCI= AICI 3+ NaCI + 2H2O离子方程式:__ AIO 2 + 4』=Al3+ + 2H2O —15. 往偏铝酸钠溶液中通入少量CO: 2NaAIQ+ 3H2O+ CO= 2AI(OH) 3 J+ NaaCQ离子方程式:_2AIO2一+ 3H2O+ CO = 2AI(OH) 3 J + CO2「16. 往偏铝酸钠溶液中通入过量CO: NaAIO2+ 2H2O+ CQ= AI(OH) 3 J + NaHCO离子方程式:AIO2「+ 2H2O+ CO= AI(OH) 3 J + HC017. 电解熔融氧化铝:2Al2Q(熔融)H 4AI + 3O f _18. 明矶净水原因:AI 3+ + 3H2O AI(OH)19. 明矶溶液中加入少量氢氧化钡溶液:2KAI(SO4)2 + 3Ba(OH)2 =2AI(OH) 3 J+ 3BaSO j + K2SQ离子方程式:2AI3++ 3SO2-+ 3Ba2++ 6OH = 2AI(OH) 3J + 3BaSO j20. 明矶溶液中加入过量氢氧化钡溶液:KAI(SO4)卄2Ba(OH)2 = KAIO2 + 2BaSQ j+ 2H2O离子方程式:A|3+ + 2SO2-+ 2Ba2+ + 4OH=AIO2 + 2BaSO J + 2H2O21. 碳酸氢钠溶液与少量石灰水反应:2NaHCO+ Ca(OH)2 = CaCOj +N@CO+2HO离子方程式:2HC0 + Ca2+ + 2OH = CaCOj+ CO2「+ 2H2O22. 碳酸氢钠溶液与过量石灰水反应NaHCO+ CaQH* CaCOJ + NaOH + H2O离子方程式:HC0 + Ca + OH= CaCOj+ H2O23. 鉴别碳酸钠和碳酸氢钠溶液:Na^CO + CaCl2= CaCO j + 2NaCI离子方程式:_ CQ? + Ca?+ = CaCOJ _24. 电解熔融氯化镁:MgC b(熔融)4川Mg+ Cl2f25. 镁与热水反应:Mg + 2H2O 丄一Mg(OHk + H2f26. 碳酸氢钙溶液与醋酸反应:Ca(HCO)卄2CHCOO= (CfCOOCa+2H2O+ 2CO f离子方程式:-HCO_ + CHCOO= CHCOC+ H2O+ CO f高中化学方程式书写练习一1. 铁与氧气反应:_3Fe + 2Q 仝基Fe s O-2. 铁与硫反应: Fe + S 丄基FeS2Fe + 3CI 2 点愿 2FeCI 3 氧化剂: ―_Ch ________ 还原剂: Fe 4. 铁与碘反应: —Fe + 12 Fel 25. 铁与盐酸反应:_ Fe + 2HCI = FeCb + H 2 f _丄 2丄离子方程式: Fe + 2H = Fe + Hd6. 铁与氯化铜溶液: Fe + CuCl 2= FeCb + Cu离子方程式: Fe += Fe + Cu咼温 7. 铁和水蒸气: _3Fe + 4H0 (g)Fe 3Q + 4H_ 氧化剂: H 2O 还原剂:Fe _____ 8. 氧化亚铁与盐酸反应: FeO + 2HCI = FeCb + HO 离子方程式:_ FeO + 2H = Fe?+ +耳0_9. 氧化铁与盐酸反应: FaQ + 6HCI = 2FeCI 3 + 3H 2O 离子方程式:_ FezQ + 6H = 2Fe + 3HO咼温10. CO 还原氧化铁: _ Fe2Q + 3CO 2Fe + 3CO高温11. 磁铁矿与一氧化碳反应: __ Fe 3O 4+4CO 高 3Fe + 4CO_ 12. 氯化铁与氢氧化钠溶液: FeCb + 3NaOH= Fe(OH )3 J + 3NaCI 离子方程式: _ Fe + 3OH = Fe(OH )3 J12.硫酸亚铁与氢氧化钠溶液:FeSO + 2NaOH= Fe(OH )2 J + Na^SO2 + — 离子方程式:_ Fe + 2OH = Fe(OH )2 J 氧化S 还原剂: Fe3.铁在氯气中燃烧:高中化学方程式书写练习一14. 氢氧化铁加热分解:_2Fe(OH)^= Fe2Q+ 3HzO_15. 氢氧化亚铁在空气中被氧化:4Fe(OH)2+ Q+4Fe(OH)316. 除去FeCl2 中的FeCb:2FeCl s+ Fe= 3FeCL _离子方程式:_2Fe + Fe = 3Fe1 2氧化剂:―FeCI 3_还原剂:_ Fe_17. FeCI 2和Cl 2 反应:_2FeCl2 + Cb= 2FeCI 3_离子方程式:_2Fe2十+ Cl 2= 2Fe3* + 2C「_18. FeCl 3和Cu反应:_2FeCb+ Cu= 2FeCb+ CuCb_离子方程式:_2Fe3十+ Cu= 2Fe2*+ CiT _3NHCI_离子方程式:_ Fe3十+ 3NH・HO= Fe(OH)3〈 + 3NH*_22. 氯化铁溶液跟少量锌粉反应:2FeCb+ Zn= 2FeCI2 + ZnCI2离子方程式:_2Fe3* + Zn= 2Fe2* + Zn2+ __23. 氯化铁溶液跟过量锌粉反应:2FeCI 3+ 3Zn= 2Fe+ 3ZnCI 2离子方程式:5Fe2 ++ MnO + 8』=5Fe3+ + M K++ 4fO7. 氧化铁溶于氢碘酸溶液:___ Fe 2Q + 6HI = 2Fel 2+12+3fO _________ + 2 +离子方程式:Fe2Q+2l_ + 6H = 2Fe + I2 + 3fO8. 氯化铁溶液中滴加少量硫化钠溶液:2FeCl3+ N@S= 2FeCI2+ S J + 2NaCI离子方程式:2Fe'+ + S = S J + 2Fe?+ _9. 氯化铁溶液中滴加过量硫化钠溶液:2FeCI 3+ 3N@S= 2FeS J + S J + 6NaCI离子方程式:2Fe'+ + 3S? = 2FeS J + S J ________10. 硅与氧气加热:_ Si + O^^SiO211. 硅与氟气:Si + 2F2= SiF412. 硅单质与氢氟酸反应:_ Si + 4HF= SiF4f + 2H413. 硅与氢氧化钠溶液反应:Si + 2NaOH+ HaO= NazSiO3+ 2H d14. 二氧化硅与氢氟酸反应:4HF+ SiO2= SiF4f + 2fO高中化学方程式书写练习一 氧化剂: ―FeCI 3 还原剂: Cu19. 氯化铁与硫氰化钾溶液反应: Fe 3+ + 3SCN I = Fe(SCN )320. 氯化铁溶液中滴加少量碘化钾溶液:_2FeCb + 2KI = 2FeCb + 2KCb + I 23亠 一 2亠离子方程式: 2Fe + 21 = 2Fe + I 221. 氯化铁溶液跟过量氨水反应:FeCl 3 + 3NH • HO = Fe(OH )3 J +1. 用氯化铁与沸水反应制氢氧化铁胶体:FeCb+ 3H2O- Fe(0H)3 (胶体)+ 3HCI2. 硫化氢气体与氯化铁溶液反应:_2FeCb+ H b S= 2FeCI 2+ S J + 2HCI离子方程式:_2Fe3++ HbS= 2Fe2 ++ S J + 2H〔3. 硫化亚铁与盐酸反应:FeS+ 2HCI= FeCH HS f4. 四氧化三铁溶于浓盐酸:__ Fe 3O+ 8HCI= 2FeCl s+ FeCa+ 4H2O _I 3 + 2 +离子方程式:Fe s O l 8H = 2Fe + Fe + 4fO5. 硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2FeSO4+ H2Q+ H2SQ= Fe2(SO4)3+ 2H02 + +3 亠离子方程式:2Fe + H2Q + 2H = 2Fe + 2HO6. 硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:___10FeSQ + 2KMnO+ 8HzSQ= 5Fe2(SO4)3 + 2MnSO+ K2SQ + 8H2O ____________________________________________________________高中化学方程式书写练习一咼温SQ 2+ 2C Si + 2COT氧化剂: Si0 2— 还原剂:__C ________18. 硅酸钠与盐酸反应: N@SiO 3 + 2HCI = H2SQ 3 J + 2NaCI 离子方程式: SQ 3 + 2H = H 2SQ 3 J _19. 往硅酸钠溶液中通入少量二氧化碳:NaSiO 3+ C0+ H0= H 2SiO 3 J + NaC03_2一 2-离子方程式:__SiO 3 + CO + H bO= H 2SQ 3J + CO - _20. 往硅酸钠溶液中通入过量二氧化碳: NazSiQ + 2CO + 2H 2O= H2SQ 3 J + 2NaHCO2 一离子方程式:_ SiO 3 + 2CO + 2fO= H 2SiO 3 J + 2HCO咼温21. 二氧化硅与纯碱反应: _ SiO 2+ NaCO 咼NQSQ 3+ CO f高温 22.二氧化硅与石灰石反应: SQ 2+ CaCOCaSiQ + CO f23. 加热硅酸:_ H z SiO^^ SQ 2+ H 2O24. 向碳酸氢钙溶液中加入过量的氢氧化钠:__ Ca(HCQ) 2+ 2NaOH = CaCOJ + 2H 2O+ Na p CO ________2 + _ 2 _离子方程式:2HCO + Ca + 2OH = CaCOj + 2H 2O + CO 25. 向碳酸氢钙溶液中加入少量的氢氧化钠: ______________ __ Ca(HCQ )2+NaO = CaCOj + H 2O+NHCO_ 咼温 15.二氧化硅与氧化钙咼温反应: SQ 2+ Ca<^^=CaSiO_16.二氧化硅与氢氧化钠溶液反应:SiO 2+ 2NaOH= Ns t SiO a + HO _ 17.二氧化硅与碳反应:离子方程式:c/十 + HCO + OH = CaCOj+ H2O26. 碳酸氢铵溶液中加入过量氢氧化钠溶液:NHHCO+ 2NjOH= NH3f + N@CO+ 2H2O离子方程式:NH4+ + HCO + 2OH = NH f+ CO2-+ 2fO1. 水煤气的制取:_ C + H2O^^ CO~ H __________________2. 用氢气还原四氯化硅:2Hk+ SiCI 4Si + 4HCI_3. 碳酸氢镁溶液中加少量氢氧化钙:_ Mg(HCO)2 + Ca(OH)2 = CaCO J + MgCOj + 2fO2丄_ 2丄_离子方程式:Mg + 2HCO + Ca + 2OH = CaCOj + MgCOj + 2HO4. 碳酸氢镁溶液中加过量氢氧化钙:Mg(HCO>2+ 2Ca(OH)2= 2CaCOj + Mg(OH》J + 2HzO2丄_ 2丄_离子方程式:Mg + 2HCO + 2Ca + 4OH = 2CaCOj+ Mg(OH)4+ 2fO5. 实验室制氯气:MnO+ 4HCI(浓)MnCl 2+ Cl 2 f + 2H2O离子方程式:MnO+ 4』+ 2CI 也=Mn2++ Cl 2 f + 2H2O氧化剂:___MnQ 还原剂:HCI6. 高锰酸钾固体加入浓盐酸:2KMnO+ 16HCI(浓)=2KCI+ 2MnCI2 +5CI2T + 8H2O离子方程式:2Mn OT+ 16』+ 10C「= 2M6++ 5Cl2f + 8fO7. 钠在氯气中燃烧:_2Na+ Cl 2亠丄2NaCI_8. 铜在氯气中燃烧:Cu + Cl 2 諛CuCI 29. 氢气在氯气中燃烧:_ H2+ CI2 2HCI_氧化剂:―CI 2 还原剂:H2高中化学方程式书写练习一10. 磷与少量氯气反应:2P + 3CI2 2PCI3 _______________一咼温11. 硅与氯气在高温下反应:_ Si + 2CI2 SiCI 4 _12. 氯气和水反应:_ CI 2+ H2O= HCI + HCIO离子方程式:Cl 2 + HO= H + Cl + HCIO氧化剂:__CI 2_ 还原剂:_ CI 2_13. 次氯酸光照分解:2HCI0 垒丄2HCI + Q f _14. 氯水中通入二氧化硫:CI2+ SQ+ 2H2O= H2SQ+ 2HCI离子方程式:CI2+ SQ+ 2H2Q= 4H+ + SQ2「+ 2CI「氧化剂:—CI 2 还原剂:SQ215. 氯气与冷氢氧化钠溶液:CI2+ 2NaQH= NaCI+ NaCIQ+ H2Q离子方程式:Cl 2 + 2QH= C「+ CIQ「+ HQ16. 氯气与热的氢氧化钠溶液:3Cb + 6NaQH“ 5NaCI + NaCIQ+ 3HQ离子方程式:3CI 2+ 6Q^^= 5C「+ CIQ3「+ 3HQ17. 工业生产漂白粉:_2Ca(QH)2 + 2CI2= Ca(CIQ) 2 + CaC“+ 2HQ18. 向漂白粉溶液中加入稀盐酸:Ca(CIQ) 2+ 2HCI= CaCb+ 2HCIQ离子方程式:—CIQ「+』=HCIQ ______________19. 次氯酸钙溶液中通入少量二氧化碳:Ca(CIQ) 2+ CQ+ fQ= CaCQ j+ 2HCIQ2+ 一离子方程式:Ca + 2CIQ + CQ + HQ= CaCQj + 2HCIQ20. 次氯酸钙溶液中通入过量二氧化碳:Ca(CIQ)2 + 2CQ + 2fQ= Ca(HCQ)2 + 2HCIQ离子方程式:CIQ 一+ CQ+ HQ= HCQ一+ HCIQ21. 次氯酸钙溶液通入SQ: Ca(CIQ) 2+ SQ+ HQ= CaSQJ + HCI + HCIQ2+ _ _ 丄离子方程式:Ca + 2CIQ_ + SQ+ HQ= CaSQ j + Cl_ + H+ HCIQ22. 氯气通入碳酸氢钠溶液:_ Cl 2 + NaHCQ= NaCI+ CQ+ HCIQ___离子方程式:Cl 2+ HCQ = Cl + CQ+ HCIQ23. 氯气通入溴化钾溶液:Cl2+ 2KBr= B“+ 2KCI离子方程式:CI2+ 2Br「= B Q+ 2CI 一24. 氯气通入碘化钾溶液:CI2+ 2KI = 12+ 2KCI离子方程式:CI2+ 21 = 12+ 2CI25. 溴水和碘化钾溶液反应:B“+ 2KI = I2+ 2KBr离子方程式:Br 2 + 21 = 12 + 2BrL圧北柚I。
(完整word)初中化学方程式书写练习题(经典题型)

化学方程式的书写练习一、化合反响:1、碳在氧气中完整焚烧生成二氧化碳。
2、碳在氧气中不完整焚烧生成一氧化碳。
3、一氧化碳在氧气中点燃生成二氧化碳。
4、二氧化碳在灼热的碳中生成一氧化碳。
5、往水中通入二氧化碳,生成碳酸。
6、铁在氧气中点燃生成四氧化三铁。
7、磷在氧气中点燃生成五氧化二磷。
8、铜在空气中加热生成氧化铜。
9、硫在氧气中点燃生成二氧化硫。
10、二氧化硫加水生成亚硫酸。
11、二氧化硫在空气中氧化为三氧化硫。
12、三氧化硫通入水中生成硫酸。
13、氢气在空气中点燃生成水。
14、氢气在氯气中点燃生成氯化氢气体。
15、氧化钙加水生成氢氧化钙。
二、分解反响:16、在二氧化锰的催化作用下加热氯酸钾,生成氯化钾和氧气。
17、加热高锰酸钾,生成锰酸钾、二氧化锰和氧气。
18、电解水,生成氢气和氧气。
19、在二氧化锰的催化作用下分解双氧水,生成水和氧气。
20、加热碳酸,分解为二氧化碳和水。
21、碳酸钙高温生成氧化钙和二氧化碳。
22、碳酸氢钠加热生成碳酸钠和二氧化碳。
23、加热碱式碳酸铜,生成氧化铜、水和二氧化碳。
三、置换反响:( 1)金属和酸反响,置换出氢气。
24、铁和稀盐酸反响,生成氯化亚铁和氢气。
25、铁和稀硫酸反响,生成硫酸亚铁和氢气。
26、镁和稀盐酸反响,生成氯化镁和氢气。
27、镁和稀硫酸反响,生成硫酸镁和氢气。
28、铝和稀硫酸反响,生成硫酸铝和氢气。
29、铝和稀盐酸反响,生成氯化铝和氢气。
30、锌和稀盐酸反响,生成氯化锌和氢气。
31、锌和稀硫酸反响,生成硫酸锌和氢气。
( 2)金属和盐溶液反响,置换出金属。
32、铁和硫酸铜反响,生成硫酸亚铁和铜。
33、铁和硝酸铜反响,生成硝酸亚铁和铜。
34、铁和氯化铜反响,生成氯化亚铁和铜。
35、铁和硝酸银反响,生成硝酸亚铁和银。
36、铜和硝酸银反响,生成硝酸铜和银。
37、镁和硫酸锌反响,生成硫酸镁和锌。
38、镁和硫酸亚铁反响,生成硫酸镁和铁。
39、镁和硫酸铜反响,生成硫酸镁和铜。
(完整版)高中化学方程式书写练习

1.碳酸氢铵受热分解2.氯气与水反响3.将二氧化氮和氧气的混淆气体通入水中4.硅与氢氧化钠溶液反响5.硫与铜反响6.二氧化硅与氢氟酸反响7.硫酸氢钠在水中电离8.乙烯与溴化氢反响9.苯的硝化反响10.实验室制甲烷高中化学方程式书写练习(二)1.硫化氢气体与氯化铁溶液反响2.氧化铝与烧碱溶液反响3.二氧化硫与硫化氢反响4.氯气与铜反响5.硫与浓硫酸反响6.过氧化钠与水反响7.红磷与白磷的互相转变8.苯与液溴反响9.乙醇的消去反响10.乙酸甲酯的水解高中化学方程式书写练习(三)1.铝与烧碱溶液反响2.氮气与镁反响3.氨气与氯化氢反响4.氧气与臭氧的转变5.氧化钠与盐酸反响6.溴化银分解7.二氧化硅与碳反响8.实验室制乙炔9.苯的焚烧10.由甲苯制取 TNT1.实验室制氯气2.浓硝酸分解3.磷与少许氯气反响4.二氧化硅与碳酸钙反响5.氟气与水反响6.过氧化钠与二氧化碳反响7.往氯化铝溶液中滴入过度的烧碱溶液8.乙烯与水反响9.制取聚氯乙烯10.苯酚钠溶液与二氧化碳反响高中化学方程式书写练习(五)1.铁与稀硝酸反响2.硫化氢与浓硫酸反响3.二氧化氮与水反响4.镁与二氧化碳反响5.往偏铝酸钠溶液中滴入少许盐酸6.二氧化硅与氢氧化钠反响7.铜与氯化铁溶液反响8.乙烯与氢气反响9.苯酚与氢氧化钠反响10.乙醛的银镜反响高中化学方程式书写练习(六)1.将过度的二氧化碳通入偏铝酸钠溶液中2.黄铁矿与氧气反响3.硅与氢氟酸反响4.过氧化钠与盐酸反响5.一氧化氮与氧气反响6.电解饱和食盐水7.铝与氧化铁反响8.溴乙烷与氢氧化钠溶液反响9.乙醛与氢气反响10.淀粉的水解1.二氧化硫与氧气反响2.工业上制漂白粉3.将过度盐酸滴入偏铝酸钠溶液中4.氨的催化氧化5.电解熔融氯化钠6.将氯气和二氧化硫的混淆气体通入水中7.氢氧化亚铁在空气中被氧化8.乙炔与氯化氢反响9.麦芽糖的水解10.苯酚与浓溴水反响高中化学方程式书写练习(八)1.碳酸氢钠与少许氢氧化钙反响2.工业上制氨气3.明矾净水原由4.铁与氯化铁溶液反响5.氯化铝与氨水反响6.镁与热水反响7.胆矾受热分解8.实验室制乙烯9.苯与氢气反响10.乙醇与钠反响高中化学方程式书写练习(九)1.氮气与氧气反响2.往次氯酸钙溶液中通入少许二氧化碳3.铜与浓硝酸反响4.往溴化亚铁溶液中通入足量氯气5.钠与硫酸反响6.碳酸氢钠与氢氧化钠反响7.硫化氢与少许氧气反响8.制聚乙烯9.甲烷与氯气反响10.乙炔与溴水反响1.硫化氢与硫酸铜溶液反响2.氯化铝与碳酸氢钠溶液反响3.将一氧化氮和二氧化氮的混淆气体通入烧碱溶液中4.双氧水分解5.实验室制氨气6.铁与碘反响7.氯气与热的氢氧化钾溶液反响8.乙醛与新制氢氧化铜反响9.乙醇的催化氧化10.苯的磺化反响高中化学方程式书写练习(十一)1.二氧化硫与过氧化钠反响2.木炭与浓硝酸反响3.实验室制氯化氢4.磁铁矿与一氧化碳反响5.二氧化碳与硅酸钠溶液反响6.氨水与氢硫酸反响7.铁与水蒸气反响8.乙烯与溴水反响9.钠与苯酚反响10.乙醇分子间脱水高中化学方程式书写练习(十二)1.硫酸铜与氢氧化钡溶液反响2.二氧化硅与生石灰反响3.将氨气与二氧化碳的混淆气体通入食盐水中4.钾在氧气中焚烧5.水煤气的制取6.氧化银与氨水反响7.铜与浓硫酸反响8.苯酚电离9.溴乙烷的消去反响10.制取乙酸乙酯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学方程式的书写
一、写出下列反应的化学方程式:
1、镁在空气中燃烧:______________________ _____
2、铁在氧气中燃烧:____________________ _______
3、铜在空气中受热:______________ _____________
4、铝在空气中燃烧:_________________ __________
5、氢气中空气中燃烧:__________ _______________
6、红磷在空气中燃烧:_______________ ___ ______
7、硫粉在空气中燃烧:__________________ _______
8、碳在氧气中充分燃烧:______________________ _ _
9、碳在氧气中不充分燃烧:____________________________________
10、葡萄糖缓慢氧化(呼吸作用):___________________________ _____
11、利用过氧化氢和二氧化锰的混合物制氧气:_________________________________
12、水在直流电的作用下分解:_______________________________________________
13、加热氯酸钾:___________________________________________________________
14、加热高锰酸钾:_________________________________________________________
二、配平下列化学方程式:
(一) 最小公倍数法:
(找出两边同种原子的个数最多的原子,然后求最小公倍数,得原子个数。
)
1、Al + O2——Al2O3
2、Al + Fe3O4——Fe + Al2O3
3、Fe + O2——Fe3O4
4、Al + MnO2——Mn + Al2O3
5、N2+ H2——NH3
6、Al + H2SO4——Al2(SO4)3 + H2
(二) 观察法:
(观察顺序:从复杂入手,推导其它)(具体观察顺序——O、C、Fe)
1、CO + Fe2O3 ——Fe + CO2
2、C + Fe2O3——Fe + CO2
3、CO + Fe3O4 ——Fe + CO2
4、C + Fe3O4——Fe + CO2
5、H2 + Fe2O3——Fe + H2O
6、H2 + Fe3O4——Fe + H2O
10、H2 + WO3——W + H2O 11、CO + O2 ——CO2
12、Fe + H2O——H2 + Fe3O413、Al(OH)3+ HCl ——AlCl3 + H2O
(三) 奇数配偶法:
(找出左右两边出现次数较多的元素,该元素的原子个数在两边为一基数一偶数)
1、FeS2 + O2 ——Fe2O3 + SO2
2、C2H2 + O2——CO2+ H2O
3、C + Fe2O3——Fe + CO2
4、MnO2 + HCl——MnCl2 + Cl2 + H2O
5、Cl2 + Ca(OH)2——CaCl2 + Ca(ClO)2 + H2O
(四) 归一法:
(找出化学式中原子数目最多的化学式,使其化学计量数为“1”,观察配平,若是分数再进行通分去掉分母,保证最后得到最简整数比)
1、C2H2 + O2——CO2 + H2O
2、C6H6 + O2——CO2 + H2O
3、C22H46 + O2——CO2 + H2O
4、NH3 + Cl2 ——NH4Cl + N2
5、As2O3+ Zn + HCl——AsH3+ ZnCl2+ H2O
6、C X H Y+ O2——CO2+ H2O
三、题型变化:
1、3Cu+8HNO3 ==3Cu(NO3)2+2X↑+4 H2O,求X的化学式为。
2、R+3O2==2CO2+3H2O 求R的化学式为。
3、4K2Cr2O8==4K2CrO4+2R+3O2求R的化学式为。
4、a C3H6+b O2==c CO2+d H2O 找出a、b、c 之间的等量关系。
四、根据信息书写化学方程式练习:
1、发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮(N2O4)作氧化剂,燃烧尾气由氮气
和水蒸气组成。
试写出反应的化学方程式。
2、用粮食作原料酿酒时,往往发现制得的酒发酸,这实际上是因为酒精(C2H5OH)在酶的作用
下与空气中的氧气作用,生成了醋酸(CH3COOH)和水,请你写出该反应的化学方程式为。
3、工业上常用接触法制硫酸(H2SO4),所使用的原料是硫铁矿(主要含FeS)。
在高温下,将硫
铁矿的粉末与氧气充分反应生成三氧化二铁和二氧化硫,再经过一系列转化可生成硫酸。
试写出硫铁矿与氧气反应的化学方程式,在这个反应中铁由+2价升到+3价,硫元素的化合价由。
4、壁画颜料中的铅白[Pb2(OH)2CO3]由于受到空气中硫化氢气体的作用而变成黑色硫化铅(PbS),
影响画面的色泽。
当用双氧水处理时就可以使黑色的硫化铅氧化成白色硫酸铅和水,试写出双氧水处理硫化铅的化学方程式。
5、哥伦比亚号航天飞机曾用金属铝和高氯酸铵(NH4ClO4)的混合物作为固体燃料。
加热铝粉
使其被氧气氧化,放出大量的热,促使混合物中的高氯酸铵受热分解,同时生成四种气体:两种气体是空气中的主要成分,一种气体是Cl2,还有一种气体是化合物(常温下是液态),因而产生巨大的推动力。
试写出其中涉及的化学方程式:
⑴、铝粉被氧气氧化成三氧化二铝:;
⑵、高氯酸铵受热分解:;
6、在通常情况下,碳单质的化学性质稳定,但它在常温下可与一种叫高氯酸的物质发生反石墨,
产物除水是液体外,其余都是气体,一种是有毒的氯气(Cl2),一种是无色无毒的化合物。
请写出此反应的化学方程式:。
7、砷化氢AsH3是一种很强的还原剂,在室温下它能在空气中自燃,其氧化产物是砒霜(As2O3),
写出该反应的化学方程式:
8、将黑色氧化铜粉末装入试管中加热,通入氨气(NH3)则生成红色的铜、水和一种气体单质,
该反应的化学方程式:。
