《离子键和离子晶体》PPT课件
合集下载
离子键、离子晶体(课件PPT)
53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。
人教选修 离子晶体 课件张ppt文档

实质:一般情况下,离子晶体中阴、 阳离子半径越小,电荷数越多,离 子键越强,熔沸点越高,硬度越大。
请思考:NaF,NaCl,NaBr,NaI晶体其熔 沸点的高低顺序?
NaF>NaCl>NaBr>NaI
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
பைடு நூலகம்
Cs+
5
1 3
4 2
6
小结
离子 阴离子的 阳离子的 阴阳离子配位 晶体 配位数 配位数 数的比值
NaCl 6
6
1:1
CsCl 8
8
1:1
(3)CaF2型晶胞
①Ca2+的配位数:8 ②F-的配位数: 4 ③一个CaF2晶胞中 含:
4个Ca2+和8个F-
Ca2+在顶点和面心,F-在体内。
(4)ZnS型晶胞
铯离子:体心
氯离子:顶点;或者反之。 (2)每个晶胞含铯离子、氯 离子的个数 铯离子:1个 ;氯离子:1个 (3)与铯离子等距离且最近 的铯离子、氯离子各有几个?
铯离子:6个 ;氯离子:8个
在CsCl晶体中 每个Cs+周围同时吸引着8个Cl每个Cl-周围同时吸引着8个Cs+
每个Cs+周围与它最近且距离相等的Cs+共有6___个 每个Cl-周围与它最近且距离相等的Cl- 共有__6__个
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
Na+:4 Cl-: 4 Cs+:1 Cl-:1
请思考:NaF,NaCl,NaBr,NaI晶体其熔 沸点的高低顺序?
NaF>NaCl>NaBr>NaI
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
பைடு நூலகம்
Cs+
5
1 3
4 2
6
小结
离子 阴离子的 阳离子的 阴阳离子配位 晶体 配位数 配位数 数的比值
NaCl 6
6
1:1
CsCl 8
8
1:1
(3)CaF2型晶胞
①Ca2+的配位数:8 ②F-的配位数: 4 ③一个CaF2晶胞中 含:
4个Ca2+和8个F-
Ca2+在顶点和面心,F-在体内。
(4)ZnS型晶胞
铯离子:体心
氯离子:顶点;或者反之。 (2)每个晶胞含铯离子、氯 离子的个数 铯离子:1个 ;氯离子:1个 (3)与铯离子等距离且最近 的铯离子、氯离子各有几个?
铯离子:6个 ;氯离子:8个
在CsCl晶体中 每个Cs+周围同时吸引着8个Cl每个Cl-周围同时吸引着8个Cs+
每个Cs+周围与它最近且距离相等的Cs+共有6___个 每个Cl-周围与它最近且距离相等的Cl- 共有__6__个
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
Na+:4 Cl-: 4 Cs+:1 Cl-:1
4离子键-离子晶体2016

C
练习2:CaF2晶体
阴离子配位数
4
阳离子配位数 8
CaF2晶胞
每个F 周围最 — 近且等距离的F 有 6 个 2+ 每个Ca 周围 最近且等距离的 2+ Ca 有 12 个
每个晶胞中
_
F有 CaF2晶胞
2+
_
8 个
个
Ca 有 4
三、离子晶体
1、定义:离子间通过离子键结合而成的 晶体。 注意:无单个分子存在;NaCl不表示分子 式。 2、性质:熔沸点较高,硬度较大,难挥 发难压缩 水溶液或者熔融状态下均导电。 3、包括:强碱、部分金属氧化物、大部 分盐类、类盐。
氯化钠晶体
氯 化 钠
Cl-
Na+
【问题探究】
①在NaCl晶体中 + 每个Na 同时吸引 6 个Cl-,每 着____ 个Cl 同时吸引几 + 个____Na 。 6
请根据刚才学习氯化钠结构的方 法研究氯化铯的空间结构
交流与讨论
在CsCl晶体中,每个Cs+同时吸引( Cl-,每个Cl- 同时吸引( 8 )个Cs+。 CsCl型离子配为数为:8
ቤተ መጻሕፍቲ ባይዱ8 )个
在CsCl晶体中,每个Cs+周围与它最接近且 距离相等的Cs+共有( 6 )个。
属于CsCl型离子晶体的还有
Cs Br、 Cs I、NH4Cl等
3.离子晶体的化学式实质就是阴阳 离子的最简个数比, 通过确定晶胞 的方法确定化学式。
练
习
1.高温下,超氧化钾晶体(KO2)呈立方体结构。如图 为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。 则有关下列说法正确的是( ) A.KO2中只存在离子键 B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和 1个O2- C.晶体中与每个K+距离最近的 O2-有6个 D.晶体中,所有原子之间都是以 离子键结合
《离子键和离子晶体》PPT课件

黄玉al所以该规则可以确定各种无机离子多面体的连接方式随着电能应用的不断拓展以电能为介质的各种电气设备广泛进入企业社会和家庭生活中与此同时使用电气所带来的不安全事故也不断发生四面体和八面体的连接方式示例四面体阴离子配位多面体八面体阴离子配位多面体连接方式化学式示例连接方式化学式示例2个四面体共顶点11nb20mo10ax3个四面体共顶点ax3dfef4个四面体共顶点ax10有限分子nbcl10四面体共pboax随着电能应用的不断拓展以电能为介质的各种电气设备广泛进入企业社会和家庭生活中与此同时使用电气所带来的不安全事故也不断发生3pauling的第三规则负离子多面体共棱共面规则在配位多面体连接中公用多面体的棱特别是公用多面体的面将会降低结构的稳定性
物
(nm)
物 数(nm) 物
(nm)
物 数(nm)
NaC l
0.5628
BaO 0.5523 NiO
0.4168
CrN
0.4140
NaI 0.6462 CdO 0.4700 TiN 0.4235 ZrN 0.4610
Mg O
0.4203
CoO 0.4250 LaN 0.5275
CaO 0.4797 MnO 0.4435 TiC 0.4320
nn
n :晶体分子式中正离子的个数
n :晶体分子式中负离子的个数
例C 如 2 a C : 1 2 l 3 U (N)a 1 C .2 0 l15 2 02 1(1 3.5 4)
9 5 189 1 5 181
精选ppt
28
点阵能
定义:由1mol气态的Mz+和Xz-离子生成 1molMX晶体时,释放出的总能量,它是离
MnCr2S
4
CoCr2S4
物
(nm)
物 数(nm) 物
(nm)
物 数(nm)
NaC l
0.5628
BaO 0.5523 NiO
0.4168
CrN
0.4140
NaI 0.6462 CdO 0.4700 TiN 0.4235 ZrN 0.4610
Mg O
0.4203
CoO 0.4250 LaN 0.5275
CaO 0.4797 MnO 0.4435 TiC 0.4320
nn
n :晶体分子式中正离子的个数
n :晶体分子式中负离子的个数
例C 如 2 a C : 1 2 l 3 U (N)a 1 C .2 0 l15 2 02 1(1 3.5 4)
9 5 189 1 5 181
精选ppt
28
点阵能
定义:由1mol气态的Mz+和Xz-离子生成 1molMX晶体时,释放出的总能量,它是离
MnCr2S
4
CoCr2S4
苏教版高三化学课件物质结构与性质离子键 离子晶体

练习4:[教材P40 问题解决] 练习5:[作业本P35 题16]
作业
• 作业本 P34~38 • 教材 P42 练习与实践 • 预习第三单元 共价键 原子晶体
作业
• • • • 作业本 P67~68 精讲精练 P118~119 划去题1、10、12 熟读附录Ⅰ~Ⅶ键
1、定义 (1)构成对象 (2)形成原因 (3)力的本质 静电作用: 2、方向性、饱和性 :无
3、强弱 离子所带电荷数
阴、阳离子核间距
练习1:[作业本 P35 题8] 练习2:[作业本 P36 题4]
一、离子键
4、形成过程表示式
书写规则: (1)反应物为原子,产物为化合物,均写成电子式 (2)形成过程用“→”表示 (3)得失的电子书写时尽量朝向空轨道对应的位置
练习3:[作业本 P35 题14(2)]
二、离子晶体
1、晶格能 (1)定义 (2)表示式:AxBy(s)→xAy+(g)+yBx-(g) ΔH >0 (3)含义: (1)晶格能越大,离子键越_____ 难 高 ,硬度越 被破坏 ,熔沸点越_____ 大 。 _____
大 , (2)离子电荷越大,晶格能越____ 阴、阳离子核间距越大,晶格能越 小 。 _____
二、离子晶体
2、常见离子晶体 (1)NaCl
①一个Na+周围最近距离有 6 个Cl-,分别位于晶胞的 _____ 什么位置? ②Na+是否只对这几个Cl-有离 子键的作用? 6 个 ③一个Cl-周围最近有____ Na+? 4 个Na+、 ④每个晶胞内有____ 4 个Cl____
二、离子晶体
2、常见离子晶体 (2)CsCl
离子键和离子晶体

(2)同一周期中电子层结构相同的阳离子的半 径,随离子的电荷数的增加而减小;而阴离子的半 径随离子的电荷数减小而增大。
(3)1 族、2 族、13~17 族的同族电荷数相同 的离子的半径,随离子的电子层数增加而增大。
8
第二节 离子晶体
一、晶格和晶胞 二、离子晶体的特征 三、离子晶体的类型 四、离子晶体的半径比规则
9
固体可分为晶体和非晶体两大类。 晶体与非晶体的主要区别是: (1)晶体一般具有整齐规则的几何外形,而非晶 体(如玻璃、沥青、石蜡等)没有固定的几何外形。 (2)晶体具有固定的熔点,而非晶体没有固定的 熔点。 (3)晶体具有各向异性,其某些物理性质在不同 方向上是不同的(如石墨在与层垂直方向上的电导率 为与层平行方向上的 1/104 ),而非晶体的物理性质在 不同方向上都相同。
2
第一节 离 子 键
一、离子键的形成
二、离子键的特征 三、离子的特征
3
一、离子键的形成
当电负性较小的活泼金属元素的原子与电负性 较大的活泼非金属元素的原子相互接近时,金属原 子失去最外层电子形成带正电荷的阳离子;而非金 属原子得到电子形成带负电荷的阴离子。阳、阴离 子之间除了静电相互吸引外,还存在电子与电子、 原子核与原子核之间的相互排斥作用。当阳、阴离 子接近到一定距离时,吸引作用和排斥作用达到了 平衡,系统的能量降到最低,阳、阴离子之间就形 成了稳定的化学键。这种阳、阴离子间通过静电作 用所形成的化学键称为离子键。
在离子晶体中,阳、阴离子被限制在晶格格 点上振动,不能移动,因此离子晶体不导电。但 是当离子晶体熔融或溶于水时,产生自由移动的 阳、阴离子,从而可以导电。
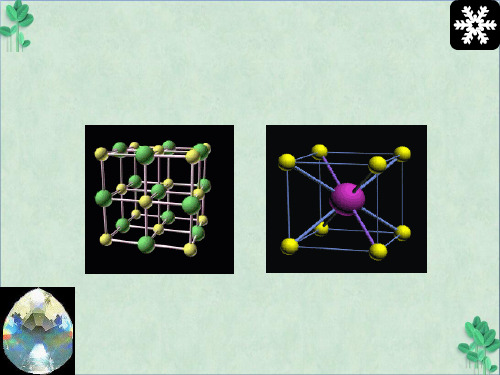
14
三、离子晶体的类型
在离子晶体中,由于阳、阴离子在空间的排列方 式不同,因此离子晶体的空间结构也就不相同。对于 AB 型离子晶体,常见的有 CsCl 型、NaCl 型和 ZnS 型三种典型晶体结构类型。
(3)1 族、2 族、13~17 族的同族电荷数相同 的离子的半径,随离子的电子层数增加而增大。
8
第二节 离子晶体
一、晶格和晶胞 二、离子晶体的特征 三、离子晶体的类型 四、离子晶体的半径比规则
9
固体可分为晶体和非晶体两大类。 晶体与非晶体的主要区别是: (1)晶体一般具有整齐规则的几何外形,而非晶 体(如玻璃、沥青、石蜡等)没有固定的几何外形。 (2)晶体具有固定的熔点,而非晶体没有固定的 熔点。 (3)晶体具有各向异性,其某些物理性质在不同 方向上是不同的(如石墨在与层垂直方向上的电导率 为与层平行方向上的 1/104 ),而非晶体的物理性质在 不同方向上都相同。
2
第一节 离 子 键
一、离子键的形成
二、离子键的特征 三、离子的特征
3
一、离子键的形成
当电负性较小的活泼金属元素的原子与电负性 较大的活泼非金属元素的原子相互接近时,金属原 子失去最外层电子形成带正电荷的阳离子;而非金 属原子得到电子形成带负电荷的阴离子。阳、阴离 子之间除了静电相互吸引外,还存在电子与电子、 原子核与原子核之间的相互排斥作用。当阳、阴离 子接近到一定距离时,吸引作用和排斥作用达到了 平衡,系统的能量降到最低,阳、阴离子之间就形 成了稳定的化学键。这种阳、阴离子间通过静电作 用所形成的化学键称为离子键。
在离子晶体中,阳、阴离子被限制在晶格格 点上振动,不能移动,因此离子晶体不导电。但 是当离子晶体熔融或溶于水时,产生自由移动的 阳、阴离子,从而可以导电。
14
三、离子晶体的类型
在离子晶体中,由于阳、阴离子在空间的排列方 式不同,因此离子晶体的空间结构也就不相同。对于 AB 型离子晶体,常见的有 CsCl 型、NaCl 型和 ZnS 型三种典型晶体结构类型。
第三章 化学键和晶体结构第一节 离子键和离子晶体

期性而非晶态物质不具有周期性所致
2023/2/19
11
(二)离子晶体及其特征结构
(1)离子晶体(ionic crystals) 靠离子 间引力结合而成的晶体 (2)特点
•晶格结点上交替排列着正、负离子,依静电引力结合 •离子键没有饱和性和方向性,正负离子按一定配位数在空 间排列,不存在单个分子,而是一个巨大的分子,如NaCl只表示 晶体的最简式 •因静电引力较强,离子晶体有较高熔、沸点和硬度。离子 电荷越高,半径越小,静电引力越强,熔、沸点越高,硬度越大 •熔融时或水溶液是电的良导体,但固态不导电
H- 208
Br7+
39
Cr6+
52
Hg2+ 110
B3+
20 Co2+ 74
In3+ 81
Bi5+
74
Cr3+
64
I7+
50
Ba2+ 135 Cu+ 96
I-
216
Be2+ 31
Cs+ 169
K+
133
Li+ 60
La3+ 115
Mn7+ 46
Mn2+ 80
Mo6+ 62
Mg2+ 65
N3- 171
6
离子 半径 离子 半径 离子 半径 离子 半径 离子 半径 离子 半径 离子 半径
Ag+ 126 C4- 260
Fe2+ 76
Al3+
50
Ca2+
99
Fe3+ 60
As3+ 47 Cd2+ 97
F-
136
As3- 222 Cl7+ 26
Ge4+ 53
Au+ 137 C4+
15
Ga3+ 62
Br- 195 Cl- 181
5. 了解价层电子互斥理论的基本要点,并能用其解释多原子分子或离子的空 间构型
2023/2/19
11
(二)离子晶体及其特征结构
(1)离子晶体(ionic crystals) 靠离子 间引力结合而成的晶体 (2)特点
•晶格结点上交替排列着正、负离子,依静电引力结合 •离子键没有饱和性和方向性,正负离子按一定配位数在空 间排列,不存在单个分子,而是一个巨大的分子,如NaCl只表示 晶体的最简式 •因静电引力较强,离子晶体有较高熔、沸点和硬度。离子 电荷越高,半径越小,静电引力越强,熔、沸点越高,硬度越大 •熔融时或水溶液是电的良导体,但固态不导电
H- 208
Br7+
39
Cr6+
52
Hg2+ 110
B3+
20 Co2+ 74
In3+ 81
Bi5+
74
Cr3+
64
I7+
50
Ba2+ 135 Cu+ 96
I-
216
Be2+ 31
Cs+ 169
K+
133
Li+ 60
La3+ 115
Mn7+ 46
Mn2+ 80
Mo6+ 62
Mg2+ 65
N3- 171
6
离子 半径 离子 半径 离子 半径 离子 半径 离子 半径 离子 半径 离子 半径
Ag+ 126 C4- 260
Fe2+ 76
Al3+
50
Ca2+
99
Fe3+ 60
As3+ 47 Cd2+ 97
F-
136
As3- 222 Cl7+ 26
Ge4+ 53
Au+ 137 C4+
15
Ga3+ 62
Br- 195 Cl- 181
5. 了解价层电子互斥理论的基本要点,并能用其解释多原子分子或离子的空 间构型
离子键理论PPT课件

在六方ZnS晶体中,S原子作六方最密堆积,Z原子填在 一半的四面体空隙中,形成六方点阵。
23
半径比(r+/r-)规则: 其中一层横截面: (4r)22(2r2r)2
令r 1
r/r 0.414
NaCl晶体
24
令 r_ =1, 则 ac =4 ab = bc = 2 + 2r+
因为abc为直角三角形, 所以 ac2 = ab2 + bc2 42 =2 (2 + 2r+ )2 r + =0.414
B.既无方向性又没有饱和性
5
3、影响离子键强度的因素
1) 离子电荷数的影响
2)
3) 2) 离子电子层结构
4)
2e, 8e, (9—17)e,
18e, (18+2)e
5) 3)离子半径的影响
离子半径:将离子晶体中的离子看成是相切 的球体, 正负离子的核间距 d 是r+ 和r- 之和
6) 半径大, 导致离子间距大, 所以 作用力小; 相反, 半径小, 则作用力大
6
离子半径的变化规律
①.同主族, 从上到下, 电子层增加, 具有相同电荷数的离子半径 增加.
②.同周期: 主族元素, 从左至右 离子电荷数升高, 最高价离子, 半径减小.
③.同一元素, 不同价态的离子, 正电荷高的半径小。
④.同一元素负离子半径较大; 正离子半径较小(H->H>H+)
⑤.周期表对角线上, 左上元素和右下元素的离子半径相似. 如: Li+ 和 Mg2+, Sc3+ 和 Zr4+ 的半径相似.
属于CsCl型晶体的化合物有: CsCl、CsBr、CsI、RbCl、TlCl、TlBr、 TlI、NH4Cl、NH4Br、NH4I等。
23
半径比(r+/r-)规则: 其中一层横截面: (4r)22(2r2r)2
令r 1
r/r 0.414
NaCl晶体
24
令 r_ =1, 则 ac =4 ab = bc = 2 + 2r+
因为abc为直角三角形, 所以 ac2 = ab2 + bc2 42 =2 (2 + 2r+ )2 r + =0.414
B.既无方向性又没有饱和性
5
3、影响离子键强度的因素
1) 离子电荷数的影响
2)
3) 2) 离子电子层结构
4)
2e, 8e, (9—17)e,
18e, (18+2)e
5) 3)离子半径的影响
离子半径:将离子晶体中的离子看成是相切 的球体, 正负离子的核间距 d 是r+ 和r- 之和
6) 半径大, 导致离子间距大, 所以 作用力小; 相反, 半径小, 则作用力大
6
离子半径的变化规律
①.同主族, 从上到下, 电子层增加, 具有相同电荷数的离子半径 增加.
②.同周期: 主族元素, 从左至右 离子电荷数升高, 最高价离子, 半径减小.
③.同一元素, 不同价态的离子, 正电荷高的半径小。
④.同一元素负离子半径较大; 正离子半径较小(H->H>H+)
⑤.周期表对角线上, 左上元素和右下元素的离子半径相似. 如: Li+ 和 Mg2+, Sc3+ 和 Zr4+ 的半径相似.
属于CsCl型晶体的化合物有: CsCl、CsBr、CsI、RbCl、TlCl、TlBr、 TlI、NH4Cl、NH4Br、NH4I等。
离子键离子晶体

①、活泼的金属元素(IA、IIA)和 ②、强碱
活泼的非金属元素(VIA、VIIA)形成的化合物。 ③、绝大多数盐(AlCl3除外)。
交流与讨论:
(1)离子化合物溶于水或熔化时离子键是否发生变化
转化成自由移动的离子,离子键即被破坏。
(2)离子键的存在方式
固态的离子化合物中。
(3)哪些学过的数据可作为判断离子键依据:
配位数
4
6 8 12
实例
ZnS
NaCl CsCl CsF
各类型离子晶体晶胞的比较
晶体 类型 晶胞 类型 晶胞结构 示意图 配位数 距离最近 且相等的 相反离子 每个晶 胞含有 离子数 实例
NaCl 型
Na+:6 Na+: 6 Cl-: 6 Cl-: 6 Cs+: 8 Cs+: 8 Cl-: 8 Cl-: 8
(4)与Cs+ 最近且等距离的Cs+有 6 个
(3)CaF2型晶胞
①Ca2+的配位数: 8 ②F-的配位数:4
③一个CaF2晶胞中平 均含: 4个Ca2+和8个F(4)Ca2+周围最近且等距离的Ca2+有 F-………………………F-有 6 12 个,
个。
Ca
F
晶胞上面心 图示为CaF2晶胞的1/8, 观察点为上左前方
Cl-
Na+
11 5 9 2 4 8
3 10 7 12
1
6
④与一个Cl-相邻最近且距离相等的 Cl-有 12 个?
Cl-
Na+
1.NaCl:
①与Na+等距离且
最近Cl- 有 即Na 6 +的配位 数 。
个,
活泼的非金属元素(VIA、VIIA)形成的化合物。 ③、绝大多数盐(AlCl3除外)。
交流与讨论:
(1)离子化合物溶于水或熔化时离子键是否发生变化
转化成自由移动的离子,离子键即被破坏。
(2)离子键的存在方式
固态的离子化合物中。
(3)哪些学过的数据可作为判断离子键依据:
配位数
4
6 8 12
实例
ZnS
NaCl CsCl CsF
各类型离子晶体晶胞的比较
晶体 类型 晶胞 类型 晶胞结构 示意图 配位数 距离最近 且相等的 相反离子 每个晶 胞含有 离子数 实例
NaCl 型
Na+:6 Na+: 6 Cl-: 6 Cl-: 6 Cs+: 8 Cs+: 8 Cl-: 8 Cl-: 8
(4)与Cs+ 最近且等距离的Cs+有 6 个
(3)CaF2型晶胞
①Ca2+的配位数: 8 ②F-的配位数:4
③一个CaF2晶胞中平 均含: 4个Ca2+和8个F(4)Ca2+周围最近且等距离的Ca2+有 F-………………………F-有 6 12 个,
个。
Ca
F
晶胞上面心 图示为CaF2晶胞的1/8, 观察点为上左前方
Cl-
Na+
11 5 9 2 4 8
3 10 7 12
1
6
④与一个Cl-相邻最近且距离相等的 Cl-有 12 个?
Cl-
Na+
1.NaCl:
①与Na+等距离且
最近Cl- 有 即Na 6 +的配位 数 。
个,
离子键离子晶体 完整版课件

即时应用 1. 下列叙述正确的是( ) A.离子键有饱和性和方向性 B.离子化合物只含有离子键 C.有些离子化合物既含有离子键又含有共 价键 D.离子化合物中一定含有金属元素
解析:选C。一种离子对带异种电荷离子的 吸引作用与其所处的方向无关,所以离子键 无方向性,一种离子可以尽可能多地吸引带 异种电荷的离子,所以离子键无饱和性;离 子化合物中一定含有离子键,可能含有共价 键,如NaOH;离子化合物中不一定含有金 属元素,如NH4Cl。
形成稳定的钠离子(Na+:1s22s22p6);氯原子 的电子排布式为:1s22s22p63s23p5,易得到一 个电子,达到氩原子的电子排布,形成稳定 的氯离子(Cl-:1s22s22p63s23p6);然后钠离子 (阳离子)和氯离子(阴离子)间以离子键相结合 形成氯化钠晶体。
探究导引2 离子键的形成过程中,只表现为 阴、阳离子间的静电吸引作用吗? 提示: 不是。离子键的实质是静电作用, 阴、阳离子之间的静电引力使阴、阳离子相 互吸引,阴离子的核外电子与阳离子的核外 电子之间、
新知初探自学导引
自主学习
一、离子键的形成 1. 概念:___阴__、__阳__离__子____间通过 __静__电__作__用____形成的化学键叫做离子键。 2. 形成:在离子化合物中,阴、阳离子之间 的___静__电__引__力____使阴、阳离子相互吸引,
阴离子的核外电子与阳离子的核外电子之
共价化合物HCl溶于水形成能导电的溶液,所 以C项错误;共价化合物不含离子,以分子形 式存在,在熔融状态下也不会电离出离子, 所以不能导电,而离子化合物可以电离出离 子,所以D项正确。
要点突破讲练互动
要点一 离子Leabharlann 的形成探究导引1 从原子结构的角度说明氯化钠 中离子键的形成过程。 提示:钠原子的电子排布式为: 1s22s22p63s1,易失去最外层的一个电子,达 到氖原子的电子排布,
离子键和离子晶体共35页
拉
60、生活的道路一旦选定,就要勇敢地 走到底体
51、山气日夕佳,飞鸟相与还。 52、木欣欣以向荣,泉涓涓而始流。
53、富贵非吾愿,帝乡不可期。 54、雄发指危冠,猛气冲长缨。 55、土地平旷,屋舍俨然,有良田美 池桑竹 之属, 阡陌交 通,鸡 犬相闻 。
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
60、生活的道路一旦选定,就要勇敢地 走到底体
51、山气日夕佳,飞鸟相与还。 52、木欣欣以向荣,泉涓涓而始流。
53、富贵非吾愿,帝乡不可期。 54、雄发指危冠,猛气冲长缨。 55、土地平旷,屋舍俨然,有良田美 池桑竹 之属, 阡陌交 通,鸡 犬相闻 。
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•特点:
(1)晶格结点上交替排列着正、负离子,依离子键结合。
(2)离子晶体中的正负离子按一定配位数在空间排列,因此晶体 中不存在单个分子,而是一个巨大的分子 (3)离子晶体一般有较高的熔、沸点。离子的电荷越高,半径越 小,静电引力越强,晶体的熔点、沸点也越高。
(4)一般硬度较大,但延展性差,因而容易破碎。
SrO 0.5150 FeO 0.4332 ScN 0.4440
精选ppt
13
(2) CsCl 型 体心立方晶格 正、负离子配位数为8 正、负离子半径介于 0.732 1 实例:TiCl, CsBr, CsI
体心立方结构
具有氯化铯结构的化合物有:铯的卤化物(除CsF外),TlCl, 一些络合物,如K[SbF6]等
位置振动便形成离子键。
精选ppt
4
图2.1 势能图
•形成离子键的条件:成键原子电负性相差较大
•离子型化合物:由离子键形成的化合物。
•离子键特点:既无方向性也无饱和性。 2、离子的性质
(1)离子的电荷
对简单正负离子,离子的电荷是指形成离子键时,原子得到 或失去电子后所具有的电荷数。
(2)离子的电子构型
精选p子被硫离子以四面体的四个顶角 的方式包围着,硫离子按ABCABC…….. 立方密堆积中,硫离子所构成的四面体 中间的空隙里,有一半充有锌离子
正、负离子配位数为4 正、负离子半径介于0.225 0.414
闪锌矿晶体结构
具有这种结构的物质有CuX,MS和MSe(其中M=Be,Mn,Zn, Cd,Hg),MP,MAs和MSb(M=Al,Ga,In),SiC等。
面心立方晶格 正、负离子配位数为6 正、负离子半径介于0.414 0.732 实例: KI , LiF, NaBr, MgO, CaS
所有碱金属卤化物(除CsCl,C精s选Bpprt 和CsI外),碱土金属氧化物12 和硫族化物,卤化物(除AgBr外)均具有氯化钠型的结构
NaCl型结构的晶体
化合 晶胞参数 化合 晶胞参 化合 晶胞参数 化合 晶胞参
(5)熔融或其水溶液都是电的良导体,但在固态时晶格结点上的 离子只能振动,因而不导电。
精选ppt
8
•最简单的AB型离子晶体的空间构型
离子晶体中,由于负离子一般比正离子大很多,使负离子的堆 积成为离子晶体的主要框架,正离子可以看成是填充在负离子堆积 形成空隙中。
离子的堆积方式与正负离子的半径之比有一定关系。
= = =90 = = =90 = = =90 = = 90 ==90, =120 = =90 , 120 90°
Cu,NaCl
Sn,SnO2 I2,HgCl2 Bi,Al2O3 Mg,AgI
S,KClO3
CuSO4·5H2O
精选ppt
11
几种典型的离子晶体结构
1. 氯化钠结构
精选ppt
15
纤锌矿(ZnS)结构
硫离子按ABAB…….六方密堆积,锌离子占据其中一半的四 面体间隙。 硫离子和锌离子周围的配位数均为4。 它与闪锌矿结构的差别仅在于密堆积的层次。 具有纤锌矿结构的化合物有:BeO, ZnO, MN (其中M=Al, Ga, In), MnS等
n( 3 N s 1 ) a n en N ( 2 s 2 2 p a 6 ) n C N l a n( 3 C s 2 3 p 5 ) l n en ( C 3 s 2 3 p 6 l)
精选ppt
3
•成键过程中势能变化情况
系统的总能量决定于离子之间的相互距离R。当排斥力与吸引力 达平衡时(R=R0),系统能量达到最低点,正负离子在各自平衡
•能对x射线产生衍射效应等。
•晶体的结构具有周期性。
非晶体不具备晶体的以上特性,主要就是由于晶体结构具有周 期性而非晶态物质不具有周期性所致。
精选ppt
6
(2)晶体的定义
•晶体:凡是原子(或分子、离子)在空间按一定规律作周期性排
列构成的物质。或凡原子、分子或离子按点阵结构作周期性地排列 而成的物质。
•粒子的配位数:在晶体内一个粒子与相邻最近的其它粒子的数目。
离子晶体中,正负离子的半径比(r+ / r-)不同,则正离子的配位
数不同。
精选ppt
9
AB型离子晶体的三种空间构型
精选ppt
10
AB型离子晶体的三种空间构型的特点
晶系
边长
夹角
晶体实例
立方 四方 正交 三方 六方 单斜 三斜
a=b=c a=b≠c a≠b≠c a=b=c a=b≠c a≠b≠c a≠b≠c
•晶格:重复出现的空间构型 (lattice)
•晶胞:能代表晶体一切特征的最小单位 (unit cell)。
晶格是由晶胞在三维空间无限重复而构成。
按照各种晶体中晶胞参数的不同,可分为7个晶系。
•非晶体又称无定形体,其内部质点排列不规则,没有一定的结晶
外形。
精选ppt
7
2、离子晶体及其特征结构
•离子晶体:由离子键化合物形成的晶体(ion crystals) 。
第二章 离子键和离子晶体
精选ppt
1
晶体中原子的结合从两个方面来认识:
第一,从原子形成晶体时的能量效应来考虑, 多个原子结合成分子以至形成晶体的根本原因在于, 原子结合起来后体系具有更低的能量,体系趋于稳定;
第二,从晶体中原子的空间配置即晶体的几何构型来考虑
精选ppt
2
•离子键:由正负离子之间的静电引力而形成的化学结合力。 一、离子键理论 1、离子键的形成和特征 •成键两步骤:形成正负离子和成键。
物
(nm)
物 数(nm) 物
(nm)
物 数(nm)
NaC l
0.5628
BaO 0.5523 NiO
0.4168
CrN
0.4140
NaI 0.6462 CdO 0.4700 TiN 0.4235 ZrN 0.4610
Mg O
0.4203
CoO 0.4250 LaN 0.5275
CaO 0.4797 MnO 0.4435 TiC 0.4320
指由原子失去或得到电子所形成的外层电子构型
精选ppt
5
二、离子晶体
1、晶体(crystal)的基本概念
(1)晶体的共同特性 •有确定的熔点(如玻璃为非晶体,无确定的熔点); •能自发地形成规则的多面体外形; •各向异性,即在晶体的不同的方向上有不同的物理性质 •均匀性,即同一块晶体的各部分的宏观性质相同;
(1)晶格结点上交替排列着正、负离子,依离子键结合。
(2)离子晶体中的正负离子按一定配位数在空间排列,因此晶体 中不存在单个分子,而是一个巨大的分子 (3)离子晶体一般有较高的熔、沸点。离子的电荷越高,半径越 小,静电引力越强,晶体的熔点、沸点也越高。
(4)一般硬度较大,但延展性差,因而容易破碎。
SrO 0.5150 FeO 0.4332 ScN 0.4440
精选ppt
13
(2) CsCl 型 体心立方晶格 正、负离子配位数为8 正、负离子半径介于 0.732 1 实例:TiCl, CsBr, CsI
体心立方结构
具有氯化铯结构的化合物有:铯的卤化物(除CsF外),TlCl, 一些络合物,如K[SbF6]等
位置振动便形成离子键。
精选ppt
4
图2.1 势能图
•形成离子键的条件:成键原子电负性相差较大
•离子型化合物:由离子键形成的化合物。
•离子键特点:既无方向性也无饱和性。 2、离子的性质
(1)离子的电荷
对简单正负离子,离子的电荷是指形成离子键时,原子得到 或失去电子后所具有的电荷数。
(2)离子的电子构型
精选p子被硫离子以四面体的四个顶角 的方式包围着,硫离子按ABCABC…….. 立方密堆积中,硫离子所构成的四面体 中间的空隙里,有一半充有锌离子
正、负离子配位数为4 正、负离子半径介于0.225 0.414
闪锌矿晶体结构
具有这种结构的物质有CuX,MS和MSe(其中M=Be,Mn,Zn, Cd,Hg),MP,MAs和MSb(M=Al,Ga,In),SiC等。
面心立方晶格 正、负离子配位数为6 正、负离子半径介于0.414 0.732 实例: KI , LiF, NaBr, MgO, CaS
所有碱金属卤化物(除CsCl,C精s选Bpprt 和CsI外),碱土金属氧化物12 和硫族化物,卤化物(除AgBr外)均具有氯化钠型的结构
NaCl型结构的晶体
化合 晶胞参数 化合 晶胞参 化合 晶胞参数 化合 晶胞参
(5)熔融或其水溶液都是电的良导体,但在固态时晶格结点上的 离子只能振动,因而不导电。
精选ppt
8
•最简单的AB型离子晶体的空间构型
离子晶体中,由于负离子一般比正离子大很多,使负离子的堆 积成为离子晶体的主要框架,正离子可以看成是填充在负离子堆积 形成空隙中。
离子的堆积方式与正负离子的半径之比有一定关系。
= = =90 = = =90 = = =90 = = 90 ==90, =120 = =90 , 120 90°
Cu,NaCl
Sn,SnO2 I2,HgCl2 Bi,Al2O3 Mg,AgI
S,KClO3
CuSO4·5H2O
精选ppt
11
几种典型的离子晶体结构
1. 氯化钠结构
精选ppt
15
纤锌矿(ZnS)结构
硫离子按ABAB…….六方密堆积,锌离子占据其中一半的四 面体间隙。 硫离子和锌离子周围的配位数均为4。 它与闪锌矿结构的差别仅在于密堆积的层次。 具有纤锌矿结构的化合物有:BeO, ZnO, MN (其中M=Al, Ga, In), MnS等
n( 3 N s 1 ) a n en N ( 2 s 2 2 p a 6 ) n C N l a n( 3 C s 2 3 p 5 ) l n en ( C 3 s 2 3 p 6 l)
精选ppt
3
•成键过程中势能变化情况
系统的总能量决定于离子之间的相互距离R。当排斥力与吸引力 达平衡时(R=R0),系统能量达到最低点,正负离子在各自平衡
•能对x射线产生衍射效应等。
•晶体的结构具有周期性。
非晶体不具备晶体的以上特性,主要就是由于晶体结构具有周 期性而非晶态物质不具有周期性所致。
精选ppt
6
(2)晶体的定义
•晶体:凡是原子(或分子、离子)在空间按一定规律作周期性排
列构成的物质。或凡原子、分子或离子按点阵结构作周期性地排列 而成的物质。
•粒子的配位数:在晶体内一个粒子与相邻最近的其它粒子的数目。
离子晶体中,正负离子的半径比(r+ / r-)不同,则正离子的配位
数不同。
精选ppt
9
AB型离子晶体的三种空间构型
精选ppt
10
AB型离子晶体的三种空间构型的特点
晶系
边长
夹角
晶体实例
立方 四方 正交 三方 六方 单斜 三斜
a=b=c a=b≠c a≠b≠c a=b=c a=b≠c a≠b≠c a≠b≠c
•晶格:重复出现的空间构型 (lattice)
•晶胞:能代表晶体一切特征的最小单位 (unit cell)。
晶格是由晶胞在三维空间无限重复而构成。
按照各种晶体中晶胞参数的不同,可分为7个晶系。
•非晶体又称无定形体,其内部质点排列不规则,没有一定的结晶
外形。
精选ppt
7
2、离子晶体及其特征结构
•离子晶体:由离子键化合物形成的晶体(ion crystals) 。
第二章 离子键和离子晶体
精选ppt
1
晶体中原子的结合从两个方面来认识:
第一,从原子形成晶体时的能量效应来考虑, 多个原子结合成分子以至形成晶体的根本原因在于, 原子结合起来后体系具有更低的能量,体系趋于稳定;
第二,从晶体中原子的空间配置即晶体的几何构型来考虑
精选ppt
2
•离子键:由正负离子之间的静电引力而形成的化学结合力。 一、离子键理论 1、离子键的形成和特征 •成键两步骤:形成正负离子和成键。
物
(nm)
物 数(nm) 物
(nm)
物 数(nm)
NaC l
0.5628
BaO 0.5523 NiO
0.4168
CrN
0.4140
NaI 0.6462 CdO 0.4700 TiN 0.4235 ZrN 0.4610
Mg O
0.4203
CoO 0.4250 LaN 0.5275
CaO 0.4797 MnO 0.4435 TiC 0.4320
指由原子失去或得到电子所形成的外层电子构型
精选ppt
5
二、离子晶体
1、晶体(crystal)的基本概念
(1)晶体的共同特性 •有确定的熔点(如玻璃为非晶体,无确定的熔点); •能自发地形成规则的多面体外形; •各向异性,即在晶体的不同的方向上有不同的物理性质 •均匀性,即同一块晶体的各部分的宏观性质相同;
