小鼠脾脏、胸腺单个核细胞分离PPT精选课件
实验四脾淋巴细胞分离 邵(1)

活细胞 死细胞
自动化细胞计数器Luna™ 韩国Logos Biosystems公司
一块计数板/2组
在5×104 – 1×107 细胞/ml的浓度范围 3-60 µm的细胞直径范围内
注意事项
1. 通常分离细胞是为了下一步实验。有些实验如需要对细胞 作进一步培养,则在分离细胞时一定要严格无菌操作。
阴性实验结果的原因分析?
个性问题 抗原和抗体反放是否会出现结果?
判断抗原的阳性程度?
弧形沉淀及沉淀倾斜的原因分析?
(四)计算细胞活力
1. 50μl细胞悬液+ 50μl的0.2% 苔盼兰溶液并混匀;
2. 显微镜下观察:
如果细胞被染成蓝色,旋转显 微镜微调节钮,细胞无反光, 则为死细胞;而细胞不被染色, 晶莹透亮,旋转显微镜调节钮, 细胞明显反光而且有立体感, 为活细胞;
3. 计算细胞活力:计数100个 细胞中活细胞的百分率,一般 活力应在95%以上。
2. 在用ACK破坏红细胞时,不要时间过长,以免破坏其他 细胞。
预实验结果
Control
50ul PBS+ 0.5ul Ab
50ul PBS+ 2ul Ab
APC-CD3 T cells
PE-CD19 B cells 分析数据时建议只放一组实验组,各人可自行安排
实验二报告分析
共性问题: 不能结合本组实验进行结果分析
MACS
➢ 磁性微珠是20世纪80年代初以高 分子材料和金属离子(如Fe3O4) 为原料聚合而成的一种以金属离 子为核心、外层均匀地包裹高分 子聚合体的固相微粒。
➢ 以磁性微珠为载体,包被上针对 某种细胞表面抗原的特异性抗体 即可制成免疫磁性微珠。
流式细胞仪(flow cytometer)是一种能够探测和计数以单细胞液体流形 式穿过激光束的细胞检测装置,由于在检测中使用的细胞标志示踪物质 为荧光标记物,因此,用来分离、鉴定细胞的流式细胞仪有被称为荧光 激活细胞分类仪(fluorescence activated cell sorter, FACS),是分离和鉴 定细胞群及亚群的一种强而有力的应用工具。
五年制免疫实验课 小鼠脾脏单个核细胞分离-新

E花环分离法
(纯化T细胞)
T细胞表面的CD2分子-绵羊红细胞受体(E受体)
尼龙纤维分离法
B细胞和单核细 胞具有易粘附特性, 将淋巴细胞悬液加 到尼龙纤维上, 37℃作用1-2小时 后,洗脱的为非粘 附性T细胞。
PBMC
B细胞 单核细胞
尼龙纤维 毛柱
T细胞
流式细胞术
(Flow Cytometry,FCM)
一 、 T细 胞 增 殖 试 验
1. 形态学检查
T细胞增殖试验 原毒的行正理刺分常素激裂:)人后的T、转细能淋非化胞转巴率特体化为母异(外为细7性形0受体%胞有态特积左,丝学异较右以分示性大。此裂意抗、测原原图代定(物)谢T如质细旺P(胞盛HA的如、、功细且C能菌能on类进。A) 4P8H~A72刺小激时
NOTE:尽量少吸分层液;
6、每管加 PBS 到1ml,重悬细胞,3000转离心5分钟。
7、计数:吸弃上清,用100ml PBS重悬细胞,取出20ml加入新 的EP管中,再加入20ml细胞计数液,混匀后取出10ml,加到 计数板内,显微镜下计数。
细胞计数方法
4
查出四个大方格的总细胞数(X) 算出每个大方格的平均细胞数:Y=X/4 每个大方格的体积为V=1mm×1mm×0.1mm=0.1mm3=10-4ml 制备的细胞悬液的细胞浓度(/ml)=Y×104×稀释倍数
2.
3 H-TdR掺 入 法 T细胞增殖试验 原激胞养腺DD淋素NN活巴经进理液嘧AAβ后入细:中中啶的,胞-S淋加,液核原期进对巴入根体苷,料入刺细据闪3H细(被(细激T胞同烁标胞d摄胞物3位仪被RH记合入)周的素检-有,的T成期应细掺测d丝则DDR进答入胞。N分N掺3H行水A细A,裂入合-明有平胞T原掺法成d显丝。的RC入)原分掺增量o新n作料加裂入则A合为或脱,的,可成合P当同在氧推H细位的培成测胸A
小鼠尾静脉取血和脾淋巴细胞分离

小鼠尾静脉取血和脾淋巴细胞分离小鼠尾静脉取血所需器材:热光源(如:普通台灯),鼠尾固定器,刀片,1.5mlEP管。
步骤:1.烘烤。
用热源烘烤小鼠使其血管膨胀。
烤至小鼠开始有剧烈反应时,关掉热源。
2.割尾。
烤完后将小鼠固定将尾部露在外面,用刀片割一下鼠尾远心端腹侧静脉血管使血液流出,立即用1.5mlEP收集滴下来的血液。
3.止血。
用干棉球按压伤口或按压尾部近心端止血,以防失血过多死亡。
要点1.烤:烤的不够:血管未膨胀,割尾后血液不易流出。
烤的太过:小鼠死亡。
2.割:割的太浅:血液不流出。
割的太深:鼠尾被割断。
后续应用:取血时可根据需要选择是否需加抗凝剂。
所取血可用于血液学指标的检测,如EPO浓度、甘油三酯浓度、红细胞数及红细胞压积等。
附表:本实验室常用的2种取血方法的比较尾静脉取血VS 眼眶后静脉丛取血小鼠脾淋巴细胞分离所需器材(以下均为取1只鼠脾需准备的量):手术器械——剪刀、镊子至少2套(高压灭菌),止血钳一个(高压灭菌),细头玻璃吸管一根(高压灭菌),,200目尼龙网一张(高压灭菌),一次性5ml注射器一支,15ml和50ml离心管各一个,60mm 中皿及血球计数板一块。
所需试剂:小鼠淋巴细胞分离液,无血清1640,进口血清,青链霉素(双抗)(100X),NEAA,丙酮酸钠,谷氨酰胺,β-巯基乙醇注:200目尼龙网和小鼠淋巴细胞分离液均从达科为公司购买。
分离原理示意图图一小鼠脾脏研磨示意图图二离心后小鼠脾细胞分层示意图分离步骤及要点:1.断颈处死小鼠,75%乙醇中浸泡几分钟消毒。
2.将小鼠转移至超净台中,先用一套剪刀和镊子剪开小鼠皮肤使腹腔内脾脏可见。
换一套干净的剪刀和镊子剪开腹腔,小心用镊子夹出脾脏,用剪刀尽量去除附着其上的脂肪组织。
脾脏位于小鼠左侧腹部,为一暗红色长条形器官,不要误取肾和肝。
取出后浸泡于RPMI1640中稍作清洗。
注意无菌操作。
3.在一无菌的中皿中加入5ml淋巴细胞分离液,用止血钳将尼龙膜固定在中皿上,放上脾脏开始研磨(如图一所示)。
报告实验二:淋巴细胞分离实验.ppt

c
8
实验步骤
5.加足量稀释液充分洗涤,1000 r/min 离心5min ,弃上清
6. 适量的培养基重悬细胞 ,计数
c
9
注意事项
1.在Ficoll上加入稀释外周血时,应缓慢 加,以免冲散界面
2. 吸取单个核细胞层时,应避免吸出过 多的上清液或分层液而导致血小板污染
c
10
细胞计数
实验步骤 注意事项
实验二
小鼠脾脏淋巴细胞的分离
小鼠脾脏淋巴细胞的分离
目的 原理 实验步骤 注意熟悉淋巴细胞和外周血单个核细胞 (PBMC)的分离方法
c
3
原理
脾脏各种血细胞的密度不尽相同, 利用淋巴细胞分层液(Ficoll)作 密度梯度离心,使一定比重的细胞 群按相应密度梯度分布,从而将各 种血细胞加以分离。
c
11
实验步骤
1、准备计数板: 2、制备细胞悬液:收集细胞,制成单个细胞
悬液 3、加样:用吸管轻轻吹打细胞悬液,取少许
细胞悬液,在计数板上盖玻片的一侧加微量细 胞悬液, 4、计数:在显微镜下,用10×物镜观察计数 板四角大方格中的细胞数
c
12
c
13
实验步骤
5、计算:将结果代入下式,得出细胞密度 细胞数/毫升原液 =(4大格细胞数之和/4)×104
c
16
c
4
原理
外周血
红细胞
1.093
粒细胞
单个核细胞 (PBMC) 血小板
淋巴细胞 单核细胞
1.092 1.075~1.090
1.030~1.035
Ficoll:1.077±0.001
c
5
稀
释
外
周
医学免疫学实验四 小鼠脾脏、胸腺单个核细胞分离及流式染色实验

NK细胞表面标志
人类细胞表面标志主要以 CD16、CD56来 认定,临床上将CD3-CD56+CD16+淋巴 细胞认定为NK细胞。
流式细胞术(FCM)
流式细胞术(FCM)是一种对处在液流中的单个细胞或其它生物微 粒(如细菌)等进行快速定量分析和分选的技术,它将免疫荧光 与细胞生物学、流体力学、光学和电子计算机等多种学科的高新 技术结合,进行细胞和分子水平的基础理论与临床应用研究。
MACS
磁性微珠是20世纪80年代初以高分子材料和金属离子(如Fe3O4 )为原料聚合而成的一种以金属离子为核心、外层均匀地包裹高 分子聚合体的固相微粒。
以磁性微珠为载体,包被上针对某种细胞表面抗原的特异性抗体 即可制成免疫磁性微珠。
通常有二种分离方式:阳性分离和阴性分离。 基本原理及步骤:首先将抗特异细胞表面抗原的抗体致敏到磁珠
胸腺功能: (1)产生T淋巴细胞 (2)产生和分泌胸腺素和激素类物质
免疫细胞分离方法
1. 根据不同免疫细胞表面标志:FAC: 1)根据细胞比重差异:自然沉降法、密度梯 度离心法、改变细胞密度法 2)根据细胞黏附特性:B细胞黏附于尼龙棉 3)根据细胞对渗透压变化的敏感度:红细胞 对低渗敏感
(二)制备单个核细胞悬液:
1. 将取出的脾脏置于盛有PBS缓冲液(10ml)的平皿中,然后再 置于尼龙指套中。用针芯轻轻碾磨使单个核细胞通过尼龙指 套悬浮于平皿中;
2. 吸取平皿中细胞悬液置于15ml离心管中,再取5mlPBS冲 洗培养皿后移入15ml离心管。以1500rpm离心5min。弃 去上清,轻轻弹散细胞沉淀,加红细胞裂解液ACK至2-3ml ,轻轻吹打混匀并放置3-4min,以破坏红细胞。然后加 PBS缓冲液至10ml,以1500rpm离心5min;
小鼠脾脏单个核细胞分离
-
特异性 敏感性
优点
缺点
细胞生物 低 学方法 免疫学方 高 法
分子生物 高 学方法
高
可确定活 性
易操作, 可大量检 测 既可定量 又可定位
繁琐费时 不能确定是 否有活性
不能反映浓 度和活性
较高
高
小鼠脾单个核细胞的分离—密度梯度离心法
原理 根据物理学中颗粒沉降原理,不同密度的物质颗 粒在其沉降运动中可因其比重的差别而处于不同 的分布位置。利用此原理可设计一定密度的液体 界面,将各种不同密度的细胞通过离心沉降而达 到使其彼此分离的目的。已知小鼠淋巴细胞和单 核细胞的密度大约在1.088之间,而红细胞与粒细 胞 的 密 度 均 大 于 1.088 。 因 此 , 若 用 密 度 为 1.088±0.001 的分离液则可通过密度梯度离心方 法,在分离液界面上收集单个核细胞。
T:表达CD2(SRBC受体) B:不表达CD2
免疫细胞功能检测
淋巴细胞转化试验
细胞毒试验
细胞因子检测 溶血空斑实验
T
PHA, ConA,PWM
或Ag
形态学观察Lc 与淋巴母细胞 的比值
3H-TdR掺入法测cpm值
细胞因子检测
细胞生物学方法: CK细胞敏感株
密度梯度离心法
聚蔗糖—泛影葡胺 Ficoll-Hypaque: 1.088±0.001
LC, M :1.088 RBC, 粒细胞:>1.092
在1ml小鼠脾脏细胞悬液混匀,然后用滴管沿盛有 2ml淋巴 细胞分离液的试管壁轻轻铺于分离液面上。 将该试管置水平式离心机中离心(1800rpm)15分钟。 用滴管小心地直接插入白色絮状的细胞层(含单个核细 胞),吸出界面层细胞,移入另一试管内。 在该细胞收集管内加入生理盐水,用滴管轻轻上下冲洗混 匀,然后在离心(1000rpm)10分钟,弃去上清液,将沉 淀细胞充分摇匀,再用生理盐水离心洗涤1次。 用0.3ml生理盐水(约6滴)将沉淀细胞稀释,摇匀。 取细胞悬液一滴加入等量白细胞稀释液于另一试管中充分 混匀,用计数板在显微镜下计数,计算单个核细胞浓度 (个/ml)。 检查细胞活力:取细胞悬液一滴加入等量锥兰溶液于另一 试管中充分混匀,用载玻片在显微镜下计数100~200个单 个核细胞中着色的死细胞数
4 脾脏单个核细胞分离及流式细胞术染色(1)(1)

• 3.急性大失血法:用粗针头一次采取大量心脏血液,可使动物致死。 • 4.吸入麻醉致死法:应用乙醚吸入麻醉的方法处死。大、小鼠在20~30秒
3.清洗:加500ulPBS,吹打混匀后, 5000rpm, 4℃,5min
4.检测:小心用枪去除上清,再加入500ul PBS吹打混匀,置于冰上, 流式细胞仪检测
CD3: T cell CD4+ T cell; CD8+ T cell
补充知识
通常分离细胞是为了下一步实验。有些实验如需要对细 胞作进一步培养,则在分离细胞时一定要严格无菌操作。
在用ACK破坏红细胞时,不要时间过长,以免破坏其他 细胞。
计数完毕后请立即清洗细胞计数板!
思考题
1.实验过程中注意问题有哪些?
实验小鼠处死方法
• 1.颈椎脱臼法:是大、小鼠最常用的处死方法。用拇指和食指用力往下按住 鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱日,造成脊髓 与脑髓断离,动物立即死亡。
实验四
小鼠脾脏单个核细胞分离及 流式细胞术染色
钱国军 邹本坤 2016-03-31
解剖图
小鼠脾脏位于上腹部左后侧, 体积较大,长条形,属于外 周免疫器官。外周血中淋巴 细胞可经再循环驻入脾脏等 外周免疫器官的特定区域, 所以富含各类免疫细胞。
实验原理
细胞计数
3mm
W1
W2
W3
4 脾脏单个核细胞分离及流式细胞术染色(1)

lived dead
实验材料:
小鼠 手术器械(剪刀、镊子)、酒精喷壶 平皿,尼龙膜指套、研磨棒
PBS缓冲液、红细胞裂解液(ACK)
细胞计数板 0.2%台盼蓝染液 显微镜(关掉之前,请把光度调到最小!!)
实验步骤
(一)取小鼠脾脏:
小鼠颈椎脱位处死(注意安全); 用75%酒精喷小鼠腹部,使其皮毛沾湿。用剪刀,剪开皮肤 暴露腹腔,再找到脾脏,劲量剪除脾脏周围组织;
• • • •
实验小鼠处死方法
• 1.颈椎脱臼法:是大、小鼠最常用的处死方法。用拇指和食指用力往下按住 鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱日,造成脊髓 与脑髓断离,动物立即死亡。
注意: 细胞总数和细胞活力可以一起做 细胞总数=视野内活细胞数+死细胞数 细胞活力=活细胞数/总数x100%
1.颈椎脱臼处死小鼠:用拇指和食指用力往下按住鼠头,另一只手抓住 鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离 2.摘取脾脏:用75%酒精喷小鼠腹部,使其皮毛沾湿。用剪刀,剪开皮 肤暴露腹腔,再找到脾脏,尽量剪除脾脏周围组织 3.研磨脾脏:在培养皿中加入3mlPBS,将脾脏放入过滤网制成的指套中, 再放入培养皿中,用注射器的活塞棒或研棒将脾脏研碎。将含有脾脏细 胞的PBS移入15ml离心管。再取3mlPBS冲洗培养皿后移入15ml离心管。
(三)计算细胞浓度
将上述细胞悬液做一定倍数(10倍左右)的稀释(小鼠脾 脏细胞一般为1x107-2x108); 混匀稀释后,取10uL加至细胞计数板中(不要有气泡),计 数细胞计数板中4大方格细胞总数; 计算细胞总数:
细胞浓度=4个大方格细胞总数/4*104*稀释倍数。
细胞总数=细胞浓度x细胞悬液的体积
%94 小鼠脾脏、胸腺单个核细胞分离

26
计数池
正面观
支持堤
侧面观
1mm 支持堤 支持堤 计数池 缝隙) (0.1mm缝隙) 缝隙
27
计数时需要遵循一定的方向逐格进行,以免重复或遗漏,对 压线细胞采用数左不数右,数上不数下 数左不数右, 数左不数右 数上不数下的原则
28
细胞数量明显增大时可适当加大稀释倍数。 细胞数量明显增大时可适当加大稀释倍数。 充池时要一次完成,不能产生满溢 满溢、 充池时要一次完成,不能产生满溢、气泡 或充池不足的现象 的现象。 或充池不足的现象。 大小方格内压线细胞的计数遵循数上不数 大小方格内压线细胞的计数遵循数上不数 的原则, 数左不数右的原则 避免多数或漏数。 下、数左不数右的原则,避免多数或漏数。
取脾脏
24
实验步骤: 实验步骤:
制备单个核细胞悬液: (二)制备单个核细胞悬液: 将取出的脾脏置于盛有PBS缓冲液的平皿 盛有PBS缓冲液的平皿中 然后再置于尼龙指 1. 将取出的脾脏置于盛有PBS缓冲液的平皿中,然后再置于尼龙指 针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中 使单个核细胞通过尼龙指套悬浮于平皿中; 套中。用针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中; 离心10min 吸取平皿中细胞悬液置于刻度离心管中, 1500rpm离心10min。 2. 吸取平皿中细胞悬液置于刻度离心管中,以1500rpm离心10min。 弃去上清, ACK至2~3ml,轻轻吹打混匀并放置3~4min, 放置3~4min 弃去上清,加ACK至2~3ml,轻轻吹打混匀并放置3~4min,以破坏 红细胞。然后加PBS缓冲液至10ml PBS缓冲液至10ml, 1500rpm离心10min; 离心10min 红细胞。然后加PBS缓冲液至10ml,以1500rpm离心10min; 弃去上清, PBS缓冲液至10ml, 1500rpm离心10min; 缓冲液至10ml 离心10min 3. 弃去上清,加PBS缓冲液至10ml,以1500rpm离心10min; 弃去上清, PBS缓冲液至10ml,吹打混匀即为小鼠脾脏单个核 缓冲液至10ml 4. 弃去上清,加PBS缓冲液至10ml,吹打混匀即为小鼠脾脏单个核 细胞悬液。 细胞悬液。
小鼠脾单个核细胞的分离-20141113硕士班

器 材
(1)水平式离心机
(2)显微镜
(3)血球计数板、血盖片
(4)一次性试管、滴管 (5)擦镜纸、卷筒纸、镊子
试 剂:
(1)小鼠脾脏细胞悬液
(2)淋巴细胞分离液(市售,比重:1.088±0.001)
(3)生理盐水
(4)白细胞稀释液 (5)0.4%锥兰生理盐水溶液
操作步骤
将1ml小鼠脾细胞悬液混匀,用滴管沿盛有2ml淋巴细胞分离液的 试管壁轻轻铺于分离液面上 ↓ 将该试管置水平式离心机中离心(2000rpm)15 min ↓ 用滴管小心地直接插入白色絮状的细胞层(含单个核细胞), 吸出界面层细胞,移入另一离心管内 ↓ 加入足量生理盐水,用滴管轻轻上下冲洗混匀 ↓ 离心(1000rpm)10 min ↓ 弃去上清液,将沉淀细胞充分摇匀,加生理盐水,洗涤 1 次 ↓ 离心(1000rpm)10 min ↓ 弃去上清液,将沉淀细胞充分摇匀 ↓ 用生理盐水将沉淀细胞稀释至0.3ml(约6滴),摇匀 ↓ 取细胞悬液一滴加入等量白细胞稀释液于另一试管中充分混匀,用计数板在显微镜下计数, 计算出白细胞总数(/ml)
×10×2×103 个/ml
15
1. 细胞数量明显增大时可适当加大稀释倍数。 2. 充池时要一次完成,不能产生满溢、气泡或充池不足的现象。
3. 大小方格内压线细胞的计数遵循数上不数下、数左不数右的原则,
避免多数或漏数。
1.
红细胞计数时,如果每个中方格之间相差超过20个以上,要重新充池
计数。正常数值范围内,两次红细胞计数相差不得超过5%
3. 加入脾细胞悬液时应十分小心,注意保护分离液的界面,勿使混淆
影响分离效果;
4. 每个吸取细胞悬液的步骤,均要混匀细胞; 5. 做细胞活力检查时,锥兰染色后应尽快计数完毕,时间过长则细胞
T细胞表型及脾细胞分离

精选ppt2021最新
13
精选ppt2021最新
14
标本染色
细胞涂片用记号笔划圈,滴固定液1滴,室温固定2~3分钟。 滴加鼠抗人CD3、CD4、CD8抗体15μL,轻轻摇晃,使单抗均 匀铺在细胞表面,37℃孵育2~3h,PBS洗3次。 滴加生物素标记羊抗小鼠抗体15μL ,37℃孵育30~45分钟, PBS洗3次。 滴加SABC 15μL ,37℃孵育30~45分钟,PBS洗3次。 滴加显色剂30~50μL ,室温显色20~40分钟。可在显微镜下 观察,待细胞膜上出现红色标记物时,用PBS淋洗。 滴加细胞核复染液1滴,30秒后自来水淋洗。 显微镜下观察结果。
精选ppt2021最新
15
注意事项:
以上操作中,37℃孵育时应将玻片置于湿盒中,切勿干片, 特别是加底物后,干片将导致阴阳性结果不能分辨。 观察结果时应使涂片保持湿润。
精选ppt2021最新
16
精选ppt2021最新
17
观察结果
高倍镜下计数100~200个单个核细胞。计算阳性率。 阳性细胞:细胞表面呈红色。 ①标准阳性:细胞表面呈红色,可见深蓝色细胞核; ②强阳性:细胞周缘及中央均呈红色,看不见细胞核; ③弱阳性:细胞表面呈淡红色,可见淡兰色细胞核; ④阴性细胞:细胞表面无着色反应,呈淡兰色。
精选ppt2021最新
8
精选ppt2021最新
9
实验基本流程
二抗
T cell
一抗 待测T细胞 CD分子(???)
精选ppt2021最新
底物
10
实验材料
肝素、淋巴细胞分层液、Hank’s液、PBS等; 一次性注射器、试管、滴管、离心机、微量移液器、玻片、显 微镜,温箱等。 鼠抗人CD3、CD4、CD8 单克隆抗体(1抗);羊抗鼠IgG(生 物素化2抗);SABC-AP;底物(BCIP/NBT 磷酸甲苯胺蓝盐) 等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流式细胞分析仪
10
MACS
磁性微珠是20世纪80年代初以高分子材料和金属离子(如Fe3O4) 为原料聚合而成的一种以金属离子为核心、外层均匀地包裹高分子聚 合体的固相微粒。
以磁性微珠为载体,包被上针对某种细胞表面抗原的特异性抗体 即可制成免疫磁性微珠。
通常有二种分离方式:阳性分离和阴性分离。
6
NK细胞表面标志
人类NK细胞表面标志主要以 CD16、CD56来认定,临床上将CD3CD56+CD16+淋巴细胞认定为NK细 胞。
7
FACS
流式细胞仪由激光光源系统,气控单细胞层流系统,光检测及信 息处理系统和细胞分离纯化系统组成。
流式细胞术(FCM)是一种对处在液流中的单个细胞或其它生物微 粒(如细菌)等进行快速定量分析和分选的技术,它将免疫荧光与细 胞生物学、流体力学、光学和电子计算机等多种学科的高新技术融为 一体,进行细胞和分子水平的基础理论与临床应用研究。
mononuclear cell PBMC)包括淋巴细胞和单核细胞,其 体积、形状和比重与其他细胞不同,利用密度在 1.077±0.001g/L之间近于等渗的Ficoll-Hypaque混合溶 液(称为淋巴细胞分层液)作密度梯度离心时,•各种血液成 分将按密度梯度重新分布聚集。
17
不同细胞密度不同
27
计数时需要遵循一定的方向逐格进行,以免重复或遗漏,对 压线细胞采用数左不数右,数上不数下的原则
28
细胞数量明显增大时可适当加大稀释倍数。 充池时要一次完成,不能产生满溢、气泡
或充池不足的现象。 大小方格内压线细胞的计数遵循数上不数
下、数左不数右的原则,避免多数或漏数。
29
红细胞计数时,如果每个中方格之间相差超过20个以上,要 重新充池计数。正常数值范围内,两次红细胞计数相差不
人的红细胞密度为1.093 粒细胞密度为1.092 单个核细胞(淋巴细胞和单核细胞)的密度为 1.075-1.090
18
不同细胞密度不同
19
用1.077±0.001的分层液可将细胞分离
20
密度梯度离心法
血浆 单个核细胞(PBMC) 粒细胞 红细胞 离心后
21
实验五 小鼠脾脏、胸腺单个核细胞分离
22
解剖图
胸腺位于胸腔胸骨后、纵隔前上方,覆 盖在心脏前上方的白色组织。通常小鼠 鼠龄越小,胸腺体积相对越大。
小鼠脾脏位于上腹部左后侧,体积 较大,长条形态,属于外周免疫器 官。外周血中淋巴细胞可经再循环 驻入脾脏等外周免疫器官的特定区 域,所以富含各类免疫细胞。
23
实验步骤:
(一)取小鼠脾脏: • 小鼠颈椎脱位处死,置70%乙醇溶液
5
B细胞表面标志
SmIg、Fc受体、补体受体、EB病毒受体,部分 CD分子是B细胞的重要表面标志,其中以SmIg 为B细胞所特有,是鉴定B细胞可靠的指标。
CD19/CD5分子:可将B细胞区分为B1细胞和B2 细胞,B1细胞为CD19和CD5双阳性,而B2细胞 仅为CD19阳性,B2细胞为通常所指的B细胞。
小鼠脾脏、胸腺单个核细胞分离
1
基本概念
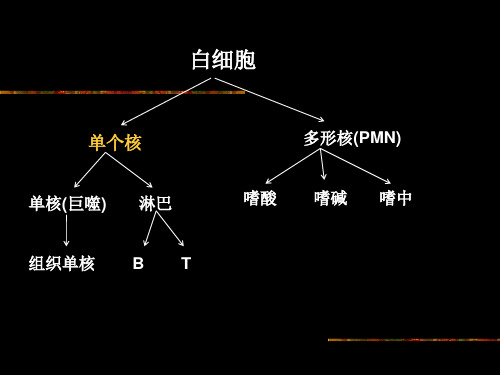
所有参与免疫应答以及与免疫应答相关的细胞均被称为免疫细胞。 包括淋巴细胞、单核-巨噬细胞、DC、各种粒细胞、红细胞、肥大 细胞、干细胞。
2
3
免疫细胞分离方法:
1. 根据不同免疫细胞表面标志:FACS、MACS 2. 根据细胞理化性质:
1)根据细胞比重差异:自然沉降法、密度梯度离心法、改变细胞密 度法
得超过5%。 白细胞计数时,一般情况下各大方格间的细胞数相差不超过
10%。 如微量吸管内壁沾有白细胞稀释液,会使红细胞破坏,故应
弃去上清,加ACK至2~3ml,轻轻吹打混匀并放置3~4min,以破坏 红细胞。然后加PBS缓冲液至10ml,以1500rpm离心10min; 3. 弃去上清,加PBS缓冲液至10ml,以1500rpm离心10min; 4. 弃去上清,加PBS缓冲液至10ml,吹打混匀即为小鼠脾脏单个核 细胞悬液。
2)根据细胞黏附特性:B细胞黏附于尼龙棉 3)根据细胞对渗透压变化的敏感度:红细胞对低渗敏感
4
T细胞表面标志及其亚群
CD3+CD4+CD8-辅助性T细胞 (help T cell,Th)
CD3+CD4-CD8+细胞毒性T细胞 (cytotoxic T cell,Tc or CTL)
CD4+CD25+调节性T细胞 (regulatory T cell,Tr or Treg)
将荧光标记的单克隆抗体加入PBMC悬液内,使二者特异性结合, 通过流式细胞仪自动检测,既可很快得到T、B细胞及其亚群百分率和 绝对值的有关数据,又能以每秒高达5000个细胞(18×106 细胞/h)的 速度分离和收集无菌的淋巴细胞,纯度可达90%~99%,细胞活性亦不 受影响,可用于淋巴细胞的各种免疫生物学功能测定。
25
实验步骤:
(三)计算细胞浓度 1. 将上述细胞悬液做一定倍数的稀释; 2. 混匀稀释后,取1滴加至细胞计数板中,计数细胞计数板中4大方格细胞
总数; 3. 计算细胞总数:
细胞总数=平均每个大方格中细胞数(4个大方格细胞总数/4)X104X稀 释倍数。
26
计数池
正面观
支持堤
侧面观
支持堤 计数池 支持堤 1mm (0.1mm缝隙)
基本原理及步骤:首先将抗特异细胞表面抗原的抗体致敏到磁珠 上,待它与混合体系中的细胞反应后,利用磁力的作用,使与致 敏结合的细胞与其它物质分离,达到纯化、分离的目的。
11
12
13
免疫磁珠法细胞分选过程
14
免 疫 磁 珠 细 胞 分 选 装 置
15
全自动细胞分选系统
16
密度梯度离心法
Ficoll-Hypaque密度梯度离心法: 人外周血单个核细胞(peripheral blood
中浸泡3~5min; • 取其后右侧卧位,消毒左侧背腹交界
处皮肤,取脾脏并尽量将去脂肪及筋 膜组织。
取脾脏
24
实验步骤:
(二)制备单个核细胞悬液: 1. 将取出的脾脏置于盛有PBS缓冲液的平皿中,然后再置于尼龙指
套中。用针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中; 2. 吸取平皿中细胞悬液置于刻度离心管中,以1500rpm离心10min。
