物质结构《元素周期表》 ppt课件
合集下载
人教版高中化学必修二课件:1.1《元素周期表》(共37张PPT)

2KI+Br2 = I2+2KBr 静置后,液体分层, 氧化性: Br2 > I2
上层 无色 ,
下层 紫色 。
结论
氧化性:Cl2 > Br2 > I2 还原性:I - > Br - > Cl 小结: 氧化性:F2> Cl2> Br2>I2 还原性:F-> Cl- > Br- > I-
氧化性:F2> Cl2> Br2>I2。 Cl2可从溴、碘的盐 溶液中置换出相应的卤素单质,F2与氯、溴、 碘的盐溶液可以置换出相应的卤素单质吗?
H2+F2 = 2HF H2+Cl2 = 2HCl 暗处剧烈反应并爆炸;HF很稳定 光照或点燃反应;HCl较稳定
H2+Br2 = 2HBr
H2+I2
加热500℃ ,HBr不稳定
2HI 需不断加热,HI同时分解
■都能跟氢气反应,体现相似性 反应通式:H2 + X2 = 2HX (X= F、Cl、Br、I) ■单质氧化性减弱,体现递变性
① 除9、10、18纵行(列序)外,族序数=列序个位数。(记忆方法) ②18个纵行,只16个族;0族和第VIII族不属主族,也不属副族。
一、碱金属元素结构和化学性质的相似性和递变性
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子 2.递变性: 核电荷数↑ 电子层数↑ 原子半径↑ 失电子能力↑ 化学性 质相似
3.请在下面的线框中用色笔画出周期表的轮廓。并标出族序数,写
出七个主族元素(可参考课本)和 0族元素的元素符号。
周期 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB VIIB
IB IIB ⅢA ⅣA ⅤA Ⅵ AⅦA 0 种类
化学:《元素周期表-周期表结构》课件(新人教版必修2)

氕 (氢)
(重氢) 氘
(超重氢) 氚
H、D、T这三种核素互称为同位素
常见的同位素:
碳 碳-12
12C
6
碳-13
13C
6
碳-14
14C
6
氧 氯 铀
16O
8
17O
8
18O
8
35Cl
17 92
37Cl
17
234U
235U
92
238U
92
【同位素小结】
两同(同质子数、同一元素)
两不同(中子数不同、原子不同)
(2)碱金属元素从上到下(Li 、Na、K、 Rb、Cs),随着核电荷数的增加,碱金属 元素原子的电子层数逐渐 增多 ,原子核 对 最外层电子 的引力逐渐减弱,原子失 电子的能力逐渐 增强 。 元素的金属性逐渐 增强 ,与水和氧气 的反应越来越 剧烈 ,生成的氧化物越来 越 复杂 。最高价氧化物对应水化物的碱 性越来越 强 。
第88号元素: 88-86 =2
第五周期第ⅦA 族。
第七周期第ⅡA 族。
第82号元素:
第六周期第ⅣA 族。
6、下列各表为周期表的一部分(表中为 原子序数),其中正确的是( D )
A.0 11 18 19
C.
6 11 12 13 24
D.
6 14 31 32
7
7. A、B、C是周期表中相邻的三种元素,其中A、B是同 周期,B、C是同主族。此三种元素原子最外层电子数之
卤素原子结构的相似性,决定了单质化学性质的相似性。
与氢反应的能力渐弱 氢化物的稳定性渐弱 与水反应的能力渐弱
元素非金属性强弱判断依据:
1、单质跟氢气反应生成气态氢化物的 难易;
元素周期表PPT课件

m(12C)=1.993 × 10-26Kg 1/12m(12C)= (1.661 × 10-27Kg )
构成原子的粒子及其性质 1/1836 1.007 1.008
相对原子质量=(电子总质量+质子 总质量+中子总质量)/ 12 C 原子质 量的12分之一 = 1/1836 ×电子数 +质子数 ×1.007+中子数×1.008
(3)金属性越强,其最高价氧化物的水化物碱性越强 碱性:KOH›NaOH(离铯近的碱性强)
碱金属的主要物理性质
二、卤族元素(代表非金属)——F Cl Br I (VIIA族)
单质均为双原子分子——X2
(1)卤素单质都是有色物质,从上到下,其颜色逐渐 加深,密度逐渐增大,熔、沸点逐渐升高(常温时的状 态由气态经液态到固态)。
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
(X:Cl、Br、I)
卤素与氢气的反应
冷暗处爆炸
H2+F2==2HF
光照
光照或点燃 H2+Cl2点=燃=2HCl
高温
500℃
H2+Br2==2HBr
高温、持 续加热
H2+I2== 2HI
HF很稳定 HCl稳定
HBr较不稳定 HI很不稳定
卤素单质间的置换反应
F2 + 2NaCl(熔融)= 2NaF + Cl2 Cl2 + 2NaBr= 2NaCl + Br2
构成原子的粒子及其性质 1/1836 1.007 1.008
相对原子质量=(电子总质量+质子 总质量+中子总质量)/ 12 C 原子质 量的12分之一 = 1/1836 ×电子数 +质子数 ×1.007+中子数×1.008
(3)金属性越强,其最高价氧化物的水化物碱性越强 碱性:KOH›NaOH(离铯近的碱性强)
碱金属的主要物理性质
二、卤族元素(代表非金属)——F Cl Br I (VIIA族)
单质均为双原子分子——X2
(1)卤素单质都是有色物质,从上到下,其颜色逐渐 加深,密度逐渐增大,熔、沸点逐渐升高(常温时的状 态由气态经液态到固态)。
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
(X:Cl、Br、I)
卤素与氢气的反应
冷暗处爆炸
H2+F2==2HF
光照
光照或点燃 H2+Cl2点=燃=2HCl
高温
500℃
H2+Br2==2HBr
高温、持 续加热
H2+I2== 2HI
HF很稳定 HCl稳定
HBr较不稳定 HI很不稳定
卤素单质间的置换反应
F2 + 2NaCl(熔融)= 2NaF + Cl2 Cl2 + 2NaBr= 2NaCl + Br2
元素周期表PPT课件12 3

高一年级化学2
节元素周期表
章物质结构元素周Βιβλιοθήκη 表质量关系: 质量数(A)=质子数(Z)+中子数(N)
质子: Z 个 原子核 A 原子( ) 中子:( A Z )个 ZX 核外电子: Z 个
电子
质子
1
中子
2
H 1
H 1
3
H 1
元素:具有相同核电荷数(即质子数) 的一类原子的总称。 (一种元素可以有多种原子) 核素:把具有一定数目的质子和一定数 目的中子的一种原子称核素。 (一种核素就是一种原子) 同位素:具有相同质子数、不同中子数 的同种元素的不同原子互称为同位素。 (同种元素的各种同位素在周期表 中处在相同的位置)
碳元素的各种核素
氧元素的各种核素
12C、 13C、 14C 6 6 6
;
16O、 17O、 18O 8 8 8
;
铀元素的各种核素
234U、 235U 、 238U 92 92 92
。
铀-235原子核完全裂变放出的能量是同量煤完全燃烧 放出能量的2700000倍。也就是说1克U-235完全裂变释 放的能量相当于2吨半优质煤完全燃烧时所释放的能量。
重水反应堆
以重水堆为热源的核电站。重水堆是以重水作慢化剂的
反应堆,可以直接利用天然铀作为核燃料。重水堆可用轻 水或重水作冷却剂,重水堆分压力容器式和压力管式类。 重水堆核电站是发展较早的核电站,有各种类别,但已实
现工业规模推广的只有加拿大发展起来的坎杜型压力管式重 水堆核电站。
放射性C-14射线测定装置
1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。14、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更5、别着急要结果,先问自己够不够格,付出要配得上结果,工夫到位了,结果自然就出来了。 6、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 7、别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 8、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给时间来定夺。 9、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡慕那些总能撞大运的人,你必须很努力,才能遇上好运气。 10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚 14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛。
节元素周期表
章物质结构元素周Βιβλιοθήκη 表质量关系: 质量数(A)=质子数(Z)+中子数(N)
质子: Z 个 原子核 A 原子( ) 中子:( A Z )个 ZX 核外电子: Z 个
电子
质子
1
中子
2
H 1
H 1
3
H 1
元素:具有相同核电荷数(即质子数) 的一类原子的总称。 (一种元素可以有多种原子) 核素:把具有一定数目的质子和一定数 目的中子的一种原子称核素。 (一种核素就是一种原子) 同位素:具有相同质子数、不同中子数 的同种元素的不同原子互称为同位素。 (同种元素的各种同位素在周期表 中处在相同的位置)
碳元素的各种核素
氧元素的各种核素
12C、 13C、 14C 6 6 6
;
16O、 17O、 18O 8 8 8
;
铀元素的各种核素
234U、 235U 、 238U 92 92 92
。
铀-235原子核完全裂变放出的能量是同量煤完全燃烧 放出能量的2700000倍。也就是说1克U-235完全裂变释 放的能量相当于2吨半优质煤完全燃烧时所释放的能量。
重水反应堆
以重水堆为热源的核电站。重水堆是以重水作慢化剂的
反应堆,可以直接利用天然铀作为核燃料。重水堆可用轻 水或重水作冷却剂,重水堆分压力容器式和压力管式类。 重水堆核电站是发展较早的核电站,有各种类别,但已实
现工业规模推广的只有加拿大发展起来的坎杜型压力管式重 水堆核电站。
放射性C-14射线测定装置
1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。14、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更5、别着急要结果,先问自己够不够格,付出要配得上结果,工夫到位了,结果自然就出来了。 6、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 7、别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 8、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给时间来定夺。 9、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡慕那些总能撞大运的人,你必须很努力,才能遇上好运气。 10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚 14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛。
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
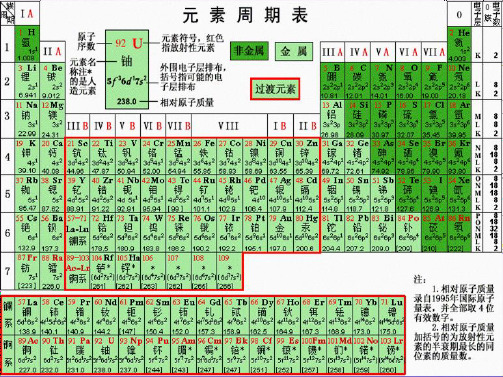
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
化学:1.1.1《元素周期表-周期表结构》课件

决定
最外层电子数
。
第 一 节
1829 年,德国科学家德贝莱纳在对当时已知的54种元素进行了系统的分析研究之后,提
元 出了元素的“三元素组”规则。他发现了几组元素,每组都有三个化学性质相似的成员。 素
周
并且,在每组中,居中的元素的原子量,近似于两端元素原子量的平均值。 如锂钠钾、
期 表
钙锶钡、磷砷锑、氯溴碘。
元素周期表的由来
B=11
Al=27.4
?=68
Ur=116 Au=197?
C=12
Si=28
?=70
Sn=118
N=14
P=31
As=75 Sb=122 Bi=210
O=16
S=32
Se=79.4 Te=128?
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4 Cs=133 Tl=204
①七个横行,七个周期。其中:三个短周期(1、2、 ),三个长周期(4、5、6),一个不完全周期(7)
②每一周期元素电子层数相同,从左到右原子序数递增。
③周期序数=电子层数
类别 短周期
长周期 不完全周期
周期序数 1 2 3 4 5 6 7
包括元素种数
2 8 8 18 18 32 26
稀有气体元素原子序数
十分相似,总称镧系元素。 第7周期中,89号元素锕(Ac)到103号元素铹 (Lr),共15种元素,它们原子的电子层结构和
性质也十分相似,总称锕系元素。
含元素最多的周期是哪一个?
4、课堂小结
元素周期表的结构: 七主七副七周期, Ⅷ族零族镧锕系。
元素原子结构与其在周期表中位置的关系:
《元素周期表》课件ppt课件

观察,可得 A是氮元素
B是 氧元素
C是
二、元素的性质与原子结构
1.碱金属元素
元素 元素 名称 符号
核电 荷数
最外层电子 电子
数
层数
原子结构
相同点
递变性
锂
碱
金 属
钠
元
素钾
铷
Li
3
Na
11
K
19
Rb
37
1
2
最
1
3
1
外 层 都 有
核电 原 电子 子 荷层 半 数数 径
1
4
个
逐逐 逐
电
渐渐 渐
子
增增 增
1
原子 序数
6
13 34 53 88
周期 2 3 4 5 7
族 IVA IIIA VIA VIIA IIA
课 堂 练
4.下列各表为周期表的一部分(表中为 原子序数),其中正确的是(D )
习 (A)
(B)
234
2
11
10 11
19
(C) 6
18 19
(D) 67
11 12 13
14
24
31 32
课 堂 5、元素X的原子获得3个电子或元素Y的原 练 子失去2个电子后,它们的电子层结构与 习 氖原子的电子层结构相同。X、Y两种元
H、Be 、 Al
。
族序数等于周期序数2倍的元素
有: C S
。
周期序数=族序数2倍的有: Li、Ca
。
课 堂 7. A、B、C是周期表中相邻的三种元素, 练 其中A、B是同周期,B、C是同主族。此三 习 种元素原子最外层电子数之和为17,质子数
人教版化学《元素周期表》完美版课件

元素
H:
H1
1
H 2
1
H 3
1
C: C C C 12
13
14
6
6
6
核素1 … 核素n
同位素
O:
O 16
8
Cl:
Cl 35
17
U: U 234 92
O 17
8
Cl 37
17
U 235
92
O 18 8
U 238 92
截至1999年,人们已经发现了113种元素,是 否可以说我们已经发现了113种原子?为什么?
1H37Cl, 14C16O2
4种元素,8种不同的原子,8种分子。
人教版高一化学必修二1.1元素周期表 核素 (共25张ppt)
强调:
1)同位素原子物理性质不同,但化学性质几 乎完全相同。如H2、D2和T2具有相同的化学性 质。
2)“同位”是指质子数相同,周期表中位置 相同,核素是指单个原子而言,而同位素则是 指核素之间关系。
微粒 质量数 质子数 中子数 电子数
H
1
1
0
1
2113X+
23
11
12
10
3126S2-
32
16
Байду номын сангаас
16
18
8305Br
80
35
45
35
人教版高一化学必修二1.1元素周期表 核素 (共25张ppt)
人教版高一化学必修二1.1元素周期表 核素 (共25张ppt)
⒉元素、核素和同位素 (1)元素:具有相同核电荷数(即质子数)的同一类原子。 (2)核素:把具有一定数目的质子和一定数目的中子 的一种原子叫做核素。 这三种原子是不是属于同种元素?
物质结构和元素周期律-PPT课件

答案:D
19
A.质子数为 7
B.最外层电子数为 2
C.核外电子数为 7
D.核外有 3 个电子层
解析:示意图中“+12”表示该原子质子数为 12,核外电子
共 12 个,电子排布情况为:最内层 2 个电子,次外层 8 个电
子,最外层 2 个电子,电子层数为 3,故应选 B、D。
答案:BD
9
大家有疑问的,可以询问和交流
4
典例剖析
【例 1·单选Ⅰ】下列说法正确的是( )。 A.同位素3648Se、6380Zn 具有相同的质量数 B.1210Na 与1119Na 互称为核素 C.氟元素的符号为197F D.同一元素的不同核素互称为同位素 解析:6384Se、6380Zn 质子数不同,不互为同位素,A 错误;2110Na 与1119Na 互称为同位素,B 错误;氟元素的符号为 F,C 错误。 答案:D
2
6.以ⅠA 和ⅦA 族为例,了解同一主族内元素性质递变规 律与原子结构的关系。
7.了解金属、非金属在元素周期表中的位置及其性质递变 的规律。
8.了解化学键的定义。了解离子键、共价键的形成。了解 化学反应的本质。
3
元素、核素、同位素
1.元素 元素是具有相同的___核__电__荷__数___(即__质__子__数__)的一类原子 的总称。 2.核素 核素是具有一定数目质子和一定数目中子的一种原子。 3.同位素 质子数___相__同___而中子数___不__同___的同一元素的不同原子 互称为同位素。
17
3.共价键 (1)定义:通过____共__用__电__子__对__而形成的相互作用。非金属 元素原子之间一般形成共价键。例如,
(2)共价键的分类。 ①非极性键:由同种元素原子形成的共价键,如 H-H 等。 ②极性键:由不同种元素原子形成的共价键,如 H-Cl 等。 4.化学反应的本质 化学反应的本质是旧化学键断裂,新化学键形成的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)碱金属单质的化学性质
(A)与氧气反应
钾与氧气的反应实验
淡黄
黄
剧烈燃烧,火焰
呈紫色
△ -1
2Na+O2
Na2O2
K+O2
△
-1 2
KO2
加热
燃烧,较 不剧烈
接触空气不加 热
接触空气不 加热
剧烈 剧烈
Li2O
更复杂的氧 化物
更复杂的氧 化物
从Li到 Cs,随 电子层 数的递 增,还 原性(金 属性)逐 渐增强.
教学重点 碱金属元素与卤族元素递变规律 教学难点 元素性质的递变规律与原子结构的关系
一。碱金属元素的原子结构和元素的性质之间有什么关系呢?
2.我们把ⅠA 族(除氢)称为碱金属,为什么要把它们 编在一个族呢?
1.碱金属元素
观察碱金属元素的原子结构示意图有何异同?
,__原__子__半__径___依次增大。
铯
结构决定性质,可否从碱金属原子的结构角度推测其化学 性质如何?又是否完全相同?
+3 2 1 +11 2 8 1 +19 2 8 8 1 +37 2 8 18 8 1 +55 2 8 18 18 8 1
失去1个电子
+1价阳离子 表现出还原性 可与非金属、水等反应
(B)与水反应
请描述钠与水反应的实验操作及现象;
钠、钾与水反 应的实验对比
钾
浮、熔、游、响、红 浮、熔、游、响、红,有 微弱爆炸
2Na + 2H2O 2NaOH + H2↑
2K + 2H2O 2KOH + H2↑
(B)与水反应
会反应,比Na缓慢
从Li到Cs,
对应的 随电子层数
碱和氢 的递增,还
气 原性(金属
性)逐渐增
碱性逐渐 遇水燃烧,甚至爆炸 增强
强。
2M + 2H2O 2MOH + H2↑ (M=Li, Na, K, Rb, Cs)
(1)碱金属元素结构和化学性质的相似性和递变性
Li Na K Rb Cs
1.相似性: 最外层上都只 有一个电子 2.递变性: 核电荷数↑
电子层数↑
化学性 质相似
1) 易失去电子,表 现出强还原性
[认知总结]
卤族元素化学性质的相似性和递变性 1.相似性
化合物 →最高价氧化物对应水化物除氟外都为强酸
2.递变性
具体情况如下:
与氢气反应 稳定性 还原性
酸性
反应越来越难 逐渐减弱 逐渐增强
逐渐减弱
1.锂是世界上最轻的金属,它属于碱金属的一种。下列关于
碱金属的说法正确的是( D )
A.和锂同一主族的都是金属元素 H
Li 3 Na 11 K 19 Rb 37 Cs 55
1
2
1
3
1
4
1
5
1
6
(1)碱金属原子结构
锂 钠
原子结构的异同:
1.相同点:碱金属元素原子结构的 __最__外__层__电_子__数___相同,都为_1_个__,
都易失去电子,具有强还原性。 钾
2.递变性:从Li 到Cs,碱金属元素
铷
的原子结构中,_电__子__层__数__依次增多
B.Na+比Li多一个电子层 Na+有两个电子层,Li有两个电子层
增
增增 增 加加 加
减 弱
增 强
增 强
大 (K 除
降 低
外)
二。卤族元素
结合下表,总结并推测卤族元素的原子结构和性质有什么相似性 和递变性?
F
9
Cl 17
Br 35
I 53
7
2
7
3
7
4
7
5
资料卡片 卤素单质的物理性质
熔沸点逐渐 升高
1.结构特点 ①卤族元素位于周期表第__Ⅶ__A______族; ②相同点:最外层上都有__7______个电子; ③递变性:从F→I,核电荷数逐渐__增__多____,电子层数逐 渐___增__多_______,原子半径逐渐__增__大________。 2.卤素单质的主要物理性质及递变规律 (1)颜色、状态 F2:淡黄绿色气体;Cl2:_黄__绿__色__气__体_______; Br2:_深__红__棕_色__液__体______;I2:__紫_黑_________色固体。 (2)递变规律 从F2到I2:颜色逐渐_加__深_____,密度逐渐 ___升__高__________,熔、沸点逐渐___增__大_________。
易失难得
(1)碱金属单质的物理性质
阅读P7,试着归纳碱金属物理性质的相似性和递变性
Li
K
Rb
Cs
密度反常,比钠
最轻的金属, 保存在石蜡里
表1-1 碱金属的主要性质
的密度小
熔沸点逐渐 降低
碱金属物理性质的递变规律
均为银白色(Cs略带金色) 柔软 较小 较低 强
逐渐增大(K特殊) 逐渐降低
碱金属元素的递变规律
2)化合物中均显+1价
原子半径↑ 核对最外层电子的引力↓ 失电子能力↑ 还原性↑ 金属性↑
牢记规律
在元素周期表中,同主族元素从上到下原子核外电 子层数依次_增__多___,原子半径逐渐_增__大___,失电子 能力逐渐__增__强__,金属性逐渐_增__强___。
还原性:Li < Na < K < Rb < Cs 氧化性:Li +< Na+ < K+ < Rb+ < Cs+
静置后,液体分层,上 层接近无色,下层呈橙 红色
静置后,液体分层,上 层接近无色,下层呈紫 红色
静置后,液体分层,上 层接近无色,下层呈紫 红色
2NaBr+ Cl2===2NaCl+Br2
2KI+Cl2===2KCl +I2 2KI+Br2===2KBr +I2
结论:
4.卤族元素的原子结构与化学性质的递变关系 随着核电荷数的增加,卤素单质的氧化性逐渐____减__弱_____, 卤族元素的非金属性逐渐______减__弱________。
3.卤素单质的化学性质
1.卤素单质与氢气反应
3.卤素单质的化学性质
1.卤素单质与氢气反应 与氢气反应生成相应的氢化物:—X—2+—H—2==—=2—HX—
规律:F2 Cl2
Br2
I2
与氢气反应剧烈程度:依次———减弱—————
生成氢化物的稳定性:依次———减弱—————
3.卤素单质的化学性质
2.单质之间的置换反应
第一章 物质结构 元素周期律
第一节 元素周期表 二。 元素的性质与原子结构
·
教学目标
知识与技能 1.掌握碱金属元素、卤族元素的主要性质及其递变规律。 2.初步掌握主族元素原子结构与元素性质的内在联系。 过程与方法 1。归纳、总结碱金属元素和卤族元素的性质。 2。探究碱金属、卤族元素原子结构与性质的关系。 情感、态度与价值观 通过探究、分析、比较和归纳,培养学生的创造性思维。
