关于盐析
盐析的概念

盐析的概念盐析是一种重要的化学反应,它不仅在工业上有重要的意义,而且在日常生活中也有重要的含义。
首先,本文将对盐析本质及其产生背后的原理做出详细介绍;其次,讨论它在医学、烹饪和农业领域的应用;最后,探讨可能伴随盐析发生过程中存在的一些风险及其解决办法。
一、盐析的本质盐析是一种比较常见的化学反应,通常指的是分解盐的化学反应过程,即“把一种盐反应转化为其他的化合物”的过程。
盐析可以用化学方程式简洁地表示为:A + B A + B,其中A和B分别是盐的合成质,A和B则是盐析过程中产生的合成质的产物。
盐析的反应原理是:在一定的温度和压力下,盐的分子开始失去氢离子和氧离子,使得盐中氢离子和氧离子最终能够形成其他的化合物。
而这种分解过程可以通过催化剂,催产促使这种反应上升到一定的温度和压力条件下,从而达到最佳的分解效果。
二、盐析在医学、烹饪和农业领域的应用1、医学方面的应用:由于盐析的分解本质是转变原有物质的性质,因此可以在医学领域中大量应用。
例如:在治疗过敏性病症中,可以使用盐析来分解盐,这样就可以把过敏原物质转变成无过敏性物质,从而起到治疗过敏性病症的作用;也可以将某种药物转变成体内更容易吸收的药物,从而提高药物的治疗效果。
2、烹饪方面的应用:盐析也可以在烹饪过程中大量应用。
例如:在烹饪过程中,可以透过盐析使酸度降低,达到更好的口感;也可以将某些食品中的毒素分解,从而起到保护我们身体健康的作用;还可以用来改变食品的营养成分,使食物更加丰富。
3、农业方面的应用:此外,盐析还可以在农业领域大量应用。
例如:可以用来调节土壤的酸碱度,从而获得更多的农作物收获;也可以用来降低农作物中的毒素含量,保护农作物的健康。
三、盐析发生时需要注意的一些风险及其解决办法1、温度和压力的控制:在操作盐析的时候,需要特别注意温度和压力的控制,要保持在适合的范围内。
这是因为,如果温度和压力不当,将会降低反应效率,存在着安全隐患。
2、催化剂的把握:此外,在使用盐析的时候,需要注意催化剂的选择和把握。
盐析知识点总结

盐析知识点总结盐析的原理是根据不同物质在化学反应中产生的特定的性质来进行分析,一般来说,通过影响物质的溶解度、酸碱性、氧化还原性等性质,对物质进行分析和鉴定。
盐析的方法有很多种类,包括沉淀分析、络合滴定、测定物质的酸碱性等方式。
它的基本原理是利用已知化合物的特定反应来判断未知物质的性质和成分。
盐析的主要步骤包括样品的准备、沉淀的生成、沉淀的处理和分析结果的判定。
在样品准备阶段,需要将待分析的物质按照一定的方法进行制备和处理,使其成为适合进行盐析的样品。
在沉淀的生成阶段,通过溶液反应,形成一个可观察的沉淀物。
在沉淀的处理阶段,对沉淀进行过滤、洗涤、烘干等处理,得到固体沉淀物。
最后,在分析结果的判定阶段,通过比色、滴定、吸光度测定等方法,来对溶液中的盐析物质进行定量或定性分析。
盐析在实际应用中有很多用途,比如用来鉴定未知物质的成分和结构,用于生产中的质量控制,用于环境检测和食品安全检测等。
盐析作为一种重要的化学分析方法,对于促进科学研究和解决实际问题具有重要意义。
盐析的应用领域盐析在化学分析中广泛应用于不同领域,它可以用于确定各种化合物的成分和结构,以及进行物质的鉴定和定量分析。
下面分别介绍盐析在不同领域的应用。
1. 生物化学在生物化学中,盐析可以用来分离和纯化蛋白质、酶和核酸等生物大分子,以及用来测定生物大分子的含量和活性。
比如,可以通过盐析的方法来分离蛋白质和 DNA,或者用来检测生物体内不同元素的含量和分布。
2. 药物研发在药物研发领域,盐析可以用来分析和鉴定药物的成分和结构,以及测定药物的含量和纯度。
通过盐析,可以快速、准确地评估药物的质量和效果。
3. 环境保护在环境保护领域,盐析可以用来监测水质、大气、土壤等环境中的各种污染物的含量和分布,以及评估环境污染的程度和影响。
通过盐析,可以及时发现和处理环境中的有害物质,保护人类和自然生态系统的健康。
4. 食品安全在食品安全领域,盐析可以用来检测和鉴定食品中的添加剂、污染物和有害物质,以及评估食品的质量和卫生。
盐析的类别

盐析的类别盐析是指在水溶液中,由于溶液中溶解度过饱和度,使得溶液中的盐类逐渐析出。
盐析是一种常见的化学现象,其类别也是多种多样的。
本文将介绍盐析的类别及其特点。
一、晶体盐析晶体盐析是指盐类溶液中,由于过饱和度过高,使得盐类逐渐析出,形成晶体的过程。
晶体盐析是一种常见的盐析方式,其特点是析出的盐类呈现出晶体形态,而且晶体的形状和大小与溶液中的过饱和度、温度、pH值等条件有关。
晶体盐析的应用广泛,例如在制药、化妆品、食品等领域中,晶体盐析可以用于制备纯度高、结晶度好的化合物,提高产品的质量和市场竞争力。
二、胶体盐析胶体盐析是指盐类溶液中,由于过饱和度过高,使得盐类逐渐析出,形成胶体的过程。
胶体盐析是一种特殊的盐析方式,其特点是析出的盐类呈现出胶体形态,而且胶体的形态和大小与溶液中的过饱和度、温度、pH值等条件有关。
胶体盐析的应用也很广泛,例如在制备纳米材料、生物医学领域中,胶体盐析可以用于制备纯度高、形态规整的纳米材料,以及制备高效、低毒的药物载体等。
三、薄膜盐析薄膜盐析是指盐类溶液中,由于过饱和度过高,使得盐类逐渐析出,形成薄膜的过程。
薄膜盐析是一种特殊的盐析方式,其特点是析出的盐类呈现出薄膜形态,而且薄膜的厚度和形态与溶液中的过饱和度、温度、pH值等条件有关。
薄膜盐析的应用也很广泛,例如在制备光学薄膜、电子薄膜、传感器等领域中,薄膜盐析可以用于制备高质量、高稳定性的薄膜材料,以及制备高灵敏度、高选择性的传感器等。
四、凝胶盐析凝胶盐析是指盐类溶液中,由于过饱和度过高,使得盐类逐渐析出,形成凝胶的过程。
凝胶盐析是一种特殊的盐析方式,其特点是析出的盐类呈现出凝胶形态,而且凝胶的形态和稳定性与溶液中的过饱和度、温度、pH值等条件有关。
凝胶盐析的应用也很广泛,例如在制备生物医学材料、仿生材料等领域中,凝胶盐析可以用于制备高稳定性、高生物相容性的材料,以及制备具有特殊功能的仿生材料等。
总之,盐析是一种常见的化学现象,其类别也是多种多样的。
蛋白质盐析的原理和影响因素

蛋白质盐析的原理和影响因素蛋白质盐析是一种常用的蛋白质纯化方法,它基于溶液中添加高浓度的盐类,使蛋白质发生沉淀而分离出来的原理。
蛋白质盐析的效果受多种因素的影响,包括盐浓度、溶液pH值、温度等。
蛋白质盐析的原理是利用盐对蛋白质溶液的离子强度的影响,使蛋白质发生沉淀从而分离出来。
在溶液中,蛋白质通常呈现带电状态,正负电荷的相互作用使蛋白质分散均匀。
当盐浓度增加时,盐中的离子与蛋白质分子间发生竞争作用,将溶液中的水分子聚集在一起形成水合层,蛋白质间的静电相互作用减弱,从而导致蛋白质发生沉淀。
影响蛋白质盐析效果的主要因素之一是盐的类型和浓度。
一般来说,常用的盐类有氯化铵、硫酸铵、硫酸钠等。
不同的盐对蛋白质的沉淀效果有差异,一般而言,盐的离子强度越大,蛋白质的沉淀效果越好。
此外,盐的浓度也会影响蛋白质的盐析效果,过高或过低的盐浓度都会导致蛋白质的沉淀效果不理想。
溶液的pH值也是影响蛋白质盐析的重要因素之一。
蛋白质的带电性质与溶液的pH值密切相关,当溶液的pH值与蛋白质的等电点接近时,蛋白质的沉淀效果最佳。
如果溶液的pH值偏离蛋白质的等电点,蛋白质的沉淀效果将受到影响。
温度也会对蛋白质盐析的效果产生影响。
一般来说,较低的温度有利于蛋白质的沉淀,因为低温可以减弱蛋白质分子间的热运动,增加静电相互作用的机会。
但是,过低的温度也会导致溶解度降低,从而影响蛋白质的盐析效果。
蛋白质本身的性质也会对盐析效果产生影响。
不同的蛋白质具有不同的等电点、溶解度和聚集特性,因此对于不同的蛋白质,选择合适的盐析条件是非常重要的。
蛋白质盐析是一种常用的蛋白质纯化方法,通过调节盐浓度、溶液pH值和温度等因素,可以实现蛋白质的分离和纯化。
在进行蛋白质盐析时,需要根据具体的蛋白质性质和实验要求选择合适的条件,以获得最佳的盐析效果。
盐析
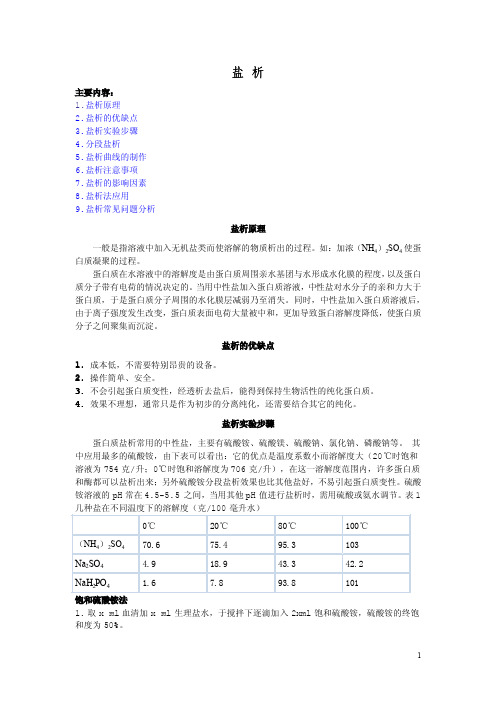
盐析主要内容:1.盐析原理2.盐析的优缺点3.盐析实验步骤4.分段盐析5.盐析曲线的制作6.盐析注意事项7.盐析的影响因素8.盐析法应用9.盐析常见问题分析盐析原理一般是指溶液中加入无机盐类而使溶解的物质析出的过程。
如:加浓(NH 4)2SO 4使蛋白质凝聚的过程。
蛋白质在水溶液中的溶解度是由蛋白质周围亲水基团与水形成水化膜的程度,以及蛋白质分子带有电荷的情况决定的。
当用中性盐加入蛋白质溶液,中性盐对水分子的亲和力大于蛋白质,于是蛋白质分子周围的水化膜层减弱乃至消失。
同时,中性盐加入蛋白质溶液后,由于离子强度发生改变,蛋白质表面电荷大量被中和,更加导致蛋白溶解度降低,使蛋白质分子之间聚集而沉淀。
盐析的优缺点1.成本低,不需要特别昂贵的设备。
2.操作简单、安全。
3.不会引起蛋白质变性,经透析去盐后,能得到保持生物活性的纯化蛋白质。
4.效果不理想,通常只是作为初步的分离纯化,还需要结合其它的纯化。
盐析实验步骤蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。
其中应用最多的硫酸铵,由下表可以看出:它的优点是温度系数小而溶解度大(20℃时饱和溶液为754克/升;0℃时饱和溶解度为706克/升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。
硫酸铵溶液的pH 常在4.5-5.5之间,当用其他pH 值进行盐析时,需用硫酸或氨水调节。
表1几种盐在不同温度下的溶解度(克/100毫升水)饱和硫酸铵法1.取x ml 血清加x ml 生理盐水,于搅拌下逐滴加入2xml 饱和硫酸铵,硫酸铵的终饱和度为50%。
0℃20℃80℃100℃(NH 4)2SO 470.675.495.3103Na 2SO 4 4.918.943.342.2NaH 2PO 41.67.893.81012.4℃,3h以上,使其充分沉淀离心(3000rpm),20min,充上清,以xml生理盐水溶解沉淀,再逐滴加饱和硫酸铵x/2ml。
盐析的原理

盐析的原理
盐析是一种利用离子间吸引力进行沉淀实验的方法。
其原理是通过加入一种能够与溶液中存在的离子反应生成固体沉淀物的反应物,从而使溶液中的离子形成可见的固体沉淀。
该方法常用于检测和分离溶液中的离子。
盐析方法的主要步骤如下:
1. 首先,将待检测的溶液加入到一个容器中。
2. 接下来,选择一种能与溶液中的离子反应生成固体沉淀物的反应物,通常是一种盐酸或硫酸盐。
3. 将反应物加入到溶液中,并充分搅拌或搅动溶液,以促进离子的反应和沉淀物的形成。
4. 当溶液中的离子与反应物反应生成固体沉淀物时,沉淀物会逐渐聚集并沉淀到溶液的底部。
5. 后续可以通过离心或过滤等方法将沉淀物与溶液分离。
可以使用化学方法或仪器进行沉淀物的进一步分析和鉴定。
盐析方法可以用于检测和分离不同离子,例如钠离子、钾离子、铜离子等。
其基本原理是根据离子之间的反应性差异进行选择性沉淀。
由于不同离子的反应性不同,盐析方法可以通过选择合适的反应物,将目标离子从溶液中沉淀出来,并通过沉淀物的形貌、颜色等特征进行识别和检测。
总之,盐析方法通过利用离子之间的反应生成固体沉淀物的特性,实现了对溶液中离子的检测和分离。
这种方法简单、快捷,并且可以用于各种离子的分析和鉴定。
关于盐析

①原理:盐析法对于许多非电解质的分离纯化都是适合的,也是蛋白质和酶提纯工作应用最早,至今仍广泛使用的方法。
其原理是蛋白质、酶在低盐浓度下的溶解质随着盐液浓度升高而增加(此时称为盐溶);当盐浓度不断上升时,蛋白质和酶的溶解度又以不同程度下降并先后析出,称为蛋白质的盐析。
这一现象是由于蛋白质分子内及分子间电荷的极性基团有着静电引力,当水中加入少量盐类时,由于盐类离子与水分子对蛋白质分子上的极性基团的影响,使蛋白质在水中溶解度增大。
但盐浓度增加到一定程度时,蛋白质表面的电荷大量被中和,水化膜被破坏,于是蛋白质就相互聚集而沉淀析出。
盐析法就根据不同蛋白质和酶在一定浓度的盐溶液中溶解度降低程度的不同而达到彼此分离的方法。
②盐的选择:蛋白质盐析常用中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。
其中应用最广的是硫酸铵,其优点是温度系数小而溶解度大(25℃时饱和溶解度为4.1mol/L,即767g/L;0℃时饱和溶解度为3.9mol/L,即676g/L),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来,而且硫酸铵价廉易得,分段效果比其他盐好,不容易引起蛋白质变性。
应用硫酸铵时,对蛋白氮的测定有干扰,缓冲能力比较差,故有时也应用硫酸钠,如盐析免疫球蛋白,用硫酸钠的效果也不错,硫酸钠的缺点是30℃以上溶解度太低。
其他的中性盐如磷酸钠的盐析作用比硫酸铵好,但也由于溶解度太低,受温度影响大,故应用不广。
硫酸铵浓溶液的pH在4.5~5.5之间,市售的硫酸铵常含有少量游离硫酸,pH值往往降至4.5以下,当用其他pH值进行盐析时,需用硫酸或氨水调节。
③硫酸铵饱和度计算法及加入方式:在分段盐析时,加盐浓度一般以饱和度表示,饱和溶液的饱和度定为100%。
用硫酸铵盐析时其溶液饱和度调整方法有3种。
一是当蛋白质溶液体积不大,所需调整的浓度不高时,可加入饱和硫酸铵溶液;饱和硫酸铵配制方法可加入过量的硫酸铵,热至50~60℃保温数分钟,趁热滤去沉淀,再在0℃或25℃下平衡1~2天,有固体析出时即达100%饱和度。
盐析的操作方法

③盐析的操作方法:最常用的是固体硫酸铵加入法。
欲从较大体积的粗提取液中沉淀蛋白质时,往往使用固体硫酸铵,加入之前要先将其研成细粉不能有块,要在搅拌下缓慢均匀少量多次地加入,尤其到接近计划饱和度时,加盐的速度更要慢一些,尽量避免局部硫酸铵浓度过大而造成不应有的蛋白质沉淀。
盐析后要在冰浴中放置一段时间,待沉淀完全后再离心与过滤。
在低浓度硫酸铵中盐析可采用离心分离,高浓度硫酸铵常用过滤方法,因为高浓度硫酸铵密度太大,要使蛋白质完全沉降下来需要较高的离心速度和较长的离心时间。
各种饱和度需加入固体硫酸铵的量可由附录中查出。
硫酸铵浓度的表示方法是以饱和溶液的百分数表示,称为百分饱和度,而不用实际的克数,这是由于当固体硫酸铵加到水溶液中去时,会出现相当大的非线性体积变化,计算浓度相当麻烦,为了克服这一困难,有人经过精心测量,确定出1L纯水提高到不同浓度所需加入硫酸铵的量,附录中的实验数据以饱和浓度的百分数表示,使用时十分方便。
④盐析曲线的制作:如果要分离一种新的蛋白质和酶,没有文献数据可以借鉴,则应先确定沉淀该物质的硫酸铵饱和度。
具体操作方法如下:取已定量测定蛋白质或酶的活性与浓度的待分离样品溶液,冷至0~5℃,调至该蛋白质稳定的pH值,分6~10次分别加入不同量的硫酸铵,第一次加硫酸铵至蛋白质溶液刚开始出现沉淀时,记下所加硫酸铵的量,这是盐析曲线的起点。
继续加硫酸铵至溶液微微混浊时,静止一段时间,离心得到第一个沉淀级分,然后取上清再加至混浊,离心得到第二个级分,如此连续可得到6~10个级分,按照每次加入硫酸铵的量,查出相应的硫酸铵饱和度。
将每一级分沉淀物分别溶解在一定体积的适宜的pH值缓冲液中,测定其蛋白质含量和酶活力。
以每个级分的蛋白质含量和酶活力对硫酸铵饱和度作图,即可得到盐析曲线。
⑤盐析的影响因素(1)蛋白质的浓度:中性盐沉淀蛋白质时,溶液中蛋白质的实际浓度对分离的效果有较大的影响。
通常高浓度的蛋白质用稍低的硫酸铵饱和度即可将其沉淀下来,但若蛋白质浓度过高,则易产生各种蛋白质的共沉淀作用,除杂蛋白的效果会明显下降。
盐析

由于盐是强电解质,解离作用强,盐的解离可抑制蛋白质弱电解质的解离,使蛋白质带电荷减少,更容易聚 集析出。
剂
剂
在中性配合萃取和离子缔合萃取体系中,使用盐析剂可提高被萃取组分的分配系数。盐析剂是一种不被萃取、 不与被萃物结合,但与被萃物有相同的阴离子从而使分配系数显著提高的无机化合物。通常盐析剂的阳离子在盐 析过程中,因在水溶液中有强烈的水合作用,能吸引大量自由水分子,降低水溶液中自由水分子浓度,可相对增 加被萃物在水相中的浓度,有利于被萃物萃入有机相。一般来说,盐析剂中的金属阳离子的电荷数越大,盐析作 用越强。在阳离子的电荷数相同的情况下,盐析作用与阳离子的半径成反比,这是因为价态高半径小的阳离子的 水化能力较强,所以使自由水分子减少的作用较大。一般金属离子的盐析效应按下列次序递减:
应用
应用
可以把发黄的白衬衫放在5%食盐水中浸泡1小时,再慢慢搓干净;或将衣服浸于10%的浓盐水中,泡1-2小时, 取出用清水漂洗干净。衣领部位的污渍可以单独加一些细盐粒轻轻搓洗效果更佳。应当注意的是衣服应当用凉水 浸泡,切勿使用热水。
谢谢观看
Al3+>Fe3+>Mg2+>Ca2+>Li+>Na+>NH4+>K+
盐析剂的选择除应考虑盐析作用外,还要考虑不影响下一步的分离和提纯、价格便宜、来源充足、水中溶解 度大等因素。通常以NH4NO3的应用最为普遍。
优点
优点
不会引起蛋白质变性,经透析去盐后,能得到保持生物活性的纯化蛋白质。
注意事项
结晶原理
ห้องสมุดไป่ตู้晶原理
盐析结晶是指在盐溶液体系中,加入某种电解质盐析剂,这种加入的盐析剂,其离子的水合作用比原溶液中 其它盐较强,它使溶液中自由水分子数减小,从而提高溶液中欲结晶物质在溶液中的有效浓度,使欲结晶物质在 溶液中结晶析出,这就是盐析结晶。
盐析作用

凝胶的溶胀
溶胀: 有的凝胶失去水分或重新吸收分散介质后, 形状和体 积几乎不变, 这种凝胶为脆性凝胶; 有的凝胶当失去分散介 质后, 体积显著缩小, 但当重新吸收分散介质时, 体积又重新 膨胀, 这种凝胶为弹性溶胶. 干燥的弹性凝胶吸收分散介质 而体积增大的现象称为溶胀. 无限溶胀: 溶胀是高分子化合物溶解的第一阶段. 对于某些 物质在一定溶剂中,最后达到全部溶解, 称为无限溶胀. 有限溶胀: 另一些高分子化合物, 由于形成了有交联的网状 结构, 在溶胀过程中, 所吸收的液体量达到最大值, 而不再继 续膨胀, 这种溶胀现象称为有限溶胀.
盐析Байду номын сангаас用
对于高分子溶液来说, 加入少量电解质, 它的稳定性并不 会受到影响, 到了等电点也不会聚沉, 直到加入更多电解质, 才能使它发生聚沉. 高分子溶液的这种聚沉现象称为盐析. 发 生盐析作用的主要原因是去水化. 有些高分子化合物含有可以电离的极性基从而使分子带 电, 少量电解质的加入可以引起动电电势的降低, 但并不能使 它失去稳定性, 这时分子仍是高度水化的, 只有加入更多的盐 才会出现盐析现象. 实验表明, 盐析能力与盐类离子的种类有 关. 一些离子盐析能力的顺序(也称感胶离子序)是: (阴)柠檬酸>酒石酸>SO42->醋酸>Cl->NO3->ClO2->I-. (阳) Li+>K+>Na+>NH4+>Mg2+ 这种顺序与离子的水化顺序极为一致.
00-8-1 4
00-8-1 2
胶凝现象, 触变现象和脱水收缩
A colloid. When gelatin is mixed with boiling water, it forms a colloidal dispersion called a sol. When cooled, the dispersion is called a gel.
盐析

盐析向蛋白质溶液中假如高浓度的中性盐,以破坏蛋白质的胶体性质,使蛋白质的溶解度降低而从溶液中析出的现象,叫做盐析. 原理:破坏了蛋白质在水中存在的两个因素(水化层和电荷),从而使蛋白质沉淀. 中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;
当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析. 将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出.盐析时若溶液pH在蛋白质等电点则效果更好.由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀.。
盐析实验报告

一、实验目的1. 了解蛋白质盐析的原理和操作方法。
2. 掌握蛋白质盐析实验的操作步骤和注意事项。
3. 通过实验,加深对蛋白质盐析现象的理解。
二、实验原理蛋白质盐析是指在蛋白质溶液中加入一定浓度的盐溶液,使蛋白质从溶液中析出的过程。
盐析过程中,蛋白质的溶解度随着盐浓度的增加而降低,当达到一定浓度时,蛋白质开始析出。
盐析是一种常用的蛋白质分离纯化方法,适用于不同类型的蛋白质。
三、实验材料与仪器1. 实验材料:鸡蛋清、饱和硫酸铵溶液、蒸馏水、试管、移液管、磁力搅拌器、滤纸、滤斗等。
2. 仪器:分析天平、烧杯、电子天平、电子秒表等。
四、实验步骤1. 准备工作:称取鸡蛋清1g,加入10ml蒸馏水,搅拌均匀。
2. 加入饱和硫酸铵溶液:将鸡蛋清溶液加入饱和硫酸铵溶液,加入量根据实验要求确定。
3. 搅拌混合:将混合液用磁力搅拌器搅拌10分钟,使蛋白质充分沉淀。
4. 静置:将混合液静置30分钟,让蛋白质充分沉淀。
5. 过滤:用滤纸和滤斗将沉淀物过滤,收集滤液。
6. 透析:将滤液加入透析袋中,放入装有蒸馏水的烧杯中,用电子天平称量透析袋和滤液的总质量。
7. 透析过程:每30分钟称量一次透析袋和滤液的总质量,观察蛋白质的沉淀情况。
8. 实验结束:透析至透析袋和滤液的总质量不再发生变化,实验结束。
五、实验结果与分析1. 实验结果:(1)在饱和硫酸铵溶液的作用下,蛋白质开始析出,形成白色沉淀。
(2)经过30分钟的静置,沉淀物逐渐增多,溶液变得浑浊。
(3)经过透析过程,蛋白质逐渐溶解,透析袋和滤液的总质量逐渐减少。
(4)透析至透析袋和滤液的总质量不再发生变化,实验结束。
2. 实验分析:(1)蛋白质在饱和硫酸铵溶液中发生盐析,沉淀出白色固体。
(2)蛋白质的沉淀速度与饱和硫酸铵溶液的浓度有关,浓度越高,沉淀速度越快。
(3)透析过程中,蛋白质逐渐溶解,透析袋和滤液的总质量逐渐减少,说明蛋白质分子透过透析膜,进入蒸馏水中。
(4)实验结果符合蛋白质盐析的原理,验证了实验目的。
盐析的应用

盐析的应用盐析作为一种被广泛应用的化学方法,一直以来就受到了广泛的关注和重视。
它可以进行常温下的反应,并且具有操作简单、反应速度快、成本低廉等优点,因此被广泛应用于化学分析、化学溶液的制备、生物制剂的制备、催化剂的制备以及有机合成研究等领域中。
首先,盐析在化学分析中发挥着重要的作用。
盐析可以将混合物中的不同成分分离出来,帮助我们更好地了解物质的组成,更准确地测定各个成分的浓度。
而且,只要把不同成分的溶液加入盐析反应中,就能产生颜色反应,从而达到快速即时分析的目的。
因此,盐析在化学分析中不可替代。
其次,盐析可以用于制备物质溶液。
盐析反应能够快速将金属离子和其他活性物质转化成溶液,因而可以用于物质溶液制备。
在医药制剂(如药物鼻滴剂)、食品添加剂、表面活性剂、颜料溶液、矿物质肥料等制剂中,都会使用盐析反应来制备溶液。
此外,盐析也被广泛应用于生物制剂的制备中。
生物制剂的制剂过程涉及到不同的物质、结构和性质,而且具有较低的稳定性,盐析可以很好地解决这些问题。
盐析可以调节生物活性物质的pH值,改善其稳定性,这样,生物制剂就能够更好地实现药物的控制释放和药物的细微颗粒化分散,从而实现药物的有效利用。
此外,盐析也被用作催化剂的制备中。
在催化反应中,盐析可以加快反应的速度,抑制反应的不对称性,提高反应的稳定性,而且还可以降低反应的副反应,减少能量消耗。
因此,盐析可以有效地改善催化反应的效率,提高反应的质量和产率,从而在有机合成研究方面发挥重要作用。
从上面可以看出,盐析作为一种被广泛应用的化学方法,在化学分析、制备生物制剂、催化剂以及有机合成研究等领域都发挥着重要的作用,以其简单、快速、低成本的特点,极大地提高了科学研究的效率,为进一步探索和发展科学技术奠定了基础。
盐溶和盐析

盐溶和盐析
盐溶解和盐析是人们日常生活中非常常见的过程,它们都有着非常重要的作用。
首先,盐溶解是将盐加入清水,使之完全融入而成为新的溶液,这是一个简单
而稳定的化学反应过程。
在我们平常生活中,盐溶解有着诸多应用,如调味料的制作,腌制食品时的使用,也常用于一些植物栽培的时候,能够有效改善土地的营养状况。
其次,盐析是将固体的盐溶解在水中,并且迅速将之分解成独立的离子,再由
溶液由渗透性离开而得到晶体的过程。
盐析也有着广泛的用途,最主要的是晶体制雨用,可以有效提纯药物材料,也可以用于食品工业。
此外,某些植物的种植,也要求借助盐析来进行营养的供应。
因此,盐溶解和盐析都是一个非常实用的过程,在我们的日常生活中无处不在,十分重要。
大家要注意分辨它们的用途,平时也要多加利用,从中获得相应的便利性。
分级盐析的原理

分级盐析的原理分级盐析(fractional crystallization),又称为逐级结晶法或分级结晶法,是一种从溶液中分离出多种物质的方法。
它的原理是基于物质在溶液中溶解度的差异,通过逐渐降低温度或者逐渐蒸发溶剂,使不同物质以不同的结晶点逐级结晶沉淀出来。
分级盐析是一个多阶段的分离过程,每个阶段中都有一部分固体物质结晶沉淀出来,然后收集和分离沉淀物。
整个过程中使用的溶剂通常是具有一定挥发性的液体,如水或有机溶剂。
分级盐析的过程可以被描述为连续的结晶和固体-溶液平衡状态之间的转变。
分级盐析的过程可以分为五个主要步骤:1. 溶解:将待分离的物质加入溶剂中,在适当的温度和压力下搅拌使其充分溶解。
溶液中的物质以离子、分子或团簇的形式存在。
2. 开始结晶:通过降低温度或者蒸发溶剂的方法,使溶液中物质的溶解度降低。
当达到物质在当前条件下的溶解度极限时,物质开始以固体的形式结晶沉淀出来。
溶液中会同时存在溶解物质和结晶沉淀物。
3. 分离结晶物质:收集并分离沉淀固体。
通常可以通过过滤、离心或者沉淀沉降等方法将结晶沉淀物与溶液分离开来。
收集的结晶物质可以作为产品或者进一步处理。
4. 重复结晶:重复步骤2和3直到得到所需纯度的结晶物质。
通过多次结晶过程,可以逐渐提高结晶物质的纯度。
每次结晶过程中,收集到的沉淀物通常会比前一次结晶时更纯。
5. 混合溶液的处理:对于溶剂中还残留有其他物质的情况,可以对溶液进行进一步的处理以去除杂质。
常见的处理方法包括沉淀物的热溶解、再结晶、萃取等。
分级盐析的原理是基于物质的溶解度和溶液中物质浓度的差异。
在一定条件下,溶液中的物质可以以溶解或结晶的形式存在,物质的溶解度取决于温度、压力和溶液中物质浓度。
当溶质的溶解度超过溶液的饱和度时,就会发生结晶沉淀。
不同物质在溶剂中的溶解度是不同的,这是由于物质之间的化学性质和相互作用力的差异导致的。
因此,在逐步降低温度或者逐渐蒸发溶剂的过程中,溶液中的不同物质会以不同的结晶点开始结晶沉淀。
盐析

典型应用行业
盐析法可适用于氯碱厂、涂布、油漆、制革、酶制剂、机加工、硫酸铵、蛋
白质提纯、生化产品、炼油厂、制药、淀粉糖类加工、食品饮料加工等多种行业。
● 技术原理
盐析是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程。
如:在乙酸的酯化反应中加入饱和碳酸钠溶液,降低乙酸乙酯溶解度,使其分层现象更明显的过程。
● 工艺流程图
● 工艺流程描述
用计量泵将有机物水溶液与浓盐水按一定体积比送入静态分布器中,充分混合后进入盐析罐,经过充分接触后,在无机盐作用下,有机物与水分层,比重轻的在上,比重重的在下。
分层后的有机物中含有少量的水,将其送入吸附精制单元进一步脱水。
水层则经中间储罐由泵送入盐溶液浓缩单元。
● 系统构成
盐析分离装置系统结构主要有静态均匀混合系统、盐析系统、盐水贮存系统、动力系统等。
● 装置特点及优势
①分辨率高;
②溶剂容易分离,并可回收使用;
③产品洁净;
⑤耗能低;操作简单。
● 典型应用行业
盐析法可适用于氯碱厂、涂布、油漆、制革、酶制剂、机加工、硫酸铵、蛋白质提纯、生化产品、炼油厂、制药、淀粉糖类加工、食品饮料加工等多种行业。
盐析的概念

盐析的概念盐析是在水溶液中发生的化学反应。
这种化学反应发生在两种化合物之间,其中一种是水分子,另一种是某种特定的盐(离子化合物)。
当水分子与这种盐的离子发生反应时,会产生盐析效果,也称为分解反应。
盐析是生物体中最重要的反应之一,它从一种物质(盐)合成另一种物质(即水),从而改变有机物质分子结构并影响其生物效应。
盐析过程是一个微量平衡反应,它要求其参与物质的分子必须在水中均匀地分散。
在盐析反应中,离子被水溶液冲洗,这导致其电荷表面从高电荷分子转变为低电荷,随着电荷的转移,发生电荷差异。
离子的形成使得水的极性特征被削弱、水的极性被改变,从而使盐析反应依赖于电荷差异、水的极性和溶质的分子性质。
盐析反应的结果是一个不可逆的化学反应,因为溶液的温度和pH值不会改变。
在盐析反应中,水会被分解成氢离子和氧离子,这两种离子不可再次结合。
因此,盐析反应可能会影响溶液的温度和pH值,从而影响生物体的行为和发育。
由于盐析反应影响溶液的电荷、极性和温度,因此它对生物体有重要的作用。
盐析反应可以在溶液中改变温度和pH值,对生物体有两个主要的作用。
第一,盐析反应改变了溶液的温度和pH值,这可以激活或抑制生物的活性,从而影响其行为和发育。
第二,盐析反应可以影响植物生长和繁殖,因为它们需要一定数量的水分,而这取决于溶液的电荷、极性和温度。
因此,植物对盐析反应非常重要,因为它可以维持生物体的生理状态和生长。
另外,盐析反应还可以用于液体的调节。
如果某种液体的浓度太高,盐析反应可以缓慢地调节其浓度。
由于盐析反应改变了溶液的温度和pH值,因此它可以用于创建一种稳定的环境条件,保护生物体免受外界刺激的影响。
总之,盐析作为一种化学反应,能够改变溶液的电荷、极性和温度,从而影响生物体的行为和发育,也能够为生物体提供保护,同时也可以用来调节液体的浓度。
然而,在进行盐析反应时,应特别注意,因为盐析反应是不可逆的,它可能会造成某些不良后果,从而影响生物体的健康。
盐析的应用

盐析的应用
盐析的应用一直被人们用来改善健康与美容,收获芳香滋润的体验。
日益普及
的盐析方法有利于作者提供时尚的享受,使人们获得舒适的客厅,使房间呈现出雅致自然宁静的氛围。
盐析方法可以有效改善呼吸状况,并能够净化空气,带给家庭安宁的生活环境。
它能够净化室内空气中的有害污染物,把室内空气转变成安宁新鲜的环境。
此外,它还有助于调节室内温度,使家庭能够充分享受舒适的温暖环境。
盐析技术还可以改善空气湿度,使室内空气得以调节,家庭业主可以在室内活
泼地放松,感受到舒适及沁凉。
它还可以净化室内空气中的有害污染物,家庭业主可以很安全地满足日常居住需求。
此外,盐析技术还有助于美容,把海盐气体添加到室内空气中可以改善皮肤的
湿度,让皮肤变得柔软滋润。
这项技术还可以改善皮肤色调,抑制去老化,使皮肤容颜焕然一新,使人们看起来年轻有活力的模样。
综上所述,盐析方法可以满足家庭对舒适、健康、环保和美容的要求,把室内
空气改善到最温暖、舒适、自然、安宁的状态,让家庭成员真正享受到家庭的温馨氛围。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①原理:盐析法对于许多非电解质的分离纯化都是适合的,也是蛋白质和酶提纯工作应用最早,至今仍广泛使用的方法。
其原理是蛋白质、酶在低盐浓度下的溶解质随着盐液浓度升高而增加(此时称为盐溶);当盐浓度不断上升时,蛋白质和酶的溶解度又以不同程度下降并先后析出,称为蛋白质的盐析。
这一现象是由于蛋白质分子内及分子间电荷的极性基团有着静电引力,当水中加入少量盐类时,由于盐类离子与水分子对蛋白质分子上的极性基团的影响,使蛋白质在水中溶解度增大。
但盐浓度增加到一定程度时,蛋白质表面的电荷大量被中和,水化膜被破坏,于是蛋白质就相互聚集而沉淀析出。
盐析法就根据不同蛋白质和酶在一定浓度的盐溶液中溶解度降低程度的不同而达到彼此分离的方法。
②盐的选择:蛋白质盐析常用中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。
其中应用最广的是硫酸铵,其优点是温度系数小而溶解度大(25℃时饱和溶解度为4.1mol/L,即767g/L;0℃时饱和溶解度为3.9mol/L,即676g/L),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来,而且硫酸铵价廉易得,分段效果比其他盐好,不容易引起蛋白质变性。
应用硫酸铵时,对蛋白氮的测定有干扰,缓冲能力比较差,故有时也应用硫酸钠,如盐析免疫球蛋白,用硫酸钠的效果也不错,硫酸钠的缺点是30℃以上溶解度太低。
其他的中性盐如磷酸钠的盐析作用比硫酸铵好,但也由于溶解度太低,受温度影响大,故应用不广。
硫酸铵浓溶液的pH在4.5~5.5之间,市售的硫酸铵常含有少量游离硫酸,pH值往往降至4.5以下,当用其他pH值进行盐析时,需用硫酸或氨水调节。
③硫酸铵饱和度计算法及加入方式:在分段盐析时,加盐浓度一般以饱和度表示,饱和溶液的饱和度定为100%。
用硫酸铵盐析时其溶液饱和度调整方法有3种。
一是当蛋白质溶液体积不大,所需调整的浓度不高时,可加入饱和硫酸铵溶液;饱和硫酸铵配制方法可加入过量的硫酸铵,热至50~60℃保温数分钟,趁热滤去沉淀,再在0℃或25℃下平衡1~2天,有固体析出时即达100%饱和度。
盐析所需饱和度可按下式计算:式中V及V0分别代表所需饱和度硫酸铵溶液及原溶液的体积,S2及S1分别代表所需达到的和原溶液的饱和度。
严格来说,混合不同体积的溶液时,总体积会发生变化使上式造成误差,但这由体积改变所造成的误差一般小于2%。
故可忽略不计。
另一种是所需达到饱和度较高而溶液的体积又不再过分增大时,可直接加入固体硫酸铵,其加入量可按下式计算:式中X是将1升饱和度为S1的溶液提高到饱和度为S2时所需硫酸铵的重量(g),G及A为常数,与温度有关。
G在0℃时为707,20℃时为0.29。
为方便起见,在室温及℃时所需硫酸铵的饱和度可直接查表2-1、表2-2求出。
表2-1室温下由S1提高到S2时每升加固体硫酸铵的克数0.10 0.20 0.25 0.30 0.35 0.40 0.45 0.50 0.55 0.60 0.65 0.70 0.75 0.80 0.85 0.90 0.95 1.000 55 113 114 175 209 242 278 312 350 390 430 474 519 560 608 657 708 7600.10 57 67 118 149 182 215 250 287 325 365 405 448 494 530 585 634 6850.20 29 59 90 121 154 188 225 260 298 337 379 420 465 512 559 6100.25 29 60 91 123 157 192 228 265 304 345 386 430 475 521 5710.30 30 61 93 125 160 195 232 270 310 351 394 439 485 5330.35 30 62 94 128 163 199 235 275 315 358 403 449 4950.40 31 63 96 131 166 205 240 280 322 365 410 4580.45 31 64 98 133 169 206 245 286 330 373 4200.50 32 63 100 135 172 211 250 292 335 3800.55 33 66 101 138 176 214 255 298 3440.60 33 67 103 140 179 219 261 3050.65 34 69 105 143 182 224 2670.70 34 70 108 146 187 2280.75 35 72 110 149 1700.80 36 73 112 1520.85 37 75 1140.90 37 760.95 38盐析法分离与纯化蛋白质注意的几个问题1)盐的饱和度:盐的饱和度是影响蛋白质盐析的重要因素,不同蛋白质的盐析要求盐的饱和度不同。
分离几个混合组分的蛋白质时,盐的饱和度常由稀到浓渐次增加,每出现一种蛋白质沉淀进行离心或过滤分离后,再继续增加盐的饱和度,使第二种蛋白质沉淀。
例如用硫酸铵盐析分离血浆中的蛋白质,饱和度达20%时,纤维蛋白原首先析出;饱和度增至28%~33%时,优球蛋白析出;饱和度再增至33%~50%时,拟球蛋白析出;饱和度大于50%以上时,白蛋白析出。
用硫酸铵不同饱和度分段盐析法,从牛胰中酸性提取分离可得到九种以上蛋白质及酶。
2)pH值:在等电点时,蛋白质溶解度最小容易沉淀析出,因此,盐析时除个别情况外,pH值常选择在被分离的蛋白质等电点附近。
3)蛋白质浓度:在相同盐析条件下,蛋白质浓度越大越易沉淀,使用盐的饱和度的极限愈低,如血清球蛋白的溶度从0.5%增到3.0%时,需用中性盐的饱和度的最低极限从29%递减至24%。
某一蛋白质欲进行两次盐析时,第1次由于浓度较稀,盐析分段范围较宽,第2次则逐渐收窄,例如用硫酸铵盐析胆碱酯酶时,第1次硫酸铵饱和度为35%至60%,第2次为40%至60%。
蛋白质浓度高些虽然对沉淀有利,但浓度过高也容易引起其他杂蛋白的共沉作用,因此,必须选择适当浓度,尽可能避免共沉作用的干扰。
表2-2 0℃下由S1提高到S2时每100ml加固体硫酸铵的克数溶液的原始饱和度(%)饱和度在0℃时所达到硫酸铵饱和度(%)20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100在100毫升中欲加固体硫酸铵的克数0 10.6 13.4 16.4 19.4 22.6 25.8 29.1 32.6 36.1 39.8 43.6 47.6 51.6 55.9 60.3 65.0 69.7 5 7.9 10.8 13.7 16.6 19.7 22.9 26.2 29.6 33.1 36.8 40.5 44.4 48.4 52.6 57.0 61.5 66.2 10 5.3 8.1 10.9 13.9 16.9 20.0 23.3 26.6 30.1 33.7 37.4 41.2 45.2 49.3 53.6 58.1 62.715 2.6 5.4 6.2 11.1 14.1 17.2 20.4 23.7 27.1 30.6 34.3 38.1 42.0 46.0 50.3 54.7 59.2 20 0 2.7 5.5 8.3 11.3 14.3 17.5 20.7 24.1 27.6 31.2 34.9 38.7 42.7 46.9 51.2 55.725 0 2.7 5.6 8.4 11.5 14.6 17.9 21.1 24.5 28.0 31.7 35.5 39.5 43.6 47.8 52.230 0 2.8 5.6 8.6 11.7 14.8 18.1 21.4 24.9 28.5 32.3 36.2 40.2 44.5 48.835 0 2.8 5.7 8.7 11.8 15.1 18.4 21.8 25.4 29.1 32.9 36.9 41.0 45.340 0 2.9 5.8 8.9 12.0 15.3 18.7 22.2 25.8 29.6 33.5 37.6 41.845 0 2.9 5.9 9.0 12.3 15.6 19.0 22.6 26.3 30.2 34.2 38.350 0 3.0 6.0 9.2 12.5 15.9 19.4 23.0 26.8 30.8 34.855 0 3.0 6.1 9.3 12.7 16.1 19.1 23.5 27.3 31.360 0 3.1 6.2 9.5 12.9 16.4 20.1 23.9 27.965 0 3.1 6.3 9.7 13.2 16.8 20.5 21.470 0 3.2 6.5 9.9 13.4 17.1 20.975 0 3.2 6.6 10.1 13.7 17.480 0 3.3 6.7 10.3 13.985 0 3.4 6.8 10.590 0 3.4 7.095 0 3.5100 04)温度:由于浓盐液对蛋白质有一定保护作用,盐析操作一般可在室温下进行,至于某些对热特别敏感的酶,则宜维持低温条件。
虽然蛋白质在盐析时对温度要求不太严格,但在中性盐下结晶纯化时,温度影响则比较明显。
5)脱盐:蛋白质、酶用盐析法沉淀分离后,常需脱盐才能获得纯品。
最常用的脱盐方法是透析法,如图2-1所示:把蛋白质溶液装入透析袋中,袋的二端用线扎紧,然后用蒸馏水或缓冲液进行透析,这时盐离子通过透析袋扩散到水或缓冲液中,蛋白质分子量大不能穿透析袋而保留在袋内,通过不断更换蒸馏水或缓冲液,直至袋内盐分透析完毕。
透析需要较长时间,常在低温下进行,并加入防腐剂避免蛋白质和酶的变性或微生物的污染。
此外用葡聚糖凝胶脱盐的效果也很好,其原理和应用方法在这里不赘述。
第一节盐析法一般来说,所有固体溶质都可以在溶液中加入中性盐而沉淀析出,这一过程叫盐析。
在生化制备中,许多物质都可以用盐析法进行沉淀分离,如蛋白质、多肽、多糖、核酸等,其中以蛋白质沉淀最为常见,特别是在粗提阶段。
盐析法分为两类,第一类叫Ks分段盐析法,在一定PH和温度下通过改变离子强度实现,用于早期的粗提液;第二种叫b分段盐析法,在一定离子强度下通过改变PH和温度来实现,用于后期进一步分离纯化和结晶。
一.影响盐析的若干因素1.蛋白质浓度高浓度蛋白溶液可以节约盐的用量,但许多蛋白质的b 和Ks常数十分接近,若蛋白浓度过高,会发生严重的共沉淀作用;在低浓度蛋白质溶液中盐析,所用的盐量较多,而共沉淀作用比较少,因此需要在两者之间进行适当选择。
用于分步分离提纯时,宁可选择稀一些的蛋白质溶液,多加一点中性盐,使共沉淀作用减至最低限度。
