二十三第一过渡系元素一钛钒铬锰
化学元素周期表记忆口诀

初⾼中化学都要求⼤家掌握元素周期表的规律与排列,以下是店铺整理的化学元素周期表记忆⼝诀,仅供参考,⼤家⼀起来看看吧。
化学元素周期表⼝诀 ⼝诀 A、按周期分: 第⼀周期:氢氦——侵害 第⼆周期:锂铍硼碳氮氧氟氖——鲤⽪捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩——那美⼥桂林留绿⽛(那美⼥⿁流露绿⽛) 第四周期:钾钙钪钛钒铬锰 铁钴镍铜锌镓锗——铁姑捏痛新嫁者砷硒溴氪——⽣⽓休克 第五周期:铷锶钇锆铌——如此⼀告你 钼锝钌——不得了铑钯银镉铟锡锑——⽼把银哥印西堤碲碘氙——地点仙 第六周期:铯钡镧铪——(彩)⾊贝(壳)蓝(⾊)河 钽钨铼锇——但(见)乌(鸦)(引)来鹅铱铂⾦汞砣铅——⼀⽩⼱供它牵铋钋砹氡——必不爱冬(天) 第七周期:钫镭锕——防雷啊! B、按族分: 氢锂钠钾铷铯钫——请李娜加⼊私访 铍镁钙锶钡镭——媲美盖茨被雷 硼铝镓铟铊——碰⼥嫁⾳他 碳硅锗锡铅——探归者西迁 氮磷砷锑铋——蛋临⾝体闭 氧硫硒碲钋——养⽜西蹄扑 氟氯溴碘砹——⽗⼥绣点爱 氦氖氩氪氙氡——害耐亚克先动 规律 ⼀、元素周期表中元素及其化合物的递变性规律 1、原⼦半径 (1)除第1周期外,其他周期元素(惰性⽓体元素除外)的原⼦半径随原⼦序数的递增⽽减⼩; (2)同⼀族的元素从上到下,随电⼦层数增多,原⼦半径增⼤。
2、元素化合价 (1)除第1周期外,同周期从左到右,元素最⾼正价由碱⾦属+1递增到+7,⾮⾦属元素负价由碳族—4递增到—1(氟⽆正价,氧⽆+6价,除外); (2)同⼀主族的元素的最⾼正价、负价均相同。
3、单质的熔点 (1)同⼀周期元素随原⼦序数的递增,元素组成的⾦属单质的熔点递增,⾮⾦属单质的熔点递减; (2)同⼀族元素从上到下,元素组成的⾦属单质的熔点递减,⾮⾦属单质的熔点递增。
4、元素的⾦属性与⾮⾦属性 (1)同⼀周期的元素从左到右⾦属性递减,⾮⾦属性递增; (2)同⼀主族元素从上到下⾦属性递增,⾮⾦属性递减。
元素周期表口诀【超好背】

元素周期表口诀【超好背】第一周期:氢氦----侵害第二周期:锂铍硼碳氮氧氟氖----鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩----那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰----嫁给康太反革命铁钴镍铜锌镓锗----铁姑捏痛新嫁者砷硒溴氪----生气休克第五周期:铷锶钇锆铌----如此一告你钼锝钌----不得了铑钯银镉铟锡锑----老爸银哥印西提碲碘氙----地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇----但(见)乌(鸦)(引)来鹅铱铂金汞砣铅----一白巾供它牵铋钋砹氡----必不爱冬(天)第七周期:钫镭锕----防雷啊!下面是竖着按族背:氢锂钠钾铷铯钫请李娜加入私访铍镁钙锶钡镭媲美盖茨被累硼铝镓铟铊碰女嫁音他碳硅锗锡铅探归者西迁氮磷砷锑铋蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱氦氖氩氪氙氡害耐亚克先动化合价可以这样记忆:一家请驴脚拿银,(一价氢氯钾钠银)一价氢氯钾钠银二家羊盖美背心.(二价氧钙镁钡锌)二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷元素周期表中各种元素名称的读音第01号元素:氢[化学符号]H,读“轻”,[英文名称]Hydrogen第02号元素:氦[化学符号]He,读“亥”,[英文名称]Helium第03号元素:锂[化学符号]Li,读“里”,[英文名称]Lithium第04号元素:铍[化学符号]Be,读“皮”,[英文名称]Beryllium第05号元素:硼[化学符号]B,读“朋”,[英文名称]Boron第06号元素:碳[化学符号]C,读“炭”,[英文名称]Carbon第07号元素:氮[化学符号]N,读“淡”,[英文名称]Nitrogen第08号元素:氧[化学符号]O,读“养”,[英文名称]Oxygen第09号元素:氟[化学符号]F,读“弗”,[英文名称]Fluorine第10号元素:氖[化学符号]Ne,读“乃”,[英文名称]Neon第11号元素:钠[化学符号]Na,读“纳”,[英文名称]Sodium第12号元素:镁[化学符号]Mg,读“美”,[英文名称]Magnesium第13号元素:铝[化学符号]Al,读“吕”,[英文名称]Aluminum第14号元素:硅[化学符号]Si,读“归”,[英文名称]Silicon第15号元素:磷[化学符号]P,读“邻”,[英文名称]Phosphorus第16号元素:硫[化学符号]S,读“流”,[英文名称]Sulfur第17号元素:氯[化学符号]Cl,读“绿”,[英文名称]Chlorine第18号元素:氩[化学符号]Ar,A,读“亚”,[英文名称]Argon第19号元素:钾[化学符号]K,读“甲”,[英文名称]Potassium第20号元素:钙[化学符号]Ca,读“丐”,[英文名称]Calcium第21号元素:钪[化学符号]Sc,读“亢”,[英文名称]Scandium第22号元素:钛[化学符号]Ti,读“太”,[英文名称]Titanium第23号元素:钒[化学符号]V,读“凡”,[英文名称]Vanadium第24号元素:铬[化学符号]Cr,读“各”,[英文名称]Chromium第25号元素:锰[化学符号]Mn,读“猛”,[英文名称]Manganese第26号元素:铁[化学符号]Fe,读“铁”,[英文名称]Iron第27号元素:钴[化学符号]Co,读“古”,[英文名称]Cobalt第28号元素:镍[化学符号]Ni,读“臬”,[英文名称]Nickel第29号元素:铜[化学符号]Cu,读“同”,[英文名称]Copper第30号元素:锌[化学符号]Zn,读“辛”,[英文名称]Zinc第31号元素:镓[化学符号]Ga,读“家”,[英文名称]Gallium第32号元素:锗[化学符号]Ge,读“者”,[英文名称]Germanium第33号元素:砷[化学符号]As,读“申”,[英文名称]Arsenic第34号元素:硒[化学符号]Se,读“西”,[英文名称]Selenium第35号元素:溴[化学符号]Br,读“秀”,[英文名称]Bromine第36号元素:氪[化学符号]Kr,读“克”,[英文名称]Krypton第37号元素:铷[化学符号]Rb,读“如”,[英文名称]Rubidium第38号元素:锶[化学符号]Sr,读“思”,[英文名称]Strontium第39号元素:钇[化学符号]Y,读“乙”,[英文名称]Yttrium第40号元素:锆[化学符号]Zr,读“告”,[英文名称]Zirconium第42号元素:钼[化学符号]Mo,读“目”,[英文名称]Molybdenum 第43号元素:碍[化学符号]Tc,读“得”,[英文名称]Technetium 第44号元素:钌[化学符号]Ru,读“了”,[英文名称]Ruthenium第45号元素:铑[化学符号]Rh,读“老”,[英文名称]Rhodium第46号元素:钯[化学符号]Pd,读“巴”,[英文名称]Palladium第47号元素:银[化学符号]Ag,读“银”,[英文名称]Silver第48号元素:镉[化学符号]Cd,读“隔”,[英文名称]Cadmium第49号元素:铟[化学符号]In,读“因”,[英文名称]Indium第50号元素:锡[化学符号]Sn,读“西”,[英文名称]Tin第51号元素:锑[化学符号]Sb,读“梯”,[英文名称]Antimony第52号元素:碲[化学符号]Te,读“帝”,[英文名称]Tellurium第53号元素:碘[化学符号]I,读“典”,[英文名称]Iodine第54号元素:氙[化学符号]Xe,读“仙”,[英文名称]Xenon第55号元素:铯[化学符号]Cs,读“色”,[英文名称]Cesium第56号元素:钡[化学符号]Ba,读“贝”,[英文名称]Barium第58号元素:铈[化学符号]Ce,读“市”,[英文名称]Cerium第59号元素:镨[化学符号]Pr,读“普”,[英文名称]Praseodymium 第60号元素:钕[化学符号]Nd,读“女”,[英文名称]Neodymium 第61号元素:钷[化学符号]Pm,读“颇”,[英文名称]Promethium 第62号元素:钐[化学符号]Sm,读“衫”,[英文名称]Samarium第63号元素:铕[化学符号]Eu,读“有”,[英文名称]Europium第64号元素:钆[化学符号]Gd,读“轧”,[英文名称]Gadolinium 第65号元素:铽[化学符号]Tb,读“忒”,[英文名称]Terbium第66号元素:镝[化学符号]Dy,读“滴”,[英文名称]Dysprosium 第67号元素:钬[化学符号]Ho,读“火”,[英文名称]Holmium第68号元素:铒[化学符号]Er,读“耳”,[英文名称]Erbium第69号元素:铥[化学符号]Tm,读“丢”,[英文名称]Thulium第70号元素:镱[化学符号]Yb,读“意”,[英文名称]Ytterbium第71号元素:镥[化学符号]Lu,读“鲁”,[英文名称]Lutetium第72号元素:铪[化学符号]Hf,读“哈”,[英文名称]Hafnium第73号元素:钽[化学符号]Ta,读“坦”,[英文名称]Tantalum第74号元素:钨[化学符号]W,读“乌”,[英文名称]Tungsten第75号元素:镧[化学符号]La,读“兰”,[英文名称]Lanthanum第75号元素:铼[化学符号]Re,读“来”,[英文名称]Rhenium第76号元素:锇[化学符号]Os,读“鹅”,[英文名称]Osmium第77号元素:铱[化学符号]Ir,读“衣”,[英文名称]Iridium第78号元素:铂[化学符号]Pt,读““,[英文名称]Platinum第79号元素:金[化学符号]Au,读“今”,[英文名称]Gold第80号元素:汞[化学符号]Hg,读“拱”,[英文名称]Mercury第81号元素:铊[化学符号]Tl,读“他”,[英文名称]Thallium第82号元素:铅[化学符号]Pb,读“千”,[英文名称]Lead第83号元素:铋[化学符号]Bi,读“必”,[英文名称]Bismuth第84号元素:钋[化学符号]Po,读“泼”,[英文名称]Polonium第85号元素:砹[化学符号]At,读“艾”,[英文名称]Astatine第86号元素:氡[化学符号]Rn,读“冬”,[英文名称]Radon第88号元素:镭[化学符号]Ra,读“雷”,[英文名称]Radium第89号元素:锕[化学符号]Ac,读“阿”,[英文名称]Actinium第90号元素:钍[化学符号]Th,读“土”,[英文名称]Thorium第91号元素:镤[化学符号]Pa,读“仆”,[英文名称]Protactinium第92号元素:铀[化学符号]U,读“由”,[英文名称]Uranium第93号元素:镎[化学符号]Np,读“拿”,[英文名称]Neptunium第94号元素:钚[化学符号]Pu,读“不”,[英文名称]Plutonium第95号元素:镅[化学符号]Am,读“眉”,[英文名称]Americium第96号元素:锔[化学符号]Cm,读“局”,[英文名称]Curium第97号元素:锫[化学符号]Bk,读“陪”,[英文名称]Berkelium第98号元素:锎[化学符号]Cf,读“开”,[英文名称]Californium第99号元素:锿[化学符号]Es,读“哀”,[英文名称]Einsteinium第100号元素:镄[化学符号]Fm,读“费”,[英文名称]Fermium第101号元素:钔[化学符号]Md,读“门”,[英文名称]Mendelevium 第102号元素:锘[化学符号]No,读“诺”,[英文名称]Nobelium第103号元素:铹[化学符号]Lw,读“劳”,[英文名称]Lawrencium第104号元素:鐪[化学符号]Rf,读“卢”,[英文名称]unnilquadium第105号元素:镀[化学符号]Db,读“杜”,[英文名称]dubnium第106号元素:钅喜[化学符号]Sg,读”喜“,[英文名称]第107号元素:钅波[化学符号]Bh,读"波“,[英文名称]Bohrium第108号元素:钅黑[化学符号]Hs,读”黑“,[英文名称]第109号元素:钅麦[化学符号]Mt,读"麦",[英文名称]第110号元素:钽[化学符号]Ds,读”达“,[英文名称]Darmstadtium 第111号元素:钅仑[化学符号]Rg,,读”伦“,[英文名称]Roentgenium。
实验二十三第一过渡系元素(钛、钒、铬、锰)

THANKS
感谢您的观看
钒(V)
物理性质
钒是一种银灰色的过渡金属,具有体心立方 晶体结构。
化学性质
钒的化学性质较为活泼,可以与氧、卤素等非金属 元素反应。此外,钒还可以形成多种氧化物和盐类 。
用途
钒主要用于钢铁工业中,作为合金元素可以 提高钢的强度、韧性和耐磨性。同时,钒在 化学、陶瓷等领域也有应用。
铬(Cr)
物理性质
酸碱反应
这些元素都能与酸反应生成相应的盐和氢气,同时也能与碱反应生成 相应的氢氧化物和氢气。
用途及应用领域
钛
由于钛具有高强度、低密度和良好的耐腐蚀性,它被广泛 应用于航空、航天、化工等领域。此外,钛及其合金在医 疗器械、珠宝首饰等方面也有应用。
铬
铬是重要的合金元素之一,可以提高钢的硬度、耐磨性和 耐腐蚀性。同时,铬也是电镀、颜料和催化剂等领域的重 要原料。
锰是一种银白色的过渡金属,具有脆性,易氧化。
化学性质
锰属于较活泼的金属,可以与氧、卤素等反应。锰的氧化物具有多 种颜色,可用于制造颜料和玻璃等。
用途
锰主要用于钢铁工业中,作为合金元素可以提高钢的强度、硬度和 耐磨性。同时,锰还用于制造电池、陶瓷和农药等领域。
Part
03
实验方法与步骤
实验材料准备
实验二十三第一过渡系 元素钛、钒、铬、锰
• 引言 • 第一过渡系元素概述 • 实验方法与步骤 • 实验结果与分析 • 第一过渡系元素性质探讨 • 实验总结与反思
目录
Part
01
引言
目的和背景
探究第一过渡系元素钛、 钒、铬、锰的物理和化学 性质。
了解这些元素在自然界中 的存在形式、提取方法和 应用领域。
【推选文档】第一过渡系元素Ti 、V、Cr、MnPPT

感谢观看
感谢观看
实验步骤
三.铬化合物的重要性质
2、低价钒化合物的生成: Zn
12四1、 、 、.CCM锰rrn((I(V化IOII))合H的的)物化化的的合合生重物物成要::及H性两性质、性质O、:H还还、原原P性b性 、氧化性 2 + - 112掌1H221421121Hp111141二1掌111、、、、、、、、、、Hmm、、、、m、++mmmmm握氧握试ooo、 、V低 V钛 低 V钒 低 CCV钒 VMVooooolllT化 Tlllll···rr纸222222HH·····nLLL价(价酸价酸((iiLLLLLOOOOOOIVI、、(---钛22II、O-----111555555II钒钒盐钒盐OOI11111))))))VV的的的的的H的、)))))的的、 、沸,,,的,,,化化的化的、、),,生生生生生生2锌化化石OOPPP生NNN的合合缩合缩CCKF成成成成成成HHbbb粒合aaa合,err2成(((生物物合物合、、CCC--SHNNNS和和和和和和、物物O、、lll和2O成的的反的反OOOOOOMM性性性性性性S4偏:4:333CC(((还nn及生生应生O应·()))Hll质质质质质质的的钒C0两--4稀稀稀222原+性成成:成:.r::::::(某 某酸2、(((性)))浓000性质:::pp(...些些铵HHOS、NNNNNN,,,,::OZZZHHHHHHH重重==、还KKK1nnn4-还444444Z11、要要MMM重m)原VVVVVVn,,3原;22PoOOOOOOnnn·化化铬性2,,lbOOO性333333·4332L合合酸444H,,;;;;;;+-11(((1、物物2铵00044)O...,氧的的、(H0化性性过.2O性质质硫2及及酸(3各各氨%主主、),要要二N氧氧氧aO化化化H态态锰(4之之、0%间间亚,相相硫6互互酸mo转转钠l·化化、L-的的1高, 条条锰2 m件件酸o。。钾l·L-1, 0. 2、Mn 的还原性: NaClO (H 、OH ) 2+ + 2、低价钒化合物的生成: Zn
钛钒铬锰实验报告

钛钒铬锰实验报告引言钛、钒、铬和锰是重要的过渡金属元素,具有重要的工业应用和研究价值。
本实验旨在通过合成和表征钛钒铬锰化合物,探究其物性和应用潜力。
通过实验研究,可以了解到钛钒铬锰化合物的结构、性质以及其在能源存储和催化领域的应用。
实验材料与方法材料•钛粉、钒粉、铬粉、锰粉•硝酸、硫酸、氢氧化钠•乙酸铵、乙二胺四乙酸•甲醇、丙酮方法1.合成TiO2-V2O5-Cr2O3-MnO2复合氧化物–将适量的钛粉、钒粉、铬粉和锰粉按一定比例混合。
–将混合粉末加入硝酸中,放置反应釜中进行反应,控制反应时间为3小时。
–将反应产物洗涤并干燥,得到TiO2-V2O5-Cr2O3-MnO2复合氧化物。
2.表征复合氧化物的结构和性质–使用X射线衍射仪(XRD)分析复合氧化物的晶体结构。
–利用扫描电子显微镜(SEM)观察复合氧化物的形貌和微观结构。
–运用傅里叶变换红外光谱(FT-IR)研究复合氧化物的化学键和功能团。
3.能源存储性能测试–制备TiO2-V2O5-Cr2O3-MnO2复合氧化物电极。
–使用循环伏安法(CV)测试电极在锂离子电池中的充放电性能。
–测试电极的循环稳定性和比容量。
4.催化性能测试–制备TiO2-V2O5-Cr2O3-MnO2复合氧化物催化剂。
–在一定温度下,利用甲醇气相催化反应评估催化剂的活性。
结果与讨论TiO2-V2O5-Cr2O3-MnO2复合氧化物的合成通过控制反应的时间和温度,成功合成了TiO2-V2O5-Cr2O3-MnO2复合氧化物。
采用XRD对产物进行分析,得到其晶体结构的信息,进一步确认了合成的化合物。
TiO2-V2O5-Cr2O3-MnO2复合氧化物的表征SEM观察结果显示,TiO2-V2O5-Cr2O3-MnO2复合氧化物呈现出颗粒形貌,并且颗粒之间有较好的结合。
FT-IR光谱显示,复合氧化物中存在着特定的化学键和功能团,这对于复合氧化物的应用具有重要意义。
能源存储性能测试结果通过对TiO2-V2O5-Cr2O3-MnO2复合氧化物的充放电性能测试,得到了其电化学性能的数据。
过渡元素的性质介绍

③、2VOCl3+3H2O==V2O5+6HCl
性 砖红色,无臭,无味,有毒,针状晶体, 质 微溶于水,两性片酸性氧化物,易溶于碱。
V2O5+2NaOH ==2NaVO3+H2O
此反应用于鉴定12MoO42-离子。
其它的杂多酸的结构和 一些性质见P971-973 (略)。
5-1 锰元素的概述
1、存在:
软锰矿(MnO2·xH2O),黑锰矿(Mn3O4), 水锰矿(MnO(OH))和锰结核(海底)。 丰度为0.085%。
二、常见氧化态
Mn有多种氧化态 +2、+3、+4、+6、+7, 在某些配位化合物中还显低氧化态+1、 0、-1、-2和-3。
为什么Ti 4+所形
成的配合物都没
在Ti(Ⅳ)与H2O2则可形成有色有的颜色配?合?物, 强酸溶液中显红色稀酸或中性溶液显橙 色配合物[TiO(H2O2)]2+:
TiO2+ + H2O2 == [TiO(H2O2)]2+ 可利用此反应测定钛。
注意: 在溶液中不存在简单 的Ti(H2O)64+,只存 在[Ti(OH)2(H2O)4]2-可简写 为[TiO(H2O)5]2+称为钛酰离子。
②、TiOSO4+2H2O=H2TiO3↓+H2SO4
或Ti(SO4)2+H2O=TiOSO4+H2SO4
③、H2TiO3==TiO2+H2O(煅烧)
④、TiO2+2C+2Cl2==TiCl4+CO↑(△)
⑤、TiCl4+2Mg=2MgCl2+Ti (△)
化学元素周期表(高清)
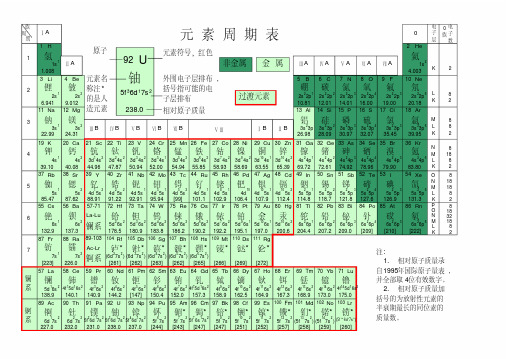
电子层1H2He3Li 4Be5B6C7N8O9F10Ne11Na 12Mg13Al 14Si 15P16S17Cl18Ar19K 20Ca21Sc 22Ti23V24Cr25Mn 26Fe 27Co 28Ni 29Cu 30Zn 31Ga 32Ge 33As 34Se 35Br36Kr37Rb 38Sr39Y40Zr41Nb 42Mo 43Tc 44Ru 45Rh 46Pd 47Ag 48Cd 49In50Sn 51Sb 52Te 53I54Xe55Cs 56Ba72Hf 73Ta74W75Re 76Os 77Ir78Pt79Au 80Hg 81Tl82Pb 83Bi84Po 85At86Rn87Fr 88Ra104Rf105Db106Sg107Bh108Hs109Mt 110Ds 111Rg57La58Ce59Pr60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er69Tm 70Yb 71Lu89Ac90Th91Pa 92U93Np 94Pu 95Am 96Cm 97Bk 98Cf 99Es 100Fm 101Md 102No 103Lr1s11s21.008 4.003元 素 周 期 表氢氦氮氧氟氖锂铍硼碳2s 22p32s 22p42s 22p52s 22p62s12s22s 22p12s 22p214.0116.0019.0020.186.9419.01210.8112.01磷硫氯氩钠镁铝硅3s 23p33s 23p43s 23p53s 23p63s13s23s 23p3s 23p230.9732.0735.4539.9522.9924.3126.9828.09钒铬锰铁钾钙钪钛镓锗砷硒钴镍铜锌溴氪4s14s23d 14s23d 24s23d 34s23d 54s13d 54s23d 64s24s 24p14s 24p24s 24p34s 24p43d 74s23d 84s23d 104s13d 104s24s 24p54s 24p639.1040.0844.9647.8750.9452.0054.9455.8569.7272.6174.9278.9658.9358.6963.5565.3979.9083.80铷锶钇锆铌钼锝钌铟锡锑碲铑钯银镉碘氙5s15s24d 15s24d 25s24d 5s14d 55s14d 55s24d 75s15s 25p15s 25p25s 25p35s 25p44d 85s14d104d 105s14d 105s25s 25p55s 25p685.4787.6288.9191.2292.9195.94[99]101.1114.8118.7121.8127.6102.9106.4107.9112.4126.9131.357-71铯钡La-Lu铪钽钨铼汞铊铅铋锇铱铂金钋砹氡6s16s25d 26s25d 36s25d 46s25d 56s25d 66s26s 26p16s 26p26s 26p36s 26p45d 76s25d 96s15d 106s15d 106s26s 26p56s 26p6132.9137.3178.5180.9183.8186.2190.2192.2[209][210]195.1197.0200.6204.4钫镭Ac-Lr[222]89-103207.2209.07s17s2(6d 27s 2)(6d 37s 2)(6d 47s 2)(6d 57s 2)(6d 67s 2)[262][265][272][223]226.0[261][262][263]镧铈镨钕钷钐铕[266][269]镱镥钆铽镝钬5d 16s24f 15d 16s 24f 36s24f 46s2铒铥4f 96s24f 106s24f 116s24f 126s24f 56s24f 66s24f 76s 24f 75d 16s24f 136s24f 146s 24f 145d 16s2138.9140.1140.9144.2[147]150.4152.0173.0175.0157.3158.9162.5164.9锕钍镤铀167.3168.9锫锎锿镄镎钚镅锔钔锘铹6d 17s26d 27s25f 26d 17s 25f 36d 17s 25f 46d 17s 25f 67s25f 77s2(5f 147s 2)(5f 146d 17s 2)5f 76s 17s 25f 97s25f 107s25f 117s2227.0232.0231.0238.05f 127s 2(5f 137s 2)[252][257]237.0[244][243][247][260]1234567[247][251]镧系锕系[258][259]锕系镧系周期族ⅠAⅡA ⅢBⅣBⅤB ⅥBⅦBⅠBⅡBⅤⅢⅢA ⅣA ⅤA ⅥA ⅦA 0族电子数KL M N O P K L M N O K L M N K L M KL K 28 18 32 18 8 2 8 18 18 8 2 8 18 8 2 8 8 28 2U92铀5f 36d 17s 2238.0相对原子质量元素符号,红色外围电子层排布,括号指可能的电子层排布原子元素名称注*的是人造元素非金属金属过渡元素注:1.相对原子质量录自1995年国际原子量表,并全部取4位有效数字。
第一过渡系元素(一)(钛、钒、铬、锰)

第一过渡系元素(一)(钛、钒、铬、锰)第一过渡系元素是指周期表中第3至第12族的元素,它们在化学性质上有相似之处。
其中,钛(Ti)、钒(V)、铬(Cr)和锰(Mn)是第一过渡系元素中的前四个元素,它们具有一些共通的特性,同时也存在一些区别。
本文将从以下几个方面来介绍这四个元素:元素性质、物理性质、化学性质以及地质应用。
一、元素性质1.钛(Ti)钛是一种质轻、高强度、高耐腐蚀性、抗疲劳性能好的金属。
它具有优异的机械性能,被广泛应用于航空、航天、化工、海洋开发等领域。
同时,钛也是一种生物医用材料,被用于制作人体骨骼支架、人造关节、人工心脏瓣膜等。
2.钒(V)钒是一种银白色金属,比铁硬但稍加工艺处理后可以获得良好的延展性和强度。
它还有广泛的应用,用于制造钢、化学试剂和合金等。
不仅如此,钒还是一种强化剂,在钢铁生产过程中起到重要的作用。
3.铬(Cr)铬是一种具有高度耐腐蚀性的银白色金属,它主要应用于不锈钢、电子元器件、航空航天、制药等领域。
除此之外,铬还是一种环保型材料,可以用于净水和净化技术。
4.锰(Mn)锰是金属元素中的一种,它是一种银灰色的金属,具有良好的延展性和韧性。
锰还是钢铁生产中的一种重要元素,可以增强钢的硬度和韧性。
二、物理性质钛是一种具有低密度和高强度的金属,密度为4.54克/厘米立方。
它具有较高的熔点(1668℃)和沸点(3287℃),同时也具有较高的热导率和电导率。
三、化学性质钛是一种化性非常稳定的金属,在常温下不会被大多数酸和碱腐蚀。
它可以与氧、氮、氢反应,产生相应的氧化物、氮化物和氢化物。
此外,钛还可以和卤素反应,如氯、溴和碘等,生成相应的卤化物,例如TiCl4、TiBr3等。
锰可以和许多元素和化合物发生反应。
它可以与氧、氯、酸、弱碱等反应,生成各种不同的化合物。
在大气环境下,锰会逐渐氧化形成氧化锰,该过程是一种蓝黑色的化学反应。
四、地质应用钒是一种重要的工业金属,在地球上的丰度较低,但在一些特定的矿物中含量较高。
实验七 第一过渡系元素 (钛、钒、镉、锰)

实验七第一过渡系元素 (钛、钒、镉、锰)第一过渡系元素是指周期表中第3到第12族元素,它们拥有类似的电子结构和化学性质,具有宽广的应用前景。
其中,钛、钒、镉、锰是较为常见的第一过渡系元素,本篇文章将介绍这些元素的基本性质、应用领域以及相关实验。
一、钛(Ti)钛是一种银白色、质地轻巧的金属,熔点高达1670℃,具有较高的强度和耐腐蚀性。
由于其优良的物理和化学性质,钛被广泛应用于航空、航天、能源、汽车、医药等领域。
目前,钛制品已成为高端制造业的主要材料之一。
钛的化学性质活泼,易于形成氧化物。
在实验中,常用Na2TiO3或K2TiO3作为钛标准溶液,通过络合滴定法测定样品中的钛含量。
此外,钛还可以与硫酰化剂反应,生成具有深色化合物,可以用于反应的定量分析。
二、钒(V)钒是一种银灰色金属,化学性质活泼。
钒元素存在于许多矿物中,主要产地为俄罗斯、中国和南非等地。
钒是重要的合金元素,可以提高钢的韧性和耐磨性。
此外,钒也可以用于生产电池和电导管等。
钒的分析方法比较复杂。
在实验中,可以通过还原-氧化反应测定样品中钒的含量。
首先,将样品转化为VO2+,然后将VO2+还原为V2+,最后再进行氧化反应。
三、镉(Cd)镉是一种银灰色金属,属于类锌金属。
长期以来,镉被广泛用于电池、电子器件、涂料、塑料等领域。
然而,由于其高毒性和紫外线敏感性,镉已被列入高毒性元素之列。
在实验中,可以用电化学或原子吸收光谱法测定样品中的镉含量。
电化学分析时,将样品置于电极中,然后进行电位扫描,以测定镉的还原电位。
原子吸收光谱法则是将样品原子吸收到特殊的光源中,测量其吸收的光谱信号,以得到镉的含量。
四、锰(Mn)锰是一种灰黑色的金属,具有较高的硬度和抗腐蚀能力。
由于其良好的物理和化学性质,锰被广泛应用于铁合金、电池、合成橡胶、开本工业等领域。
在实验中,可用酸碱滴定法测定锰的含量。
首先,将锰溶解为Mn2+,然后加入过量的氧化还原剂,使Mn2+被氧化为MnO4-。
钪钛钒铬锰元素符号

钪钛钒铬锰元素符号
钪钛钒铬锰是一种元素符号,也叫钪钛钒铬锰系元素,它包含化学元素:钪(Sc)、钛(Ti)、钒(V)、铬(Cr)、锰(Mn)。
它们属于第3d期元素,也
就是常说的4d期元素的前一群。
钪钛钒铬锰元素都是过渡金属元素,具有许多非常有用的特点,其中钪具有检测辐射性能、优良的耐腐蚀性和高强度力学性能,在航空航天中有广泛的应用;钛具有轻、坚硬、阻燃等诸多优异的特性,适宜应用于医疗器材,航空航天、防护及机械产品;钒具有高熔点、高强度以及耐腐蚀性,可以应用于制造军工设备和汽车部件;铬有优异的耐蚀性、耐热性和硬度,广泛应用于建筑、军の工、汽车制造;锰具有抗酸、抗蚀性,可以用于制造锚、军工设备、汽车零件甚至游船、直升机等。
这些元素最主要的特点是耐腐蚀性和抗老化能力,其中钪钛钒铬锰元素的结构特征和耐腐蚀性的物理性质,可以被用来制造高质量的器件,尤其是用于制造绝缘材料。
它们也可用作催化剂,可以加快几乎所有反应的进程。
总之,钪钛钒铬锰系元素在元素化学中占据着重要的地位。
它们广泛应用于社会生产和日常生活,有着多方面的优异性能,为当今社会和未来发展提供了重要贡献。
d区金属元素钛钒铬锰实验报告

实验报告:d区金属元素钛钒铬锰背景d区金属元素是周期表中4d和5d区的过渡金属元素,包括钛(Ti)、钒(V)、铬(Cr)和锰(Mn)。
这些元素具有重要的工业应用和科学研究价值。
本实验旨在通过一系列实验方法对这些金属元素进行分析,了解它们的性质和特点。
实验目的1.通过化学反应、物理性质等实验手段分析钛、钒、铬和锰的特性;2.研究这些金属元素在不同条件下的反应行为;3.探究这些金属元素的应用领域及潜在价值。
实验步骤1.钛(Ti)实验:–准备一定浓度的氯化钛溶液;–在试管中加入氯化钛溶液,并观察其颜色变化;–在不同条件下,如加热或与其他试剂反应,观察其反应行为。
2.钒(V)实验:–准备一定浓度的硫酸亚铁溶液和硫酸钠溶液;–将硫酸亚铁溶液滴加到硫酸钠溶液中,观察产生的颜色变化;–在不同条件下,如改变温度或添加其他试剂,观察其反应行为。
3.铬(Cr)实验:–准备一定浓度的硫酸铬溶液;–在试管中加入硫酸铬溶液,并观察其颜色变化;–在不同条件下,如改变pH值或与其他试剂反应,观察其反应行为。
4.锰(Mn)实验:–准备一定浓度的硝酸锰溶液和氯化亚锡溶液;–将氯化亚锡溶液滴加到硝酸锰溶液中,观察产生的颜色变化;–在不同条件下,如改变温度或添加其他试剂,观察其反应行为。
分析钛(Ti)钛是一种轻质、高强度、耐腐蚀的金属,在航空航天、汽车制造和医疗器械等领域有广泛应用。
实验结果显示,在加热时,钛溶液呈现出橙红色,并发生氧化反应,生成了二氧化钛。
钒(V)钒是一种重要的合金元素,在钢铁工业中起着关键作用。
实验结果显示,当硫酸亚铁溶液滴加到硫酸钠溶液中时,产生了深蓝色的络合物。
这种颜色变化可以用来检测钒的存在和浓度。
铬(Cr)铬是一种耐腐蚀的金属,在不锈钢制造、镀铬工艺等方面有广泛应用。
实验结果显示,在酸性条件下,硫酸铬溶液呈现出黄绿色。
而在碱性条件下,它会转变为深绿色。
锰(Mn)锰是一种重要的合金元素,在冶金、电池制造和化学工业中有广泛应用。
无机化学实验报告 第一过渡元素 一 Ti V Cr Mn
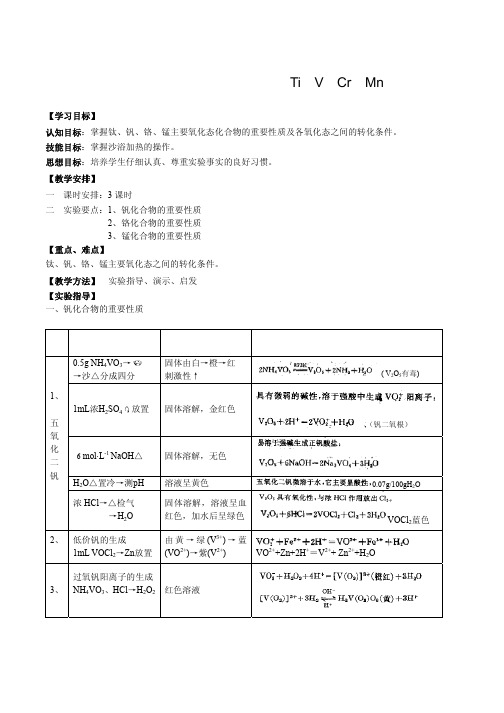
(VO2+)→紫(V2+)
VO2++Zn+2H+=V2++ Zn2++H2O
过氧钒阳离子的生成 3、 NH4VO3、HCl→H2O2 红色溶液
4、
►0.1g NH4VO3 →pH14、3、2、1 的
pH14:无色溶液(VO43-
)
缩 水溶液, 使溶解。
合 反 应
► pH=1→水△→0.1 mol·L-1NaOH ► pH=14→水△→ 0.1 mol·L-1HCl
2、铬化合物的重要性质 3、锰化合物的重要性质 【重点、难点】 钛、钒、铬、锰主要氧化态之间的转化条件。
【教学方法】 实验指导、演示、启发 【实验指导】 一、钒化合物的重要性质
内 方法、试剂
容
0.5g NH4VO3→ →沙△分成四分
现象
固体由白→橙→红 刺激性↑
解释及方程式
( V2O5有毒)
1、
1mL浓H2SO4 放置 五
酸、碱性介质
才会被氧化。 在碱由于生成难溶Mn(OH)2,易被空气中的氧氧化。
(2) MnS 的生成与性质 Mn2+→H2S Mn2+→Na2S
H2S:无明显现象 Na2S:肉红色↓
Mn2++S2-=MnS Ksp=1.4×10-15 饱和H2S溶液中为弱酸,S2-浓度较低,很难使之沉 淀,而Na2S呈碱性,S2-浓度能保证使之沉淀。H2S =2H++S2-
Mn2+的性质 与OH-→Mn(OH)2↓;酸中能稳定存在,在碱中易被氧化;与Na2S→MnS↓
2、MnO2生成与氧化性
(1) KMnO4→Mnห้องสมุดไป่ตู้O4→↓
16.钛钒铬锰

合,因此不能采用碳直接还原法炼制钛。目前常
采用的炼制方法为:
浓H2SO4 钛铁矿 选矿 精矿砂 酸解 H2O
硫酸盐
水解
偏钛酸
焙烧
Cl2 TiO2 钛锭
浇铸 电弧熔融
金属钛
(海绵状)
还原
(氩气)
TiCl4
氯化
1000-1100K
Mg
C
⑴酸解 用浓硫酸处理钛铁矿[FeTiO3]精矿砂, 使钛铁矿中的钛和铁转变为硫酸盐。
短柱状、双锥状等,金刚光泽,
无色;天然锆石因常含杂质而带
各种颜色,成色优的可作为宝石。
主产于火层岩和片麻岩中,是工 业提取锆的主要原料。
②斜锆石[ZrO2]又称为“巴西石”,单斜晶系,晶
体常呈板状或片状,集合体为不规则块状,金刚光
泽,无色;天然斜锆石因常含杂质而带各种颜色。
主产于与碱性或超基性岩有关的烧绿石碳酸岩矿床 中及其风化后形成的砂矿中,也是工业提取锆的主 要原料。
BaTiO3 + CO2↑
钛酸钡为白色粉末或无色晶体,
其熔点为1618℃,1460℃以上结 晶出来的属六方晶系,在130- 1460℃时转变为立方晶系。
Ti O
Ba
钛酸盐和钛氧盐
钛酸盐大多难溶于水 硫酸氧钛(TiOSO4)为白色粉末可 溶于冷水 均易水解,生成白色偏钛酸沉淀 Na2TiO3 + 2H2O → H2TiO3 + 2NaOH TiOSO4 + 2H2O
3.四氯化钛
沸点为136.4℃,有刺激性气味;在室温下为无色
液体,不纯时常为黄或红棕色液体,易溶于有机溶 剂 ,是生产金属钛及其化合物的重要中间体。 四氯化钛极易水解,在空气中发烟,生成二氧化 钛固体和盐酸液滴的混合物。 可用于制 造烟雾
第一过度系元素(钛、钒、镉、锰)

实验二十三:第一过渡系元素(钛、钒、铬、锰)〔实验目的〕1.掌握钛、钒、铬、锰主要氧化态的化合物的重要性质及各氧化态之间相互转化的条件;2.练习沙浴加热操作。
〔实验原理〕一、钛的重要化合物1.二氧化钛(TiO2)(1) 物理性质:自然界存在的金红石TiO2具有晶体状结构,属四方晶系,它因含有铁、铌、钽、钒等而呈红色或黄色。
金红石的硬度高,化学性能稳定;用化学方法制备而得的二氧化钛是白色粉末,可在工业上用作白色涂料,最重要是可用于制备钛的化合物。
(2) 化学性质:TiO2 + BaCO3 = BaTiO3 + CO2TiO2 + H2SO4 = TiOSO4+ H2O(用于制备β型钛酸)α- TiO2·H2O + 2NaOH = Na2TiO3·nH2O(偏钛酸钠)(碱作用于酸性的新制备的钛盐溶液,则得到型α型钛酸,其反应活性大于β型钛酸,能溶于酸和碱。
)(3) 制备:① TiCl4 + O2 = TiO2 + 2Cl2② FeTiO3 + 2H2SO4 = TiOSO4(硫酸氧钛)+ FeSO4 + 2H2OTiOSO4 + 2H2O = TiO2·H2O (β型钛酸)+ H2SO4TiO2·H2O = TiO2 + H2O2.四氯化钛(TiCl4)⑴ 物理性质:四氯化钛是以共价键占优势的化合物,它的熔点为250K,沸点为409K,因此在常温下四氯化钛是无色液体,有刺激性气味,且易吸潮。
⑵ 化学性质:①水解:TiCl4 + 2H2O = TiO2 + 4HCl如果HCl的量不足,则会生成[TiO2Cl4]4-或[ TiOCl5]3-;如果HCl过量,则生成 [ TiCl6]2-②与还原剂反应:2TiCl4 + H2 = 2TiCl3+ 2HCl(生成紫色粉末状的三氯化钛)2TiCl4 + Zn = 2TiCl3+ ZnCl2(在水溶液中析出紫色TiCl3·6H2O晶体,而在乙醚层中得到绿色TiCl3·6H2O)Ti3+ + 3OH- = Ti(OH)3↓或2Ti3+ + 3H2O + 3CO32- = 2Ti(OH)3↓+ 3CO2 (紫色沉淀)是一种较强的还原剂,在空气中易被氧化:4Ti3+ + 2H2O + O2 = 4TiO2+ + 4H+TiO2+ + 2OH-+ H2O = Ti(OH)4↓⑶ 制备:TiO2 + 2Cl2 + 2C = TiCl4 + 2COTiO2与COCl2、SOCl2、CHCl3、CCl4等氯化试剂反应:TiO2 + CCl4 = TiCl4 + CO2⑷ 用途:制作烟幕弹,有机聚合反应的催化剂。
27、第一过渡系元素(一)(钛、钒、铬、锰)

[VO2(O2)2]3++6H+→[V(O2)]3+
现象:生成红棕色[V(O2)]3+。 总结:NH4VO3在强酸性介质中,加入H2O2,生 成过氧钒[V(O2)]3+阳离子,该离子为红 棕色。
4.钒酸盐的缩合反应 (1)取四支试管,分别加入10mLpH分别为14,3,2和1(用 0.1 mol· L-1NaOH溶液和0.1 mol· L-1盐酸配制)的水溶液, 再向每支试管加入0.1g偏钒酸铵固体(约一角勺尖)。振 荡试管使之溶解,观察现象并加以解释。 现象:
在试管中加入米粒大小的二氧化钛粉末,然后加 入2mL浓H2SO4,再加入几粒沸石,摇动试管至近沸 (注意防止浓硫酸溅出),观察试管的变化。冷却 静置后,取0.5mL溶液,滴入1滴3%的H2O2,观察现 象。
反应方程式如下: TiO2+2H2SO4(浓)=Ti(SO4)2+2H2O
Ti(SO4)2易水解,实际得到TiOSO4白色粉末
实验:
第一过渡系元素(一)(钛、钒、铬、锰)
[实验目的]
1、掌握钛、钒、铬、锰主要氧化 态的化合物的重要性质及各氧
化态之间相互转化的条件。 2、练习沙浴加热操作。
[实验用品]见教材P179。
[基本操作]:
沙浴加热,参见第三章三。
[实验内容]
一、钛的化合物的重要性质
1、二氧化钛的性质和过氧钛酸根的生成
在第一份固体中,假如1 mL浓 H2SO4 振荡,
放置。观察溶液颜色,固体是否溶解?在第二份
固体中,加入6 mol· L-1NaOH溶液加热。有何变化?
在第三份固体中,加入少量蒸馏水,煮沸、静置,待其
冷却后,用pH试纸测定溶液的pH 。在第四份固体中,加入浓
第二十三章 过渡元素

从Ti到Mn的最高氧化态往往只在氧化物、氟
化物或氯化物中遇到,随后出现低氧化态。
4. 同一元素氧化态的变化是连续的。
5. 第一过渡系列后半部的元素(V,Cr, Mn,Fe,Co)能出现零氧化态,它们与不带
电的中性分子配位体形成羰基配合物。
二、最高氧化态氧化物水合氧化物的酸碱性
同种元素,不同氧化态的氧化物,其酸碱
性随氧化数的降低酸性减弱,碱性增强。 Mn2O7 MnO3 MnO2 Mn2O3 MnO
强酸性
酸性
两性
弱碱性
碱性
这是由于其水合物中非羟基氧的数 目减少。
同一过渡系内各元素的最高氧化态的氧 化物及水合物,从左到右碱性减弱,酸性增 强。 Sc2O3 TiO2 CrO3 Mn2O7 强碱 两性 酸性 强酸 同族元素,自上而下各元素相同氧化态 的氧化物及其水合物,通常是酸性减弱,碱 性增强。 H2CrO4 H2MoO4 H2WO4 中强酸 弱酸 两性偏酸性
第一 过渡 分类方法:(1)所有的副族元素都是过渡元 系元 素 素,即从ⅢB钪开始,到ⅡB锌分族为止共 30
第二十三章 过渡元素
VIII IIIB IVB VB VIB VIIB 个元素 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 第二 (不包括镧系和锕系)。 钪 钛 钒 铬 锰 铁 钴 镍 过渡 系元 41 42 43 44 45 39 Y Tc Ru Rh 46 Pd 素 (40 2)仅指Ⅷ族的铁系、铂系九个元素。 Zr Nb Mo
铌 B钪开始,到Ⅷ铁系、铂系为 钼 锝 钌 铑 钯 钇(3 锆 )从Ⅲ 57-71 72 Hf 73 Ta 74 W 75Re 76 Os 77 Ir 78 Pt 止,因为这些元素在原子结构上具有共同特 第三 Lu La 锇 铪 钽 钨 铱 铂 过渡 铼 点,即具有未填满的d电子,所以这些元素又
元素周期表中的过渡族元素探索

元素周期表中的过渡族元素探索元素周期表是化学家们的宝库,其中的过渡族元素更是引人注目。
这些元素位于周期表的中间区域,从第三周期的钒元素开始,一直延伸到第十一周期的铍元素。
过渡族元素具有许多独特的性质和应用,让我们一同来探索它们的奥秘。
1. 钒(V)钒是周期表中的第23号元素,它的特殊之处在于它可以在多个氧化态之间转变。
钒的化合物在催化剂、合金和电池中有着广泛的应用。
例如,钒可以用作锂离子电池的正极材料,提高电池的能量密度和循环寿命。
此外,钒催化剂在化学合成中也扮演着重要的角色,促进反应速率和选择性。
2. 铬(Cr)铬是周期表中的第24号元素,它以其耐腐蚀性和光亮的外观而闻名。
铬被广泛应用于不锈钢、合金和电镀等领域。
不锈钢中的铬可以增加材料的抗腐蚀性能,使其在恶劣环境下仍能保持良好的外观和性能。
此外,铬也被用于电镀,通过在金属表面形成一层铬膜,提高材料的硬度和耐磨性。
3. 锰(Mn)锰是周期表中的第25号元素,它是一种重要的微量元素,对生物体的正常生长和发育至关重要。
锰参与多种酶的催化反应,如超氧化物歧化酶和乳酸脱氢酶。
此外,锰也被用作钢铁制造中的合金添加剂,可以提高钢材的强度和韧性。
4. 铁(Fe)铁是周期表中的第26号元素,是地球上最常见的金属之一。
铁具有良好的导电性和磁性,因此被广泛应用于电子设备和磁性材料中。
铁也是人体中的重要元素,是血红蛋白和肌红蛋白的组成部分,负责输送氧气和储存氧气。
此外,铁也被用于建筑和制造业,如钢铁和铁路轨道的制造。
5. 钴(Co)钴是周期表中的第27号元素,它是一种重要的过渡金属。
钴的化合物常用于催化剂、电池和磁性材料中。
例如,钴氧化物可以用作锂离子电池的正极材料,提高电池的能量密度和循环寿命。
此外,钴也被用于制造高强度的磁性材料,如钴磁体和磁性合金。
6. 镍(Ni)镍是周期表中的第28号元素,它是一种重要的合金添加剂。
镍合金具有良好的耐腐蚀性和高温强度,因此被广泛应用于航空航天、化工和能源领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Na2TiO3+2H2SO4(浓)= TiOSO4+Na2SO4+2H2O
TiO2++H2O2=[TiO(H2O2)]2+
2.钛(Ⅲ)化合物的生成和还原性
在盛有 0.5mL 硫酸氧钛的溶液(用液体四氯化钛 和1mol· L-1(NH4)2SO4按1﹕1的比例配成硫酸钛溶液) 中,加入两个锌粒,观察颜色的变化,把溶液放置 几分钟后,滴入几滴0.2 mol· L-1CuCl2溶液,观察现 象。由上述现象说明钛(Ⅲ)的还原性。 反应方程式如下:
[VO2(O2)2]3++6H+→[V(O2)]3+
现象:生成红棕色[V(O2)]3+。 总结:NH4VO3在强酸性介质中,加入H2O2,生 成过氧钒[V(O2)]3+阳离子,该离子为红 棕色。
4.钒酸盐的缩合反应 (1)取四支试管,分别加入10mLpH分别为14,3,2和1(用 0.1 mol· L-1NaOH溶液和0.1 mol· L-1盐酸配制)的水溶液, 再向每支试管加入0.1g偏钒酸铵固体(约一角勺尖)。振 荡试管使之溶解,观察现象并加以解释。 现象:
V5+→V4+→V3+→V2+ ,其颜色变化为黄→兰→绿→ 紫。 3.过氧钒阳离子的生成 在盛有0.5mL饱和偏钒酸铵溶液的试管中,加 入0.5mL2 mol· L-1HCl溶液和2滴3%H2O2溶液,观察 并记录产物的颜色和状态。
反应方程式如下: VO3-+H2O2=[VO2(O2)2]3++H2O
实验:
第一过渡系元素(一)(钛、钒、铬、锰)
[实验目的]
1、掌握钛、钒、铬、锰主要氧化 态的化合物的重要性质及各氧
化态之间相互转化的条件。 2、练习沙浴加热操作。
[实验用品]见教材P179。
[基本操作]:
沙浴加热,参见第三章三。
[实验内容]
一、钛的化合物的重要性质
1、二氧化钛的性质和过氧钛酸根的生成
反应方程式如下:
2VO4-+2H+=V2O74-+H2O
3 V2O74-+6H+=2V3O93-+3H2O
依pH值的降低,溶液颜色由黄变红,不断加深。
总结:
向钒酸盐溶液中加酸,pH值逐渐下降,则生成不同缩合度的多钒 酸盐,随着pH值的下降,多钒根中含钒原子越多,缩合度越大。缩合 度增大,溶液的颜色逐渐加深,即由淡黄色变到深红,溶液转为酸性 后,缩合度不再改变,而是获得质子的反应。
2VO43-+2H+=2HVO42-=V2O74-+H2O 3V2O74-+6H+=2V3O93-+3H2O pH≧8.4 10V3O93-+12H+=3[V10O28]6-+6H2O 8﹥pH﹥3
此后不再缩合,加酸
pH≧13
[V10O28]6-+H+=[HV10O28]5[HV10O28]5-+H+=[H2V10O28]4pH=2时,有V2O5水合物的红棕色沉淀析出 pH=1时,[H2V10O28]4-+14H+=10VO2++8H2O
(2)将pH为1的试管放入热水浴中,向试管内缓慢滴 加0.1 mol· L-1NaOH溶液并振荡试管。观察颜色变化, 记录该颜色下溶液的pH。 反应方程式如下:
在试管中加入米粒大小的二氧化钛粉末,然后加 入2mL浓H2SO4,再加入几粒沸石,摇动试管至近沸 (注意防止浓硫酸溅出),观察试管的变化。冷却 静置后,取0.5mL溶液,滴入1滴3%的H2O2,观察现 象。
反应方程式如下: TiO2+2H2SO4(浓)=Ti(SO4)2+2H2O
Ti(SO4)2易水解,实际得到TiOSO4白色粉末
在第一份固体中,假如1 mL浓 H2SO4 振荡,
放置。观察溶液颜色,固体是否溶解?在第二份
固体中,加入6 mol· L-1NaOH溶液加热却后,用pH试纸测定溶液的pH 。在第四份固体中,加入浓
盐酸,观察有何变化。微沸,检验气体产物,加入少量蒸馏
2 .低价钒的化合物的生成
在盛有1mL氯化氧钒溶液(在1g偏钒酸铵固体中,
加入 20mL6 mol· L-1 HCl 溶液和 10mL 蒸馏水)的试
管中,加入2粒锌粒,放置片刻,观察并记录反应
过程中溶液颜色的变化,并加以解释。
反应方程式如下:
VO2++Zn+2H+=V2++Zn2++H2O
总结:V5+或V4+具有氧化性,V5+离子被还原,依次为
TiO2++H2O2=[TiO(H2O2)]2+
总结:
得到TiOSO4产物,该物质与H2O2反应,
生成[TiO(H2O2)]2+桔黄色溶液,该反应用于 钛的定性检验。
另取少量二氧化钛固体,注入 2mL40%NaOH 溶液,加热。静置后,取上 层清液,小心滴入浓硫酸至溶液呈酸性, 滴入几滴3%H2O2,检验二氧化钛是否溶解。
[H2V10O28]4-+14H+=10VO2++8H2O
加NaOH平衡向左移动
现象:溶液由黄色(NO2+)变为红棕色 ([H2V10O28]4-),溶液的pH值为2。
(3)将pH为14的试管放入热水浴中,向试管内缓慢滴 加0.1 mol· L-1盐酸,并振荡试管。观察颜色变化,
记录该颜色下溶液的pH。
TiOSO4+Zn=Ti2(SO4)3+ZnSO4 Ti3++Cu2++2Cl-+2H2O=2CuCl↓+2TiO2++4H+ 总结: 三价钛具有还原性,产生为白色的CuCl沉淀。
二、钒的化合物的重要性质
1、 取 0.5 偏钒酸铵固体放入蒸发皿中,在沙浴
上加热,并不断搅拌,观察并记录反应过程中固
体颜色的变化,然后把产物分成四份。
水,观察溶液颜色。 反应方程式如下:
2NH4VO3=V2O5+2NH3+H2O
(1)加浓硫酸,溶解, V2O5+2H+=2VO2++H2O (2)加NaOH,V2O5+6NaOH=2Na3VO4(淡黄色)+3H2O (3)pH﹤7 (4)V2O5+6HCl=2VoCl2+Cl2↑+3H2O
总结:
NH4VO3受热分解,生成V2O5,由橙红色固体→深 红色→橙黄色→橙色;(1)V2O5溶于酸(2) V2O5 溶于碱(3)V2O5溶于两性偏酸(4)具有活氧化 性,还原为VoCl2,兰色,放出Cl2。
