专题复习金属与盐溶液反应共28页
2023年中考化学复习微专题金属与盐溶液反应

中考复习微专题金属与盐溶液反应考点1 滤液、滤渣成分的判断例1.将铁粉和铜粉置于AgNO3和Zn(NO3)2混合溶液中,待反应完毕后,过滤得滤液和滤渣,下列说法错误的是()A.滤渣一定有Ag,可能有ZnB.滤液最少有两种金属阳离子C.滤渣中加酸,可能有气泡D.滤渣中加酸,可能无气泡例2.在CuSO4和FeSO4的混合溶液中加入一定量的镁粉,下列说法正确的是()A.若镁粉无剩余,且滤液为蓝色,则滤液中一定含有MgSO4、FeSO4B.若镁粉无剩余,且滤液为无色,则滤液中一定含有MgSO4、FeSO4C.若镁粉有剩余,则滤液中一定含有MgSO4,可能含有FeSO4,不含CuSO4D.若镁粉有剩余,则滤液中一定含有MgSO4、FeSO4,不含CuSO4考点2 滤液、滤渣质量的判断例3.向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒。
下图是反应过程中氯化亚铁的质量变化情况。
(1)B点时,反应的化学方程式是________。
(2)B点时,溶液中的溶质有________。
(3)C点与A点相比。
溶液质量增加的原因是________。
例4.某化学小组的同学将单质锌和单质银的混合物ag 加入到一定量的Cu(NO3)2溶液中,充分反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,在滤渣中加入稀盐酸,有气泡冒出。
下列有关说法中,不合理的是()A.滤液一定是无色溶液B.滤液中一定含有Zn2+C.滤渣的质量一定大于agD.滤渣中一定含有单质银、单质铜和单质锌考点3 根据计算推断金属混合物的组成试卷第1页,共8页试卷第2页,共8页例5.向200gAgNO 3溶液中加入m 克Fe 和Cu 的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得16.2固体。
向滤液中滴加NaCl 溶液,产生白色沉淀。
下列说法正确的是( )A .滤液的质量是183.8gB .混合粉末的质量范围是4.2g<m <4.8gC .固体中加入稀盐酸可能会有气体生成D .原AgNO 3溶液的溶质质量分数是12.75%巩固训练:1.向一定质量的AgNO 3、Cu (NO 3)2和Mg (NO 3)2的混合溶液中加入一定质量铁粉,充分反应后过滤,得滤液M 和滤渣N 。
专题复习金属与盐溶液反应 PPT

发生: Zn+2AgNO3=Zn(NO3)2 +2Ag 溶液A中为:Zn(NO3)2 Cu(NO3)2 固体B中为:Ag
答案:
3、加入得Zn把Ag置换出来,又置换部分Cu
发生: 先 Zn+2AgNO3=Zn(NO3)2 +2Ag 后 Zn+Cu(NO3)2 = Zn(NO3)2 +Cu
解题关键: 1、活动性强得金属能置换出活动性弱的 金属; 2、加入金属得量,瞧清少量、过 量、一定量、恰好反应等关键词
例题2
某化学小组将过量Zn加入AgNO3与Cu(NO3)2混合溶 液进行了如图实验,
混合溶液
Zn,过滤
讨论:
溶液A
固体B
对溶液A与固体B得成分进行分析 溶液A______固体B______.
【提出问题】溶液A中得溶质可能有哪些?
【做出猜想】①只有Zn(NO3)2 ③Zn(NO3)2、Cu(NO3)2
【交流讨论】不合理的猜想就是
②Zn(NO3)2、AgNO3 ④Zn(NO3)2、Cu(NO3)2、AgNO3
(填标号),其理由是
.[来源:
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写
完整.
(2013、河南.9)(1分)
探究金属活动性顺序时,将锌粒
放入硫酸铜溶液中,锌粒表面有紫红
色物质析出,还有无色无味气体产生
得“异常”现象。推测该气体可能就
是
()
A.氢气
B.二氧化硫
C.二氧化碳
பைடு நூலகம்
D.一氧化碳
(2013、河南.20)(4分) 某化学小组用一定量AgNO3与
九年级化学中考专题:金属与盐溶液反应

离子有
;反应后溶液的质量比原混合溶液
(填“大”或“小”);有关反应的化学方程式为
(写出一个即可)。
一种金属与多种盐溶液反应的解题思路:
1.按金属活动性由强到弱顺序排列金属; 2.金属与最不活泼金属的盐溶液优先反应; 3.反应混合物过滤后,滤渣中一定有最不 活泼的金属单质,滤液中一定有最活泼的 金属离子;
引题2
向一定量的Cu(NO3)2溶液中加入一定量的Zn, 充分反应后向滤渣中滴加稀硫酸,有气体生成 如图
CuC(Nu(ON3O)23溶)2液
Zn,过滤
溶液A
固体B
对分溶析液溶A液和A固及体固B体的B成中分成进分行了分析和研 究溶.液A —— 固体B——
小结:
金属+盐溶液→ 新 盐溶液+新金属
解题关键: 1.金属活动性顺序 2.注意加入金属的量
题型2 几种金属与一种盐溶液反应的规律
向AgNO3溶液中加入一定质量Fe和Al,充分反应后
过滤,得到滤渣和浅绿色滤液。下列说法正确的
是( D ) A. 滤液中一定含有Al3+、Ag+ B. 滤液中一定含有Fe2+、Ag+ C. 滤渣中一定含有Fe D. 滤渣中一定含有Ag
变式训练 某化学小组用一定量AgNO3和Al(NO3)3的
题型1 一种金属与多种盐溶液反应
向一定量的AgNO3和Cu(NO3)2混合溶液中加入一定量 的Zn,充分反应后向滤渣中滴加稀硫酸,有气体生成 如图
讨论:
混合溶液
Zn,过滤
溶液A 固体B
对溶液A和固体B的成分进行分析 溶液A______固体B______.
题型1 一种金属与多种盐溶液反应
向一定量的AgNO3和Cu(NO3)2混合溶液中加入一定量 的Zn,充分反应后向滤渣中滴加稀硫酸,有气体生成 如图
金属与盐溶液反应规律的解析一ppt课件.pptx

序号 ①
②
③
④
⑤
滤渣 Ag
Ag
滤液 中的 溶质
Zn(NO3)2
Fe(NO3)2 Cu(NO3)2 AgNO3
Zn(NO3)2
Fe(NO3)2
Cu(3)2
Ag Cu Ag Cu Ag Cu Fe
Zn(NO3)2
Fe(NO3)2
Cu(NO3)2
Zn(NO3)2
Fe(NO3)2
Zn(NO3)2
Fe(NO3)2
A.取a点溶液,滴加稀盐酸,无白色沉淀
B.图标上b~c段质量增加的原因是Zn与Cu(NO3)2溶 液反应
C. b点时溶液中金属离子有Zn2+、Cu2+,金属单质 有Zn、Cu、Ag
D. c点和d点溶质种类不同,金属单质种类也不同
通过本节的学习你收获了什么? 还有什么困惑?
真题剖析,寻找规律
例C充u1分(N.(反O31应)52的•后衡混滤过有阳合滤渣)H溶前。中在液向金A一中g滤属N定加O渣3入、中一Z加n定(入N量O稀3的)盐2 铁和酸粉,,
有气泡产生。根据上述现象,下列结论正 确的是( C )
A. 滤渣中一定有Zn B. 滤渣中可能有Ag、Cu C. 滤液中一定有Fe(NO3)2、Zn(NO3)2 D. 滤液中可能有AgNO3、Cu(NO3)2
一种金属与多种盐溶液反应的解题思路:
1.按金属活动性由强到弱顺序排列金属; 2.金属与最不活泼金属的盐溶液优先反应; 3.反应混合物过滤后,滤渣中一定有最不 活泼的金属单质,滤液中一定有最活泼的 金属离子;
4. 滤渣与滤液中的物质不能发生反应。
变式训练,拓展思维
变式2. 在AgNO3、Zn(NO3)2 和Cu(NO3)2的混 合溶液中加入一定量的铁 锌粉 ,充分反应后过 滤。向滤渣中加入稀盐酸,无气泡产生。根 据上述现象,则滤渣中一定有___________ , 可能有____________ ;滤液中一定有 ___________,可能有___________。
金属及盐溶液的置换反应 初三专题复习

专题金属及盐溶液的置换反应姓名_______【基础知识】1、写出金属活动性顺序表:活动顺序依次减弱2.金属活动性顺序表的应用:(1)在金属活动性顺序表里,金属的位置越靠前,它的活动性就越____。
(2)在金属活动性顺序表里,位于氢前面的金属能置换酸中的________。
(3)活动性较_____的金属可以将活动性较_____的金属从其盐溶液中置换出来。
例:Cu、Fe同时投入AgNO3 中,____先与AgNO3反应。
Fe投入Cu(NO3)2、AgNO3 混合液中,____先与Fe反应。
【巩固练习】一、选择题1.在以下四种金属中,有一种金属元素形成的化合物的溶液与其他三种金属单质都能发生置换反应,这种金属是()A.Fe B.Cu C.Zn D.Ag将过量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后过滤,滤出剩余的铁和生成的铜,在滤液里含有的物质是()A. FeSO4 B.CuSO4 C.Fe2(SO4)3 D.H2SO43.向含Cu(NO3)2和AgNO3的混合溶液中加入一定量的铁粉充分反应,发现有少量金属析出,过滤后向滤液中滴加稀盐酸,有白色沉淀生成。
则析出的金属是( )A.有Cu和Ag B.只有Ag C.只有Cu D.无法判断4.铁片分别投入下列溶液中,溶液质量增大的是()A.硫酸B.硫酸铜C.硫酸锌D.硫酸镁5.往氧化铜和铁粉的混合物中,加入一定量的稀硫酸并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后取出铁钉,发现铁钉并无任何变化.根据上述的变化,你认为结论正确的是()A.不溶物一定是铜B.不溶物中一定含铜,也可能含铁C.滤液中一定有硫酸,可能有硫酸铜D.滤液中一定有硫酸亚铁,可能有硫酸和硫酸铜6.一定质量的Cu(NO3)2和AgNO3的混合液中加入Zn,溶液质量与加入Zn的质量关系如图。
下列说法正确的是()A.取a点溶液,滴加盐酸,无白色沉淀。
B.c点溶液中只有硝酸锌C.取b~c段固体,滴加稀盐酸,有气泡。
2022年中考化学专题复习——金属与酸金属与盐溶液的反应(word版有答案)
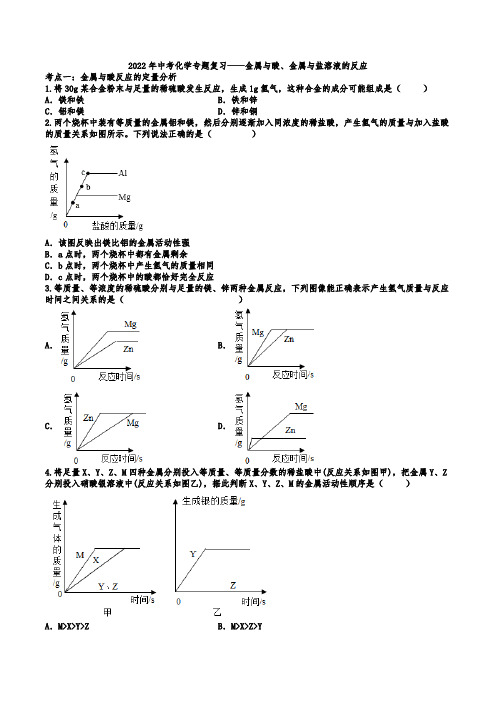
2022年中考化学专题复习——金属与酸、金属与盐溶液的反应考点一:金属与酸反应的定量分析1.将30g某合金粉末与足量的稀硫酸发生反应,生成1g氢气,这种合金的成分可能组成是()A.镁和铁B.铁和锌C.铝和镁D.锌和铜2.两个烧杯中装有等质量的金属铝和镁,然后分别逐渐加入同浓度的稀盐酸,产生氢气的质量与加入盐酸的质量关系如图所示。
下列说法正确的是()A.该图反映出镁比铝的金属活动性强B.a点时,两个烧杯中都有金属剩余C.b点时,两个烧杯中产生氢气的质量相同D.c点时,两个烧杯中的酸都恰好完全反应3.等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是()A.B.C.D.4.将足量X、Y、Z、M四种金属分别投入等质量、等质量分数的稀盐酸中(反应关系如图甲),把金属Y、Z 分别投入硝酸银溶液中(反应关系如图乙),据此判断X、Y、Z、M的金属活动性顺序是()A.M>X>Y>Z B.M>X>Z>YC.X>M>Z>Y D.X>M>Y>Z5.将足量X、Y、Z、M四种金属分别投入等质量、等质量分数的稀盐酸中(反应关系如图甲),把金属Y、Z 分别投入硝酸银溶液中(反应关系如图乙),据此判断X、Y、Z、M的金属活动性顺序是()A.M>X>Y>Z B.M>X>Z>YC.X>M>Z>Y D.X>M>Y>Z4.现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。
则下列说法中不正确的是()A.生成氢气的质量:甲>乙>丙B.相对原子质量:乙>丙>甲C.金属活动性:乙>甲>丙D.消耗硫酸的质量:甲>乙>丙5.质量相同质量分数相同的稀H2SO4与足量Mg、Al、Zn、Fe充分反应,生成氢气质量与金属质量的关系如图所示,分析图像信息,得出结论正确的是()A.四种金属都能与酸反应生成H2B.四种金属的活动性顺序:Al>Mg>Fe>ZnC.相同质量的四种金属与稀H2SO4反应,消耗酸的质量相等D.相同质量的四种金属与足量稀H2SO4反应氢气质量:Zn>Fe>Mg>Al考点二:金属活动性顺序的判断1.下列有关事实不能用金属活动性顺序解释的是()A.铁能将铜从硫酸铜溶液中置换出来B.相同条件下,镁和锌与稀盐酸反应的剧烈程度C.不能用金属铜与稀硫酸反应制取氢气D.铝制品抗腐蚀能力比铁制品强2.现有X、Y、Z三种金属单质如果把X和Y分别放入稀硫酸中,Y溶解并产生氢气,X不反应;又把X和Z 分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。
专题复习 金属与酸、盐溶液反应的图像分析

( B)
6.下列图像中有关量的变化趋势与对应叙述关系正确的是( D )
A.向一定量的铁粉和铜粉的混合物中加入足量稀盐酸 B.向一定量的稀硫酸中加入铁粉至过量 C.向一定量的硫酸铜溶液中不断加入锌粉 D.向铁片(足量)中加入一定量的硫酸铜溶液
7.下列图像与对应叙述不相符的是( B )
A.将等质量的镁片和锌片分别加入溶质质量分数相同的足量稀硫酸中 B.分别向等质量且足量的锌中加入等质量、不同浓度的稀硫酸 C.向等质量、等质量分数的稀硫酸中分别加入铁粉和锌粉至过量 D.铁和硝酸银溶液反应
氢气的质量与反应时间的关系如图。关于甲、乙两金属判断
合理的
(C )
A.铁、镁 C.铁、锌
B.锌、铁 D.锌、镁
4.取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸。 加入稀盐酸的质量与有关量的变化关系图错误的是 ( B )
5.向一定质量AgNO3和Cu(NO3)2的混合溶液中逐渐加入足量
的锌粒,下列图像不能正确反映对应关系的是
注意 从上述两个图中不能判断金属的活动性强弱!
二、金属与盐溶液的反应图像
图1
图2
金属与盐溶液反应后溶液及固体质量的变化与两种金属的相对原子质量和化学计量数有关。
举例:
固体+ 溶液 —→溶液 + 固体
2Al + 3CuCl2═══2AlCl3+ 3Cu
54
405
267
192
反应后溶液质量减小,变化趋势如图1所示,固体质量增大,变化
等量金属,足量酸 (等金不等氢)
足量金属,等量酸 (等酸等氢)
图像
酸足量,生成氢气的质量由参加反应的金属的质量决定,由化学方
分
反应后金属的化合价
析 程式可知,生成氢气的质量=金属的质量×金属的相对原子质量;
金属与盐溶液间的置换反应专题复习

解析金属与盐溶液间的置换反应专题复习金属与盐溶液混合后能否发生置换反应的判断、分析是初中化学的难点,学生在解决此类问题时很容易出错,其实,解决这类题目是有规律的;一、理解内涵金属活动性顺序的内容:我们已经知道:金属与盐溶液间的置换反应是较活泼的金属可置换较不活泼的金属;盐类必须溶于水,故只有可溶性盐的水溶液才会与金属反应;根据金属活动性顺序,只有排在前面的金属才能把排在后面的金属从它的盐溶液中置换出来,也就是说:前面的金属单质与后面的金属离子不能共存于溶液中,常见反应有:Cu+2AgNO3=2Ag+CuNO32Fe+CuSO4=FeSO4+Cu值得注意的是极活泼的金属钾、钠、钡、钙等常温下与水剧烈反应,因此它们不能置换出盐溶液中的金属;例如,金属钠与硫酸铜溶液反应时,钠首先与水反应生成氢气和氢氧化钠,然后氢氧化钠又与硫酸铜发生复分解反应:2Na+2H2O+CuSO4 = Na2SO4+CuOH2↓+H2↑2NaOH + CuSO4 = Na2SO4+CuOH2↓二、熟记条件金属与盐溶液发生置换反应的条件是:1金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;2特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;3盐必须溶于水;4铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时要用+2价的亚铁盐;三、灵活运用在实际的应用中我们会发现在金属与盐溶液反应中,包括了这样2类反应.1.多种金属与一种盐溶液反应;2.一种金属与多种盐溶液反应;但是无论其中哪一种反应,都遵循这样一条规律:金属活动性相差越大,它们间的置换反应越易发生;1、一种金属与多种盐溶液反应例题1:在KNO3、CuNO32、AgNO3的混合溶液中,加入一定量的Zn粉,充分反应后过滤,得到滤液和滤渣,则滤液中一定有 ,一定没有 ,可能有;滤渣中一定有 ,一定没有 ,可能有 ;分析:首先把几种金属按金属活动性由强到弱顺序排列:K、Zn、Cu、Ag,锌粉先置换金属活动性最弱的金属,即Ag,只有把它全部置换出来以后才能置换第二弱的金属,依次类推;因此,金属活动性越弱的金属越先存在于滤纸上,金属活动性越强的金属越先保存在滤液中;而Zn的活动性弱于K,所以不会有K被置换出来,故在滤液中只要有AgNO3存在就一定会存在KNO3、ZnNO32、CuNO32;则:滤液中一定有 KNO3 ZnNO32 ,一定没有 \ ,可能有CuNO32、AgNO3;滤渣中一定有 Ag ,一定没有 K ,可能有 Cu、Zn ;在实际的应用中我们可分别取滤渣或滤液进行实验,来推断其成分,具体情况如下:①滤渣+盐酸产生气泡滤液中:一定有:KNO3 ZnNO32可能有: \ 一定无:CuNO32、AgNO3滤渣中:一定有:Zn、Cu、Ag 可能有: \ 一定无:K②滤渣+盐酸不产生气泡滤液中:一定有:KNO3 ZnNO32可能有:CuNO32、AgNO3一定无:\滤渣中:一定有: Ag 可能有: Cu 一定无:K 、 Zn③滤渣+盐酸产生沉淀滤液中:一定有:KNO3、ZnNO32、CuNO32、AgNO3可能有: \ 一定无:\滤渣中:一定有: Ag 可能有: \ 一定无:K、Zn、Cu④滤渣+盐酸无沉淀滤液中:一定有:KNO3、ZnNO32可能有:CuNO32一定无:AgNO3滤渣中:一定有: Ag 可能有: Cu 一定无:K 、Zn⑤滤液为蓝色滤液中:一定有:KNO3、ZnNO32、CuNO32、可能有:AgNO3 一定无:\3滤渣中:一定有: Ag 可能有: Cu 一定无:K、Zn、⑥滤液为无色滤液中:一定有:KNO3、ZnNO32可能有: \ 一定无:CuNO32、 AgNO3滤渣中:一定有: Ag 、Cu 可能有: Zn 一定无:K2、多种金属与一种盐反例题2:实验课上,老师把一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液;老师让同学们对滤液的组成进行探究;1同学们对滤液中所含的溶质做出了多种猜想,其中有两种猜想可能成立,这两种猜想是:①溶质为________________;②溶质为________________;2请你设计实验来验证这两种猜想;分析:将Zn、Cu放入AgNO3溶液中后, Zn、Cu 的金属活动性均强于Ag而Zn的活动性最强,故一定存在的反应是Zn+2AgNO3=2Ag+ZnNO32故所以反应后的溶液中一定含有ZnNO32;可能存在的反应是Zn+CuNO3 2=Cu+ZnNO32和Cu +2AgNO3=2Ag+CuNO32;而反应后的溶液为蓝色,故在溶液中还一定含有CuNO32,溶液中是否含有AgNO3无法确定;所以滤液中所含的溶质只有下面两种可能:①溶质为_ ZnNO32_、CuNO3 2____________;②溶质为ZnNO32 、CuNO3 2 、AgNO3 ;只要我们验证滤液中是否有AgNO3,就能验证这两种猜想,鉴别的方法有多种,我们常用的是:取待测溶液与试管中,滴加稀盐酸若有白色沉淀生成,则为②,若无明显变化,则为① ;四:形成规律经过以上讨论我们可以看出:金属活动性相差越大,金属与盐溶液间的置换反应就越易发生;不同金属与盐溶液反应时,活动性强的金属先与盐溶液反应;同一金属与不同的盐溶液反应时,该金属先与活动性较弱的金属所组成的盐反应,也就是说:金属在和盐溶液反应时,总是最先置换活动性最弱的金属离子,因此在过滤后所得的滤渣中一定含有最不活泼的金属,而在滤液中,一定会存在最活泼金属的离子 ;金属与盐溶液的优先置换原理若某一溶液中同时含有多种金属离子,则加入一种金属时,优先置换出金属活动性弱的金属的离子;〖例1〗、在盛有AgNO3和CuNO32混合溶液的试管中,加入一定量的锌粉充分反应,试管底部有少量固体存在;过滤,向滤液中加稀盐酸,产生白色沉淀,滤渣是A. CuB. AgC. Zn和AgD. Zn和Cu分析:由于金属的金属活动性顺序是Cu>Ag,因而加入的锌粉优先与AgNO3反应,只有AgNO3完全反应后,锌粉才能与CuNO32反应,否则不反应;“向滤液中加稀盐酸,产生白色沉淀”说明溶液中的AgNO3尚未反应完,故CuNO32不可能反应,证明锌量不足,所以滤渣的成分应选B;〖例2〗、向含AgNO3、CuNO32、ZnNO32的混合液中,加入一些铁粉,待反应完成后过滤,下列情况是可能存在的是A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+B.滤纸上有Ag 、Cu,滤液中有Ag+、Zn2+、Fe2+C.滤纸上有Ag、Fe,滤液中有Zn2+、Fe2+D.滤纸上有Ag、Zn、Fe,滤液中有Zn2+、Fe2+分析:铁粉加入混合液中,可能发生的反应有:Fe+2AgNO3=FeNO32+2Ag ①;Fe+2CuNO32=FeNO32+Cu ②,根据溶液中的优先置换原理,反应①优先于反应②进行;因此,A选项中,滤液中有Ag+证明反应①未完成,自然反应②还未进行,正确;B选项中,滤纸上已经有Cu,说明反应②已经发生或已经完全发生,则反应①应完全反应,滤液中不可能有Ag+,不正确;C选项中,滤纸上有Fe,说明反应①②都已完全,但滤纸上没有Cu,不正确;D选项中,滤纸上由Zn,不正确;练习1.将铁粉加到一定量的AgNO3 、CuNO32的混合溶液中,等充分反应后过滤,向滤渣中加入稀盐酸,没有气体产生;则滤渣含有的物质可能是A、铜B、银C、铜和银D、铁、铜、银2.05青岛某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生;则下列有关说法中,正确的是A.滤出的固体中一定含有银和铜,一定不含铁B.滤出的固体中一定含有银,可能含有铜和铁C.滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜D.滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜3.向含AgNO3、CuNO32、MgNO32混合液中,加入一定量的锌粒,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体中一定有、Cu、Mg、Mg、Zn 、Cu、Zn、Mg、Zn4.向含AgNO3、CuNO32混合液中,加入一定量的锌粒,充分反应后过滤,向滤液中加稀盐酸,产生白色沉淀;则滤液中的离子有++ Zn2++ Zn2++ Cu2+ Zn2+5、2014、十堰市中考某化学小组用一定量AgNO3和AlNO33的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:①溶液甲中一定含有AlNO33和ZnNO32②固体乙中一定含有Ag,可能含有Cu和Zn③若溶液甲是蓝色,则溶液甲一定含有AlNO33、ZnNO32和CuNO32④向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和CuNO32;上述四种说法正确的个数为个个个个6、2013、十堰市中考.将下列各组中的物质放入烧杯中,加适量水搅拌,待充分反应后过滤,在滤纸上留下两种金属的是A.Zn、NaCl、CuCl2过量 B.Fe过量、Cu NO32、AgNO3C.Fe过量、KNO3、CuSO4 D.Cu过量、FeCl2、HCl7、2013、十堰市中考资料获悉铁在高温条件下与氧化铜反应:2Fe+3CuO Fe2O3+3Cu铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液表示为“甲”于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙.下列判断正确的是①甲中不含FeCl3;②甲中含有FeCl3;③若向固体丙加稀盐酸无明显现象,则滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2;A.①③B.②③C.①④D.②④8、思考、讨论、完成表中各项内容1 在AgNO3和CuNO32的混合物中加入一定量的铁粉,充分反应后过滤:①若在滤液中加入稀盐酸出现白色沉淀;则滤液中一定有__________ ___; 滤纸上一定含有______________;②若在滤液中加入稀HCl无任何现象;则滤纸上一定含有___________;可能含有___________________;③若在滤液中插入铁片,取出后无任何变化;则滤纸上一定有_________;可能有________________;④若将滤纸上的固体放入稀HCl中,生成无色可燃性气体;则滤液中一定有___________ _; 滤纸的物质一定是___________;铁粉的量溶液中的溶质固体中的物质一点多点再多点再多点再多点9.小明同学做了金属与盐溶液反应的实验探究,他向AgNO 3、CuNO 32混合溶液中加入一些铁粉,完全反应后过滤,请你帮助分析下列情况不可能存在的是A 滤纸上有Ag 、Fe 、Cu,滤液中有FeNO 32B.滤纸上有Ag 、Cu,滤液中有CuNO 32、FeNO 32C.滤纸上有Ag 、Cu 、Fe,滤液中有Ag NO 3 、CuNO 32D.滤纸上有Ag,滤液中有Ag NO 3 、CuNO 32、FeNO 3210.向AgNO 3、CuNO 32和MgNO 32的混合溶液中加入一些锌粉,完全反应后过滤;下列说法正确的是A .滤纸上一定有Ag 和CuB .滤纸上一定有Ag,可能有Cu 、Zn 和MgC .滤液中可能含有Zn 2+、Mg 2+D .滤液中一定有Zn 2+、Mg 2+,可能含有Ag +、Cu 2+11.把足量的铁粉分别加入到含有下列各组物质的溶液中,充分反应后过滤,滤液中只有一种溶质的是A .H 2SO 4、ZnSO 4B .HCl 、CuCl 2C .ZnSO 4、CuSO 4D .KNO 3、HgNO 3212.印刷铜制电路板的“腐蚀液”为FeCl 3溶液;已知铜、铁均能与FeCl 3溶液反应,反应方程式分别为:Cu+2FeCl 3=2FeCl 2+CuCl 2 ,Fe+2FeCl 3=3FeCl 2 ,现将一包铜、铁的混合粉末加入到盛有FeCl 3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是A.若溶液中含FeCl 3,则固体一定含有铁和铜B.若溶液中含FeCl 2和CuCl 2, 则固体一定含铁C .若溶液中只含FeCl 2, 则固体一定含铜可能含铁D.若溶液中只含FeCl 2, 则固体一定有铁,可能有铜13. 在CuO 和Fe 的混合物中,加入一定量的稀H 2SO 4并微热;当反应停止后,滤出不溶物,再向滤液中放入一粗铁丝,片刻后取出铁丝,发现粗铁丝无任何变化;据此,你认为下列结论正确的是提示CuO+H 2SO 4=CuSO 4+H 2OA.不溶物一定是铜B.不溶物中一定含有铜,也可能含有铁C.滤液中一定含有H 2SO 4,也可能含有CuSO 4D.滤液中一定含有FeSO 4,也可能含有CuSO 4 和H 2SO 4 14.向AgNO 3、CuNO 32、ZnNO 32的混合溶液中加入一些铁粉,反应完成后过滤,下列情况不可能...存在的是A .滤纸上有Ag 、Cu 、Fe,滤液中有Zn 2+、Fe 2+B .滤纸上有Ag 、Cu,滤液中有Zn 2+、Fe 2+C .滤纸上有Ag 、Cu,滤液中有Cu 2+、Zn 2+、Fe 2+D .滤纸上有Ag 、Cu 、Fe,滤液中有Cu 2+、Zn 2+、Fe 2+ 三讨论1:在AgNO 3和CuNO 32、KNO 3的混合溶液中加入一定量的铁粉,充分反应后过滤,会出现哪几种情况2:在AgNO 3和CuNO 32、FeNO 32、KNO 3的混合溶液中加入一定量的锌粉,充分反应后过滤,会出现哪几种情况四作业:1.向AgNO3、CuNO32、ZnNO32的混合溶液中加入一些铁粉,反应完成后过滤,下列情况不可能存在的是A.滤纸上有Ag、Cu、Fe,滤液中有Zn2+、Fe2+B.滤纸上有Ag、Cu,滤液中有Zn2+、Fe2+C.滤纸上有Ag、Cu,滤液中有Cu2+、Zn2+、Fe2+D.滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Zn2+、Fe2+2.现有硝酸银、硝酸铜和硝酸镁三种物质组成的混合溶液,进行下列实验:根据实验推断:1固体甲是______________________;2滤液2中的溶质是______________________写化学式;3滤液2跟固体aZ三种金属,结果如下表所B.Y > Z > XD.2.下列各组药品,A.Fe、ZnSO4溶液、CuSO4溶液B.Fe、Cu、ZnSO4溶液C.Cu、ZnSO4溶液、FeSO4溶液D.Zn、Fe、CuSO4溶液3.等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图像能正确表示氢气质量与反应时间之间关系的是4\2014兰州有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放人硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化.根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为A.Z、Y、X B.X、Y、Z C.Y、X、Z D.X、Z、Y5\2014鄂州向CuSO4溶液中加入一定质量的铝粉,完全反应后过滤,得滤渣和蓝色滤液;下列说法正确的是A.向滤渣中滴加稀盐酸,无气泡产生B.滤渣中一定有Cu,可能有AlC.滤液中只有Al2SO43 D.滤液中只有CuSO46\2014武汉某化学兴趣小组的同学将一枚洁净的铁钉放入硫酸铜溶液中,观察到铁钉表面有红色的物质析出,且产生少量的气体;于是,他们重新配制硫酸铜溶液,再次实验,又观察到相同的现象;关于该实验,有如下说法:①产生的气体可能是氢气;②完全反应后溶液呈黄色;③实验中过量固体a过滤过量固体a过滤过量溶液b过滤一定发生了置换反应;④由实验可以得出金属活动性顺序:Cu > Fe;⑤硫酸铜溶液可能显酸性;⑥重做实验没有任何意义;其中正确说法的个数有A.2个B.3个 C.4个 D.5个。
九单元二节金属与盐溶液的反应-PPT精选

金属与氧气的反应
铁丝和氧气的反应
镁带和氧气的反应
镁、锌、铁、铜与盐酸反应比较
金属与盐酸反应的比较
3.通过上述探究你能比较出镁、锌、 铁、铜的金属活动性强弱吗?
(Mg Zn Fe) ( H ) Cu
金属活动性由强减弱
金属活动性顺序:
k Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag PMgCl2 + H2 ↑ Zn + 2HCl = ZnCl2 + H2 ↑ Fe + 2HCl = FeCl2 + H2 ↑
单质 化合物 化合物 单质
小结:
这种由一种单质与一种化合物反应,生成了另 一种单质和另一种化合物的反应叫做置换反应。
化学反应的基本类型
化合反应:A + B + … → AB… 分解反应:AB… →A + B + … 置换反应:A +BC →AC + B 复分解反应:AB + CD → AD + CB
(1)银与稀盐酸
(2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:
(2)Zn + CuSO4 = Cu + ZnSO4 (4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
为
;工人师傅在切割钢板时,常用硫酸铜溶
液画线是因为
。
2.小兰家中收藏一件清末的铝制佛像,该佛像至今保存十
中考专题复习金属与盐溶液反应后滤渣滤液情况分析

Zn粉的量
AgNO3
先
Cu(NO3)2
后
AgNO3恰 好完全反
应
Cu(NO3)2 恰好完全
反应
滤液成分 加Cl-有白色 滤渣成分
沉淀生成
Zn(NO3)2、Cu(NO3)2、AgNO3
Zn(NO3)2、Cu(NO3)2 Zn(NO3)2、Cu(NO3)2
Zn(NO3)2 Zn(NO3)2
Ag Ag
;滤液的情况有 种,
分别是
;
溶液质量的变化及原因
,
固体质量的变化及原因
。
分析
第一步:将题目中涉及的金属,按照金属活动性由强到弱的 顺序排列Mg>Zn>Cu,判断哪些反应能产生。 第二步:写出产生反应的化学方程式 Zn+Cu(NO3)2=Cu+Zn(NO3)2
第三步:根据反应程度判断反应后滤液、滤渣的成分及溶 液、固体质量的变化
Fe(NO3)2、Cu(NO3)2、AgNO3
滤渣成分
Ag、Cu、Fe
加盐酸有 气泡生成
Ag、Cu
Ag、Cu
Ag Ag
即时练习
(202X·宁波)将一定量的铜锌混合粉末放入盛有硝酸银溶 液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤
液中分别加入足量的稀盐酸,均无现象。则滤渣中( B )
A.一定有银,可能有铜和锌 B.一定有银,可能有铜,一定没有锌 C.一定有银和铜,可能有锌 D.一定有银和铜,一定没有锌
新课讲授
类型一:一种金属和一种盐溶液反应
将锌粉加入一定质量的硝酸镁和硝酸铜的混合溶液中,充分反应后过滤,得到滤渣和
滤液,则滤渣的情况有 2 种,分别是 Cu或Cu和Zn ;滤液的情况有 2 种,分
