有关电导、电导率、摩尔电导率
溶液的电导、电导率、摩尔电导率

溶液的电导、电导率、摩尔电导率溶液的电导、电导率、摩尔电导率是描述溶液导电性质的重要物理化学参数。
溶液的电导指溶液在外加电压的作用下通过的电流强度,是反映溶液导电能力的物理量。
电导率是指单位长度、单位截面积的溶液导电能力,是电导和电流的比值。
摩尔电导率是指单位摩尔浓度的溶液在单位长度、单位截面积内的导电能力。
溶液的电导和电导率是溶液中电解质的浓度和性质的函数。
一般来说,溶液中溶解的电解质浓度越高,溶液的电导和电导率就越大。
此外,电解质的种类和离子的迁移率也会影响溶液的电导和电导率。
一般来说,离子的迁移率越大,溶液的电导和电导率就越高。
因此,电导和电导率可以用来研究溶液中电解质的浓度和性质,以及离子的迁移率等参数。
摩尔电导率是用来比较不同溶液中电解质导电能力的物理量。
摩尔电导率不仅与溶液中电解质的浓度和性质有关,还与电解质的迁移率有关。
因此,摩尔电导率也可以用来研究电解质的浓度和性质,以及离子的迁移率等参数。
测定溶液的电导、电导率、摩尔电导率可以通过导电仪、电导率计等实验仪器进行。
一般来说,实验中可以控制温度、电解质浓度和性质等参数,以研究它们对溶液的电导和电导率的影响。
通过实验可以得到不同溶液的电导、电导率、摩尔电导率等数据,从而研究电解质的浓度和性质,以及离子的迁移率等参数。
在实际应用中,测定溶液的电导、电导率、摩尔电导率是非常重要的。
例如,通过测定水中的电导和电导率可以判断水中是否含有电解质,从而判断水的纯净度。
此外,电导和电导率还可以用来研究溶液中电解质的浓度和性质等参数,以及离子的迁移率等物理化学性质。
因此,测定溶液的电导、电导率、摩尔电导率对于化学、生物、环境等领域都具有重要的应用价值。
总之,溶液的电导、电导率、摩尔电导率是描述溶液导电性质的重要物理化学参数。
它们可以用来研究电解质的浓度和性质,以及离子的迁移率等参数。
通过测定溶液的电导、电导率、摩尔电导率可以了解电解质的浓度和性质,从而对溶液的物理化学性质有深入的了解。
第六章:电化学(2个)

第六章电化学一、本章基本要求1.掌握电化学中的一些基本概念:导体、原电池和电解池、正负极、阴阳极。
了解离子迁移数的意义及常用测定方法。
2.掌握电导、电导率及摩尔电导率的概念及它们与浓度的关系。
熟悉离子独立运动定律及电导测定的应用。
3.熟悉电解质溶液的活度、平均活度系数、平均浓度和离子强度的定义及计算方法,了解德拜-休克尔极限公式的使用。
4.掌握可逆电池的基本概念和表示方法,熟悉可逆电极的类型和书写方法,能正确书写电极反应和电池反应。
5.了解电池电动势的产生机制,测定原理。
了解电极电势的确定方法及标准氢电极作用。
6.熟练掌握电池电动势和电极电势的Nernst方程,掌握它们的计算和重要的应用。
7.熟练掌握电化学和热力学之间的联系,能利用电化学手段计算热力学函数的变化值。
8.了解浓差电池的基本概念。
熟悉膜电势的概念和意义。
9.熟悉电解过程的基本概念和基本原理,了解电极极化的产生原因。
10.了解电化学在生物学中的应用。
二、基本公式和内容提要(一)电化学基本概念1.导体导体是指能够导电的一类物体,通常分为电子导体和离子导体两种。
电子导体通过自由电子的定向移动而导电,且导电过程中无化学变化,导体的导电能力随温度升高而降低。
离子导体通过正、负离子的定向移动来实现导电目的,导电过程中有化学反应发生,导体的导电能力随温度升高而增强。
2.原电池和电解池实现化学能和电能之间相互转化的装置称为电化学装置,或简称电池。
其中将电能转化为化学能的装置叫电解池,将化学能转化为电能的装置叫原电池。
两种电池中,发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。
而正负极则是根据电势的高低来认定的。
电势高者为正极,电势低者为负极。
原电池中的正极为阴极,负极为阳极;电解池中的阳极为正极,阴极为负极。
无论在原电池还是电解池中,正离子向阴极的定向迁移和负离子向阳极的定向迁移,都可以实现电流在溶液内部的传导;而两电极上氧化、还原反应的彼此独立进行,又可以实现电流在电极与溶液界面处的连续。
物化实验思考题

2.1 电解质溶液的电导思考题1. 什么是溶液的电导、电导率和摩尔电导率?它们的相互关系如何?答: 将电解质溶液放入两平行电极间,两电极距离为L ,两电极面积为A ,这时溶液的电导G 是:R G 1= = LA κ 式中电导G 即电阻的倒数,单位为西门子(S 或Ω-1);κ称为电导率,为电极面积为1 m 2,电极距离为1 m 时两极间的电导,亦即电阻率的倒数。
SI 单位为S ·m -1。
摩尔电导率的定义式是该溶液的电导率与其浓度之比。
Λm =cκ (8-19) 其物理意义表示两个相距1 m 的电极间含1 mol 电解质的溶液时两电极间的电导率。
单位为S ·m 2·mol -1。
2. 影响电解质溶液导电能力的因素有哪些?答: 电解质溶液的导电能力与温度、电解质性质、溶剂、溶液的浓度等因素有关。
3. 强、弱电解质的摩尔电导率与浓度的关系有何不同?答: Λm 随浓度变化的规律,强弱电解质各不相同。
强电解质的稀溶液符合科尔劳斯(Kohlrausch F )经验公式:Λm =Λm ∞ - A ×c式中,Λm ∞为无限稀摩尔电导率,A 为常数。
对弱电解质,导电离子数随溶液的稀释、电离度α的增大而增大,当溶液无限稀释时,弱电解质完全电离,α=1,因而有:α==ΛΛ∞数之比电解质溶液中导电离子mol m m14. 结合教材学习和你所完成的实验,谈谈电导率的测定有哪些应用?答: 1.计算弱电解质的解离度和解离常数; 2.测定难溶盐的溶解度; 3. 检验水的纯度;4 应用于动力学研究;5 电导滴定;等等。
2.2 蔗糖水解反应的速率常数测定思考题1. 蔗糖水解反应的反应速率常数k 值与哪些因素有关?答:与温度,催化剂有关。
2. 蔗糖水解反应中H +的作用是什么?答:起催化剂的作用。
3. 一级反应有什么动力学特征?答:① lnc 与 t 成线型关系。
②半衰期与反应物初始浓度无关。
《物化问题及答案》实验十六 电导法测定氯化银的溶度积和溶解度思考题

实验十六 电导法测定氯化银的溶度积和溶解度思考题1、电导、电导率和摩尔电导率是如何定义的?三者分别以何符号表示?三者之间有何联系和区别?2、电导池常数K 的物理意义是什么?其数值如何测得?3、在运用公式c m /κ=Λ进行有关计算时,c 的单位是什么?4、极限摩尔电导率∞Λm 的物理意义和用途分别是什么?5、对于强、弱电解质,获得其∞Λm 分别有哪几种方法?6、对于强电解质难溶盐,如何理论计算其m Λ?为什么?7、难溶盐饱和溶液的电导率就是难溶盐的电导率吗?为什么?8、简述难溶盐溶解度和溶度积的区别?9、温度对电解质溶液的电导、电导率和摩尔电导率是否有影响?有何影响?10、科尔劳施公式c A m m -Λ=Λ∞成立的条件是什么?11、电导率的测定为何用交流电而不用直流电?12、简述用DDS-11A 型电导率仪测定溶液电导率的步骤?13、简述用DDS-11A 型电导率仪测定AgCl 溶解度和溶度积的步骤?答案:1、电导G 为电阻R 的倒数,表示导体的导电能力大小。
电导率κ为单位体积导体的电导。
摩尔电导率m Λ为单位浓度电解质溶液的电导率。
三者均反映导体的导电能力,对第二类导体电解质溶液而言,电导对电解质溶液的体积和浓度均没有限制,而电导率和摩尔电导率则分别对电解质溶液有体积限制和浓度限制,分别为单位体积电解质溶液和单位浓度电解质溶液的电导。
2、电导池常数K 为电导池两极之间距离 与极板面积A 之比值,对于指定的电导池,K 为常数。
K 值可通过测定已知电导率κ的电解质溶液的电阻R ,利用公式K= /A=κR 求得。
3、3-⋅m mol 。
4、∞Λm 为无限稀电解质溶液的摩尔电导率,由∞Λm 和m Λ可计算弱电解质稀溶液的电离度=αα,m Λ/∞Λm 。
5、对于强电解质,获得其∞Λm 有实验测定和理论计算两种方法,前者为以m Λ对c 作图,在低浓度下直线在纵轴(即横坐标c =0时)上的截距,后者为∞Λm =∞--∞++Λ+Λm m νν 。
电导率和摩尔电导率

§7.3 电导、电导率和摩尔电导率
• 3.1 定义 • 3.2 电导的测定 • 3.3 摩尔电导率与浓度的关系
自学P.10,准备回答下列问题: (1)分别解释强、弱电解质的摩尔电导率为 什么随着浓度减小而增加。 (2)柯尔劳施结论及其适合条件? (3)怎样求强电解质的极限摩尔电导率?弱 电解质能否用同样方法?
(3)无限稀释时离子的摩尔电导率
t
m,
m
, t
m,
m
离子的摩尔电导率需要指明涉及的基本 单元 P.12 表7.3.2
m
(Mg
2
)
2m
(
1 2
Mg
2
)
§7.3 电导、电导率和摩尔电导率
• 3.5 电导测定的应用
P.47 习题7.11
(1)计算弱电解质的解离度和解离平衡常数 分析:Λm→κ→R,Kcell
答:(1)导电强弱与离子的数量及运动速度有关 (2)强电解质的极稀溶液 (3)外推法求强电解质的极限摩尔电导率,稀溶
液不能用此法
§7.3 电导、电导率和摩尔电导率
• 3.4 离子独立运动定律与离子的摩尔电导率
(1)实验结果
★ 具有相同阴离子的钾盐和锂盐的Λm∞之差为一常数,与阴离子的性质无关 ★ 具有相同阳离子的钾盐和锂盐的Λm∞之差为一常数,与阳离子的性质无关
Λm∞→P.12 表7.3.2
K
2
1
c c
m
m
解答: Kcell=κKCl·RKCl =74.025m-1
κNH4OH= Kcell·1/R NH4OH
电导率

A G =κ l
l R=ρ A
κ=
1
ρ
电导率( 相当 相当A=1m2,l=1m时导体具有的电导。 时导体具有的电导。 电导率 κ)相当 时导体具有的电导
电导率的定义
电导率κ
K cell =
κ KCl
G KCl
κ 未 知 = G 未 知 ⋅ K cell
影响电导率的因素
电解质溶液电导率大小主要取决于两方面: 电解质溶液电导率大小主要取决于两方面: 1. 离子的多少; 离子的多少; 2. 离子的运动速度。 离子的运动速度。 外界条件的影响: 外界条件的影响: a. 温度 温度越高,离子的运动速度v越大,电导率越大; 温度越高,离子的运动速度 越大,电导率越大; 越大 b. 溶剂粘度 溶剂粘度越大,v越小,电导率越小 溶剂粘度越大, 越小 越小, 离子本性: 离子本性: a. 水化离子半径 水化离子半径r b. 离子价数 c. 特殊迁移方式
电导、电导率的测定 电导、
接通电源后,移动触C DGC线路中无电流 接通电源后,移动触C点,使DGC线路中无电流 通过,如用耳机则听到声音最小,这时D 通过,如用耳机则听到声音最小,这时D,C两点电 位降相等,电桥达平衡。 位降相等,电桥达平衡。根据几个电阻之间关系就 可求得待测溶液的电导。 可求得待测溶液的电导。
Λ =λ
∞ m
∞ m,+
+λ
∞ m,−
λ
∞ m
:离子的极限摩尔电导率
离于独立地运动, 离于独立地运动,是它在无限稀释溶液中表现出 的规律。如果不是无限稀释的溶液, 的规律。如果不是无限稀释的溶液,离子的电导不仅 自身属性有关 同时还要受到其他离子的影响 有关, 受到其他离子的影响。 与自身属性有关,同时还要受到其他离子的影响。这 时的离子不再是独立地运动, 时的离子不再是独立地运动,电解质的摩尔电导率也 不等于各离子摩尔电导率之和。 不等于各离子摩尔电导率之和。
电导率和摩尔电导率的关系

电导率和摩尔电导率的关系嘿,你问电导率和摩尔电导率的关系呀,那咱就来唠唠。
电导率呢,简单说就是衡量物质导电能力的一个指标。
就好比一条路,电导率高呢,就像这条路很宽很平坦,电流在上面走得就顺畅;电导率低呢,就像这条路又窄又崎岖,电流走起来就费劲。
而摩尔电导率呢,是在电导率的基础上,考虑了物质的量的因素。
它就像是给电导率加上了一个“小秤砣”,用来衡量每摩尔物质的导电能力。
这俩家伙的关系呢,有点像亲兄弟。
电导率是比较直观地反映整体的导电情况,而摩尔电导率呢,更细致地从物质的量的角度去看导电能力。
比如说,同样是一种溶液,浓度不一样的时候,电导率会变化,但是摩尔电导率能更清楚地告诉我们,每摩尔溶质对导电的贡献有多少变化。
一般来说呢,随着溶液浓度的增加,电导率会先上升,因为溶质多了嘛,导电的离子也多了。
但是摩尔电导率呢,可能会先上升后下降。
为啥呢?一开始浓度增加,每摩尔溶质提供的离子多了,所以摩尔电导率上升。
但是浓度太高的时候,离子之间的相互作用就变强了,就像一群人挤在一起走不动路一样,反而会让导电变得困难,所以摩尔电导率就下降了。
我给你举个例子哈。
就像煮一锅汤,一开始加点盐,汤会变得更有味道,导电能力也像汤的味道一样变强了,这就是电导率增加。
但是如果不停地加盐,汤就会变得太咸,反而不好喝了。
同样的,溶液浓度太高的时候,导电也会受到影响。
而摩尔电导率呢,就像是在看每一勺盐对汤味道的贡献。
如果加了很多盐,虽然汤整体更咸了,但是每一勺盐对味道的提升可能没有一开始那么大了。
所以啊,电导率和摩尔电导率既有联系又有区别,它们一起帮我们更好地理解物质的导电性能呢。
天津大学物理化学下册知识点归纳

第七章电化学一、法拉第定律Q=Zfξ通过电极的电量正比于电极反应的反应进度与电极反应电荷数的乘积;其中F=L e,为法拉第常数,一般取F=96485C·mol 近似数为965000C·mol;二、离子迁移数及电迁移率电解质溶液导电是依靠电解质溶液中正、负离子的定向运动而导电,即正、负离子分别承担导电的任务;但是,溶液中正、负离子导电的能力是不同的;为此,采用正负离子所迁移的电量占通过电解质溶液总电量的分数来表示正负离子导电能力,并称之为迁移数,用t+t-表示,即正离子迁移数t+=Q+/Q++Q-=v+/v++v-=u+/u++ u-负离子迁移数t_=Q-/Q++Q-=v-/v++v-=u-/u++ u-上述两式适用于温度及外电场一定而且只含有一种正离子和一种负离子的电解质溶液;式子表明,正负离子迁移电量与在同一电场下正、负离子运动速率v+与v-有关;式中的u+与u-称为电迁移率,它表示在一定溶液中,当电势梯度为1V·m-1时正、负离子的运动速率;其电解质溶液中含有两种以上正负离子时,则其中某一种离子B的迁移数计算式为t Bz+=BBBQQ三、电导、电导率、摩尔电导率1.电导电阻的倒数称为电导,单位为S西门子;G=1/R 2.电导率电极面积为1 ,电极间距为1 时溶液的电导,称为电导率,单位为G=1/R=S A κ/l 3.摩尔电导率在相距为单位长度的两平行电极之间,放置有1 电解质溶液时的电导,称为摩尔电导率,单位是S ·m 2·mol -1;m Λ=c /κ4摩尔电导率与电解质溶液浓度的关系式1柯尔劳施Kohlrausch 公式m Λ=∞Λm —A c式中∞Λm 是在无限稀释条件下溶质的摩尔电导率;c 是电解质的体积摩尔浓度;在一定温度下对于指定的溶液,式中A 和∞Λm 皆为常数;此式中适用与强电解质的稀溶液;2柯尔劳施离子独立运动定律∞Λm =v +∞+Λ,m +v -∞-Λ,m式v + 及v - 分别为正、负离子的计量系数;∞+Λ,m 及∞-Λ,m 分别为在无限稀释条件下正、负离子的摩尔电导率;此式适用与一定温度下的指定溶剂中,强电解质或弱电解质在无限稀释时摩尔电导率的计算;四、电解质的平均离子活度、平均离子活度因子及德拜—休克尔极限公式1.平均离子活度α±def --++v v αα2.平均离子活度因子±γdef vv v /1)(--++γγ 3.平均离子质量摩尔浓度b ±def b ++v b --v 1/v 4.离子活度a=a v ±=a ++v a --v =v ±γb ±/b Θ5.离子强度与德拜—休克尔极限公式离子强度的定义式为I=1/2∑2B B Z b式中b B与z B分别代表溶液中某离子B的质量摩尔浓度和该离子的电荷数;I的单位为mol·kg-1 ;I值的大小反应了电解质溶液中离子的电荷所形成静电场强度的强弱;I的定义式用于强电解质溶液;若溶液中有强、弱电解质时,则计算I值时,需要将弱电解质解离部分离子计算在内;德拜—休克尔极限公式为lg±γ=—Az+|z-|I上式是德拜-休克尔从理论上导出的计算±γ的式子,它只适用于强电解质极稀浓度的溶液;A为常数,在25℃的水溶液中A=0.509mol-1·kg-1-1/2;五、可逆电池及其电动势1.可逆电池热力学1 △r G m=W r,m=-zFE式中z是电池反应中电子转移数;F为法拉第常数;E是电动势;当△rG m<0 时,E>0 ,说明自发的化学反应恒温压下在原电池中可逆进行;2△r S m=-pmrTG⎪⎭⎫⎝⎛∂∆∂=zFpTE⎪⎭⎫⎝⎛∂∂式中pTE⎪⎭⎫⎝⎛∂∂称为原电池电动势的温度系数,表示恒温下电动势随温度的变化率,单位为3△r H m=-z F E+zFTpTE⎪⎭⎫⎝⎛∂∂4Q r,m= zFTpTE⎪⎭⎫⎝⎛∂∂2.电动势的计算1能斯特方程化学反应为∑B v=0E=ΘE-zFRT ln∏BvBBa或E=ΘE-zV05916.0ln∏BvBBa当电池反应达平衡时,△rG m=0,E=0,则ΘE=zFRT lnΘK2电极的能斯特公式E 电极= Θ电极E —zF RTln {})(B a 电极(电极)(电极)B v B ∏ =Θ电极E +zFRTln )()(还原态氧化态a a n 3任何可逆电池的电动势 E=E 右-E 左=E 阴-E 阳ΘE =Θ(阴)E -Θ(阳)E4液体接界电势E 液界=t +-t -F RTln 2,1,±±a a 六、电极的种类 1.第一类电极这类电极一般是将某金属或吸附了某种气体的惰性金属置于含有该元素离子的溶液中构成的,包括金属电极、氢电极、氧电极和卤素电极等;2.第二类电极第二类电极包括金属—难溶盐电极和金属—难溶氧化物电极;3.氧化还原电极任何电极均可发生氧化还原反应;这里所说的氧化还原电极专指如下一类电极:电极极板 只起输送电子的任务,参加电极反应的物质都在溶液中;如电极Fe 3+,Fe 2+ ;-4M nO ,Mn 2+,H +,H 2O |Pt;七、极化电极电势阳极:E 阳=E 阳,平+η阳η阴阴极:E 阴=E 阴,平+η阴式中 E 阳,平 及 E 阴,平 分别为阳极及阴极的平衡电板电势;η阴及η阴分别为阴、阳极的超电势;上述二式既适用与原电池,也适用于电解池个别电极的极化电极电势的计算;第八章 量子力学基础 一、量子力学的基本假设量子力学的4个基本假设是对3个问题的回答:一是运动状态如何描述;二是可观测的力学量如何表达;三是状态变化的规律;1.波函数由N 个粒子组成的微观系统,其状态可由N 个粒子的坐标或动量的函数ψt,q 1,q 2,…… 来表示,ψ 被称为波函数;波函数是单值、连续的;2.薛定谔方程系统状态 ψt,r r代表所有坐标 随时间的变化遵循薛定谔方程-i h t∂ψ∂=ψH其中 H为哈密顿算符,H =∑⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛∂∂+∂∂+∂∂j j j j z y x m h 22222222+Vt ,r当势能与时间无关时,系统的波函数ψt,r =e -iEt/h ψr3.系统所有可观测物理量的算符表示量子力学中与力量学O 对应的算符的构造方法:1写出以时间、坐标和动量为坐标的力学量O 的经典表达式Ot;q 1,q 2,···;p 1,p 2,··· 式中 q 1,q 2,···表示动量 ; p 1,p 2,···表示坐标2将时间t 与坐标q 1,q 2,···看做数乘算符,而将动量p j 用算符jj q i h p ∂∂= 代替,则与力学量O 对应的算符O为O t,q 1,q 2···;,1q i h ∂∂,1q i h ∂∂,2q i h ∂∂,··· 4.测量原理在一个系统中对力学量 O进行测量的本征值 λn :Oψn =λn ψn其有两层含义:1如果系统所处的状态为O的本征态ψn ,则对O的测量结果一定为λn;2如果系统所处的状态ψ 不是O的本征态,则对O的测量将使系统跃迁到O的某一本征态ψk ,其测量结果为该本征态对应的本征值λk ;可将ψ用O的本征态展开,即ψ=∑ψjj j a则测量结果为λk 的概率为 |a k |2; 一般来说,对处于状态 ψ的系统进行测量,力学量 O的平均值为<O > =⎰⎰ψψψψττd d O n*二、 一维势箱中离子的薛定谔方程-2222mdx d h ψ=E ψ波函数ψx=a 2sin )(axn π n=1,2,3···能及公式E=2228mah n n=1,2,3···三、一维谐振子 哈密顿算符H =-2222dx d m h +1/2kx 2 能级E v =1/2+vhv 0其中 v=0,1,2,3,··· 为振动量子数,v 0=mkπ21 为谐振子经典基数; 波函数ψv =N v H v ξexp-ξ/2 其中ξ=xh km =x h mv 02π N v =π!21v vH v ξ 为 阶厄米多项式H v ξ=-1vexp ξ2)exp(2ξξξ-vd d 四、二体刚性转子1.拉普拉斯算符在球级坐标中的表示2∇=⎭⎬⎫⎩⎨⎧∂∂+∂∂∂∂+∂∂∂∂)(sin 1)(sin sin 11)(1222222ϕθθθθθr r r r r2.球谐函数 Y J,m ψ,θ=)ex p(cos )! m (J 4)! m -(J 1J 2ϕθπim P mJ )()(++如设ξ=cos θ,则其中mJ P ξ=2m 2J )-(1J21ξJ mJ d )1(d 2J -+ξξJm ≥3二体刚性转子若r 及Vr 均为常数,二体问题即成为二体刚性转子问题;若μ= m 1m 2/m 1+m 2 ,则E J =I hJ J J J d h 2)1()1(22+=+μJ=0,1,2,···其中I=μd 2 为转动惯量,波函数即为球谐函数Y J, m θ,ϕ五、类氢离子及多电子原子的结构 1.类氢离子Vr=-22Z reE n =-02222Z a n ea 0=0.5292×10-10m n=1,2,3,······ψ=R n,J r ·Y J, m θ,ϕ其中:R n,J r=—()(){}⎪⎭⎫⎝⎛-+--•⎪⎪⎭⎫ ⎝⎛++2exp )(!2!1Z 212330ρρρJ J n J L J n n J n na式中:ρ=Zr2na ,而)(12ρ++J Jn L=⎪⎪⎭⎫ ⎝⎛-+++++)(e n 1212ρρρρρe d d d d J J n J n J J2.多电子原子1多电子原子的哈密顿算符H =—∑∑∑∑>+-∇i i i j iji i i r e r Z m h 2222e 2 其中2i ∇=222222ii i z y x ∂∂+∂∂+∂∂ 为第i 个电子的拉普拉斯算符,r i 为它与核的距离,r ij 为电子i 与电子j 的距离,m 为电子质量;2多电子原子电子波函数①中心立场近似法将除电子i 以外的其余Z-1个电子看做是球形对称分布的,电子i 的势能为V i =—i r 2e -Z )(σ=— i r 2*eZ ,对不同电子σi 值不同;H =∑⎭⎬⎫⎩⎨⎧-∇-i i i r e m h 2*22Z 2 ψn,J,m =R`rY J,m θ,ϕEn=—13.6eV n2*2Z②自洽场方法多原子的电子波函数为各个电子的波函数乘积:ψ1,2···,Z=∏ψjj j )( 电子i 与所有其他电子j 的相互作用即为V ij =e 2j ijj j d r j j τ⎰ψψ)()(*单电子哈密顿算符i H =—i ii V r Z m h +-∇222e 2通过求解单电子薛定谔方程i Hψi=)(i i i ψε即可得到多电子薛定谔方程的解;可通过迭带过程求解;先假设一组单电子波函数;3.斯莱特行列式∏ψ=ψii ,不满足费米子对波函数的反对称性的要求,斯莱特提出构造反对称波函数的一般方法;对N 个电子的系统,若归一化的空间-自旋轨道组为{ψj ,j=1,2,3···} ,则反对称波函数表示为ψ1,2···,N=N!1)()()()()()()()()(N ```N N `````````1```221```11N 21N 21N 21ψψψψψψψψψ六、分子轨道理论简介1.玻恩-奥本海默近似分子系统中核的运动与电子的运动可以分离;2.类氢分子离子的Schrodinger 方程的解哈密顿算符el H =—222i m h ∇—a r e 2—br e 2定义椭球坐标为ξ=R r r b a +,η=Rrr b a - 1Schrodinger 方程的解ψel ξ,η,ϕ=))ex p(im )M(L(21ψηξπm=0,±1,±2,···2表8-1对于坐标反演 ξ, η,ϕ→ ξ, η,—ϕ+π 波函数不变的用g 表述,改变符号的用u 表示;3电子能级E el R 为核间距的函数,当核间距R ∞→时趋于氢原子能级,核间距R →0时趋于氦正离子He +能级;4UR= E el R+e 3/R 为势能曲线,对基态,在 R=R e =1.06×10-10m 时有极小值—16.40eV;所以,该轨道为成键轨道;第九章 统计热力学初步 一、离子各运动形式的能级及能级的简并度1.三维平动子εt =⎪⎪⎭⎫ ⎝⎛++22222228c n b n a n m h z y x n x ,n y ,n z =0,1,2···当a=b=c 时有简并, n x +n y +n z 相等的能级为简并的;2.刚性转子双原子分子εr =JJ+1I228h π J=0,1,2,···式中,I=μ20R ,μ=2121m m m m + 简并度为g r,J =2J+1;3.一维谐振子εv=v=1/2hv v=0,1,2··· 式中,v=μπk21, k 为常数,μ为折合质量;能级为非简并的,即g v,v =1;4.电子及原子核系统中全部离子的电子运动及核运动均处于基态;电子运动及核运动基态的简并度为常数;分子能级是各种独立运动能级之和,为ε=εt +εr +εv +εe +εn二、能级分布微态数及系统总微态数1.定域子系统 W D =N ∏ii n in gi !2.离域子系统温度不太低时即g i >>niW D =∏i in i n g i!一般情况下W D =∏-⨯-+ii i i i n g n !1g !!1)(3.系统总微态数Ω=∑DD W三、最概然分布与平衡分布 1.等概率定律在N 、U 、V 确定的情况下,假设系统各微态出现的概率相等;这个假设称为等概率定律;P=Ω1 分布D 出现的概率是P D =ΩD W2.最概然分布和平衡分布在N 、U 、V 确定的条件下,微态数量大的分布称为最概然分布;而当N 很大时,出现的分布方式几乎可以用最概然方式来代表;N 、U 、V 确定的系统平衡时,粒子的分布方式几乎不随时间而变化的分布,称为平衡分布;四、玻耳兹曼分布n i =kT i I e g /qNε- 符合上式的分布称为玻耳兹曼分布;其中q 为离子的配分函数;q def∑-jkTj e/ε=∑ikT i i e g /ε任两个能级上分布n i , n k 之比为j i n n =kTk kTi k i e g e g //εε-- 任一能级i 上分布的粒子数 n i 与系统的总粒子数N 之比为=Nin ∑--ikTikT i i i e g e g //εε=q e g kTi i /ε- 五、粒子配分函数的计算1.配分函数的析因子性质 q = q t q r q v q e q n2.能量零点的选择对配分函数的影响若基态能级能量值为0ε,以基态为能量零点时,能量值00εεε-=i iq =∑-ikT i i e g /ε=kTe /0ε-∑-ikTi i eg /0ε=kTi e/0ε-q 0即q 0 =kT e /0εq常温下,平动及转动配分函数与能量零点选择几乎无关,但振动配分函数与能量零点选择有关,即 t t q q ≈0r t q q ≈0 因为 εv,0=hv/2所以 0vq =q v exp ≈kT2hve 5q v电子运动与核运动的配分函数与能量零点选择也无关;3.配分函数的计算 1平动t q = 2/32mk 2⎪⎭⎫ ⎝⎛h T πV2转动对线性刚性转子r q =()()⎥⎦⎤⎢⎣⎡+-+∑∞=kIT h J J 21exp 12J 20J其中h =π2h 若设 r Θ =kITh 22则当 T >>r Θ 时r q rT Θ≈σ 其中σ为绕通过质心,垂直于分子的旋转轴一周出现的不可分辨的几何位置的次数,即分子对称数;对线性刚性转子转动自由度为2;3振动v q =[]∑-ii v i v kT g /exp ,,ε=e-hv/2kT∑∞=⎥⎦⎤⎢⎣⎡-0ex p v kT vhv 若设v Θ =khv2 ,x=/T v e Θ ,当 T<<v Θ时常温,振动运动量子化效应突出,不能用积分代替加和;v q =∑∞=ΘΘ0v /T v -/2T-v v e e=xx -1 0vq =x-114电子运动因为电子运动全部处于基态,电子运动能级完全没有开放,求和项中自第二项起均可忽略;所以kTe n eg q /0,e 0,ε-=0e q =0,e g =Const5核运动kTn n eg q /0,n 0,ε-=n q =0,n g =Const六、系统的热力学能与配分函数的关系U i =NkT2V T ln ⎪⎭⎫ ⎝⎛∂∂i q 此处U i 可代表: 总热力学能;零点为0ε时的热力学能U 0 = U — N 0ε平动能,i q 表示相应的配分函数; 当U i 代表转动能、振动能、电子能、核能时,i q 与V 无关,偏微商可以写作全微商;U i 与 0i U 的关系:只有0v U =2NhvU v -,其余: ≈t U 0t U=r U 0v U =e U 0e U=n U 0n U七、系统的摩尔定容热容与配分函数的关系Vm m T U ⎪⎭⎫⎝⎛∂∂=V,C =V V T q RT T ⎥⎦⎤⎢⎣⎡⎪⎭⎫⎝⎛∂∂∂∂ln 2=VV T q RT T⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛∂∂∂∂02ln kT e q q /0ε-=,0ε与T 无关, m V,C 与零点能选择无关;m V,C =t V,C +r V,C +v V,C八、系统熵与配分函数的关系 1.玻耳兹曼熵定定理 S=kln Ωk 为玻耳兹曼常数;当N 无限大时,最概然分布微态微1ln /ln →ΩB W 时,用 B W ln 代替Ωn ,则 S=B W K ln ,这种近似方法称为摘取量大项原理;2.熵与配分函数的关系 离域子系统: S=Nk TUN q Nk ++ln= N q Nk 0ln +Nk TU 0定域子系统: S=0ln q Nk +T U 0=q Nk ln +TU3.统计熵通常把由统计热力学方法计算出系统的S t 、S r 及S v 之和称为统计熵S=S t +S r +S v S m,t =R()()()⎭⎬⎫⎩⎨⎧+-+•-723.20/ln /ln 25/ln 231Pa p K T l mol kJ M 理想气体S m,r =Rln R r +⎥⎦⎤⎢⎣⎡ΘσTS m,r =Rln1--1/-1V 1-T /)1(e T R -Θ+Θ-ΘT V V e九、其他热力学函数与配分函数的关系1.A 、G 、H 与配分函数的关系 1A=-kTlnQQ=!N q N , A=—kT !ln N q N离子域子系统Q= N q , A=—kT N q ln 定域子系统2G=—kT !ln N q N+NkTV TV q ⎪⎭⎫ ⎝⎛∂∂ln 离域子系统G=—kT N q ln +NkTV TV q ⎪⎭⎫ ⎝⎛∂∂ln 定域子系统3H= NkT 2Tq ⎪⎭⎫ ⎝⎛∂∂T ln +NkTV TV q ⎪⎭⎫ ⎝⎛∂∂ln2.理想气体的标准摩尔吉布斯函数=ΘTG,m —RT Nqln =—RT m ,00ln U Nq+ 3. 理想气体的标准摩尔吉布斯自由能函数TU -Gm 0,Tm,Θ=—R Nq 0ln4.理想气体的标准摩尔焓函数TU -H m 0,T m,Θ=—RT VTq ⎪⎪⎭⎫ ⎝⎛∂∂0ln +R十、理想气体反应的标准平衡常数—ΘK ln =∑⎪⎪⎭⎫⎝⎛-ΘB B m B B TU G v R ,,0,m 1+∑BBT m B Uv RT,,,01= —m r m r U RT T U G R ,0,0m 11∆+⎪⎪⎭⎫ ⎝⎛-∆Θ 以平衡系统中各组分的粒子数 表示的平衡常数为K Ndef∏Bv B B N=∏∆-BkT B Br e v q/00ε其中,0εr ∆=∑BB B v ,0ε以平衡系统中各组分单位体积中的粒子数 表示的平衡常数为K Cdef∏Bv B B C=()kT Bv B r be V q /00/ε∆-⎭⎬⎫⎩⎨⎧∏ 其中,分子浓度 C B defN B /V第十章界面现象一、表面功、表面吉布斯函数和表面张力在温度、压力和组成不变的条件下,可逆地使表面积增加dA S 时,环境对体系所做的非体积功δ`Wr称为表面功,表示为δ`Wr=γdA S恒温、恒压下,可逆非体积功等于系统的吉布斯函数的增加,即dG T,p=δ`Wr=γdA S该式表明,若dA S<0 ,则dG T,p<0 ,即表面积减小的变化时自发的;上式又可写作γ=pTSAG,⎪⎪⎭⎫⎝⎛∂∂γ表示在单位面积上,表面层的分子比相同数量的内部分子多余的吉布斯函数,称表面吉布斯函数,其单位为J·m-2 ;γ又表示沿着液或固体表面并垂直作用在单位长度上的表面收缩力,称为表面张力,其单位为N·m-1;一、弯曲液面的附加压力和蒸气压1.弯曲液面的附加压力弯曲液面下的液体或气体均受到一个附加压力的作用,该的大小可由拉普拉斯方程计算,该方程为r/2γρ=∆式中:ρ∆为弯曲液面内外的压力差;γ为表面张力;r为弯曲液面的曲率半径;注意:1计算ρ∆时,无论凸液面还是凹液面,曲率半径r一律取正数,并规定弯曲液面的凹面一侧压力为p内,凸面一侧为p内,ρ∆一定是p内减p外, 即ρ∆=p内—p外2附加压力的方向总指向曲率半径中心;3对于在气相中悬浮的气泡,因液膜两侧有两个气液表面,所以气泡内气体所承受的附加压力为ρ∆=4γ/r2.弯曲液面附加压力引起的毛细现象当液体润湿毛细管管壁时,则液体沿内管上升,其上升高度可按下式计算h=2γcosθ/rρg式中:r 为液体表面张力;ρ为液体密度;g为重力加速度;为接触角;r为毛细管内径;注意:当液体不湿润毛细管时,则液体沿内管降低;3.微小液滴的饱和蒸气压——开尔文公式RTlnp r/p= 2γM/ρr式中:p r为液滴的曲率半径为r 时的饱和蒸气压;p为平液面的饱和蒸气压;ρ、M 和γ分别为液体的密度、摩尔质量和表面张力;上式只用于计算在一定温度下,凸液面如微小液滴的饱和蒸气压随球形半径的变化;当计算毛细管凹液面如过热液体中亚稳蒸气泡的饱和蒸气压随曲率半径变化时,则上式的等式左边项要改写为RTlnp/ p r;无论凸液面还是凹液面,计算时曲率半径均取正数;一、固体吸附固体表面的分子由于受力不均而具有剩余力场,对气体分子产生吸引力,使气体在固体表面聚焦,从而降低固体的表面自由能,这种现象称为吸附;按吸附剂与吸附质作用本质的不同,吸附可分为物理吸附和化学吸附;用单位质量吸附剂所吸附气体的物质的量n或其在标准状况下所占有的体积V来表示吸附量n a=n/m或V a=V/m单位分别为mol ·kg -1 或m 3·kg -1;1.朗缪尔单分子层吸附等温式 朗缪尔从吸附动态平衡的基本观点出发,提出了在均匀固体表面、吸附分子间无相互作用,只发生单分子层吸附情况下的吸附理论,推导出朗缪尔吸附等温式θ=bpbp+1 式中θ为覆盖率,θ=V a /a m V ,表示固体表面被覆盖的分数;b 为吸附平衡常数,又称吸附系数,b 值越大,则表示吸附能力越强;p 为平衡时的气相压力;朗缪尔吸附等温式也可以表示为V a =am V bpbp+1 式中 a m V 表示吸附搭饱和时的吸附量;V a 则表示覆盖为θ时的平衡吸附量;当压力很低或吸附较弱时,bp1 ,则上式可简化为V a =a m V bp ;当压力足够高时或吸附较强时,bp1则上式可简化为 V a =a m V ; 2.吸附热力学吸附式一个自发过程,是吉布斯函数下降的过程,G ∆= H ∆—T S ∆<0 ;因吸附过程中,气体分子由三维空间被吸附到二维表面,自由度减小,S ∆<0 ,则 H ∆<0 ;吸附通常为放热过程;121212ln p pT T T RT H ads --=∆ p 1和 p 2 分别是在 T 1 和 T 2 下达到某一个相同吸附量时的平衡压力;温度升高时,要想维持同样的吸附量,必然要增大气体的压力,即若T 2>T 1 ,必然 p 2> p 1; 四、液—固体面 1.接触角与杨氏方程当一液滴在固体表面上不完全展开时,在气、液、固三相汇合点,液—固界面的水平线与气—液界面切线之间通过液体内部的夹角 ,称为接触角;其角度大小取决于同时作用于O 处的液体分子之上的固体表面张力γs 、液体界面张力γls 以及液体表面张力γl ;当平衡时,存在以下关系:γs =γls +γl cos θ以上公式只使用于光滑的表面; 2.湿润与铺展湿润是固体表面上的气体被液体取代的过程;按湿润程度的不同,分为沾湿、浸湿和铺展3种;θ<90;的情形称为湿润;θ>90;的称为不湿润;θ=0;或不存在时称为完全湿润;θ=180; 时称为完全不湿润;铺展是少量液体在固体表面上自动展开,形成一种薄膜的过程;用铺展系数S 作为衡量液体在固体表面能否铺展的判据;S=—S G ∆=γs -γls -γlS ≧0时,可发生铺展,S 越大,铺展性能越好;S ﹤0,则不能铺展;五、溶液表面的吸附1. 溶液表面的吸附现象 溶液的表面张力随溶质的性质及浓度而变化,所以溶液会自动调节表面层的浓度而尽量降低表面自由能,导致溶液表面层的组成与本体溶液的组成不同,称这种现象为溶液表面的吸附作用;若溶质在表面层的浓度大于它在本体溶液中的浓度,则为正吸附,反之为负吸附;2.吉布斯吸附等温式吉布斯吸附公式描述了描述了溶质的表面吸附量 与溶质的活度和表面张力随溶质活度变化率之间的关系:2Γ=—22a da d RT γ•对于稀溶液,可用溶质的浓度代替活度,并可略去下角标,表示为Γ=—dcd RT γ•c 若dcd γ<0得Γ>0,表明凡增加浓度使表面张力降低的溶质在表面层发生正吸附;若dcd γ>0得Γ<0,表明凡增加浓度使表面张力增大的溶质在表面层发生负吸附;3.表面活性剂凡融入某液体后能使某液体的表面张力显著降低,在液体表面产生正吸附的物质称为表面活性剂;按化学结构来分类,大体上可分为离子型和非离子型两大类;表面活性剂物质的基本性质包括外表面定向排列和内部形成胶束,它们都能降低表面张力;表面活性剂物质在溶液中开始形成胶束的最低浓度为临界胶束浓度;第十一章化学动力学一、化学反应速率及速率方程1.反应速率单位时间单位体积内化学反应的反应进度为反应速率;v def1/v B Vdn B/dt反应速率的单位为mol·m-3·s-1;其与用来表示速率的物质B的选择无关,与化学计量式的写法有关;对于恒容反()V v B/1v=()tcddB/对于化学计量反应AvA-BvB-CvC-VvB-—···→···+YvY+ZvZ经常指定反应物A的消耗速率Av= —()V/1()tnddA/或某指定产物Z的生成速率zv= ()V/1()tnddZ/来表示反应进行的速率,则AA∨-=νν=BB∨-ν=···YY∨-ν= ZZ∨-ν各不同物质的消耗速率或生成速率与各自的化学计量数的绝对值成正比;对于恒温恒容气相反应,Pv=()Bv/1()tnddB/恒容Pv=vRT2.基元反应的质量作用定律对基元反应aA + bB→P其质量作用定律表示为r=k bBaAcc该式表示基元反应的速率与所用反应物浓度带相应指数的乘积成正比,其中浓度指数恰是反应式中各相应物质计量系数的绝对值;其中,比例系数k 为基元反应的速率常数;3. 反应速率方程表示化学体系中反应速率与反应物的浓度间函数关系的方程式称为反应速率方程;由实验数据得出的经验速率方程一般可表示为A v =—tc d d A =k B Ac b BaAc ···式中n A 、n B 等分别称为反应组分的反应分级数;n= n A +n B +···为反应的总级数;反应级数的大小表示浓度对反应速率影响的程度,级数越大,则反应速率受浓度的影响越大;二、具有简单级数反应的速率方程及特点三、速率方程的确定1. 微分法 —tA d d c =k n A c 是速率方程的微分式,应用此式求反应级数的方法即为微分法;2. 尝试法试差法又称为尝试法;就是看某一化学反应的c A 与t 间的关系适合于哪一级数的动力学积分式,从而确定该反应的反应级数;3. 半衰期法半衰期法确定反应级数的依据是化学反应的半衰期和反应物初始浓度之间的关系与反应级数有关;四、反应速率与温度的关系 阿伦尼乌斯公式指数式 k=A ·eRTE a- 式中a E 为活化能;A 为指前因子GB3102—93称“指前参量”;对数式 lnk=RTE a-+lnA 微分式dT kd ln =2a RTE 定积分式 12lnk k =()1212a T RT T -T E五、典型复合反应1. 对行反应如以正、逆反应均为一级反应;A −−←−→−-11k k Bt=0 0,c A 0 t=t A c 0,c A —A c t=∞ e A ,c 0,c A —e A ,c —tA d d c =1k A c -1-k 0,c A -A c—te A d d ,c =1k e A ,c -1-k 0,c A -e A ,c =0K c =1k /1-k =0,c A -e A ,c /e A ,c —d A c -e A ,c /dt =1k +1-k A c -e A ,c当 K c 很大,即 1k 1-k , e A ,c 0≈ 时—tA d d c =1k A c2. 平行反应当两个反应都是一级反应,则td d B c =k 1A ctd d C c =k 2A c若反应开始时,0,B c =0,C c =0,则A c +B c +C c =0,c A ,所以—tA d d c =1k + 2k A c积分得ln 0,c A /A c =1k + 2k t 平行反应的特点:当组成平行反应每一个反应级数均相同时,则各个反应物的浓度比等于各反应的速率常数之比,而与反应物的起始浓度及时间无关;3. 连串反应假设由两个一级反应组成的连串反应;A −→−1kB −→−2k C t=0 0,c A 0t=t A c B c C c—dt d A c =1k A c—tc Bd d =1k A c -2k B c因为A c +B c +C c =0,c A ,则c C =0,c A ()⎥⎦⎤⎢⎣⎡----t k t k e k e k k 211212k 1-1 六、复合反应速率的近似处理法1. 选取控制步骤法 连串反应的总速率等于最慢一步的速率;最慢的一步称为反应速率的控制步骤;控制步骤的反应速率常数越小,其他各串联步骤的速率常数越大,则此规律就越准确;这时,要想使反应加速进行,关键就在于提高控制步骤的速率;2. 平衡态近似法 对于反应处理A +B −−←−→−-11k k C 快速平衡C −→−k 2D 慢若最后一步为慢步骤,因而前面的对行反应能随时近似维持平衡;从化学动力学角度考虑,上面的快速平衡时正向、逆向反应速率近似视为相等;3. 稳态近似法 在连串反应中A −→−1kB −→−2k C若中间物B 很活泼,极易继续反应,则必k 2k 1 ;就是说第二步反应比第一步反应快的多,B 一旦生成,就立即经第二步反应掉,所以反应系统中B 基本上没什么积累,c B 很小;这时B 的浓度使处于稳态或定态;所以稳态或定态就是指某中间物的生成速率与消耗速率相等以致其浓度不随时间变化的状态;七、基元反应速率理论 1.简单碰撞理论1双分子气体反应的碰撞数 碰撞频率同种分子异种分子2双分子气体反应速率 同种分子 异种分子 其中 为 能;2.过渡状态理论活化络合物理论 1浓度 为标准时的速率常数其中 为玻耳兹曼常量,h 为普朗克常量,n为所用反应物系数之和;2对气相反应,以为标准态时的速率常数3溶液中离子反应速率的原盐效应其中z A 、z B为离子A、B的电荷;I为离子强度;k0为各种离子和活化络合物的活度系数均为1时的速率常数;25℃的水溶液A=0.509;八、量子效率与量子产率量子效率量子产率第十二章胶体化学一、胶体系统特点分散相粒子在某方向上在1-1000mm范围的高分散系统称为胶体;可分溶胶、高分子溶液、缔合胶体3类;具有可透明或不透明性,但均可发生光散射,胶体粒扩散速率慢,不能透过半透膜,具有较高的渗透压的特点,其主要特征是高度分散的多相性和热力学不稳定性;二、光学性质当将点光源发出的一束可见光照射到胶体系统时,在垂直于入射光的方向上可观察到一个发亮的光锥,此现象称为丁铎尔现象;丁铎尔现象产生的原因是胶体粒子大小小于可见光的波长,而发生光的散射的结果;散射光的强度I可由瑞利公式计算:I=2222224222l2CV9⎪⎪⎭⎫⎝⎛+-nnnnλπ1+cos2αI0式中:I0及λ表示入射光的强度与波长;n及n0分别为分散相及分散介质的折射率;α为散射角,即观测方向与入射光之间的夹角;V为单个分散相粒子的体积;C为分散相的数密度;l 为观测者与散射中心的距离;此式适用于粒子尺寸小于入射光波长,粒子看成点光源,而且不导电,还有不考虑粒子的散射光相互发生干涉;三、胶体系统的动力性质1.布朗运动胶体粒子由于受到分散介质分子的不平衡撞击而不断地做不规则的运动,称此运动为布朗运动;其平衡位移x可按下列爱因斯坦-布朗位移公式计算x=RTt/3Lπrη式中:t为时间,r为粒子半径, η为介质的粘度;2.扩散、沉降及沉降平衡扩散:指当有浓度梯度存在时,特质粒子包括胶体粒子因热运动而发生宏观上的定向迁移现象;沉降:指胶体粒子因受重力作用而发生下沉的现象;沉降现象:当胶体粒子的沉降速率与其扩散速率相等时,胶体粒子在介质的浓度随高度形成一定分布并且不随时间而变,这一状态称为胶体粒子处在沉降平衡;其数密度C与高度h的关系为LnC2/C1 =—Mg/RT{1-)(ρρ/}h2-h1式中:ρ及ρ分别为粒子及介质的密度,M为粒子的摩尔质量,g为重力加速度;此式适用于单级分散粒子在重力场中的沉降平衡;四、胶体的电学性质胶粒表面电荷来源于电离作用、吸附作用和摩擦带电荷等;施特恩Stern双层模型表示为图12-1所示;若固体表面带正电荷,则双电层的溶液一侧由两层组成,第一层是。
电导率和摩尔电导率

§7.3 电导、电导率和摩尔电导率
• 3.1 定义 • 3.2 电导的测定 • 3.3 摩尔电导率与浓度的关系
自学P.10,准备回答下列问题: (1)分别解释强、弱电解质的摩尔电导率为 什么随着浓度减小而增加。 (2)柯尔劳施结论及其适合条件? (3)怎样求强电解质的极限摩尔电导率?弱 电解质能否用同样方法?
Λm=κ/c = 3.647×10-2S·m2·mol-1
Λm∞= Λm,NH4+∞+ Λm,OH-∞ =271.4×10-4S·m2·mol-1
α=1.344×10-2,Kθ=1.831×10-5
§7.5 可逆电池及其电动势的测定
• 5.1 可逆电池
(1)原电池的图解表示法
)Zn ZnSO4(aq)MCuSO4(aq) Cu(
§7.3 电导、电导率和摩尔电导率
• 3.4 离子独立运动定律与离子的摩尔电导率
(1)实验结果 (2)离子独立运动定律
m
m,
m,
★ 无限稀释溶液中,离子彼此独立运 动,互不影响,无限稀释电解质的摩尔 电导率等于无限稀释时阴、阳离子的摩 尔电导率之和
★ 离子独立运动定律适用于无限稀释 的强、弱电解质溶液
(3)无限稀释时离子的摩尔电导率
t
m,
m
, t
m,
m
离子的摩尔电导率需要指明涉及的基本 单元 P.12 表7.3.2
m
(Mg
2
)
2m
(
1 2
Mg
2
)
§7.3 电导、电导率和摩尔电导率
• 3.5 电导测定的应用
电导率、摩尔电导率与浓度的关系

11.2.3 电导率、摩尔电导率与浓度的关系日期:2007-2-26 20:08:22 来源:来自网络查看:[大中小] 作者:不详热度: 2313三、电导率、摩尔电导率与浓度的关系电解质溶液的电导率及摩尔电导率均随溶液的浓度变化而变化,但强、弱电解质的变化规律却不尽相同。
几种不同的强弱电解质其电导率χ与摩尔电导率Λm随浓度的变化关系示于图11-4和11-5。
图11-4 一些电解质电导率随浓度的变化图11-5 在298K时一些电解质在水溶液中的摩尔电导率与浓度的关系从图11—4可以看出,对强电解质来说,在浓度不是很大时,χ随浓度增大而明显增大。
这是因为单位体积溶液中导电粒子数增多的原故。
当浓度超过某值之后,由于正、负离子间相互作用力增大,而由此造成的导电能力减小大于导电粒子增多而引起的导电能力增大,故净结果是χ随浓度增大而下降。
所以在电导率与浓度的关系曲线上可能会出现最高点。
弱电解质溶液的电导率随浓度的变化不显著,这是因为浓度增加电离度随之减少,所以溶液中离子数目变化不大。
与电导率不同,无论是强电解质或弱电解质,溶液的摩尔电导率Λm均随浓度的增加而减小(见图11-5)。
但二者的变化规律不同。
对强电解质来说,在水溶液中可视为百分之百电离,因此,能导电的离子数已经给定。
当浓度降低时,离子之间的相互作用力随之减弱,正、负离子的运动速度因此增加,故Λm增大。
当浓度降低到一定程度、离子之间作用力已降到极限,此时摩尔电导率趋于一极限值——无限稀释时的摩尔电导率Λm∞。
在浓度较低的范围内,Λm,Λm∞与浓度C之间存在着下列经验关系式:(11-7)式中A为一常数。
但对弱电解质来说,溶液变稀时离解度增大,致使参加导电的离子数目大为增加(注意:电解质数量未变),因此Λm的数值随浓度的降低而显著增大。
当溶液无限稀释时,电解质已达 100% 电离,且离子间距离很大,相互作用力可以忽略。
因此,弱电解质溶液在低浓度区的稀释过程中。
电导分析法

电解质
电解质
KCl LiCl KNO3 LiNO3 KOH LiOH
0.00349
HCl HNO3 KCl KNO3 LiCl LiNO3
0.00049
0.00349
0.00049
0.00348
0.00049
电解质溶液的电导与浓度的关系
Λm Λm A c
8.20 105 82.5 c Λm Λm 3/ 2 1/ 2 ( DT ) ( DT )
现在使用的电导仪 一般采用电阻分压 原理,电路图如右
Em=Rm*E/(Rm+Rx) E和Rm为恒定值
Rx
在测量低电阻时, 为了防止极化现象, 采用 1000~2500HZ的 高频电压 也就是传说中的 高频滴定法
影响电导测量的因素
(1) 温度的影响 温度升高, 粘度降低,电导增大.每升高1度, 约增加2% (2) 溶剂的影响 25 C 蒸馏水电导率:0.8~1.0 S·cm-1 进一步纯化后电导率: 0.03~0.06 S·cm-1
1 电极不直接与试液接触,避免电解和电极
极化现象。适用于沉淀滴定,也可用于一般 金属离子(铜锌铝铁etc.)的EDTA配合的滴 定 2 能测定电容变化,非水溶剂中的滴定分析 3 对于介电常数相差甚远的两组分混合物的 分析,高频滴定法能得到比较理想的结果
其他应用
平衡常数 难溶盐的溶解度 …………
Λmபைடு நூலகம் Λ A c
m
表11-1 25℃时一些电解质极限电导数据 Λm∞ (Ω1m2mol1) 0.01499 0.01150 0.01450 0.01101 0.02715 0.02367 △ (差值) Λm∞ (Ω1m2mol1) 0.04262 0.04213 0.01499 0.01450 0.01150 0.01101 △ (差值)
电解质溶液的电导率和摩尔电导率

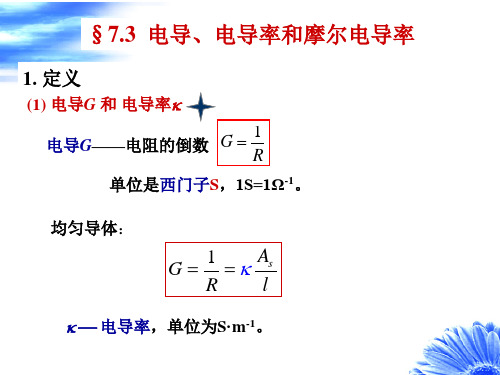
§7.2 电解质溶液的电导率和摩尔电导率1. 电导和电导率通过溶液的电流强度I 与溶液电阻R 和外加电压V 服从欧姆定律R =V/I ;而溶液的电阻率ρ可根据(/)R A l ρ=计算。
通过测量电阻(resistance, R )和电阻率(resistivity, ρ)即可评价电解质溶液的导电能力,不同的是l 为两电极间的距离,而A 则取浸入溶液的电极面积。
习惯上多用电导(conductance ,G )和电导率(conductivity, κ)来表示溶液的导电能力,定义:G =1/R κ=1/ρ电导G 的单位是Ω-1,也记为S(西门子),κ的单位是S·m -1。
电导和电导率间的关系:l G A κ⎛⎫=⎪⎝⎭(7.3)2. 电导的测量通常采用电导率仪(conductometer )来测量电解质溶液的电导,其原理如图7.2。
测量时将电导电极(conductance electrode )插入待测溶液或将待测溶液充入具有两个固定Pt 电极的电导池(conductance cell )M 中,而后将M 连入惠斯登(Wheatstone)电桥的一臂。
测量方法与测定金属的电阻相同但技术上需做一些改进,如测量时不用直流电源而改用1000 Hz 的高频交流电源S ;以耳机或示波器T 来指示桥中零电流;在电桥另一臂的可变电阻R 1上需串联一个可变电容器K 以补偿电导池的电容。
电桥平衡时有314R R R R = 3141R G R R R ==(7.4) 溶液的电导率可按(7.3)式求算。
式中(l /A)称为电导池常数(conductance cell constant )。
不同的电导池具有不同的电导池常数,即使是同一电导池,其电导池常数也会随时间而改变。
实际测量时多用标准溶液(standard solution )法,即先将一精确已知电导率(κs )的标准溶液充入电导池,在指定温度下测定其电导(G s ),而后再将待测溶液充入该电导池测量其电导(G ),分别带入(7.3)式比较可得:ssGG κκ= (7.5) 式中不再出现电导池常数。
强电解质极限摩尔电导率的测定

一. 实验目的及要求1、理解溶液的电导、电导率和摩尔电导率的概念。
2、掌握由强电解质稀溶液的电导率测定极限摩尔电导率的方法。
3、用电导仪测定KCl溶液的摩尔电导率,并用作图外推求其极限摩尔电导。
二.实验原理1.电导、电导率与摩尔电导率(1)电导:(conductance) 物体导电的能力可用电阻R (resistance,单位为欧姆,用符号Ω表示)或电导G来表示。
G为电阻R的倒数,即G =1/R,单位为西门子(siemens),用S或Ω-1表示。
(2)电导率( conductivity ):电导率κ为电阻率ρ的倒数,即由上式可知,κ的单位是S · m-1。
其物理意义是电极面积各为1m2、两极间相距1m时溶液的电导。
其数值与电解质的种类、溶液浓度及温度等因素有关。
(3)摩尔电导率(molar conductivity) :摩尔电导率是指在相距为1m的两个平行电极之间充入含1mol电解质的溶液时所具有的电导,用公式表示为式中V m为含有1mol电解质的溶液的体积(单位为m · mol ),c为电解质溶液的物质的量浓度(单位为mol · m ),所以的单位为S · m2· mol-1。
注意:在使用摩尔电导率时,要注明所取的基本单元。
如以1mol 元电荷的量为基本单元,则(1/2CuSO4)=7.17×10S · m2· mol-1。
2. 强电解质溶液的摩尔电导率与浓度的关系柯尔劳施(Kohlrausch)根据实验结果得出结论:在很稀的溶液中,强电解质的摩尔电导率与其浓度的平方根成直线关系,即—无限稀释时的摩尔电导率Λ∞mA —常数下图为几种电解质的摩尔电导率对浓度的平方根的图。
由图可见,无论是强电解质,还是弱电解质,其摩尔电导率均随 c→0 而增大。
对于强电解质,c→0 ,离子间引力减小,离子运动速度增加,所以摩尔电导增加。
电导、电导率和摩尔电导率
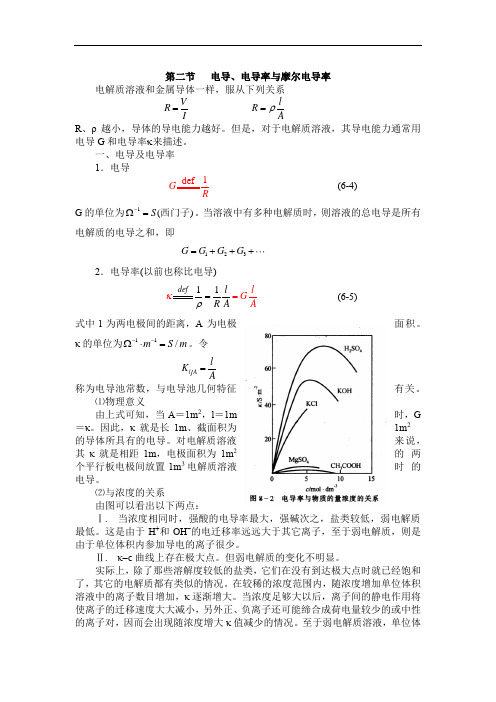
第二节 电导、电导率与摩尔电导率 电解质溶液和金属导体一样,服从下列关系V R I = l R Aρ= R 、ρ越小,导体的导电能力越好。
但是,对于电解质溶液,其导电能力通常用电导G 和电导率κ来描述。
一、电导及电导率1.电导1 def G R(6-4) G 的单位为1()S -Ω=西门子。
当溶液中有多种电解质时,则溶液的总电导是所有电解质的电导之和,即123G G G G =+++2.电导率(以前也称比电导)11def l G A l R A ρκ== (6-5)式中l 为两电极间的距离,A 为电极面积。
κ的单位为11/m S m --Ω⋅=。
令l A l K A= 称为电导池常数,与电导池几何特征有关。
⑴物理意义由上式可知,当A =1m 2,l =1m 时,G =κ。
因此,κ就是长1m 、截面积为1m 2的导体所具有的电导。
对电解质溶液来说,其κ就是相距1m ,电极面积为1m 2的两个平行板电极间放置1m 3电解质溶液时的电导。
⑵与浓度的关系由图可以看出以下两点:Ⅰ. 当浓度相同时,强酸的电导率最大,强碱次之,盐类较低,弱电解质最低。
这是由于H +和OH -的电迁移率远远大于其它离子,至于弱电解质,则是由于单位体积内参加导电的离子很少。
Ⅱ. κ-c 曲线上存在极大点。
但弱电解质的变化不明显。
实际上,除了那些溶解度较低的盐类,它们在没有到达极大点时就已经饱和了,其它的电解质都有类似的情况。
在较稀的浓度范围内,随浓度增加单位体积溶液中的离子数目增加,κ逐渐增大。
当浓度足够大以后,离子间的静电作用将使离子的迁移速度大大减小,另外正、负离子还可能缔合成荷电量较少的或中性的离子对,因而会出现随浓度增大κ值减少的情况。
至于弱电解质溶液,单位体。
第七章 电化学习题讲解

a v av av
m v mv mv
v
v
v
a m / m
7.电解质溶液的离子强度及平均活度系数的估算
(1)
I1 2
mB zB2
(2) lg =-A z+ z I
二、可逆电池
{ 1.可逆电池的条件
电池反应可逆 能量可逆
I 1 (0.00112 0.02 32 0.06112 ) 0.121 2
lg =-A z+ z I
4.Ag+1/2Cl2=AgCl反应在25℃,100kPa下进 行放热127.07kJ mol-1,若设计成可逆电池,在 可逆电池中进行,则放热32.998 kJ mol-1。该反 应的
(1)计算该化学反应的△rSm
解:
S体
QR T
4000 13.42J 298.15
K 1
mol 1
(2)当反应自发进行时(即不做电功)求环 境的熵变和总熵变
rS环
Q环 T
40000 134.2J 298.15
K 1
mol 1
S孤 S体 S环 147.6J K 1 mol1
F
96500
Ag (CN )32 / Ag
Ag / Ag
0.059lg[Ag ]
A(g CN)32- Ag+ +3CN-
Cu e Cu2 Cu e Cu
2Cu Cu2 Cu
ln K zFE RT
8.25℃时,Pt│H2(p)│HI(a)│AuI(s)│Au的电 池电动势E=0.543V,已知
7-2电导、电导率和摩尔电导率
HCl 0.966 0.930 0.906 0.833 0.798 0.769 0.811 1.011
KCl 0.966 0.927 0.902 0.816 0.770 0.652 0.607 0.577
CaCl2 0.888 0.798 0.732 0.584 0.524 0.510 0.725
-
400
HCl
增大而减小,但减小情况不同。
m/(Scm2 mol-1)
300
NaOH
200
AgNO3
(ii):强电解质:在溶液很稀时,Λm与 电解质的 c成直线关系,
m m A c
100
将直线外推至c =0时,截距为无限稀释
CH3COOH
的摩尔电导率—极限摩尔电导率
0
0.5
1.0
1.5
cB/mol dm3
例: m (NaCl) m (Na ) m (Cl)
m (BaCl2)
m (Ba2 ) 2 m (Cl )
2
m
(1 2
Ba2
)
2 m (Cl )
m (CH3COOH) m (H ) m (CH3COO)
在表示离子的无限稀释摩尔电导率时,应标明离子的基本单元
如:
m (12 Ba2 ), m (Ba2 ), m (12 SO42 ), m (Ba2 ) 2 m (12 Ba2 )
aB
a
a
a
例: 已知0.1molkg1HCl溶液的平均离子活度因子
γ±=0.795,试计算此溶液中HCl的活度及平均离子活度。
分析:利用 a b / b
a a
b
( b
b
)1/
b b
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
