羧酸及其衍生物-四川大学
第十三章羧酸及其羧酸衍生物二详解

O CH3-C-NH2
乙酰胺
-CONH2
环己烷甲酰胺
CH2(CONH2)2
丙二酰胺
-CONH2
苯甲酰胺
O CH3-C-NHCH2CH3
N-乙基乙酰胺
O H-C-N
CH3
CH3
N,N -二甲基甲酰胺
O
-C -C
NH
O
邻苯二甲酰亚胺
-CONH2 -CONH2
邻苯二甲酰胺
第四页,共四十页。
酸酐:
① 二分子相同一元酸所得的酐 叫单酐。命名在酸字后加
第二十页,共四十页。
1. 羰基的亲核取代反应
① 水解
羧酸衍生物水解都生成相应的羧酸
O
R-C-Cl
OO
反 应 速
R-C-O-C-R/
O
+ H-OH
度 R-C-OR/
递
O
增 R-C-NH2
O
R-C-OH + HCl (反应猛烈)
O
O
R-C-OH + R/-C-OH(热水立即反应)
O R-C-OH + R/-OH
(加热、加酸、 碱催化剂)
O R-C-OH
+ NH3↑
(长时间加热回 流、且加酸、 碱
催化剂)
水解活性: 酰氯 > 酸酐 > 酯 > 酰胺
O R-C-C..l >
O -C-C..l
第二十一页,共四十页。
酯水解是可逆过程,但在OH- 条件下水解生成盐,平衡破坏,
水解可进行到底。
O
NaOH
R-C-OR/ + H2O
核磁共振:
O CH3-C-Y δ= 2 ~ 3 ppm (酯、酸酐、酰卤 、酰胺)
《羧酸衍生物》课件

酰化反应
通过羧酸与醇反应,生成 酯类羧酸衍生物。
羧酸衍生物的应用领域
1
医药领域
羧酸衍生物在药物合成和制剂中具有
化工领域
2
重要应用,例如抗生素、消炎药等。
羧酸衍生物可以作为有机合成的重要
中间体和催化剂。
3
食品领域
羧酸衍生物可以用作食品添加剂和调 味剂,增加食品的口感和保鲜效果。
羧酸衍生物的生物活性
性质
羧酸衍生物具有一定的化学活性和反应性。它 们可以参与酯化、酰化、酰胺化等多种反应。
物理性质
羧酸衍生物通常呈固体或液体状态,具有一定 的熔点和沸点。它们在溶剂中的溶解性和稳定
羧酸衍生物的制备方法
酰基化反应
通过酯、醛、酮等化合物 与羧酸反应,生成羧酸衍 生物。
酰胺化反应
酰基氯与胺类化合物反应, 生成羧酸酰胺。
羧酸衍生物在生物学活性方面具有广泛的应用和研究价值,包括植物生长素、草酸途径、代谢产物等。
羧酸衍生物的前景与展望
前景
随着有机合成和化学工艺的发展,羧酸衍生物在 医药、化工、食品等领域的应用前景广阔。
展望
对羧酸衍生物的研究将为新的合成方法和新型化 合物的发现提供机会。
《羧酸衍生物》PPT课件
在这个PPT课件中,我们将深入了解羧酸衍生物的定义、结构与性质、制备 方法、应用领域、生物活性以及前景与展望。
羧酸衍生物的定义
羧酸衍生物是一类有机化合物,含有一个或多个羧酸基。它们在化学结构上与羧酸相似,但具有不同的 官能团。
羧酸衍生物的结构与性质
பைடு நூலகம்结构
羧酸衍生物的结构包括羧酸基和官能团的结合。 它们可以由酯、醛、酮等化合物通过酰基化反 应制备而成。
羧酸及其衍生物

脂肪酸
系统命名法
选择分子中含羧基的最长碳链为主链, 主链上碳原子的编号从羧基的碳原子开始,根 据主链上碳原子数目称为某酸。
系统命名
例如:
CH3 6 CH3 5 CH2 4 CH 3 CH2 2 CH2 1 COOH
4-甲基己酸
俗名(γ -甲基己酸)
不饱和羧酸选择含有“双键”和“COOH”的最长碳链为主链,从靠近“羧基” 一侧开始编号,根据主链上的碳原子数称 为“某烯酸”,并标明“双键”的位次。
RCOOH+NaHCO3
酸性大小:RCOOH>H2CO3>Ph-OH>H2O>ROH
羧酸根负离子的结构
¨ O ∶ R C ¨O ∶ ¨ R C ¨O ∶ ¨ O∶ ¨ O R C
1/2-
O
1/2-
O
0.120nm
两个碳氧键的键 长相等,为 0.127nm
H
C
0.134nm
OH
RCOONa+ HCl
+
NH3
④与格利雅试剂的反应
酰氯与格利雅试剂作用可以得到酮或叔醇。
O R C Cl + R'MgX R OMgX C R' O R C R'+ R'MgX R R' C R' OMgX H2O R R' C R' OH Cl R C O -MgXCl R'
酮
Hale Waihona Puke 叔醇④与格利雅试剂的反应
酯与格利雅试剂生成叔醇,反应很难停留在酮。
草酸具有较强的还原性。
乙二酸
重要反应:
5(COOH)2 + 2 KMnO4 + 3 H2SO4 K2SO4 + 2 MnSO4 + 10 CO2+ 8 H2O
第9章-1 羧酸

四川大学化学学院
二、羧酸的物理性质 1. 物态
C1~C3 有酸味的无色液体 C4~C9 有腐败酸臭味的油状液体 C10 以上——蜡状固体,没有气味
芳香族羧酸(ArCOOH)和脂肪族二元羧酸为结晶的固体.
四川大学化学学院
2. 沸点
与相对分子质量相近的其它类型有机物相比, 羧酸具有特 别高的沸点:
用下或加热,分子间失去一分子水生成酸酐
酐键
甲酸与脱水剂共热,分解为一氧化碳和水:
四川大学化学学院
五、六元环的环状酸酐易通过加热相应二元羧酸得到, 而不 用脱水剂。
马来酸
马来酸酐
四川大学化学学院
3.酯的生成 羧酸与醇在酸催化下加热反应生成酯和水
酯键
可逆反应
酯
常用的催化剂有硫酸、苯磺酸等
四川大学化学学院
41
四川大学化学学院
若α-位带有吸电子(-I)基团,使脱羧反应更易发生。 G = COOH, CN, C=O, NO2, CX3, C6H5 , X, C=C
四川大学化学学院
(六)二元羧酸的热分解反应 二元羧酸受热分解,根据两个羧基相对位置的不同,可 分别发生脱羧、脱水或既脱羧又脱水等反应。 乙二酸和丙二酸受热易脱羧:
CH3CO2H CH3CHCH3 CH3-CO-CH3 CH3-C=CH2
OH
CH3
MW 60
60
Bp/℃ 117.9
82.3
形成双分子氢键缔合体
58
56
56.5
-6.9
O H—O
CH3-C
C-CH3
O—H O
四川大学化学学院
问题
1. 按沸点升高排序: C2H5OH, CH3COOH, CH3CHO, HOOC-COOH
有机化学-- 羧酸及其衍生物

碱性水解
O
OH-
RC
OR'
O R C OR' OH
O R C + -OR'
OH
O
RC OH
H+
O
R C + HOR'
O-
同位素跟踪结果表明: 碱性水解时,发生酰氧键断裂。
O
O
C2H5C18OC2H5 + H2O NaOH CH3CONa + C2H518OH
碱性水解的讨论
1. 碱性水解速率与 [-OH]成正比。
OO C RO R
酸酐 carboxylic acid anhydride
RCN
腈 nitrile
➢羧酸及其衍生物的命名和物理性质 ➢羧酸及其衍生物的制备 ➢羧酸衍生物的水解、醇解和氨解 ➢羧酸及其衍生物的还原反应 ➢羧酸及其衍生物-碳的反应
羧酸及其衍生物的命名
HCO2H CH3CO2H CH3(CH2)16CO2H
(4) 在RCOOR'中, R对速率的影响是: 一级 > 二级 > 三级 R'对速率的影响是: 三级 > 一级 > 二级
CH3COOR'在盐酸中,于25OC时水解的相对速率v的 实验数据如下:
R': CH3 C2H5 CH(CH3)2 C(CH3)3
v: 1 0.97
0.53 1.15(历程不同)
2.98
CO2H OR
水杨酸: R = H O
阿司匹林: R = -CCH3
羧酸及其衍生物的制备
1. 羧酸的制备
(1)醇和醛的氧化
RCH2 OH
or O
RC H
KMnO4 or
羧酸衍生物

理论解释:
活性取决于L离去难易.
酸碱理论
酸性: HCl > RCOOH > ROH > NH3
pKa -2.2 4~5
16~19 34
共轭碱的碱性: Cl < RCOO < RO < NH2
碱性愈弱,愈易离去。
=
=
=
(一)酰基上的亲核取代
1.水解
O (C6H5)2CHCH2CCl
H2O, Na2CO3 0℃
O NH O
0oC + Br2 + NaOH
O N Br + NaBr + H2O
O
= =
N-溴代丁二酰亚胺
碱性水解
RCONH2 + H2O NaOH RCOONa + NH3
酸性水解
RCONH2 + H2O H2SO4
RCOOH + (NH4)2SO4
水解较难,环内酰胺易水解
5. 酯缩合反应-乙酰乙酸乙酯的合成 乙酰乙酸乙酯可用 Claisen 酯缩合反应合成
O
R C O R'
生成酰胺。
OO
RR
CC
++ HHCCll
NNHH22
O
R C NH2
O
+ R' C O H
OO
RR C NNHH22
+ R'CH22OH
4. 酰胺的反应
O
RC
P-π共轭
NH2
= =Hale Waihona Puke = =酰胺的弱酸碱性
显碱性 NH3
O
亚酰胺
NH
O
RNH2
O NH O
pKa 8.3
第八章羧酸及其衍生物

(2)
解: (1) CH3COOCH2CH2N+(CH3)3OH-
解:
问题 8-7按由易到难排出下列化合物的脱羧顺序:
(1) (2) (3) (4)
解:(1)>(3)>(4)>(2)
问题 8-8命名下列化合物:
解:(1)<(3)<(2)<(4)
问题 8-3按熔点由低到高排出下列化合物的顺序:
(1)乙酸 (2)丙二酸 (3)丁二酸 (4)丙酸
解:(4)<(1)<(2)<(3)
问题 8-4按酸性强弱排出下列化合物的酸性顺序:
(1)草酸 (2)己二酸 (3)丁二酸 (4)丙二酸 (5)甲酸
第八章 羧酸及其衍生物
一、 学习要求
1. 羧酸是有机化合物酸性物质的代表,应掌握其结构和性质的关系及命名。
2. 掌握羧酸衍生物的结构和化学性质。
3. 了解羧酸衍生物的酰基取代反应机制。
4. 了解羧酸及其衍生物的分类方法和在医药卫生保健事业中的重要性。
二、 本章要点
(一) 羧酸
(二) 羧酸酸衍生物
1.结构和命名 羧酸衍生物的结构特点是均含有酰基,因此它们又称为酰基化合物,其通式用
表示。酰卤和酰胺的命名是根据酰基的名称而称为某酰卤、某酰胺;酯的命名是先酸后醇即某酸某醇酯;酸酐的名称是生成酸酐的酸后加酐,即某酸酐。
2.化学性质
(1)亲核取代反应及反应机制:羧酸衍生物的典型化学性质是水解、醇解和氨解,其取代产物可以看作羧酸衍生物中的酰基取代了水、醇(酚)中羟基氢原子和氨(伯、仲胺)中氮上的氢原子,形成羧酸、酯和酰胺,其反应通式为:
(CH3CO)2O CH3COOC2H5 CH3COCl CH3CONH2
第9章-2 羧酸衍生物
催化氢化
四川大学化学学院
催化氢化
四川大学化学学院
三、碳酸衍生物
碳酸是不稳定的二元酸。碳酸的单酯或单酰胺等 均不稳 定,但碳酸双衍生物很稳定,是合成药物的原料。
碳酸酯
光气
脲
四川大学化学学院
(一) 脲(尿素) 1. 弱碱性 不能使石蕊试纸变色, 只能与强酸成盐。
尿素与硝酸生成不溶性盐, 由尿中分离尿素。 2. 与亚硝酸反应——定量测定尿素的常用方法之一
64
四川大学化学学院
亲核取代反应
羧酸衍生物可以在酸性和碱性条件下与许多亲核试剂发生 酰基亲核取代反应;取代过程中经历了亲核加成和消除反 应两个步骤。
加成
消去
羧酸衍生物在碱性条件下的亲核取代反应通式
:L- = Cl-; Br-; RCOO-; RO-; H2N- ; RHN-; R2N-
65
四川大学化学学院
δ-己内?酯
54
四川大学化学学院
四、酰胺的命名
伯酰胺:“酰基名” + “胺”
仲酰胺:“N-某基” + “酰基名” + “胺” 叔酰胺:N,N-二某基某酰胺; N-某基-N-某基某酰胺
O CH3-C-NH2
O C-N CH3
H
伯酰胺
仲酰胺
乙酰胺
N-甲基苯甲酰胺
O
H-C-N
CH3 CH3
叔酰胺
N,N-二甲基甲酰胺
四川大学化学学院
叔醇形成的酯酸催化水解:
质子化羰基
+ 叔碳正离子中间体
SN1
四川大学化学学院
(二)醇解——与醇作用生成相应的酯
(很快反应,碱可催化)
反
..
应
《羧酸及其衍生物 》课件

沸点和熔点
羧酸通常具有较高的沸点和熔 点,这取决于分子间的氢键形 成。
酸性
羧酸在水中可与碱发生中和反 应,产生相应的盐。
羧酸的化学性质
酯化反应 氧化反应 酰化反应
羧酸与醇反应生成酯,常用于合成香料和涂料。
羧酸可以被氧化剂氧化为相应的醛、酮或羧酸。
羧酸与胺类化合物反应生成酰胺,常用于药物合 成。
羧酸衍生物的合成方法
农业工业
在食品工业中,羧酸及其盐被用作防腐剂和增味剂。
羧酸衍生物被广泛用于制备农药和肥料,以提高农 作物的产量和质量。
结论和总结
通过本课件,我们了解了羧酸及其衍生物的基本概念、结构与分类、物理性质、化学性质、合成方法以及应用 领域。希望这些内容对大家的学习和工作有所帮助。
1
卤代羧酸
通过将羧酸与卤化物反应,生成相应的卤代羧酸。
2
酸酐
通过羧酸与酸性还原剂反应,生成相应的酸酐。
3
酯化反应
通过羧酸与醇反应,生成相应的酯。
羧酸及其衍生物的应用领域
化学工业
羧酸及其衍生物广泛用于制备染料、塑料和涂料等 化学产品。
制药工业
羧酸衍生物被广泛应用于药物合成和药物交付系统 的设计。
食品工业
《羧酸及其衍生物》PPT 课件
本课件将介绍羧酸及其衍生物的基本概念、结构与分类、物理性质、化学性 质、合成方法以及应用领域,旨在通过生动的内容让大家更好地理解羧酸及 其衍生物。
羧酸的基本概念
羧酸是一类分子中含有羧基(-COOH)的有机化合物,具有酸性。它们在许多生物和化学过程中起着重要的作 用。
羧酸的结构与分类
脂肪酸
由长链烃基与羧基组成,常见于天然油脂和脂 肪中。
羧酸盐
第八章羧酸及其衍生物-四川大学

第七章醛酮醌一、学习要求1.掌握醛酮的结构及命名。
2.掌握醛酮的主要化学性质及异同点。
3.了解醌的结构、命名和化学性质。
二、本章要点(一)醛和酮1.结构醛和酮分子中均含有羰基。
羰基与氢和烃基相连(甲醛除外)的有机化。
羰基与两个烃基相连的有机化合物称为酮,通式为。
羰基中碳原子为SP2杂化,由于氧的电负性较大,因此羰基是极性不饱和基团。
2.命名IUPAC法是选择含羰基的最长碳链作母体,从羰基碳原子开始给主链编号,根据主链碳原子数称为某醛或某酮。
对于酮,还要标明酮基的位次,以此作为母体名。
再将取代基、双键或叁键的位置编号和名称写在母体名称前。
3.物理性质在常温下,除甲醛为气体外,其它醛、酮为液体或固体。
醛、酮是极性分子,分子之间存在着偶极-偶极之间的相互作用,从而使醛、酮的沸点高于相对分子质量相近的烷烃和醚。
醛、酮分子中羰基氧原子可与水分子中的氢原子形成氢键,故含碳数较低的醛、酮易溶于水,但随着分子中烃基碳原子数增多,水中的溶解度逐渐降低。
4.化学性质羰基是极性不饱和基团,可发生亲核加成。
又由于羰基的-I效应,使α-H有一定活性,可发生一些反应。
(1)亲核加成:羰基中碳原子带部分正电荷,易受到亲核试剂的进攻而发生加成反应。
反应通式为:CRR'δδ+-:A CRR'Nu-CRR'NuO A+羰基亲核加成反应的活性大小,主要取决于羰基碳上连接的原子或原子团的电子效应和空间效应。
羰基碳原子上的正电性越强,亲核反应越易进行;羰基所连的烃基越多或体积越大,反应越难进行。
不同结构的醛、酮进行亲核加成时,反应活性次序为:①与氢氰酸加成:醛、脂肪族甲基酮和小于8个碳原子的环酮能与氢氰酸加成,生成α-羟基腈(又称为α-氰醇)。
②与亚硫酸氢钠加成:醛、脂肪族甲基酮以及8个碳以下的环酮可与饱和亚硫酸氢钠溶液(40%)作用,生成α-羟基磺酸钠。
③与醇加成:在干燥氯化氢的催化下,醛能和一分子醇发生亲核加成,生成不稳定的半缩醛,再继续与一分子醇脱水而生成稳定的缩醛。
四川大学华西药学院《有机化学(II)-1,2》教学大纲

《有机化学(II)-1,2》(药物化学专业)教学大纲一、课程基本信息课程名称( 中、英文): 有机化学Ⅱ-1[Organic Chemistry Ⅱ-1]有机化学Ⅱ-2[Organic Chemistry Ⅱ-2]课程号( 代码) :,课程类别: 类级平台课程,必修课学时:64+48学分:4+3先修课程:《无机化学》、《分析化学》基本面向:药物化学专业二、教学目的及要求有机化学与药学渊源深厚。
该课程要求药物化学专业的学生系统地、扎实地掌握有机化学的基本理论和基本规律,为后续课程的学习以及继续深造,为将来利用有机化学,服务药学奠定坚实的基础。
通过有机化学的教学,把有机化学与药学紧密结合起来,进一步加强对学生解决问题、分析问题和提出问题的能力培养。
在学习该课程时学生要着重掌握各类有机化合物的结构、命名、物理性质、光谱性质、常用制备方法和用途。
紧紧抓住结构与性能的关系,深入理解各类有机化合物的典型反应的规律,机理,立体化学。
三、教学内容1 前言(4学时)基本要求:一、了解有机化学的发展史、主要任务和学习方法;二、了解有机化合物的基本特点、分类和反应类型;三、了解共价健的本质,掌握共价健的属性,熟悉利用键能数据推算反应的焓变;四、掌握下述名词术语:有机化学;同分异构现象;分子间作用力;Van der walls 力;官能团1-1 有机化学的由来和发展1-2 有机化合物的特点:分子结构和组成(同分异构现象,结构的表示方法);理化性质1-3 共价键的键参数:键能、键长、键角;键的极性与诱导效应;键的可极化性1-4 共价键的断裂方式与有机反应的类型1-5 有机化合物的分类1-6 学习有机化学的目的和学习方法2 烷烃和环烷烃(6学时)基本要求:一、了解烷烃的物理性质,掌握烷烃的命名规则。
二、掌握构象的表示方法和典型的构象ap, sp, sc, ac 的稳定性分析;三、了解饱和碳原子的sp 3 杂化轨道与烷基自由基的sp 2 杂化轨道的形成与构型;四、着重掌握烷烃的自由基取代反应(卤代反应)的基本规律(区域选择性)和反应机理(自由基反应),五、弄清下列概念:同系列与同分异构;构造异构与链异构;T.S 与活泼中间体;扭转张力与Van der Walls 张力;Newman 投影式与透视式;活性与选择性;Baeyer 张力;船式与椅式构象2-1 烷烃的同系列与同分异构现象(键异构)2-2 烷烃和命名:习惯命名;系统命名(采用1980 年中国化学会有机化学命名原则)衍生物命名与俗名2-3 烷烃的结构:CH 4 的正四面体结构与sp 3 杂化轨道;烷烃的构象2-4 烷烃的物理性质2-5 烷烃的反应:烷烃的卤代反应(CH 4 的氯代反应及自由基反应历程);卤代反应中卤素的活性与选择性;氧化反应(燃烧与部分氧化);热裂反应2-6 烷烃自由基的立体化学(sp 2 杂化)2-7 环烷烃的分类、异构与命名2-8 环烷烃的物理性质2-9 环烷烃的化学反应2-10 拜尔张力学说与近代观点2-11 环烷烃的构象(环丙烷、环己烷及其衍生物、十氢萘)3 立体化学- 对映异构(6学时)基本要求:一、掌握对称因素与手性的关系;二、掌握Fischer 投影式的书写规则,并能熟练地掌握R/S 的命名法,正确地判断手性中心的构型;三、弄清下列概念:对映异构体和非对映异构体;手性和旋光性;旋光度与比旋光度;内消旋体和外消旋体;手性与对称因素,手性中心与手性分子;赤式与苏式;外消旋化与内消旋化3-1 手性现象3-2 平面偏振光与物质的光活性:平面偏振光;物质的光活性;旋光度与比旋光度3-3 手性与对称因素(对称面、心、轴,更迭对称轴)3-4 手性分子构型表示方法与命名结构表示法(透视式与投影式)命名(R 、S ,赤式与苏式,次序规则)3-5 含两个手性碳原子的化合物3-6 含三个手性碳原子的化合物3-7 其它手性分子4 卤代烃(8学时)基本要求:一、重点掌握卤代烃的三类反应:亲核取代、消去反应与活泼金属的反应以及前两类反应的极端历程的描述和特征(动力学特征、立体化学特征等);二、掌握影响S N 1 ,S N 2 ,E1 ,E2 历程的影响因素及其规律(判断反应的历程);三、熟练掌握消去反应的规律——Saytzev 烯和Hofman 烯;四、熟练掌握Grignard 试剂的制备和应用,了解RLi ,R 2 CuLi ,RNa 等的形成与应用;五、掌握下述概念:亲核剂;溶剂解;氢解;Walden 转化;两可离子;邻基参与与邻位促进4-1 卤代烃的分类、异构与命名4-2 卤代烃的化学反应一.亲核取代反应:碳亲核剂的反应;氧亲核剂的反应;氯亲核剂的反应硫亲核剂的反应;卤亲核剂的反应二.卤代烷SN 反应的历程和立体化学(S N 1 、S N 2 )三.影响SN 反应的因素:R 的结构;L 离去基团;Nu 的亲核性;溶剂四.芳卤的SN 反应(Meisenheimer 络合物,苯炔历程)五.卤代烃的消去反应:β- 消去的历程(E1 ,E2 ,E1cb )影响因素;定向规律六.卤代烷与金属的反应:格氏试剂及其反应;类格氏试剂及其反应七.卤代烃的还原八.多卤代烃与α- 消去反应九.分子内的SN 反应与邻基参与5 烯烃(10学时)基本要求:一、掌握烯烃和环烷烃的顺反异构现象和E/Z 命名法;二、掌握烯烃的各类反应,重点掌握其反应规律及离子型亲电加成反应的历程;三、了解环烷烃的性质和构象,掌握环丙烷和环已烷的构象及其理论解释;四、掌握下述概念:Markovnikov 规则与过氧化物效应;立体选择性反应与立体与一性反应;亲电剂;亲电反应;氢化热与燃烧热;5-1 烯的结构5-2 烯烃的异构与命名:烯烃的异构(位置、顺反异构);命名(Z 、E 命名法)5-3 烯烃的物理性质5-4 烯烃的化学反应;烯烃与卤素的加成反应与亲电加成反应的历程[ 立体选择性] 与立体专一性;烯烃与无机酸的亲电加成反应(Markovnikov 规则);烯烃与H 2 O 的反应;烯烃与HOX 的反应;烯烃的聚合反应;硼氢化一氧化反应;溶剂汞化一去汞化反应;烯烃的还原与氧化反应;烯烃的自由基加成反应;烯烃的α-H 反应5-5 烯烃的制备;醇脱水(Saytzev 规律)和卤代烃脱HX (Hofmann 规律)6 炔烃与二烯烃(6学时)基本要求:一、掌握炔烃的亲电加成反应、氧化还原和炔氢的反应,了解亲核加成、聚合反应等;二、掌握共轭二烯的亲电加成反应规律和共轭二烯的Diels-Alder 反应;三、掌握下述概念:共轭效应与诱导效应;双烯组分与亲双烯组分;乙烯基化反应与乙炔基化反应;速度控制与平衡控制;1 ,2- 加成与共轭加成6-1 炔烃的结构、异构和命名6-2 炔烃的化学反应:加成反应(亲电加成);炔烃与含活泼氢化物反应(亲核加成、乙烯基化);氧化与还原反应(Lindlar 催化剂);炔氢的反应(酸性、亲核取代、乙炔基化反应);乙炔的聚合反应6-3 炔烃的制备6-4 二烯烃的分类与多烯烃的命名6-5 共轭二烯烃的结构与π、π共轭效应6-6 其它类型的共轭效应(P- π、P-P 、σ- π、σ-P )6-7 共轭二烯烃的反应:与H 2 和HX 的反应(动力学和热力学控制反应)加H 2 ;游离基加成反应;Diels-Alder 反应;聚合反应6-8 共轭二烯烃的制备7 芳烃(8学时)基本要求:一、掌握苯系芳烃的亲电取代反应类型(卤代;硝化;磺化;付一克烷化与酰化)、历程和定位规则,能充分利用电子效应和共振论来解释其规律;二、掌握侧链上的氧化与卤代反应规律,了解芳环被催化氢化,催化氧化,Birch 还原的规律;三、掌握萘及一取代萘的亲电取代反应和蒽、菲的特性;四、掌握Huckel 规律与芳香性判断;五、掌握下述概念和人名反应:共振论和Kekule 结构;活化基与钝化基;邻对位定位基与间位定位基;同位素效应;空间效应;Friedel-Crafts 烷化和酰化;Clemensen 还原;Haworth 合成法7-1 芳烃的分类和命名7-2 苯的结构:苯的特性与Kekule 结构;苯结构的描述(MO 和共振论)7-3 苯系芳烃的亲电取代反应的反应历程:卤代;硝化;磺化;付一克烷化与酰化7-4 芳环上的亲电取代反应的定位规则及其应用:定位规律及理论解释;苯二元取代物再取代的定位规律;定位规律的应用7-5 氧化(苯环上氧化,侧链氧化)7-6 游离基反应(环的加成,侧链卤代)7-7 萘的结构与衍生物的命名7-8 萘的化学反应;亲电取代(定位规则);氧化与还原7-9 蒽、菲的特性7-10 致癌烃7-11 非苯芳烃:芳香性的条件(Huckel 规则);几个典型碳环非苯芳香族化合物(环丙烯正离子,环戊二烯负离子,环庚三烯正离子,篮烃,杯烯、轮烯)8 醇、醚(6学时)基本要求:一、了解醇、醚的结构的共性、命名与物理性质及一些主要合成法;二、掌握醇的亲核取代反应和消去反应的规律,了解醇氧化和掌握邻二醇的特性;三、掌握不对称醚的醚键断裂规律和酸碱作用下的环醚开环规律;四、弄清下述试剂与反应的体质:Lucas 试剂;Sarett 试剂;Oppenmer 氧化法;Williamenson 醚合成;Pinacol 重排;Wagner-meerwein 重排;Fries 重排8-1 醇的分类和命名8-2 醇的结构与物理性质8-3 醇的化学性质:酸性、碱性、亲核性(与R-X 反应,与ROH 反应,与RCOOH 反应,与TsCl 和无机酰卤反应,与CS 2 反应)与无机酸反应;消去反应;醇的氧化8-4 邻二醇的特性(氧化与重排)8-5 醇的制备8-7 醚(分类,命名,反应,制备)8-8 硫醇和硫醚:命名;物理性质;化学性质9 醛、酮(8学时)基本要求:一、重点掌握羧基上的各种亲核加成反应的规律及历程,注意Cram 规则的立体化学问题;二、掌握醛、酮的α-H 的反应历程;三、了解插烯原理,掌握α、β- 不饱和醛酮的共轭加成规律及意义;四、搞清下列名称反应:Aldol 反应;Claisen-Schmidt 缩合;Mamich 反应;Wittig 反应;Baeyer-Villiger 反应;Wolff-Kisher- 黄鸣龙反应;Michael 反应;Robinson 反应;Cannizzaro 反应9-1 醛酮的分类与命名9-2 醛酮羰基上的亲核加成反应——加HCN 、NaHSO 3 ,有机金属化合物,H 2 O ,LiAlH 4 ,NaBH 4 ,PCl 5 等和立体化学;与氨及氨衍生物的反应(肟、腙、缩氨脲),与醇的加成缩合反应——半缩醛(酮)、缩醛(酮)的生成,醛(酮)的Wittig 反应、Mannich 反应、安息香缩合;9-3 醛酮α-H 的反应:酮- 烯醇互变,卤代与卤仿反应,aldol 反应;9-4 醛酮的氧化与还原:醛酮的一般氧化,Baeyer-Villiger 氧化和Riley 氧化;Cannizzaro反应;还原成醇(催化氢化和金属氢化物和金属还原);还原成烃基(Clemensen 还原,Wolff-Kisher- 黄鸣龙还原)9-5 醛、酮、的制备9-6 不饱和醛、酮(插烯原理与共轭加成)10 酚、醌(4学时)基本要求:一、掌握酚的结构、反应和制备方法;二、掌握醌的结构特征和对体醌的基本反应;三、弄清Reimer-Tiemann 反应;Kolbe 反应;10-1 酚的结构和命名10-2 酚的化学反应(酸性,氧上的烷化与酰化,显色反应,芳环上的反氧化与还原,10-3 酚的制备(磺化法、氯苯水解法、异丙苯法等)10-4 醌的分类与命名10-5 对苯醌的反应10-6 醌的制备11 羧酸及取代羧酸(6学时)基本要求:一、重点掌握羧酸羰基碳上的亲核取代反应,熟悉取代羧酸的特性;二、了解羧酸的结构对酸性的影响,羧酸的脱酸与还原反应,羧酸的α-H 的反应;三、适当的掌握卤代酸、酚酸、醇酸的特有反应。
第一节羧酸衍生物
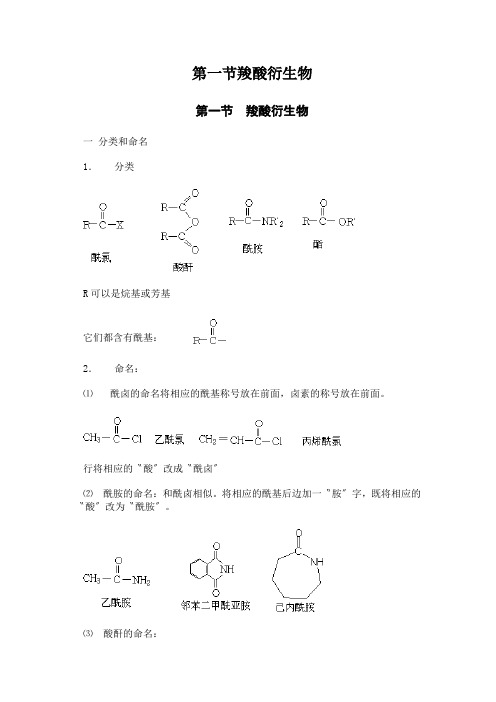
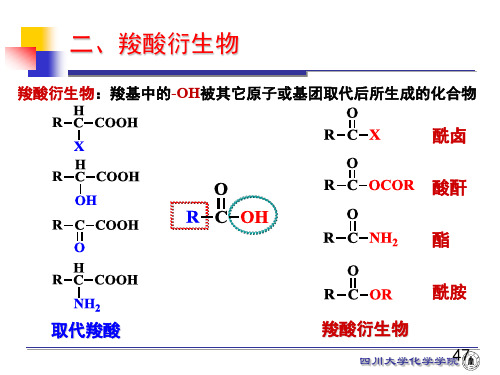
第一节羧酸衍生物第一节羧酸衍生物一分类和命名1.分类R可以是烷基或芳基它们都含有酰基:2.命名:⑴酰卤的命名将相应的酰基称号放在前面,卤素的称号放在前面。
行将相应的〝酸〞改成〝酰卤〞⑵酰胺的命名:和酰卤相似。
将相应的酰基后边加一〝胺〞字,既将相应的〝酸〞改为〝酰胺〞。
⑶酸酐的命名:①由二分子相反的一元羧酸脱水构成的酸酐称为单酐,它们的命名,可在原来的羧酸称号之后加一〝酐〞字来称谓,〝酸〞字也可以省略。
Acetic anhydride②由二分子不相反的一元羧酸脱水构成的酸酐称为混酐。
它们的命名,可把复杂的或低级的羧酸称号放在前面,复杂的或初级的羧酸称号放在前面〔即按甲、乙、丙…顺序,英文按字母顺序〕,两者的中间加一逗点分开〔也可省略〕,再加一〝酐〞字来称谓。
③环状酸酐,一分子的二元酸或多元以上的多元酸,它们脱水后可生成环状酸酐。
命名时,可在二元酸的称号后加一〝酐〞字。
⑷酯的命名:把酸的称号放在前面,烃基的称号放在前面,在加一〝酯〞字。
二.羧酸衍生物的光谱性质1.IR:醛、酮、羧酸、酰卤、酸酐、酯和酰胺都含有羰基,因此,在IR 都有C=O的强吸收峰。
1705~1740cm-1醛、酮的νC=O羧酸衍生物的C=O伸缩振动扩展到了1550~1928 cm-1.这是由于:-I效应使波数降低。
+C效应使波数降低。
降低了C=O的极性。
供电子作用而使C=O的双键性降低。
添加了C=O的双键性。
吸收频率的波数降低。
波数增高。
酰卤:νC=O ~1800cm-1 νC=O~1920cm-1酸酐:在1800-1860cm-1(强)和1750-1800cm-1〔强〕区域有两个C=O伸拉振动吸收峰,这两个峰往往相隔60cm-1左右。
关于线形酸酐,高频峰较强于低频峰,而环状酸酐那么反之。
另外:C—O的伸拉振动吸收在1045~1310/cm〔强〕。
酯:酯的C=O伸缩振动稍高于酮,在1735~1750cm-1处,与芳基相连的那么降至1715~1730 cm-1,酯在1015~1300 cm-1区域内有两个强的C—O伸缩谱带。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章醛酮醌一、学习要求1.掌握醛酮的结构及命名。
2.掌握醛酮的主要化学性质及异同点。
3.了解醌的结构、命名和化学性质。
二、本章要点(一)醛和酮1.结构醛和酮分子中均含有羰基。
羰基与氢和烃基相连(甲醛除外)的有机化。
羰基与两个烃基相连的有机化合物称为酮,通式为。
羰基中碳原子为SP2杂化,由于氧的电负性较大,因此羰基是极性不饱和基团。
2.命名IUPAC法是选择含羰基的最长碳链作母体,从羰基碳原子开始给主链编号,根据主链碳原子数称为某醛或某酮。
对于酮,还要标明酮基的位次,以此作为母体名。
再将取代基、双键或叁键的位置编号和名称写在母体名称前。
3.物理性质在常温下,除甲醛为气体外,其它醛、酮为液体或固体。
醛、酮是极性分子,分子之间存在着偶极-偶极之间的相互作用,从而使醛、酮的沸点高于相对分子质量相近的烷烃和醚。
醛、酮分子中羰基氧原子可与水分子中的氢原子形成氢键,故含碳数较低的醛、酮易溶于水,但随着分子中烃基碳原子数增多,水中的溶解度逐渐降低。
4.化学性质羰基是极性不饱和基团,可发生亲核加成。
又由于羰基的-I效应,使α-H有一定活性,可发生一些反应。
(1)亲核加成:羰基中碳原子带部分正电荷,易受到亲核试剂的进攻而发生加成反应。
反应通式为:CRR'δδ+-:A CRR'NuO-CRR'NuO A+羰基亲核加成反应的活性大小,主要取决于羰基碳上连接的原子或原子团的电子效应和空间效应。
羰基碳原子上的正电性越强,亲核反应越易进行;羰基所连的烃基越多或体积越大,反应越难进行。
不同结构的醛、酮进行亲核加成时,反应活性次序为:①与氢氰酸加成:醛、脂肪族甲基酮和小于8个碳原子的环酮能与氢氰酸加成,生成α-羟基腈(又称为α-氰醇)。
②与亚硫酸氢钠加成:醛、脂肪族甲基酮以及8个碳以下的环酮可与饱和亚硫酸氢钠溶液(40%)作用,生成α-羟基磺酸钠。
③与醇加成:在干燥氯化氢的催化下,醛能和一分子醇发生亲核加成,生成不稳定的半缩醛,再继续与一分子醇脱水而生成稳定的缩醛。
酮较难发生此反应。
④与水加成:醛、酮可与水加成形成水合物,但这种水合物是一种同碳二元醇化合物,极不稳定,很易失水又形成羰基,因此反应平衡主要偏向反应物一方。
若羰基与强的吸电子基团相连,羰基碳上的正电性增大,则可以与水加成形成较稳定的水合物。
⑤氨的衍生物加成:所有羰基化合物均可与氨的衍生物加成,但加成产物很不稳定,易发生分子内脱水,生成含有碳氮双键的化合物。
(2)α-活泼氢的反应①羟醛缩合反应:在稀碱作用下,有α-氢的醛可发生羟醛缩合反应,生成β-羟基醛,反应的结果使主碳链增长两个碳原子。
含有α氢的酮在碱催化下也能发生羟酮缩合反应,但酮的羟酮缩合反应比醛难。
②卤代反应和卤仿反应:在碱催化下,醛、酮的α-氢容易被卤素(Cl 2、Br 2 、I 2)取代,生成α-多卤代醛、酮。
具有三个α-氢结构的化合物,在碱性条件下,与卤素作用或与次卤酸钠溶液作用时,甲基上的三个α-氢都会被卤素取代,生成α-三卤代醛、酮,三卤代醛、酮在碱溶液中发生碳碳键断裂,生成卤仿和少一个碳原子的羧酸盐,此反应称为卤仿反应。
此外具有 结构的醇也能发生卤仿反应。
(3)还原反应: 醛、酮分子中的羰基可以被还原,但所用还原剂不同,生成的产物也不同。
在金属铂、镍和钯催化下与氢气作用时,羰基被还原成醇羟基,若分子中有其他不饱和基团,将同时被还原。
用金属氢化物(氢化铝锂 LiAlH 4,氢硼化钠NaBH 4)还原醛或酮时,羰基被还原成CH 3CH R OH(H)C O HHC O HCH C O HC 6H 5C O CH CH 3OC O C 6H 5CH 3C O C 6H 5C 6H >>>>>>醇羟基,这些金属氢化物具有选择性,它只还原羰基,而不影响分子中的碳碳双键和叁键。
醛、酮与锌汞齐和浓盐酸一起回流,羰基被还原成亚甲基。
(4)歧化反应:在浓碱作用下,不含α氢原子的醛可发生分子之间的氧化还原反应,结果一分子醛被氧化成羧酸盐,另一分子醛被还原成醇,此反应又称康尼查罗反应。
(5)醛、酮的鉴别反应:醛、酮的许多化学性质基本相同,但在氧化反应中却有较大差别。
醛基上的氢对氧化剂比较敏感,极易氧化。
而酮只有在剧烈氧化条件下才发生碳链断裂,生成分子量较小的羧酸混合物。
一些弱的氧化剂如Tollens 试剂能将所有醛氧化成羧酸;Fehling 试剂能将脂肪醛氧化成羧酸,而酮和苯甲醛不被氧化。
因此可用弱氧化剂来鉴别醛、酮。
醛可与Schiff 试剂作用显紫红色,酮则不显色。
醛与Schiff 试剂作用后的紫红色溶液里加入浓硫酸,甲醛不褪色,而其他醛紫红色要褪去,这可用作鉴别甲醛。
(二)醌1.醌的结构 醌是具有共轭体系的环已二烯二酮类化合物,有对位和邻位两种基本醌型结构,无间位醌型结构。
2.醌的命名 醌类化合物的命名以相应芳香基为母体,两个羰基的位置用阿拉伯数字注明,也可用邻、对、远、α、β等标明。
3.醌的化学性质(1)加成反应:醌中的碳碳双键可以与卤素(Cl 2、Br 2)等亲电试剂发生加成。
对苯醌的羰基可与一些亲核试剂发生加成反应。
对苯醌可与氯化氢或氢氰酸发生共轭1,4-加成反应。
(2)氧化还原反应: 对苯醌与对苯二酚可以通过还原与氧化反应互相转变。
三、 问题参考答案 问题7-1 用系统命名法命名下列化合物。
解: (1)5-甲基-3-庚酮 (2)3-苯基2-丁酮(3)4-甲基-1,3-环己二酮问题7-2 试设计一种将苯酚、环己醇、环己酮的混合物中各组份分离纯化的方法。
解:在混合物中加入饱和NaHSO 3溶液,环己酮与之生成加成产物——白色的α-羟基磺酸钠晶体而析出,过滤沉淀,在沉淀中加酸分解加成产物而析出环己酮。
再在滤液中加入NaOH 溶液,苯酚将成钠盐溶于水层,然后用分液漏斗分离,在水层中加稀H 2SO 4O OCH 3(1)(2)(3)CH 3CH 2 C CH 2 CH CH 3OCH 2CH 3CH C CH 3O CH 3酸化。
即析出苯酚。
问题7-3 写出甲醛、苯乙酮分别与2,4-二硝基苯肼、氨基脲加成反应的反应式。
解:问题7-4 分别写出丙醛在碱催化下羟醛缩合的产物,甲醛与等摩尔苯乙酮在碱催化下羟醛缩合的产物。
解:问题7-5 下列化合物中,哪些可以发生碘仿反应。
(1)乙醇 (2)1-丙醇 (3)异丙醇 (4)2-丁醇 (5)丙醛 (6)苯乙酮 (7)3-戊酮 (8)甲基环己基甲酮解答:(1)(3)(4)(6)(8)问题7-6 下列化合物中,哪些能发生Cannizzaro 反应?(1)环戊基甲醛 (2)2-甲基-2-苯基丙醛 (3)3-甲基丁醛 (4) 苯乙醛 (5)2,2-二甲基丁醛 解答:(2)(5)HCHO + C CH 3O 稀OHCH 2 CH 2 C OOHCH 3CH 3HCHO +NO 2NO 2H 2NNH CH 2 N NO 2NO 2NHHCHO +NH 2NHCNH 2OCH 2 NNHCNH 2OC CH 3O NO 2NO 2H 2NNHN NO 2NO 2NH +C CH 3C CH 3O +NH 2NHCNH 2ONHCNH 2ON C CH 32CH 3CH 2CHOCH 3CH 2CHCHCHOCH 3OH四、习题参考答案1.用IUPAC 法命名下列化合物。
解答:(1)3-甲基戊醛 (2)环戊基乙酮 (3)对-甲氧基苯甲醛(4)3,7-二甲基-6-辛烯醛 (5)丙醛缩二乙醇 (6)环己酮肟 (7)3-(3’,3’-二甲基环己基)丙醛 (8) 邻苯醌2.写出下列化合物的结构式。
(1) 间羟基苯乙酮 (2) 苯基苄基甲酮 (3)丁酰苯(4) α-氯代丁醛 (5) 甲醛苯腙 (6) 2-乙基-1,4-萘醌 (7) 3-苯丙烯醛 (8) 3-(间羟基苯基)丙醛 解:CH 3CHCH 2CHOCH 2CH 3C CH 3O CH 3(1)(2)(3)(4)1CH 2 CO23CH 3CH 2CH 2CO45C NNH HH2H 563CH 3CH 2CHCHOCl( )( )( )( )( )( )CH 3CH 2 C HOC 2H 5OC 2H 5N OH(5)(6)(7)(8)2CH 2CHOH 3H 3OO3.写出下列反应的主要产物。
⑴(6)(7)CHO +CH 3OH 干燥HClCH 3CHCHOCH 3稀OH-2CHO78( )( )CHO+ (CH 3)2C OOH(2)(3)CH 3COCH 2CH 2CHO222+CHOCH 3O(8)(1) HCOONa + (CH 3)3CCH 2OH(2)CH CH C CH 3O (3)CH 3CCH 22NNH NNH222解:CH 2CH 2CHO (4)CH 3CHCH 23OOH 2(5)4.下列化合物中,哪些化合物可与饱和NaHSO 3加成?哪些化合物能发生碘仿反应?哪些化合物两种反应均能发生?解:可与饱和NaHSO 3加成的化合物有:(1)、(2)、(4)、(5)、(8)能发生碘仿反应的化合物有:(1)、(3)、(7)、(9) 两种反应均能发生的化合物有:(1) 5.按亲核加成反应活性次序排列下列化合物。
解:(3)、(6)、(1)、(5)、(2)、(4) 6.用化学反应方程式表示下列反应 (1) 环己酮与羟胺的缩合反应。
(2) 异丙醇与碘的氢氧钠溶液反应。
(3) 2-丁烯醛用铂催化加氢。
(1)CH 3COCH 2CH 3(2) CH 3CH 2CH 2CHO (3) CH 3CH 2OH (4)(5)O(6) CH 3CH 2COCH 2CH 3(7) CH 3CHOHCH 2CH 3(8) (CH 3)3CCHO3(9)(1)CH 3CHO (2) CH 3COCH 3 (3) CF 3CHO 3(4)(5)(6) HCHO(5)(6)NaOOCCH 2COONa + 2 CHI 3CH CHCH 3OCH 3OOCH 3OCH 32CH 2COOH(4)CH 3CH CH CCHOCH 3CH 3CH 3(7)OH |CH 3CH 3O(8)(4) 丁醛在稀碱溶液中,然后加热。
(5) 丙醛与乙二醇,干HCl 催化。
解:7.用化学方法鉴别下列各组化合物。
(1) 乙醇、丙酮、正丙醇 (2) 甲醛、乙醛、丙醛、苯乙酮 (3)苯甲醛、苯乙醛、丙酮 (4)2-戊酮、3-戊酮 、环己酮 解:(1)O+ NH 2 OHN OH(2)CH 3 CH CH 3OH+ I 2 + NaOHNaOOCCH 3 + CHI 3(3)CH 3 CH CH CHO + H 2PtCH 3CH 2CH 2CH 2OH(4)CH 3CH 2CH 2CHOCH 3CH 2CH 2CH C CHOCH 2CH 3(5)CH 3CH 2CHO + HOCH 2CH 2OH干HClCH 3CH 2CHO CH 2O CH2乙醛丙醛苯乙酮Ag ( - )(2)2 CHI 黄色( - )甲醛( - )甲醛丙醛Schiff 试剂①浓硫酸②紫红色不褪去紫红色褪去A.甲醛乙醛丙醛B.C.乙醇丙酮正丙醇(1)2 CHI 黄色( - )CHI 黄色( - )A. B.乙醇丙酮8.由指定原料(其它试剂任选)合成目标化合物。
