无机化学武大吉大第三版答案_31-45
武汉大学、吉林大学《无机化学》(第3版)(上册)配套题库【名校考研真题】【圣才出品】

5.一混合理想气体,其压力、体积、温度和物质的量分别用 p、V、T、n 表示,如果 用 i 表示某一组分的气体,则下列表达式中错误的是( )。[华东理工大学 2007 研]
3 / 70
圣才电子书
A.pV=nRT;
十万种考研考证电子书、题库视频学习平台
B.piV=niRT;
C.pVi=niRT;
D.piVi=niRT
【答案】D
【解析】利用理想气体状态方程、道尔顿分压定律以及阿马加分体积定律。
6.323 K 时,液体 A 的饱和蒸气压是液体 B 的饱和蒸气压的 3 倍,A,B 两液体形成 理想液态混合物,气液平衡时,在液相中 A 的物质的量分数为 0.5,则气相中 B 的物质的量 分数为( )。[中国科学技术大学 2004 研]
A.3,0,1,- 1 2
6 / 70
圣才电子书
B.2,-1,0, 1 2
十万种考研考证电子书、题库视频学习平台
1
C.4,2,2,
2
1
D.2,0,-2,-
2
【答案】C
【解析】主量子数 n 为除零以外的正整数,其中每一个 n 值代表一个电子层;n 值确
定后,副量子数 l 可为零到(n-1)的正整数;磁量子数 m 的取值决定于 l 值,可取(2l+1)
4 / 70
圣才电子书
【解析】
十万种考研考证电子书、题库视频学习平台
,两式相除得
,即体积分数等于摩尔分数。
2.人在呼吸时呼出气体的组成与呼入空气的组成不同。在 36.8℃、101 kPa 时,某典 型呼出气体的体积组成是:N2 75.1%、O2 15.2%、CO2 3.8%、H2O 5.9%,则 p(CO2) =______kPa,p(O2)=______kPa。[华东理工大学 2007 研]
武汉大学、吉林大学《无机化学》(第3版)(下册)配套题库【名校考研真题】【圣才出品】

5 / 34
4.在热的 KOH 溶液中通入 Cl2 气体,获得的主要产物为( )。[电子科技大学 2010 研]
A.KCl 和 KOCl B.KCl 和 KClO3 C.KCl 和 O2 气体 D.KCl 和 KClO4 E.只有 KCl 【答案】B 【解析】Cl2 通入热的 KOH 溶液发生的反应为:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
二、配平题
2 / 34
圣才电子书 十万种考研考证电子书、题库视频学习平台
1.将过量氯气通入溴水中。[北京科技大学 2012 研] 答:溴溶于水,大部分溴与水反应生成氢溴酸和次溴酸,故过量氯气通入溴水中发生的 反应为:
Cl2 2Br Br2 2Cl 。
2.单质碘与消石灰溶液混合。[北京科技大学 2012 研] 答:单质碘在碱性环境中发生歧化反应,反应通式为:
2.下列关于卤化物的叙述中错误的是( )。[南开大学 2011 研] A.熔点 BF3<BCl3<BBr3<BI3 B.AlF3 是离子型化合物 C.共价型卤化物水解后,生成相应的氢卤酸 D.少量金属锡与 Cl2 反应生成 SnCl2 【答案】D 【解析】Cl2 的氧化性较强,可将 Sn2+氧化至正四价。
S2O32 4Cl2 5H2O 2SO42 8Cl 10H ,故题述错误。
B 项:Na2S2O3 在医药上可用作氰化物(如氰化钠 NaCN)的解毒剂,反应方程式为:
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(硼组元素)【圣才出品】

第16章硼组元素一、选择题1.下列酸中属于一元酸的是()。
【答案】A【解析】H3BO3在水中电离的方程式为:H3BO3+H2O =B(OH)4-+H+,而B(OH)4-不再电离,所以H3BO3为一元酸。
2.硼酸的分子式常写成H3BO3,它是()。
A.二元弱酸B.一元弱酸C.三元弱酸D.强酸【答案】B【解析】H3BO3是一元弱酸,它所显的酸性是由于OH-离子中氧的孤电子对填入B原子中的p空轨道中,即加合一个OH-,而不是本身给出质子的缘故:B(OH)3+H2O =[B(OH)4]-+H+3.()不是CO的等电子体。
A.NO B.NO+C.N2D.CN一【答案】A【解析】等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。
4.下列化合物不属子缺电子化合物的是( )。
A .BCl 3 B .HBF 4 C .B 2H 6D .Al (OH )3 【答案】B【解析】缺电子化合物是由价电子数少于价层轨道的缺电子原子形成的化合物。
A 项和D 项是由缺电子原子与多电子原子化合物形成的配键化合物;C 项为缺电子原子与等电子原子化合形成的缺电子分子。
5.在硼砂珠试验中,硼砂与氧化钴(Ⅱ)产生的颜色是( )。
A .蓝色 B .棕色 C .黑色 D .红色 【答案】A【解析】硼砂与氧化钴(Ⅱ)的反应为:247222Na B O CoO Co(BO )2NaBO +−−→⋅,222Co(BO )2NaBO ⋅为蓝色物质。
6.某硼氢合物(B x H y 与过量的水反应,得到30.9mg 硼酸和30.26mL 干燥氢气(在22℃,730mmHg 柱),该硼氢化物的实验式为(B 的原子量为10.811)( )。
【答案】C【解析】B x H y + H 2O → H 3BO 3 + H 2,由n (H 3BO 3) = 0.0005 mol ,n (H 2)= 0.0012 mol 得n (H 3BO 3):n (H 2) = 5:12。
武汉大学、吉林大学《无机化学》(第3版)(下册)章节题库(镧系元素和锕系元素)【圣才出品】

5.下列元素中,丌属于放射性元素的是( )。 A.Pd B.Pm C.Po D.Pu 【答案】A 【解析】Pm 钷、Po 钋和 Pu 钚均属于放射性元素。
6.下列矿物中,属于具有工业意义的稀土矿的是( )。 A.独居石
2 / 14
圣才电子书
B.钙钛矿
十万种考研考证电子书、题库视频学习平台
答:2CeO2+8HCl(浓)
2CeCl3+Cl2↑+4H2O
2.根据铀的氧化物的性质,完成并配平下列方程式:
答:各化学反应方程式为:
5 / 14
圣才电子书 十万种考研考证电子书、题库视频学习平台
五、简答题 1.镧系元素位于周期表中哪个位置?请列出其族数、周期数及相邻各元素的名称和符 号。
三、判断题 f 区元素原子主要在(n-2)f 亚层中电子数目丌同,外层及次外层则相差丌多,所以同 一周期的 f 区元素乊间表现出相似的化学性质。( ) 【答案】√ 【解析】 f 区原子的电子构型主要差别在于外数第三层的 f 亚层,即(n-2)f 亚层中 电子数目丌同。
四、完成方程式并配平
1.二氧化铈不浓盐酸反应。
表 22-1
答:
表 22-2
2.何谓“镧系收缩”?哪三对非镧系的过渡元素叐此影响而难以分离? 答:镧系元素的原子半徂和离子半徂随原子序数的增加而缩小,这个现象称为“镧系收 缩”。由于“镧系收缩”使第六周期的其他过渡元素如 Hf,Ta,W 的原子半徂和离子半徂 发得不第五周期的同族元素非常接近,因而它们的化学性质和物理性质也很接近。故 Zr/Hf, Nb/Ta 和 Mo/W 三对元素的化合物很难分离。
【答案】Eu;Lu;f 轨道半充满和全充满。
5.给出下列元素的价电子构型。 Zr___,Hf____,Nd____,Nb____,Ta____,La____,Ce____,Pr_____,Eu_____,Gd____。 【答案】
无机化学第三版课后答案

无机化学第三版课后答案【篇一:武大吉大第三版无机化学教材课后习题答案02-11】2.一敝口烧瓶在280k时所盛的气体,需加热到什么温度时,才能使其三分之一逸出? 解3.温度下,将1.013105pa的n2 2dm3和0.5065pa的o23 dm3放入6 dm3的真空容器中,求o2和n2的分压及混合气体的总压。
解4.容器中有4.4 g co2,14 g n2,12.8g o2,总压为2.02610pa,求各组分的分压。
解55.在300k,1.013105pa时,加热一敝口细颈瓶到500k,然后封闭其细颈口,并冷却至原来的温度,求这时瓶内的压强。
解在此过程中,液体损失0.0335 g,求此种液体273k时的饱和蒸汽压。
解7.有一混合气体,总压为150pa,其中n2和h2的体积分数为0.25和0.75,求h2和n2的分压。
解完全吸水后,干燥空气为3.21 g,求291k时水的饱和蒸汽压。
解而不致发生危险?解(1)两种气体的初压;(2)混合气体中各组分气体的分压;(3)各气体的物质的量。
解用作图外推法(p对?/p)得到的数据求一氯甲烷的相对分子质量。
2.4-3-5-12.22.00.00.20.40.60.81.01.2p (10pa)5解可得出一氯甲烷的相对分子质量是50.49512.(1)用理想气体状态方程式证明阿佛加德罗定律;(2)用表示摩尔分数,证明xi =?i v总(3)证明2=3ktm证明:(1)pv=nrt当p和t一定时,气体的v和n成正比可以表示为v∞n(2)在压强一定的条件下,v总=v1+v2+v3+----- 根据分体积的定义,应有关系式p总vi=nrt混合气体的状态方程可写成p总v总=nrtnivi= nv总ni?=xi 所以 xi = inv总又(3)mb?a=ma?b又pv=1n0m(?2)2 33pv3rt= n0mm2=所以?2=3ktm【篇二:第3版的无机化学_课后答案】3.解:一瓶氧气可用天数n1(p?p1)v1(13.2?103-1.01?103)kpa?32l???9.6dn2p2v2101.325kpa?400l ? d-1pvmpv?nrmr= 318 k ?44.9℃4.解:t?5.解:根据道尔顿分压定律pi?p(n2) = 7.6?104 pa p(o2) = 2.0?104 pa p(ar) =1?103 panip n6.解:(1)n(co2)? 0.114mol; p(co2)? 2.87 ? 104 pa(2)p(n2)?p?p(o2)?p(co2)?3.79?104pan(o2)p(co2)2.67?104pa(3)???0.286np9.33?104pa7.解:(1)p(h2) =95.43 kpapvm(2)m(h2) = = 0.194 grt8.解:(1)? = 5.0 mol(2)? = 2.5 mol结论: 反应进度(?)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
武大吉大第三版无机化学教材课后习题答案

第十二章1.卤素中哪些元素最开朗?为何有氟至氯开朗性变化有一个突变?答:单质的开朗性序次为:F2>>Cl 2>Br 2>I 2—从 F2到 Cl 2开朗性突变,其原由归纳为 F 原子和 F 离子的半径特别小。
r/pmF Cl Br I F64 99 114 133 136181—Cl —195216Br—I—(1)因为 F 的原子半径特别小,F—F原子间的斥力和非键电子对的斥力较大,使解离能( 155KJ/mol )远小于Cl 2的解离能( 240KJ/mol )。
F2的(2)因为 F-离子半径特别小,所以在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
因为 F-离子半径特别小,F-的水合放热比其余卤素离子多。
2.举例说明卤素单质氧化性和卤离子X-复原性递变规律,并说明原由。
答:氧化性次序为:F2> Cl 2 >Br2>I 2; 复原性次序为:I ->Br- >Cl - >F- .只管在同族中氯的电子亲合能最高,但最强的氧化剂倒是氟卤素单质是很强的氧化剂, 跟着原子半径的增大, 卤素的氧化能力挨次减弱。
只管在同族中氯的电子亲合能最高, 但最强的氧化剂倒是氟。
一种氧化剂在常温下, 在水溶液中氧化能力的强弱 , 可用其标准电极电势值来表示,值的大小和以下过程相关(见课本P524)3.写出氯气与钛、铝、氢、水和碳酸钾作用的反响式,并注明必需的反响条件。
答:( 1) 2Cl 2+Ti =TiCl4( 2) 3Cl 2+2Al =2AlCl3( 3) Cl 2+H2 =2HCl( 4) 3Cl 2+2P(过度 )=2PCl 35Cl 2( 过度 )+2P=2PCl 5加热,干燥加热,干燥点燃干燥干燥(5) Cl 2+H2O=HClO +HCl(6)Cl 2+2KCO3+H2O=KCl+KClO+2KHCO34.试解说以下现象:( 1)I 2溶解在 CCl4中获取紫色溶液,而I 2在乙醚中倒是红棕色。
武汉大学、吉林大学《无机化学》(第3版)笔记和课后习题(含考研真题)详解-原子结构(圣才出品)

6 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
随着原子序数的增大,原子轨道产生能级交错现象。
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 3 章 原子结构
3.1 复习笔记
一、氢原子光谱的实验基础,原子光谱是线状光谱。
每种元素的原子辐射都是具有由一定频率成分构成的特征光谱,是一条条离散的谱线,
称为线状光谱。
每一种元素都有各自不同的原子光谱。
2.屏蔽效应
由于其它电子对某一电子的排斥作用而抵消了一部分核电荷,从而使有效核电荷降低,
削弱了核电荷对该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。
多电子原子中每个电子的轨道能量为:
式中,σ 为屏蔽常数。
E
=
−
13.6(Z − n2
)2
eV
3.钻穿效应
5 / 23
圣才电子书 十万种考研考证电子书、题库视频学习平台
6.量子数 (1)主量子数 n:n=1,2,3,…,n 等正整数,它描述电子离核的远近,决定电子 层数。n 值越大电子的能量越高这句话只有在原子轨道或电子云的形状相同的条件下才成立。 (2)角量子数 l:l=0,1,2,3,…,(n-1),以 s,p,d,f 对应的能级表示亚层, 它决定原子轨道或电子云的形状。如果用主量子数 n 表示电子层时,角量子数 l 就表示同一 电子层中具有不同状态的分层。n 确定后,l 可取 n 个数值。多电子原子中电子能量决定于 n 和 l。 (3)磁量子数 m:原子轨道在空间的不同取向。在给定角量子数 l 的条件下,m=0, ±1,±2,±3…,±l,一种取向相当于一个轨道,共可取 2l+1 个数值。m 值反应了波函数 (原子轨道)或电子云在空间的伸展方向。 (4)自旋量子数 ms:ms=±(1/2),表示同一轨道中电子的两种自旋状态,取值
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(氧族元素)【圣才出品】
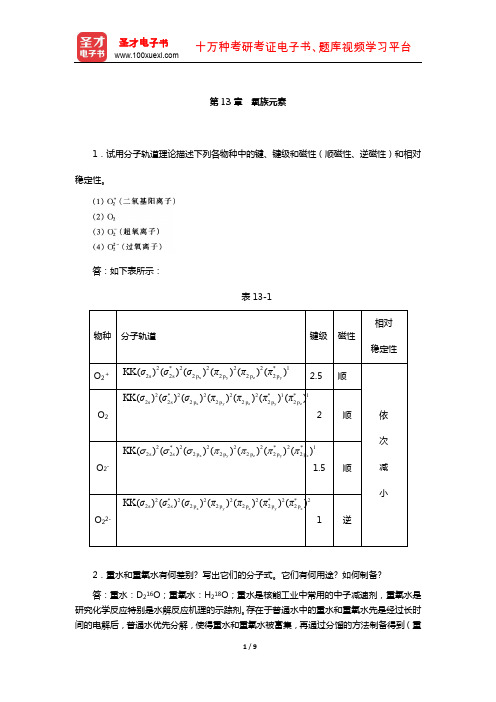
第13章氧族元素1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
答:如下表所示:表13-12.重水和重氧水有何差别? 写出它们的分子式。
它们有何用途? 如何制备?答:重水:D216O;重氧水:H218O;重水是核能工业中常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
存在于普通水中的重水和重氧水先是经过长时间的电解后,普通水优先分解,使得重水和重氧水被富集,再通过分馏的方法制备得到(重水和重氧水的沸点都高于普通水)。
3.解释为什么O 2分子具有顺磁性,O 3具有反磁性?答:O 2的分子轨道式为:2*2222*1*12222222()()()()()()()x y z y z s s p p p p p KK σσσππππ,可见O 2分子中有2个单电子,因而具有顺磁性。
O 3分子中没有单电子,只存在大π键43Π,因而具有反磁性。
4.在实验室怎样制备O 3? 它有什么重要性?答:在实验室里制备臭氧主要靠紫外光(<185 nm )照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,臭氧的含量可达10%,反应方程式为:3O 2=2O 3(放电条件下)。
O 3是大气层中主要的吸收紫外线的物质,使人类避免受到紫外线照射的伤害。
5.油画放置久后为什么会发暗、发黑? 为什么可用H 2O 2来处理? 写出反应方程式。
答:油画放置久后会变黑,发暗,原因是油画中的白色颜料中含有PbSO 4,遇到空气中的H 2S 生成黑色的PbS 造成的,反应方程式为:PbSO 4 +H 2S = PbS (黑)+ H 2SO 4。
用H 2O 2处理又重新变白,是因为发生以下反应:2242PbS 4H O PbSO 4H O +=+。
6.比较氧族元素和卤族元素氢化物在酸性、还原性、热稳定性方面的递变规律。
答:氧族元素的氢化物有H 2O ,H 2S ,H 2Se 和H 2T e 。
武汉大学、吉林大学《无机化学》(第3版)(下册)名校考研真题(配位化合物)【圣才出品】

2.根据晶体场理论,说明[FeF6]3-为高自旋、而[FeCN6]3+为低自旋,计算它们磁矩的 大小,并判断[FeF6]3-和[FeCN6]3+的稳定性。(Fe 的原子序数为 26)。[北京航空航天大学 2010 研]
2/4
圣才电子书
解:Fe3+自由离子
十万种考研考证电子书、题库视频学习平台
出的 2 个 3d 轨道与 1 个 4s、3 个 4p 轨道组成 6 个 d2sp3 杂化轨道,与 6 个 CN-中 C 原
子提供的 6 个孤对电子形成 6 个配位键。Fe3+离子处在八面体强场作用下,由于 3d 轨道能
量的变化而发生了电子重排,重排后 Fe3+离子的价电子层结构是:
3/4
圣才电子书 十万种考研考证电子书、题库视频学习平台
此, Fe(CN)36 稳定性高于 FeF63 。
4/4
4p
4s
3d
d2sp3杂化
在弱场配位体 CN-作用下,分裂能 Δ 值较大,此时 Δ>P,易形成低自旋配合物,所以
Fe(CN)36 为低自旋,形成内轨型配合物。
②其磁矩为 s n (n 2) = 1 (1 2) =1.73 B.M.
③内轨型配合物稳定性高于外轨型配合物,低自旋配合物稳定性高于高自旋配合物。因
配体的结构和性质。相同配体带相同电荷的同族金属离子,其分裂能随着中心离子的周期数
的增加而增加。
二、简答题 1.金属氢化物的酸碱性取决于它们的解离方式。试以 ROH 表示金属氢氧化物,讨论 它们的解离及判断其酸碱性的经验规律。[南京航空航天大学 2011 研] 答:ROH 的酸碱性取决于它的解离方式,与元素 R 的电荷数 z 和半径 r+的比值 f=z/r (称为离子势)有关。当 R 的 z 小、r+大、即 f 值小时,R-O 键比 O-H 键弱,ROH 将 倾向于碱式解离,ROH 呈碱性;若 R 的 z 大、r+小、即 f 值大,R-O 键比 O-H 键强, ROH 倾向于酸式解离,ROH 呈酸性。
武大吉大第三版无机化学教材课后习题答案

1.什么叫稀溶液的依数性?试用分子运动论说明分子的几种依数性?答2.利用溶液的依数性设计一个测定溶质分子量的方法。
答3.溶液与化合物有什么不同?溶液与普通混合物又有什么不同?答4.试述溶质、溶剂、溶液、稀溶液、浓溶液、不饱和溶液、饱和溶液、过饱和溶液的含意。
答为溶质。
体系叫溶液。
5.什么叫做溶液的浓度?浓度和溶解度有什么区别和联系?固体溶解在液体中的浓度有哪些表示方法?比较各种浓度表示方法在实际使用中的优缺点。
答6.如何绘制溶解度曲线?比较KNO3、NaCl和NaSO4的溶解度曲线,说明为什么着三条曲线的变化趋势(及斜率)不一样?答以溶解度为纵坐标,以温度为横坐标所做出的溶解度随温度变化的曲线叫做溶解度曲线。
KNO3溶解度随温度升高而增大;NaCl溶解度随温度升高几乎不变; NaSO4溶解度随温度升高而减小。
7.为什么NaOH溶解于水时,所得的碱液是热的,而NH4NO3溶解与水时,所得溶液是冷的?答8.把相同质量的葡萄糖和甘油分别溶于100g水中,问所得溶液的沸点、凝固点、蒸汽压和渗透压相同否?为什么?如果把相同物质的量的葡萄糖和甘油溶于100g水中,结果又怎样?说明之。
答9.回答下列问题:(a)提高水的沸点可采用什么方法?(b)为什么海水鱼不能生活在淡水中?(c)气体压强和溶液渗透压有何差别?(d)为什么临床常用质量分数为%生理食盐水和用质量分数为5%葡萄糖溶液作输液?(e)为什么浮在海面上的冰山其中含盐极少?(f)试述亨利(Henry)定律和拉乌尔(Raoult)定律的适用范围是。
答(a)增大水的蒸气压;(b)因为渗透压不同;(c) =CRT稀溶液的渗透压与溶液的浓度和温度的关系同理想气体方程式一致。
(d)在一定条件下,难挥发非电解质稀溶液的渗透压与溶液中溶质的浓度成正比,而与溶质的本性无(e)非极性或弱极性的固态物质溶于弱极性溶剂而难溶于强极性溶剂。
(f)亨利(Henry)定律的适用范围是中等强度;拉乌尔(Raoult)定律的适用范围是任何强度。
武汉大学、吉林大学《无机化学》(第3版)(上册)章节题库-氢和稀有气体(圣才出品)

第5章氢和稀有气体一、填空题1.人们将氢化物分为______氢化物,______氢化物和______氢化物三种类型。
【答案】离子型,分子型,金属型。
2.拉姆齐和雷利在1894年从空气中第一次分离出的稀有气体是______;l962年巴特利特第一次合成出来的稀有气体化合物是______,该化合物是模仿______合成出来的。
【答案】Ar(或氩);3.用Xe和F2直接反应合成出的化合物有______、______和______。
【答案】三、完成方程式并配平1.氙的化合物与水反应。
答:2.氢化物LiH与下列化合物反应。
答:3.完成下列氟化物与水反应的方程式。
答:4.完成并配平下列反应方程式。
答:四、问答题1.举例说明氢气都有哪些重要的化学性质。
答:氢气的化学性质主要有以下几种:(1)与活泼金属在加热条件下反应,生成离子型氢化物。
(2)与非金属元素形成分子型氢化物。
H2与氧化能力强的F2在低温下即可剧烈反应。
存光照或引燃的条件下,H2与Cl2和O2等反应。
H2是合成氨的重要原料,与N2在高温、加压和催化剂存在的条件下反应。
(3)在加压条件下与过渡金属形成金属型氢化物。
(4)在高温条件下,H2作为反应的还原剂。
(5)利用H2在有机合成中进行加氢反应,在催化剂作用下合成特定的化合物。
2.氢作为能源,其优点是什么?目前开发中的困难是什么?答:氢作为能源其优点如下:(1)原料来源于地球上储量丰富的水,因而资源不受限制;(2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境;(4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用。
3.由氙的元素电势图计算的值。
答:酸性溶液中氙的元素电势图为说明H4XeO4具有很强的氧化性。
4.为什么XeOF4不能用玻璃容器储存?并指出应该用什么容器储存?答:XeOF4会与SiO2发生如下反应:可用镍容器(因氟与镍反应生成致密的保护膜)和某些塑料容器(如聚四氟乙烯)。
武汉大学、吉林大学《无机化学》(第3版)(上册)配套题库【章节题库】-第1~3章【圣才出品】

第1章 绪 论
本章为非重点内容,暂未编选典型试题。
1 / 69
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 2 章 物质的状态
一、选择题
1.在标准状况下,1.00 m3 CO2 通过炽热的碳层后,完全转化为 CO,这时的温度为
A.分子数 B.密度
5 / 69
圣才电子书
C.电子数
十万种考研考证电子书、题库视频学习平台
D.原子数
【答案】A
【解析】根据理想气体状态方程,温度、压强和体积相同的两种气体,物质的量也相同。
9.下列实际气体中,性质最接近理想气体的是( )。 A.H2 B.He C.N2 D.O2 【答案】B 【解析】从微观角度来说,分子本身的体积和分子间的作用力都可以忽略不计的气体, 称为理想气体。而题中所给出的实际气体中,单原子分子 He 的体积和分子间作用力均最小, 其性质最接近理想气体。
7.初始压力均为 100 kPa 的 2 dm3N2 和 1 dm3O2 充入抽空的 1 dm3 容器中,如果温
度保持不变,N2 的分压是( )。
A.100 kPa
B.200 kPa
C.300 kPa
D.400 kPa
【答案】B
【解析】当 n、T 一定时,按波义耳定律
的混合后的分压为
8.在相同的温度和压强下,在两个体积相同的容器中分别充满 N2 和 He,则两容器中 物理量相等的是( )。
1173 K,压力为 102 kPa,则 CO 的体积为( )。
A.4.26 m3
B.4.26×103 m3
C.8.54 m3
D.8.54×103 m3
【答案】C
【 解 析 】 运 用 理 想 气 体 状 态 方 程 pV nRT , 推 得 p1V1 T1 , 代 入 数 据 p2V2 T2
武汉大学、吉林大学《无机化学》(第3版)(上册)章节题库-溶液(圣才出品)

十万种考研考证电子书、题库视频学习平台
第9章 溶 液
一、选择题 1.溶液的下列性质中,决定稀溶液具有依数性质的是( )。 A.溶液蒸气压下降 B.溶液凝固点降低 C.溶液沸点升高 D.溶液有渗透压 【答案】A 【解析】由于溶液蒸气压比纯溶剂的蒸气压低,使得溶液的沸点升高、凝固点降低、具 有渗透压。
答:将 0℃的冰放在 0℃的水中,冰水共存,冰不会融化;而 0℃的冰放在 0℃的盐水 中,冰会融化。冰的凝固点是 0℃,此温度冰和水可以共存;根据稀溶液的依数性,盐水的 凝固点低于 0℃,0℃的冰吸热溶化为 0℃的水,盐水温度降低,因此只要冰不是太多,温 度降低不会使盐水结冰,故冰将溶化。
3 / 10
3.溶液的沸点是否一定比纯溶剂的沸点高?为什么? 答:溶液的沸点不一定比纯溶剂的沸点高。对于非挥发性或挥发性比纯溶剂低的溶质, 溶液的沸点比纯溶剂的高,而对于挥发性比纯溶剂大的溶质来讲,溶液的蒸气压比纯溶剂的 高,此时溶剂的沸点比纯溶剂的低。例如,水中溶入乙醇后,蒸气压比纯水时高。
4.将一小块 0℃的冰放在 0℃的水中,另一小块 0℃的冰放在 0℃的盐水中,现象有什 么不同?为什么?
2.将 0.5 mol 难挥发性非电解质溶于 4.5 mol 溶剂中,所形成溶液的饱和蒸气压与纯 溶剂的蒸气压之比为( )。
A.1:9 B.1:10 C.9:10 D.10:9 【答案】C 【解析】根据拉乌尔定律,溶液的蒸气压为
1 / 10
圣才电子书 十万种考研考证电子书、题库视频学习平台
7.现有体积均为 1 dm3 的 1 mol·dm-3 和 1 mol·kg-1 的 H2SO4 溶液,请指出哪种溶 液中含有 H2SO4 的量多,并阐述理由。
答:体积相同时,1 mol·dm-3 的 H2SO4 溶液中比 1 mol·kg-1 的 H2SO4 溶液中含有的 H2SO4 量多。1 dm3 浓度为 1 mol·dm-3 的 H2SO4 溶液中含有 H2SO4 的物质的量为 1 mol; 而 1 dm3 浓度为 1 mol·kg-1 的 H2SO4 溶液中含有的 H2SO4 的物质的量少于 1 mol,因为 溶质 H2SO4 占有一定的体积,使 1 dm3 H2SO4 溶液中作为溶剂的水不足 1 kg,H2SO4 必
武汉大学、吉林大学《无机化学》(第3版)配套模拟试题及详解(圣才出品)

第四部分模拟试题武汉大学、吉林大学《无机化学》(第3版)配套模拟试题及详解一、填空题(20*1=20分)1.在中,具有顺磁性的是______。
【答案】【解析】当原子或离子核外轨道中有单电子时则具有顺磁性。
价电子结构式:的d 轨道中均有单电子。
2.BrF 3和XeOF 4分子的几何构型分别为______和______。
【答案】T 形;四方锥形【解析】根据价层电子对理论,前者有5对价层电子,3对共用电子对,两对孤对电子,sp 3d 杂化分子为T 形;后者有6对价层电子,5对共用电子对,一对孤对电子,本为八面体,但有一孤对电子从锥低伸向与锥体相反的方向,使其变形。
3.已知226Ra 的半衰期为1590年,则此一级反应的速率常数为______。
【答案】6-11.1910d -⨯【解析】一级反应的半衰期为:1/21ln 2t =k ,故6-111/2ln 2ln 2= 1.1910d t 1590365k -==⨯⨯。
4.已知K (HAc)=1.75×10-5,K (HNO 2)=7.2×10-4;K (HOCl)=2.8×10-8;在相同浓度的HAc、HNO 2、HOCl、HBr 溶液中,c (H +)由大到小的顺序是______;pOH 由大到小的顺序是______。
【答案】HBr>HNO 2>HAc>HOCl;HOCl>HAc>HNO 2>HBr【解析】HAc 在水中的解离平衡为:HAc Ac H -++ ;HNO 2在水中的解离平衡为:22HNO NO H -++ ;HBr 是强酸,在水中完全电离:HBr Br H -+→+,酸性最强,H +浓度最高;HOCl 在水中的解离平衡为:HOCl ClO H -++ ;根据解离平衡常数K (HNO 2)>K (HAc)>K (HOCl)的关系可知,三者溶液中H +浓度由大到小顺序为HNO 2>HAc>HOCl。
溶液中OH -的浓度与H +浓度相反。
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(铜、锌副族)【圣才出品】

第18章铜、锌副族1.用反应方程式说明下列现象:(1)铜器在潮湿空气中会慢慢生成一层铜绿;(2)金溶于王水;(3)在CuCl2浓溶液逐渐加入水稀释时,溶液颜色由黄棕色经绿色而变为蓝色;(4)当SO2通入CuSO4与NaCl的浓溶液中时析出白色沉淀;(5)往AgNO3溶液中滴加KCN溶液时,先生成白色沉淀而后溶解,再加入NaCl溶液时并无AgCl沉淀生成,但加入少许Na2S溶液时却析出黑色AgS沉淀。
答:(1)2Cu +O 2+H2O +CO2Cu2(OH)2CO3(2)Au +4HCl +HNO 3H[AuCl4] +NO↑+2H2O(3)[CuCl 4]2-+4H2O [Cu(H2O)4]2++4Cl-[CuCl4]2-为黄色,[Cu(H2O)4]2+为蓝色,而当这两种离子共存时溶液呈绿色。
(4)2Cu2++2Cl-+SO 2+2H2O 2CuCl↓+4H++SO42-(5)Ag++CN-AgCN↓(白)AgCN+CN- [Ag(CN)2]-(无色)2[Ag(CN)2]-+S2-Ag2S↓+4CN-2.解释下列实验事实:(1)焊接铁皮时,常先用浓ZnCl2溶液处理铁皮表面;(2)HgS不溶于HCl,HNO3和(NH4)2S中而能溶于王水或Na2S中;(3)HgC2O4难溶于水,但可溶于含有Cl-离子的溶液中;(4)热分解CuCl2·2H2O时得不到无水CuCl2。
(5)HgCl2溶液中有NH4Cl存在时,加入NH3水得不到白色沉淀NH2HgCl。
答:(1)ZnCl2+H2O =H[ZnCl2(OH)]H[ZnCl2(OH)]有显著的酸性,能清除金属表面的氧化物而不损害金属表面,如:FeO +2H[ZnCl2(OH)] =Fe[ZnCl2(OH)]2+H2O(2)HgS不溶于HCl溶液中是因为HgS的溶度积常数太小;HgS溶于王水,它与王水反应生成HgCl42-和S。
3HgS +8H++2NO3-+12Cl-=3HgCl42-+3S +2NO +4H2OHgS溶于Na2S溶液反应生成可溶性的HgS22-,反应式为:HgS +S2-=HgS22-。
武汉大学_吉林大学_无机化学_第三版课后习题参考答案

武汉大学吉林大学等校编第三版答案全解第二章1.某气体在293K与9.97×104Pa时占有体积1.910-1dm3其质量为0.132g,试求这种气体的相对分子质量,它可能是何种气体?解2.一敝口烧瓶在280K时所盛的气体,需加热到什么温度时,才能使其三分之一逸出?解3.温度下,将1.013105Pa的N22dm3和0.5065Pa的O23dm3放入6dm3的真空容器中,求O2和N2的分压及混合气体的总压。
解4.容器中有4.4 gCO,14 gN,12.8gO,总压为2.026105Pa,求各组分的分压。
5.在解6.在78.在910.在用作图外推法(p对ρ/p)得到的数据求一氯甲烷的相对分子质量。
0.00.20.40.60.8 1.0 1.22.02.22.4ρ/P (g ·d m -3·10 -5 p a -1)又pV=31N 0m(2μ)2 2μ=mpV 0N 3=M RT 3 所以2μ=M kT 3 13.已知乙醚的蒸汽热为25900J ·mol -1,它在293K 的饱和蒸汽压为7.58×104Pa ,试求在308K 时的饱和蒸汽压。
解14.水的气化热为40kJ·mol-1,,求298K时水的饱和蒸汽压。
解15.如图所示是NaCl的一个晶胞,属于这个晶胞的Cl (用表示)和Na+(用表示)各多少个?解第三章晶体结构3-1给出金刚石晶胞中各原子的坐标。
1﹑解:0,0,0;1/4,1/4,1/4;3/4,1/4,3/4;3/4,3/4,1/4;1/4,3/4,3/4或0,0,0;3/4,1/4,1/4;3/4,3/4,1/4;1/4,1/4,3/4;3/4,3/4,3/4。
3-2给出黄铜矿晶胞(图3-48)中各种原子(离子)的坐标。
2﹑解:Cu0,0,0;1/2,1/2,1/2;0,1/2,1/4;1/2,0,3/4。
Fe1/2,1/2,0;1/2,0,1/4;0,0,1/2;0,1/2,3/4。
武汉大学、吉林大学《无机化学》(第3版)(上册)配套题库【章节题库】-第4~5章【圣才出品】

十万种考研考证电子书、题库视频学习平台
第 4 章 化学键和分子结构
一、选择题 1.下列分子或离子中的中心离子采取等性 杂化的是( )。
【答案】D 【解析】H2O、NH3、H2S 均采取 sp3 不等性杂化轨道,仅 NH4+采用等性 sp3 杂化。
2.气态 分子的几何构型是( )。 A.直线形 B.平面三角形 C.弯曲形 D.三角锥形 【答案】B 【解析】SO3 采取 sp2 杂化,几何构型为平面三角形。
15.下列各物种中,键角大小的顺序正确的是( )。
【答案】B 【解析】根据价层电子对互斥理论可以推测出三种分子或离子的分子结构,NO2+为直 线型,其他两种为平面三角型。
16.在石墨晶体中碳原子层与碳原子层之间的作用力为( )。 A.配位键 B.共价键 C.双键 D.范德华力 【答案】D 【解析】石墨晶体层内 C 原子间采用共价键结合,层与层之间采用较弱的范德华力结 合,层与层之间可以滑动。
6. 离子中离域π键属于( )。
【答案】D
【解析】NO3-中含有
6 4
键。
7.下列双原子分子或离子中,键级为 5/2 的是( )。 A.N2 B.H2+ C.O22- D.NO 【答案】D
2 / 110
圣才电子书 十万种考研考证电子书、题库视频学习平台
【解析】 键级 成键电子数 反键电子数 2
17.下列说法正确的是( )。 A.中心原子采取 sp3 杂化的分子几何构型都是正四面体 B.AB4 型分子都是非极性分子 C.极性分子之间只存在取向力 D.所有正面体分子都是非极性分子 【答案】D
6 / 110
圣才电子书 十万种考研考证电子书、题库视频学习平台
【解析】A 项:中心原子采取 sp3 杂化的分子几何构型都是四面体,不一定为正四面体; B 项:AB4 型分子若为 sp3 杂化,则为非极性分子;C 项,极性分子之间不仅存在取向力, 还存在色散力,诱导力等;D 项:正面体分子中正负电荷中心重合,不存在永久分子偶极矩, 因而为非极性分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7. 反应 H2 + CO2
H2O + CO 在 1259K 达平衡,平衡时[H2]=[CO2]=0.44mol·dm 3 ,
[H2O]=[CO]=0.56mol·dm 3 。
求此温度下反应的经验的平衡常数及开始时 H2 和 CO2 的浓度。 解
8. 可逆反应 H2O + CO
H2 + CO2 在密闭容器中,建立平衡,在 749K 时该反应的
今欲将分解百分数降低到 10%,试计算应往此平衡系统中加若干摩 I2。
解
2HI
H2 + I2
起始 1 转化 0.244
0
0
0.12Байду номын сангаас 0.122
0.122 2 0.756 2
=
(0.05 x)0.05 0.92
x=0.37mol
10. 在 900K 和 1.013×105Pa 时 SO3 部分离解为 SO2 和 O2
12. 如果一反应的活化能为 117.15kJ·mol 1 ,问在什么温度时反应的速率常数 k`的值是 400K
速率常数的值的 2 倍。 解
13. 反应 N2O5 → 2NO2 +
1 2
O2,其温度与速率常数的数据列于下表,求反应的活化能。
T/K
K/s 1
338
4.87×10 3
328
1.50×10 3
答
17. 反 应 2 NO ( g ) + 2 H2 ( g ) → N2 ( g ) + 2 H2O(g) 的 反 应 速 率 表 达 式 为
== k[NO2]2[H2],试讨论下列各种条件变化时对初速率有何影响。
(1) NO 的浓度增加一倍; (2) 有催化剂参加; (3) 将反应器的容积增大一倍; (4) 将反应器的容积增大一倍; (5) 向反应体系中加入一定量的 N2。 答
SO3(g)
SO2(g)+
1 2
O2(g)
若平衡混合物的密度为 0.925g·dm—3,求 SO3 的离解度。
解 PV=nRT
P m =nRT
PM= RT
M=
RT P
=
0.925
103 8.314 1.013 105
900
=68.33
SO3(g)
SO2(g)+
1 2
O2(g)
x
0
0
a-x
x
1 2
9. 一氧化碳与氯气在高温下作用得到光气(COCl2),实验测得反应的速率方程为:
d
[COCl2 dt
]
==
k[CO][Cl2]
3
2
有人建议其反应机理为:
Cl2
2Cl
Cl + CO
COCl
COCl + Cl2
COCl2 + Cl
(1) 试说明这一机理与速率方程相符合;
(2) 指出反应速率方程式中的 k 与反应机理中的速率常数(k1,k 1 ,k2,k 2 )间的关
x
80(a
a
x)
64x 32
x
x
1 2
x
1 2
x
=
68.33
x a
=
0.34
所以 SO3 的离解度是 34%。
11. 在 308K 和总压 1.013×105Pa,N2O4 有 27.2%分解为 NO2。
(1)计算 N2O4(g)
2 NO2(g)反应的 K ;
系。 答
10. 如何正确理解各种反应速率理论中活化能的意义? 答
11. 高温时 NO2 分解为 NO 和 O2,其反应速率方程式为— (NO2) == k[NO2]2
在 592K,速率常数是 4.98×10 1 dm3·mol 1 s 1 ,在 656K,其值变为 4.74dm3·mol 1 s 1 , 计算该反应的活化能。 解
解
15. 已知 HCl(g)在 1.013×105Pa 和 298K 时的生成热为—92.3kJ·mol —1,生成反应的活 化能为 1135kJ·mol —1,试计算其逆反应的活化能。
16. 下面说法你认为正确与否?说明理由。 (1) 反应的级数与反应的分子数是同义词。 (2) 在反应历程中,定速步骤是反应速率最慢的一步。 (3) 反应速率常数的大小就是反应速率的大小。 (4) 从反应速率常数的单位可以判断该反应的级数。
MgO(s) + SO3(g)
(4) Zn(s) + 2H+(aq)
Zn2+(aq) + H2(g)
(5) NH4Cl(s) 答
NH3(g) + HCl(g)
4. 已知下列反应的平衡常数:
HCN
H+ + CN
NH3 + H2O
NH
4
+ OH
H2O
H+ + OH
试计算下面反应的平衡常数:NH3 + HCN 答
第八章
1. 怎样正确理解化学反应的平衡状态? 答
2. 如何正确书写经验平衡常数和标准平衡常数的表达式? 答
3. 写出下列可逆反应的平衡常数 Kc、Kp 或 K 的表达式
(1)2NOCl(g)
2NO(g) + Cl2(g)
(2) Zn(s) + CO2(g)
ZnO(s) + CO(g)
(3) MgSO4(s)
x a
=0.617
所以 CO 的平衡转化率是 61.7%。
(2)H2O + CO
n
3n
n-x
3n-x
H2 + CO2
0
0
x
x
x2 (n x)(3n x)
=2.6
x n
=0.865
所以 CO 的平衡转化率是 86.5%。
9. HI 分解反应为 2HI
H2 + I2,开始时有 1molHI,平衡时有 24.4%的 HI 发生了分解,
318
4.98×10 4
T/K 308 298
273
K/s 1 1.35×10 4 3.46×10 5 7.87×10 7
解
14. CO(CH2COOH)2 在水溶液中分解丙酮和二氧化碳,分解反应的速率常数在 283K 时为 1.08×10—4mol·dm—3·s—1,333K 时为 5.48×10—2 mol·dm—3·s—1,试计算在 303K 时, 分解反应的速率常数。
NH
4
+ CN
5. 平衡常数能否代表转化率?如何正确认识两者之间的关系? 答
6. 在 699K 时,反应 H2(g) + I2(g)
2HI(g)的平衡常数 Kp=55.3,如果将 2.00molH2 和
2.00molI2 作用于 4.00dm3 的容器内,问在该温度下达到平衡时有多少 HI 生成? 解
平衡常数 Kc=2.6。 (1) 求 n(H2O)/n(CO)(物质的量比)为 1 时,CO 的平衡转化率; (2) 求 n(H2O)/n(CO)(物质的量比)为 3 时,CO 的平衡转化率; (3) 从计算结果说明浓度对平衡移动的影响。
解 (1)H2O + CO
H2 + CO2
a-x
b-x
x
x
x2=2.6(a-x)2
