酸碱中和滴定实验(课堂PPT)
合集下载
酸碱中和滴定法3.ppt

NH4Cl弱酸性如果黄色变成橙色,可视为中 和滴定完全,此时HCl并不过量
酸滴定碱选酚酞,变色时PH=8.2为碱性,此时可能碱未 被完全中和。
③强碱滴定弱酸时用酚酞 NaOH + CH3COOH == CH3COONa + H2O
CH3COONa溶液为弱碱性,当酚酞由无色变 成粉红时,达到终点,碱不过量
解:V(HCl)=(30.51+30.50+30.49)/3=30.50ml
C(HCl)·V(HCl)=C(NaOH)·V(NaOH)
C(NaOH)=
C(HCl)·V(HCl) V(NaOH)
=
0.120×30.5 25
=0.146mol/L
三、酸碱中和滴定的主要仪器:
酸式滴定管 碱式滴定管 锥形瓶 容量瓶 滴定管夹 铁架台
3.不引起偏差的操作:
1)锥形瓶只用蒸馏水洗涤后,仍留有少量蒸 馏水;
2)量入待测液在锥形瓶内加入少量水稀释 待测液
(二) 杂质引起的误差
研究对象一般是在配制碱液时,所取固体碱中 混入了杂质。杂质不同所耗酸的体积不同.(等 质量的杂质与等质量的碱比较中和酸的能力)
1.用已知物质的量浓度的标准酸滴定未知物质的 量浓度的碱溶液(甲基橙作指示剂)
碱性:弱酸与强碱中和
例如:H3PO4+3NaOH==Na3PO4+3H2O 1 :3 即完全中和,,但溶液的PH>7 故酸碱完全中和指的是酸碱刚好完全反 应,n(H)=n(OH),而不是PH=7
二、酸碱中和滴定的定义及意义:
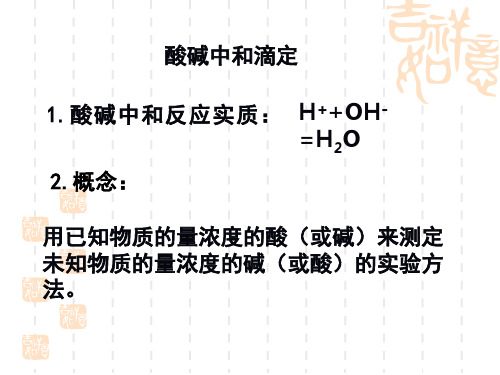
1、中和滴定的定义 用已知物质的量浓度的酸(或碱)来测定未 知物质的量浓度的碱(或酸)的方法叫酸碱 中和滴定
用Na2CO3溶液测定盐酸的量浓度时,如果杂质中含 NaHCO3,K2CO3,NaCl等杂质,所耗碱液体积偏多, 测出酸浓度偏高
酸碱中和滴定专业ppt课件.ppt

☆实验:酸碱中和滴定
1、原理(或定义):用已知浓度的酸(或碱)来测定未知浓 度的碱(或酸)的方法。
2、公式:c酸v酸=c碱v碱(一元酸和一元碱)
3、实验的关键: (1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应
4、实验仪器
仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、 滴定管夹、烧杯、白纸(有时还需要移液管)
石蕊溶液
紫色
红5紫8蓝
a、甲基橙和酚酞的变色范围较小:4.4-3.1=1.3、10-8=2对 溶液的酸碱性变化较灵敏
b、溶液使指示剂改变颜色,发生化学变化。指示剂滴加太多将 消耗一部分酸碱溶液(一般为1→2滴)。
3、酸碱中和滴定中指示剂的选择:
a、强酸强碱间的滴定: 酚酞溶液、甲基橙
b、强酸滴定弱碱 两者正好完全反应,生成强酸弱碱盐,反应后溶
= 0.1233mol/L
答:测得NaOH的物质的量浓度为0.1233mol/L。
★三、误差分析:
❖ 例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧 化钠放于锥形瓶中)下列操作(其它操作均正确),对 氢氧化钠溶液浓度有什么影响?
一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管 偏高
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 偏高
4、赶气泡:使滴定管尖嘴部分充满溶液. 酸式滴定管:快速放液 碱式滴定管:橡皮管向上翘起
5、调液面:
调节滴定管中液面高度,
使液面等于“0”刻度或在 “0”刻度以下的某一位 置,并记下读数,记作起 始读数。
(二)滴定阶段
6、取液: ①从碱式滴定管中放出一定量氢氧化钠溶液于锥形瓶中。 ②滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并 在瓶底衬一张白纸。
1、原理(或定义):用已知浓度的酸(或碱)来测定未知浓 度的碱(或酸)的方法。
2、公式:c酸v酸=c碱v碱(一元酸和一元碱)
3、实验的关键: (1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应
4、实验仪器
仪器:酸式滴定管、碱式滴定管、锥形瓶、 铁架台、 滴定管夹、烧杯、白纸(有时还需要移液管)
石蕊溶液
紫色
红5紫8蓝
a、甲基橙和酚酞的变色范围较小:4.4-3.1=1.3、10-8=2对 溶液的酸碱性变化较灵敏
b、溶液使指示剂改变颜色,发生化学变化。指示剂滴加太多将 消耗一部分酸碱溶液(一般为1→2滴)。
3、酸碱中和滴定中指示剂的选择:
a、强酸强碱间的滴定: 酚酞溶液、甲基橙
b、强酸滴定弱碱 两者正好完全反应,生成强酸弱碱盐,反应后溶
= 0.1233mol/L
答:测得NaOH的物质的量浓度为0.1233mol/L。
★三、误差分析:
❖ 例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧 化钠放于锥形瓶中)下列操作(其它操作均正确),对 氢氧化钠溶液浓度有什么影响?
一、酸式滴定管
1、未用标准液(HCl)润洗酸式滴定管 偏高
2、滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 偏高
4、赶气泡:使滴定管尖嘴部分充满溶液. 酸式滴定管:快速放液 碱式滴定管:橡皮管向上翘起
5、调液面:
调节滴定管中液面高度,
使液面等于“0”刻度或在 “0”刻度以下的某一位 置,并记下读数,记作起 始读数。
(二)滴定阶段
6、取液: ①从碱式滴定管中放出一定量氢氧化钠溶液于锥形瓶中。 ②滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并 在瓶底衬一张白纸。
《酸碱中和滴定实验》课件

消除方法:选择精度高的滴定管、控制滴定速度、准确判断滴定终点等
Part Four
滴定剂的配制和标 定
滴定剂的种类性质
酸碱指示剂: 酸碱滴定剂: 缓冲溶液:用 标准溶液:用
用于指示滴定 用于滴定反应, 于控制滴定反 于标定滴定剂
终点,如酚酞、 如盐酸、氢氧 应的pH值,
的浓度,如
甲基橙等
化钠等
如磷酸缓冲液、 0.1M的盐酸、
状况
监测工业排放: 检测工业排放 物酸碱度,判 断排放是否达
标
在食品检测中的应用
检测食品中的酸碱度
检测食品中的微生物含量
添加标题
添加标题
检测食品中的添加剂含量
添加标题
添加标题
检测食品中的重金属含量
Part Seven
酸碱中和滴定实验 的改进和发展趋势
实验方法的改进
自动滴定仪的应用:提高滴定精度和速度
指示剂变色误差:指示剂变色不明显, 导致滴定终点误差
温度影响:温度变化导致溶液体积变化, 影响滴定终点
滴定速度影响:滴定速度过快或过慢, 导致滴定终点误差
消除方法:使用准确读数的滴定管,选 择合适的指示剂,控制温度,保持稳定 的滴定速度。
Part Six
酸碱中和滴定实验 的应用
在化学分析中的应用
滴定终点的确定方法
指示剂变色法:通过观察指示剂颜色的变化来确定滴定终点 电位法:通过测量溶液的电位变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点
滴定终点误差的来源和消除方法
滴定管读数误差:滴定管读数不准确, 导致滴定终点误差
滴定管改进:采用更精确的滴定管,提高滴定精度
Part Four
滴定剂的配制和标 定
滴定剂的种类性质
酸碱指示剂: 酸碱滴定剂: 缓冲溶液:用 标准溶液:用
用于指示滴定 用于滴定反应, 于控制滴定反 于标定滴定剂
终点,如酚酞、 如盐酸、氢氧 应的pH值,
的浓度,如
甲基橙等
化钠等
如磷酸缓冲液、 0.1M的盐酸、
状况
监测工业排放: 检测工业排放 物酸碱度,判 断排放是否达
标
在食品检测中的应用
检测食品中的酸碱度
检测食品中的微生物含量
添加标题
添加标题
检测食品中的添加剂含量
添加标题
添加标题
检测食品中的重金属含量
Part Seven
酸碱中和滴定实验 的改进和发展趋势
实验方法的改进
自动滴定仪的应用:提高滴定精度和速度
指示剂变色误差:指示剂变色不明显, 导致滴定终点误差
温度影响:温度变化导致溶液体积变化, 影响滴定终点
滴定速度影响:滴定速度过快或过慢, 导致滴定终点误差
消除方法:使用准确读数的滴定管,选 择合适的指示剂,控制温度,保持稳定 的滴定速度。
Part Six
酸碱中和滴定实验 的应用
在化学分析中的应用
滴定终点的确定方法
指示剂变色法:通过观察指示剂颜色的变化来确定滴定终点 电位法:通过测量溶液的电位变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点 滴定管法:通过观察滴定管中溶液的颜色变化来确定滴定终点
滴定终点误差的来源和消除方法
滴定管读数误差:滴定管读数不准确, 导致滴定终点误差
滴定管改进:采用更精确的滴定管,提高滴定精度
第四节酸碱中和滴定PPT课件

❖强酸与弱碱相互滴定时,应选用甲基橙。 ❖强碱与弱酸相互滴定时,应选用酚酞。
中和滴定——主要实验仪器
量取液体常用仪器:量筒、移液管、滴定管
❖量筒:粗量仪,10mL量筒最小分刻度为 0.1mL ,读数精确到0.1mL,无“O”刻度 ❖移液管:精量仪,读数精确到0.01mL 准确量取一定量的试液(中和滴定量取待测液) ❖滴定管:精量仪 ▪标有温度、容积、“0”刻度在最高点 ▪常用规格:25mL、50mL ▪最小分刻度:0.1mL,读数精确到0.01mL (精量仪可估读一位,粗量仪不能估读)
中和滴定实验步骤
四、滴定
• 滴定管夹在夹子上,保持垂直 • 右手持锥形瓶颈部,向同一方向作圆周运动,
而不是前后振动 • 左手控制活塞(或玻璃球),注意不要把活塞
顶出 • 滴加速度先快后慢,直至指示剂颜色突变 • 滴定过程右手摇动锥形瓶,眼睛注视锥形瓶内
溶液颜色变化 • 滴定终点达到后,半分钟颜色不变,再读数
1、两体积如何准确测定 2、判断中和反应恰好完成,即达到终点
1、需要能准确表示所加溶液体积的仪器 ——滴定管
2、需要能指示酸碱反应完全的物质 ——酸碱指示剂
酸碱指示剂的选择
原则:为减少误差,变色点与等当点尽可能接近
讨论:强酸和强碱完全中和时,溶液pH应为7,但
甲基橙与酚酞的变色点不等于7,对实验有无误差? 为什么可将滴定终点当成完全中和的点?
▪种类: 酸式滴定管——下端玻璃活塞 碱式滴定管——下端连接一橡皮管(内有玻 璃小球控制流速)下端尖嘴玻璃管
、Na2SiO3) 碱式滴定管——可盛放碱性物质或无氧化性的物质
思考:为什么碱不能盛放在酸式滴定管, KMnO4不能用碱式滴定管盛放?
结论:常用甲基橙与酚酞
中和滴定——主要实验仪器
量取液体常用仪器:量筒、移液管、滴定管
❖量筒:粗量仪,10mL量筒最小分刻度为 0.1mL ,读数精确到0.1mL,无“O”刻度 ❖移液管:精量仪,读数精确到0.01mL 准确量取一定量的试液(中和滴定量取待测液) ❖滴定管:精量仪 ▪标有温度、容积、“0”刻度在最高点 ▪常用规格:25mL、50mL ▪最小分刻度:0.1mL,读数精确到0.01mL (精量仪可估读一位,粗量仪不能估读)
中和滴定实验步骤
四、滴定
• 滴定管夹在夹子上,保持垂直 • 右手持锥形瓶颈部,向同一方向作圆周运动,
而不是前后振动 • 左手控制活塞(或玻璃球),注意不要把活塞
顶出 • 滴加速度先快后慢,直至指示剂颜色突变 • 滴定过程右手摇动锥形瓶,眼睛注视锥形瓶内
溶液颜色变化 • 滴定终点达到后,半分钟颜色不变,再读数
1、两体积如何准确测定 2、判断中和反应恰好完成,即达到终点
1、需要能准确表示所加溶液体积的仪器 ——滴定管
2、需要能指示酸碱反应完全的物质 ——酸碱指示剂
酸碱指示剂的选择
原则:为减少误差,变色点与等当点尽可能接近
讨论:强酸和强碱完全中和时,溶液pH应为7,但
甲基橙与酚酞的变色点不等于7,对实验有无误差? 为什么可将滴定终点当成完全中和的点?
▪种类: 酸式滴定管——下端玻璃活塞 碱式滴定管——下端连接一橡皮管(内有玻 璃小球控制流速)下端尖嘴玻璃管
、Na2SiO3) 碱式滴定管——可盛放碱性物质或无氧化性的物质
思考:为什么碱不能盛放在酸式滴定管, KMnO4不能用碱式滴定管盛放?
结论:常用甲基橙与酚酞
酸碱中和滴定ppt课件

作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用 甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
四、实验步骤
1.滴定前准备
2.滴定操作 用左手控制滴定管活塞,逐滴放出溶液,右手摇动锥形瓶, 两眼注视锥形瓶内溶液颜色变化。
控制活塞
摇动锥形瓶
锥形瓶 内溶液颜色变化
3.终点判断 当滴入最后半滴×××标准溶液后,溶液由××色变成××色,
【课堂练习】
1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确 选项( C )
序号
① ② ③ ④
锥形瓶中 滴定管中 选用指示 选用滴定
溶液
溶液
剂
管
碱
酸
石蕊
甲
酸
碱
酚酞
甲
碱
酸
甲基橙
甲
酸
碱
酚酞
乙
A.①② B.②③ C.③④ D.②④
2.用0.10mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,恰好完全反应 时,下列叙述中正确的是( D ) A.溶液呈中性,可选用甲基橙或酚酞
带玻璃球 的橡胶管
注意: 酸式滴定管:酸性、强氧化性试剂 碱式滴定管:碱性试剂
【课堂练习】
1.下列所述仪器“0”刻度位置正确的是( B )
A.在量筒的上端
B.在滴定管上端
C.容量瓶上端
D.在托盘天平刻度尺的右边2.50ml的滴定管盛有
溶液,液面恰好在20.0处,若把滴定管中溶液全部
C 排出,则体积( )
液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;D.取标准KOH
溶液注入碱式滴定管至“0”刻度以上2~3 mL;E.调节液面至“0”或“0”以
酸碱中和滴定法第1课时.ppt

碱性
(如NaOH、Na2CO3等)
碱式滴定管 碱性物质易腐蚀玻璃, (带橡皮管) 致使玻璃塞无法打开
二、酸碱中和滴定的主要仪器及使用方法
• (2)滴定管操作方法 ① 检漏:检查滴定管是否漏水。
② 润冼:加入酸碱反应液之前,滴定管要用待装液润冼2 -3遍。
③ 装液:将反应液加入相应的滴定管中,使液面位于“0” 刻度以上2-3mL.
注意: 1、温度:20℃ 2、体积:25mL或50mL 3、刻度:0刻度在上
最小刻度0.1 4、精确度:0.01mL
二、酸碱中和滴定的主要仪器及使用方法
• 2、酸碱式滴定管的使用方法 • (1)滴定管的选择
溶液性质
酸性、氧化性
(如酸、KMnO4等)
滴定管
原因
酸式滴定管 氧化性物质易腐蚀橡胶管 (带玻璃活塞)
• (2)用标准NaOH溶液滴定时,应将标准NaOH溶 液注入 乙 (选填“甲”或“乙”)中。
• (3)右图是碱式滴定管中液面在滴定前后的读数,
c(HCl)=____a(_V_2_-V_1_)/_V_____mol·L-1。
课后作业
• 1、预习酸碱中和滴定操作和误差分析。 • 2、思考:滴定终点是酸碱恰好中和的点吗? • 3、完成《金版学案》对应课时练习。
[问题情境]
• 实验室有一瓶盐酸 溶液,标签已被腐 蚀,浓度未知,你 能通过实验的方法 测出它的物质的量 浓度吗?
ห้องสมุดไป่ตู้
一、酸碱中和滴定的概念和原理
1、概念
利用中和反应,用已知浓度的酸(或碱)来 测定未知浓度的碱(或酸)的实验方法。
2、原理:
中和滴定以酸碱中和反应为基础,其实质为: H+ + OH- = H2O
《酸碱中和滴定》课件ppt

学习目标
掌握酸碱中和滴定实验的原理和操作方法, 通过对酸碱溶液的分析,了解溶液中数量变化对性质的影响,体会由量变到质变的过程。 了解化学定量分析的方法,体验化学在科学研究中的作用和地位,提高学生的科学素质。
一、酸碱中和滴定原理。
1、 定义:用已知物质的量浓度的强酸或强碱(标准溶液)来测定未知物质的量浓度的强碱或强酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。
红 橙 黄
红 紫 蓝
无色 粉红 红
2、 原理:以酸碱中和反应为基础, H+ + OH- = H2O 在滴定达到终点(即酸碱恰好反应)时:
1mol
1mol
有 n(H+) = n(OH-)
例题:用0.1032mol/L的HCl溶液滴定25.00mL未知浓度的NaOH溶液, 滴定完成时,用去HCl溶液27.84mL。通过中和滴定测得NaOH溶液的物质的量浓度是多少?
用0.1000mol/L的NaOH溶液,滴定20 .00ml 0.1000mol/L的HCl 溶液,求随V NaOH的增大,pH=?
滴定过程的pH变化
思考
VNaOH()
0.00
5.00
10.00
15.00
18.00
19.00
19.50
19.98
pH
1.00
1.22
1.48
1.84
3、酸碱中和滴定的关键
(1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应
需要能在滴加溶液时准确表示所加溶液体积的仪器——滴定管 需要能指示酸碱反应完全的物质 ——酸碱指示剂
【思维探究】:要想测定的浓度结果更准确,你 认为实验的关键是什么?
酸碱中和滴定ppt课件.ppt

不同点有哪些认识?使用它们注意哪些事项?
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
答案:酸式滴定管:取酸液或强氧化性溶液,特征:玻璃活塞。碱式滴
定管:取碱液,特征:内有玻璃球的橡皮管。注意点:a.检查是否漏水,玻璃
活塞用左手指内扣转动。b.滴定前要洗涤:洗涤剂洗—自来水洗—蒸馏
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
(4)取:从碱式滴定管中放出 25.00 mL 氢氧化钠溶液于锥形瓶中,
滴入 2 滴酚酞溶液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白
纸。
(5)滴定:左手控制活塞,右手振荡锥形瓶,边滴入盐酸,边不断摇动锥
内含少量的氢氧化钾,用标准盐酸溶液进行滴定(偏低)
(2)同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何(偏低)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
迁移与应用
例 3 用标准盐酸滴定未知浓度的 NaOH 溶液时,若测得的结
目标导航
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
答案:①不能用量筒代替滴定管,因为计量的精确度不同。在量取液
体的体积时,量筒只能读至 0.1 mL,而滴定管可读至 0.01 mL。用滴定管
测量时有测定值的精确度较高,读数方便,操作简单等优点。
(4)滴定操作时,有少量盐酸滴于锥形瓶外(偏高)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
答案:酸式滴定管:取酸液或强氧化性溶液,特征:玻璃活塞。碱式滴
定管:取碱液,特征:内有玻璃球的橡皮管。注意点:a.检查是否漏水,玻璃
活塞用左手指内扣转动。b.滴定前要洗涤:洗涤剂洗—自来水洗—蒸馏
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
(4)取:从碱式滴定管中放出 25.00 mL 氢氧化钠溶液于锥形瓶中,
滴入 2 滴酚酞溶液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白
纸。
(5)滴定:左手控制活塞,右手振荡锥形瓶,边滴入盐酸,边不断摇动锥
内含少量的氢氧化钾,用标准盐酸溶液进行滴定(偏低)
(2)同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何(偏低)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
迁移与应用
例 3 用标准盐酸滴定未知浓度的 NaOH 溶液时,若测得的结
目标导航
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
答案:①不能用量筒代替滴定管,因为计量的精确度不同。在量取液
体的体积时,量筒只能读至 0.1 mL,而滴定管可读至 0.01 mL。用滴定管
测量时有测定值的精确度较高,读数方便,操作简单等优点。
(4)滴定操作时,有少量盐酸滴于锥形瓶外(偏高)
酸碱中和滴定实验ppt课件.ppt
C(酸)×V(酸) =化学计量数之比 C(碱)×V(碱)
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
讨论:运用这种方法的关键问题是什么?
4.关键: ①准确测出参加反应的两种溶液的体积。
②准确判断中和反应是否恰好进行完全。
思考:测定溶液体积的仪器有哪些? 量筒 滴定管:酸式滴定管和碱式滴定管
想一想:
1、如何判断酸式滴定管和碱式滴定管?
2、量筒和滴定管的“0”刻度位置是否一致?
思考:如果是强碱和弱酸中和滴定又该选择 什么指示剂?
结论:根据达到终点后溶液的酸碱性来选 变色范围尽可能与所生成盐的酸碱性范围一致 浅变深更好
练一练
1、酸碱恰好完全中和时,它们的( D)一定相等。
A、质量
B、物质的量
C、物质的量浓度
D、H+和OH-的物质的量
2、物质的量浓度相同、体积也相同的一元酸和一元
碱相互中时,溶液显什么性( D )
A、显酸性B、显碱性C Nhomakorabea显中性D、酸碱性无法判断
练一练
3.用已知物质的量浓度的NaOH溶液滴定未 知物质的量浓度的HCl溶液,一般选用(酚酞 ) 作指示剂,用已知物质的量溶液的HCl溶液滴 定未知物质的量浓度的NaOH溶液,一般选用 (甲基)橙作指示剂。
5、实验仪器
解: HCl 1mol
+
NaOH = NaCl+ H2O
1mol
c(HCl)•V[HCl(aq)] c(NaOH)•V[NaOH(aq)]
c(NaOH)= c(HCl ) •V[HCl (aq)] 1mol
V[NaOH (aq)] 1mol
= 0.1100mol / L 0.02900L
0.02300L
V[NaOH (aq)] 1mol
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4
4、中和滴定实验(用酸滴定碱)
(1)仪器:酸式滴定管、碱式滴定管、锥形瓶、 烧杯、滴定管夹、铁架台 (2)用品:0.1mol/L HCl aq,未知浓度的NaOH aq,酚酞溶液,蒸馏水,(白纸)
滴定管
类型 酸式滴定管:玻璃活塞(装酸或氧化剂) 碱式滴定管:橡胶管、玻璃小球
用途:精确测量液体体积或量取一定体积的液体。
2
2 实验原理 (2)关键:
甲基橙
3.1~4.4 红、橙、黄
酚酞
8.2 ~ 10.0 无色、浅红、红色
①准确测出两种溶液的体积 ——精密的量器
②准确判断中和反应恰好完成 ——酸碱指示剂
3 指示剂的选择和滴定终点判断:
强酸滴定强碱:酚 酞: 红色→无色 甲基橙:黄色→橙色
强碱滴定强酸:酚 酞: 无色→浅红 甲基橙:红色→橙色
8
(4)调节起始读数、排气泡 排出尖嘴气泡,调整液面至“0”或以下,读数并记录。 eg1 滴定管内部有气泡—— 快速放液除去气泡
(5)放出待测液:从滴定管中放出一定体积的待测液于 锥形瓶中,加2—3滴指示剂
9
(二)滴定阶段
(6)滴定 左手_控__制__滴__定__管__活__塞__, 使溶液成滴流下,先快后慢 ; 右手_摇__动_锥__形__瓶___;眼睛注视_锥__形__瓶__中_溶__液__颜__色__的__变__化,
★加入最后一滴标准液时溶液刚好变色,且半分种内不恢复 原来的颜色,说明到达滴定终点,立即停止。
3
注意:(1)石蕊颜色变化不明显,不作滴定指示剂 (2)滴定终点尽可能与变色范围一致
eg1 用NaOH滴定HAc NaAc显碱性——用酚酞
eg2 用HCl滴定NH3·H2O NH4Cl显酸性——用甲基橙
酸碱中和滴定曲线
上部标识:温度、容积、0刻度
(常用规格:25mL、50mL,有无色和棕色)
读数方法:平视液面,读取与凹液面相切刻度
估读到0.01mL, 小数点后保留二位
5
滴定管的读数:
25.60mL
6
滴定管的读数:
7
3、实验步骤
(一)准备阶段(教材P50)
(1)查、洗:滴定管是否漏水和堵塞(活塞是否漏水)。 蒸馏水洗涤滴定管、锥形瓶
27.85
0.00
27.85 25.00
V[HCl(aq)]=—27—.84—m—L+—2—7.8—3m—L—+2—7.—85—mL——=27.84mL 3
c(NaOH)=—c(H—C—l)—V[—HC—l(—aq—)] V[NaOH(aq)]
=
0.10mol/L×27.84mL 25.00mL
=0.11mol/L
(2)润洗:用所装溶液润洗滴定管2-3次、不润洗锥形瓶
具体做法:从滴定管上口加入3-5mL所要盛装的酸或碱溶液, 倾斜着转动滴定管,使液体润湿全部滴定管内壁。然后,一手 控制活塞(酸式——轻轻转动活塞,碱式——轻轻挤压玻璃 球),将液体从滴定管下部放入预置的烧杯中
(3)装液:向滴定管中加入待装液至“0”刻度以上 2—3cm处,垂直固定在滴定管夹上。
通常在锥形瓶下方垫一张白纸,使滴定终点颜色变化更易观察
(7)记
当看到加一滴盐酸时,锥形瓶中溶液红色突变为无 色时,停止滴定,准确记下盐酸读数并记录。
重复做两Hale Waihona Puke ,取三次标准液的平均值计算10
(三)数据处理阶段
28.34 0.50
27.84 25.00
28.28
0.45
27.83 25.00 0.11mol/L
减小 2OH- + CO2 = CO32- + H2O
已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在 空气中放置一段时间)所消耗硫酸的体积为VA,中和另一 份消耗硫酸溶液的体积为VB,则:
(1)以甲基橙为指示剂时,VA与VB的关系是_V_A_=_V__B___ 。
(2)以酚酞为指示剂时,VA与VB的关系是__V_A__<_V_B____ 。
滴定过程中振荡时有液滴溅出 __偏__小__
滴定达终点时发现滴定管尖嘴处
挂着一滴液滴
__偏__大__
15
练习
取体积相同(0.025L)的两份0.10mol/L NaOH溶液,把其 中一份放在空气中一段时间后,溶液的pH _________(填 “增大、减小或不变”),其原因是__________________。 (用离子方程式表示)
分析:用H2SO4滴定Na2CO3溶液,反应分两个阶段进行:
a、H+ + CO32- ====HCO3-(此时溶液呈弱碱性)
b、H+ + HCO3- ====H2O + CO2↑(此时溶液呈弱酸性)
甲基橙 变色范围3.1-4.4 反应进行到b,2NaOH——Na2CO3——2H+—
—CO2
16
酚酞 变色范围8.0-10.0 反应进行到a,2NaOH——Na2CO3——H+—
c(NaOH) _偏_大____ _偏_大____ _偏_小____
_无_影__响__
13
滴定前仰视读数或滴定
后俯视读数 读数
滴定前俯视读数或滴定
后仰视读数
__偏_小___ __偏_大___
14
滴定完毕后立即读数,半分钟内
颜色又褪去
__偏__小__
滴定前滴定管尖嘴部分有气泡滴
操作 定后气泡消失
__偏__大__
11
酸碱中和滴定
5、误差分析
紧扣公式:c(待) c(标 V()V待()标)
误差由V(标)决定 所测V(标)偏大,则c(待)偏大 所测V(标)偏小,则c(待)偏小
12
步骤
洗涤 (润洗)
操作 未用标准溶液润洗滴定管 锥形瓶用待测溶液润洗 未用待测溶液润洗取用待测 液的滴定管 锥形瓶洗净后瓶内还残留有 少量蒸馏水
重要的定量实验—— 酸碱中和滴定
1
酸碱中和滴定
1 概念:利用中和反应用已知浓度的酸(或碱) 来测定未知浓度的碱(或酸)的实验方法叫酸碱 中和滴定。 2 实验原理
(1)实质: H++OH- =H2O 恰好反应时:n(H+)=n(OH-)
强酸与强碱: c(H+)V酸=c(OH-)V碱
c(H+) ? c(OH-) ?
4、中和滴定实验(用酸滴定碱)
(1)仪器:酸式滴定管、碱式滴定管、锥形瓶、 烧杯、滴定管夹、铁架台 (2)用品:0.1mol/L HCl aq,未知浓度的NaOH aq,酚酞溶液,蒸馏水,(白纸)
滴定管
类型 酸式滴定管:玻璃活塞(装酸或氧化剂) 碱式滴定管:橡胶管、玻璃小球
用途:精确测量液体体积或量取一定体积的液体。
2
2 实验原理 (2)关键:
甲基橙
3.1~4.4 红、橙、黄
酚酞
8.2 ~ 10.0 无色、浅红、红色
①准确测出两种溶液的体积 ——精密的量器
②准确判断中和反应恰好完成 ——酸碱指示剂
3 指示剂的选择和滴定终点判断:
强酸滴定强碱:酚 酞: 红色→无色 甲基橙:黄色→橙色
强碱滴定强酸:酚 酞: 无色→浅红 甲基橙:红色→橙色
8
(4)调节起始读数、排气泡 排出尖嘴气泡,调整液面至“0”或以下,读数并记录。 eg1 滴定管内部有气泡—— 快速放液除去气泡
(5)放出待测液:从滴定管中放出一定体积的待测液于 锥形瓶中,加2—3滴指示剂
9
(二)滴定阶段
(6)滴定 左手_控__制__滴__定__管__活__塞__, 使溶液成滴流下,先快后慢 ; 右手_摇__动_锥__形__瓶___;眼睛注视_锥__形__瓶__中_溶__液__颜__色__的__变__化,
★加入最后一滴标准液时溶液刚好变色,且半分种内不恢复 原来的颜色,说明到达滴定终点,立即停止。
3
注意:(1)石蕊颜色变化不明显,不作滴定指示剂 (2)滴定终点尽可能与变色范围一致
eg1 用NaOH滴定HAc NaAc显碱性——用酚酞
eg2 用HCl滴定NH3·H2O NH4Cl显酸性——用甲基橙
酸碱中和滴定曲线
上部标识:温度、容积、0刻度
(常用规格:25mL、50mL,有无色和棕色)
读数方法:平视液面,读取与凹液面相切刻度
估读到0.01mL, 小数点后保留二位
5
滴定管的读数:
25.60mL
6
滴定管的读数:
7
3、实验步骤
(一)准备阶段(教材P50)
(1)查、洗:滴定管是否漏水和堵塞(活塞是否漏水)。 蒸馏水洗涤滴定管、锥形瓶
27.85
0.00
27.85 25.00
V[HCl(aq)]=—27—.84—m—L+—2—7.8—3m—L—+2—7.—85—mL——=27.84mL 3
c(NaOH)=—c(H—C—l)—V[—HC—l(—aq—)] V[NaOH(aq)]
=
0.10mol/L×27.84mL 25.00mL
=0.11mol/L
(2)润洗:用所装溶液润洗滴定管2-3次、不润洗锥形瓶
具体做法:从滴定管上口加入3-5mL所要盛装的酸或碱溶液, 倾斜着转动滴定管,使液体润湿全部滴定管内壁。然后,一手 控制活塞(酸式——轻轻转动活塞,碱式——轻轻挤压玻璃 球),将液体从滴定管下部放入预置的烧杯中
(3)装液:向滴定管中加入待装液至“0”刻度以上 2—3cm处,垂直固定在滴定管夹上。
通常在锥形瓶下方垫一张白纸,使滴定终点颜色变化更易观察
(7)记
当看到加一滴盐酸时,锥形瓶中溶液红色突变为无 色时,停止滴定,准确记下盐酸读数并记录。
重复做两Hale Waihona Puke ,取三次标准液的平均值计算10
(三)数据处理阶段
28.34 0.50
27.84 25.00
28.28
0.45
27.83 25.00 0.11mol/L
减小 2OH- + CO2 = CO32- + H2O
已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在 空气中放置一段时间)所消耗硫酸的体积为VA,中和另一 份消耗硫酸溶液的体积为VB,则:
(1)以甲基橙为指示剂时,VA与VB的关系是_V_A_=_V__B___ 。
(2)以酚酞为指示剂时,VA与VB的关系是__V_A__<_V_B____ 。
滴定过程中振荡时有液滴溅出 __偏__小__
滴定达终点时发现滴定管尖嘴处
挂着一滴液滴
__偏__大__
15
练习
取体积相同(0.025L)的两份0.10mol/L NaOH溶液,把其 中一份放在空气中一段时间后,溶液的pH _________(填 “增大、减小或不变”),其原因是__________________。 (用离子方程式表示)
分析:用H2SO4滴定Na2CO3溶液,反应分两个阶段进行:
a、H+ + CO32- ====HCO3-(此时溶液呈弱碱性)
b、H+ + HCO3- ====H2O + CO2↑(此时溶液呈弱酸性)
甲基橙 变色范围3.1-4.4 反应进行到b,2NaOH——Na2CO3——2H+—
—CO2
16
酚酞 变色范围8.0-10.0 反应进行到a,2NaOH——Na2CO3——H+—
c(NaOH) _偏_大____ _偏_大____ _偏_小____
_无_影__响__
13
滴定前仰视读数或滴定
后俯视读数 读数
滴定前俯视读数或滴定
后仰视读数
__偏_小___ __偏_大___
14
滴定完毕后立即读数,半分钟内
颜色又褪去
__偏__小__
滴定前滴定管尖嘴部分有气泡滴
操作 定后气泡消失
__偏__大__
11
酸碱中和滴定
5、误差分析
紧扣公式:c(待) c(标 V()V待()标)
误差由V(标)决定 所测V(标)偏大,则c(待)偏大 所测V(标)偏小,则c(待)偏小
12
步骤
洗涤 (润洗)
操作 未用标准溶液润洗滴定管 锥形瓶用待测溶液润洗 未用待测溶液润洗取用待测 液的滴定管 锥形瓶洗净后瓶内还残留有 少量蒸馏水
重要的定量实验—— 酸碱中和滴定
1
酸碱中和滴定
1 概念:利用中和反应用已知浓度的酸(或碱) 来测定未知浓度的碱(或酸)的实验方法叫酸碱 中和滴定。 2 实验原理
(1)实质: H++OH- =H2O 恰好反应时:n(H+)=n(OH-)
强酸与强碱: c(H+)V酸=c(OH-)V碱
c(H+) ? c(OH-) ?
