两种碘化丙啶染色DNA定量方法检测HL_60细胞凋亡结果的比较_徐晓雪
PI染色法

流式细胞仪检测细胞凋亡——PI单染色法碘化丙啶(propidium iodide,PI)检测早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,细胞膜通透性无明显改变,相对分子质量大的与DNA结合的荧光染料(如PI)不能进入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。
应用流式细胞仪或荧光显微镜可区分和坏死细胞,细胞内DNA出现Hoechest 3342标记而不出现PI标记的为凋亡细胞。
基本原理其原理主要是根据细胞凋亡时在细胞、亚细胞和分子水平上所发生的特征性改变.这些改变包括细胞核的改变、细胞器的改变、细胞膜成分的改变和细胞形态的改变等,其中细胞核的改变最具特征性,主要包括以下几个方面:1. 细胞核的改变:由于凋亡细胞核的改变,造成各种染色体荧光染料对凋亡细胞DNA可染性发生改变。
研究表明,用各种染色体荧光染料对经固定的凋亡细胞进行染色,其DNA可染性降低。
许多学者把这种DNA可染性的降低认为是凋亡细胞的标志之一。
2。
光散射特性:凋亡细胞形态上的改变影响它们的光散射特性。
在流式细胞仪上,前散射光与细胞的大小有关,而侧散射光反映的是光在细胞内的折射作用,与细胞内的颗粒多少有关。
在细胞凋亡时,细胞固缩,体积变小,故前散射光降低,这一特性往往被认为是凋亡细胞的特点之一。
此外细胞凋亡时由于染色体降解,核破裂形成,细胞内颗粒往往增多,故凋亡细胞侧散射光常增加.细胞坏死时,由于细胞肿胀,其前散射光增大;侧散射光在细胞坏死时也增大,因此可根据前散射光和侧散射光区别凋亡细胞和坏死细胞。
但需要注意的是,根据前散射光和侧散射光判断凋亡细胞的可靠性受被检测细胞形态上的均一性和核胞浆比率影响很大。
因此在某些淋巴细胞凋亡中,用光散射特性检测凋亡的可靠性较好,而在肿瘤细胞凋亡中,其可靠性就较差。
根据光散射特性检测凋亡细胞最主要的优点是可以将光散射特性与细胞的表面免疫荧光分析结合起来,用以区别经这些特殊处理发生选择性凋亡的淋巴细胞亚型。
PI三步法DNA定量检测技术

PI三步法DNA定量检测技术
徐晓雪;王兴翠;孙丽娜
【期刊名称】《首都医科大学学报》
【年(卷),期】2008(29)5
【摘要】DNA定量检测技术是根据细胞周期中不同时相DNA含量的变化来检测细胞周期中G0/G1、S及G2/M各时相的细胞比例,在临床肿瘤诊断和医学科研中都有重要作用。
本文介绍了一种简便实用的碘化丙啶(Propidium Iodide,PI)染色方法,同时对染色中容易忽视的技术细节提出了一些规范性的建议。
【总页数】2页(P658-659)
【作者】徐晓雪;王兴翠;孙丽娜
【作者单位】首都医科大学医学实验与测试中心;首都医科大学化学生物学与药学院
【正文语种】中文
【中图分类】R4
【相关文献】
1.原位一步法制备PMDA/ODA基PI/Ag复合薄膜 [J], 齐胜利;吴战鹏;罗芸;宋芳;武德珍;金日光
2.细胞DNA定量分析法和液基薄层细胞学检测技术在宫颈癌早期诊断中的应用对比 [J], 杨正浩;魏珍;刘涛
3.细胞DNA定量分析法和液基薄层细胞学检测技术在宫颈癌早期诊断中的应用对比 [J], 杨正浩;魏珍;刘涛;
4.用硫铁矿烧渣等一步法生产固体污水处理剂PISC [J],
5.用硫铁矿烧渣等一步法生产固体汗水处理剂PISC [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
三氧化二砷对HL-60细胞凋亡及其端粒酶hTERT-mRNA表达影响的实验研究

三氧化二砷对HL-60细胞凋亡及其端粒酶hTERT-mRNA表达影响的实验研究章尧;赵燕;陈昌杰【期刊名称】《中国药理学通报》【年(卷),期】2003(019)002【摘要】目的探讨不同浓度的三氧化二砷(As2O3)对急性早幼粒细胞白血病细胞株HL-60细胞端粒酶亚单位hTERT-mRNA表达及其诱导凋亡的作用.方法不同浓度的As2O3与HL-60细胞株共培养48 h,流式细胞术鉴定HL-60细胞凋亡;RT-PCR法检测HL-60细胞端粒酶亚单位hTERT mRNA的表达.结果在0.1、1.0和5.0 μmol*L-1 3种浓度的As2O3作用下,HL-60细胞凋亡率分别为2.28%±0.40%、2.55%±0.22%和47.57%±2.79%;端粒酶亚单位hTERT-mRNA 表达的相对值分别为73.97%、63.70%和29.04%.细胞凋亡率在5.0 μmol*L-1与0.1和1.0 μmol*L-1浓度组间差异有显著性(P<0.01);端粒酶亚单位表达的差异也有显著性(P<0.05).As2O3诱导HL-60细胞凋亡效应与其抑制端粒酶亚单位hTERT mRNA的表达相关.结论 As2O3对HL-60细胞具有凋亡诱导效应,且对其端粒酶亚单位hTERT mRNA的表达具有抑制作用,两者均呈现浓度依赖效应.As2O3可能通过抑制HL-60细胞端粒酶亚单位hTERT mRNA的表达而诱导肿瘤细胞凋亡.【总页数】4页(P206-209)【作者】章尧;赵燕;陈昌杰【作者单位】蚌埠医学院医学检验系,蚌埠,233003;蚌埠医学院医学检验系,蚌埠,233003;蚌埠医学院医学检验系,蚌埠,233003【正文语种】中文【中图分类】R955;R329.24;R329.25【相关文献】1.三氧化二砷对HL-60细胞凋亡及Survivin和Caspase-3表达的影响 [J], 陈昌杰;陈正徐;章尧2.三氧化二砷对HL-60细胞端粒酶活性表达的抑制作用 [J], 章尧;赵燕;陈昌杰3.硼替佐米或联合三氧化二砷诱导HL-60细胞凋亡实验研究 [J], 孙启鑫;孟凡义;扶云碧;李利;田帅4.尼美舒利对SGC-7901胃癌细胞系增殖及端粒酶hTERT-mRNA表达的影响 [J], 廖爱军;刘立玺;石巍;申月明5.三氧化二砷诱导HL-60细胞凋亡的实验研究 [J], 王展翔;许勇钢;廖军鲜;麻柔;周霭祥因版权原因,仅展示原文概要,查看原文内容请购买。
细胞凋亡的几种检测方法

细胞凋亡的几种检测方法本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March细胞凋亡的几种检测方法1、形态学观察方法(1)HE(苏木精—伊红染色法)染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。
(2)丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
(3)台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。
(4)透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
2、 DNA凝胶电泳细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
正常活细胞DNA 电泳出现阶梯状(LADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带3、酶联免疫吸附法(ELISA)核小体测定凋亡细胞的DNA断裂使细胞质内出现核小体。
核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
检测步骤1、将凋亡细胞裂解后高速离心,其上清液中含有核小体;2、在微定量板上吸附组蛋白体’3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合‘4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合’4、加酶的底物,测光吸收制。
细胞凋亡 染色种类

细胞凋亡染色种类
细胞凋亡染色有多种方法,包括以下几种常见的染色种类:
1. HE染色:这是一种常用的细胞凋亡染色方法,使用苏木素-伊红染料对细胞进行染色。
在光学显微镜下观察,凋亡细胞会呈现圆形,胞核深染,胞质浓缩,染色质成团块状的现象。
2. Giemsa染色:Giemsa染色也是一种常见的细胞凋亡染色方法。
正常细胞的核色泽均一,而凋亡细胞的染色质会浓缩、边缘化,核膜裂解,染色质分割成块状和凋亡小体等。
3. AO/PI双染色法:吖啶橙(AO)是一种荧光染料,能透过细胞膜使核DNA和RNA染色。
在荧光显微镜下观察,活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
碘化丙啶(PI)是一种DNA 结合性染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而将细胞核染红。
因此,通过AO/PI双染色法可以区分活细胞、凋亡细胞和坏死细胞。
4. Hoechst染色:Hoechst染料与DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。
在紫外光激发下,活细胞核呈均匀淡蓝色荧光,凋亡细胞则呈现亮蓝色,或核呈分叶状、边集的荧光。
5. TUNEL染色:这是一种检测细胞凋亡中DNA断裂的方法。
在细胞凋亡过程中,会激活DNA内切酶,导致DNA断裂。
TUNEL 染色可以标记这些断裂的DNA,从而检测细胞凋亡。
以上信息仅供参考,如需了解更多关于细胞凋亡染色的信息,建
议查阅专业书籍或咨询相关领域的专家。
细胞凋亡检测方法汇总

细胞凋亡检测,细胞凋亡实验步骤,检测方法一、定性和定量研究只定性的研究方法:常规琼脂糖凝胶电泳、脉冲场倒转琼脂糖凝胶电泳、形态学观察(普通光学显微镜、透射电镜、荧光显微镜)进行定量或半定量的研究方法:各种流式细胞仪方法、原位末端标记法、ELISA定量琼脂糖凝胶电泳。
二、区分凋亡和坏死可将二者区分开的方法:琼脂糖凝胶电泳,形态学观察(透射电镜是是区分凋亡和坏死最可靠的方法),Hoechst33342/PI双染色法流式细胞仪检测,AnnexinV/PI双染色法流式细胞仪检测等。
不能将二者区分开的方法:原位末端标记法、PI单染色法流式细胞仪检测等。
三、样品来源不同选择组织:主要用形态学方法(HE染色,透射电镜、石蜡包埋组织切片进行原位末端标记,ELISA 或将组织碾碎消化做琼脂糖凝胶电泳)。
四、细胞凋亡检测1、早期检测:1) PS(磷脂酰丝氨酸)在细胞外膜上的检测2)细胞内氧化还原状态改变的检测3)细胞色素C的定位检测4) 线粒体膜电位变化的检测2、晚期检测:细胞凋亡晚期中,核酸内切酶在核小体之间剪切核DNA,产生大量长度在180-200 bp 的DNA片段。
对于晚期检测通常有以下方法:1) TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记)2) LM-PCR Ladder (连接介导的PCR检测)3) Telemerase Detection (端粒酶检测)3、生化检测:1)典型的生化特征:DNA 片段化2)检测方法主要有:琼脂糖凝胶电泳、原位末端标记(TUNEL)等3)TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记)4)通过DNA末端转移酶将带标记的dNTP (多为dUTP)间接或直接接到DNA片段的3’-OH端,再通过酶联显色或荧光检测定量分析结果。
可做细胞悬液、福尔马林固定或石蜡处理的组织、细胞培养物等多种样本的检测。
4、LM-PCR Ladder (连接介导的PCR检测)当凋亡细胞比例较小以及检测样品量很少(如活体组织切片)时,直接琼脂糖电泳可能观察不到核DNA的变化。
常用细胞凋亡检测方法

常用细胞凋亡检测方法更新日期:2009-03-23受关注度:324920 [ 哪个强 : 丁香园医学搜索引擎搜狗有道百度谷歌 ]∙上一篇:细胞冻存、解冻方法与细胞计数∙下一篇:没有了∙挑错∙推荐∙打印生物医学药学信息产业实验机构人物论坛, 分子生物学,基因芯片,细胞生物学,神经生物学,细胞,分子,基因,研究动态,生物产业,人才,招聘,求职,神经科学,生物学,功能基因组学,基础医学,功能蛋白组学,生物信息学,生命科学,生物技术,生物芯片,基因芯片,基因工一的形态学检测1 光学显微镜和倒置显微镜(1)未染色细胞:凋亡细胞的体积变小变形,细胞膜完整但出现发泡现象,晚期可见凋亡小体贴壁细胞出现皱缩变圆脱落(2)染色细胞:常用姬姆萨染色瑞氏染色等凋亡细胞的染色质浓缩边缘化,核膜裂解染色质分割成块状和凋亡小体等典型的凋亡形态2 荧光显微镜和共聚焦激光扫描显微镜一般以细胞核染色质的形态学改变为指标来评判的进展情况常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI三种种染料与DNA的结合是非嵌入式的,主要结合在DNA的A-T 碱基区紫外光激发时发射明亮的蓝色荧光Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释,终浓度为10ug/mlDAPI为半通透性,用于常规固定细胞的染色储存液用蒸馏水配成1mg/ml 的浓度,使用终浓度一般为10ug/ml结果评判:过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体图1:3 透射电子显微镜观察结果评判:凋亡细胞体积变小,细胞质浓缩凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构图2:;Ⅱa期细胞核的染色质高度凝聚边缘化;的晚期,细胞核裂解为碎块,产生凋亡小体二磷脂酰丝氨酸外翻分析(Annexin V法)磷脂酰丝氨酸(Phosphatidylserine,PS)正常位于细胞膜的内侧,但在的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中图3:Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合将Annexin-V进行荧光素(FITC PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测的发生碘化丙啶(propidine iodide,PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来方法:1 悬浮细胞的染色:将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用PBS洗2次,加入100ul Binding Buffer和FITC标记的Annexin-V(20ug/ml)10ul,室温避光30min,再加入PI(50ug/ml)5ul,避光反应5min后,加入400ul Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1h),同时以不加AnnexinV-FITC及PI的一管作为阴性对照2 贴壁培养的细胞染色:先用0.25%的胰消化,洗涤染色和分析同悬浮细胞3 爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察结果图4图5:注意事项:1 整个操作动作要尽量轻柔,勿用力吹打细胞2 操作时注意避光,反应完毕后尽快在一小时内检测时主要的生化特征是其染色质发生浓缩,染色质DNA在核小体单位之间的连接处断裂,形成50~kbp长的DNA大片段,或180~200bp整数倍的寡核苷酸片段,在凝胶电泳上表现为梯形电泳图谱(DNA ladder)细胞经处理后,采用常规方法分离提纯DNA,进行琼脂糖凝胶和溴化乙啶染色,在凋亡细胞群中可观察到典型的DNA ladder如果细胞量很少,还可在分离提纯DNA后,用32P-ATP和脱氧核糖核苷酸末端转移(TdT)使DNA标记,然后进行电泳和放射自显影,观察凋亡细胞中DNA ladder的形成1 大分子染色体DNA片段的测定的早期,染色体断裂成为50~kbp长的DNA大片段所有超过一定分子量大小的双链DNA分子在琼脂糖凝胶中的迁移速度相同线性DNA的双螺旋半径超过凝胶半径时,即达到分辨力的极限此时凝胶不再按分子量的大小来筛分DNA,DNA像通过弯管一样,以其一端指向电场一极而通过凝胶,这种迁移模式称之为"爬行"因此,早期产生的50~kbp长的DNA大片段不能用普通的琼脂糖凝胶电泳来分离通常采用脉冲电泳技术可圆满地解决这一问题这个方法是在凝胶上外加正交的交变脉冲电场每当电场方向改变后,大的DNA分子便滞流在爬行管中,直至新的电场轴向重新定向后,才能继续向前移动DNA分子量越大,这种重排所需要的时间就越长当DNA分子变换方向的时间小于电脉冲周期时,DNA 就可以按其分子量大小分开参考文献Brown,D.G., Sun, X.M., and Cohen, G.M.(1993) Dexamethasone-induced apoptosis involves cleavage of DNA to large fragments prior to internucleosomal fragmentation. J. Biol.Chem. 268, 3037-30392 DNA Ladder 测定方法:收获细胞(1′107)沉淀?细胞裂解液?10rpm′5min,收集上清?1%SDS和RnaseA(5mg/ml)56°C,2h?蛋白K(2.5mg/ml)37°C,2h?1/10体积3M醋酸钠和2.5倍体积的冷无水乙醇沉淀DNA,4°C过夜?14000rpm′15min?最后将沉淀溶解在TE buffer中,加DNA Loading Buffer?1.2%琼脂糖凝胶电泳,EB染色并照相结果:图6:参考文献 Herrmannm M, Lorenz HM, Voll R et al. A Rapid and simple method for the isolation of apoptotic DNA fragments. Nucleic Acid Res. 1994; 22:5506-55073 凋亡细胞DNA含量的流式细胞计分析方法:收集细胞?70%冷乙醇(in PBS)4°C固定过夜?PBS洗涤,1000rpm′10min?RNase A(0.5mg/ml)37°C消化30min?PI(50mg/ml)染色,室温避光15min?FACScan分析DNA亚二倍体的形成及细胞周期的变化结果:图8:4 ApoAlertTM LM- Ladder Assay (CLONTECH)优点:敏感度高,适合于检测少量样本,小部分凋亡细胞如临床活组织检测。
碘化丙啶染色流式细胞术分析肿瘤细胞凋亡的方法学探讨

碘化丙啶染色流式细胞术分析肿瘤细胞凋亡的方法学探讨李妍;王海;张铎;李瑶;曹慧玲【摘要】@@ 针对凋亡细胞的生物化学改变[1],已经建立了多种基于FCM来检测凋亡的方法.其中,碘化丙啶单染(propidium iodide,PI )单染法和PI/ AnnecxinⅤ 双染法应用最为广泛[2].双染法可精确区分早期凋亡、晚期凋亡和坏死细胞.虽然PI 单染法仅能检测到晚期凋亡和坏死细胞,但因操作简单、试剂廉价,更适合样本量大的预实验或新药筛选.实践中发现,细胞培养、收集和染色等环节,存在多处影响检测结果的因素.本文以贴壁生长的Hela为例,从样品制备的角度出发,讨论影响PI染色检测凋亡的因素.【期刊名称】《中国实验诊断学》【年(卷),期】2012(016)005【总页数】2页(P799-800)【作者】李妍;王海;张铎;李瑶;曹慧玲【作者单位】吉林医药学院检验学院,吉林,吉林132013;吉林大学中日联谊医院检验科,吉林,长春130033;吉林医药学院检验学院,吉林,吉林132013;吉林医药学院检验学院,吉林,吉林132013;吉林医药学院科研处,吉林,吉林132013【正文语种】中文针对凋亡细胞的生物化学改变[1],已经建立了多种基于FCM来检测凋亡的方法。
其中,碘化丙啶单染(propidium iodide,PI)单染法和 PI/AnnecxinⅤ双染法应用最为广泛[2]。
双染法可精确区分早期凋亡、晚期凋亡和坏死细胞。
虽然PI单染法仅能检测到晚期凋亡和坏死细胞,但因操作简单、试剂廉价,更适合样本量大的预实验或新药筛选。
实践中发现,细胞培养、收集和染色等环节,存在多处影响检测结果的因素。
本文以贴壁生长的Hela为例,从样品制备的角度出发,讨论影响PI染色检测凋亡的因素。
1 材料与方法1.1 材料人宫颈癌细胞Hela引自美国典型物种保藏中心,去甲斑蝥素(norcantharidin,NCTD)购自国家标准物质中心,胰蛋白酶(trypsin)、乙二胺四乙酸(EDTA)二钠、PI和 Triton X-100和台盼蓝购自Sigma公司(美国)。
AnnexinV-FITCPI双染法流式细胞术检测细胞凋亡

AnnexinV-FITCPI双染法流式细胞术检测细胞凋亡看到来我们眼科公共平台来使用Fortessa检测凋亡时,看到很多人都是泪流满面,鉴于此,作者大找网络资源结合自己的理解,针对普遍的问题给眼科的童鞋们一个交代,期待对大家有用,期待大家板砖!!Reference1. Galluzzi L, Aaronson SA, Abrams J, et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death Differ 2009; 16:1093-107.一、原理在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。
Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。
因此Annexin V被作为检测细胞早期凋亡的灵敏指标之一。
将Annexin V进行荧光素(FITC)标记,以标记了的Annexin V作为荧光探针,利用荧光显微镜或流式细胞仪可检测细胞早期凋亡的发生。
碘化丙啶(Propidium Iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。
因此将Annexin V与PI(7-AAD也可以)匹配使用,就可以将处于不同凋亡时期的细胞区分开来。
二、注意事项1.Annexin V-EGFP,Propidium Iodide (PI)避光保存及使用。
2. Propidium Iodide (PI)有毒,操作时要戴手套。
3.推荐使用悬浮培养细胞,如果是贴壁细胞,用胰酶消化不当,会引起假阳性,而用细胞刮子会造成细胞粘连成团,而影响检测。
三氧化二砷诱导HL-60细胞凋亡的实验研究

三氧化二砷诱导HL-60细胞凋亡的实验研究王展翔;许勇钢;廖军鲜;麻柔;周霭祥【期刊名称】《中国中西医结合杂志》【年(卷),期】2000(20)7【摘要】目的:探讨三氧化二砷(As_2O_3)治疗白血病的疗效机理。
方法:以HL-60细胞株为体外模型,终浓度为0.20μmol/LAs2_O_3作用24、48h后,用PI/AnnexinV-FITC双标记,流式细胞术观察As_2O_3对HL-60细胞凋亡及其对细胞株端粒酶活性的影响。
结果:As2_O_3作用于HL-60细胞后PI阴性/AnnexinV-FITC阳性细胞增多,提示细胞发生凋亡,DNA周期分析显示主要作用在细胞G_2-M期,48h对端粒酶有轻微抑制作用。
结论:As_2O_3主要通过诱导细胞凋亡杀伤白血病细胞。
【总页数】3页(P536-538)【关键词】三氧化二砷;HL-60;细胞凋亡;端粒酶;白血病【作者】王展翔;许勇钢;廖军鲜;麻柔;周霭祥【作者单位】中国中医研究院西苑医院血液科,全国中医血液病医疗中心【正文语种】中文【中图分类】R733.705;R73-36【相关文献】1.内源性TGF-β1、TNF-α在三氧化二砷诱导HL-60细胞凋亡中作用的研究 [J], 陈元仲;吴勇;黄美娟;吕联煌2.三氧化二砷和曲古抑菌素A协同诱导HL-60细胞凋亡的作用及分子机制研究[J], 杨炜华;温培娥;谢超;乔高娟;任霞;任海泉;唐天华;姜国胜3.三氧化二砷对HL-60细胞凋亡及其端粒酶hTERT-mRNA表达影响的实验研究[J], 章尧;赵燕;陈昌杰4.硼替佐米或联合三氧化二砷诱导HL-60细胞凋亡实验研究 [J], 孙启鑫;孟凡义;扶云碧;李利;田帅5.c-Myc和Fas在三氧化二砷体外诱导HL-60细胞凋亡中的变化与作用的研究[J], 杨晓梅;温培娥;乔高娟;赵海涛;范华;任霞;姜国胜;杨炜华因版权原因,仅展示原文概要,查看原文内容请购买。
流式测凋亡原理步骤和结果判断

流式双染测凋亡原理、步骤和结果判断一、原理:磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。
Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。
将Annexin-V进行荧光素(FITC)标记,以标记了荧光素(FITC)的Annexin-V作为荧光探针,利用流式细胞仪可检测细胞凋亡的发生。
碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和坏死细胞,PI能够穿透细胞膜而使细胞核红染,所以PI主要检测坏死或中晚期调亡细胞(二者的膜都发生了破裂)。
因此将Annexin-V与PI匹配使用,就可以将早期凋亡细胞和中晚期以及坏死细胞区分开来。
二、步骤:1、无菌条件下获取新鲜的肝组织,置于事先消毒好的200目不锈钢细胞筛网上,下接50ml小烧杯。
用眼科剪把组织剪成小块,眼科镊去除小血管及结缔组织,用玻璃棒轻轻研磨组织,使细胞脱落。
待研磨充分后,用5%预冷的RPMI-1640液冲洗,收集小烧杯中单细胞悬液,随后以500-1000r/min离心5min ,弃上清。
重悬、离心洗涤2次 ,以获得较纯化的肝细胞。
将肝细胞悬液取样在光镜下用血细胞计数板计数,调节细胞数目至1×106 ∕ml。
2、取1ml单细胞悬液,用预冷的PBS洗涤两次,然后加入1×结合缓冲液1ml重悬细胞。
3、取100ul加入到5ml的培养管中,加入5ulFITC标记的Annexin-V和5ul PI,混匀后室温下避光孵育15min,然后再加入400ul的1×结合缓冲液。
整个操作过程动作要尽量轻柔,勿用力吹打细胞。
4、反应完毕后尽快在一小时内上机检测,用FL1通道检测FITC- Annexin V荧光,FL2通道检测PI荧光。
Survivin shRNA促进HL-60细胞凋亡及其对阿糖胞苷敏感性的研究

g r o u p ; ②A m— C g r o u p ;  ̄p o s i t i v e p l a s m i d g r o u p ; @n e g a t i v e p l a s m i d g r o u p ;  ̄p o s i t i v e p l a s m i d + A r a - C g r o u p ;  ̄n e g —
2 0 1 3 年 4月第 1 0 卷第 1 1 期
・
实验 研 究 ・
S ur vi vi n s hR K N I A A 促进
HL - 6 0细胞 凋亡 及其对 阿糖胞 苷敏感性 的研究
冯 霞 杨 红。
1 . 昆明医科大学第一附属医院检验科 , 云南 昆明 6 5 0 0 3 2 ; 2 . 昆明医科大学第二附属医院血1阿糖 胞苷 ; 细胞 凋 亡 ; RNA 干扰
【 中图分 类 号】 R 5 5
【 文 献标 识 码】 A
【 文章 编 号】 1 6 7 3 — 7 2 1 0 ( 2 0 1 3 ) 0 4 ( b ) 一 0 0 2 5 — 0 4
I n v e s t i g a t i o n o f S u r v i v i n s h RNA o n t h e a p o p t o s i s a n d s e n s i t i v i t y t o ARa - - C o f HL- 6 0 c e l l s
胞凋 率改变的检测。 结果 与空白实验组 比较 , 阳性质粒组的 m R N A表达抑制率为 5 7 . 7 %, 表达下降 , 差异有 统计学意义( P<0 . 0 5 ) ; 阳性质粒组细胞凋亡率为 5 . 8 7 %, 阳性质粒+ A r a — C组细胞对 A r a — C敏感性明显提高, 细 胞凋亡率为 1 2 . 4 %,差异有统计学意义 ( P<0 . 0 5 ) 。 结论 S u r v i v i n s i R N A能够高效特异的抑制 H L 一 6 0细胞 内 S u r v i v i n 基因的表达 , 诱导细胞凋亡 。 并提高了 H L 一 6 0 细胞对 A r a — C的敏感性 , 这有助于 白血病基因治疗 的进
碘化丙啶PI染色液(50ugml,含RNase)

碘化丙啶染色液(50μg/ml,含RNase)简介:碘化丙啶染色(PI stain)可以对细胞周期与细胞凋亡进行分析。
碘化丙啶(Propidium Iodide, PI)是一种可以嵌合到双链DNA 和RNA 的碱基对中并与之结合的荧光染料,无碱基特异性。
碘化丙啶与双链DNA 结合后可以产生荧光,并且荧光强度和双链DNA 的含量成正比。
细胞内的DNA 被Propidium Iodide 染色后,可以用流式细胞仪对细胞进行DNA 含量测定,然后根据DNA 含量的分布情况,可以进行细胞周期和细胞凋亡的分析。
碘化丙啶染色后,假设G0/G1期细胞的荧光强度为1,那么含有双份基因组DNA 的G2/M 期细胞的荧光强度的理论值为2,正在进行DNA 复制的S 期细胞的荧光强度为1~2之间。
凋亡细胞由于细胞核发生浓缩以及发生DNA 片段化(DNA fragmentation)导致部分基因组DNA 片断在染色过程中丢失,因此凋亡细胞碘化丙啶染色后呈现明显的弱染,即荧光强度小于1,在流式检测的荧光图上出现所谓的sub-G1峰,即凋亡细胞峰。
Leagene 碘化丙啶染色液(50μg/ml,含RNase)主要由PI 、破膜剂、RNase 等组成,经常用于培养的贴壁或悬浮细胞的细胞周期与细胞凋亡检测, 亦可用于区分细胞凋亡和细胞坏死。
Leagene PI 染色液工作浓度为20~50μg/ml ,推荐用于DNA 染色,细胞检测含量范围一般为0.1~1×106之间。
组成:自备材料:1、 胰蛋白酶消化液2、 流式细胞仪3、 PBS4、 预冷固定液:预冷的70%乙醇或4%多聚甲醛操作步骤(仅供参考):1、细胞样品的制备:⑴贴壁细胞:① 小心收集细胞培养液到一个无菌离心管内备用。
② 用胰蛋白酶消化细胞至可以被轻轻用移液管或枪头吹打下来时,加入前面收集的细胞培 编号 名称 DA0023 Storage PI Stain(50μg/ml,含RNase) 10ml -20℃ 避光 使用说明书 1份养液,吹打下所有的贴壁细胞,并轻轻吹散细胞。
PI三步法DNA定量检测技术-首都医科大学
DNA 定量检测技术是根据细胞周期中不同时相 DNA 含量的变化来检测细胞周期中 G0 /G1、S及 G2 / M 各时相的细胞比例, 在临床肿瘤诊断和医学科研中 都有重要作用。本文介绍了一种简便实用的碘化丙 啶 ( P ropidium Iodide, P I) 染色方法, 同时对 染色中容 易忽视的技术细节提出了一些规范性的建议。
2008年 10月 第 29卷 第 5期
首 都 医科 大 学 学报 Journal of C apitalM ed ical U niversity
O ct. 2008 V o .l 29 N o. 5
PI三步法 DNA 定量检测技术
技术方法
徐晓雪 1 王兴翠 1 孙丽娜 2
( 1. 首 都医科大学医学实验与测试中心; 2. 首都医科大学化学生物学与药学院 )
FL3 Channels versus cell numb er.
第 5期
徐晓雪等: P I三步法 DNA 定 量检测技术
6 59
3 讨论
3. 1 技术细节 1) 流式检测所需的样本量一般为 ( 0. 5~ 1) 106
个细胞, 加入少量 PBS制成约 0. 5 m L 的单细胞悬液, 若细胞数目过少, 检测时在最佳液流速度下细胞通过 量过小, 检测时间过长 [ 1] 。
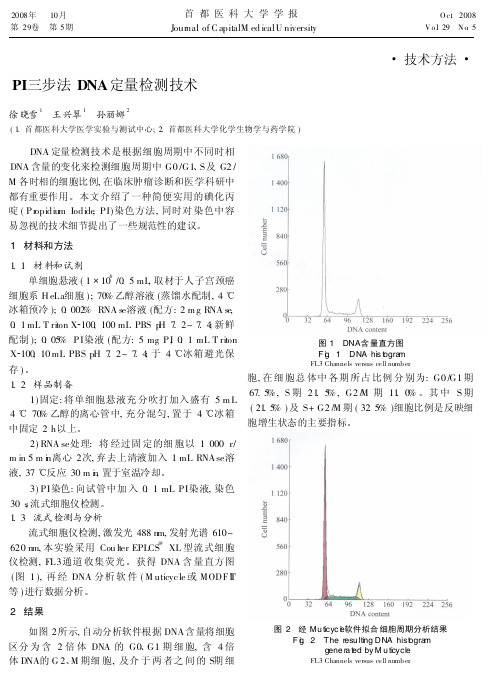
图 1 DNA含 量直方图 F ig. 1 DNA his togram FL3 Channels versus cell numb er.
胞, 在 细 胞总 体中 各期 所占 比例 分 别为: G0 /G1 期 67. 5% , S 期 21. 5% , G2 /M 期 11. 0% 。其 中 S 期 ( 21. 5% ) 及 S+ G2 /M 期 ( 32. 5% )细胞比例是反映细 胞增生状态的主要指标。
细胞色素C诱导HL-60细胞凋亡运用机制的探讨

3.5附图(图3.1—3.6本课题组已做)幽3.2相著显微镜’r观察培养24小时正常对照组细胞(400×)图3.3相差显微镜下观察培养24小时处理组细胞(400×)斟3.4荧光显微镜下经Hoechest33342、PI双染后对对照组细胞形态学观察(400×)Fig3.4MorophologyobservationofHL一60cellsofthecontrolgroupthroughfluorescencemicroscope图3.5细胞甑素C处理组经Hoechest33342、PI取染后细胞形态学观察(400X)Fig3,5MorophologyobservationofilL-60cellsthroughfluorescencemicroscopeaftertreatmentwithcytochtomeCfor24h.(1:normalcell,2:apoptoticcell,3:necroticcell).幽3.6州不同浓度细胞色素c处理l{L一60细胞24小时凋亡DNA凝胶电泳幽谱Fig3.6DNAfragmenteIectmphoretogramofHL・60cellsaftertreatmentwithdifferentconcentrationsofcytochtoraeCfor24h.1aneA:DNAmarker;lane13andC:controlgroups;laneD:the9375mg/Lgroup;laneE:the18.75mg/Lgroup;laneF:the37.5mg/Lgroup;laneG:the75meJLgroup;laneH:the150reg/Lgroup.H∞正gjZ一百()垂霍售餐壁羹邀。
一~;一一磁DNA(,ont口jlt^04nCl=l∞.7钾tI=‘.Dxqi;∞.2z‘2=27一aC:,E1=0丑竹x■d■,●‘.,Ch‘她.=1t图37细胞色素C浓度为0培养24小时的HL一60细胞流式结果Fig3.7TheresultofthecontrolgroupanalyzedbyFCM本实验数据资料用i±S表示,使用SPSSll.5统计软件进行统计描述,多个样本均数间的比较用方差齐性检验(Homogeneity—of-Variance),当总体方差齐同时,多个样本均数的比较采用采取随机区组设计的方差分析;当方差不齐时,选择随机区组设计的秩和检验(Friedman法)。
双染法检测细胞凋亡

双染法检测细胞凋亡(2011-11-16 20:38:42)标签:今天用双染法检测树突状细胞的凋亡情况,存有下面几个问题:1、对照组细胞体积太少,根本不够调试细胞团位置(和参数)、自身荧光和荧光补偿的。
大约需要3的细胞悬液才能够进行调试。
2、正式上样检测时应该从对照管开始,也就是说前面用作仪器条件调试的还要重新走样。
这样在编辑模板时,应该按照实际需要检测的样品管数进行设置。
原理:在正常细胞中,磷脂酰丝氨酸(, )位于细胞膜的内侧,但在细胞凋亡的早期,可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。
是一种分子量为35.8的2+依赖性磷脂结合蛋白,能与高亲和力特异性结合。
本试剂盒采用重组人融合蛋白作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
碘化丙啶( , )是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期细胞和死细胞,能够透过细胞膜而使细胞核红染。
因此将与匹配使用,就可以将亡早晚期的细胞以及死细胞区分开来(图)。
注意:1、和碘化丙啶染液应该避光存放和使用。
2、碘化丙啶有毒,应小心保存和使用,注意个人保护。
样品着色1. 离心收集悬浮细胞,微量离心机转速2000,离心时间5,弃培养基。
(贴壁细胞用不含的胰酶消化收集,胰酶消化时间不易过长,以防引起假阳性)2. 用冷洗涤细胞两次(2000,离心时间5收集细胞)。
3. 用400 1X 悬浮细胞,浓度大约为1 X 106 。
4. 在细胞悬浮液中加入5 ,轻轻混匀后于2-8°C 避光条件下孵育15分钟。
5. 加入10 后轻轻混匀于2-8°C 避光条件下孵育5分钟。
6. 在1 小时内用流式细胞仪或荧光显微镜检测。
A、流式细胞仪分析流式细胞仪激发光波长采用 488双波长激发, 510 检测荧光(1 )和>575 的发射检测。
细胞应可分成三个亚群:活细胞仅有很低的荧光强度,凋亡细胞有较强的绿色荧光,坏死细胞(包括极晚期凋亡细胞)有绿色和红色荧光双重染色。
图像流式检测细胞周期有丝分裂中期细胞比例的方法

图像流式检测细胞周期有丝分裂中期细胞比例的方法徐晓雪;邹林樾;户乃丽;田蜜【摘要】图像流式技术结合图像采集与处理技术和流式分析技术检测,使流式检测的指标更加丰富,分析方法更加复杂,分析的数据对应图像验证更为客观可靠,不仅可以应用其进行更为客观精确的流式检测,也可以利用图像所提供的形态和位置信息开展传统流式无法完成的检测.将其应用于经典的流式细胞周期检测可以对同样的标记样品进行更加深入的分析,介绍了如何使用图像流式分析技术对经典碘化丙啶(propidium iodide,PI)染色样品进行图像细胞周期分析,检测样品各周期细胞比例及确定有丝分裂中期细胞比例的方法,解决了经典流式细胞周期分析中仅凭荧光强度参数无法识别有丝分裂中期细胞的难题.【期刊名称】《继续医学教育》【年(卷),期】2017(031)011【总页数】2页(P133-134)【关键词】图像流式细胞术;细胞周期;有丝分裂【作者】徐晓雪;邹林樾;户乃丽;田蜜【作者单位】首都医科大学中心实验室,北京 100069;首都医科大学中心实验室,北京 100069;首都医科大学中心实验室,北京 100069;首都医科大学中心实验室,北京100069【正文语种】中文【中图分类】R3流式DNA定量检测技术,可以根据细胞周期中不同时项DNA含量的变化来检测细胞周期中G0/G1、S及G2/M各时项的细胞比例,在临床肿瘤诊断和医学科研中都有重要作用。
随着图像流式技术的出现,检测参数更加丰富,传统的流式细胞DNA定量检测也有了更加深入分析的可能,本文介绍了如何使用图像流式分析技术对经典碘化丙啶(propidium iodide,PI)染色样品进行细胞周期分析,检测样品各周期细胞比例及有丝分裂中期细胞比例的具体方法。
1.1 材料和试剂单细胞悬液(3×106个/ml,取材于培养的U87细胞);70%乙醇溶液(蒸馏水配制,4℃冰箱预冷);0.002%核糖核酸酶(Ribonuclease,RNase)溶液(配方:2 mg RNase,0.1 ml曲拉通X-100,100 ml 磷酸盐缓冲溶液pH 7.2~7.4;新鲜配制);0.05% PI染液(配方:5 mg PI,0.1 ml Triton X-100,10 ml PBS pH 7.2~7.4;于4℃冰箱避光保存)。
细胞凋亡流式细胞仪分析方法的比较及选择

细胞凋亡流式细胞仪分析方法的比较及选择韦伟;龚建平;裘法祖【期刊名称】《同济医科大学学报》【年(卷),期】1999(28)3【摘要】以凋亡诱导剂喜树碱影响下的HL-60细胞为检测对象,对以流式细胞仪为基础建立的3种细胞凋亡定量分析方法,进行了敏感性和特异性比较,结果:3种方法对凋亡均有定性和定量作用,均能同时提供细胞周期方面的信息。
加入喜树碱(CAM)120min后,低分子量DNA抽提后荧光染料(PI)染色法(Sub-G1法)和TdT酶探测DNA断端方法(TdT法)均可检测到凋亡细胞;而DNA变性后Y啶橙染色法(AO法)在加入CAM100min后,就能够证实细胞凋亡的存在。
TdT法所显示的检测结果最清晰、直观。
Sub-G1法操作最简便、迅速,费用最低。
结论:AO法敏感性好;TdT法更适合于细胞凋亡的细胞周期特异性分析;Sub-G1法最具实用性。
【总页数】4页(P181-184)【关键词】细胞凋亡;定量分析;流式细胞术【作者】韦伟;龚建平;裘法祖【作者单位】同济医科大学附属同济医院分子医学中心【正文语种】中文【中图分类】R329.28;R446.11【相关文献】1.应用流式细胞仪检测细胞凋亡的4种方法的比较 [J], 范宁娟;项萍;段敏2.探讨统计数据分析体系中统计分析方法的选择与比较 [J], 杨清华3.急性胰腺炎大鼠胰腺细胞凋亡分析方法的比较 [J], 李军成;吴浩荣;田斌;陈易人;冯一中;俞秋兴;毛棣华;冯萍;单为民;朱雪明4.适合流式细胞仪分析的小麦细胞核提取方法比较 [J], 孙永星;李素花;魏小丽;韩榕5.流式细胞仪检测细胞凋亡的几种方法的比较 [J], 吴建勇;赵德璋因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
两种碘化丙啶染色 DNA 定量方法检测 HL-60 细胞凋亡结果的比较
徐晓雪1 户乃丽1 孙丽娜2 孔 璐3*
( 1. 首都医科大学医学实验与测试中心,北京 100069; 2. 首都医科大学基础医学院药理学系,北京 100069; 3. 首都医科大学基 础医学院生物化学与分子生物学系,北京 100069)
基金项目: 国家自然科学基金面上项目( 81272406) 。This study was supported by National Natural Science Foundation of China( 81272406) . * Corresponding author,E-mail: konglu@ ccmu. edu. cn 网络出版时间:2014 - 12 - 09 16∶ 05 网络出版地址:http: ∥www. cnki. net / kcms / detail /11. 3662. R. 20141209. 1605. 027. html
的各组细胞悬液各加入 1 mL RNA 酶溶液,37 ℃ 反应
图 1 活细胞凋亡检测结果 Fig. 1 FITC Annexin V apoptosis analyse
A: unlabeled control; B: normal cells; C: camptothecin treated cells; FITC-A: fluorescein isothiocyanate Annexin V.
2014 年 12 月 第 35 卷 第 6 期
首都医科大学学报 Journal of Capital Medical University
Dec. 2014 Vol. 35 No. 6
[doi: 10. 3969 / j. issn. 1006-7795. 2014. 06. 028]
· 技术方法 ·
1) 凋亡检测: 对正常细胞和刺激凋亡细胞同时进
3) 显微镜观察: 每例 PI 染色标本在荧光倒置显
行 FITC Annexin V 标记凋亡检测。样品离心,弃去上 微镜下进行形态学观察,采集相差和荧光叠加图像, 清,细胞计数,各取单细胞悬液含有 3 × 105 个细胞,加 同时显示细胞结构和荧光标记情况。
11. 99 ± 2. 27
26. 75 ± 1. 87
0. 00
0. 00
* DNA synthetic phase.
图 3 PI 染色 HL-60 细胞相差与荧光叠加图像 Fig. 3 Phase contrast and fluorescence overlay photographys of HL-60 cells stained with PI
入 5 μL Annexin V-FITC 染液,充分混合,避光,室温下 1. 3 统计学方法
孵育 10 min,同时取相同量细胞加入 5 μL PBS 充分混
各组 DNA 含量分析所得数据使用 SPSS 12. 0 统
合,避光,室温下孵育 10 min,作为未染色对照。再向 计软件进行分析,数据描述采用均数 ± 标准差( x珋± s)
2. 2 流式 DNA 含量分析结果
个分布,胞膜光滑、完整,胞核圆形,染色均匀,可见分
如图 2 所示,A、B 为正常 HL-60 细胞的两种方法 裂项; 常规染色法: 刺激凋亡组细胞呈聚集分布,胞膜
DNA 定量结果,C、D 为刺激凋亡细胞的两种方法 DNA 褶皱增多,稍不完整,染色较均匀,分裂项形态不清
样本和对照管中分别加入 10 倍 稀 释 的 结 合 缓 冲 液 表示,将两种不同染色方法检测相同样品得到的结果
500 μL,避光,室温下孵育 5 min,全程采用无菌操作, 的百分数值进行配对 t 检验,以 P < 0. 05 为差异有统
流式细胞仪检测。
计学意义。
2) PI 染色 DNA 含量分析: 样品固定: 将单细胞悬 2 结果
1 mL 磷酸氢钠-柠檬酸缓冲液,室温孵育 10 min,300 g 样品的细胞为阳性细胞群,P2 门代表凋亡细胞。对照
( 相对离心力单位,g = 9. 8 m / s2 ) 离心 5 min,弃上清, 细胞 P2 = 0. 1% ,正常细胞样品 P2 = 2. 6% ,刺激凋亡
加入 PBS 充分混匀。RNA 酶处理: 将洗涤后弃去上清 细胞样品 P2 = 31. 7% 。结果见图 1。
取对数生长期 HL-60 细胞以 1 × 105 / mL 的密度 接种于 3 个 6 孔板,每孔接种 1. 5 mL,用含体积分数 为 10% 胎牛血清的 RPMI-1640 培养基在 5% ( 体积分 数) CO2 ,37 ℃ ,饱和湿度的细胞培养箱内培养 48 h, 其中 9 孔细胞作为正常培养对照,另外 9 孔细胞中各 加入 5 μL,1 mmol / L 喜树碱溶液,继续培养 2 h。分 别收集各孔细胞,得到 18 个同步培养细胞样品,取正 常培养和刺激凋亡细胞各 1 例,进行 FITC Annexin V 标记凋亡检测,验证凋亡的存在,再将剩余 16 例样品 各自充分混匀后平均分入两管,得两两一对的共 32 例样品,分为 4 组,分别是正常培养细胞常规染色组,
3 讨论
形态清晰,PI 染色明确。常规染色法: 正常细胞组细
作为 DNA 定量检测的经典方法的 PI 染色法被认
胞呈聚集分布,胞膜光滑、完整,胞核圆形,染色均匀, 为可以作为观察细胞凋亡的重要手段之一,但是由于
可见分裂项,胞质可见; 渗透染色法: 正常细胞组呈单 致凋亡因素、凋亡程度及细胞自身条件的差异,仅采
第6 期
徐晓雪等: 两种碘化丙啶染色 DNA 定量方法检测 HL-60 细胞凋亡结果的比较
825
图 2 DNA 含量直方图 Fig. 2 DNA content histograms of corresponding
HL-60 cells untreated( A,B) and treated with camptothecin ( C,D) ; Cells represented by A,C histogram were stained by conventional method while those represented by B,D histogram treated by phosphate-citrate buffer rinse method; FL3 LIN: fluorescein three linearity.
定量结果,各组数据统计分析结果详见表 1,对于正常 晰; 渗透染色法: 刺激凋亡细胞组呈单个分布,部分细
细胞两种方法检测结果差异无统计学意义,对于刺激 凋亡细胞两种方法检测结果差异有统计学意义。 2. 3 荧光显微镜观察结果
镜下可见( 图 3) 细胞经过 RNA 酶处理后细胞核
胞发生胞膜皱缩、包膜破裂,胞核皱缩或松散,核染色 变淡或染色区缩小,可见空细胞。
表 1 各组 DNA 含量分析数据统计结果
Tab. 1 The statistical analysis of the data of DNA content analysis
( %)
Group
Conventional method Phosphate-citrate buffer rinse method P
本实验以 DNA 合成抑制剂喜树碱作用于对数生 长期的 HL-60 细胞,促进细胞凋亡,并用 Annexin V 标 记流式检测确认细胞凋亡存在,比较了常规 PI 单色 DNA 定量检测法与渗透法 PI 单色 DNA 定量检测法
检测正常和凋亡细胞样品的结果,同时对各组细胞进 行了形态学观察。
1 材料和方法
碘化丙啶( propidium iodide,PI) 是插入性核酸染 料,直接插入双链核酸的 2 个碱基对之间,每 5 个碱 基插入 1 个荧光分子,与核酸的结合均匀、稳定。细 胞经过 RNA 酶处理后,PI 可以与细胞内 DNA 特异性 结合,在流式细胞仪上经 488 nm 激光激发,发出峰值 610 ~ 620 nm 的 荧 光,可 以 准 确 的 反 映 细 胞 群 体 中 DNA 含量的分布情况,适用于 DNA 定量检测。根据 细胞周期中不同时项 DNA 的变化来检测细胞周期中 DNA 合成 前 期 ( G0 / G1 期) 、DNA 合 成 期 ( S 期) 与 DNA 合成后期( G2 期) 各时项的细胞比例。因为 PI 是适用于所有流式细胞仪的染料,这一染色技术在临 床肿瘤诊断和医学科研中被普遍的采用,常规使用的 染色方法是包括固定、RNA 酶处理、PI 饱和染色 3 个 关键步骤的 3 步法 PI 染色技术[1]。在一些研究中,当 细胞在生理或病理条件下发生了凋亡,DNA 损伤,细 胞内 DNA 降低,也可以采用 3 步法 PI 染色检测亚 G1 峰( 也称作凋亡峰) ,用于凋亡细胞比例和特征的分 析[2]。但是在实 际 应 用 中,由 于 凋 亡 时 相 的 不 同,当 凋亡细胞中 DNA 损伤部分没有完全脱出细胞时,往 往检测不到明确可辨的亚 G1 峰,敏感度较低。作为 细胞凋亡检测的经典方法之一的彗星检测[3],以细胞 在电泳移 动 中 DNA 的 迁 移 形 态 作 为 凋 亡 的 特 征 指 标,此技术中比较关键的一步即采用碱性高渗试剂使 凋亡细胞中断裂的 DNA 碎片脱出细胞,从而在电泳 迁移中呈现出彗星尾样的拖痕,本课题组利用类似方 法,用高渗缓 冲 液 作 用 于 固 定 后 的 悬 浮 细 胞,使 凋 亡 细胞内断裂 DNA 较彻底的脱出细胞外,再进行 DNA 定量检测,提高对细胞凋亡的识别度和敏感性[4]。
824
首都医科大学学报
第 35 卷
正常培养细胞渗透染色组,刺激凋亡 细 胞 常 规 染 色 30 min,置于室温冷却。PI 染色: 向试管中加入 0. 1
组,刺激凋亡细胞渗透染色组。
mL PI 染液,染色 30 s,流式细胞仪检测,Multicycle 软
