膜片钳常见问题解答
丁香园膜片钳技术讨论区资料汇编

丁香园膜片钳技术讨论区资料汇编整理人:xiaoxuanzi发起人:tianx7752006年6月目录第一节膜片钳技术介绍 (1)应用 (1)基本概念 (2)第二节仪器操作和维护 (3)仪器的使用 (3)噪声 (4)玻璃微电极的制备 (5)第三节实验操作 (7)1.细胞的分离、培养 (7)(1)心肌细胞 (7)(2)平滑肌细胞 (17)(3)其他细胞 (19)2.电极的拉制与电镀 (23)3.电极内外液与渗透压 (25)4.串联、封接、电极电阻 (28)5.补偿 (37)6.刺激方案 (40)7.动作电位记录 (42)8.电流记录 (42)(1)钙电流 (42)(2)钾电流 (45)(3)钠电流 (47)(4)其他电流 (48)9.穿孔 (50)10.单通道记录 (51)11.脑片 (54)12.数据分析与处理 (55)第四节 相关电子文献及书籍 (61)第一节 膜片钳技术介绍一、应用1.全细胞记录技术的应用[Cactuswzw](1)离子通道宏观性质的分析,例如,离子通道的性质和分类(电压门控通道、膜受体激活通道、配体门控通道、胞内第二信使激活通道等)(2)离子通道微观性质分析,例如单一离子通道活动的测定的测定,离子通道的构造,分布和机能的分析等。
(3)膜电容的测量及其对细胞分泌活动的研究。
(4)胞内钙离子浓度和钙通道电流的同时定量检测。
(5)组织切片的全细胞记录。
(6)植物细胞的电生理研究。
二、基本概念1.刚刚接触patch,有些概念都很模糊holding potential与command potential?Axon200B的放大器控制面板上有ext. command,又是什么东东?都分别什么时候给予?在我理解,pipette capacity compesation就是快电容补偿,而Cm补偿为慢电容补偿,那为何Axon200B的面板上在pipette capacitance compensation下面列了FAST和SLOW的magnitude以及时间常数的调节扭?[baxiansheng]Holding potential 是钳制电压,这是实验中从头至尾通过电极用于钳制细胞的一个电压,和膜电位的关系取决于采用的实验模式。
膜片钳之问题汇总

膜片钳网上问题收集汇总膜片钳之实验操作篇1、消化分离海马锥体细胞时,应该通氧气?不用通氧,直接放入CO2 孵箱里就行了。
电极内液应该过滤完分装入EPPENDORF 管,用时再拿出来。
尽量避免污染。
另外,环境中的灰尘也要考虑。
细胞外液要及时清洗。
2、全细胞破膜以后串联电阻总是在不断上升,膜渐渐的又融合起来了。
有没有什么办法解决串联电阻上升是由于破膜不完全,或者电极内液有污染堵塞电极所至。
解决方法:适当增大电极的口径,以利于破膜;电极内液使用前一定用0.22目滤器过滤;灌注电极液的器具也要保持洁净;电极现用现拉;电极下降入细胞外液时给予一定的正压防止此过程中灰尘堵塞电极。
3、破膜以后封接电阻有所降低的话,会不会影响记录到的动作电位?通常情况下offset调0,是在zero程序下,holding在0,给一个5-10mv,持续2ms的电压刺激,然后用offset补偿电极尖端电位。
axon 破膜后电阻当然会下降,根据我的经验瞬时电阻应在100M以上,之后会上升,以稳定在500M以上的为佳,越高越好。
4、第一军医大学高天明教授组分离大鼠海马神经元的方法:脑片的制备与神经元的急性分离成年Wistar大鼠(200~250 g)麻醉后(水合氯醛40 mg/100 g)迅速断头取脑, 置于0~4℃的高浓度蔗糖溶液中冷冻约2 min, 再用振动切片机(World Precision Instruments MA752-045)切成400 μm厚的脑片。
高浓度蔗糖溶液的成分为(mmol/L): 蔗糖 234、 KCl 2.5、 Na2HPO4 1、 MgSO4 4、 CaCl2 0.1、 HEPES 15、葡萄糖 11、用1 mol/L的NaOH调pH值至7.3。
将切好的脑片置于通以95% O2+5% CO2混合气的EBSS液中孵育1~6 h (室温), 然后将脑片移入低Ca2+的羟乙基磺酸钠缓冲液中, 并在解剖显微镜下用细解剖针按Paxinos图谱所示, 将海马CA1区含锥体细胞层的一小块组织从脑片上分割下来, 将组织块放入用100% O2饱和的HBSS液中(33℃)用链白蛋白酶(protease XIV, 1.1~1.4 mg/ml)消化30~45 min后取出, 置于低Ca2+的羟乙基磺酸钠缓冲液中清洗3次, 用尖端经火抛光处理的吸管(口径依次为500、 300和150 μm)将之吹打成细胞悬液, 并移数滴至盖玻片上。
模具钳工常见问题解答1000例6.doc

模具钳工常见问题解答1000例(6)1:两圆锥管斜交,其相贯线用什么方法求?答:用辅助球面法。
2:用辅助球面法求相贯线时必须满足哪两个条件?答:满足一是回转体相贯,二是回转体的轴线要相交且要反映实长。
3:当一直线平行于一个投影面时,该直线的投影具有什么性?答:具有真实性。
4:用什么方法可做出圆方过渡接头的展开图?答:用三角形法可作出。
5:冲裁用的主要设备是什么压力机?答:主要是曲柄压力机和摩擦压力机。
6:冲裁时,板料的变形过程分为哪三个阶段?答:弹性变形阶段;塑性变形阶段;剪裂阶段。
7:液压机是利用什么来传递运动和增力的?答:利用水和油的静压力。
8:大批量生产冲裁件时,一般选用什么冲裁模?答:选用带导柱冲裁模。
9:再材料弯曲过程中,怎样防止偏移?答:采用加压矫正法。
10:一般拔缘的方法有哪些?答:有通用工具拔缘;型胎拔缘。
11:放边的方法主要有哪些?答:有打薄和拉薄。
12:什么叫收边?答:把直角板材收成一个凸曲线弯边的工作。
13:落压成型的主要设备是什么?答:是落锤。
14:矫正的方法很多,根据外力的来源和性质可分为哪几种?答:可分为手工矫正,机械矫正,火焰矫正。
15:常用的板材矫正设备有哪些?答:有钢板矫直机,卷板机和压力机。
16:钢结构变形的原因有哪些?答:一种是受外力后产生的变形,一种是由内应力引起的变形。
17:消除焊接残余应力的主要方法有哪些?答:有整体高温回火和局部高温回火,温差拉伸法,机械拉伸法,振动法。
18:冷矫正只适用哪些材料?答:由于有冷作硬化现象存在,所以只适用塑性好,变形不严重的材料。
19:钣金工常用的焊接方法有什么?答:有电弧焊,气焊,电阻焊,钎焊。
20:钣金工常用的连接方法有什么?答:榫连接,铆接,螺栓连接,焊接。
21:获得牢固钎焊接头的关键是什么?答:一方面是熔化的钎料能很好的流入接头间隙中去,另一方面是熔融的钎料流入接头间隙后能与焊件金属相互作用及随后冷却结晶,形成牢固接头。
模具钳工常见问题解答1000例3

1:金属结构的要紧形式有哪些?答:有框架结构、容器结构、箱体结构、一样构件结构。
2:铆工操作按工序性质可分为几部分?答:分为备料、放样、加工成型、装配连接。
3:金属结构的连接方法有哪几种?答:有铆接、焊接、铆焊混合联接、螺栓联接。
4:在机械制造业中铆工属于(热加工类)。
5:什么叫热加工?答:金属材料全部或局部加热加工成型。
6:珩架结构是以什么为主体制造的结构?答:是以型材为主体。
7:容器结构是以什么为主体制造的结构?答:是以板材为主体。
8:箱体结构和一样结构是以(板材)和(型材)混合制造的结构。
9:备料是指(原材料)和(零件坯料)的预备。
10:钢板和型材在(运输、吊放、储存)的过程中可造成变形。
11:钢材的变形会阻碍零件的(吊运、下料、气割)等工序的正常进行。
12:零件在加工过程中产生的变形如不进行矫正,则会阻碍结构的(正确装配)崐13:焊接产生的变形会降低装配的(精度),使钢结构内部产生附加应力,阻碍(构件的强度)。
14:扁钢的变形有(弯曲、扭曲、弯扭复合变形)。
15:多辊矫正机依照轴辊的排列形式和调剂辊的位置可分为哪几种?答:可分为上下辊列平行矫正机、上下辊倾斜矫正机。
16:火焰校正的加热方式有哪些?答:有点状、线状、三角形加热。
17:火焰矫正的成效由什么因素决定?答:由加热的位置和加热温度决定。
18:矫正的方法有哪些?答:机械校正、手工矫正、火焰矫正、高频热度铰正。
19:什么是制作金属结构的第一道工序?答:放样和号料是制作金属结构的第一道工序。
20:放样与号料对产品的阻碍有哪些?答:它将直截了当阻碍产品质量对生产周期及成本都有直截了当阻碍。
21:放样常用的量具有什么?答:有木折尺、直尺、钢卷尺、钢板尺等。
22:放样常用的工具有什么?答:有划规、地规、样冲、划针、小手锤。
23:实尺放样的程序是什么?答:程序是线型放样、结构放样、展开放样。
24:展开放样的内容有什么?答:有板厚处理、展开作图、制作号料样板。
膜片钳如何消除噪音

膜片钳实验系统震动消除和噪声消除震动的消除方法通过仔细的设计,是可以避免震动的危害,例如在半夜的地下室,各种白天的震动都消失了。
但预防震动比仅仅靠小心更重要。
需要一个用来补偿微操纵器的复杂的空气隔离实验台和一个稳定良好设计的微操纵器。
微操纵器必须是坚固而紧凑的。
因此其移动部分(包括从微操纵器Holder、电极尖端、到chamber中的细胞),这部分应尽可能短。
微操纵器应靠近chamber,应直接安装在显微镜平台上。
记录放大器的headstage,应直接固定在微操纵器上(而不要挂在一个杆子上),电极也应该短。
在做膜片钳记录时,最好使用远程控制微操纵器以消除手的震动。
现在,有3种主要类型的远程控制微操纵器:压电驱动、电机驱动、液压/气压驱动。
1 压电微操纵器坚固紧凑,有优异的长期稳定性,且移动非常平滑,没有改变方向时的后冲。
(Burleigh PCS5x00, PCS6x00系列)2 电机微操纵器坚固紧凑。
但是,它们常常缓慢而笨拙地到位,在改变方向时,可能出现后冲。
3 而液压/气压微操纵器驱动非常快,很方便,且没有后冲,但有些型号在用于特定的设置时,可能发生缓慢的漂移。
非常适合做注射微操。
防震台一般包括一个很重的厚板,放在气垫支持上。
这样的防震台都比较昂贵。
但是,自制的防震台也是可选的,例如将厚板放置在部分充气的内胎或网球上,特别是使用了高品质的微操纵器之后,一般可以不用昂贵的气垫防震台。
噪声消除方法外来的电气影响(非仪器内部噪声),可归类为3种:辐射拾取,磁感应拾取,地环路噪声。
辐射拾取辐射拾取的例子包括:从灯源和电源插座来的工频噪声(嗡嗡声hum);计算机来的高频噪声。
这种类型的噪声一般可以通过如下方法削减:在chamber和电极周围放置导体屏蔽层,使用带屏蔽的BNC电缆。
屏蔽层连接到微电极放大器的信号地。
一般的,法拉第屏蔽笼可以用来屏蔽微电极和chamber。
作为替代,下列方法也能削减噪声:(1)(1)找到噪声源,使用一个开路的示波器探针,并屏蔽它。
膜片钳之仪器操作与维护篇

膜片钳之仪器操作与维护篇1、电极一旦拉制成功后,其尖端必须作进一步的处理。
目的之一是为了减小电极内部与溶液之间的电容,即在电极末梢前数微米处,涂敷一层疏水材料,如硅酮树脂(Sylgard)。
这种物质能够防止液膜爬上电极。
另一目的是为了对电极尖端作优化处理,如同热抛光的方法使电极尖端光滑、周围均匀,以提高实验过程中的封接成功率。
2、关于电极的问题a. 洁净的电极是封接的关键。
电极需要在使用前拉制完成放在密闭容器中,通常在12小时内用掉比较好;b. 内液(确切的说是电极液)需要过滤;c. 在电极入水之前可以加一个正压,可以吹开电极尖端的液体及灰尘;d. 如果不用灌流的话,最好bath solution也要过滤。
e、电极拉制成功以后,常置于一有盖的容器内,2-3小时内必须使用,电极使用前要进行充灌。
在充灌前,电极内液要用的滤膜或滤纸进行过滤。
利用玻璃管的虹吸作用,溶液可从电极尖端吸入,也可利用5ml注射器在尾端加负压以实现充灌,随后电极从尾端充灌。
电极内液不能漏到夹持器,会使其内表面变湿形成薄膜从而产生热噪声,在充灌时,电极内出现的气泡可以通过轻敲电极而消失。
3、降低噪声的关键是地线和屏蔽,第一地线接地要好;第二要注意将一些容易产生噪声的设备屏蔽好,比如显微镜灯光的电源、电动微超的马达、监视和记录的电脑以及一些可能产生噪声的电源线,总之你可以用排除法一一试验,肯定会降低噪声的,一般降低到几个pA/fA级即可。
另外,你的负压也可以用一个“U”形管通过3通管加上。
我认为屏蔽很重要哦,以前我在实验中,常遇到电极入水后方波有50HZ干扰,有时还跳动,很是心烦,想了很多办法就是去不掉,包括接地线,镀银丝、参比电极,清洗Holder等等,甚至怀疑仪器有问题,感到有些绝望了!后来发现灌流时干扰明显,把灌流装置控制电源搬到法拉第笼子外,一切就ok了!而且发现只要有电源线进入屏蔽笼,即使没有通电,也有交流干扰,所以所有进入屏蔽笼的电源线都应该用屏蔽线(而不是一般电线)。
膜片钳技术

2008级硕士研究生膜片钳技术试题请用A4纸书面手写,严禁抄袭。
下学期开学后两周内交于先知楼2002室陆巍老师处,过期不侯!问答题(共100分)1、什么是膜片钳技术?它的基本工作原理是什么?答:膜片钳技术是以记录通过离子通道的离子电流来反映细胞上单一的(或多个的)离子通道分子活动的技术,具体说来就是利用微玻管(膜片电极或膜片吸管)接触细胞膜,以吉欧姆(GΩ)以上的阻抗使之封接,使与电极尖开口处相接的细胞膜的小区域(膜片)与其周围在电学上绝缘,在此基础上固定电位,对此膜片上的离子通道的离子电流(pA级)(10-12A)进行监测记录的方法。
膜片箝的基本原理是:用一个尖端光洁、直径约0.5-3um的玻璃微电极同神经或肌细胞的膜接触而不刺入,然后在微电极的另一段开口施加适当的负压,将与电极尖端接触的那一小片膜轻度吸入电极尖端的纤细开口,这样在小片膜周边与微电极开口的玻璃之间形成紧密封接,在理想状态下电阻可达数十兆欧。
实际上把吸附在微电极尖端开口的那小片膜同其余部分的膜在电学上完全分开,如果这小片膜上只含一个或几个通道分子,那么微电极就可以测量出单一开放的离子电流或电导,对离子通道的其他功能进行研究。
2、膜片钳记录方法分为四类?各有何特点?答:膜片箝有四种分类:(1)单通道记录法-细胞吸附模式(Cell-attached Mode)微电极在显微镜下贴近细胞后,给微电极施加一负压,形成高阻抗封接。
此时可看到背景噪音明显减少,通常选取电极下仅有一个通道的膜片进行分析,即单通道记录,以利于不失真的观察一个通道的活动状态。
该方法的优点是对细胞膜结构和调制系统干扰最小,能准确反映通道的活动状态并对此进行客观分析。
但缺点是电流小,分辨率地,对技术要求高,难度较大,且工作量大而成功率又较低。
(2)全细胞记录法(Whole-cell recording)在高阻抗封接做好后,再给一个很小的负压,将电极覆盖的膜吸破,使电极内与整个细胞内相通,用这个方法可记录进出整个细胞的电流。
膜片钳技术及其应用

膜片钳技术可以用于研究细胞信号转导过程中离子通道和受体的变 化,了解信号转导的机制。
细胞功能调控的研究
膜片钳技术可以用于研究细胞功能调控的机制,例如细胞兴奋性的 调节和细胞内离子浓度的变化。
04 膜片钳技术的优势与局限 性
膜片钳技术的优势
高灵敏度
细胞无损
膜片钳技术具有高灵敏度,能够检测单 个离子通道的活动,从而提供关于细胞 膜电位和离子通道功能的重要信息。
膜片钳技术可以在保持细胞完整性的 情况下进行实验,不会对细胞造成严 重损伤或干扰细胞的正常功能。
实时监测
膜片钳技术可以对细胞膜电位进行实时 监测,从而了解离子通道的动态变化, 有助于深入理解细胞生理和病理过程。
膜片钳技术的局限性
1 2 3
实验条件要求高
膜片钳技术需要高精度的实验设备和条件,包括 低温、低噪声和低阻抗等,这增加了实验的难度 和成本。
03
04
05
膜片钳放大器
微操纵器
细胞培养皿或显 微镜载玻片
电极溶液
细胞内和细胞外 灌流液
用于放大细胞膜电信号, 提高信号的检测灵敏度。
用于精确控制电极的移动 ,以便在细胞膜上定位和 进行膜片钳实验。
用于培养和固定细胞,以 便进行膜片钳实验。
用于填充电极,以保持电 极的湿润和导电性。
用于维持细胞内外环境的 稳定,并排除干扰实验的 物质。
03
在单细胞水平上研究细胞信号转导和离子通道功能,深入了 解细胞生理和病理过程。
膜片钳技术与其他技术的联合应用
结合光学成像技术,利用膜片钳技术对神经元电生理特性进行同时监测和成像,实现多参数的同时测 量。
与基因编辑技术结合,利用膜片钳技术对特定基因表达的离子通道进行功能研究,深入了解基因与离子 通道的关系。
膜片钳技术原理及相关基本知识0306

失活 状态
Inactive state
复活
recovery
静息 状态
resting state
开放 状态
激活
activation
open state
离子通道的功能
(Function of Ion Channels)
1.产生细胞生物电现象,与细胞兴奋性相关。
2.神经递质的释放、腺体的分泌、肌肉的运动、 学习和记忆 3.维持细胞正常形态和功能完整性
• 机械门控通道
一类是牵拉活化或失活的离子通道,另一类是剪切力敏 感的离子通道,前者几乎存在于所有的细胞膜,研究较多 的有血管内皮细胞、心肌细胞以及内耳中的毛细胞等,后 者仅发现于内皮细胞和心肌细胞
• 水通道
2003年诺贝尔化学奖: Pete Agre、 Roderick MacKinnon
电生理学研究简史:
• 二千年前,观察到电鳐鱼放电现象。 • 1825 年, Nobili 发明了电流计,用其证实了肌 •
肉有电流存在。 1912 年, Bridge 确定了 AP 的“全或无”现象。 同年,Oxford提出了突触的概念及反射弧的生 理学研究,获1932年Nobel奖。
• 1937年,Hodgkin和Huxley在枪乌贼巨大神经轴 •
离子通道结构研究:目前,绝大
多数离子通道的一级结构得到了阐明 ,但最根本的还是要搞清楚各种离子 通道的三维结构,在这方面,美国的 二位科学家彼得· 阿格雷和罗德里克· 麦 金农做出了一些开创性的工作,他们 利用X光绕射方法得到了K离子通道的 三维结构,二位因此获得2003年诺贝 尔化学奖。有关离子通道结构不是本 PPT的重点,可参考杨宝峰的≪离子通 道药理学≫和Hill的≪ Ionic Channels Of Excitable Membranes ≫. .
膜片钳的原理和应用

膜片钳的原理和应用膜片钳的原理膜片钳是一种常见的机械制动器,它的工作原理基于膜片的弹性变形和钳片的夹持作用。
膜片钳由膜片和钳片组成,通过外部力的作用,使膜片产生变形,进而通过钳片的夹持实现制动功能。
膜片钳的主要部件是膜片,膜片通常由弹簧钢或不锈钢材料制成,具有良好的弹性。
当膜片钳受到外部力的作用时,膜片会发生弹性变形,从而产生一定的弹性力,通过这种弹性力的作用,将制动器与被制动器之间产生接触,并通过膜片的变形实现制动。
膜片钳的应用膜片钳由于其结构简单、可靠性高、使用寿命长等特点,被广泛应用于各个领域。
1. 汽车制动系统膜片钳在汽车制动系统中起到至关重要的作用。
汽车制动系统中的制动器通常由膜片钳和摩擦材料组成。
当驾驶员踩下制动踏板时,膜片钳受到踏板力的作用,膜片钳的膜片发生弹性变形,钳片夹持摩擦材料与制动器之间的摩擦面,实现制动效果。
2. 工业机械膜片钳在工业机械中也有广泛的应用。
例如,膜片钳可以用于制动装置,通过膜片的变形实现机械的制动。
此外,膜片钳还可以用于离合器,通过膜片的弹性变形实现传动效果。
3. 制动防抱死系统膜片钳还可以应用于汽车的制动防抱死系统中。
制动防抱死系统通过利用膜片钳的快速反应和可靠的制动效果,实现对车轮的减速和控制,防止车轮抱死,提高行车安全性。
4. 其他领域膜片钳还可以应用于其他领域,如航空航天、医疗设备等。
在航空航天领域,膜片钳可以用于飞机的刹车系统,通过膜片钳的制动作用实现飞机的停止。
在医疗设备中,膜片钳可以用于手术器械的夹持,实现准确和可靠的操作。
总结膜片钳是一种常见的机械制动器,通过膜片的弹性变形和钳片的夹持作用实现制动功能。
膜片钳由于其结构简单、可靠性高、使用寿命长等特点,在汽车制动系统、工业机械、制动防抱死系统以及其他领域都有广泛的应用。
膜片钳的应用使得各个领域的设备和机械能够实现安全、可靠的操作。
膜片钳技术
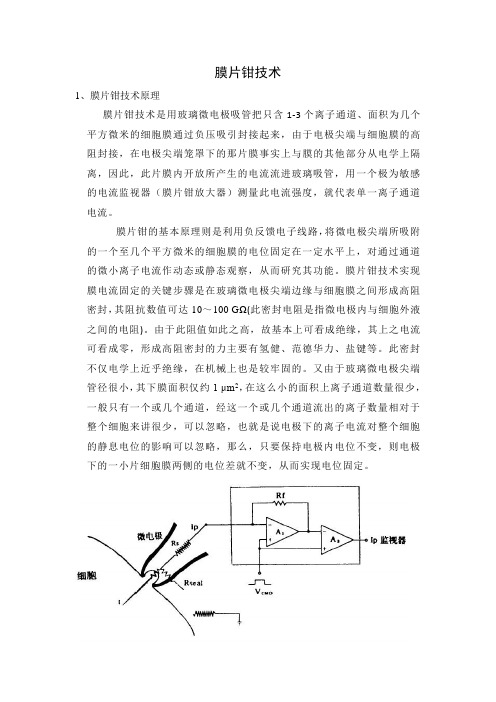
膜片钳技术1、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳的基本原理则是利用负反馈电子线路,将微电极尖端所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。
膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极尖端边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。
由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。
此密封不仅电学上近乎绝缘,在机械上也是较牢固的。
又由于玻璃微电极尖端管径很小,其下膜面积仅约1 μm2,在这么小的面积上离子通道数量很少,一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。
膜片钳技术的原理图[51]Rs是与膜片抗阻串联的局部串联电阻(或称入路阻抗),Rseal是封接阻抗。
RS通常为1~5MΩ,如果Rseal高达10GΩ以上是成为Ip/I=Rseal/(Rs+Rseal)-1。
此Ip可作为I~V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压下降而被检测出。
实际上这是场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场效应管运算放大器(A2)时被减掉。
本实验采用的是全细胞记录模式。
全细胞记录构型(whole-cell recording)高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。
膜片钳常见问题解答

膜片钳常见问题解答膜片钳常见问题解答(一)1.什么是电压钳和膜片钳,有什么区别?答:电压钳技术是通过向细胞内注射一定的电流,抵消离子通道开放时所产生的离子流,从而将细胞膜电位固定在某一数值。
由于注射电流的大小和离子流的大小相等、方向相反,因此它可以反映离子流的大小和方向。
膜片钳技术钳制的是“膜片”,是指采用尖端经过处理的微电极和细胞膜发生紧密接触,使尖端下的这片细胞膜在电学上和其它细胞膜分离,这大大降低了背景噪声,使单通道微弱的电流得以分辨出来。
采用电压钳技术将这片膜的电位钳制在某一数值,可记录到单通道电流。
从这点上看,膜片钳技术是特殊的电压钳技术。
随着膜片钳技术的发展,它已经不仅仅局限于“膜片”的概念,也不仅仅采用电压钳技术,还常采用电流钳技术。
2. 离子通道电导的单位是什么?如何换算?答:离子通道电导的单位是西门子(Siemens, S),旧称姆欧,即安培/伏特。
常用皮西门子(pS),1pS=10E-12 S,1,000 pS=1 pA/mV。
3. MultiClamp 700A中,在放大器和信号器的连接中,放大器的raw output是否需要连接信号器的 ANALOG IN 接口? scaled output,raw output有什么区别?答:Raw output为原始信号输出,放大器输出的信号没有经过处理(如滤波、放大等),scaled output为定标输出,输出的信号经过了处理。
后者的灵活度大,因此多采用。
目前膜片钳放大器多设有scaled output,你可将其和数模转换器(你所说的信号器)的ANALOG IN连接,这样放大器的输出信号就能传送给计算机了,此时已经没有必要再使用Raw output了。
若你想记录两个输出,则需要将Raw output和数模转换器的另一个ANALOG IN连接。
4. 在Clampex的Edit protocol/Wave中,Step和ramp各有什么适用范围?答:Ramp多用于电流衰减缓慢的离子通道以及失敏不明显的受体通道的I-V曲线制作,如多用于钾、钙离子通道。
膜片钳之仪器操作与维护篇.

膜片钳之仪器操作与维护篇1、电极一旦拉制成功后,其尖端必须作进一步的处理。
目的之一是为了减小电极内部与溶液之间的电容,即在电极末梢前数微米处,涂敷一层疏水材料,如硅酮树脂(Sylgard)。
这种物质能够防止液膜爬上电极。
另一目的是为了对电极尖端作优化处理,如同热抛光的方法使电极尖端光滑、周围均匀,以提高实验过程中的封接成功率。
2、关于电极的问题a. 洁净的电极是封接的关键。
电极需要在使用前拉制完成放在密闭容器中,通常在12小时内用掉比较好;b. 内液(确切的说是电极液)需要过滤;c. 在电极入水之前可以加一个正压,可以吹开电极尖端的液体及灰尘;d. 如果不用灌流的话,最好bath solution也要过滤。
e、电极拉制成功以后,常置于一有盖的容器内,2-3小时内必须使用,电极使用前要进行充灌。
在充灌前,电极内液要用0.2um的滤膜或滤纸进行过滤。
利用玻璃管的虹吸作用,溶液可从电极尖端吸入,也可利用5ml注射器在尾端加负压以实现充灌,随后电极从尾端充灌。
电极内液不能漏到夹持器,会使其内表面变湿形成薄膜从而产生热噪声,在充灌时,电极内出现的气泡可以通过轻敲电极而消失。
3、降低噪声的关键是地线和屏蔽,第一地线接地要好;第二要注意将一些容易产生噪声的设备屏蔽好,比如显微镜灯光的电源、电动微超的马达、监视和记录的电脑以及一些可能产生噪声的电源线,总之你可以用排除法一一试验,肯定会降低噪声的,一般降低到几个pA/fA级即可。
另外,你的负压也可以用一个“U”形管通过3通管加上。
我认为屏蔽很重要哦,以前我在实验中,常遇到电极入水后方波有50HZ干扰,有时还跳动,很是心烦,想了很多办法就是去不掉,包括接地线,镀银丝、参比电极,清洗Holder等等,甚至怀疑仪器有问题,感到有些绝望了!后来发现灌流时干扰明显,把灌流装置控制电源搬到法拉第笼子外,一切就ok了!而且发现只要有电源线进入屏蔽笼,即使没有通电,也有交流干扰,所以所有进入屏蔽笼的电源线都应该用屏蔽线(而不是一般电线)。
膜片钳技术原理及相关基本知识

膜片钳技术可以用于研究内分泌系统的电生理特性,了解激素分泌的 调节机制。
其他领域的应用
肿瘤学研究
膜片钳技术可以用于研究肿瘤细胞的 电生理特性,了解肿瘤的发生和发展 机制。
免疫学研究
膜片钳技术可以用于研究免疫细胞的 电生理特性,了解免疫反应的调节机 制。
THANKS
感谢观看
膜片钳技术可以用于药物筛选, 快速筛选出具有潜在治疗作用的 药物。
膜片钳技术可以用于研究药物对 离子通道的影响,了解药物的副 作用和不良反应。
生理学领域的应用
心血管系统研究
膜片钳技术可以用于研究心血管系统的电生理特性,了解心脏和血 管的电活动和功能。
呼吸系统研究
膜片钳技术可以用于研究呼吸系统的电生理特性,了解呼吸肌的电 活动和功能。
膜片钳技术的应用领域
生理学研究
研究细胞膜离子通道的电生理 特征和功能,揭示生理状态下
细胞膜电活动的规律。
药理学研究
研究药物对离子通道的作用机 制和效果,为新药研发提供实 验依据。
神经科学研究
研究神经元和神经网络的电活 动和信息传递机制,揭示神经 系统的工作原理。
疾病机制研究
研究疾病状态下细胞膜离子通 道的异常变化,为疾病诊断和
数据采集
使用膜片钳系统记录细胞膜 电位变化,通过放大器和记 录器获取数据。
数据筛选
排除异常或噪声数据,确保 数据质量。
数据转换
将原始数据转换为适合分析 的格式,如电压值或电流值 。
数据分析方法
统计分析
对数据进行统计分析,如平均值、标准差、相 关性等。
频谱分析
对数据进行频谱分析,以了解信号的频率成分。
膜片钳技术适用于多种细胞 类型,包括神经元、肌肉细 胞、上皮细胞等,具有广泛 的应用范围。
膜片钳问题解答

膜片钳常见问题解答1.什么是电压钳与膜片钳,有什么区别?答:电压钳技术是通过向细胞内注射一定的电流(怎么注射),抵消离子通道开放时所产生的离子流,从而将细胞膜电位固定在某一数值。
由于注射电流的大小与离子流的大小相等、方向相反,因此它可以反映离子流的大小和方向。
膜片钳技术钳制的是“膜片”,是指采用尖端经过处理的微电极与细胞膜发生紧密接触,使尖端下的这片细胞膜在电学上与其它细胞膜分离(怎么分离),这大大降低了背景噪声,使单通道微弱的电流得以分辨出来。
采用电压钳技术将这片膜的电位钳制在某一数值,可记录到单通道电流。
从这点上看,膜片钳技术是特殊的电压钳技术。
随着膜片钳技术的发展,它已经不仅仅局限于“膜片”的概念,也不仅仅采用电压钳技术,还常采用电流钳技术。
2. 离子通道电导的单位是什么?如何换算?答:离子通道电导的单位是西门子(Siemens, S),旧称姆欧,即安培/伏特。
常用皮西门子(pS),1pS=10E-12 S,1,000 pS=1 pA/mV。
3. MultiClamp 700A中,在放大器和信号器的连接中,放大器的raw output是否需要连接信号器的ANALOG IN 接口? scaled output,raw output有什么区别?答:Raw output为原始信号输出,放大器输出的信号没有经过处理(如滤波、放大等),scaled output为定标输出,输出的信号经过了处理。
后者的灵活度大,因此多采用。
目前膜片钳放大器多设有scaled output,你可将其与数模转换器(你所说的信号器)的ANALOG IN连接,这样放大器的输出信号就能传送给计算机了,此时已经没有必要再使用Raw output了。
若你想记录两个输出,则需要将Raw output与数模转换器的另一个ANALOG IN连接。
4. 在Clampex的Edit protocol/Wave中,Step和ramp各有什么适用范围?答:Ramp多用于电流衰减缓慢的离子通道以及失敏不明显的受体通道的I-V曲线制作,如多用于钾、钙离子通道。
膜片钳重点技术原理与基本操作

膜片钳技术原理与基本操作1976 年Neher 和Sakmann 建立了膜片钳技术(Patch clamp technique),这是一种以记录通过离子通道旳离子电流来反映细胞膜上单一旳或多数旳离子通道分子活动旳技术。
1981 年Hamill, Neher 等人又对膜片钳实验措施和电子线路进行了改善,形成了当今广泛应用旳膜片钳实验技术。
该技术可应用于许多细胞系旳研究,也是目前唯一可记录一种蛋白分子电活动旳措施,膜片钳技术和克隆技术并驾齐驱给生命科学研究带来了巨大旳迈进动力,这一伟大旳奉献,使Neher 和Sakmann 获得1991 年诺贝尔医学与生理学奖。
一、膜片钳技术旳基本原理用一种尖端直径在1.5~3.0μm 旳玻璃微电极接触细胞膜表面,通过负压吸引使电极尖端与细胞膜之间形成千兆欧姆以上旳阻抗封接,此时电极尖端下旳细胞膜社区域(膜片,patch)与其周边在电学上分隔,在此基本上固定(钳制,Clamp)电位,对此膜片上旳离子通道旳离子电流进行监测及记录。
基本旳仪器设备有膜片钳放大器、计算机、倒置显微镜、示波器、双步电极拉制器、三轴液压显微操纵器、屏蔽防震实验台、恒温标本灌流槽、玻璃微电极研磨器。
膜片钳放大器是离子单通道测定和全细胞记录旳核心设备,具有高敏捷度、高增益、低噪音及高输入阻抗。
膜片钳放大器是通过单根电极对细胞或膜片进行钳制旳同步记录离子流经通道所产生旳电流。
膜片钳放大器旳核心部分是以运算放大器和反馈电阻构成旳电流-电压(I-V)转换器,运算放大器作为电压控制器自动控制,使钳制电位稳定在一定旳水平上。
二、操作环节1.膜片钳微电极制作(1) 玻璃毛细管旳选择:有二种玻璃类型,一是软质旳苏打玻璃,另一是硬质旳硼硅酸盐玻璃。
软质玻璃在拉制和抛光成弹头形尖端时锥度陡直,可减少电极旳串联电阻,对膜片钳旳全细胞记录模式很有利;硬质玻璃旳噪声低,在单通道记录时多选用。
玻璃毛细管旳直径应符合电极支架旳规格,一般外部直径在1.1~1.2mm。
膜片钳常见问题解答讲解

膜片钳常见问题解答(一)1.什么是电压钳与膜片钳,有什么区别?答:电压钳技术是通过向细胞内注射一定的电流,抵消离子通道开放时所产生的离子流,从而将细胞膜电位固定在某一数值。
由于注射电流的大小与离子流的大小相等、方向相反,因此它可以反映离子流的大小和方向。
膜片钳技术钳制的是“膜片”,是指采用尖端经过处理的微电极与细胞膜发生紧密接触,使尖端下的这片细胞膜在电学上与其它细胞膜分离,这大大降低了背景噪声,使单通道微弱的电流得以分辨出来。
采用电压钳技术将这片膜的电位钳制在某一数值,可记录到单通道电流。
从这点上看,膜片钳技术是特殊的电压钳技术。
随着膜片钳技术的发展,它已经不仅仅局限于“膜片”的概念,也不仅仅采用电压钳技术,还常采用电流钳技术。
2. 离子通道电导的单位是什么?如何换算?答:离子通道电导的单位是西门子(Siemens, S),旧称姆欧,即安培/伏特。
常用皮西门子(pS),1pS=10E-12 S,1,000 pS=1 pA/mV。
3. MultiClamp 700A中,在放大器和信号器的连接中,放大器的raw output是否需要连接信号器的 ANALOG IN 接口? scaled output,raw output有什么区别?答:Raw output为原始信号输出,放大器输出的信号没有经过处理(如滤波、放大等),scaled output为定标输出,输出的信号经过了处理。
后者的灵活度大,因此多采用。
目前膜片钳放大器多设有scaled output,你可将其与数模转换器(你所说的信号器)的ANALOG IN连接,这样放大器的输出信号就能传送给计算机了,此时已经没有必要再使用Raw output了。
若你想记录两个输出,则需要将Raw output与数模转换器的另一个ANALOG IN连接。
4. 在Clampex的Edit protocol/Wave中,Step和ramp各有什么适用范围?答:Ramp多用于电流衰减缓慢的离子通道以及失敏不明显的受体通道的I-V曲线制作,如多用于钾、钙离子通道。
膜片钳实验技术入门---基本原理与操作

膜片钳实验技术入门------基本原理与操作关兵才 李国华 刘理望按:本文乃于2003年根据较旧型号的仪器写成,后被《机能实验科学》 (郑先科主编,北大医学版,2006)收入。
因新旧仪器基本原理和操作步骤大同小异,现对原文略作修改和标注,供同学们参考。
【实验目的】1. 了解膜片钳技术的基本原理和操作。
2. 初步学习电压依赖性离子通道电流的基本记录方法。
【实验原理】一、膜片钳技术原理简介膜片钳(patch clamp)是一种主要用于检测细胞膜离子通道活动的电生理技术,按工作方式可区分为电压钳(voltage clamp)和电流钳是最基本的工作方式,即对细胞膜电位进行人为控制,如将膜电位钳制于某一固定水平,或在此基础上再施以阶跃(step)式或斜坡式(ramp)电压刺激,同时记录跨膜电流,从而分析细胞膜通道的活动。
电流钳即人为控制经微电极对细胞进行注射的电流(等于离子通道电流与细胞膜电容电流之和),同时记录膜电位及其变化。
若注射电流为零即常用的零位钳流,用于测量细胞膜静息电位,若注射方波脉冲刺激电流,用于诱发、观测动作电位。
另外,膜片钳技术还常用于观测细胞膜电容, 从而推测分泌细胞的活动情况。
下面主要介绍其电压钳工作方式的基本原理。
(注:在电生理资料中,因通常将细胞外液和记录系统的“地”点相连作为参考点即零电位点,所以电位和电压两个概念经常混用。
)根据膜片钳实验中受检细胞膜的型式(configuration)不同,又可将膜片钳分为全细胞式(whole-cell)、细胞贴附式(cell-attached 或on-cell)、内面朝外式(inside-out)、外面朝外式(outside-out)等四种模式。
(一)全细胞式1.电压钳制和电流记录的实现图9-9为全细胞式膜片钳工作原理示意图。
图9-9 全细胞膜片钳实验原理示意图A1:运算放大器;A2:单倍增益差动放大器;R f:反馈电阻;V p:电极电位(A1反向输入端电位);V c:A1同向输入端电位;C in:输入端杂散电容;C p:电极电容;Rs:串联电阻;C m:细胞膜电容;R m:细胞膜电阻;E m:细胞膜内在电位(指钳压时的细胞膜诸通道状态决定的内在Goldman-Hodgkin-Katz平衡电位);V o:A2输出端电位;V-offset:偏移电位补偿电位;C c:用于电容补偿的电容;V c(app):表观钳制电压即欲施加于受试膜片的电压;图中⊕和表示求和电路将充有电解质溶液的玻璃微电极(glass microelectrode或 recording pipette)利用负压紧密吸附于细胞表面,形成吉欧即千兆欧(109Ω)级高阻封接,进一步对微电极内施加负压、将放大器(以下简称运放)A1在深度负反馈工作状态下的“虚短路(virtual short circuit)”原理实现,即只要A1工作于线性范围内,其反向输入端的电位V p总是等于同向输入端的电位V c,这两个输入端之间虽非短路却类似于短路。
黄山细胞生物学膜片钳原理及步骤

黄山细胞生物学膜片钳原理及步骤黄山细胞生物学膜片钳是一种常用的实验工具,被广泛应用于细胞生物学、生物化学、神经生物学等领域。
本文将从原理、步骤等方面介绍黄山细胞生物学膜片钳。
黄山细胞生物学膜片钳是一种特殊的微型电极,由两个电极组成,一个用于控制电压,另一个用于测量电流。
它的主要原理是利用膜的特殊性质,将细胞膜上的离子通道限制在微小的空间范围内,从而实现对离子通道的精确控制和测量。
步骤1. 制备细胞膜片首先需要从细胞中分离出膜片,可以通过机械或化学方法来实现。
机械法是将细胞用刀切成很小的块,然后用玻璃管吸取细胞块,用力振荡使细胞膜上的离子通道破裂,形成膜片。
化学法则是先用胰蛋白酶等酶类消化细胞表面的蛋白质,再用玻璃管吸取细胞膜,同样用力振荡破裂膜片。
2. 制备膜片钳制备膜片钳需要用到高精度的仪器,包括微型电极、振荡器、高压电源等。
将制备好的细胞膜片放在钳子中间,然后将钳子靠近微型电极,用振荡器振动细胞膜片,使其与电极紧密贴合。
3. 记录离子电流当电极施加电压时,离子通道会被开启,离子开始流动,这时可以通过另一个电极记录电流的大小。
通过改变电极的电压,可以控制离子通道的开闭程度,从而实现对离子通道的控制和测量。
应用黄山细胞生物学膜片钳广泛应用于细胞生物学、生物化学、神经生物学等领域。
它可以用于研究细胞膜上离子通道的特性、离子通道的开闭机制、离子通道的调节机制等。
此外,还可以用于研究神经元的电生理性质、神经递质的释放机制、蛋白质的功能等问题。
总结黄山细胞生物学膜片钳是一种常用的实验工具,通过对细胞膜上离子通道的精确控制和测量,可以研究细胞膜上离子通道的特性、离子通道的开闭机制、离子通道的调节机制等问题。
它在细胞生物学、生物化学、神经生物学等领域有着广泛的应用和重要的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
膜片钳常见问题解答(一)1.什么是电压钳与膜片钳,有什么区别?答:电压钳技术是通过向细胞内注射一定的电流,抵消离子通道开放时所产生的离子流,从而将细胞膜电位固定在某一数值。
由于注射电流的大小与离子流的大小相等、方向相反,因此它可以反映离子流的大小和方向。
膜片钳技术钳制的是“膜片”,是指采用尖端经过处理的微电极与细胞膜发生紧密接触,使尖端下的这片细胞膜在电学上与其它细胞膜分离,这大大降低了背景噪声,使单通道微弱的电流得以分辨出来。
采用电压钳技术将这片膜的电位钳制在某一数值,可记录到单通道电流。
从这点上看,膜片钳技术是特殊的电压钳技术。
随着膜片钳技术的发展,它已经不仅仅局限于“膜片”的概念,也不仅仅采用电压钳技术,还常采用电流钳技术。
2. 离子通道电导的单位是什么?如何换算?答:离子通道电导的单位是西门子(Siemens, S),旧称姆欧,即安培/伏特。
常用皮西门子(pS),1pS=10E-12 S, 1,000 pS=1 pA/mV。
3. MultiClamp 700A中,在放大器和信号器的连接中,放大器的raw output是否需要连接信号器的 ANALOG IN 接口? scaled output,raw output有什么区别?答:Raw output为原始信号输出,放大器输出的信号没有经过处理(如滤波、放大等),scaled output为定标输出,输出的信号经过了处理。
后者的灵活度大,因此多采用。
目前膜片钳放大器多设有scaled output,你可将其与数模转换器(你所说的信号器)的ANALOG IN连接,这样放大器的输出信号就能传送给计算机了,此时已经没有必要再使用Raw output了。
若你想记录两个输出,则需要将Raw output与数模转换器的另一个ANALOG IN连接。
4. 在Clampex的Edit protocol/Wave中,Step和ramp各有什么适用范围?答:Ramp多用于电流衰减缓慢的离子通道以及失敏不明显的受体通道的I-V曲线制作,如多用于钾、钙离子通道。
而像钠通道,其衰减非常迅速,在持续去极化的情况下,通道很快失活,无法使用ramp,另外诸如烟碱受体通道等具有明显失敏特征的受体通道也不宜采用ramp。
?有什么作用?ramp什么是5.答:与步阶(step)不同,ramp在pClamp软件中表示施加给细胞的一种逐渐变化的电压或电流,称为“斜坡电压或电流”,可用于作通道I-V曲线。
膜片钳常见问题解答(二)6. input resistance是什么意思?如何测量?答:在电生理学中,“input resistance”指“输入膜电阻(Rin)”。
全细胞记录时,给细胞膜施加一系列刺激方波(一般为超极化),在离子通道没有开放的情况下测定跨膜电流,根据欧姆定律即可求出Rin。
膜电阻(Rm)与膜输入阻抗Rin的关系为:Rm=4πr2 Rin,r为细胞半径。
7. 在一次电压钳全细胞记录中,是否每次一定要做电容消除、串连电阻补偿、漏减、和液接电位矫正?答:在电压钳实验中,如果需要给予细胞电刺激来改变细胞膜电位(如超极化或去极化),则会出现膜的被动反应,产生电容电流与电阻电流,此时,前者需要用电容补偿消除,后者需要用漏减功能消除。
全细胞记录中,串联电阻是必须要补偿的(至少要补偿80%),除非它很小而忽略不计。
液接电位(一般在10mV 左右)也需要校正,除非它很小。
你可采用Clampex软件中的菜单Tools/ Junction Potential功能对其测算,然后决定是否需要校正。
8. Decay是什么意思?和inactivation有何区别?答:Decay是“衰减”之意,inactivation是“失活”之意,但在文献中经常混用,decay也常常被说成失活,例如钙电流的衰减常被说成失活,这样用也没什么问题。
但实际上,两者细分的话还是有区别的。
可以将Inactivation分为稳态失活与非稳态失活。
后者即Decay,是指在刺激因素(电位变化、施加药物等)持续存在下通道的失活,而稳态失活(Steady-state inactivation)一般是指将膜电位钳制在不同的水平,然后观察通道的失活情况,做出失活曲线。
9. 什么是尾电流,他主要反映通道的什么特性及用在那些方面?答:在离子通道的激活因素(去极化或超级化)结束时通道的关闭过程叫做去激活(Deactivation),所记录到的电流称为尾电流(Tail current),主要反映通道的关闭特征。
延迟整流性K+离子通道以及一些不同类型的Ca2+离子通道,它们的尾电流均具有电压依赖性,关闭过程呈指数分布,可用指数方程拟合而获得通道关闭过程的时间常数。
尾电流的分析对研究电压门控性离子通道的激活、关闭、失活等动力学过程很有帮助。
如研究尾电流幅度与脉冲电压的关系、脉冲电压的不同持续时间或尾电流不同的钳制电压对尾电流幅度、衰减时间常数的影响等等。
通过这些研究可了解通道关闭过程中出现的不同关闭状态。
药物可影响通道的关闭过程,表现为尾电流的衰减过程变快或变缓慢。
10. 如何理解steady state activation中的steady state 的意义?答:“steady state”是“稳态”的意思。
一般通过给予细胞持续一定时间的一系列去极化(多为去极化)脉冲来激活离子通道,记录通道电流峰值,再计算岀电导G,作出G-V曲线,该曲线称为稳态激活曲线,也就是我们常说的激活曲线。
膜片钳常见问题解答(三)11. 电极拉制程序中具体应该如何控制。
在参数设定的摸索中,是否需要每次都用显微镜检测,还是另有更易操作的方法.答:不同的拉制仪拉制参数的设置不尽相同,你需要阅读说明书,参数中主要是设定拉力(对于P-97拉制仪,只需要设置Velocity,可不用设定Pull)与温度。
一般第一步拉制电极颈部,温度要比第二步高(对于P-97拉制仪,温度的设定需要先测量Ramp值),拉力不要过大,以保证颈部较短;第二步拉制尖端,一般要使温度低些,拉力大些。
一般都是通过显微镜查看电极尖端,这很简单,并不复杂!最好是抛光,这样就在抛光仪显微镜下查看。
注意抛光后的电极尖端开口会变小,故在拉制电极时,尖端开口要大些。
检查电极还有其它方法,如“气泡数法”,也可用放大器通过测量电阻来查看。
12. Rm=4πr2Rin?似乎Rin是一个用细胞大小标化的膜电阻,那为什么不用电容Cm来标化而用这个什么4πr2?细胞形状各异,Cm是个公认的膜面积的指标,电流密度不就是用Cm标化的吗?盼回答,同时希望能将Rin的意义再多讲一点,谢谢答:(1)一定要注意不要拘泥于Rm和Rin这两个符号,文献中常混用,但实际上表示的大多是Rin。
通常我们所说的“膜电阻”是指“膜输入阻抗Rin”,来计算膜面积,实际上这也正是我们的Cm)你可以用2。
(Rm但也有人用来指.做法,用来估算细胞大小,用于对通道电流幅度进行标化,但我们从来不用它计算膜电阻Rm(也称为“固有膜电阻”)。
Rm的计算公式是数学理论上的,并没有多少应用的价值,我们很少发现有使用Rm的(虽然符号用Rm)。
(3)实际上,Rin反映的当然就是膜电阻,它被称为膜输入阻抗(或膜输入电阻),也时常被称为“膜电阻”(这正是使人们产生混淆的原因!),是膜的被动反应参数之一。
所谓被动反应是指膜上离子通道没有开放时,膜所表现出的电缆特性。
膜的被动反应参数还包括膜电容、轴浆电阻等。
全细胞记录时,给细胞膜施加一系列刺激方波(多为超极化),在离子通道没有开放的情况下测定跨膜电流,根据欧姆定律可求出Rin。
当大量离子通道开放时,膜对电流的阻力急剧降低,测试脉冲电压与通道电流之间不满足欧姆定律,无法测量Rin,也没有了测量的意义。
13. 请教什么是Channel availability?答:Channel availability指在排除失活情况下,能够开放的某通道的多少,通过全细胞电流幅度的大小来反映。
例如,海马神经元Na通道的channel availability可因乙酰胆碱M受体的激活而降低,表现为Na通道电流幅度的降低。
14. 什么是window current,我知道是激活曲线和失活曲线的重叠。
但是我有一个疑问,比如电压依赖的T型钙通道,书上说在windonw current的时候有持续性的钙内流,但是T性钙通道不是有时间依赖性的失活吗?怎么会有不失活的电流呢?答:如果将通道的稳态激活曲线与失活曲线作在一个图上,则激活曲线与失活曲线之间交叉部分的电流就是window current,在这个电压范围内,有一些通道并没有完全失活,仍能被打开,有一定的开放概率。
T性钙通道是有时间依赖性的失活,但还有很小的部分失活非常缓慢,此即window current,它是一些快速失活通道的动力学特征。
对于T型钙通道,其window current维持了一个紧张性去极化,对动作电位的连续发放产生影响,当然,不同细胞中的T通道其作用不尽相同。
15. 使用Clampex 8.0记录配体门控离子通道电流,protocol 如何设置?Edit名称。
在Signal序号和Channel中设定好Lab Bench答:需要事先在.Protocol中选择Gap-free模式,采样频率可用5kHz,选好Input和Output。
先在Clampex中启动记录(Record),然后诱发电流,可用Time Tag作诱发标记。
膜片钳常见问题解答(四)16. 电极内液中加入1mmol/L的EGTA和10mmol/L的EGTA有什么区别?答:EGTA一般用10 mM左右(1 mM太低),促进封接,鳌和内钙。
17. 什么是漏电流,为什么要做Leak subtraction?答:漏电流的概念比较混乱,可以指封接电流(封接时从封接处“漏掉”的电流),也可指放大器的系统偏差,还可指膜漏电流。
一般来讲,膜漏电流是细胞膜的被动反应电流,是非离子通道电流,因此在记录离子通道电流时要将它去除。
膜片钳放大器与采样分析软件都具有将其去除的漏减功能。
18. 请问动作电位是否一定要有越过0的超射,我在一篇文献中看到作者将一个没有超射的电位变化也称为动作电位,我觉得不对,应该是阈下反应才对吧?但又不敢下结论,觉得国外文献不该出错。
答:一般生理情况下动作电位都含有超射,超射与Na离子(或Ca离子)的平衡电位有关。
但在具体实验中(或某些病理情况下),若细胞内外液的Na离子(或Ca离子)的浓度发生变化,则Na离子(或Ca离子)的平衡电位也随之变化,就可能不产生超射或超射值更大。
19. 我想请教一下为什么我们用培养的大鼠海马神经元记录NMDA电流,总是会出现电流的衰减,而且我们记录是选择的培养第10-14天的大鼠,可是电流大小不等,具体在100-1500pA间波动,这让我们很疑惑,注明一下,电极内液中我们用了CsCl和ATP、GTP。
