中南大学物化课后习题标准答案-9--章-可逆原电池
物理化学——第9章-可逆电池复习题

ln K zFE /RT 9.1782 K 9.68 103
2 96485 (0.3402 0.2223) 8.314 298.15
计算题
3. 25℃时,电池 Pt|H2(p )|HCl(0.1molkg-1)|AgCl,Ag 的电动势为0.3522V, (1)求反应H2(g)+2AgCl(s)=2Ag+2H++2Cl- ,在25℃的 标准平衡常数。(已知0.1molkg-1 HCl的 =0.798); (2)求金属银在1molkg-1 HCl溶液中产生H2的平衡压 力。(已知25℃时1molkg-1 HCl的 =0.809)。
概念简答
4、为什么燃料电池的效率比热机高? 答: 比较极限值:可逆热机和可逆电池。
Tc 根据热力学第二定律,可逆热机的效率为 1 Th
所以热机效率不可能达到100%。然而可逆电池的 能量转化是可逆的,化学能全部转化为电能,效 率为100%。
选择题
1.25℃时电池反应 H2(g) + ½O2(g) = H2O(l) 对应 的电池标准电动势为 E1ϴ,则反应2H2O(l) = 2H2(g) + O2(g) 所对应的电池的标准电动势 E2 ϴ是: (C) (A) E2 ϴ = - 2 E1 ϴ ; (B) E2 ϴ = 2E1 ϴ ; (C) E2 ϴ = - E1 ϴ ; (D) E2 ϴ = E1 ϴ 。 2. 某电池在标准状况下,放电过程中, (B) 当Qr = -200 J 时,其焓变ΔH为: (A) ΔH = -200 J ; (B) ΔH < -200 J ; (C) ΔH = 0 ; (D) ΔH > -200 J 。
(2) 计算该原电池在25℃时的电动势E;
物理化学第9章可逆电池

物理化学第9章可逆电池第九章可逆电池本章用化学热力学的观点讨论电极反应的可逆行为。
原电池是将化学能转变为电能的装置,两个电极和电解质溶液是电池最重要的组成部分。
电极电势是本章主要概念之一,它是相对于标准氢电极而言的电势,是一种相对值,即把一个电极与标准氢电极组成一个已消除了液接电势的原电池,其电动势就是给定电极的标准电极电势。
对于一个可逆化学电池,电极两极间的电势差称电池的电动势,可用电池反应的能斯特方程计算。
因为电池电动势与热力学量之间密切相关,所以本章内容是围绕电动势而展开。
一、基本内容(一) m r G ?=-zFE式中m r G ?为电池反应的摩尔吉布斯自由能变;z 是电池反应的电子的物质的量;E 为电池的电动势。
此式运用于等温等压的可逆过程,所以E 为可逆电池的电动势。
此式表明,在可逆电池中,化学反应的化学能(m r G ?)全部转变成了电能z FE 。
该式将化学反应的性质与电池的性质联系起来,是电化学的基本公式之一。
若参与电池反应的所有物质均处于各自的标准态,则上式成为θm r G ?=-zFE $ 其中E $称为电池的标准电动势,对于指定的电池,E $只是温度的函数。
(二) 电池反应的能斯特公式若电池反应为 aA+bB =gG+hHE=E $-zF RT ㏑b Ba A hHg G a a a a ?? 此式表明,电池的电动势取决于参加反应的各物质的状态,它对如何改变电池电动势具有指导的意义,计算时首先要正确写出电池反应式。
(三) 电极反应的能斯特公式若电极反应为 aA+bB+ze -=gG+hHE=E $-zF RT ㏑b Ba A hHg G a a a a ?? 式中E 和E $分别为该电极的电极电势和标准电极电势。
此式表明,一个电极的电势取决于参与电极还原的各物质的状态。
计算的关键是要正确写出电极上的还原反应。
(四) E =负正E E -,E $=θθ负正E E -式中E 和E $分别为可逆电池的电动势和标准电动势;正E (θ正E )和负E (θ负E )分别为正极和负极的电极电势(标准电极电势)。
物理化学第9章可逆电池

第九章可逆电池本章用化学热力学得观点讨论电极反应得可逆行为.原电池就是将化学能转变为电能得装置,两个电极与电解质溶液就是电池最重要得组成部分。
电极电势就是本章主要概念之一,它就是相对于标准氢电极而言得电势,就是一种相对值,即把一个电极与标准氢电极组成一个已消除了液接电势得原电池,其电动势就就是给定电极得标准电极电势.对于一个可逆化学电池,电极两极间得电势差称电池得电动势,可用电池反应得能斯特方程计算.因为电池电动势与热力学量之间密切相关,所以本章内容就是围绕电动势而展开。
一、基本内容(一) =-zFE式中为电池反应得摩尔吉布斯自由能变;z就是电池反应得电子得物质得量;E 为电池得电动势。
此式运用于等温等压得可逆过程,所以E为可逆电池得电动势。
此式表明,在可逆电池中,化学反应得化学能()全部转变成了电能zFE。
该式将化学反应得性质与电池得性质联系起来,就是电化学得基本公式之一。
若参与电池反应得所有物质均处于各自得标准态,则上式成为=-zFE$其中E$称为电池得标准电动势,对于指定得电池,E$只就是温度得函数.(二)电池反应得能斯特公式若电池反应为aA+bB=gG+hHE=E$—㏑此式表明,电池得电动势取决于参加反应得各物质得状态,它对如何改变电池电动势具有指导得意义,计算时首先要正确写出电池反应式。
(三)电极反应得能斯特公式若电极反应为aA+bB+ze-=gG+hHE=E —㏑式中E与E 分别为该电极得电极电势与标准电极电势。
此式表明,一个电极得电势取决于参与电极还原得各物质得状态。
计算得关键就是要正确写出电极上得还原反应.(四)E=,E =式中E与E$分别为可逆电池得电动势与标准电动势;()与()分别为正极与负极得电极电势(标准电极电势).(五)标准电动势E$与标准平衡常数K$得关系(六)电池反应得熵变就是与电池电动势得温度系数关系(七)电池反应得焓变与电池电动势E与电池电动势得温度系数得关系(八)可逆电池得反应热效应QR与电池电动势得温度系数得关系(九) 液接电势E1得计算公式E1=㏑[(a±)负/(a±)正]式中z+,z-代表正、负离子得价数,t+与t—分别代表在液-液界面处正、负离子得迁移数,一般认为就是两溶液中迁移数得平均值,即t+=1/2(t+,负+ t+,正)t-=1/2(t-,负+t-,正)(十)膜电势E m计算公式式中E m就是离子B得膜电势;zB就是离子B得价数;aB,左与a B,右分别为膜左右两侧离子B得活度。
9章-可逆原电池(2)资料

解:左边(负极) 右边(正极) 电池反应
H2(101325Pa)→2H+(aH+=1)+2e 2AgCl(s)+2e→2Ag(s)+2Cl-(aCl-=1) H2(101325Pa)+2AgCl(s)=2Ag(s) +2HCl(a=1)
如何根据化学反应设计原电池?
先找出化学反应被氧化的物质作为原电池的负极,被还原的 物质作为原电池的正极,然后按上述惯例写出原电池符号。
充电
金属铜和锌片同时插入硫酸水溶液所组成的电池是否可逆?
Cu片
Zn片
硫酸水多 孔溶液
隔 膜
① 当外加电动势E外稍小于电池的电动势E时,则该电池 起原电池作用,反应如下:
负极(锌极) Zn-2e→Zn2+ ————正——极—(—铜—极——) ——2—H—++—2—e—→—H—2————————
电池总反应 Zn+2H+=Zn2++H2
解:电池反应为
负极 正级
Zn(s)→Zn2+(aZn2+=7.34×10-4) +2e Cu2+(aCu2+=0.047)+2e→Cu(s)
原电池反应 Zn(s)+Cu2+(aCu2+)=Zn2+(aZn2+)+Cu(s)
EERTlnaZn2aCu zF a a ZnCu2
1.1008.31429.185ln7.34104 1.13V4 296485 0.047
2.4 计算原电池可逆放电时反应过程热
恒温下,原电池可逆放电时的反应过程热为:
Q R T r S m zF ( E / T T )P
9-可逆电池答案.doc

(3分)(3分)(4分) (3分) 物理化学试卷答案一、 选择题1-5:CDDAC 6-10: DCCBC 11-15: ACCBC 16-20: ACC AC 21-25: BBDBB 26-30: DCBAD 31-35: BCCAD 36-40: BBDAC 41-45: DCCBC 46-47: DD 二、 填空题(共17题37分) 48[答] Pb(s)+PbO 2 (s)+2H 2SO 4(aq) = 2PbSO 4(s)+2H 2O(1)49[答]摩尔甘汞电极||Fe 叭 Fe 2+|Pt 或 Hg(l)|Hg 2Cl 2(s)|Cl~(=1 )||Fe 3+, Fe 2+|Pt 50 嗒]Pt,O 2(g)|OH -(aq)|Ag 2O(s)|Ag(s) 51 [答]PtHehmadlH 4•⑷)|电(長),Pt 52.[答]Pt,C12(/)|Cl S)||C1 ©2)|C12(/,),Pt 53[答]Hg(l)|HgO(s)|KOH(aq)|K(Hg)(a am ) 54.[答]Hg(l)|Hg 2SO4(s)|SO42 (aq)||Hg 22+(«)|Hg(l) 55[答]Pt,H 2(g)|H 2SO 4(aq)|PbSO 4(s)|Pb (s) 56.[答]Pt,H 2(g)|HI(aq)|I 2(s),Pt57[答] Zn(s)|ZnC12(/7?2)IIAgNO 3(777i)|Ag(s);饱和 KNO3 (或 NH4NO3)盐桥。
58[答] E 33 = y (3£i 3 -備)=- 0.4395 V 59.嗒 1 E 33=2E!3 - E 2360. [答]Cu(s)|Cu +(aq)||l _(aq)|CuI(s)|Cu(s) 61. [答]Ag(s) 1 A£⑷ II cr ⑷ | AgCl(s) 1 Ag(s) 62[答]Zn(s) I ZnCl 2(W!)II AgNO 3(m 2) | Ag(s)KNO 3盐桥(或NH 4NO 3盐桥) 63. [答] Q r = TAS = 21.57kJ ・ moF 164. [答]Ag(s) I Ag +(aq) II SO^(aq) | Ag 2SO 4(s),Ag(s) 65.[答] 具 0.323 V8.46X10"三、计算题(共14题162分)66. [答](1) (-)H 2(g)-*2H ++2e-(+) Hg 2Cl 2(s)+2e J2Hg ⑴+2C1 伽)总反应:H2(g)+Hg2C 以s)->2Hg ⑴+2H+(aq)+2CL(aq)(2) A r G m 3= -zEV= -51.7kJ ・ mol'1A r G m 3=2AfG m 3(Cl ■) -AfG m 3(Hg 2Cl 2)= - 51.7 kJ • mol'1 A r G m 3(Hg 2Cl 2(s))= - 210.82 kJ ・ mol" (3) Hg 2Cl 2(s)->Hg 22+(aq)+2Cr (aq)△Q J 二[152.0+2(— 131.26)-(-210.82)] kJ ・ mol —100.3 kJ ・ mol" /C sp 3=exp(-A r G m 3//?7)=2.6 X 101867. [^]Ag(s)+AgCl(s)|Cl -(aq)|Hg 2Cl 2(s)|Hg(I)(1) (-) Ag(s)+Cr-e ->AgCl(s)(+) l/2Hg2Cl2 (s)+e--*Hg(l)+Cr(2)A r H m3= [- 127.03 - 1( -264.93)1 kJ ・ moL = 5.435 kJ ・ mol"J二[(77.4+96.2)-(195.8 X 1/2+42.55)] J • K d• mol—33.15 J ・ K 1• mol1A r G m3=A r//m3 - 7A r5m3=-4443.7 J ・ mol」E=^= - A r G m3/zF=0.046 V (3 分)(—)“ =A r5m d/zF=3.43XW1 V-K d(2 分)dT卩(3)2R=7A r S in3, ,Q R-0=4.44 kJ (2 分)68.[答] 电池反应:H2(p3)+Ag2O(s)->2Ag(s)+H2O(l) (2 分)(1)从Kw求出W(H2|OH-)=-0.828 V; £=^=0.344 V + 0.828 V = 1.172 V (2 分)(2)A r G m3= - zE3F= - 226.2 kJ-mol1 A,//m3= - 286+30.57= - 255.4 kJ-mol1A r S m3=(A r H in3 - - 98.0 J ・ KJ ・ mol"0r=7A r S m3= - 29.2 kJ-mol'1BE 3 4 i(——)=A r V/2F=-5.08X 10 4 V K U6T "(3)e p=A./7m3= - 255.4 kJ-mol'1(各1 分) 69.[答]电池反应:Ag(s) + (1⑵Hg2Cl2(s) —-> AgCl(s) + Hg(l) (1 分)為=.H 爲[AgCl(g)] + [Hg(l)]・街丹和Ag(s)]-(l/2)A r H^ [Hg2Cl2(s)] = 5.44 kJ ・ mol" (2 分)凤=S; [AgCl(g)] + S為[Hg(l)J -Si lAg(s)] -(1/2)S: [Hg2Cl2(s)]=32.9 J ・ K"・ mol" (2 分)A r G^ 二 - = -4.37 J ・ K,・ mol1(2 分)£-= -A,G \ /zF = 0.045 V (1 分)(dE/dT)p = A r5'^ /zF= 3.41 X IO 4 V ・ K1(2 分)1 -70.[劄电池反应为Ag(s)+ - C12(P Z)—- AgCl(s)£ = EAfG^ = - zE?F= -109.67 kJ ・ moL (2 分)A r S^ = zF(dE/OT)p= - 57.83 J ・ K」・ mol" (2 分)S爲(AgCl)=△必+S啟Ag)+*S鳥(C12)=96.26J ・ K1・ mof1(4 分)爲+T^r s\ =-126.90 kJ ・ moP1(2 分)71.[答](1) Zn | ZnSO4(t/=l) II CuSO4(^=l) I Cu (2 分)(-)Zn(s) — -Zn2+(a=l) + 2e_(+) CU2+(AH1) + 2V —I cu(s) (29)(2)>G 汀 n>Gnp 心 FE n 121103 kJ ・ mol'(2 V)>5" n FgE-aTj n6C2OC 』・ K,1 ・ mo 「l (2莎)A3一 n ArGm+ 一 n ,234007 kJ ・ 30-.- (1 莎) 心IIFs 十 H ,230046 kJ ・ Bo-.- (1 M) 珮」(1) p 二 H2£4) 一 HI(卞一)一 I2(s) 一 p 〔 (2 9)(2) 4GmH 4G"H 2亘(H+) + 2Aft (「)g" (H2)・A(I2) ”'03.341<j ・ mo 「l (2 ©) E H Ell —4G - 一 MF H 0.5354 < (2 妙)Klrexp(,4.G" 一 RT} UL30X 一0乔(3) E H Elro.5354 V 4G" n —51.67診 1.14X10973.砾=1) (,) H2(g 丸)+ 2OH,(aq) I 2HOS+ 2V (+) Hgo(s) + H2OS+ 2V —— Hg(D + 2OH・(aq) 甲苜辺m” H2(g0) + Hgo(s) ! Hg(D + Hoe(2)E H 学RT-ZFX一 g(Hg)AH2o)、a(H2)AHgo) H E汇 0.924 V(3)3(衣』一 *一 ) n zf_r (段一TH e一 m)".耳-R乂三Tu 1/T-)圧爭 ETE2H 0.93 V74・晞」 (1) Al(s) _ A13+(o=0・l) _ sn4+(aH0・Dsn2+(aH0・一) 一 Pt Eum,R776FX=03(sn2+)s2(A_3+)、(、sn4+)」H (0山(Sn2+、sn4+) + 1.66) •RT莎 F 乂xo. - )2 Sn4・ + 4e —I SnSn2+ + 2V ------ SnSn4+ + 2V —Sn2+ArG" (Sn2+sn4+) H>G^ (SPSI/+) •>G" (S.psn2+)n QF 知(Sn2+sn4+)兔(Sn2+sn4+llP154 V 走>_|2戈起EHL834 V(取一莎)(3莎)(2 9)(3莎)(1分) (2分) (2分) (2分) (2分) (4分)(2分) (1分) (2分) (1分)(2)£>0,正向反应能自发进行 lg^ zFE a /2.303/?7'= 182 A^= IO 182 -*875・[答](1) Pt | Sn 2+(aq),Sn 4+(aq) II Fe 3+(aq),Fe 2+(aq) I Pt(-)Sn 2+(aq)・ 2e _ --------- Sn 4+(aq) (+) 2Fe 3+(aq) + 2e" ------ * 2Fe 2+(aq)(2)0.62 V(3) ln/^= zE^F/RT = 48.30A^= 9.4 X 102076.[答](1) (-) Cd(s) + 20H' —-Cd(OH)2(s) + 2e0: (+) 2H 2O + 2e' —-» 2OH' + H 2(/?3)0;电池反应 Cd(s) + 2H 2O —-- Cd(OH)2(s) + H 2(/^)(2) A r G m = -zFE = 0A r //m = -zFE + zFT(dE/dT)p = 115.11 kJ ・ mol" A r S,n = zF(cE/dT)p = 386 J ・ K“(3) 利用 /T W (H 2O) = 1X1014 求出 0;=呎 =-0.828 V 设计电池 Cd(s) | Cd 2+(a!)II OHS) I Cd(OH)2(s) I Cd电池反应 Cd(OH)2 = Cd 2+ + 20H -E\ =0:・ 3 (Cd 2+/Cd) = -0.425 V。
(完整版)中南大学物化课后习题答案9章可逆原电池

s e第9章 可逆原电池1.写出下列原电池中各电极反应、电池反应及E 的计算公式。
①② Pt,H 2(101325Pa)|KOH(a )|O 2(101325Pa),Pt③④解:(1) 负极 Pb(s)+(a) → PbSO 4(s)+2e正极 Cu 2+() + 2e →Cu(s)电池反应 Pb(s)+SO 4(a) + Cu 2+ (a Cu 2+) ==== PbSO 4(s)+Cu(s)(2) 负极 H 2( p Θ ) -2e → 2H + (a H +)正极 O 2( p Θ ) + H 2O +2e → 2OH -(a OH -)电池反应 H 2(p Θ)+ O 2(p Θ) → H 2O(l)(3) 负极 3H 2(p H2) - 6e → 6H +(aq)正极 Sb O (s) + 6e + 6H +(aq) → 2Sb(s) +3H O(l)电池反应 Sb2O3O(l)+3H2 (p H2) → 2Sb(s) + 3H2(4) 负极 Ag(s) + I -(a I -) → AgI(s) + e正极 AgCl(s) + e → Ag(s) + Cl - (a Cl-)-)电池反应 Agl(s) + I-(a I -) → Ag(s) + Cl - (a Cl2.试将下列化学反应设计成原电池(1)Zn(s) + H2SO4(a1) === ZnSO4(a2) + H2(p H2);(2)Ni(s) + H2O ==== NiO(s) + H2(p H2)(3)H2(p H2) + O2(p O2) ==== H2O(l);(4)H2(p H2) + HgO(s) ==== Hg(l) + H2O(l)解:(1)负极 Zn(s) -2e → Zn2+(a2)正极 2H+(a1) + 2e → H2(P H2)电池反应 Zn(s) +2H+(a1) ==== Zn2+(a2)+ H2(p H2)电池符号 Zn(s) | ZnSO4(a2) || H2SO4(a1) | H2(p H2),Pt(2) 负极 Ni(s) + 2OH -→NiO(s) + H2O +2e正极 2H2O + 2e →H2(p H2) +2OH -电极反应 Ni(s) + H2O==== NiO(s) + H2(p H2)电池符号 Ni(s),NiO(s) | KOH(稀) | H2(p H2), Pt(3)负极 H2(p H2) + 2OH -→ 2H2O + 2e正极 2H2O +2e → 2OH - + O2(p O2)电池反应 H2(p H2) + O2(p O2) ==== H2O(l)电池符号 Pt,H2(p H2) | NaOH(稀) | O2(p O2),Pt(4) 负极 H2(p H2) + 2OH -→2H2O +2e正极 HgO(s) + H2O +2e → Hg(l) +2OH -电池反应 H2(p H2) + HgO(s) ==== Hg(l) + H2O(l)电池符号 Pt ,H2(p H2) | KOH(稀) | HgO(s),Hg(l)3.工业上用铁屑加入硫酸铜溶液中以置换铜,试设计原电池;计算该反应在298.15K时的平衡常数,并说明此置换反应进行的完全程度。
中南大学物化课后习题标准答案-9--章-可逆原电池

第9章可逆原电池1 •写出下列原电池中各电极反应、电池反应及E旳计算公式.②Pt,H 2(101325Pa) | KOH@) I Q(101325Pa),Pt④I :I :l ・」:-:解:⑴负极Pb(s)+「(a-;J —PbSQ4(s)+2e............................................... .正极Cu2+(-丄'')+ 2e —Cu(s)2+电池反应Pb(s)+SQ4(aEM) + Cu (a C2+) ==== PbSO4(s)+Cu(s)⑵负极比(p® ) -2e —2H+ (a H+)正极Q( p® ) + H 2O +2e —2OH -(a OH -).. ........ — ..... —.... ......... .... ... 电池反应H2(p®) + O(l)O2( P®) —H2(3)负极3H2( P H2)- 6e —6H+(aq)正极Sb2Q(s) + 6e + 6H +(aq) —2Sb(s) +3H 20(1)............................................... 电池反应Sb2O3 +3H2 ( P H2)—2Sb(s) + 3H 20(1)⑷负极Ag(s) + I -(a i-) —AgI(s) + e_______________________________________________ 正极AgCI(s) + e —Ag(s) + Cl ( a ci-)电池反应Agl(s) + I -(a i-) —Ag(s) + Cl - ( a。
-)2. iJ:将下勿化学反应陵计成目电池(1) Zn(s) + H 2SQ(a": ===ZnSO4( ◎) + H2( P H2)(2) Ni(s) + H 2Q ==== NiQ(s) + H 2( P H2)(3) H2 (P H2) + Q( P Q2)= :===H 2OQ);(4)H2(P H2)+ HgQ(s)== ==Hg(l) + H 20(1)( 1)负极Zn (s) -2e2+ —Zn正极2H+( a i) + 2e —H2(P H2)----------------------------------------------- 电池反应Zn(s) +2H +(a i) ====Zn2+(a2)+ H 2( P H2)电池符号Zn(s) | ZnSO 4( a?) || H 2SO( a) | H 2( p H》,Pt(2) 负极Ni(s) + 20H -—NiO(s) + H 2O +2e正极2H2O + 2e —H2(P H2)+20H -.............................................. .电极反应Ni(s) + H 20 ==== NiO(s) + H 2伽)电池符号Ni(s),NiO(s) | KOH( 稀)| H 2(P H2), Pt(3) 负极H2(P H2) + 2OH -—2H2O + 2e正极2H2O +2e —2OH- + Q(p°2).............................................. 电池反应H 2( P H2)+ Q( P O2) ==== H2OQ)电池符号Pt,H 2伽)| NaOH(稀)| O 2(p°2>,Pt(4) 负极H2(P H2) + 2OH -—2HO +2e正极HgO(s) + H 2O +2e —Hg(l) +2OH ----------------------------------------------- 电池反应H2(P H2)+ HgO(s) ==== Hg(l) + H 2。
物理化学课件物化习题课第九、十章 可逆电池的电动势

例4. 如溶液中有Ag+, Cu2+, Cd2+三种离子存在,浓度均为
1mol·kg-1,计算判断银、铜、镉三种金属是否能分离完全
?
已知
(Ag)
=
0.799V,
(Cu)=0.337V,
(Cd)
=
-
0.403V
解:
(Ag)>
(Cu)>
(Cd)
,Ag先析出。
当铜开始析出时,银离子的浓度?
= (Ag) +0.0591 lg a(Ag+ ) 0.337=0.799 + 0.0591 lg c(Ag+) c(Ag+)= 1.5 10-8 mol·kg-1
由于 (Cl2)> (Br2)> (I2),所以阳极反应中,I-优先 反应,其次是Br-,最后是Cl-。
20
三、例题
(1) [I-] = 0.1000(1-99%)=0.0010 molkg-1 (阳)= (I2) = (I2) (RT/F) ln a(I-) =0.5362 0.0591 lg 0.0010= 0.714V 电解电压V=0.714+0.793=1.507V
11
三、例题
(8)用铜电极电解CuCl2水溶液时,不考虑超电势,在 铜阳极上会发生下面哪个反应(已知ºCu= 0.337V, ºO2 = 1.230V,ºCl2 =1.360V)( D) (A)析出O2 (B)析出Cl2 (C)析出铜 (D)Cu极溶解
(9)298K时,H2(g) 在Zn(s)上的超电势为0.70V,已 知ºZn= -0.763V。现在电解一含有Zn2+(aZn2+ =0.01)的 溶液,为了使H2(g)不与Zn(s)同时析出,溶液的pH应 至少控制在(>2.06 )
《物理化学(第五版)》第九章复习题答案
复习题
8.有哪些求算标准电动势EΘ的方法?在公式E zF ln K 中,EΘ是否是电池反应达平衡时的电动势?KΘ是否是
zE F K exp RT
a
复习题
(8).醋酸的解离平衡常数。 电池:Pt|H2(pΘ)|HAc(mHAc),Ac-(mAc-),Cl-(aCl)|AgCl(s)|Ag(s) 净反应:AgCl(s)+H2(pΘ)→H+(aH+)+Cl-(aCl-) +Ag(s
1.可逆电极有哪些主要类型?每种类型试举一例,并写 出该电极的还原反应。对于气体电极和氧化还原电极 在书写电极表示式时应注意什么问题? 答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如: Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极 反应所依附的惰性金属。
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
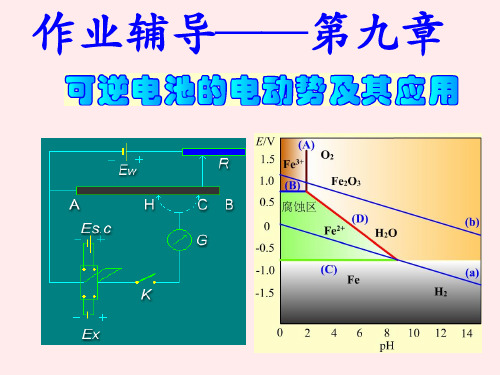
9章可逆原电池

第 九 章 可逆原电池§1 可逆原电池电动势一、可逆电池和不可逆电池条件:条件:(1) (1) (1) 电池反应必须可逆电池反应必须可逆H 2 + Cl 2 2HCl 放电充电原电池电解池(2) (2) 电池反应条件必须可逆电池反应条件必须可逆 在近平衡的条件下进行反应,即工作电流在近平衡的条件下进行反应,即工作电流无限小,或充、放电的电势差无限小,或充、放电的电势差||E – U 外|→0。
丹尼尔(锌铜)电池:丹尼尔(锌铜)电池:Zn -+ CuZnSO 4CuSO 4多孔隔膜铜锌电池示意图ZnZn (-)极反应为: Zn → Zn 2+(m 1) + 2e - Cu (+)极反应为: Cu 2+(m 2) + 2e - → Cu电池反应为:Zn + Cu 2+(m 2) → Cu + Zn 2+(m 1) ZnZn (阴)极反应为: Zn 2+(m 1) + 2e - → Zn Cu (阳)极反应为:Cu → Cu 2+(m 2) + 2e - 电池反应为: Cu + Zn 2+(m 1) → Zn + Cu 2+(m 2)充电放电金属铜和锌片同时插入硫酸水溶液所组成的电池Cu 片ZnZn 片多孔隔膜硫酸水溶液 放电过程(原电池)Zn(-)极 : Zn - 2e - → Zn 2+ Cu(+)极: 2H + + 2e -→ H 2电池反应: Zn + 2H +=Zn 2++H 2 充电过程(电解池)Zn(阴)极 : 2H + + 2e -→ H 2 Cu(阳)极: Cu - 2e - → Cu 2+电池反应: Cu+ 2H + = Cu 2++H 2不符合条件(1),不是可逆电池;充电电池寿命:不符合条件(2),也不是可逆电池二、原电池的表示法(原电池符号)原电池—→(两个)电极—→金属类导体|电解质(溶液)或电解质(溶液)|金属类导体金属类导体|电解质(溶液)+电解质(溶液)|金属类导体负极正极规定:★产生电势差的相界面以“|”表示;★负极在左边,正极在右边,电解质在中间;★注明物质的存在形态、温度、压强、活度;★ 以“ǁ”代表连接两种电解质溶液的盐桥;★ 气体电极必须写明载(导)体金属(惰性)。
第9章可逆电池的电动势及其应用解读

阳极 (Ag+AgCl(s)): Ag (s) + Cl - → AgCl (s) + e 总反应: ½Zn2++ Ag(s)+Cl - → ½ Zn(s)+AgCl(s) ----- (2) 充放电时电流都很小,两个总反应正好相反,上述电池为可逆电池。 若充电时施以较大的外加电压,有较大的电流通过,虽然电池反应仍 可按(2)式进行,但能量是不可逆的,∴ 仍旧为不可逆电池。
氢电极
卤素电极 汞齐电极
Pt, H2 (g) | H + (aq)
Pt, Cl2 (g) | Cl Na+ (a+) | Na (Hg) (a) 正极 a—Na(Hg) 活度
(2)第二类电极
难溶氧化物电极:由金属表面覆盖一薄层该金属氧化物,插入含 H+ 或 OH- 的溶液中构成的电极。
OH- (a -) | Hg (l) + HgO (s)
Cd(Hg)│CdSO4 ·8/3H2O (s)│CdSO4 (饱和)│CdSO4 ·8/ 3H2O(s)│Hg2SO4+ Hg (l)
特点:电池反应可逆,电动势稳定,随温度( CdSO4· 8/ 3H2O(s)的溶解 度)变化波动小。 20℃ E =1. 01845 V 25℃ E =1. 01832 V
(2)由 电动势E 及其温度系数 (∂E / ∂T)p 求 r Hm 及 r Sm 吉布斯-亥姆霍兹公式: [ ∂ ( G /T ) / ∂ T ] P = - H / T 2 将 rGm = - zEF 代入 rHm= - zEF + zET (∂E / ∂T)p rHm= rGm + T rSm 常温下 QR=T rSm = zTF (∂E / ∂T)p
09章-可逆电池答案

物理化学试卷答案一、选择题( 共10题19分)1. 2 分(4112)4112[答] (D) (2分)2. 2 分(4115)4115[答] (D) (2分)3. 2 分(4134)4134[答] (D) (2分)4. 2 分(4194)4194[答] (C) (2分)5. 2 分(4224)4224[答] (D)6. 2 分(4247)4247[答] (C)7. 2 分(4251)4251[答] (A)(A) 4.33×1021设计成电池Pt│Fe2+,Fe3+‖Au3+,Au+│Ptφ∃= (Au3+/Au+) = 1.41V E∃= 0.64 V8. 2 分(4259)4259[答] (B)9. 1 分(4428)4428[答] (C)*. 2 分(4444)4444[答] (D)二、填空题( 共6题18分)11. 2 分(4152)4152[答]摩尔甘汞电极||Fe3+,Fe2+|Pt 或Hg(l)|Hg2Cl2(s)|Cl–(Cl =1a-)||Fe3+,Fe2+|Pt (2分)12. 2 分(4153)4153[答] Pt,O2(g)|OH–(aq)|Ag2O(s)|Ag(s) (2分)13. 2 分(4158)4158[答] Pt,H2(g)|H2SO4(aq)|PbSO4(s)|Pb(s) (2分)14. 2 分(4226)4226[答] Ag(s)│Ag+(a)‖Cl-(a)│AgCl(s)│Ag(s)15. 5 分(4256)4256[答]吸热,因为Q r= T∆r S m> 0 (2分)吸热,Q r> Q实际,因为∆U相同,可逆时作功多,所以Q r大(3分)16. 5 分(4453)4453[答]Ag│AgCl(s)│KCl(aq)‖Ag+(aq)│Ag(s) (2分)∆r Gm$= -zEθF = -55.60 kJ·mol-1(1分)K sp = 1.8×10-10(1分)E = 0 (1分)三、计算题( 共7题72分)17. 15 分(4191)4191[答] 电池反应为:AgCl(s)→Ag(s)+12Cl2(p∃) (2分)⑴ r m r m r mG H T S E E zF zF∆∆-∆==-=-$$$$51r m f m (AgCl) 1.270310 J mol H H -∆=-∆=⨯⋅$$11r m 12(42.70(243.87)96.11)68.52 J K mol S --∆=+-=⋅⋅$ (5分)得 E = - 1.105 V⑵ Q r =T ∆r S m ∃= 2.042×104 J (2分)41r m ()7.110 V K p E S T zF--∂∆==⨯⋅∂$(2分)⑶ l n 43.04pz E FK RT==-$$;192.0310pK -=⨯$;122Cl ()p p K p =$$233Cl = 4.210 Pa p -⨯(4分)18. 2 分 (4312) 4312[答] (1) Cu(s) + 2AgAc(s) ─→ Cu (0.1 mol ·kg -1) + 2Ag + 2Ac -(0.2 mol ·kg -1)(3分) (2) ∆r G m = -zEF = -71.769 kJ ·mol -1 (1分) ∆r S m = zF (∂E /∂T )p = 38.6 J ·K -1·mol -1 (1分) ∆r H m = ∆r G m + T ∆r S m = -60.293 kJ ·mol -1 (1分) (3) 设计电池 Ag │Ag +‖Ac -│AgAc(s)│Ag φ ∃ (AgAc,Ag) = 0.6413 VK sp = 2.07×10 -3 (4分)19. 10 分 (4185) 4185[答]⑴ (-) H 2(g)→2H ++2e – (+) Hg 2Cl 2(s)+2e -→2Hg(l)+2Cl –(aq)总反应:H 2(g)+Hg 2Cl 2(s)→2Hg(l)+2H +(aq)+2Cl –(aq) (3分)⑵ ∆r G m ∃= - zE ∃F = - 51.7 kJ ·mol -1 ∆rG m ∃=2∆f G m ∃(Cl -) –∆f G m ∃(Hg 2Cl 2)= - 51.7 kJ ·mol -1∆r G m ∃(Hg 2Cl 2(s))= - 210.82 kJ ·mol -1 (3分)⑶ Hg 2Cl 2(s)→Hg 22+(aq)+2Cl –(aq)∆r G m ∃=[152.0+2(– 131.26) – (– 210.82)] kJ ·mol -1=100.3 kJ ·mol -1 K sp ∃=exp(–∆r G m ∃/RT )=2.6×10-18 (4分)20. 10 分 (4186)4186[答]Ag(s)+AgCl(s)|Cl –(aq)|Hg 2Cl 2(s)|Hg(l) (1) (-) Ag(s)+Cl - - e -→AgCl(s)(+) 1/2Hg 2Cl 2(s)+e -→Hg(l)+Cl -(3分)(2) ∆r H m ∃= [- 127.03 – 12( - 264.93)] kJ ·mol -1 = 5.435 kJ ·mol -1∆r S m ∃=[(77.4+96.2) – (195.8×1/2+42.55)] J ·K -1·mol -1=33.15 J ·K -1·mol -1∆r G m ∃=∆r H m ∃ - T ∆r S m ∃=-4443.7 J ·mol -1E =E ∃= - ∆r G m ∃/zF =0.046 V (3分) p TE)(∂∂=∆r S m ∃/zF =3.43×10-1 V·K -1 (2分) (3) Q R =T ∆r S m ∃,Q p =∆r H m ∃,Q R - Q p = 4.44 kJ(2分)21. 15 分 (4189) 4189[答](1) H 2(30 p ∃)→H 2(p ∃)(2分)2121m 22111(2) d 11 ()d [ln ()]0.0439 V pr m p p p G E V pzF zF RT pp RT p p zFp zF p αα∆=-=-=-+=-+-=⎰⎰ (5分)12(3) ()ln p E R pT zF p ∂=∂ Q R =T ∆r S m =zFT 12()ln 8427 J, p E pRT T p ∂==∂吸热。
第9章可逆原电池题及前段复习

1、在298.15 K,KCl水溶液的体积 与KCl的质量摩尔浓度 的关 、 , 水溶液的体积V与 的质量摩尔浓度m的关 水溶液的体积 的质量摩尔浓度 系式如下: =( =(1.0021+0.01684m+1.81×10-3m3/2)dm3。试 系式如下:V=( + + 计算1mol·kg-1 的KCl溶液中 溶液中KCl和H2O的偏摩尔体积分别为 计算 溶液中 和 的偏摩尔体积分别为
时反应: 解:1200K时反应: 时反应 (1) PbO(l) ==== Pb(l)+0.5O2(g) +
PbO-SiO2(l,aPbO) ==== Pb(l)+.5O2(g) +
熔体中PbO的标准态为纯 熔体中 的标准态为纯PbO(l),两反应的∆rGmØ ,两反应的 的标准态为纯 相同, 相同,即:
1200K时,在Ag-Pd固溶体中钯不挥发, 时 固溶体中钯不挥发, 固溶体中钯不挥发 xAg=0.810,固溶体的蒸气压为 ,固溶体的蒸气压为0.1357Pa, , 活度系数为0.753,则纯Ag的蒸气压 ,则纯 的蒸气压 活度系数为 为 。
a=rx=0.810×0.753= × a=P/P*, * P* =P/ a=0.1357/ * =
3、非理想气体进行绝热恒外压膨胀,下述各组 、非理想气体进行绝热恒外压膨胀, 答案中哪一个正确? 答案中哪一个正确?
A. ΔU>0, ΔS>0 ΔU> ΔS> C.ΔU=0, ΔS= .ΔU= ΔS=0 B.ΔU<0, ΔS > 0, .ΔU< D. ΔU= ΔS>0 ΔU=0, ΔS>
4、苯的正常沸点为353K,此时Δ 4、苯的正常沸点为353K,此时ΔvapHm 353K (C6H6,353K)=30.77kJmol-1。现将 353K、PØ下的 、 下的1mol液态苯向真空蒸发为同 液态苯向真空蒸发为同 温同压下的苯蒸气(可视为理想气体) 温同压下的苯蒸气(可视为理想气体), 此过程的∆U= 此过程的 ,ΔG=
中南大学物理化学PPT第9章

当电池放电时:
负极
Cd(Cd-Hg齐)→Cd2++2e
正极
Hg2SO4+2e→2Hg(1)+SO2-4
电池反应 Cd(Cd-Hg齐)+Hg2SO4(s)=CdSO4(s)+2Hg(1)
韦斯顿电池的电动势随温度的变化关系式可用下式表示: ET=1.01845-4.05×10-5(T-293.15)-9.5×10-7 (T-293. 15)2+1×10-8(T-293.15)3/V
如果该可逆电池按电池反应式进行,当反应进度ξ=1mol 时,其吉布斯自由能变化值应为:
△rGT,P=-nEF/ξ=-zEF z表示电极的氧化或还原反应式中电子的计量系数。
热力学量与电化学量联系起来的重要公式
如已知某反应的△G,并将其设计成可逆原电池,即可求此 可逆原电池的电动势;相反地,如能测出可逆原电池的电动 势,便可算出该电池反应的吉布斯自由能变化值。
△G值与z有关,即与反应式量有关
1/2Cu+Ag+=1/2Cu2++Ag z=1 △rGm,1=-1×EF=-EF
Cu+2Ag+=Cu2++2Ag
z=2
△rGm,2=-2×EF=-2EF
若此二反应式中各种离子浓度均未变化,只是反 应式量变化,则△rGm,2=2△rGm,1
2.2 原电池的电动势与浓度的关系
1.3.4 电动势的产生
原电池的电动势等于构成原电池各相间界面上所形成电势 差的代数和。或者说,它就是原电池的开路电压。“开路” 条件的实质就是没有电流通过电池。
为了表示出接触电势差,原电池表示符号的两边应表示为相
同的金属,这样图2.2
中南大学《工科大学化学》(张平民)_物理化学部分课后习题答案

第1章 化学热力学基本定律与函数习 题1.1mol 双原子理想气体在300 K 、101 kPa 下,经恒外压恒温压缩至平衡态,并从此状态下恒容升温至370 K 、压强为1 010 kPa 。
求整个过程的U ∆、H ∆、W 及Q 。
(答案:△U = 1455 J ,△H = 2037 J ,W=17727 J ,Q = -16272 J ) 解: 第一步:恒外压恒温压缩至平衡态,U ∆=0,H ∆=0V 1=8.314×300/(101×103)=24.695dm 3,此平衡态的体积就是末态的体积V 2, V 2=8.314×370/(1010×103)= 3.046dm 3 此平衡态的压强P’=8.314×300/(3.046×10-3)=818.84kPaW=-P’(V 2-V 1)=-818.92×103×(3.046-24.695)×10-3 =17727 J=17.727 kJ-Q=W=17.727 kJ Q=-17.727 kJ第一步: 因恒容W=0U ∆=Q v =C v,m (T 2-T 1) =20.79×(370-300)=1455.3 J=1.455 kJH ∆=(20.79+R)×70=2037.3 J=2.037 kJ整个过程:W=17.727 kJ ;Q= -17.727+1.455= -16.27 kJ ;U ∆=1.455 kJ ;H ∆=2.037 kJ 。
2.设有0.1 kg N 2,温度为273.15 K ,压强为101325 Pa ,分别进行下列过程,求U ∆、H ∆、Q 及W 。
(1) 恒容加热至压强为151987.5 Pa ; (2) 恒压膨胀至原体积的2倍;(3) 恒温可逆膨胀至原体积的2倍; (4) 绝热可逆膨胀至原体积的2倍。
(答案: ①△U = Q V = 1.01×104 J ,△H = 1.42×104 J ,W = 0;②△H = Q P = 28.4 kJ ,△U = 20.20 kJ ,W= -8.11 kJ ;③ Q = 5622 J ,W = -5622 J ,△H = △U = 0 J ;④ Q = 0,W = △U = -4911 J ,△H = - 6875 J )解: 将N 2 气视为双原子理想气体,则C p,m =29.10 J ·mol -1·K -1;C v,m =20.79 J ·mol -1·K -1(1) W=0, 末态温度 T 2=1.5T 1=1.5×273.15 K∴U ∆=Q v =n C v (T 2-T 1) =(100/28)×20.79×(1.5×273.15-273.15)=1.01×104 JH ∆= n C p (T 2-T 1) =(100/28)×29.10×(1.5×273.15-273.15)=1.42×104 J(2) 末态温度 T 2=2T 1=2×273.15KH ∆=Q p = n Cp(T 2-T 1) =(100/28)×29.10×(2×273.15-273.15) =28388 J=28.4 kJU ∆=n C v (T 2-T 1) =(100/28)×20.79×273.15 = 20201 J=20.20 kJW= -P V ∆= -101325×(100/28)×8.314×273.15/101325= -8110J= -8.11kJ(3) 理想气体恒温,H ∆=U ∆=0,W= -Q= -(100/28)×8.314×273.15×ln2= -5622 J= -5.62 kJ(4) 运用理想气体绝热过程方程:4.0224.011V T V T =T 2=(1/2)0.4×T 1=(1/2)0.4×273.15 =207 KQ=0W=U ∆= n C v,m T ∆= (100/28)×20.79×(207-273.15)= -4911 J= - 4.911 kJH ∆= (100/28)×29.10×(207-273.15)=-6875 J= -6.875 kJ3.在373.15 K 、101325 Pa 下,1 mol 水缓慢蒸发。
第9章 可逆电池试题

第9章可逆电池试题(一) 填空题(每题2分)1. 9-1-1-1电化学按电极反应性质规定为阳极。
为阴极。
2. 9-1-1-1按物理学的规定为正极,为负极。
3. 9-1-1-1原电池的负极为,正极为。
4. 9-1-1-1 电解池阳极为,阴极为。
5. 9-1-1-6标准氢电极表示为:6. 9-1-1-6 甘汞电极表示为:7. 9-1-1-6银一氯化银电极表示为:8. 9-1-1-6气体氯电极表示为:9.9-1-1-6金属锌电极Zn (s)|Zn2+ (a) 反应为:10.9-1-1-6 氧电极Pt (s) | O2 (p)|OH- (a) 反应为:11.9-1-1-6电极Pt (s)|Fe2+ (a1),Fe3+ (a2) ,电极反应为:12.9-1-1-6电极Pt (s)|Sn2+(a1),Sn4+(a2) ,电极反应为:13.9-1-1-6甘汞电极电极电势为:14.9-1-1-6银一氯化银电极电极电势为:(二)单项选择题:(每题1分)15.9-4-2-4 电池在等温、等压和可逆条件下放电,则其与环境间的热交换为下列何者:(A) 一定为零;(B)为ΔH;(C)为TΔS;(D)与ΔH和TΔS均无关。
16.9-4-2-1 下列说法正确的是:(A) 电解池的阳极发生氧化反应;(B) 原电池的负极就是阴极;(C) 电解池的阴极发生氧化反应;(D) 原电池的正极就是阳极。
17. 9-4-2-1对于原电池,下列说法正确的是:(A) 正极是阴极,电池放电时, 溶液中带负电荷的离子向阴极迁移(B) 负极是阳极,电池放电时,溶液中阴离子向正极迁移(C) 负极是阳极,电池放电时,溶液中带负电荷的离子向负极迁移(D) 负极是阴极,电池放电时,溶液中带负电荷的离子向阳极迁移18. 9-4-2-1对于丹聂尔电池,在充电过程中,有下列说法中正确的是:(A) Cu 为正极, Zn为负极(B) Cu 为阳极, Zn为阴极(C) Cu 为负极, Zn为正极(D) Cu 为阴极, Zn为阳极19. 9-4-2-1对于电解池来说:?(A) 与电源正极相联的是阴极,发生还原反应(B) 与电源正极相联的是阳极,发生氧化反应(C) 与电源负极相联的是阴极,发生氧化反应(D) 与电源负极相联的是阳极,发生还原反应20.9-4-2-2下列电池中肯定为不可逆电池的是:(A) Pt,H2(P1)|HCl(a)|Cl2(P2),Pt (B) Ag(s),AgCl(s)|KCl(a)|Hg2Cl2(s),Hg(l)(C) Zn|H2SO4(a)|Cu (D) Pb,PbO(s)|NaOH(a)|HgO(s),Hg(l)21.9-4-2-3 采用补偿法测定可逆电池电动势,主要目的是:(A) 消除电极上的副反应(B) 使标准电池的电动势稳定(C) 在接近可逆的条件下测电池电动势(D) 减少工作电池的损耗22.9-4-2-5 Pt,H2(P)|OH-(a)电极是:(A) 第一类可逆电极(B) 第二类可逆电极(C) 第三类可逆电极(D) 不可逆电极23.9-4-2-5有四个电极(1) Cu |CuSO4(a);(2) Cu |H2SO4(a) (3)Cu│HCl(a);(4) Cu |CuCl2(a);其中:(A) (1)(2)是可逆电极(B) (1)(3)是可逆电极(C) (1)(4)是可逆电极(D) 全是可逆电极24.9-4-2-5下列电极中,对阴离子可逆的电极为:(A) 铜电极 (B) 标准氢电极 (C) 甘汞电极 (D) 玻璃电极 25.9-4-2-5酸度计所用的指示电极是:(A) 玻璃电极 (B) 氢电极 (C) 甘汞电极 (D) 铂电极 9-4-2-5 (A)26.9-4-2-5甘汞电极是:(A) 金属电极 (B) 金属-金属难溶盐电极 (C) 金属-金属氧化物电极 (D) 氧化-还原电极27.9-4-2-5 测定溶液 pH 值的最常用的指示电极为玻璃电极,它是: (A) 第一类电极 (B) 第二类电极 (C) 氧化-还原电极 (D) 离子选择性电极 28.9-4-2-7对于甘汞电极,下列叙述正确的是:(A) 电极反应为 Hg +22+2e -→Hg ; (B) 属于第一类电极;(C) 对阴离子可逆,电极电势较稳定;(D) 电极电势为φ(Hg 2Cl 2)=φθ(Hg 2Cl 2)+(RT/2F)ln α(Cl -)29.9-4-2-7 0℃ 时,对于下列电极反应: Cl 2(P θ)+ 2e -2Cl -(α(Cl -))下列电极电势计算式中,哪个 是正确的:(A) φ=φθ-0.05915lg α(Cl -) (B) φ=φθ+0.05915lg α(Cl -)(C) φ=φθ-0.1183lg α(Cl -) (D) φ=φθ-0.02568lg α(Cl -)30.9-4-2-8 298K 时,已知 φθ(Fe 3+,Fe 2+)=0.77V , φθ(Sn 4+,Sn 2+)=0.15V , 当这两个电极组成自发电池时,E θ为:(A) 1.39 V (B) 0.62 V (C) 0.92 V (D) 1.07 V 31.9-4-2-4下述各量与电池反应方程式的书写无关的是: (A) Q B ; (B) Δr H θm ; (C) K θ; (D) E θ32.9-4-2-3韦斯登标准电池放电时正极上发生的反应为:(A) Cd 2++2e -→Cd (B) PbSO 4+2e -→Pb+SO -24 (C) Hg 2SO 4(s)+2e -→2Hg(l)+SO -24 (D) Hg 2Cl 2+2e-→2Hg+2Cl -33.9-4-2-2下列可以安排为可逆电池的是:(A)Zn(s) | HCl (b ) | Ag (s); (B)Zn (s)|ZnSO 4 (a 1)|CuSO 4 (a 2)|Cu (s); (C) Zn (s)|ZnSO 4 (a 1)║CuSO 4 (a 2)|Cu (s);(D) Zn (s)|CuSO 4 (a 2)|Cu (s)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第9章可逆原电池1.写出下列原电池中各电极反应、电池反应及E①(101325Pa)|KOH(a)|O2(101325Pa),Pt② Pt,H2③④解:(1) 负极 Pb(s)+(a) → PbSO 4(s)+2e正极 Cu2+() + 2e →Cu(s)(a) + Cu2+ (a Cu2+) ==== PbSO4(s)+Cu(s)电池反应 Pb(s)+SO4( pΘ ) -2e → 2H+ (a H+)(2) 负极 H2( pΘ ) + H2O +2e → 2OH -(a OH -)正极 O2(pΘ) +电池反应 H2O2(pΘ) → H2O(l)(3) 负极 3H(p H2) - 6e → 6H+(aq)2正极 Sb2O3(s) + 6e + 6H+(aq) → 2Sb(s) +3H2O(l)电池反应 Sb2O3+3H2(p H2) → 2Sb(s) + 3H2O(l)(4) 负极 Ag(s) + I -(a I -) → AgI(s) + e正极 AgCl(s) + e → Ag(s) + Cl - (a Cl-)电池反应 Agl(s) + I-(a I -) → Ag(s) + Cl - (a Cl-)2(1)Zn(s) + H2SO4(a1) === ZnSO4(a2) + H2(p H2);(2)Ni(s) + H2O ==== NiO(s) + H2(p H2)(3)H2(p H2) + O2(p O2) ==== H2O(l);(4)H2(p H2) + HgO(s) ==== Hg(l) + H2O(l)解:(1)负极 Zn(s) -2e → Zn2+(a2)正极 2H+(a1) + 2e → H2(P H2)电池反应 Zn(s) +2H+(a1) ==== Zn2+(a2)+ H2(p H2)电池符号 Zn(s) | ZnSO4(a2) || H2SO4(a1) | H2(p H2),Pt(2) 负极 Ni(s) + 2OH -→NiO(s) + H2O +2e正极 2H2O + 2e →H2(p H2) +2OH -电极反应 Ni(s) + H2O ====NiO(s) + H2(p H2)电池符号 Ni(s),NiO(s) | KOH(稀) | H2(p H2), Pt(3)负极 H2(p H2) + 2OH -→ 2H2O + 2e正极 2H2O +2e → 2OH - + O2(p O2)电池反应 H2(p H2) + O2(p O2)==== H2O(l)电池符号 Pt,H2(p H2) | NaOH(稀) | O2(p O2),Pt(4) 负极 H2(p H2) + 2OH -→2H2O +2e正极 HgO(s) + H2O +2e → Hg(l) +2OH -电池反应 H2(p H2) + HgO(s)==== Hg(l) + H2O(l)电池符号 Pt ,H2(p H2) | KOH(稀) | HgO(s),Hg(l)3.工业上用铁屑加入硫酸铜溶液中以置换铜,试设计原电池;计算该反应在298.15K时的平衡常数,并说明此置换反应进行的完全程度。
已知=0.3402V,=-0.4402V。
(答案:2.423×1026)解:电池符号为:-)Fe(s) |Fe2+ (a1)|| Cu2+(a2)|Cu(s) (+因很大,故可以认为反应进行彻底。
4.试计算反应:2Fe 3+ +2Br -→2Fe 2++Br 2在298.15K 下的标准平衡常数?(答案:1.06×10-10)解: 将反应设计为原电池:-) Pt, Br 2 | Br -(a 1) || Fe 3+-(a 2), Fe 2+(a 3) | Pt (+查298.15K 下标准电极电势顺序表得,5.在298.15K 时,测得下列电池的E 为1.228VPt,H 2()|H 2SO 2(0.01mol ·kg -1)|O 2(),Pt已知△f =-285.83kJ ·mol -1。
试计算:① 此电池的温度系数;②设反应热在此温度范围内为常数,试求此电池在273.15K 时的电动势。
(答案:–8.493×10-4 V ·K -1;1.2492V )解: 负极 : H 2() → 2H +(m H + =2×0.01 mol ·kg -1 ) + 2e正极 : O 2() + 2H +( m H + =2×0.01mol ·kg -1) + 2e → H 2O(l)电池反应:H 2() + O 2() ==== H 2O(l)(1)求电池的温度系数ΔG = -2EF = -2×1.228×96485 = -236967.16 J ·mol -1-163.89 J·mol-1·k-1(2) 求电动势-zEF = ΔG = ΔH –TΔS = ΔH -= (-285.83) - [273.15×2×96485×(-8.49×10-4)]×10-3= -241.06 kJ·mol -16.已知;。
求。
在298.15K时,溶液混合,试计算平衡时Cu+离子浓度?(答案:铜粉与含0.01mol·kg-1的CuSO20.158V;4.42×10-5)解: (1) Cu2+ + 2e ==== Cu(2) Cu+ + e ==== Cu(3) Cu2+ +e ==== Cu+因(1) - (2) = (3),故,即溶液混合时,可能发生下述反应Cu粉与 CuSO4Cu2+ + Cu ==== 2Cu+0.01 00.01-x 2x取mΘ=1.0mol·kg-17.在298.15K时,将金属铁片和镉片分别插入下列溶液之中构成原电池,何者为负极?(1) 溶液中Fe 2+及Cd2+的浓度均为0.1mol·kg-1;(2) 溶液中含Fe2+为0.1mol·kg-1,含Cd2+为0.0036 mol·kg-1。
(答案:(1)铁;(2)镉)解:设溶液中各离子的活度系数均为1,mΘ=1.0mol·kg-1(1) 计算 Fe及Cd的电极电势Fe2+ (m1 =0.1 mol·kg-1) + 2e → Fe(s)Cd2+( m2 =0.01mol·kg-1) + 2e → Cd(s)在因为< ,所以此溶液中铁为负极(2) 在此溶液中,仍为0.4698V因为<,故在此溶液中金属镉为负极。
8.已知298.15K时=-0.1263V,PbSO2的活度积K sp=1.66×10-8,试求(答案:–0.3564V)解:(1) Pb2+ (a1) + 2e → Pb(2) PbSO4→ Pb2+ (a1) + (a2)(1) + (2) = (3): PbSO4+2e → Pb + (a2)故9.在298.15K 时,浓度为0.1mol·kg-1或0.01mol·kg-1的AgNO3溶液中Ag+离子的平均迁移数为0.467。
试计算下列电池在298.15K时的电动势及电池(2)的液体接界电势。
(1) Ag|AgNO3(0.01mol·kg-1,=0.892)‖AgNO3(0.1mol·kg-1,=0.733|Ag;(2) Ag|AgNO3(0.01mol·kg-1,=0.892)|AgNO3(0.1mol·kg-1,=0.733|Ag(答案:0.054;0.058V)解:对1-1价型的电解质溶液而言:m± = m i = m ,电池(1)正极反应:Ag+ (a2) + e → Ag负极反应:Ag → Ag+ (a1) + e电池反应:AgNO3(a2) ==== AgNO3(a1)电池(2)为有迁移的浓差电池,对正离子可逆,故用扩0.0577 - 0.0541 = 0.0036V10.在298.15K时,测得下列电极反应的。
Ag(NH3)+2+ e ===== Ag + 2NH3已知银的,求银氨配离子的不稳定常数。
(答案:6.146×10-8)解:Ag(NH3)+2+ e ===== Ag + 2NH3Ag++e ===== Ag(1) - (2) 得: Ag(NH3)2+ ===== Ag+ + 2NH311Zn(s)|ZnCl2(0.1mol·kg-1)|Cl2(101325Pa),Pt(答案:E+=0.7948V;E-=1.402V;2.197V)解:设溶液中各离子的活度系数均为1第一法,现分别计算电极电势:负极:Zn(s) → Zn2+(a1) + 2e正极: Cl2+ 2e → 2Cl -(a2)E =第二法,先写出电池反应,然后直接求此电池的电动势:Zn(s) + Cl2(pΘ) ==== Zn2+(0.1 mol·kg-1) + 2Cl-(0.2 mol·kg-1)12.某水溶液中约含0.01mol ·kg -1 CdSO 2、0.01mol ·kg -1 ZnSO 4和0.5 mol ·kg -1 H 2SO 4,在此溶液中插入两支铂电极,在极低电流密度下进行电解,同时很好搅拌,已知298.15K 时,① 试问何种金属将首先在阴极上沉积;② 当另一金属开始沉积时,溶液中先放电的那种金属所剩余的浓度是多少(设浓度等于活度)? (答案:Cd ;6.62×10-15mol ·kg -1) 解:(1)先计算出各电极在相应浓度的溶液中的电极电势由于镉电极电势较为正,故在阴极上首先析出镉 (2)当锌开始沉积时,镉电极电势与锌电极电势相等,则:13.设有pH =3的硫酸亚铁溶液,试问用空气中的氧(p O2=21278.25Pa) 能否使Fe 2+氧化成Fe 3+,当酸度增大时,对Fe 2+氧化有利还是不利? 已知O 2 + 4H + + 4e ==== 2H 2OFe 3+ + e ==== Fe 2+(答案:可使Fe 2+氧化)解:由+) O2 + 4H+ + 4e ==== 2H2O-) 4Fe2+ ==== 4Fe3+ + 4eO2+ 4Fe2+ + 4H+===== 4Fe3+ + 2H2O反应平衡时E=0,则:所以在此条件下,Fe2-能被空气中的氧所氧化成Fe3+,并随着酸度的增大氧化将越完全。
14.在298.15K时,原电池Cd|CdCl2(0.01mol·kg-1)|AgCl(s),Ag的电动势为0.7585V,其标准电动势EΘ=0.5732V。
