九年级上册化学文字表达式及化学方程式53206
人教版九年级上册化学化学方程式汇总.doc

化学反应
化学方程式
反应现象
反应现象
反应 类型
1
红磷在空气中燃烧
4P+5 02点燃2P2O5
红磷在空气中燃烧,产生人量白烟
化
合 反 应
2
硫在空气中燃烧
S+ 02点燃so2
硫在空气屮燃烧淡蓝色火焰, 有刺激性气味的气休
二氧化碳通入氢氧化钠溶液,儿 乎无现彖,吸收一氧化碳
49
卷氧化钠与二氧化硫反应
2NaOH+SO2==Na2SO3+H2O
没有明显现象
49
氢氧化钠与三氧化硫反应
2NaOH+SO3==Na2SO4+H2O
无明显现象
C2H5OH+ 3O2点燃2CO?+ 3H2O
产生淡蓝色的火焰
集气瓶的内壁有水珠出现,并能使澄清的石 灰水变浑浊的气体
47
一氧化碳还原三氧化二铁
3CO +Fe2O3高温2Fe+ 3C02
玻璃管A中的现象:红色的氧 化铁粉末逐渐变为黑色
B屮的现象:澄清石灰水变浑浊
48
氢氧化钠与•氧化碳反应
2NaOH+CO2==Na2CO3+H2O
2Mg+ O2疊2 MgO
发出耀眼的白光,放出热量, 生成白色固体
剧烈燃烧,发岀輝眼白光,生成白烟,放出 大量的热
7
蛍气在空气屮燃烧
2 H2+ O2点燃2 H2O
氢气在空气中燃烧淡蓝色火焰;
氢气在氧气屮燃烧与空气屮和同
8
铝在空气中反应
4 Al + 3O2==2 AI2O3
九年级化学要背的所有文字表达式、化学式、元素符号

九年级化学要背的所有文字表达式、化学式、元素符号九年级化学要背的所有文字表达式、化学式、元素符号化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铝在空气中燃烧:4Al + 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 + O2点燃2H2O5、红磷在空气中燃烧:4P + 5O2点燃2P2O56、硫粉在空气中燃烧:S + O2点燃27、碳在氧气中充分燃烧:C + O2点燃CO28、碳在氧气中不充分燃烧:2点燃2CO9、二氧化碳通过灼热碳层:2高温2CO10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO211:CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4加热24 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 ==ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2↑25、甲烷在空气中燃烧:CH42点燃CO2 + 2H2O26、水蒸气通过灼热碳层:H2高温H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O30、酒精在空气中燃烧:C2H52点燃2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热232、一氧化碳还原氧化铁:3CO+ Fe23高温2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2 O35. 氢气中空气中燃烧:2H2 2 点燃2H2 O6. 红磷在空气中燃烧:4P + 5O2 点燃 2 O57. 硫粉在空气中燃烧:S + O2 点燃 28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧: 2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 2 + 2H2 O12. 酒精在空气中燃烧:C2 H5 2 点燃2CO2 + 3H2 O 二.几个分解反应:13. 水在直流电的作用下分解:2H2 O 通电2H2 ↑+O2 ↑14. 加热碱式碳酸铜:Cu2 (OH)2 CO3加热2 O + CO2 ↑15. 3△2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4加热K2 MnO4 2 + O2 ↑17. 碳酸不稳定而分解:H2 3 2 O + CO2 ↑18. 高温煅烧石灰石:CaCO3高温CaO + CO2 ↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热Cu + H2 O20. 木炭还原氧化铜:C+ 2CuO 高温2 ↑21. 焦炭还原氧化铁:3C+ 2Fe2 3高温4Fe + 3CO2 ↑22. 焦炭还原四氧化三铁:2C+ Fe34高温3Fe + 2CO2 ↑23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2 3高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:34高温3Fe + 4CO2 四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2 SO4 = ZnSO4 + H2 ↑27. 铁和稀硫酸Fe + H2 SO4 = FeSO4 + H2 ↑28. 镁和稀硫酸Mg + H2 SO4 = MgSO4 + H2 ↑29. 铝和稀硫酸2Al +3H2 SO4 = Al2 (SO4)3 +3H2 ↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2 ↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2 ↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2 ↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2 ↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2 O3 + 6HCl === 2FeCl3 + 3H2 O38. 氧化铁和稀硫酸反应:Fe2 O3 + 3H2 SO4 === Fe2 (SO4)3 + 3H2 O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2 O40. 氧化铜和稀硫酸反应:CuO + H2 SO4 ==== CuSO4 + H2 O41. 氧化镁和稀硫酸反应:MgO + H2 SO4 ==== MgSO4 + H2 O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2 O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2 CO3 + H2 O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2 SO3 + H2 O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2 SO4 + H2 O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2 O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2 O (5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2 O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2 O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2 O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2 O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2 O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2 O54.硫酸和烧碱反应:H2 SO4 + 2NaOH ==== Na2 SO4 + 2H2 O55.硫酸和氢氧化钾反应:H2 SO4 + 2KOH ==== K2 SO4 + 2H2 O56.硫酸和氢氧化铜反应:H2 SO4 + Cu(OH)2 ==== CuSO4 + 2H2 O57. 硫酸和氢氧化铁反应:3H2 SO4 + 2Fe(OH)3==== Fe2 (SO4)3 + 6H2 O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2 O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2 O + CO2 ↑60.碳酸钠与稀盐酸反应: Na2 CO3 + 2HCl === 2NaCl + H2 O + CO2 ↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2 O + CO2 ↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2 CO3 + H2 SO4 === Na2 SO4 + H2 O + CO2 ↑64.硫酸和氯化钡溶液反应:H2 SO4 + BaCl2 ==== BaSO4↓+ 2HCl (7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2 ↓+ Na2 SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2 ↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2 ↓+ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O 77.无水硫酸铜作干燥剂:CuSO4 + 5H24·5H2O化学方程式反应现象应用2Mg+O2点燃2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹4Al+3O点燃2Al2O3银白金属变为白色固体3Fe+2O点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H22点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4氧炔焰、焊接切割金属2KClO3Mn O2Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4ΔK24+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2通电2H2↑+O2↑水通电分解为氢气和氧气电解水Cu223Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热。
九年级上册化学文字表达式及化学方程式

九年级上册化学文字表达式及化学方程式在九年级上册的化学学习中,文字表达式和化学方程式是非常重要的内容,它们是我们理解化学反应的关键工具。
接下来,让我们一起深入了解一下这些重要的知识。
一、文字表达式文字表达式是用文字来描述化学反应的式子。
它能够简单直观地表示出反应物和生成物。
1、红磷燃烧红磷+氧气点燃五氧化二磷这个反应中,红磷在氧气中燃烧生成了五氧化二磷。
红磷燃烧会产生大量的白烟。
2、硫燃烧硫+氧气点燃二氧化硫硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧则发出明亮的蓝紫色火焰,生成有刺激性气味的二氧化硫气体。
3、铁燃烧铁+氧气点燃四氧化三铁铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体四氧化三铁。
4、木炭燃烧(1)木炭在氧气充足时燃烧木炭+氧气点燃二氧化碳(2)木炭在氧气不充足时燃烧木炭+氧气点燃一氧化碳木炭燃烧的情况取决于氧气的供应量。
5、加热高锰酸钾制取氧气高锰酸钾加热锰酸钾+二氧化锰+氧气这是实验室制取氧气的方法之一,高锰酸钾受热分解产生锰酸钾、二氧化锰和氧气。
6、过氧化氢分解制取氧气过氧化氢二氧化锰水+氧气在二氧化锰的催化作用下,过氧化氢分解生成水和氧气。
7、氯酸钾受热分解制取氧气氯酸钾加热氯化钾+氧气加热氯酸钾可以制取氧气,但通常需要加入二氧化锰作为催化剂来加快反应速率。
二、化学方程式化学方程式是用化学式来表示化学反应的式子,它不仅能表示出反应物、生成物,还能反映出反应的条件和各物质之间的质量关系。
1、氢气燃烧2H₂+ O₂点燃 2H₂O氢气在氧气中燃烧生成水,这是一个清洁能源的反应。
2、水通电分解2H₂O 通电 2H₂↑ + O₂↑通过通电,水分解为氢气和氧气。
3、镁燃烧2Mg + O₂点燃 2MgO镁条在空气中燃烧,发出耀眼的白光,生成白色固体氧化镁。
4、碳的完全燃烧C + O₂点燃 CO₂5、碳的不完全燃烧2C + O₂点燃 2CO6、一氧化碳燃烧2CO + O₂点燃 2CO₂一氧化碳是一种有毒气体,但它可以燃烧生成二氧化碳。
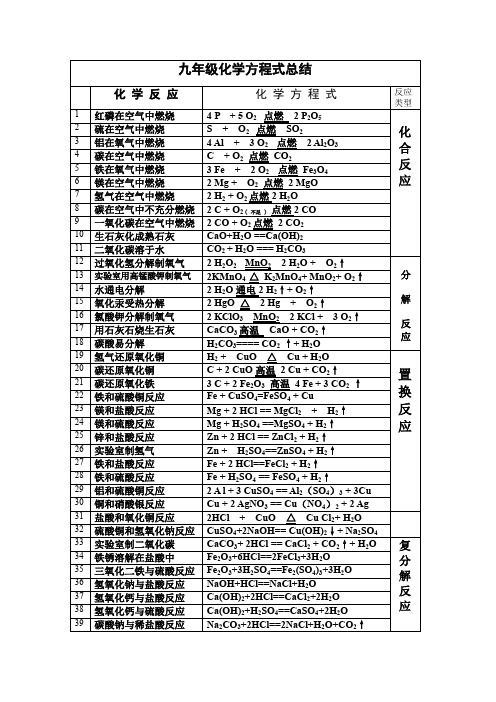
人教版九年级上册化学化学方程式汇总

九年级上册化学方程式总结 (红色的为期中前的化学方程式,蓝色部分为期末内容,其余的为下学期)"反应 类型反应现象化红磷在空气中燃4 P +5 O 点燃 2 P O22 52碳在空气中燃烧 (充分)合2铁在氧气中剧烈燃烧,火星四 射;生成黑色固体;放出大量.铁在氧气中燃烧反氢气在氧气中燃烧与空气中相氢气在空气中燃 同氢气在空气中燃2 H + O 点燃2 H O2烧烧淡蓝色火焰;22}铝在空气中不能 在纯氧中可燃,现象是剧烈燃 燃烧,但与氧气能 烧,发出白光,生成白色固体7 铝在空气中反应 4 Al + 3 O ==2 AlO22 3应分 碳在空气中不充分燃烧2 C + O点燃2 CO2 ( 不足 )|2 CO + O 点燃 2 CO22生石灰化成熟石10CaO+H O ==Ca(OH)2~2水变酸性,生成碳酸,颜色没变化,基本上没什么现象,就是冒气泡,应用于常喝的汽水22过氧化氢分解制氧气产生大量的气泡,产生的气体能使带火星的木条复燃22$高锰酸钾 制造氧气是最容易 产生大量的气泡,产生的气134242解反正极氧气,负极氢气22用集气法 收集氧162 KClO MnO 2 KCl +3 O ↑2把带有火星的木条深入集气的水被排 32氧气是:氧气 很难溶于 水这个反应很容易让同学们忽略,但是考得多,你说不记吗17 CaCO 高温 CaO + CO↑2应 3产生气泡 如果滴 了紫色石蕊指示剂 的话 溶液从红色18 碳酸易分解 H C O ==== CO ↑+ H O2232变成紫色 置黑色粉末逐渐变成 光亮的红色物质, H + CuO △ Cu + H O2同时试管口有水滴2生成10:1 的比放在研数分钟后,即可看 钵中充分研磨,使 到石灰水变浑浊, 之混合均匀,装入 而原来的黑色粉末 硬质试管并铺开 混合物基本变为红(如图),再用酒精 色。
喷灯(或大火焰酒换反C + 2 CuO 高温 2 Cu + CO↑2红棕色固体逐渐减少2 3 2则会出现混浊铁溶解,有红色物质生成,溶液由蓝 色变为浅绿色,22 Fe + CuSO =FeSO + Cu44金属较快溶解,并放出气体 应置2 4 4有气泡产生溶液颜色不变2 4 42发生剧烈反应,白 色固体溶解,在固体表面生成大量气泡得到无色溶液2金属逐渐溶解 产 溶液由无色变为浅 生少量气体 绿色金属逐渐溶解 产 溶液由无色变为浅2绿色2 4 4蓝色的硫酸铜溶液 会变色成为无色的硫酸铝。
人教版九年级上册化学化学方程式汇总
用石灰石烧生石灰
CaCO3高温CaO + CO2↑
18
碳酸易分解
H2CO3==== CO2↑+ H2O
19
氢气还原氧化铜
H2+ CuO△Cu + H2O
置
换
反
应
20
碳还原氧化铜
C + 2 CuO高温2 Cu + CO2↑
21
碳还原氧化铁
3 C+ 2 Fe2O3高温4 Fe + 3 CO2↑
22
铁和硫酸铜反应
NaHCO3+HCl=NaCl+H2O+CO2↑
41
用碳酸钠制取氢氧化钠
Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
42
一氧化碳还原氧化铜
CO +CuO加热Cu + CO2
特
殊
类
型
43
二氧化碳和石灰水反应
CO2+ Ca(OH)2= CaCO3↓+ H2O
44
甲烷在空气中燃烧
CH4+ 2 O2点燃CO2+ 2 H2O
九年级化学方程式总结
化学反应
化学方程式
反应
类型
1
红磷在空气中燃烧
4 P + 5 O2点燃2 P2O5
化
合
反
应
2
硫在空气中燃烧
S + O2点燃SO2
3
铝在氧气中燃烧
4 Al + 3 O2点燃2 Al2O3
4
碳在空气中燃烧
C + O2点燃CO2
5
铁在氧气中燃烧
九年级化学文字表达式

九年级化学文字表达式九年级化学文字表达式大全学习化学纪要记住各种化学物质反应现象的表达式。
下面是店铺整理分享给大家的'九年级化学文字表达式,希望对大家有所帮助!一.氧化反应1) 单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃= 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃== Fe3O43. 铜在空气中受热:2Cu + O2 加热== 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃== 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃== 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃== 2P2O57. 硫粉在空气中燃烧: S + O2 点燃== SO28. 碳在氧气中充分燃烧:C + O2 点燃== CO29. 碳在氧气中不充分燃烧:2C + O2 点燃== 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃== 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃== CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃== 2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电== 2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热== 2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热== K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温== CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热== Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温== 2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温== 4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温== 3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热== Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温== 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温== 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1) 金属单质 + 酸——盐 + 氢气 (置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液)——另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸——- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 +H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱——盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 + H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 + H2O(5)酸 + 碱——盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐——另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 + 2HCl(7)碱 + 盐——-另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2 + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3 + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2 + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2 + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3 + 2NaOH(8)盐 + 盐——两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl + NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4 + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4?5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4。
九年级上册所有化学方程式及化学文字表达式

九年级上册所有化学方程式及化学文字表达式teacher073 2013-12-16 化合反应1、镁在空气中燃烧:2Mg+O2 2MgO2、铁在氧气中燃烧:3Fe+2O2 Fe3O43、铝在空气中燃烧:4Al+3O2 2Al2O34、氢气在空气中燃烧:2H2+O2 2H2O5、红磷在空气中燃烧:4P+5O2 2P2O56、硫粉在空气中燃烧:S+O2SO27、碳在氧气中充分燃烧:C+O2 CO28、碳在氧气中不充分燃烧:2C+O22CO9、二氧化碳通过灼热碳层:C+CO2 2CO10、一氧化碳在氧气中燃烧:2CO+O22CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O==H2CO312、生石灰溶于水:CaO+H2O==Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2 2NaCl分解反应15、实验室用双氧水制氧气:2H2O22H2O+O2↑16、加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O 2H2↑+O2↑18、碳酸不稳定而分解:H2CO3==H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 CaO+CO2↑置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑23、氢气还原氧化铜:H2+CuOCu+H2O24、木炭还原氧化铜:C+2CuO 2Cu+CO2↑25、水蒸气通过灼热碳层:H2O+C H2+CO26、焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑其他27.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO428、甲烷在空气中燃烧:CH4+2O2 CO2+2H2O29、酒精在空气中燃烧:C2H5OH+3O2 2CO2+3H2O30、一氧化碳还原氧化铜:CO+CuO Cu+CO231、一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO232、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O33、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑35、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2Mg+O2 2MgO2. 铁在氧气中燃烧:3Fe+2O2 Fe3O43. 铜在空气中受热:2Cu+O2 2CuO4. 铝在空气中燃烧:4Al+3O2 2Al2O35. 氢气中空气中燃烧:2H2+O2 2H2O6. 红磷在空气中燃烧:4P+5O22P2O57. 硫粉在空气中燃烧:S+O2 SO28. 碳在氧气中充分燃烧:C+O2 CO29. 碳在氧气中不充分燃烧:2C+O2 2CO⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2 2CO211. 甲烷在空气中燃烧:CH4+2O2 CO2+2H2O12. 酒精在空气中燃烧:C2H5OH+3O2 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 2H2↑+O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 2CuO+H2O+CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 2KCl+3O2↑16. 加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H2CO3==H2O+CO2↑18. 高温煅烧石灰石:CaCO3CaO+CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+CuO Cu+H2O20. 木炭还原氧化铜:C+2CuO 2Cu+CO2↑21. 焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑22. 焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑23. 一氧化碳还原氧化铜:CO+CuO Cu+CO224. 一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO225. 一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO2四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑27. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑28. 镁和稀硫酸Mg+H2SO4==MgSO4+H2↑29. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn+2HCl==ZnCl2+H2↑31. 铁和稀盐酸Fe+2HCl==FeCl2+H2↑32. 镁和稀盐酸Mg+2HCl==MgCl2+H2↑33. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑⑵金属单质+ 盐(溶液)-------另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu35. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu36. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg⑶碱性氧化物+酸--------盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O39. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O40. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O41. 氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O42. 氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O⑷酸性氧化物+碱-------- 盐+水43.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O46.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O47. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O⑸酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O49. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O58.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O⑹酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl⑺碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO466.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl67.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH⑻盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO371.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O==H2CO373.生石灰溶于水:CaO+H2O==Ca(OH)274.氧化钠溶于水:Na2O+H2O==2NaOH75.三氧化硫溶于水:SO3+H2O==H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O化学方程式反应现象应用2Mg+O2 2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O22HgO银白液体、生成红色固体拉瓦锡实验2Cu+O2 2CuO红色金属变为黑色固体4Al+3O22Al2O3银白金属变为白色固体3Fe+2O2 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热C+O2 CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O2SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 2H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O22H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2 2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3 2KCl+3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4 K2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO 2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O 2H2↑+O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3 2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3 NH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4==ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4==FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4==MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4==Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2W+3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2Mo+3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2 2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl22HCl 苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O2 2CO煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+O2 2CO2蓝色火焰煤气燃烧C+CuO 2Cu+CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 4Fe+3CO2↑冶炼金属Fe3O4+2C 3Fe+2CO2↑冶炼金属C+CO22COCO2+H2O==H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3 CO2↑+H2O石蕊红色褪去Ca(OH)2+CO2==CaCO3↓+H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2==Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2 CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3 Na2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 CaO+CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl==CaCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4==Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl==2NaCl+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl==MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO+CO Cu+CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO2Fe+3CO2冶炼金属原理Fe3O4+4CO 3Fe+4CO2冶炼金属原理WO3+3CO W+3CO2冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O22CO2+4H2OC2H5OH+3O2 2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4==Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4==Fe+MgSO4溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2Cu+2AgNO3==2Ag+Cu(NO3) 2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4==Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl==2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl==2AlCl3+3H2O白色固体溶解Na2O+2HCl==2NaCl+H2O白色固体溶解CuO+2HCl==CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl==ZnCl2+H2O白色固体溶解MgO+2HCl==MgCl2+H2O白色固体溶解CaO+2HCl==CaCl2+H2O白色固体溶解NaOH+HCl==NaCl+H2O白色固体溶解Cu(OH)2+2HCl==CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl==MgCl2+2H2O白色固体溶解Al(OH)3+3HCl==AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl==FeCl3+3H2O红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2OHCl+AgNO3==AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4==CuSO4+H2O黑色固体溶解、溶液呈蓝色ZnO+H2SO4==ZnSO4+H2O白色固体溶解MgO+H2SO4==MgSO4+H2O白色固体溶解2NaOH+H2SO4==Na2SO4+2H2OCu(OH)2+H2SO4==CuSO4 +2H2O蓝色固体溶解Ca(OH)2+H2SO4==CaSO4+2H2OMg(OH)2+H2SO4==MgSO 4+2H2O白色固体溶解2Al(OH)3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4==Fe2(SO4)3+3H2O红褐色沉淀溶解、溶液呈黄色Ba(OH)2+H2SO4==BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+H2SO4==BaSO4↓+2HCl生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4==BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3==2NaNO3+H2O白色固体溶解CuO+2HNO3==Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3==Zn(NO3)2+H2O白色固体溶解MgO+2HNO3==Mg(NO3)2+H2O白色固体溶解CaO+2HNO3==Ca(NO3)2+H2O白色固体溶解NaOH+HNO3==NaNO3+H2OCu(OH)2+2HNO3==Cu(NO3)2 +2H2O蓝色固体溶解Mg(OH)2+2HNO3==Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3==Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3==Ca(NO3)2+2H2OFe(OH)3+3HNO3==Fe( NO3)3+3H2O红褐色沉淀溶解、溶液呈黄色3NaOH+H3PO4==3H2O+Na3PO43NH3+H3PO4==(NH4)3PO 42NaOH+CO2==Na2CO3+H2O 吸收CO、O2、H2中的CO22NaOH+SO2==Na2SO3+H2O2NaOH+SO3==Na2SO4+H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH==Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH==Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH==Mg(OH)2↓+2NaClCuCl2+2NaOH==Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O==Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2==CaSO3↓+H2O有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3==CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3==BaCO3↓+2NaOH有白色沉淀生成Ca(OH)2+K2CO3==CaCO3↓+2KOH有白色沉淀生成CuSO4+5H2O==CuSO4·H2O蓝色晶体变为白色粉末CuSO4+H2O CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl==AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2+Na2SO4==BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3==CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2==BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl==CaCl2+H2O+CO2↑MgCO3+2HCl==MgCl2+H2O+ CO2↑NH4NO3+NaOH==NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+KOH==KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体。
人教版九年级上册化学化学方程式汇总
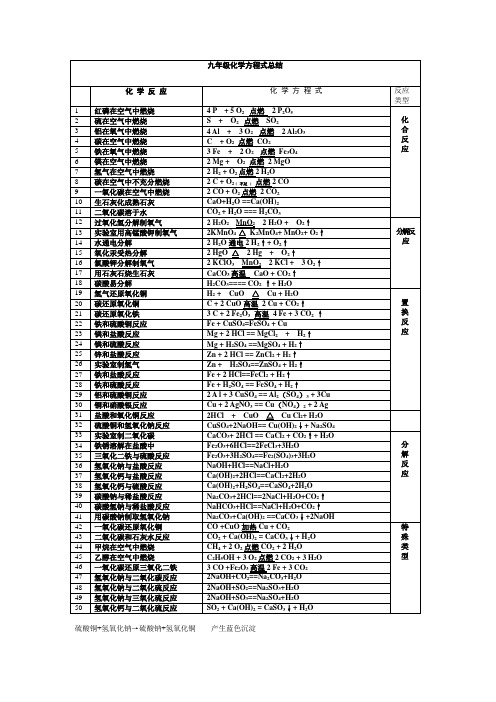
硫酸铜+氢氧化钠→硫酸钠+氢氧化铜产生蓝色沉淀复分解反应: 硫化铁+硫酸→硫化氢+硫酸铁还有硫酸铝+氢氧化钠→硫酸钠+氢氧化铝实验电解水[生成氢气和氧气],澄清石灰水[氢氧化钙]中通入二氧化碳[产生白色沉淀],生成碳酸钙和水大理石[碳酸钙]和盐酸反应[产生大量气泡],生成二氧化碳,水和氯化钙生石灰[氧化钙]和水生成熟石灰[氢氧化钙],[生石灰变疏松,放出热量(如果加无色酚酞试剂{中和酸性不变,碱性变红}:变红)]水和二氧化碳反应生成碳酸[加紫色石蕊试剂{酸红碱蓝中紫}:变红]*氯酸钾加二氧化锰作催化剂加热生成氯化钾和氧气{检验用带火星的小木条}*双氧水[过氧化氢]加二氧化锰作催化剂生成水和氧气{同上}初三化学方程式总结(1--7单元)化学方程式反应现象应用2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4ΔK2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2ΔW +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4+2C高温3Fe + 2CO2↑冶炼金属CO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2ΔCaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔCu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2O2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4ΔK2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验Cu2(OH)2CO3Δ2CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2ΔW +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑冶炼金属Fe3O4+2C高温3Fe + 2CO2↑冶炼金属CO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2ΔCaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔCu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属。
人教版九年级上册化学化学方程式汇总(K12教育文档)

人教版九年级上册化学化学方程式汇总(word 版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(人教版九年级上册化学化学方程式汇总(word 版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快 业绩进步,以下为人教版九年级上册化学化学方程式汇总(word 版可编辑修改)的全部内容。
化 学 反 应化 学 方 程 式1 磷在空气中燃烧 4 P + 5 O2 点燃 2 P 2O 52 硫在空气中燃烧 S + O 2 点燃 SO 23 碳在氧气中燃烧 C + O 2 点燃 CO 24 铁在氧气中燃烧 3 Fe + 2 O 2 点燃 Fe 3O 45 镁在空气中燃烧 2 Mg + O 2 点燃 2 MgO6 氯酸钾分解制氧气2 KClO3 MnO 2 2 KCl + 3 O 2↑△7 实验室用高锰酸钾制氧气2KMnO 4 △ K 2MnO 4+ MnO 2+ O 2↑8 过氧化氢分解制氧气2 H 2O 2 MnO 2 2 H 2O + O 2↑ 9水通电分解 2 H 2O 通电2 H 2↑+ O 2↑10 氢气在氧气中燃烧 2 H 2 + O 2点燃2 H 2O 11 氧化汞受热分解2 HgO △ 2 Hg + O 2↑2Mg +O2点燃 2MgO 2Mg +O2== 2MgO4Al +3O 2 点燃2Al 2O 3 4Al +3O 2 == 2Al 2O 33Fe +2 O 2点燃Fe 3O 4 2Cu + O 2 △2CuOH 2SO 4 + Mg == MgSO 4 + H 2↑2HCl + Mg == MgCl 2+ H 2↑3H 2SO 4 + 2Al == Al 2(SO 4)3 + 3H 2↑ 6HCl + 2Al == 2AlCl 3+ 3H 2↑H 2SO 4 +Zn == ZnSO 4 + H 2↑(实验室制备H 2)2HCl +Zn == ZnCl 2 + H 2↑ H 2SO 4 + Fe == FeSO 4 + H 2↑ 2HCl + Fe == FeCl 2+ H 2↑Fe 2O 3 +3H 2SO 4 == Fe 2(SO 4)3 + 3H 2O Fe 2O 3 +6HCl == 2FeCl 3 + 3H 2O CuO + 2HCl == CuCl 2 + 2H 2O CuO +H 2SO 4 == CuSO 4 + H 2OHCl + NaOH == NaCl + H 2O 2HCl + Ca (OH)2 == CaCl 2 + 2H 2O H 2SO 4 + 2NaOH == Na 2SO 4 + 2H 2O H 2SO 4 + BaCl 2 == BaSO 4 ↓+ 2HCl 2HCl + Na 2CO 3 == 2NaCl + CO 2↑+ H 2O2HCl + CaCO 3 == CO 2↑+ CaCl 2 + H 2O(实验室制备CO 2 )HCl + NaHCO 3 == NaCl +CO 2↑+H 2O (治疗胃酸过多) HCl + AgNO 3 == HNO 3 + AgCl ↓NaOH 和非金属氧化物的反应: 2NaOH + CO 2 == Na 2CO 3 + H 2O 2NaOH + SO 2 == Na 2SO 3 + H 2O 2NaOH + SO 3 == Na 2SO 4 + H 2O Ca(OH)2 + CO 2 == CaCO 3↓+ H 2O (澄清石灰水变浑浊的原因) Ca (OH )2+Na 2CO 3 ==CaCO 3↓+2NaOH (工业制烧碱) 2NaOH + CuSO 4 == Cu(OH)2↓ + Na 2SO 4 3NaOH + FeCl 3 == Fe (OH )3↓ + 3NaCl Ca(OH)2 + Na 2CO 3 == CaCO 3↓ + 2NaOHCa (OH )2 + CuSO 4 == CaSO 4 + Cu (OH)2↓(配制波尔多液时发生的反应) NaCl + AgNO 3 == AgCl ↓+ NaNO 3 Na 2SO 4 + BaCl 2 == BaSO 4 ↓+ 2NaClC 6H 12O 6 + 6O 2 6CO 2 + 6H 2O(呼吸作用)酶九年级化学方程式汇总。
人教版九年级上册12单元化学反应文字表达式及现象

1-2单元化学反响文字表达式及现象1、镁在空气中燃烧:文字表达式 :镁 + 氧气 氧化镁Mg O 2 MgO现象:〔1〕发出耀眼的白光〔2〕放出热量〔3〕生成白色粉末2、铁在氧气中燃烧:文字表达式 :铁 + 氧气 四氧化三铁Fe O 2 Fe 3O 4现象:〔1〕剧烈燃烧,火星四射〔2〕放出热量〔3〕生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:文字表达式 :铜 + 氧气 氧化铜Cu O 2 CuO现象:铜丝变黑。
4、铝在空气中燃烧:文字表达式 :铝 + 氧气 三氧化二铝〔氧化铝〕Al O 2 Al 2O 3现象:发出耀眼的白光,放热,有白色固体生成。
5、红〔白〕磷在空气中燃烧:文字表达式 :红磷 + 氧气 五氧化二磷P O 2 P 2O 5现象:〔1〕发出白光〔2〕放出热量〔3〕生成大量白烟。
6、硫粉在空气中燃烧:文字表达式 :硫 + 氧气 二氧化硫S O 2 SO 2现象:A 、在纯的氧气中发出亮堂的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B 、在空气中燃烧〔1〕发出淡蓝色火焰〔2〕放出热量〔3〕生成一种有刺激性气味的气体。
7、碳在氧气中充分燃烧:文字表达式 :碳 + 氧气 二氧化碳C O 2 CO 2现象:〔1〕发出白光〔2〕放出热量〔3〕澄清石灰水变浑浊8、蜡烛在空气中燃烧文字表达式 :石蜡 + 氧气 水 + 二氧化碳O 2 H 2O CO 2现象:在氧气中燃烧发出白光,在空气中燃烧发黄光,集气瓶的内壁有水珠出现,并生成能使澄清的石灰水变浑浊的气体。
9、实验室制氧气:① 过氧化氢 水 + 氧气H 2O 2 H 2O O 2② 高锰酸钾 锰酸钾 + 二氧化锰 + 氧气KMnO 4 K 2MnO 4 MnO 2 O 2③ 氯酸钾 氯化钾 + 氧气 点燃点燃加热加热点燃点燃点燃2MnO 加热−−−−→二氧化锰加热点燃KClO3KCl O2。
初三上册化学方程式

初三上册化学方程式初中化学上册化学方程式及现象石灰石(或大理石)与稀盐酸反应(实验室制co2):caco3 + 2hcl === cacl2 + h2o+ co2↑初中化学上册化学方程式及现象二氧化碳通过澄清石灰水(检验co2):ca(oh)2 + co2 =caco3↓+ h2o初中化学上册化学方程式及现象初中化学上册化学方程式及现象氯酸钾与二氧化锰的混合物共热:2kclo3初中化学上册化学方程式及现象2kcl + 3o2↑初中化学上册化学方程式及现象加热高锰酸钾:2kmno4初中化学上册化学方程式及现象k2mno4 + mno2 + o2↑一、燃烧反应1、木炭在氧气中燃烧:c + o2初中化学上册化学方程式及现象co2 (在氧气中:产生使石灰水变浑浊的无色气体)2、木炭在空气中不充分燃烧:2c + o2 初中化学上册化学方程式及现象2co3、一氧化碳在氧气中燃烧:2co + o2 初中化学上册化学方程式及现象2co2 (产生蓝色火焰)4、硫粉在氧气中燃烧: s + o2 初中化学上册化学方程式及现象 so2 (在空气中:呈淡蓝色火焰;在氧气中:呈明亮的.蓝紫色火焰,产生有刺激性气味的气体)5、磷在氧气中燃烧:4p + 5o2初中化学上册化学方程式及现象2p2o5 (产生浓厚的白烟)初中化学上册化学方程式及现象6、铁在氧气中燃烧:3fe + 2o2初中化学上册化学方程式及现象fe3o4 (剧烈燃烧,火星四射,生成黑色固体)7、镁在空气中燃烧:2mg + o2 初中化学上册化学方程式及现象 2mgo (发出耀眼的白光,生成白色固体)8、铜在空气中加热;2cu + o2 初中化学上册化学方程式及现象 2cuo (红色固体变为黑色固体)9、氢气在空气中燃烧:2h2 + o2初中化学上册化学方程式及现象2h2o (产生淡蓝色火焰,干冷烧杯壁有小水株。
或产生爆鸣声)10、甲烷在空气中燃烧:ch4 + 2o2初中化学上册化学方程式及现象co2 + 2h2o11、酒精在空气中燃烧:c2h5oh + 3o2初中化学上册化学方程式及现象2co2 + 3h2o二、制取气体1、实验室用过氧化氢与二氧化锰的混合物制氧气:2h2o2 初中化学上册化学方程式及现象2h2o+ o2↑2、石灰石(或大理石)与稀盐酸反应(实验室制co2):caco3 + 2hcl === cacl2 + h2o+ co2↑初中化学上册化学方程式及现象3、锌和稀硫酸反应(实验室制h2):zn + h2so4 = znso4 + h2↑4、锌和稀盐酸反应:zn + 2hcl = zncl2 + h2↑5、镁和稀盐酸反应:mg + 2hcl = mgcl2 + h2↑6、高温煅烧石灰石:caco3初中化学上册化学方程式及现象cao + co2↑(工业上制二氧化碳的方法)三、还原反应1、木炭还原氧化铜:c+2cuo初中化学上册化学方程式及现象2cu + co2↑(黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体)2、焦炭还原氧化铁:3c+ 2fe2o3 初中化学上册化学方程式及现象4fe +3co2↑3、一氧化碳还原氧化铜:co+cuo初中化学上册化学方程式及现象cu + co2(黑色固体变红色,产生使澄清石灰水变浑浊的气体)4、一氧化碳还原氧化铁:3co+ fe2o3初中化学上册化学方程式及现象2fe + 3co25、氢气还原氧化铜:h2 + cuo初中化学上册化学方程式及现象cu + h2o。
九年级上册化学文字表达式及化学方程式

九年级上册化学 文字表达式及化学方程式1. 红磷燃烧红磷+氧气→点燃五氧化二磷 4P+502=点燃2P 2O 5 2. 硫燃烧硫+氧气→点燃二氧化硫 S+O 2=点燃SO 2 3. 木炭燃烧木炭+氧气→点燃二氧化碳 C+O 2=点燃CO 2 4. 铁丝燃烧铁+氧气→点燃四氧化三铁 3Fe+2O 2=点燃Fe 3O 4 5. 高锰酸钾制氧气高锰酸钾→加热锰酸钾+二氧化锰+氧气2KMnO 4=△K 2MnO 4+MnO 2+O 2↑ 6. 过氧化氢制氧气过氧化氢→二氧化锰水+氧气 2H 2O 2=MnO22H 2O+O 2↑ 7. 氯酸钾制氧气氯酸钾→二氧化锰,加热氯化钾+氧气 2KClO 3=MnO2 △2KCl+3O 2↑8. 氢气燃烧氢气+氧气→点燃水 2H 2+O 2=点燃2H 2O 9. 水电解水→电解氧气+氢气 2H 2O =电解2H 2↑+O 2↑ 10.铁与硫酸铜反应铁+硫酸铜→铜+硫酸亚铁 Fe+CuSO 4=FeSO 4+Cu11. 镁燃烧 镁+氧气→点燃氧化镁 2Mg+O 2=点燃2MgO12. 煅烧石灰石石灰石→高温生石灰+二氧化碳 CaCO 3=高温CaO+CO 2↑ 13.碳燃烧不充分碳+氧气→点燃一氧化碳 2C+O 2=点燃2CO 14.木炭和氧化铜反应碳+氧化铜→高温铜+二氧化碳 C+2CuO =高温2Cu+CO 2↑ 15.木炭和氧化铁(三氧化二铁)的反应碳+氧化铁→高温铁+氧气 3C+2Fe 2O 3=高温4Fe+3CO 2↑ 16.木炭和二氧化碳反应碳+二氧化碳→高温一氧化碳 C+CO 2=高温2CO 17.大理石(石灰石)和稀盐酸制二氧化碳碳酸钙+稀盐酸=氯化钙+二氧化碳+水 CaCO 3+2HCl=CaCl 2+CO 2↑+H 2O 18.二氧化碳和氢氧化钙反应二氧化碳+氢氧化钙=碳酸钙+水 CO 2+Ca(OH)2=CaCO 3↓+H 2O 19.一氧化碳燃烧一氧化碳+氧气→点燃二氧化碳 2CO+O 2=点燃2CO 2 20.甲烷燃烧甲烷+氧气→点燃二氧化碳+水 CH 4+2O 2=点燃CO 2+2H 2O 21.酒精(乙醇)燃烧酒精+氧气→点燃二氧化碳+水 C 2H 5OH+3O 2=点燃2CO 2+3H 2O 22.锌与稀硫酸制氢气锌+稀硫酸→硫酸锌+氢气 Zn+H 2SO 4=ZnSO 4+H 2↑。
九年级化学上化学方程式完整版

九年级化学〔上〕有关的化学方程式一、氧气的性质:〔1〕单质与氧气的反应:〔化合反应〕1.镁在空气中焚烧:2Mg+O22MgO2.铁在氧气中焚烧:3Fe+2O2Fe3O43.铜在空气中受热:2Cu+O22CuO4.铝在空气中焚烧:4Al+3O22Al2O35.氢气中空气中焚烧:2H+O22H2O26.红磷在空气中焚烧:4P+5O22P2O57.硫粉在空气中焚烧:S+O2SO28.碳在氧气中充足焚烧:C+O2CO29.碳在氧气中不充足焚烧:2C+O22CO过关署名:时间。
〔2〕化合物与氧气的反应:10.一氧化碳在氧气中焚烧:2CO+O22CO211.甲烷在空气中焚烧:CH+2O2CO+2HO422 12.酒精在空气中焚烧:C2H5OH+3O22CO2+3H2O 〔3〕氧气的根源:13.氯酸钾受热分解2KClO32KCl+3O2↑14.加热高锰酸钾:2KMnO K2MnO+MnO+O2↑44215.过氧化氢在二氧化锰作催化剂条件下分解反应:2H 2O2 2H2O+O2↑过关署名:时间。
二、自然界中的水:16.电解水:2H2O 2H2↑+O2↑17.生石灰溶于水:CaO+H2O=Ca(OH)218.二氧化碳可溶于水: H2O+CO2=H2CO3三、质量守恒定律:19.镁在空气中焚烧:2Mg+O2 2MgO20.铁和硫酸铜溶液反应:Fe+CuSO4=FeSO421.氢气还原氧化铜:H2+CuO △Cu+H22. 镁还原氧化铜:Mg+CuO Cu+MgO +Cu 2O过关署名:时间。
四、碳和碳的氧化物:〔1〕碳的化学性质23. 碳在氧气中充足焚烧:C+O2CO224.木炭还原氧化铜:C+2CuO2Cu+CO2↑25.焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑〔2〕煤炉中发生的三个反应:〔几个化合反应〕26.煤炉的基层:C+O2CO227.煤炉的中层:CO2+C2CO28.煤炉的上部蓝色火焰的产生:2CO+O22CO〔3〕二氧化碳的制法与性质:29.大理石与稀盐酸反应:CaCO+2HCl=CaCl2+H2O+CO2↑330.碳酸不稳固而分H2CO=H2O+CO2↑331.二氧化碳可溶于水:H2O+CO2=H2CO332.高温煅烧石灰石〔工业制二氧化碳〕:CaCO3CaO+CO2↑33.石灰水与二氧化碳反应:Ca(OH)2+CO=CaCO↓+HO232〔4〕一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO Cu+CO235.一氧化碳的可燃性:2CO+O22CO过关署名:时间。
九上化学文字表达式及符号表达式

九上化学文字表达式及符号表达式九上化学文字表达式及符号表达式一、文字表达式1.1 化学方程式在化学学习中,我们经常会接触到化学方程式,它是一种用化学符号和化学公式表示化学反应的表达式。
化学方程式能够清晰地传达出反应物和生成物的种类和数量关系,为我们理解化学反应提供了重要的信息。
当我们要表示氧气和氢气生成水的化学反应时,可以用以下方程式来表示:2H2 + O2 → 2H2O。
1.2 化学式另外,在化学学习中,我们还需要学习化学式的表示方法。
化学式是用化学元素的符号和下标组成的表示化合物中各元素种类和相对数量关系的表达式。
水的化学式就是H2O,其中H代表氢元素,O代表氧元素,2和1分别代表氢和氧元素的原子数。
1.3 化学名词在化学学习中,我们还需要了解一些化学名词的文字表达方式。
酸、碱、盐等化学物质,它们都有各自的化学名词表示方法,我们需要通过学习和记忆这些名词的含义和表示方式来理解化学知识。
二、符号表达式2.1 元素符号元素符号是用来表示化学元素的一种简单符号,由拉丁字母或拉丁字母的组合构成,能够直观地表达出元素的种类。
氢元素的符号就是H,氧元素的符号就是O。
2.2 化合物符号化合物符号是用来表示化合物的一种符号,由元素符号组成,能够表达出化合物中各元素的种类和相对数量关系。
水的化合物符号就是H2O,其中2表示氢元素的原子数,O表示氧元素。
2.3 反应物和生成物的符号表示在化学方程式中,反应物和生成物都需要使用符号表示。
反应物的符号表示清晰地表达了反应物的种类和数量关系,而生成物的符号表示则表达了生成物的种类和数量关系。
通过符号表示,我们能够更直观地了解化学反应过程。
三、个人观点和理解在学习九上化学中的文字表达式及符号表达式时,我深刻地感受到了它们的重要性。
文字表达式和符号表达式能够直观地传达化学知识,帮助我们更好地理解和记忆化学概念。
通过学习这些表达方式,我对化学的学习有了更深入的理解,也更加有信心应对学习中的挑战。
九年级上册化学方程式大全
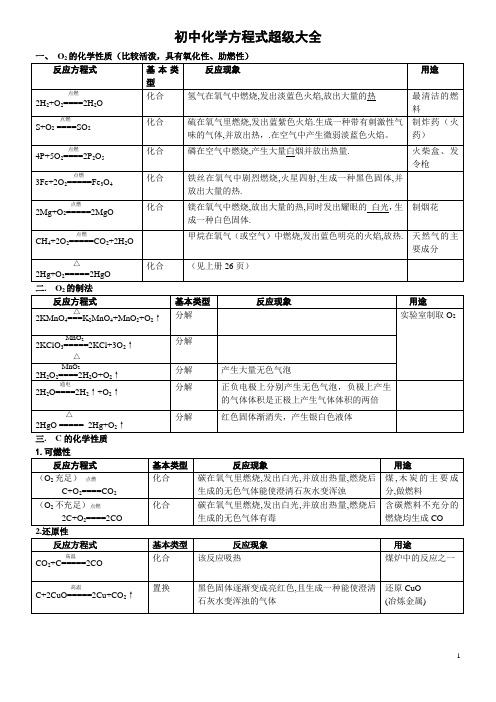
初中化学方程式超级大全一、O四. CO的化学性质1.可燃性反应方程式基本类型反应现象用途点燃2CO+O2=====2CO2化合一氧化碳在空气中燃烧,发出淡蓝色火焰,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊煤气主要成分,做燃料反应方程式基本类型反应现象用途△CuO+CO====Cu+CO2黑色的粉末逐渐变成红色的粉末,且生成一种使澄清石灰水变浑浊的无色气体还原CuO(冶炼铜)高温Fe2O3+3CO====2Fe+3CO2红色的粉末逐渐变成黑色的粉末,且生成一种使澄清石灰水变浑浊的无色气体还原Fe2O3(炼铁)高温Fe3O4+4CO====3Fe+4CO2还原Fe3O4(炼铁)对比:△H2+CuO====Cu+H2O置换黑色固体变红色,管壁有水珠精练Cu五.CO2的化学性质2反应方程式基本类型反应现象用途CO2+H2O==H2CO3化合紫色石蕊试液变成红色制碳酸饮料H2CO3===H2O+CO2↑分解产生气泡,红色石蕊试液变成紫色(H2CO3不稳定) 2.与碱的反应反应方程式类型反应现象用途Ca(OH)2+CO2===CaCO3↓+H2O 产生白色沉淀.(石灰水变浑浊) 用石灰浆粉刷墙壁;实验室检验CO22NaOH+CO2==Na2CO3+H2O 无明显现象工业上吸收废气反应方程式类型反应现象用途CaCO3+2HCl==CaCl2+H2O+CO2↑复分解产生无色气泡,大理石逐渐溶解实验室制取CO2,在大理石上"刻字" Na2CO3+2HCl==2NaCl+H2O+CO2↑复分解反应剧烈,产生大量气泡,白色固体溶解可治疗胃酸过多高温CaCO3====CaO+CO2↑分解工业上用石灰石制取生石灰、CO2。
九年级化学上册表达式

九年级化学上册表达式反应(化学变化)——化学符号表达式、文字表达式、现象1、石蜡燃烧文字表达式:石蜡+氧气→水+二氧化碳现象:石蜡融化,发光发热。
在干冷的小烧杯上方燃烧,烧杯内壁出现小水珠;在内壁涂有澄清石灰水的小烧杯上方燃烧,石灰水变浑浊。
2、光合作用文字表达式:二氧化碳+水→葡萄糖+氧气符号表达式:CO2 + H2O → C6H12O6 + O23、镁条燃烧文字表达式:镁+氧气→氧化镁符号表达式:Mg + O2 → MgO现象:发出耀眼的白光,产生大量的白烟,生成白色物质。
4、红磷燃烧文字表达式:磷+氧气→五氧化二磷符号表达式:P + O2 → P2O5现象:发光发热,产生大量白烟,放出热量。
5、碳的燃烧文字表达式:碳+氧气→二氧化碳符号表达式:C + O2 → CO2现象:发出白光,产生使澄清石灰水变浑浊的气体(在氧气中)。
6、硫的燃烧文字表达式:硫+氧气→二氧化硫符号表达式:S + O2 → SO2现象:发出微弱的淡蓝色火焰,产生刺激性气味气体(在空气中),发出明亮的蓝紫色火焰,产生刺激性气味气体(在氧气中)。
7、铁丝在氧气中燃烧文字表达式:铁+氧气→四氧化三铁符号表达式:Fe + O2 → Fe3O4现象:剧烈燃烧,火星四射,生成黑色物质,放出大量热。
8、氢气燃烧文字表达式:氢气+氧气→水符号表达式:H2 + O2 → H2O现象:发出淡蓝色火焰,将干冷的烧杯罩在火焰上方,烧杯内壁出现水雾。
9、加热高锰酸钾制氧气文字表达式:高锰酸钾→锰酸钾+二氧化锰+氧气符号表达式:KM nO4 → K2MnO4 + MnO2 + O2现象:产生一种能使带火星木条复燃的气体。
10、加热氯酸钾制氧气文字表达式:氯酸钾→氯化钾+氧气符号表达式:KClO3 → KCl + O2现象:产生一种能使带火星木条复燃的气体。
11、催化分解双氧水制氧气文字表达式:过氧化氢→水+氧气符号表达式:H2O2 → H2O + O2现象:产生大量气泡,该气体能使带火星的木条复燃。
初三上册化学方程式(K12教育文档)

初三上册化学方程式(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初三上册化学方程式(word 版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为初三上册化学方程式(word版可编辑修改)的全部内容。
上册化学方程式一.物质与氧气的反应:(1)单质与氧气的反应: 现象1. 镁在空气中燃烧:2Mg+O2点燃2MgO(发出耀眼白光、放热、生成白色粉末)2. 铁在氧气中燃烧:3Fe+2O2点燃Fe3O4(剧烈燃烧火星四射,放热、生成黑色固体)3. 铜在空气中受热:2Cu+O2△2CuO(红色固体变为黑色)4。
铝在空气中氧化:4Al+3O22Al2O35. 氢气中空气中燃烧:2H2+O2点燃2H2O6. 红磷在空气中燃烧:4P+5O2点燃2P2O5(放热、生成大量白烟)7。
硫粉在空气中燃烧:S+O2点燃SO2(硫在空气里燃烧发出微弱的淡蓝色火焰,在氧气中燃烧得更旺发出蓝紫色火焰,放热、生成有刺激性气味的气体)8。
碳在氧气中充分燃烧:C+O2点燃CO2(发出白光、放热、生成一种能使石灰水变浑浊的无色气体)9。
碳在氧气中不充分燃烧:2C+O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃2CO211. 甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12. 酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O二.实验室制取氧气、二氧化碳、氢气原理13。
加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑14. 加热氯酸钾(有少量的二氧化锰):2KClO3 MnO2 2KCl+3O2↑△15。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级上册化学 文字表达式及化学方程式
1. 红磷燃烧
红磷+氧气→点燃
五氧化二磷 4P+502=点燃
2P 2O 5 2. 硫燃烧
硫+氧气→点燃
二氧化硫 S+O 2=点燃
SO 2 3. 木炭燃烧
木炭+氧气→点燃
二氧化碳 C+O 2=点燃
CO 2 4. 铁丝燃烧
铁+氧气→点燃
四氧化三铁 3Fe+2O 2=点燃
Fe 3O 4 5. 高锰酸钾制氧气
高锰酸钾→加热
锰酸钾+二氧化锰+氧气2KMnO 4=△
K 2MnO 4+MnO 2+O 2↑ 6. 过氧化氢制氧气
过氧化氢→二氧化锰
水+氧气 2H 2O 2=MnO2
2H 2O+O 2↑ 7. 氯酸钾制氧气
氯酸钾→二氧化锰,加热
氯化钾+氧气 2KClO 3=MnO2 △
2KCl+3O 2↑
8. 氢气燃烧
氢气+氧气→点燃
水 2H 2+O 2=点燃
2H 2O 9. 水电解
水→电解
氧气+氢气 2H 2O =电解
2H 2↑+O 2↑ 10.
铁与硫酸铜反应
铁+硫酸铜→铜+硫酸亚铁 Fe+CuSO 4=FeSO 4+Cu
11. 镁燃烧 镁+氧气→点燃
氧化镁 2Mg+O 2=点燃
2MgO
12. 煅烧石灰石
石灰石→高温
生石灰+二氧化碳 CaCO 3=高温
CaO+CO 2↑ 13.
碳燃烧不充分
碳+氧气→点燃
一氧化碳 2C+O 2=点燃
2CO 14.
木炭和氧化铜反应
碳+氧化铜→高温
铜+二氧化碳 C+2CuO =高温
2Cu+CO 2↑ 15.
木炭和氧化铁(三氧化二铁)的反应
碳+氧化铁→高温
铁+氧气 3C+2Fe 2O 3=高温
4Fe+3CO 2↑ 16.
木炭和二氧化碳反应
碳+二氧化碳→高温
一氧化碳 C+CO 2=高温
2CO 17.
大理石(石灰石)和稀盐酸制二氧化碳
碳酸钙+稀盐酸=氯化钙+二氧化碳+水 CaCO 3+2HCl=CaCl 2+CO 2↑+H 2O 18.
二氧化碳和氢氧化钙反应
二氧化碳+氢氧化钙=碳酸钙+水 CO 2+Ca(OH)2=CaCO 3↓+H 2O 19.
一氧化碳燃烧
一氧化碳+氧气→点燃
二氧化碳 2CO+O 2=点燃
2CO 2 20.
甲烷燃烧
甲烷+氧气→点燃
二氧化碳+水 CH 4+2O 2=点燃
CO 2+2H 2O 21.
酒精(乙醇)燃烧
酒精+氧气→点燃
二氧化碳+水 C 2H 5OH+3O 2=点燃
2CO 2+3H 2O 22.
锌与稀硫酸制氢气
锌+稀硫酸→硫酸锌+氢气 Zn+H 2SO 4=ZnSO 4+H 2↑
Welcome !!! 欢迎您的下载,资料仅供参考!。
