锂钠钾铷铯钫
20个化学元素顺口溜

20个化学元素顺⼝溜
20个化学元素顺⼝溜:氢氦锂铍硼,碳氮氧氟氖,钠镁铝硅磷,硫氯氩钾钙。
记忆⼝诀:亲爱李⽪彭,坦荡养福来。
(氢氦锂铍硼,碳氮氧氟氖)那美⼥桂林,⽜⾁要加钙。
(钠镁铝硅磷,硫氯氩钾钙)
⾃我介绍版20个化学元素顺⼝溜
我是氢,我最轻,⽕箭靠我运卫星;
我是氦,我⽆赖,得失电⼦我最菜;
我是锂,密度低,遇⽔遇酸把泡起;
我是铍,耍赖⽪,虽是⾦属难电离;
我是硼,有点红,论起电⼦我很穷;
我是碳,反应慢,既能成链⼜成环;
我是氮,我阻燃,加氢可以合成氨;
我是氧,不⽤想,离开我就憋得慌;
我是氟,最恶毒,抢个电⼦就满⾜;
我是氖,也不赖,通电红光放出来;
我是钠,脾⽓⼤,遇酸遇⽔就⽕⼤;
我是镁,最爱美,摄影烟花放光辉;
我是铝,常温⾥,浓硫酸⾥把澡洗;
我是硅,⾊⿊灰,信息元件把我堆;
我是磷,害⼈精,剧毒列表有我名;
我是硫,来历久,沉淀⾦属最拿⼿;
我是氯,⾊黄绿,⾦属电⼦我抢去;
我是氩,活性差,霓虹紫光我来发;
我是钾,把⽕加,超氧化物来当家;
我是钙,⾝体爱,⾻头⽛齿我都在;
按族分的化学元素周期表⼝诀
氢锂钠钾铷铯钫——请李娜加⼊私访铍镁钙锶钡镭——媲美盖茨被雷
硼铝镓铟铊——碰⼥嫁⾳他
碳硅锗锡铅——探归者西迁
氮磷砷锑铋——蛋临⾝体闭
氧硫硒碲钋——养⽜西蹄扑
氟氯溴碘砹——⽗⼥绣点爱
氦氖氩氪氙氡——害耐亚克先动。
关于化学元素周期表完整带拼音

关于化学元素周期表完整带拼音化学元素周期表完整带拼音1氢(qīng)2氦(hài)3锂(lǐ)4铍(pí)5硼(péng)6碳(tàn)7氮(dàn)8氧(yǎng)9氟(fú)10氖(nǎi)11钠(nà)12镁(měi)13铝(lǚ)14硅(guī)15磷(lín)16硫(liú)17氯(lǜ)18氩(yà)19钾(jiǎ)20钙(gài)21钪(kàng)22钛(tài)23钒(fán)24铬(gè)25锰(měng)26铁(tiě)27钴(gǔ)28镍(niè)29铜(tóng)30锌(xīn)31镓(jiā)32锗(zhě)33砷(shēn)34硒(xī)35溴(xiù)36氪(kè)37铷(rú)38锶(sī)39钇(yǐ)40锆(gào)41铌(ní)42钼(mù)43锝(dé)44钌(liǎo)45铑(lǎo)46钯(bǎ)47银(yín)48镉(gé)49铟(yīn)50锡(xī)51锑(tī)52碲(dì)53碘(diǎn)54氙(xiān)55铯(sè)56钡(bèi)57镧(lán)58铈(shì)59镨(pǔ)60钕(nǚ)61钷(pǒ)62钐(shān)63铕(yǒu)64钆(gá)65铽(tè)66镝(dī)67钬(huǒ)68铒(ěr)69铥(diū)70镱(yì)71镥(lǔ)72铪(hā)73钽(tǎn)74钨(wū)75铼(lái)76锇(é)77铱(yī)78铂(bó)79金(jīn)80汞(gǒng)81铊(tā)82铅(qiān)83铋(bì)84钋(pō)85砹(ài)86氡(dōng)87钫(fāng)88镭(léi)89锕(ā)90钍(tǔ)91镤(pú)92铀(yóu)93镎(ná)94钚(bù)95镅(méi)96锔(jú)97锫(péi)98锎(kāi)99锿(āi)100镄(fèi)101钔(mén)102锘(nuò)103铹(láo)104钅卢(lú)105钅杜(dù)106钅喜(xǐ)107钅波(bō)108钅黑(hēi)109钅麦(mài)110钅达(dá)111钅仑(lún)元素周期表顺口溜我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜;我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离;我是硼,黑银灰,论起电子我很穷;我是碳,反应慢,既能成链又成环;我是氮,我阻燃,加氢可以合成氨;我是氧,不用想,离开我就憋得慌;我是氟,最恶毒,抢个电子就满足;我是氖,也不赖,通电红光放出来;我是钠,脾气大,遇酸遇水就火大;我是镁,最爱美,摄影烟花放光辉;我是铝,常温里,浓硫酸里把澡洗;我是硅,色黑灰,信息元件把我堆;我是磷,害人精,剧毒列表有我名;我是硫,来历久,沉淀金属最拿手;我是氯,色黄绿,金属电子我抢去;我是氩,活性差,霓虹紫光我来发;我是钾,把火加,超氧化物来当家;我是钙,身体爱,骨头牙齿我都在。
专题--金属及其化合物

一、第IA族(碱金属)(一)、包含的金属元素:(氢)锂钠钾铷铯(钫*)(铷和铯在高中阶段了解其危险性即可)(二)、物理性质:质软,具有金属光泽,可燃点低,锂密度小于煤油甚至小于液体石蜡,钠、钾密度比煤油大,比水小,因此锂封存于固体石蜡中,钠钾保存于煤油中,铷铯因过于活泼需要封存在在充满惰性气体的玻璃安瓿中。
(三)、化学性质:1、与氧气反应:①对于锂,R+O2→R2O(无论点燃还是在空气中均只能生成氧化锂)②对于钠,R+O2→R2O(空气中) R+O2→R2O2(点燃)③对于钾,R+O2→R2O(空气中) R+O2→R2O2(氧气不充足时点燃) R+O2→RO2(氧气充足时)因此,我们认为,钾在点燃时的产物为混合物④对于铷和铯,在空气中就可以燃烧,生成复杂氧化物,高中范围内不做过多了解2、与酸反应:R+H+→R++H2(碱金属先与水解氢离子较多的酸反应,然后才与水反应)3、与水反应: R+H2O→ROH+H2①锂与水反应现象:短暂的浮熔游响(因生成了溶解度较小的LiOH,附在锂的表面,影响了反应的继续进行,反应速率越来越慢,直至完全停止)②钠和钾常温反应现象:浮熔游响红,密度小于水,漂浮于水面,,迅速“熔”成小球(实际上是与水反应放热引起的、金属与水发生反应质量体积变小的共同作用,讲授时认为是反应放热),由于生成了氢气,小球四处游动,并发出呲呲的响声,在反应后的溶液里加入酚酞,发现溶液变为粉红色或红色。
③铷铯与水反应的现象:放入水中即发生爆炸反应,十分危险。
4、与有机物的反应:R+M-OH→M-OR+H2(反应不如与水反应剧烈,但仍可以看到低配版的浮熔游响红)5、与卤素反应:R+Cl2→RCl(现象:冒白烟)6、与硫反应:R+S→R2S(爆炸式反应,危险)7、锂与氮反应:Li+N2→Li3N(知道其为一种优良催化剂即可,高中范围内不需要掌握)8、钠与氢气反应:Na+H2→NaH(高温条件)(四)、常见化合物及其化学性质1、氢氧化钠(烧碱,有强烈的腐蚀性)可与酸及酸性气体反应,也可以与两性氧化物发生反应OH-+H+→H2O OH-+CO2→CO3-+H2O(过量CO2:OH-+CO2→HCO3-)OH-+Al→AlO2-+H2↑2、碳酸钠(苏打,纯碱)可与酸反应,可与酸性气体反应,可在高温下分解为氧化钠和二氧化碳CO3-+H+→H2O+CO2 CO3-+CO2+H2O→HCO3-3、碳酸氢钠(小苏打)可与酸反应可加热分解HCO3-+H+→H2O+CO2 NaHCO3—△→Na2CO3+H2O+CO2↑4、过氧化钠(优良制氧物质,具有强氧化性,可用作漂白剂)可与酸反应(注意反应顺序为先水后酸!),可与水反应可与湿润的二氧化碳反应(与干燥的二氧化碳不反应)可与二氧化硫反应可与三氧化硫反应可以与钠发生归中反应可吸收氮氧化合物Na2O2+H2O→NaOH+O2↑Na2O2+CO2→Na2CO3+O2↑Na2O2+SO2→Na2SO4 Na2O2+SO3→Na2SO4+O2Na2O2+Na→Na2O Na2O2+NO→NaNO2 Na2O2+2NO2= 2NaNO35、氢化钠(强碱性物质,极度危险品)NaH+O2→NaOH(潮湿的空气中极易自燃) 不溶于有机溶剂,溶于熔融金属钠中,是有机实验中用途广泛的强碱。
元素周期表记忆口诀及规律

元素周期表口诀A、按周期分:第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动元素周期表规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
化学元素周期表口诀

化学元素周期表口诀口诀A、按周期分:第一周期:氢氦----侵害第二周期:锂铍硼碳氮氧氟氖----鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩----那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰----嫁改康太反革命铁钻镍铜锌镓错----铁姑捏痛新嫁者砷硒溴氟----生气休克第五周期:铷锶钇锆铌----如此一告你钼锝钉一不得了铑钯银镉铟锡锑----老把银哥印西堤碲碘氙----地点仙第六周期:铯钡镧铪一(彩)色贝(壳)蓝(色)河钽钨铼锇----但(见)乌(鸦)(引)来鹅铱铂金汞砣铅----一白巾供它牵铋钋砹氡----必不爱冬(天)第七周期:钫镭锕一很简单了〜就是一防雷啊!B、按族分: 氢锂钠钾铷铯钫一一请李娜加入私访铍镁钙锶钡镭媲美盖茨被雷硼铝镓铟铊----- 碰女嫁音他碳硅错锡铅探归者西迁氮磷砷锑铋一一蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱氦氖氩氟氙氡----- 害耐亚克先动规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2 )同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1 )除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1 (氟无正价,氧无+6价,除外);(2 )同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1 )同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2 )同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性(1 )同一周期的元素从左到右金属性递减,非金属性递增;(2 )同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
化学元素周期表口诀

化学元素周期表口诀化学元素周期表口诀2011-04-20 18:20:39A、按周期分:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老把银哥印西堤碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 很简单了~就是---- 防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动C、全部青害李碧朋,探丹阳付奶。
(氢氦锂铍硼,碳氮氧氟氖)那美女桂林,流露押嫁该。
(钠镁铝硅磷,硫氯氩钾钙)抗台反革命,提供难题新。
(钪钛钒铬锰,铁钴镍铜锌)假者生喜羞,可入肆意搞。
(镓锗砷硒溴,氪铷锶钇锆)你母得了痨,八音阁隐息。
(铌钼锝钌铑,钯银镉铟锡)替弟点仙色,贝兰是普女。
(锑碲碘氙铯,钡镧铈铺钕)破杉诱扎特,弟火而丢意。
(钷钐铕钆铽,镝钬铒铥镱)虏获贪污赖,我一并进攻。
(镥铪钽钨铼,锇铱铂金汞)他钱必不安,东方雷阿土。
(铊铅铋钚砹,氡钫镭锕钍)普诱那不美,惧怕可爱肥。
(镤铀镎钚镅,锔锫锎锿镄)们若老,炉肚喜波黑,卖Uun Uuu Uub!规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
化学元素周期表歌词及口诀速记

化学元素周期表歌词及口诀速记
你的元素周期表还记不住吗?学会了化学元素周期表之歌,元素周期表马上就能记住了,而且有旋律地唱出来还不容易忘记。
元素周期表之歌歌词
说一个,道一个,是想起了哪个说哪个,
哪个说好都不错,说说咱的化学课。
化学要想学得好,先背元素周期表。
背好表格解困扰,中考高考没烦恼。
氢锂钠钾铷铯钫,性质我来讲一讲。
第一主族先登场,性质活泼难阻挡。
氢质子孤苦伶仃,没有中子作哨兵。
核外电子是精英,经常出门去反应。
然后再来说说锂,锂的优点无人比。
电池材料难枚举,密度很小令人喜。
然后就来谈谈钠,投到水里真可怕。
密度刚比煤油大,点着就是过氧化。
钾是钠的老大哥,金属性要强的多。
铷铯钫却开口说,咱仨才是最活泼。
第二主族都有谁,铍镁钙锶钡和镭。
也算活泼的范围,金属性质永相随。
首当其冲就是铍,铍的性质多传奇。
绿柱石里得分离,铍有两性莫怀疑。
化学元素周期表读音及元素化学符号表示

化学元素周期表读音及元素化学符号表示化学元素周期表读音及元素化学符号表示元素是原子的电子数目发生量变而导致质变的结果,那你知道化学元素周期表里的各元素的发音吗,对比下面的内容,看看自己的发音准不精确。
以下是关于化学元素周期表读音及元素化学符号表示的相关内容,供大家参考!化学元素周期表读音及元素化学符号表示01号元素:氢[化学符号]H,读qīng第02号元素:氦[化学符号]He,读hài第03号元素:锂[化学符号]Li,读lǐ第04号元素:铍[化学符号]Be,读pí第05号元素:硼[化学符号]B,读péng第06号元素:碳[化学符号]C,读tàn第07号元素:氮[化学符号]N,读dàn第08号元素:氧[化学符号]O,读yǎng第09号元素:氟[化学符号]F,读fú第10号元素:氖[化学符号]Ne,读nǎi第11号元素:钠[化学符号]Na,读nà第1页/共13页第12号元素:镁[化学符号]Mg,读měi 第13号元素:铝[化学符号]Al,读lǚ第14号元素:硅[化学符号]Si,读guī第15号元素:磷[化学符号]P,读lín第16号元素:硫[化学符号]S,读liú第17号元素:氯[化学符号]Cl,读lǜ第18号元素:氩[化学符号]Ar,A,读yà 第19号元素:钾[化学符号]K,读jiǎ第20号元素:钙[化学符号]Ca,读gài第21号元素:钪[化学符号]Sc,读kàng 第22号元素:钛[化学符号]Ti,读tài第23号元素:钒[化学符号]V,读fán第24号元素:铬[化学符号]Cr,读gè第25号元素:锰[化学符号]Mn,读měng 第26号元素:铁[化学符号]Fe,读tiě第27号元素:钴[化学符号]Co,读gǔ第28号元素:镍[化学符号]Ni,读niè第2页/共13页第29号元素:铜[化学符号]Cu,读tóng 第30号元素:锌[化学符号]Zn,读xīn 第31号元素:镓[化学符号]Ga,读jiā 第32号元素:锗[化学符号]Ge,读zhě 第33号元素:砷[化学符号]As,读shēn 第34号元素:硒[化学符号]Se,读xī 第35号元素:溴[化学符号]Br,读xiù 第36号元素:氪[化学符号]Kr,读kè 第37号元素:铷[化学符号]Rb,读rú 第38号元素:锶[化学符号]Sr,读sī第39号元素:钇[化学符号]Y,读yǐ第40号元素:锆[化学符号]Zr,读gào 第41号元素:铌[化学符号]Nb,读ní 第42号元素:钼[化学符号]Mo,读mù 第43号元素:碍[化学符号]Tc,读dé 第44号元素:钌[化学符号]Ru,读liǎo 第45号元素:铑[化学符号]Rh,读lǎo第3页/共13页第46号元素:钯[化学符号]Pd,读bǎ 第47号元素:银[化学符号]Ag,读yín 第48号元素:镉[化学符号]Cd,读gé 第49号元素:铟[化学符号]In,读yīn 第50号元素:锡[化学符号]Sn,读xī第51号元素:锑[化学符号]Sb,读tī第52号元素:碲[化学符号]Te,读dì第53号元素:碘[化学符号]I,读diǎn 第54号元素:氙[化学符号]Xe,读xiān 第55号元素:铯[化学符号]Cs,读sè第56号元素:钡[化学符号]Ba,读bèi 第57号元素:镧[化学符号]La,读lán 第58号元素:铈[化学符号]Ce,读shì 第59号元素:镨[化学符号]Pr,读pǔ第60号元素:钕[化学符号]Nd,读nǚ 第61号元素:钷[化学符号]Pm,读pǒ 第62号元素:钐[化学符号]Sm,读shān第4页/共13页第63号元素:铕[化学符号]Eu,读yǒu 第64号元素:钆[化学符号]Gd,读gá 第65号元素:铽[化学符号]Tb,读tè 第66号元素:镝[化学符号]Dy,读dī 第67号元素:钬[化学符号]Ho,读huǒ 第68号元素:铒[化学符号]Er,读ěr 第69号元素:铥[化学符号]Tm,读diū 第70号元素:镱[化学符号]Yb,读yì 第71号元素:镥[化学符号]Lu,读lǔ 第72号元素:铪[化学符号]Hf,读hā 第73号元素:钽[化学符号]Ta,读tǎn 第74号元素:钨[化学符号]W,读wū 第75号元素:铼[化学符号]Re,读lái 第76号元素:锇[化学符号]Os,读é 第77号元素:铱[化学符号]Ir,读yī第78号元素:铂[化学符号]Pt,读bó 第79号元素:金[化学符号]Au,读jīn第5页/共13页第80号元素:汞[化学符号]Hg,读gǒng 第81号元素:铊[化学符号]Tl,读tā第82号元素:铅[化学符号]Pb,读qiān 第83号元素:铋[化学符号]Bi,读bì第84号元素:钋[化学符号]Po,读pō 第85号元素:砹[化学符号]At,读ài第86号元素:氡[化学符号]Rn,读dōng 第87号元素:钫[化学符号]Fr,读fāng 第88号元素:镭[化学符号]Ra,读léi 第89号元素:锕[化学符号]Ac,读ā第90号元素:钍[化学符号]Th,读tǔ第91号元素:镤[化学符号]Pa,读pú 第92号元素:铀[化学符号]U,读yóu 第93号元素:镎[化学符号]Np,读ná 第94号元素:钚[化学符号]Pu,读(bù 第95号元素:镅[化学符号]Am,读méi 第96号元素:锔[化学符号]Cm,读jū第6页/共13页第97号元素:锫[化学符号]Bk,读péi第98号元素:锎[化学符号]Cf,读kāi第99号元素:锿[化学符号]Es,读āi第100号元素:镄[化学符号]Fm,读fèi第101号元素:钔[化学符号]Md,读mén 第102号元素:锘[化学符号]No,读nuò 第103号元素:铹[化学符号]Lw,读láo 第104号元素:鐪[化学符号]Rf,读第105号元素:钅杜[化学符号]Db,读dù 第106号元素:钅喜[化学符号]Sg,读xǐ 第107号元素:钅波[化学符号]Bh,读bō 第108号元素:钅黑[化学符号]Hs,读hēi 第109号元素:钅麦[化学符号]Mt,读mài 第110号元素:鐽[化学符号]Ds,读dá第111号元素:钅仑[化学符号]Rg,读lún 第112号元素:uub(112)第113号元素:uut(113)第7页/共13页第114号元素:uuq(114)第115号元素:uup(115)第116号元素:uuh(116)化学元素周期表顺口溜巧记我是氢,我最轻,火箭靠我运卫星; 我是氦,我无赖,得失电子我最菜; 我是铍,耍赖皮,虽是金属难电离; 我是硼,有点红,论起电子我很穷; 我是碳,反应慢,既能成链又成环; 我是氮,我阻燃,加氢可以合成氨; 我是氧,不用想,离开我就憋得慌; 我是氟,最恶毒,抢个电子就满意; 我是氖,也不赖,通电红光放出来; 我是钠,脾气大,遇酸遇水就火大; 我是镁,最爱美,摄影烟花放光辉; 我是铝,常温里,浓硫酸里把澡洗; 我是硅,色黑灰,信息元件把我堆;第8页/共13页我是磷,害人精,剧毒列表有我名; 我是硫,来历久,沉淀金属最拿手; 我是氯,色黄绿,金属电子我抢去; 我是氩,活性差,霓虹紫光我来发; 我是钾,把火加,超氧化物来当家; 我是钙,身体爱,骨头牙齿我都在; 我是钛,过渡来,航天飞机我来盖; 我是铬,正六铬,酒精过来变绿色; 我是锰,价态多,七氧化物爆炸猛; 我是铁,用途广,不锈钢喊我叫爷; 我是铜,色紫红,投入硝酸气棕红; 我是砷,颜色深,三价元素夺你魂; 我是溴,挥发臭,液态非金我来秀; 我是铷,碱金属,沾水烟花钾不如; 我是碘,升华烟,遇到淀粉蓝点点; 我是铯,金黄色,入水爆炸容器破; 我是钨,高温度,其他金属早呜呼;第9页/共13页我是金,很稳定,扔进王水影无形;我是汞,有剧毒,液态金属我为独;我是铀,浓缩后,造原子弹我最牛;我是镓,易溶化,沸点很高难蒸发;我是铟,软如金,稍微放射宜当心;我是铊,能脱发,投毒出名看清华;我是锗,可晶格,红外窗口能当壳;我是硒,补人体,口服液里有玄机;我是铅,能储电,子弹头里也消失。
化学元素周期表背诵口诀

化学元素周期表背诵口诀化学元素周期表背诵口诀化学元素周期表背诵口诀一第一周期:氢、氦----侵害第二周期:锂、铍、硼、碳、氮、氧、氟、氖----鲤皮捧碳、蛋养福奶第三周期:钠、镁、铝、硅、磷、硫、氯、氩----那美女桂林留绿牙(那美女鬼、流露绿牙)第四周期:钾、钙、钪、钛、钒、铬、锰----嫁改康太反革命铁、钴、镍、铜、锌、镓、锗----铁姑捏痛新嫁者砷、硒、溴、氪----生气、休克第五周期:铷、锶、钇、锆、铌----如此一告你钼、锝、钌----不得了铑、钯、银、镉、铟、锡、锑----老把银哥印西堤碲、碘、氙、----、地点仙第六周期:铯、钡、镧、铪----(彩)色贝(壳)蓝(色)河钽、钨、铼、锇----但(见)乌(鸦)(引)来鹅铱、铂、金、汞、砣、铅----一白巾、供它牵铋、钋、砹、氡----必不爱冬(天)第七周期:钫、镭、锕----很简单了~就是----防雷啊!化学元素周期表背诵口诀二氢锂钠钾铷铯钫,请李娜加入私访(李娜什么时候当皇(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物的水化物酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
化学元素周期表的记忆方法 巧记元素周期表的顺口溜

化学元素周期表的记忆方法巧记元素周期表的顺口溜化学元素周期表的记忆方法巧记元素周期表的顺口溜很多人想知道怎么才能快速记忆化学元素周期表,在记忆化学元素上有哪些比较好的记忆方法呢?下面为大家介绍一下!快速记忆化学元素周期口诀方法谐音记忆周期表的具体方法如下:一、按周期记忆第一周期:氢氦。
谐音:轻嗨!它告诉我们个喜讯背周期表不难,轻而易举。
第二周期:锂铍硼炭,氮氧氟氖。
谐音:狸皮捧炭,蛋养弗奶。
意思是用狐狸猎皮捧煤炭,凡是从蛋里孵出来的都不吃奶。
第三周期:钠镁铝硅,磷硫氯氩。
谐音:拉美旅归,林柳绿啊!意思是一个人从拉丁美洲旅行归来,看到路旁柳树成林,绿得可爱,便不由感叹道:林柳绿啊!第四周期:钾钙钪钛钒铬猛,铁钴镍铜锌镓储,砷硒溴氪。
谐音:贾盖抗袋烦落猛,铁箍裂桶新家者,身洗臭壳。
意思是:一名叫贾盖的人,扛袋子特别累,心里烦躁,把袋子往地下摔(落猛);铁箍的裂桶是新搬来的那家人的;搬家弄得浑身很脏,必须洗个澡,把身上的臭壳去掉。
第五周期:铷锶钇锆铌钼锝,钌铑钯银镉铟锡,锑碲碘氙。
谐音:如思已告尼目的,钌铐把人隔音息,涕地点三。
意思是:如果让你思考一个问题,却又把答案告诉你了,那就没有什么目的了(有的方言中尼是没有的意思)。
前些年(十年动乱中)知识分子受迫害,用钌铐把人铐起来,和外界隔断了音息,他心里难过,哭了,涕泪掉到地下三点。
第六周期:铯钡镧铪钽钨铼,锇铱铂金汞铊铅,铋钋砹氡,谐音:塞被拦河旦勿来,俄依铂金供他钱,必破挨轰。
意思是:要用塞棉被的办法把河流拦起来,这种蠢事旦勿来(不要去干)。
俄国每年在国际市场上抛售大量铂金,想依靠铂金供他钱用,这样下去必定破产,俄国的当权者必定被国内人民反对,要挨轰。
第一周期还有15个镧系元素:镧铈错钕钷钐铕,钆铽镝钬铒铥镱镥。
谐音:南市普女叵煞有,札特敌火耳丢一了。
意思是:南市场上有一位普通的女人很富有。
有个名叫札特的愣家伙玩火打仗(敌火),耳朵被烧,丢掉一个了。
化学元素周期表口诀

化学元素周期表口诀口诀A、按周期分:第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
化学主族元素背诵口诀

化学主族元素背诵口诀
主族元素记忆口诀是:氢锂钠钾铷铯钫、铍镁钙锶钡镭、硼铝镓铟铊、碳硅锗锡铅、氮磷砷锑铋、氧硫硒碲钋、氟氯溴碘砹、氦氖氩氪氙氡。
化学主族元素口诀:
第一主族:氢锂钠钾铷铯钫——请李娜加入私访
第二主族:铍镁钙锶钡镭——媲美盖茨被雷
第三主族:硼铝镓铟铊——碰女嫁音他
第四主族:碳硅锗锡铅——探归者西迁
第五主族:氮磷砷锑铋——蛋临身体闭
第六主族:氧硫硒碲钋——养牛西蹄扑
第七主族:氟氯溴碘砹——父女绣点爱
第八主族:氦氖氩容氪氙氡——害耐亚克先动化学元素周期表顺口溜:
我是氢,我最轻,火箭靠我运卫星;我是氦,
我无赖,得失电子我最菜;
我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离;
我是硼,有点红,论起电子我很穷;我是碳,反应慢,既能成链又成环;
我是氮,我阻燃,加氢可以合成氨;我是氧,不用想,离开我就憋得慌;
我是氟,最恶毒,抢个电子就满足;我是氖,也不赖,通电红光放出来;
我是钠,脾气大,遇酸遇水就火大;我是镁,最爱美,摄影烟花放光辉;
我是铝,常温里,浓硫酸里把澡洗;我是硅,色黑灰,信息元件把我堆;
我是磷,害人精,剧毒列表有我名;我是硫,来历久,沉淀金属最拿手;
我是氯,色黄绿,金属电子我抢去;我是氩,活性差,霓虹紫光我来发;
我是钾,把火加,超氧化物来当家;我是钙,身体爱,骨头牙齿我都在。
元素周期表顺口溜

氢qīng 氦hài锂lǐ 铍pí硼péng 碳tàn 氮dàn 氧yǎng 氟fú氖nǎi钠nà镁měi 铝lǚ 硅guī 磷lín 硫liú氯lǜ 氩yà钾jiǎ 钙gài 钪kàng 钛tài 钒fán 铬gè锰měng 铁tiě 钴gǔ 镍niè铜tóng 锌xīn 镓jiā 锗zhě 砷shēn 硒xī 溴xiù氪kè铷rú锶sī 钇yǐ 锆gào 铌ní钼mù锝dé钌liǎo 铑lǎo 钯pá银yín 镉gé铟yīn 锡xī 锑tī 碲dì碘diǎn 氙xiān铯sè钡bèi 镧lán 铪hā 钽tǎn 钨wū 铼lái 锇é铱yī 铂bó金jīn 汞gǒng 铊tā 铅qiān 铋bì钋pō 砹ài 氡dōng钫fāng 镭léi 锕ā 钅卢lú dù xǐ bō hēi mài 钅达dá钅仑lún镧lán 铈shì镨pǔ 钕nǚ 钷pǒ 钐shān 铕yǒu 钆gá铽tè镝dí钬huǒ 铒ěr 铥diū 镱yì镥lǔ锕ā 钍tǔ 镤pú铀yóu 镎ná钚bù镅méi 锔jū 锫péi 锎kāi 锿āi 镄fèi 钔mén 锘nuò铹láo 附化学元素周期表口诀在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙哇,太恐怖了吧,后来只能嫁给了一个叫康太的反革命;刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了;这下不得了,娘家要上告了;铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方;这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊;看完了吗现在我们把这个故事浓缩一下,再用6分钟时间,把它背下来;侵害鲤皮捧碳蛋养福奶那美女桂林留绿牙嫁给康太反革命铁姑捏痛新嫁者生气休克如此一告你不得了老爸银哥印西提地点仙彩色贝壳蓝色河但见乌鸦引来鹅一白巾供它牵必不爱冬天防雷啊好了,现在共用去8分钟时间,你已经把背下来了,不信那你再用余下的2分钟,对照一下:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙第六周期:铯钡镧铪----彩色贝壳蓝色河钽钨铼锇---- 但见乌鸦引来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬天第七周期:钫镭锕---- 防雷啊唉,没办法,这么难记的东东,又必须要背,就只能这样了;以上是横着按周期背;下面是竖着按族背:氢锂钠钾铷铯钫请李娜加入私访李娜什么时候当皇上啦铍镁钙锶钡镭媲美盖茨被累呵想和比尔.盖茨媲美,小心累着硼铝镓铟铊碰女嫁音他看来新郎新娘都改名了碳硅锗锡铅探归者西迁氮磷砷锑铋蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱父女情深啊氦氖氩氪氙氡害耐亚克先动。
锂钠钾铷铯钫
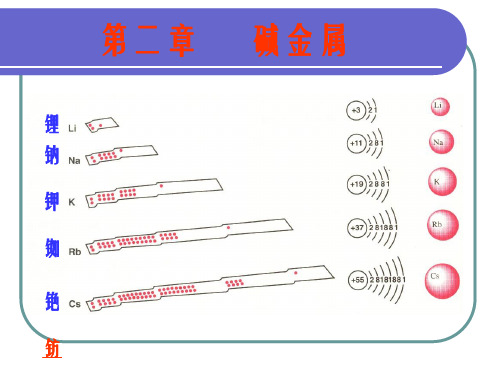
锂 钠 钾 铷 铯 钫
第一节 钠
一、钠的物理性质
质:软,可以用刀切割; 色泽:银白色,有金属光泽; 密度:0.97g/cm3,密度比水小; 熔沸点:熔点97.81℃,沸点882.9℃; 可导性:钠是热和电的良导体。
二、钠的化学性质
钠原子最外电子层上只有1个电子,在 化学反应中该电子很容易失去,因此,钠的 化学性质非常活泼,能与多种非金属及水反 应。 1、钠与非金属的反应 [实验2-2] 观察用刀切开的钠的表面所发生的变
试液,然后把一小块钠投入小烧杯。观察反 应的现象和溶液颜色的变化。
二、钠的化学性质
[实验现象]
现象
浮在水面
熔成小球 四处游动
溶液变红
原因
密度比水小 熔点低 生成气体推动小球 生成物质成碱性二ຫໍສະໝຸດ 钠的化学性质钠与水反应原理
2Na 2H2O 2NaOH H2
钠与水反应实质 钠与水电离所产生的氢离子反应,生成氢气。
实验与讨论
2、钠与盐的反应 [补充实验3] 把一块金属钠投入到硫酸铜溶液中,观察发 生的现象,写出反应的离子方程式。
实验与讨论
[实验现象]
浮在水面、熔成小球、四处游动、有蓝色絮状沉 淀产生。
2Na 2H2O 2Na 2OH H2
2OH Cu 2 Cu(OH )2
钠发出的黄色的光穿透能力强。也可用于暗室 内,黄光不会使相纸曝光。
六、作业
P31 三、四、五写在作业本上,其它写在书上。
化。把一小块钠放在石棉网上加热,观察现象。
二、钠的化学性质
[实验现象] 1、新切开的钠的光亮的表面很快就变暗了。
4Na O2 2Na2O
2与、充钠足与的氧氧气气反剧应烈可反以应生生成成白淡色黄的色N物a2质O,(N但a是2O2 ),并发出黄色的火焰。
氯化镧系元素记忆口诀

氯化镧系元素记忆口诀第一周期:氢、氦----侵害第二周期:锂、铍、硼、碳、氮、氧、氟、氖----鲤皮捧碳、蛋养福奶第三周期:钠、镁、铝、硅、磷、硫、氯、氩----那美女桂林留绿牙(那美女鬼、表露蓝牙)第四周期:钾、钙、钪、钛、钒、铬、锰----嫁改康太反革命铁、钴、镍、铜、锌、镓、锗----铁姑揉苦崭新嫁者砷、硒、溴、氪----生气、休克第五周期:铷、锶、钇、锆、铌----如此一宣告你钼、锝、钌----不得了铑、钯、银、镉、铟、锡、锑----旧把银哥印西堤碲、碘、氙、----、地点仙第六周期:铯、钡、镧、铪----(彩)色贝(壳)蓝(色)河钽、钨、铼、锇----但(见)乌(鸦)(引)来鹅铱、铂、金、汞、鸡爪、铅----一白巾、可供它拖铋、钋、砹、氡----必不爱冬(天)第七周期:钫、镭、锕----很直观了~就是----防火啊!氢锂钠钾铷铯钫,请李娜加入私访(李娜什么时候当皇上啦)铍镁钙锶钡镭,相媲美盖茨被辛苦(呵!想要和比尔.盖茨相媲美,小心辛苦着)硼铝镓铟铊,碰女嫁音他(看来新郎新娘都改名了)碳硅锗锡铅,探归者西迁氮磷砷锑铋,蛋临身体闭氧硫硒碲钋,养牛西蹄挥氟氯溴碘砹,父女绣点爱(父女情深啊)氦氖氩氪氙氡、害耐亚克这么一来一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心(二价氧钙镁钡锌)一价氢氯钾钠银,二价氧钙钡镁锌三铝四硅五价磷,二三铁、二四碳一至五价都有氮,铜汞二价最常见正一铜氢钾钠银,正二铜镁钙钡锌三铝四硅四六硫,二四五氮三五磷一五七氯二三铁,二四六七锰为也已碳有正四与正二,再把负价牢记心负一溴碘与氟氯,正数二氧硫三氮磷A、按周期分:第一周期:氢氦 ---- 侵犯第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼表露蓝牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命钴镍铜锌镓锗 ---- 铁姑揉苦崭新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一宣告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 旧把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞鸡爪铅 ---- 一白巾可供它拖铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很直观了~就是---- 防火啊!B、按族分:氢锂钠钾铷铯钫——恳请李娜重新加入怀陵铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰到女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋之南身体闭合氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点快乐氦氖氩氪氙氡——害耐亚克先动。
由锂到铯熔沸点

由锂到铯熔沸点锂、钠、钾、铷和铯是元素周期表中第一列元素,称为碱金属。
这五种金属在常温下都是固态,但它们具有很低的熔点和沸点。
随着从锂到铯这一系列元素的原子量逐渐增大,熔点和沸点也逐渐升高。
锂的熔点是180.5摄氏度,而铯的熔点则高达28.5摄氏度,是五种元素中熔点最高的。
这种现象可以通过研究这些元素的物理性质和原子结构来解释。
在这五种元素中,电子层数逐渐增多,原子半径也随之增大。
由于电子云的层次和范围增加,原子核与外层电子之间的吸引力变弱。
这导致了这些元素的融点和沸点的升高。
锂、钠、钾、铷和铯都是金属元素,具有良好的导电性和热导性。
在高温下,它们的原子和离子开始不规则地振动和移动,形成液态金属。
在这种状态下,它们的化学性质发生了显著变化,更容易与其他元素结合和反应。
这也是为什么碱金属在催化剂和电池等领域有广泛应用的原因之一。
除了物理性质的影响外,也有其他因素会影响这些元素的熔点和沸点。
例如,外部压力、纯度、晶体结构等因素都会对元素的相变温度造成一定程度的影响。
因此,实验条件的不同也可能会导致不同的结果。
嗯,我先确定一下这个食材有些什么,然后我们再决定做什么好吗?我觉得我们可以按照课本上的步骤来做。
我知道,一定要看看有没有熟食。
没错。
解释起来可能有些复杂,但从锂到铯熔沸点的变化是一个很有趣的现象。
通过对这五种元素的研究,我们可以更深入地了解元素周期表的规律和元素之间的关系。
这也有助于我们在材料科学、能源储存等领域的应用中更好地利用这些元素。
希望未来的科学家们能够继续深入研究这一领域,为人类社会的发展做出更大的贡献。
让我们总结一下本文的重点,我们可以发现,由锂到铯熔沸点的变化是一个复杂而有趣的过程,涉及到多种因素的影响。
通过对这些元素的研究,我们可以深入理解元素周期表的规律和元素之间的关系,为未来的科学研究和技术应用奠定基础。
希望本文的内容能够对读者有所启发,并促进更多人对这一领域的关注和探索。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、钠的物理性质
钠
质:软,可以用刀切割; 色泽:银白色,有金属光泽; 密度:0.97g/cm3,密度比水小; 熔沸点:熔点97.81℃,沸点882.9℃; 可导性:钠是热和电的良导体。
二、钠的化学性质
钠原子最外电子层上只有1个电子,在 化学反应中该电子很容易失去,因此,钠的 化学性质非常活泼,能与多种非金属及水反 应。 1、钠与非金属的反应 [实验2-2] 观察用刀切开的钠的表面所发生的变
化。把一小块钠放在石棉网上加热,观察现象。
二、钠的化学性质
[实验现象] 1、新切开的钠的光亮的表面很快就变暗了。
4Na O2 2Na2O
2、钠与氧气反应可以生成白色的 Na2O,但是 Na2O2 与充足的氧气剧烈反应生成淡黄色物质( ),并发出黄色的火焰。
2Na O2 Na2O2
2OH Cu
2
Hale Waihona Puke Cu(OH )2 二、钠的化学性质
[实验2-4]
切一块绿豆大小的钠,用铝箔(事先 用针刺有小孔)包好,再用镊子夹住,放 在试管口下,用排水法收集气体。并检验 钠与水生成的气体。
二、钠的化学性质
[实验2-4]
二、钠的化学性质——小结
1、钠的最外层只有1个电子,容易失去,是很 活泼的金属元素。具有很强的还原性。
2、钠与水、酸、盐反应的实质是钠与溶液中 的H+反应。 H+浓度越大反应越剧烈。
三、钠的保存与讨论
常温下钠易被空气中的氧气所氧化,水 及水蒸汽也会与之反应,所以钠应保存在煤 油或石蜡中,使之隔绝空气和水。
[讨论]
如果一块钠长期露置于空气,会发生哪些化学变化?
Na Na2O NaOH Na2CO3 Na2CO3 10H 2O(结晶) Na2CO3 (风化)
2Na 2H 2Na H 2
因为酸中H+浓度比水中的要大,所以反应速 率要快。
实验与讨论
2、钠与盐的反应 [补充实验3] 把一块金属钠投入到硫酸铜溶液中,观察发 生的现象,写出反应的离子方程式。
实验与讨论
[实验现象]
浮在水面、熔成小球、四处游动、有蓝色絮状沉 淀产生。
2Na 2H 2O 2Na 2OH H 2
四、钠的存在形式
自然界里元素有两种存在形态:一种是 以单质的形态存在,叫做元素的游离态;一 种是以化合物的形态存在,叫做元素的化合 态。
由于钠的性质很活泼,所以它在自然界里不 能以游离态存在,只能以化合态形式存在。 钠的化合物在自然界里分布很广,主要以氯 化钠的形式存在,如海水中氯化钠的质量分数大 约为3%。除此之外,钠也以硫酸钠、碳酸钠、硝 酸钠等形式存在。
钠与水反应实质 钠与水电离所产生的氢离子反应,生成氢气。
实验与讨论
1、钠与酸的反应 [补充实验2] 把一小块金属钠投入到装有盐酸的烧杯里 观察现象。指出钠与水反应和钠与盐酸反 应现象的不同点。 [实验现象] 钠与酸反应除了有钠与水反应的所有现象之 外,还有一点,钠与酸反应更加剧烈。
实验与讨论
[反应的实质]
五、钠的主要用途
1、原子反应堆的导热剂 钠和钾的合金(钾的质量分数约为50%~80%) 在室温下呈液态,是原子反应堆的导热剂。 2、作为还原剂,制其它金属 钠是一种很强的还原剂,可以把钛、锆、铌、钽等 金属从它们的卤化物里还原出来。 3、电光源 钠发出的黄色的光穿透能力强。也可用于暗室 内,黄光不会使相纸曝光。
TiCl4 4Na Ti 4NaCl
700 C ~ 800 C
六、作业
P31 三、四、五写在作业本上,其它写在书上。
点燃
二、钠的化学性质
[补充实验1]
把金属钠投入盛有Cl2的集气瓶里,观察现象。
Cl22 Na2 NaCl
金属钠除了能和O2直接化合外,还可以与Cl2、 S等很多非金属直接化合,例如:钠与硫化合 Na2 S 时甚至发生爆炸,生成硫化钠( )。
S 2 Na Na2 S
二、钠的化学性质
2、钠与水的反应 [实验2-3] 向一个盛有水的小烧杯里滴入几滴酚酞 试液,然后把一小块钠投入小烧杯。观察反 应的现象和溶液颜色的变化。
二、钠的化学性质
[实验现象]
现 象
浮在水面 熔成小球 四处游动 溶液变红 熔点低
原 因
密度比水小
生成气体推动小球 生成物质成碱性
二、钠的化学性质
钠与水反应原理
2Na 2H 2O 2NaOH H 2
