蒙古黄芪根腐病病原菌的分离鉴定及药剂筛选防治研究
蒙古黄芪根腐病病原鉴定及防治药剂室内筛选

蒙古黄芪根腐病病原鉴定及防治药剂室内筛选马桂花;段晓明;徐文华;周渊涛;马海霞;马伟丽;祁鹤兴【期刊名称】《草地学报》【年(卷),期】2022(30)5【摘要】为鉴定青海省民和地区蒙古黄芪(Astragalus membranaceusvar.mongholicus)根腐病病原菌及筛选防治该病害的有效杀菌剂,本研究基于形态学特征、rDNA-ITS,TEF-1α和RPB2序列分析对蒙古黄芪根腐病病原进行鉴定,并利用菌丝生长速率法测定8种杀菌剂对病原菌的抑制作用。
结果发现,引起黄芪根腐病的病原菌为腐皮镰刀菌(Fusarium soani)、逗号镰刀菌(F.virguliforme)、木贼镰刀菌(F.equiseti)和锐顶镰刀菌(F.acuminatum)。
室内药剂试验表明硅唑·咪鲜胺对4种镰刀菌的抑制作用最好,EC_(50)在0.195~0.588 mg·L^(-1)之间;多菌灵对腐皮镰刀菌、木贼镰刀菌和锐顶镰刀菌的抑制作用较强,EC_(50)在0.113~0.869 mg·L^(-1)之间;咯菌腈对逗号镰刀菌、木贼镰刀菌和锐顶镰刀菌的抑制作用较强,EC_(50)在0.153~0.390 mg·L^(-1)之间;甲基硫菌灵、噁霉灵、溴菌腈和石硫合剂对4种镰刀菌的抑制作用较差,EC_(50)在1.018~4.360 mg·L^(-1)之间。
试验结果为生产上合理选用杀菌剂防治黄芪根腐病提供了科学依据。
【总页数】9页(P1122-1130)【作者】马桂花;段晓明;徐文华;周渊涛;马海霞;马伟丽;祁鹤兴【作者单位】青海大学农牧学院;青海正德农牧开发有限公司;中国科学院西北高原生物研究所【正文语种】中文【中图分类】S435.621.24【相关文献】1.一种新的豇豆根腐病病原菌鉴定及室内药剂筛选2.云南灯盏花根腐病的2种新病原鉴定及防治药剂的室内筛选3.饲用玉米根腐病病原鉴定及室内药剂筛选4.油梨根腐病病原菌的鉴定、生物学特性及室内药剂筛选5.草莓根腐病病原菌鉴定及其防治药剂筛选因版权原因,仅展示原文概要,查看原文内容请购买。
黄芪常见病虫害防治方法

田间卫生
定期清除田间杂草、残株 ,减少病原菌和虫卵的藏 匿场所。
实施生物防治,保护和利用天敌昆虫和有益微生物
• 保护天敌昆虫:保护和招引天敌昆虫,如寄生蜂、捕食性昆虫等,控制害虫数量。 • 利用有益微生物:施用含有拮抗微生物的生物制剂,抑制病原菌的生长和繁殖。 • 推广生物农药:选用对天敌昆虫和有益微生物安全的生物农药,减少对环境的负面影响。 • 综上所述,黄芪病虫害的综合防治策略包括种植抗病抗虫品种、加强田间管理以及实施生物防治等方面。通过采取这些措
施,可以有效降低黄芪病虫害的发生和危害,保障黄芪产量和质量的安全与稳定。
04 病虫害防治的注意事项和 未来展望
使用农药的注意事项和安全防护
选择合适农药
根据黄芪病虫害的种类和严重程 度,选择合适的农药进行防治, 确保农药对目标病虫有效,并尽 量降低对环境和非目标生物的影
响。
遵循使用说明
严格按照农药的使用说明进行操 作,控制用药量、用药次数和用 药时间,避免滥用和误用农药。
化学防治:使用高效、低毒的杀虫剂进行喷雾防治,注 意轮换用药,避免抗药性产生。
黄芪红蜘蛛
黄芪红蜘蛛是黄芪上的重要害虫,对黄芪叶片造成危害 。
防治方法
生物防治:释放捕食性天敌如螨蚜蝇、草间小黑蛛等进 行控制。
描述:黄芪红蜘蛛身体红色或黄红色,喜欢在黄芪叶片 背面结网,吸食叶片汁液,导致叶片出现黄白色斑点, 严重时叶片干枯脱落。
种植抗病抗虫品种
选择良种
选择经过鉴定具有抗病抗虫性状 的黄芪良种,降低病虫害发生的 可能性。
繁殖健康种苗
采用健康的种子和繁殖材料,减 少病原菌和虫卵的携带量。
黄芪根腐病病根的显微及超微结构研究

黄芪根腐病病根的显微及超微结构研究赵庆芳;张艳芳;李巧峡【摘要】The anatomical structure of Astragalus membranaceus roots infected by root rot, the way of pathogenic fungi invaded and the distribution of the fungi in the root are studied by paraffin sectioning and thin sectioning, taking the healthy roots as comparison, the result provide the theory basis for deeply researching the pathogenic mechanism of Astragalus membranaceus root rot. The results indicate that the only difference on the basic anatomical structure is that the fungi invade in the diseased roots and many pelotons in parenchymatous cells; The fungi don't infect the periderm, they enter the phloem parenchymas through periderm, and then, form pelotons, colonize and infect other cells continuously by means of hypha penetrating the cell wall, then they continue to infect the next parenchymatous cells, even xylem. The growth and proliferation of the fungi inhibite the growth of cells.%利用石蜡切片和超薄切片方法,以黄芪(Astragalus membranaceus)的健康植株作为对照,研究了黄芪根腐病病根的解剖结构、致病真菌的侵入方式以及在根内的分布,为进一步从细胞水平研究黄芪根腐病致病机理提供理论依据.结果表明:病根与健根的基本解剖结构没有明显的区别,主要差异是病根中有入侵的真菌,大量染色较深的茵丝结分布在薄壁组织细胞中;真菌侵入时不破坏周皮,其菌丝穿过周皮组织细胞进入韧皮薄壁组织,在薄壁细胞中形成菌丝结,并逐步扩展成一定的侵染区域,继而向下一层薄壁组织细胞内侵入,严重时甚至侵染到木质部.真菌的生长和增殖抑制了细胞的生长.【期刊名称】《西北师范大学学报(自然科学版)》【年(卷),期】2012(048)005【总页数】6页(P84-88,120)【关键词】黄芪;根腐病;病根;显微结构;超微结构【作者】赵庆芳;张艳芳;李巧峡【作者单位】西北师范大学生命科学学院,甘肃兰州 730070;西北师范大学生命科学学院,甘肃兰州 730070;西北师范大学生命科学学院,甘肃兰州 730070【正文语种】中文【中图分类】Q944.54黄芪(Astragalusmembranaceus)为豆科多年生草本植物,以根入药,性温,味甘,可补气固表,是药用价值很高的中药材[1].甘肃省定西市的渭源县、漳县、陇西县、岷县、临洮县是黄芪主产区,被誉为“中国黄芪之乡”.随着市场对黄芪需求量的持续增加,其种植面积不断扩大,但轮作周期的缩短致使黄芪根腐病的发病率大大增加,成为影响黄芪产量的重要因素之一.黄芪根腐病属于土传病害,以病残体和土壤带菌传播;患病植株地上部分长势衰弱,严重时整株叶片枯黄脱落;地下根部表皮粗糙,有大量横向细纹,严重时呈褐色腐朽状;其致病菌经分离及致病性测定,主要有尖镰孢菌(Fusariumoxysporum)和腐皮镰孢菌(Fusariumsolani)[2].目前对黄芪根腐病的研究主要集中在症状的肉眼观察、病原菌分离鉴定[3-4]及致病菌的抑制等方面[5-8],而对病根解剖结构的研究国内外尚未见报道.本文利用光学显微镜和透射电镜,以健康黄芪的根作为对照,对自然生长状态下病根的解剖结构进行观察,研究了黄芪根腐病致病植株根的解剖结构的变化,为今后深入了解病害的症状、探求病害的入侵方式、发展规律和病因诊断奠定基础,为进一步从细胞水平研究黄芪根腐病致病机理提供理论依据.蒙古黄芪,分别于2011年8月和2011年10月采自甘肃省定西市渭源县的会川镇.1.2.1 光镜观察取新鲜黄芪根腐病病株的根切成2~3mm长的小段,用福尔马林-醋酸-酒精固定液(FAA)固定,系列乙醇脱水,石蜡包埋,旋转切片机连续切片,厚度8~10μm,番红、固绿双重染色[9],中性树胶封片,光学显微镜观察及显微照相,同时取健康植株的根作为对照.1.2.2 电镜观察取新鲜黄芪根腐病病株的根,放入预冷的2.5%戊二醛溶液中,在4℃下预固定4~12h,在气压0.07左右抽真空1h,换新鲜固定液后再固定1d.用0.1mol·L-1磷酸缓冲液清洗材料4次,每次30min;再放入1%锇酸中4℃下固定过夜,用0.1mol·L-1磷酸缓冲液洗6次,每次20min,经系列乙醇脱水,每次30min,Epon812包埋,在35℃—45℃—60℃聚合72h.超薄切片,醋酸铀和柠檬酸铅双重染色,电子显微镜观察并照相,同时取健康植株的根作为对照.黄芪根为典型的双子叶植物根的结构,它的次生结构主要包括周皮和次生维管组织(图版Ⅰ:1).在最外侧是起保护作用的周皮,由木栓层、木栓形成层和栓内层构成.木栓形成层由1~2层细胞构成,细胞扁平,细胞经过分裂、分化,向外产生2~3层木栓层,多数细胞扁平形,木栓层细胞成熟时为死细胞,细胞壁强烈栓质化,不透水不透气,细胞排列紧密,具有保护作用;向内产生2~3层栓内层,细胞近似椭圆形,为生活的薄壁组织细胞(图版Ⅰ:2).次生维管组织位于周皮的内侧,由次生韧皮部、维管形成层和次生木质部组成.其中,次生韧皮部由筛管、伴胞、韧皮薄壁组织细胞和韧皮射线组成(图版Ⅰ:2),韧皮薄壁细胞较大,排列疏松,有明显的细胞间隙.次生韧皮部约占根半径的1/3.维管形成层呈环状,细胞扁平形,排列整齐紧密.次生木质部由导管、木薄壁细胞和木射线构成,导管口径较大,单个散生,少数两个聚生,导管之间有大量木薄壁细胞分布,木射线多列,细胞扁平,不规则,木射线经维管形成层和韧皮射线相连接,呈辐射状排列,射线直达周皮.木质部约占根半径的2/3,根中间无髓部(图版Ⅰ:1,3).维管组织薄壁细胞中存在丰富的后含物(即细胞中的储藏物质),有大量的颗粒状物质,有时在韧皮薄壁组织细胞还分布有针状结晶束(图版Ⅰ:4).经光学和电子显微镜观察发现,病根与健根的基本解剖结构没有明显的区别(图版Ⅰ:1,5,6),主要差异是病根中有入侵的真菌,大量染色较深的菌丝结分布在薄壁组织细胞中(图版Ⅰ:7,8).显微镜下观察根段横截面的切片可以看到,真菌侵入时不破坏周皮.真菌在周皮层不形成菌丝结,也不进入细胞内部,而是存在于相邻细胞的细胞壁之间,有些虽然进入细胞壁中但不通过质膜进入细胞内部(图版Ⅰ:7).真菌菌丝穿过周皮组织细胞,进入韧皮部薄壁细胞内,在薄壁细胞中的一个或连续几个细胞中定殖,然后菌丝穿过细胞壁上的纹孔继续侵染其他相邻的细胞,逐渐扩展为一个侵染区域(图版Ⅰ:9,10,图版Ⅱ:1),继而向下一层薄壁组织细胞内侵入.在受侵染的根段横截面上可以看到,菌丝主要分布在韧皮薄壁组织细胞,对于有些侵染程度较高的根段,韧皮薄壁细胞内部布满了大量的菌丝或菌丝结,甚至有菌丝侵染到了根中间的木质部(图版Ⅰ:6,9).真菌菌丝侵入薄壁细胞后,会沿细胞壁缠绕(图版Ⅱ:2),而且常膨大,膨大的菌丝在细胞中呈螺旋状、棒状、椭圆状、球状等形状(图版Ⅰ:10).另外还发现,在正常植株的根中有大量的淀粉粒,而当真菌侵入后细胞内的淀粉粒消失,细胞内充满了菌丝(图版Ⅰ:10,图版Ⅱ:3).薄壁组织的细胞含有丰富的内含物(图版Ⅰ:2),为真菌的生长和增殖提供了主要的栖居区域,但分布不均匀.观察发现,真菌菌丝只分布在某些区域的薄壁细胞中;此外,菌丝并非在所有侵染到的薄壁细胞中定殖,有些只定殖于某一个细胞,而有些能在几个相邻的细胞中连续定殖(图版Ⅰ:6,7,8,9).定殖在细胞中的真菌吸收细胞内的营养物质不断进行生长和增殖,菌丝细胞会不断的膨大,而且真菌数量也会不断的增多(图版Ⅰ:10).真菌的生长和增殖不但抑制了细胞的生长,而且当真菌生长和增殖到一定程度,就会使细胞变形,细胞膜破裂,有些受侵染的细胞发生了质壁分离(图版Ⅰ:7,8,10);染菌细胞中的菌丝常向细胞核靠近,致使细胞核常膨大变形(图版Ⅱ:4).黄芪根具有较厚的周皮,这与黄芪根常在土壤的浅表层有关,需要较厚的保护层可减少根内部水分的丧失,增加根内水分的吸收和贮存.黄芪根中含有丰富的后含物,据段琦梅[10]研究发现,细胞后含物随着根的发育在逐渐增多,尤其是在八月份以后明显增多;另外本研究还发现,在有些韧皮薄壁细胞内分布有针状结晶束.Rasmussen[11]研究表明,兰科植物原球茎中的针状结晶是植酸钙镁,韧皮薄壁细胞中这种结晶可能也是这类物质.针状结晶束在薄壁细胞中形成后,细胞便失去活力,成为死细胞[12].病根与健根的基本解剖结构没有明显的区别,主要差异是病根中有入侵的真菌,这表明菌丝、菌丝结等是真菌侵入黄芪根之后的产物.不破坏周皮,穿过周皮组织细胞,进入韧皮薄壁组织细胞是真菌侵入黄芪根的主要途径.这可能与黄芪根的组织结构有关,它的周皮是强烈栓质化的死细胞,不透水不透气,不利于真菌的侵入和增殖;而韧皮薄壁组织的细胞含有丰富的营养物质,为真菌的生长和增殖提供了有利的环境.真菌继而向下一层薄壁组织细胞内侵入,严重时甚至侵染到木质部,这说明菌丝具有很强的活力,尽管受到大量细胞的阻截仍能继续向内侵入.真菌菌丝在整个根的横切面分布不均匀,只是集中在某些区域的薄壁细胞中.Hadleyt和WiUiamson[13]在地生兰的根中发现了同样的现象,认为根中真菌菌丝被限制并定位在某些区域的薄壁组织细胞中.但菌丝对薄壁细胞的侵染是否存在一定的选择性,有待进一步研究.真菌菌丝在薄壁细胞中定殖并缠绕成各种形状,菌丝结常与细胞核接近[14];另外还发现,在正常植株的根中有大量的淀粉粒,而当真菌侵入后细胞内的淀粉粒消失,细胞内充满了菌丝,这与伍建榕等[15]的研究结果一致.综上所述,真菌侵入黄芪根后利用细胞中的营养物质不断进行生长和增殖,其代谢产物不仅抑制了细胞的生长,而且当真菌生长和增殖到一定程度,致使细胞的膜通透性增高,细胞及其细胞器膨大变形,最后导致细胞膜破裂,使细胞解体死亡释放出内含物,常引起根部腐烂,严重者导致植株死亡.【相关文献】[1]张东佳,杨永建,赵汝能.甘肃黄芪属药用植物资源[J].中国野生植物资源,2005,24(1):38-40.[2]邓成贵.黄芪根腐病病原鉴定研究初报[J].中药材,2005,28(2):85.[3]王立新,孙先荣,白全江,等.黄芪根腐病病原菌鉴定[J].华北农学报,1994,9(2):107-109.[4]骆得功,韩相鹏,邓成贵,等.定西市药用黄芪病害调查与病原鉴定[J].甘肃农业科技,2004(1):38-40.[5]南换杰,秦雪梅,武滨,等.黄芪根腐病研究概况[J].山西中医学院学报,2009,10(1):67-70.[6]赵庆芳,赵培强,郭鹏辉,等.17种植物水提物对黄芪根腐病菌的抑制活性初步研究[J].西北农林科技大学学报:自然科学版,2009,37(3):163-167.[7]赵庆芳,周紫娟,王树红,等.七种植物对黄芪根腐病病原菌的抑制作用研究[J].西北师范大学学报:自然科学版,2009,45(5):92-95.[8]赵庆芳,陈健,李巧峡,等.不同物质对黄芪根腐病致病菌的抑制作用[J].兰州大学学报:自然科学版,2011,47(2):83-87.[9]李正理.植物组织制片学[M].北京:北京大学出版社,1996:130-154.[10]段琦梅.黄芪生物学特性研究[D].杨凌:西北农林科技大学,2005.[11] Rasmussen H N.Cell differentiation and mycorrhizal infection in Dactylorhizamajalis(Rchb F)Hunt &Summerh(Or-chidaceae)during germination invitro[J].NewPhytol,1990,116:137-147.[12]谭小明,郭顺星,周雅琴,等.七叶一枝花根的显微结构及其内生真菌分布研究[J].菌物学报,2006,25(2):227-233.[13] Hadleyt G,Williamson B.Features of mycorrhizal infection in some Malayan orchids[J].NewPhytol,1972,71:1111-1118.[14] Currah R S,Smreciu E A,Hambleton S. Mycorrhizae and mycorrhizal fungi of boreal species of Platanthera and Coeloglossum(Orchidaceae)[J].CanJBot,1990,68:1171-1181.[15]伍建榕,吕梅,刘婷婷,等.6种兰科植物菌根的显微及超微结构研究[J].西北农林科技大学学报:自然科学版,2009,37(7):199-207.。
几种杀菌剂对黄芪根腐病病原菌的毒力测定_范钱

几种杀菌剂对黄芪根腐病病原菌的毒力测定
范 钱,简 恒 (中国农业大学植物病理系,北京 100193)
摘要:采用生长速率法在室内选用 5 种药剂对黄芪根腐病病原菌进行毒力测定。 结果表明,所选 2 种商品化药剂中 苯醚甲环唑对黄芪根腐病主要致病菌尖镰孢菌和腐皮镰 孢菌的 EC50分别为 0.107 6 mg/L 和 66.055 9 mg/L, 其总体 抑制效果远优于三唑酮;3 种原药对黄芪根腐病病原菌的抑制作用均很强。 其中咪鲜胺和多菌灵的抑制效果比腈菌 唑更为突出,可以作为开发黄芪新种衣剂的候选药剂。 关键词:黄芪;根腐病;杀菌剂;毒力测定 中图分类号:S482.2 文献标识码:B 文章编号:1672-6820(2009)06-0041-03
瓜蒌(栝蒌),作为安徽省潜山县的特色资源已 经成为该县的一种支柱产业。 但是瓜蒌根结线虫病 是潜山瓜蒌产区最为严重的病害,发病率高,为害严 重,制约着瓜蒌产业的可持续发展。为了解决这一问 题,笔者开展了瓜蒌根结线虫病防治研究。 1 试验材料与方法 1.1 试验材料 瓜蒌品种为皖蒌 1 号 。 参 试 药 剂 1.5%二硫氰基甲烷 WP 由浙江省绍兴天诺农化有限 公司生产。 对照药剂为 3%辛硫磷 WP 和 2.5%阿维 菌素 EC。 1.2 试验地点及小区设计 2007、2008 年试验地均
回归方程
EC50 相关系数 (mg/L) (r)
10%苯醚甲环唑 WG y=0.191 2x+5.439 6 0.005 0 0.865 1
50%三唑酮 EC
y=0.600 9x+3.952 3 55.405 3 0.967 0
不同药剂处理对黄芪根腐病的防治效果

! " # "
.= >%' <
恶霉灵 Q > L O G R 6 7 H 甲基托布津 = E 6 = G F G J L> L J = 7 S H 高巧 ; 瑞苗青 T G 6 E G 6 ;+ I EV E G 6 E F U U < 清水 W G J L P
& ( '8 & 9 ( (8 & 9& ( #8 &;$( ( # 对照 . 6 F J P 6 7
!8 6 数据处理 使用 3 O D L 7 ' ( ( )" 1 , 15 $ 软件进
行数据处理 (
" 结果与分析 "8 ! 不同药剂处 理 对 黄 芪 根 腐 病 发 病 植 株 数 的影响 恶 霉 灵 ) 甲级托布津和高巧;瑞苗清)
种不同浓度的药剂处理后黄芪根部病级大都集中在 表 '% ( 其 中" 甲基 托布津 ) () ) 三个级别之间# 个浓度处理组的健康植株均明显多于另外两种 药剂 处理组 ( 高巧 ; 瑞苗清 病 级 的 发 病 黄 芪 ) 中 ) 植株平均株数分别只有 ( 甲基托布津 8 ) ) 与 ( 株$ ) 中) 恶霉灵 8 ) )株 $ 病 级 发 病 黄 芪 平 均 株 数 都 为( 8 ) ) 与 ( 株( 病 级 发 病 平 均 株 数 分 别 为 ! ) 中) 但不同药剂间发病黄芪平均株数差异并不显著 (
"8 # 不同药剂 对 黄 芪 苗 期 生 长 量 的 影 响 黄
芪苗期地 上 生 长 量 可 以 直 观 显 示 黄 芪 苗 的 生 长 状 侧 枝 数) 茎 粗 和 侧 枝 长 等 指 标 数 值 越 大" 况(株 高) 说明地上部分生长 越 旺 盛 " 表明药剂处理后的出苗 期黄芪品质越优 ( 不同药剂处理后的黄芪种苗在出 表明大部 苗期地上生长量指 标 大 部 分 高 于 对 照 组 " 分药剂处理有利于黄芪生长 () 种 药 剂 不 同 浓 度 处 理间对出 苗 期 地 上 生 长 量 的 影 响 也 存 在 一 定 的 差 异" 其中 药 剂 高 巧 ; 瑞 苗 清 组 合 ) 组的测量指标 与甲基托布津 且 二 者 间 差 别 不 大$ 恶霉 ) 均 较 好" 表) % ( 灵) 的效果最差 #
蒙古黄芪苗期立枯病害及其病原菌鉴定

蒙古黄芪苗期立枯病害及其病原菌鉴定作者:陈爱昌王艳霞漆永红罗宁李惠霞来源:《农学学报》2021年第09期摘要:为明确蒙古黄芪苗期立枯病害及其病原菌种类,采用组织分离法进行病原菌分离,并根据其培养性状、形态学和分子生物学rDNA-ITS特征进行鉴定。
结果表明,该病害的病原菌为立枯丝核菌(Rhizotonia solani)。
室内致病性测试结果表明,立枯丝核菌可引起蒙古黄芪苗期立枯病。
本研究首次报道了蒙古黄芪苗期立枯病及其病原菌,可为生产上该病害的防治提供理论依据。
关键词:苗期;蒙古黄芪;立枯病;病原鉴定;致病性测定中图分类号:S436.429文献标志码:A论文编号:cjas2020-0082Identification of Rhizoctonia solani and Its Pathogen in Astragalus membranaceus var. mongholicus Seedling StageChen Aichang1, Wang Yanxia2, Qi Yonghong3, Luo Ning4, Li Huixia4(1Dingxi Station of Plant Protection and Quarantine, Dingxi 743000, Gansu, China;2Dingxi Station of Rural Energy, Dingxi 743000, Gansu, China; 3Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou 730070, Gansu, China;4College of Plant Protection, Gansu Agricultural University, Lanzhou 730070, Gansu,China)Abstract: In order to clarify the pathogen and pathogenicity of Rhizoctonia solani in Astragalus membranaceus var. mongholicus seedling stage, the pathogen was isolated by tissue isolation method and identified according to its culture traits, morphology and molecular biological characteristics. The results showed that the disease pathogens were identified as Rhizotonia solani. This study first reported Rhizoctonia solani and its pathogen in Astragalus membranaceus var. mongholicus seedling stage, which could provide a theoretical basis for the control of the disease in production.Keywords: Seedling Stage; Astragalus menbranaceus var. mongholicus; Rhizoctonia solani; Pathogen Identification; Pathogenic Testing0引言黃芪(Astragalus menbranaceus)是豆科黄芪属多年生草本植物,有蒙古黄芪(Astragalus menbranaceus var. mongholicus)和膜荚黄芪(Astragalus menbranaceus)[1],以干燥的根入药,具有补气固表、利尿托毒、排脓、敛疮生肌等功效[2]。
应用新型杀虫剂杀菌剂配比防治黄芪根腐病效果研究
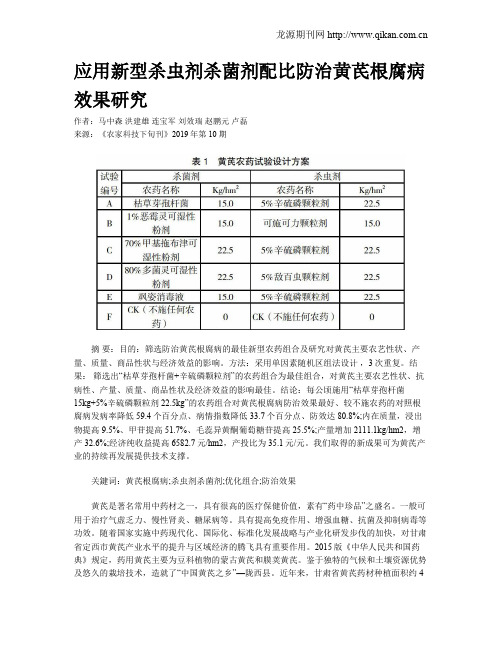
应用新型杀虫剂杀菌剂配比防治黄芪根腐病效果研究作者:马中森洪建雄连宝军刘效瑞赵鹏元卢磊来源:《农家科技下旬刊》2019年第10期摘要:目的:筛选防治黄芪根腐病的最佳新型农药组合及研究对黄芪主要农艺性状、产量、质量、商品性状与经济效益的影响。
方法:采用单因素随机区组法设计,3次重复。
结果:筛选出“枯草芽孢杆菌+辛硫磷颗粒剂”的农药组合为最佳组合,对黄芪主要农艺性状、抗病性、产量、质量、商品性状及经济效益的影响最佳。
结论:每公顷施用“枯草芽孢杆菌15kg+5%辛硫磷颗粒剂22.5kg”的农药组合对黄芪根腐病防治效果最好、较不施农药的对照根腐病发病率降低59.4个百分点、病情指数降低33.7个百分点、防效达80.8%;内在质量,浸出物提高9.5%、甲苷提高51.7%、毛蕊异黄酮葡萄糖苷提高25.5%;产量增加2111.1kg/hm2,增产32.6%;经济纯收益提高6582.7元/hm2,产投比为35.1元/元。
我们取得的新成果可为黄芪产业的持续再发展提供技术支撑。
关鍵词:黄芪根腐病;杀虫剂杀菌剂;优化组合;防治效果黄芪是著名常用中药材之一,具有很高的医疗保健价值,素有“药中珍品”之盛名。
一般可用于治疗气虚乏力、慢性肾炎、糖尿病等。
具有提高免疫作用、增强血糖、抗菌及抑制病毒等功效。
随着国家实施中药现代化、国际化、标准化发展战略与产业化研发步伐的加快,对甘肃省定西市黄芪产业水平的提升与区域经济的腾飞具有重要作用。
2015版《中华人民共和国药典》规定,药用黄芪主要为豆科植物的蒙古黄芪和膜荚黄芪。
鉴于独特的气候和土壤资源优势及悠久的栽培技术,造就了“中国黄芪之乡”—陇西县。
近年来,甘肃省黄芪药材种植面积约4万hm2,年总生产量约8万吨,约占全国黄芪生产总量的60%。
但目前该区域在黄芪生产中规范化栽培技术水平有待进一步提高,科研新成果新技术的应用与推广尚待进一步加强。
由于黄芪种植效益较高,使种植面积逐年扩增,但适宜种植区域有限。
《内蒙古苜蓿根腐病根内生菌群落及苜蓿对根内分离病原菌的抗性评价》范文

《内蒙古苜蓿根腐病根内生菌群落及苜蓿对根内分离病原菌的抗性评价》篇一一、引言内蒙古地区作为我国重要的牧业基地,苜蓿的种植和产量一直是当地农业生产的关注焦点。
然而,近年来随着气候变化及土地连作等环境因素的叠加影响,苜蓿的病害问题逐渐显现,其中尤以根腐病为主。
本文以内蒙古地区的苜蓿根腐病为研究对象,探讨其根内生菌群落结构及其与苜蓿抗病性的关系,以期为该地区苜蓿病害的防治提供理论依据。
二、材料与方法本文所采用的实验材料主要来源于内蒙古地区的苜蓿根茎样本。
首先通过根茎样品的收集和分离培养技术,获得根内生菌的纯培养物。
其次,运用现代生物技术手段如高通量测序、荧光定量PCR等方法对菌群的结构进行分析和评价。
最后,通过实验室条件下的病原菌接种实验,评估苜蓿对根内分离病原菌的抗性。
三、根内生菌群落结构分析通过对内蒙古地区苜蓿根内生菌的分离和鉴定,发现该地区的根内生菌主要包括细菌、真菌和放线菌三大类。
其中,细菌占据绝对优势地位,主要为变形杆菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)。
而真菌和放线菌则相对较少,但在维持土壤生态平衡及对苜蓿的抗病性上起到了重要作用。
这些微生物之间的相互影响、协同共生以及互作关系对于保持苜蓿根系的健康生长具有重要意义。
四、病原菌的分离与鉴定在根腐病发病的苜蓿根茎中,我们成功分离出多种病原菌。
通过形态观察、生理生化特性分析及分子生物学鉴定,我们发现其中一种半知名病原菌与根腐病的发生密切相关。
该病原菌具有典型的腐生性特征,能够在根系内部迅速繁殖并破坏根部组织,从而导致根部腐烂,影响植物的正常生长。
五、苜蓿对根内分离病原菌的抗性评价为了评估苜蓿对根内分离病原菌的抗性,我们进行了实验室条件下的病原菌接种实验。
通过对比接种前后苜蓿的生长状况及病害发生情况,我们发现不同品种的苜蓿对根腐病的抗性存在明显差异。
部分品种的苜蓿具有较强的抗病性,能够在一定程度上抑制病原菌的生长和繁殖;而部分品种则表现出较高的感病性,容易受到病原菌的侵害。
植物黄芪根内生真菌的分离

株 , 肉膏蛋 白胨 固体 培养基 中得到 内生真 菌 2株 ; 牛 菌株 在 P A培养 基 中长势 最好 , 分离 得 到 的 内生 D 且 真菌数 量最 多 ( 1 。用 4种 不 同 的培 养基 进行 黄 表 ) 芪 内生 真菌 的分 离 时 ,D P A培 养基 无 论 是 在提 取 菌 的数量 上 , 是在 菌 的生 长 状 态上 都 要 明显 好 于 其 还 他 3种培 养基 。因此 , 确定 P A培养 基 为本实 验 最 D 佳 的提取 分离 黄芪 内生真菌 的培 养基 。
122 内生真 菌的分 离纯化及 培 养基 的筛选 .. 组织培 养 : 择无 病斑 新鲜黄 芪根块 冲洗 干净 , 选 晾至表面无 水珠 , 主根 切 成 约 3c 长 的小 段 , 取 m 注
角瓶 ( 海五 一玻璃 仪器 厂 ) 上 。
试验试药 : 牛肉膏 、 酵母提取物、 胰化蛋白胨 、 蛋 白胨、 可溶性淀粉 ( 北京奥博 星生物技术有限责任 公司) 琼脂 (A A .O OD E G A D ; ; J P N X I N L N ) 葡萄糖 ( 分析纯 , 天津基准化学试剂有 限公 司) 医用酒精 ;
蒙 古 黄 芪 [ saa sm m rnc  ̄( i . At gl e b ae r u a u Fs ) h B e a og ocs( g. s o 为 名贵 中药 g.vr .m nhlu Be )H i ] i a 材。但 目前对其过度 的采挖 , 已造成传统道地黄芪 已远远 不能 满足市 场 需求 J 因此 从 天然 药 用微 。
意保持切 口的整齐。 培养组织表面消毒: 自来水冲洗干净,5 乙醇 7% 漂洗 3 i, n 无菌水冲洗 3 , % 的次氯酸钠溶液 m 次 1 0 浸泡 7 i, n 无菌水冲洗 3 , m 次 每次 2 i。为检查材 n m 料表面消毒是否彻底做对照实验如下 : ①接组织块 : 将 与上述 同样 条件 处 理过 的根 段不 作 分 割 , 接 种 直
黄芪常见病虫害及防治1

02
CATALOGUE
黄芪常见虫害及防治
蚜虫
生物防治
使用瓢虫、草蛉虫等天敌进行防治。
化学防治
使用10%吡虫啉可湿性粉剂等药剂进行喷雾防治。
螟虫
01
02
03
农业防治
及时清除黄芪园内枯枝、 落叶和杂草,减少越冬虫 源。
生物防治
使用赤眼蜂等天敌进行防 治。
化学防治
使用2.5%溴氰菊酯乳油等 药剂进行喷雾防治。
案例二:黄芪蚜虫的防治
总结词
黄芪蚜虫是一种常见的虫害,对黄芪的叶片和花朵产生严重损害。
详细描述
黄芪蚜虫的防治主要使用生物防治和化学防治两种方法。生物防治可以释放天敌进行自然控制,化学 防治主要使用杀虫剂进行叶片喷洒。
案例三:黄芪菟丝子的防治
总结词
黄芪菟丝子是一种寄生植物,对黄芪的生长 和产量产生严重影响。
黄芪常见病虫害及防治
2023-11-16
CATALOGUE
目 录
• 黄芪常见病害及防治 • 黄芪常见虫害及防治 • 黄芪病虫害综合防治措施 • 黄芪病虫害防治案例分享
01
CATALOGUE
黄芪常见病害及防治
根腐病
症状识别
黄芪根腐病是一种严重的土传 病害,病原体侵入根部后,导 致根部腐烂,地上部分叶片变
发病原因
黄芪锈病是由真菌引起的,病菌 在病残体中越冬,通过气流传播
,反复侵染。
防治方法
加强田间管理,及时清除病残体 ,减少侵染源;发病初期喷洒三 唑酮、烯唑醇等杀菌剂,控制病
情蔓延。
白粉病
症状识别
白粉病主要危害黄芪的叶片和茎部,导致叶片和茎部出现白色或 灰色的粉状物。
发病原因
根腐病病原菌粗提物胁迫下黄芪幼根代谢变化初探
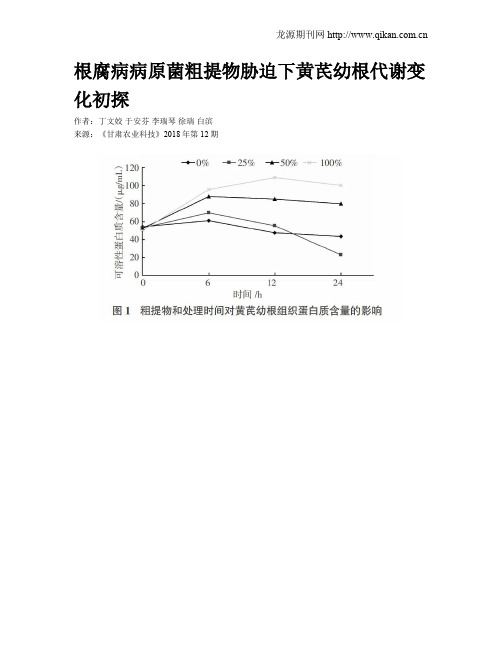
根腐病病原菌粗提物胁迫下黄芪幼根代谢变化初探作者:丁文姣于安芬李瑞琴徐瑞白滨来源:《甘肃农业科技》2018年第12期摘要:为明确黄芪根腐病致病机制,探索感病植株在物质代谢上对毒素的响应,将分离所得茄病镰刀菌毒素粗提物稀释成不同浓度胁迫处理黄芪幼根,对处理后的幼根蛋白质含量进行了测定。
结果表明,随着毒素胁迫时间的延长,黄芪幼根蛋白質含量均快速下降,这可能是随着毒素作用时间的延长,破坏了植株体内的正常代谢,进而抑制了蛋白质的合成。
毒素胁迫后黄芪幼根可溶性糖含量降低得快,说明植株体内呼吸作用加强;脯氨酸含量则随着胁迫时间和毒素浓度的增加而增加,说明黄芪幼苗对毒素危害表现为敏感响应。
关键词:根腐病菌;粗毒素;黄芪幼苗;物质代谢中图分类号:S567.23; ; ; ; ;文献标志码:A; ; ; ; ;文章编号:1001-1463(2018)12-0031-04doi:10.3969/j.issn.1001-1463.2018.12.010黄芪根腐病(Astragalus Root Rot)是黄芪的重要病害之一,它是一种分布较广、危害较重、致病的病原种类多和防治困难的常发土传病害,其主要病原菌为镰刀菌,以土壤带菌和植株的病残体进行传播[1; ]。
黄芪普遍种植于甘肃各地,尤以甘肃中部的定西等地种植最多,种植面积也不断扩大,轮作周期缩短,连作面积增加,导致黄芪根腐病越来越严重。
被根腐病危害的黄芪植株地上部生长衰弱,地下部被害后主、侧根出现褐色坏死病斑,严重时根皮腐烂呈纤维状,直接影响黄芪的产量和品质。
我们在对甘肃中部地区黄芪根腐病原的研究中发现,茄病镰刀菌(F. solani)是该区域黄芪根腐病的优势病原菌[2 ]。
镰刀菌可产生对植物组织和细胞有明显毒害作用的毒素[3 - 5 ],脯氨酸和可溶性糖在高等植物的抗逆生理中发挥着重要的作用[6 ],是在各种生物体内均有分布的渗透保护物质,在毒素胁迫下,高等植物通过增加细胞内的脯氨酸和可溶性糖含量来维持细胞的渗透压。
《内蒙古苜蓿根腐病根内生菌群落及苜蓿对根内分离病原菌的抗性评价》范文

《内蒙古苜蓿根腐病根内生菌群落及苜蓿对根内分离病原菌的抗性评价》篇一一、引言内蒙古地区以其丰富的土壤资源及独特的气候条件为农作物生长提供了得天独厚的条件。
然而,近年来,苜蓿根腐病在该地区广泛传播,给当地农业生产带来了巨大的损失。
根腐病不仅破坏了植物根部的正常生理结构,还导致土壤内生菌群落的失衡。
本文旨在探讨内蒙古地区苜蓿根腐病根内生菌群落的特点,以及苜蓿对根内分离病原菌的抗性评价,以期为防治苜蓿根腐病提供理论依据。
二、研究方法本研究采用分子生物学和微生物学技术手段,对内蒙古地区苜蓿根腐病根内生菌群落进行调查,并从根内分离出病原菌。
通过分析病原菌的生物特性,结合苜蓿的抗性评价,以期全面了解苜蓿对根腐病的抗性机制。
三、内蒙古苜蓿根腐病根内生菌群落分析(一)根内生菌群落结构通过PCR扩增和Illumina高通量测序技术,我们对内蒙古地区苜蓿根腐病根内生菌群落进行了分析。
结果表明,该地区根内生菌群落主要由细菌、真菌和放线菌组成。
其中,细菌占据主导地位,其次是真菌和放线菌。
细菌群落主要包括厚壁菌门、放线菌门等优势类群,而真菌和放线菌也呈现出多样化的种类分布。
(二)内生菌与苜蓿生长关系在分析了内蒙古地区土壤的化学性质后,我们发现土壤中的内生菌与苜蓿的生长密切相关。
这些内生菌在促进苜蓿生长、提高土壤肥力等方面发挥了重要作用。
然而,当根腐病发生时,这些内生菌的数量和种类会发生变化,导致土壤生态平衡被破坏。
四、苜蓿对根内分离病原菌的抗性评价(一)病原菌的分离与鉴定通过PCR扩增和形态学观察等方法,我们从根内成功分离出病原菌。
通过16S rRNA基因测序等技术手段,我们鉴定了病原菌的种类和生物特性。
结果表明,该病原菌属于一种半知菌类真菌。
(二)苜蓿对病原菌的抗性评价为了评估苜蓿对根内分离病原菌的抗性,我们进行了室内外抗性试验。
结果表明,不同品种的苜蓿对病原菌的抗性存在显著差异。
其中,某些品种的苜蓿在感染病原菌后仍能保持较高的生长速度和产量,显示出较强的抗病能力。
黄芪根腐病拮抗菌的筛选及生防机制

黄芪根腐病拮抗菌的筛选及生防机制许磊磊;白晓丽;李哲斐【期刊名称】《西北师范大学学报(自然科学版)》【年(卷),期】2024(60)2【摘要】由Fusarium oxysporum引起的根腐病是制约黄芪产量和品质的重要因素之一,为了获得环境适应性强且拮抗效果好的黄芪根腐病生防菌,以病原真菌F.oxysporum为指示菌,通过稀释涂布法和平板对峙实验从黄芪根和根际土壤中共分离得到197株细菌,其中20株细菌对病原真菌有拮抗作用,且20株拮抗菌中优势菌为芽孢杆菌.7株拮抗菌对病原真菌生长抑制率超过35%,用这7株细菌进行盆栽试验,结果表明,菌株AS1对黄芪根腐病的防治效果最好,在接种病原菌第20 d时AS1对黄芪根腐病的防效达46.86%.进一步研究发现,菌株AS1基因组中含有伊枯草素、脂肽和杆菌霉素的编码基因,AS1处理后病原真菌孢子萌发率下降了74.4%.接种AS1第8 h后植物的苯丙氨酸解氨酶、几丁质酶、多酚氧化酶、过氧化物酶、脂氧合酶活性和茉莉酸含量较不接种对照分别提高了16.0%,21.5%,10.6%,12.6%,14.2%和97.3%.此外,AS1处理15 d后使黄芪的根长和株高分别增加了37.52%和12.78%.根据生理生化特征和16S rDNA测序发现菌株AS1归属于贝莱斯芽孢杆菌.因此,AS1是一株具有较大应用潜力的生防和促生菌株.【总页数】9页(P77-85)【作者】许磊磊;白晓丽;李哲斐【作者单位】西北农林科技大学生命科学学院【正文语种】中文【中图分类】S432.45【相关文献】1.黄芪根腐病生防芽孢杆菌的筛选鉴定与盆栽防效试验2.黄芪根腐病生防菌株的筛选鉴定及其防效评价3.辣椒根腐病生防菌的筛选鉴定及生防作用4.蓝莓根腐病生防真菌的筛选鉴定及其生防机制分析5.黄芪根腐病生防放线菌筛选鉴定及其优化培养因版权原因,仅展示原文概要,查看原文内容请购买。
《内蒙古苜蓿根腐病根内生菌群落及苜蓿对根内分离病原菌的抗性评价》范文

《内蒙古苜蓿根腐病根内生菌群落及苜蓿对根内分离病原菌的抗性评价》篇一一、引言内蒙古地区作为我国重要的畜牧业基地,苜蓿作为该地区的主要牧草之一,其健康状况直接关系到畜牧业的可持续发展。
近年来,苜蓿根腐病在内蒙古地区频繁发生,给苜蓿生长和草地生态带来了严重影响。
本文旨在探究内蒙古苜蓿根腐病根内生菌群落的结构特点,并评价苜蓿对根内分离病原菌的抗性,以期为苜蓿病害的防控和草地生态系统的健康管理提供科学依据。
二、研究区域与方法1. 研究区域本文研究区域位于内蒙古典型草原地区,选择该区域主要是考虑到该地区的气候特点和土壤条件,均与苜蓿根腐病的发生密切相关。
2. 研究方法(1)样品采集:在研究区域内,选择不同发病程度的苜蓿地块,采集根样。
(2)根内生菌群落分析:利用分子生物学技术,对根内生菌群落进行PCR扩增和测序分析。
(3)病原菌分离与鉴定:通过常规的微生物分离纯化技术,从病根中分离病原菌,并进行形态学和分子生物学鉴定。
(4)抗性评价:通过接种试验,观察不同抗性苜蓿品种对根内分离病原菌的生长反应和抗病性表现。
三、根内生菌群落结构特点通过对内蒙古地区不同发病程度苜蓿根样的分析,我们发现根内生菌群落具有以下特点:1. 多样性高:根内生菌群落包括多种细菌、真菌和放线菌等微生物种类。
2. 结构差异:不同发病程度的苜蓿根内生菌群落结构存在显著差异,健康根样与病态根样的菌群组成有明显区别。
3. 优势菌群:某些特定种类的细菌在病态根样中占优势,可能与苜蓿根腐病的发生有关。
四、病原菌的分离与鉴定通过常规的微生物分离纯化技术,我们从病根中成功分离出多种病原菌。
经过形态学和分子生物学鉴定,确定了主要病原菌的种类。
这些病原菌多数属于真菌类,具有侵染苜蓿根部的能力,是导致苜蓿根腐病发生的重要原因。
五、苜蓿对根内分离病原菌的抗性评价通过接种试验,我们发现不同抗性苜蓿品种对根内分离病原菌的生长反应和抗病性表现存在显著差异。
具体评价如下:1. 抗病性强:某些品种的苜蓿具有较强的抗病性,能够在受到病原菌侵染时迅速抵抗并抑制其生长。
渭源县黄芪根腐病病原菌的分离与鉴定

渭源县黄芪根腐病病原菌的分离与鉴定作者:陈健孙旭春赵庆芳来源:《甘肃农业科技》2020年第10期摘要:对从甘肃省渭源县采集到的黄芪根腐病病株进行了病原菌的分离、纯化和致病性检测,并对致病菌形态学进行了观察,结合核糖体DNA(rDNA) ITS序列分析的分子生物学鉴定,以明确引起黄芪根腐病的致病病原菌。
结果表明:黄芪根腐病致病菌为半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)瘤座孢目(Tuberculariales)瘤座孢科(Tuberculariaceae)鐮刀菌属(Fusarium)的4个种。
共分离出16个菌株,经检测有5个菌株具有致病性,均属镰刀菌,其中尖孢镰刀菌(Fusarium oxysporun)1株(9号菌株),腐皮镰刀菌(Fusarium solani)2种(12号菌株和16号菌株,其中16号菌株可能为腐皮镰刀菌的变种),锐顶镰刀菌(Fusarium acuminatum)1株(15号菌株),待定镰刀菌1株(14号菌株,与三线镰刀菌的同源性仅为88%)。
关键词:黄芪;根腐病;致病菌鉴定;ITS序列分析;渭源县中图分类号:S512.1 文献标志码:A 文章编号:1001-1463(2020)10-0021-07doi:10.3969/j.issn.1001-1463.2020.10.005Abstract:The root rot strains of Astragalus membranaceus root rot symptom collected from Weiyuan County, Gansu Province were isolated, purified and tested for pathogenicity, and by morphological identification and identification of pathogenic bacteria with molecular identification of ribosomal DNA(rDNA) ITS sequence analysis, so as to identify pathogenic bacteria of causing Astragalus membranaceus root rot. The results show that the pathogen of root rot of astragalus membranaceus was four species of Deuteromycotina, Hyphomycetes, Tubercuariles,Tuberculariaceae, Fusarium, a total of 16 strains were isolated, and 5 strains were detected to be pathogenic, all of which were fusarium, of which 1 strain(strain 9) was Fusarium oxysporum,2 strains of (strains 12 and strains 16 of which may be a variant of Fusarium solani) were Fusarium solani, 1 strain(strain 15) was Fusarium acuminatum, 1 strain(strain 14, only 88% homologous to Fusarium trichomonas) was determined Fusarium.Key words:Astragalus membranaceus;Root rot;Pathogenic bacteria identification;ITS sequences analysis;Weiyuan County黄芪(Astragalus membranaceus)为豆科多年生草本植物,以根入药,是药用价值很高的中药材[1 - 3 ]。
白及根腐病病原菌的鉴定及抑制效应研究

㊀Guihaia㊀Feb.2024ꎬ44(2):345-353http://www.guihaia-journal.comDOI:10.11931/guihaia.gxzw202302001马晓雅ꎬ路茜ꎬ吴巧芬ꎬ等ꎬ2024.白及根腐病病原菌的鉴定及抑制效应研究[J].广西植物ꎬ44(2):345-353.MAXYꎬLUXꎬWUQFꎬetal.ꎬ2024.IdentificationandinhibitingeffectofpathogensthatcausedtuberrotofBletillastriata[J].Guihaiaꎬ44(2):345-353.白及根腐病病原菌的鉴定及抑制效应研究马晓雅1ꎬ2ꎬ路㊀茜1ꎬ2ꎬ吴巧芬2ꎬ杨燕妮2ꎬ夏㊀科2ꎬ赵志国2ꎬ郑文俊1∗ꎬ仇㊀硕2∗(1.桂林理工大学旅游与风景园林学院ꎬ广西桂林541006ꎻ2.广西壮族自治区广西植物研究所ꎬ中国科学院广西植物功能物质与资源持续利用重点实验室ꎬ广西桂林541006)摘㊀要:为明确鉴定白及块茎腐烂病(根腐病)的病原菌ꎬ并筛选能够抑制病原菌的中药材提取物ꎮ该研究利用常规组织分离法对病原菌进行分离ꎬ通过形态学和分子生物学技术对致病菌株进行鉴定ꎬ同时观察了7种中药材提取物对病原菌的抑菌效果ꎮ结果表明:(1)从感病叶片㊁叶鞘及块茎中共分离得到14株真菌和4株细菌ꎬ病原菌室内和室外回接表明菌株GF ̄1致病症状与田间一致ꎬ致病率均达到100%ꎮ(2)经形态学鉴定ꎬ菌株GF ̄1为附球菌属(Epicoccum)病原菌ꎬ菌落白色绒絮状ꎬ圆形ꎻ菌丝匍匐向外㊁向上生长ꎬ气生ꎬ无色ꎬ有隔膜ꎬ有分枝ꎬ具有分生孢子和厚垣孢子ꎮ(3)菌株GF ̄1的ITS序列(全长522bp)与GenBank中已登录的甘蔗的高粱附球菌(E.sorghinumꎬMN493119.1)序列一致性最高ꎬ达99.62%ꎬ与已报道的白及叶斑病致病菌高粱附球菌(E.sorghinumꎬMF948994.1)的一致性为98.88%ꎮ(4)培养基中含有0.1~0.2g mL ̄1的青钱柳等7种中药材提取物ꎬ能够完全抑制GF ̄1菌落的生长ꎻ当培养基中含有0.05g mL ̄1的提取物时ꎬ肉桂和丁香提取物仍然能够完全抑制菌落的生长ꎮ综上认为ꎬ引起白及根腐病的致病菌为附球菌属高粱附球菌(E.sorghinum)ꎬ培养基中分别含有0.1~0.2g mL ̄1的青钱柳㊁白及㊁厚朴㊁八角㊁肉桂㊁蛇床子和丁香7种中药材提取物且均能完全抑制致病菌的生长ꎮ该研究结果为白及根腐病的防治提供了理论指导ꎮ关键词:白及ꎬ根腐病ꎬ病原菌分离和鉴定ꎬ高粱附球菌ꎬ中草药提取物中图分类号:Q948㊀㊀文献标识码:A㊀㊀文章编号:1000 ̄3142(2024)02 ̄0345 ̄09IdentificationandinhibitingeffectofpathogensthatcausedtuberrotofBletillastriataMAXiaoya1ꎬ2ꎬLUXi1ꎬ2ꎬWUQiaofen2ꎬYANGYanni2ꎬXIAKe2ꎬZHAOZhiguo2ꎬZHENGWenjun1∗ꎬQIUShuo2∗(1.CollegeofTourism&LandscapeArchitectureꎬGuilinUniversityofTechnologyꎬGuilin541006ꎬGuangxiꎬChinaꎻ2.GuangxiKeyLaboratoryofPlantFunctionalPhytochemicalsandSustainableUtilizationꎬGuangxiInstituteofBotanyꎬGuangxiZhuangAutonomousRegionandChineseAcademyofSciencesꎬGuilin541006ꎬGuangxiꎬChina)收稿日期:2023-06-20基金项目:广西重点研发计划项目(桂科AB18294026)ꎻ广西科学院园艺植物种质资源创新及利用创新研究团队启动经费项目(CQZ ̄E ̄1919)ꎻ桂林市创新平台和人才计划项目(20210102 ̄3)ꎻ桂林市技术应用与推广计划项目(20220135 ̄1)ꎮ第一作者:马晓雅(1997-)ꎬ硕士研究生ꎬ主要从事园林植物栽培及景观设计研究ꎬ(E ̄mail)1207092435@qq.comꎮ∗通信作者:郑文俊ꎬ博士ꎬ教授ꎬ主要从事民族乡土景观及风景旅游规划ꎬ(E ̄mail)149480860@qq.comꎻ仇硕ꎬ博士ꎬ副研究员ꎬ主要从事园艺植物种质资源创新与利用研究ꎬ(E ̄mail)qiushuo001@163.comꎮAbstract:InordertoidentifythepathogensthatcausedtuberrotinBletillastriataandstudytheinhibitingeffectsofherbalextractsonpathogensꎬthepathogensthatcausedtuberrotofB.striatawereisolatedusingusualtissueisolationthestrainswereidentifiedbymorphologicalandmolecularbiologicaltechniquesꎬandinhibitingeffectsofseventraditionalChinesemedicineextractsonpathogenwereobserved.Theresultswereasfollows:(1)Atotaloffourteenfungiandfourbacteriawereisolatedfromdiseasedleavesꎬleafsheathsandtubers.ButonlystrainGF ̄1causeddiseaseꎬwhosesymptomsconsistentwiththoseinthefield.TheincidencesofGF ̄1diseasereinoculatedinthefieldandlaboratorywereboth100%.(2)GF ̄1wasidentifiedasamemberofEpicoccumꎬanditscolonialmorphologywasacircularformꎬwithwhitemyceliumꎬprostrateonthemediumꎬaerialꎬdiaphragmsandbranches.Therewereconidiaandchlamydospores.(3)Atlastꎬthesequenceofinternaltranscribedspacer(ITS)regionofGF ̄1wereanalyzedꎬthelengthwas522bp.ThesequencewascomparedwithotherspeciesintheGenBankandreached99.62%similaritytoEpicoccumsorghinum(MN493119.1)isolatedformSorghumꎬwhichwascloserthanothersꎬincludingEpicoccumsorghinum(MF948994.1)isolatedformleavesofBletillastriata.(4)GF ̄1couldbefullyinhibitedwhenthemediumcontained0.1-0.2g mL ̄1extractsthatextractedfromseventraditionalChinesemedicinesꎬrespectively.Italsocouldbefullyinhibitedby0.05g mL ̄1ofCinnamomumcassiaorSyringaoblate.InsummaryꎬthepathogenthatcausedtuberrotinBletillastriatawasidentifiedasEpicoccumsorghinum.AndGF ̄1couldbefullyinhibitedcultivatedonthemediumwhichcontained0.1-0.2g mL ̄1herbalextractsꎬe.g.:CinnamomumcassiaꎬSyringaoblateꎬCyclocaryapaliurusꎬBletillastriataꎬHoupoeaofficinalisꎬIlliciumverumorCnidiummonnieri.TheresultsprovidetheoreticalreferencesforthecontroloftuberrotofBletillastriata.Keywords:BletillastriataꎬtuberrotꎬpathogenisolationandidentificationꎬEpicoccumsorghinumꎬChineseherbalextracts㊀㊀白及(Bletillastriata)为兰科(Orchidaceae)白及属(Bletilla)多年生草本植物ꎬ别名白芨㊁连及草㊁利知子㊁甘根等ꎮ白及属植物全球有6种ꎬ均分布在亚洲ꎬ其中中国有4种ꎬ分别为白及㊁小白及㊁华白及㊁黄花白及(中国植物志ꎬ1999)ꎮ白及具有止血补肺㊁生肌止痛之功效ꎬ用于防治咯血㊁吐血㊁慢性胃溃疡及肿瘤㊁外伤出血㊁疮疡肿毒㊁皮肤皲裂等症(中华人民共和国药典ꎬ2020)ꎻ此外ꎬ白及叶态优美㊁花大色艳㊁花期长ꎬ可在园林景观中用于布置花坛㊁花境或花海(石晶ꎬ2010ꎻ朱娇等ꎬ2020)ꎮ此外ꎬ白及还可用于制作粘合剂㊁浆丝绸㊁面膜或涂料以及酿酒等(刘光斌等ꎬ2005ꎻGouvgetal.ꎬ2009)ꎮ因此ꎬ白及是一种兼具药用㊁观赏和工业价值的多用途植物ꎮ近年来ꎬ随着市场需求量的逐年上升ꎬ种植规模不断扩大ꎬ各类病害频繁爆发ꎬ如叶斑病(柯尚艳等ꎬ2018ꎻZhouetal.ꎬ2018)㊁叶褐斑病和锈病等(宋莉莎ꎬ2019)ꎬ严重影响了白及的产量和质量以及观赏价值ꎮ根腐病是白及的常见病害之一ꎬ大多发生在6 8月ꎬ地下块茎出现褐色病斑ꎬ内部呈黑褐色软腐状ꎬ并伴有腥臭味ꎬ整个根部维管束被破坏ꎬ失去输水能力ꎻ地上茎秆㊁叶片基部和叶鞘早期表现为褐色干枯状长条形病斑ꎬ边缘黄色晕染状ꎬ后期则干枯至死ꎬ病株易连根茎从土中拔出ꎬ发病块茎呈木质化纤维ꎮ整体发病率在15%左右ꎬ危害较大ꎬ一旦受害就会严重影响药材的品质和产量ꎮ该病害易与叶斑病混淆(Zhouetal.ꎬ2018)ꎮ目前ꎬ虽然研究报道表明引起白及根腐病的病原菌主要是尖孢镰刀菌(Fusariumoxysporum)和腐皮镰刀菌(F.solani)(孙乐乐等ꎬ2013ꎻ宋莉莎ꎬ2019)ꎬ但这些研究并未报道引起根腐病的地上部症状的病原菌ꎮ鉴于以上情况ꎬ在广西地区引起白及根腐病的病原菌是否与叶斑病致病菌一致或者与根腐病致病菌一致目前尚不清楚ꎮ中药材提取物具有低污染㊁低毒㊁低残留的特点ꎬ广泛用于中药材病害防治ꎬ如厚朴和蛇床子提取液分别对黄芪和五味子根腐病具有很好的防治效果(刘莹等ꎬ2009ꎻ马伟等ꎬ2010)ꎮ然而ꎬ这些中药材提取物对白及病害的防治效果还需要验证ꎮ本文以白及根腐病为研究对象ꎬ采用常规组织分离法分离不同组织部位的病原菌ꎬ通过形态学且结合分子生物学技术鉴定病原菌ꎬ并采用菌丝生长速率法测定中药材提取液对病原菌的抑制效果ꎬ以期明确鉴定广西地区根腐病的病原菌ꎬ并筛643广㊀西㊀植㊀物44卷选出能够抑制病原菌的中药材提取物ꎬ为白及根腐病防治提供理论指导ꎮ1㊀材料与方法1.1试验材料2021年6月ꎬ于桂林市雁山区(地处110ʎ17ᶄE㊁25ʎ01ᶄN)采集白及病株ꎬ初步判断为叶斑病或根腐病ꎮ该病害多发生在6月中旬至8月初ꎬ整体发病率在15%左右ꎬ发病初期地上部无症状ꎬ地下部根系和块茎出现褐色病斑ꎬ块茎切开后呈黑褐色软腐状ꎬ并伴有腥臭味ꎻ随着病情的加深ꎬ当地下块茎出现1/3~1/2腐烂时ꎬ根系完全腐烂ꎬ地上茎秆开始出现褐色ꎬ叶片尖部和基部出现不规则病斑ꎬ病斑中央深褐色ꎬ边缘黄褐色至淡黄色ꎬ直至萎蔫ꎬ茎秆容易被抽出(图1)ꎮA.田间病株ꎻB.田间病株茎秆ꎻC.病株块茎ꎻD.健康块茎ꎻE.健康植株ꎮA.InfectedplantinthefieldꎻB.StalksofinfectedplantinthefieldꎻC.TubersofinfectedplantꎻD.HealthtubersꎻE.Healthplants.图1㊀白及根腐病的症状Fig.1㊀SymptomsoftuberrotinBletillastriata1.2试验方法1.2.1病原菌的分离㊀参照常规组织分离法(方中达ꎬ1998)ꎬ从发病植株上采集病叶㊁叶鞘和地下块茎ꎬ冲洗干净ꎬ在病健交界处切下约5mmˑ5mm的小块组织ꎻ先用75%的酒精处理30sꎬ再用0.1%浓度的升汞溶液消毒60s㊁无菌水冲洗晾干㊁无菌滤纸吸干水分后移置于PDA培养基上ꎻ在每个培养皿中(Φ=90mm)放入3~4块组织ꎬ于25ħ恒温条件下培养3dꎬ对其进行纯化培养ꎮ采用平板划线法进行菌种纯化ꎬ即在无菌操作台中用接种环挑取菌丝ꎬ在PDA平板上划线ꎬ进行编号后继续置于25ħ恒温条件下培养ꎬ纯化至出现单个的菌落即可ꎮ1.2.2病原菌的致病性测定1.2.2.1室内回接㊀将3年生的白及组培苗健康植株采回实验室ꎬ采取创伤接种法进行接种ꎮ用无菌水冲洗叶片和块茎ꎬ用无菌滤纸吸干表面水分ꎬ在超净工作台内操作ꎬ步骤如下:用解剖刀将叶片背面轻轻刮伤(约5mmˑ5mm)ꎻ对块茎采用刺伤接种法ꎬ使用直径5mm的打孔器在菌落边缘打取菌饼ꎻ将带有菌丝那一面覆盖在叶片和块茎的伤口处ꎬ以接种PDA培养基的健康白及叶片和块茎为对照组ꎻ每个叶片处理3个伤口ꎬ粘贴菌饼ꎬ重复3次ꎻ每个块茎从中间切开ꎬ各处理1个伤口ꎬ粘贴菌饼ꎬ重复3次ꎮ将样品平铺于带有湿润吸水纸的平盘内ꎬ做保湿处理ꎬ6d后统计感病数和发病率ꎮ计算公式:发病率=(感病数/接种总数)ˑ100%ꎮ1.2.2.2田间回接㊀选择室内回接致病的菌株ꎬ进一步进行田间回接验证ꎮ选择健康植株的叶片ꎬ用解剖刀轻轻割伤叶片上表面ꎬ面积约5mmˑ5mmꎬ使用直径5mm的打孔器取培养基中生长良好的病原菌菌饼ꎬ将带有菌丝的一面贴向叶片ꎬ并利用透明胶布粘附到已接种的叶片部位ꎻ以无菌的PDA培养基作对照ꎮ每个处理3株ꎬ每张叶片粘贴3个菌饼ꎬ共计9个接种部位ꎮ用保鲜袋罩住24hꎬ6d后统计感病数和发病率ꎮ计算公式:发病率=(感病数/接种总数)ˑ100%ꎮ1.2.2.3致病菌重新分离㊀对田间回接致病的植株进行再次分离ꎬ验证是否符合柯赫式法则ꎬ病原菌的分离方法同1.2.1ꎮ1.2.3病原菌的形态学鉴定㊀对田间回接致病的病原菌ꎬ挑取生长良好的病原菌菌落ꎬ采用插片培7432期马晓雅等:白及根腐病病原菌的鉴定及抑制效应研究养法置于含有PDA培养基的一次性培养皿中ꎬ在25ħ恒温条件下培养ꎬ3~5d后观察菌丝体㊁分生孢子的形态ꎬ用leika正置式显微镜DM2500拍照ꎬ并测量分生孢子大小(长㊁宽)及菌丝直径ꎮ同时ꎬ查阅文献资料进行初步鉴定ꎮ1.2.4病原菌的分子生物学鉴定㊀刮取菌丝ꎬ用液氮研磨法破壁ꎬ采用CTAB法提取病原菌菌丝的DNAꎮ采用真菌通用引物对ITS1/ITS4进行PCR扩增ꎬ将获得的DNA片段进行1%的琼脂糖凝胶电泳检验ꎮPCR产物的纯化和测序由武汉擎科创新生物有限科技公司完成ꎬ将所得序列与GenBank(http://www.ncbi.nlm.nih.gov)中核酸数据进行BLAST分析ꎬ利用VectorNTIAdvance11进行比对ꎬ通过MEGA5.0进行UPGMA分析生成系统发育树ꎮ通过同源性分析ꎬ对病原菌菌种进行分子水平鉴定(李若瑜等ꎬ2002)ꎮ1.2.5中药材提取物对根腐病病原菌的抑制效应㊀把7种备试中药材于烘箱中60ħ烘干ꎬ粉碎ꎬ过40目筛(孔径0.425mm)ꎬ密封后于-20ħ下保存待用ꎮ将乙醇作为溶剂ꎬ采用3次振荡浸提法提取(韩建华等ꎬ2002)ꎬ合并3次滤液进行减压浓缩至质量浓度为1g mL ̄1ꎬ密封后于4ħ冰箱中保存ꎮ采用菌丝生长速率法(吴文君ꎬ1988)测定中药材提取液对白及根腐病致病菌的抑制效果ꎮ取质量浓度1g mL ̄1的中药提取液加入PDA培养基中ꎬ摇匀ꎬ参照前人的浓度设计梯度制成浓度分别为0.05㊁0.1㊁0.2g mL ̄1的带药平板(马伟等ꎬ2010ꎻ刘莹等ꎬ2019)ꎬ以加入无菌水的PDA培养基为空白对照ꎮ选用直径为5mm的打孔器ꎬ打取菌落边缘的菌饼ꎬ接种于带药平板上ꎬ每组处理重复3次ꎬ于25ħ恒温下培养ꎮ培养48hꎬ每隔24h用十字交叉法测量菌落直径ꎬ连续记录7次结果ꎬ计算抑制生长率ꎮ计算公式:抑制生长率=[(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径5.0mm)]ˑ100%ꎮ2㊀结果与分析2.1病原菌的分离根据田间症状ꎬ初步判断为根腐病或叶斑病ꎮ从感病植株的叶片㊁叶鞘和块茎的病健交界处分别取样ꎬ分离病原菌ꎬ共分离出病原菌18株(真菌14株㊁细菌4株)ꎮ其中ꎬ从叶片中分离得到2株真菌和1株细菌ꎬ从叶鞘中分离得到9株真菌和2株细菌ꎬ从块茎中分离得到3株真菌和1株细菌ꎬ这说明分离的菌种相对较多且较为复杂ꎬ但不同组织部位均没有分离到霉菌ꎮ真菌编号为GF ̄1~GF ̄14ꎬ细菌编号为GB ̄1~GB ̄4ꎬ其中GF ̄1和GF ̄7在叶片㊁叶鞘以及块茎中均能分离得到ꎮ图2:A示部分分离的菌株ꎮ2.2病原菌的致病性测定分别对18株菌株进行室内回接ꎬ接种3d后观察ꎬ发现真菌GF ̄1㊁GF ̄4㊁GF ̄5和GF ̄7出现较明显的致病症状(图2:B)ꎬ6d后统计发病率(表1)ꎮ对室内接种发病率较高的GF ̄1㊁GF ̄4㊁GF ̄5和GF ̄7等进行田间回接ꎬ发现仅GF ̄1接种部位呈现黑斑㊁有烧焦状㊁中间部位干枯(图3:A)ꎬ室内回接有明显的黄色晕斑(图2:B中的GF ̄1)ꎬ切开根茎后有腐烂(图2:C)ꎬ与田间采取病株时的病害症状基本一致ꎻ其他菌株因致病病斑和对照组没有继续扩大或者无感病症状而接种部位干枯(图3:B-E)ꎮ从接种GF ̄1的发病组织中重新分离获得的病原菌ꎬ经纯化培养后与接种的病原菌完全一致ꎬ符合柯赫式法则ꎬ这充分表明分离获得的病原菌为该病的致病菌ꎮ2.3病原菌形态学鉴定病原菌GF ̄1在PDA培养基上ꎬ于25ħ恒温条件下培养5dꎬ长出白色绒絮状菌落ꎬ菌丝匍匐向外㊁向上生长ꎬ气生ꎬ菌落絮状ꎬ白色ꎬ圆形ꎬ菌落背部中心褐色或黑褐色ꎬ周围绿褐色至黄褐色(图4:AꎬB)ꎮ菌丝无色ꎬ生长较快ꎬ有隔膜ꎬ直径为3.2~6.9μmꎬ其分生孢子梗多分枝ꎻ厚垣孢子为长方形或椭圆形ꎬ大小为(6.5~9.6)μmˑ(6.5~7.1)μmꎬ分生孢子散生ꎬ呈卵形ꎬ大小为(5.3~8.9)μmˑ(1.4~3.6)μm(图4:CꎬD)ꎮ菌落培养5d后直径为5.2~7.0cm(培养皿Φ=90mm)ꎮ对照中国真菌志没有发现类似的真菌种类ꎬ经查阅相关文献资料(Aveskampetal.ꎬ2010)ꎬ初步判断GF ̄1病原菌为附球菌属病原菌ꎮ2.4病原菌ITS区的序列系统发育分析对菌株GF ̄1的ITSrDNA的PCR扩增产物进行测序㊁校对㊁剪切和拼接ꎬ获得全长为552bp的序列ꎮ将序列与GenBank中的相关数据进行一致性分析ꎬ结果表明菌株GF ̄1的ITS序列(TSB1G643013)与甘蔗的高粱附球菌(E.sorghinumꎬMN493119.1)序列一致性最高ꎬ为99.62%ꎬ而与白及中分离的843广㊀西㊀植㊀物44卷A.分离的4个菌株ꎻB.4个菌株室内回接ꎻC.GF ̄1室内回接块茎ꎻD.对照块茎ꎮA.FourisolatedstrainsꎻB.ReinoculationoffourstrainsintheroomꎻC.ReinoculationofGF ̄1oftubersintheroomꎻD.Controlintubers.图2㊀白及病原菌室内回接Fig.2㊀ReinoculationpathogenofBletillastriataintheroomA.GF ̄I田间回接ꎻB.GF ̄4田间回接ꎻC.GF ̄5田间回接ꎻD.GF ̄7田间回接ꎻE.田间回接对照ꎮA.ReinoculationofGF ̄1inthefieldꎻB.ReinoculationofGF ̄4inthefieldꎻC.ReinoculationofGF ̄5inthefieldꎻD.ReinoculationofGF ̄7inthefieldꎻE.Reinoculationofcontrolinthefield.图3㊀白及病原菌田间回接Fig.3㊀ReinoculationpathogenofBletillastriatainthefiled高粱附球菌(E.sorghinumꎬMF948994.1)序列一致性为98.88%ꎮ将这些序列利用MEGA5.0构建系统进化树ꎬ该序列与甘蔗分离的高粱附球菌(E.sorghinumꎬMN493119.1)聚为同一族ꎬ亲缘关系最近ꎬ与已分离鉴定的白及高粱附球菌(E.sorghinumꎬMF948994.1)的亲缘关系相对较远ꎬ后者与烟草高粱附球菌(E.sorghinumꎬKJ767080.1)聚为同一族ꎬ这可能是因致病菌自身容易变异而引起的ꎬ这些病原菌在分子进化方向上存在一定差异(图5)ꎮ2.5中药材提取物对白及根腐病致病菌的抑制效果中药材提取物对根腐病致病菌的抑制效果如图6和表2所示ꎮ与含无菌水培养的菌落(对照)相比ꎬ培养基中分别含有0.1㊁0.2g mL ̄1的7种中药材提取物能够完全抑制GF ̄1菌落的生长ꎮ当培养基中添加低浓度(0.05g mL ̄1)的提取物时ꎬ肉桂和丁香提取物仍能完全抑制菌落的生长ꎬ八角提取物抑制菌的生长率达到99.6%ꎻ而低浓度的青钱柳㊁白及㊁厚朴和蛇床子却不能完全抑制菌9432期马晓雅等:白及根腐病病原菌的鉴定及抑制效应研究表1㊀部分菌株接种白及叶片6d后的发病率Table1㊀IncidenceinleavesofBletillastriataafterinoculationforsixdaysbysomestrains菌株编号Strainaccessionnumber室内回接发病率Incidenceofreinoculationintheroom(%)田间回接发病率Incidenceofreinoculationinthefield(%)对照CK00GF ̄1100.0100.0GF ̄366.70GF ̄4100.025.0GF ̄5100.033.3GF ̄666.70GF ̄7100.040.0落生长ꎬ菌落直径分别为13.8㊁25.6㊁6.6㊁9.9mmꎬ抑制生长率分别为82.4%㊁58.8%㊁96.8%㊁90.2%ꎮ3㊀讨论与结论3.1白及根腐病病原菌的鉴定根腐病是由腐霉㊁镰刀菌㊁疫霉等多种病原菌侵染引起的一种病害ꎮ根腐病病原菌首先引起根部腐烂ꎬ造成根部水分和养分的吸收功能逐渐减弱ꎬ随后导致整株叶片发黄㊁枯萎ꎬ最后全株死亡ꎮ除了这些典型特征外ꎬ本研究还发现白及根腐病会导致白及的茎基部和叶鞘出现褐色长条形斑块ꎬ这一特点与曾令祥等(2012)报道的丝核菌属A.菌落正面ꎻB.菌落反面ꎻC.厚垣孢子ꎻD.分生孢子ꎮ标尺:CꎬD=50μmꎮA.FrontofcolonyꎻB.BackofcolonyꎻC.ChlamydosporeꎻD.Conidia.Scalebars:CꎬD=50μm.图4㊀菌株GF ̄1的形态特征Fig.4㊀MorphologicalcharacteristicsofstrainGF ̄1图5㊀菌株GF ̄1及其近缘种聚类分析的树状图Fig.5㊀PhylogenetictreeofstrainGF ̄1anditshomologuesspeciesbasedonITSsequences病原菌(Rhizoctoniasp.)引起白及块茎腐烂病症状相似ꎮ根腐病发病率高ꎬ对药材产量和品质危害很大ꎬ目前已成为影响三七㊁白术㊁黄芪等多种药用植物生产的主要病害ꎬ并发现镰刀属真菌为主要病原菌(沈清清等ꎬ2014)ꎮ孙乐乐等(2013)报道ꎬ引起云南地区白及根腐病的病原菌是尖孢镰刀菌(Fusariumoxysporum)和腐皮镰刀菌(F.solani)ꎻ宋莉沙(2019)鉴定了贵州地区白及根腐053广㊀西㊀植㊀物44卷1㊁2㊁3分别表示浓度为0.05㊁0.1㊁0.2g mL ̄1ꎻA㊁B㊁C㊁D㊁E㊁F㊁G分别表示青钱柳㊁白及㊁厚朴㊁八角㊁肉桂㊁蛇床子和丁香ꎻCK表示对照ꎮ1ꎬ2ꎬ3indicatetheconcentrationof0.05ꎬ0.1ꎬ0.2g mL ̄1ꎬrespectivelyꎻAꎬBꎬCꎬDꎬEꎬFꎬGindicateCyclocaryapaliurusꎬBletillastriataꎬHoupoeaofficinalisꎬIlliciumverumꎬCinnamomumcassiaꎬCnidiummonnieriandSyringaoblateꎬrespectivelyꎻCKindicatescontrol.图6㊀不同中药材提取物对菌株GF ̄1的抑制效应Fig.6㊀InhibitingeffectsofdifferenttraditionalChinesemedicineextractstostrainGF ̄1病致病菌是腐皮镰刀菌(F.solani)ꎮ本研究通过调查㊁致病菌分离ꎬ结合形态学和分子序列鉴定ꎬ发现引起广西桂林地区白及根腐病的致病菌与前人(Perelló&Morenoꎬ2005ꎻAldoetal.ꎬ2010ꎻOliveiraetal.ꎬ2017ꎻ朱香ꎬ2018ꎻZhouetal.ꎬ2018)的报道不同ꎬ鉴定为附球菌属真菌高粱附球菌(Epicoccumsorghinum)ꎮ该病菌鉴定时间较晚ꎬ国内于2018年后才逐渐报道ꎬ引起多种园艺植物叶斑病㊁褐斑病或环斑病(Yuetal.ꎬ2019ꎻLaureletal.ꎬ2021)ꎮ该致病菌引起白及叶斑病(Zhouetal.ꎬ2018)的叶片出现褐色斑块ꎬ周围有黄色晕圈ꎻ而本研究发现该病菌早期引起白及地下块茎腐烂ꎬ有腥臭味ꎬ后期导致茎基部和叶鞘基部长条形灰褐色斑块ꎬ斑块中央呈干枯状㊁周围黄色晕圈ꎻ而分子序列聚类则不是同一族ꎬ亲缘关系相对较远ꎬ这说明可能属于不同生理小种引起的不同病害ꎮ3.2中草药提取物对白及根腐病病原菌的抑制效应化学农药常用于药用植物根腐病的防治ꎬ虽然具有疗效快㊁操作方便㊁价格低廉等优点ꎬ但易造成农药残留量超标ꎬ从而影响药材的品质ꎻ而植物源杀菌剂具有安全无毒害的作用ꎬ但控制药用植物根腐病的效果较慢ꎬ并且易受环境影响(穆向荣等ꎬ2014)ꎮ丁香酚是丁香提取物的主要成分ꎬ通过干扰微生物的细胞膜结构起到抗菌作用(于未博ꎬ2020)ꎻ北细辛主要化学成分为萜类化合物ꎬ具有提高免疫力功能㊁抗菌等功效ꎬ蛇床子主要成分蛇床子素具有较好的速效性(马伟ꎬ2010ꎻ肖瑶ꎬ2019)ꎻ刘莹等(2009)发现厚朴主要活性成分厚朴酚具有抗炎抗菌等作用ꎻ赵庆芳等(2011)发现同种物质丙酮溶液的抑菌效果明显好于水溶液ꎮ高粱附球菌(E.sorghinum)能分泌一种类似于苯乙酸1532期马晓雅等:白及根腐病病原菌的鉴定及抑制效应研究表2㊀不同中药材提取物对菌株GF ̄1的抑制效果Table2㊀InhibitingeffectsofdifferenttraditionalChinesemedicineextractsonthestrainGF ̄1中药材TraditionalChinesemedicine浓度Concentration(g mL ̄1)菌落直径Diameterofcolony(mm)抑制生长率Resistingrate(%)青钱柳Cyclocaryapaliurus0.0513.882.40.105.01000.205.0100白及Bletillastriata0.0525.658.80.105.01000.205.0100厚朴Houpoeaofficinalis0.056.696.80.105.01000.205.0100八角Illiciumverum0.055.299.60.105.01000.205.0100肉桂Cinnamomumcassia0.055.01000.105.01000.205.0100蛇床子Cnidiummonnieri0.059.990.20.105.01000.205.0100丁香Syringaoblata0.055.01000.105.01000.205.0100对照CK0.0555.000.1057.900.2055.00的毒素ꎬ不仅具有很强的致病性(朱香ꎬ2018)ꎬ而且该病原菌寄主范围广泛ꎬ易感染葫芦科㊁豆科㊁十字花科㊁杨柳科㊁禾本科㊁马齿苋科㊁百合科及天南星科的植物(李润根等ꎬ2020)ꎮ目前ꎬ未见有关该致病菌的生物防治研究ꎮ本研究利用乙醇提取了7种中药材的提取物ꎬ观察了对白及致病病原菌的室内抑制作用ꎬ发现0.1g mL ̄1和0.2g mL ̄1的青钱柳㊁白及㊁厚朴㊁八角㊁肉桂㊁蛇床子㊁丁香的提取物均能完全抑制高粱附球菌(E.sorghinum)的生长ꎬ0.05g mL ̄1的八角㊁肉桂和丁香的提取物也基本能完全抑制生长ꎬ抑制生长率达到99.6%或100%ꎮ因此ꎬ这些中药材提取物室内抑制菌的生长非常显著ꎬ而室外田间抑制效果以及施用浓度却还有待进一步研究ꎮ参考文献:AVESKAMPMMꎬDEGRUYTERJꎬWOUDENBERGJHCꎬetal.ꎬ2010.HighlightsoftheDidymellaceae:ApolyphasicapproachtocharacterisePhomaandrelatedpleosporaleangenera[J].StudMycolꎬ65:1-60.ALDOAꎬMLDECꎬBARBOSANETOIJFꎬetal.ꎬ2010.PhomasorghinaꎬanewpathogenassociatedwithphaeosphaerialeafspotonmaizeinBrazil[J].PlantPatholꎬ53:259-259.ChinesePhanmacopoeiaCommissionꎬ2020.PharmacopoeiaofthePeople sRepublicofChina[S].Beijing:ChinaMedicalScienceandTechnologyPress.[国家药典委员会ꎬ2020.中华人民共和国药典一部[S].北京:中国医药科技出版社.]FANGZDꎬ1998.Methodologyforplantpathology[M].3rded.Beijing:ChinaAgriculturePress.[方中达ꎬ1998.植病研究方法[M].第3版.北京:中国农业出版社.]EditoridcommitteeofFloraofChinaꎬ1999.FloraReipublicaePopularisSinicae[M].Beijing:SciencePressꎬ18:50. [«中国植物志»编辑委员会.1999.中国植物志[M].北京:科学出版社ꎬ18:50.]GOUVGMRꎬRIBEIROCꎬDESOUZACFꎬetal.ꎬ2009.Rheologicalbehaviorofboratecomplexandpolysaccharides[J].MatSciEng:Cꎬ(2):607-612.HANJHꎬZHUMJꎬFENGJTꎬetal.ꎬ2002.Screeningstudiesonfungistasisof27plants[J].JNWA&FUniv(NatSciEd)ꎬ(6):134-137.[韩建华ꎬ祝木金ꎬ冯俊涛ꎬ等ꎬ2002.27种植物抑菌活性初步筛选[J].西北农林科技大学学报(自然科学版)ꎬ(6):134-137.]KESYꎬYANGLYꎬCHENLꎬetal.ꎬ2018.IsolationandidentificationofafungaldiseasefromBletillastriata[J].JYunnanAgricUniv(NatSciEd)ꎬ33(3):405-409.[柯尚艳ꎬ杨林毅ꎬ陈潞ꎬ等ꎬ2018.白及植株上一种真菌病害的分离与鉴定[J].云南农业大学学报(自然科学版)ꎬ33(3):405-409.]LAURELNRꎬDETORRESRLꎬMENDOZAJVSꎬetal.ꎬ2021.IdentificationofEpicoccumsorghinumanditseffectonstalksugaryield[J].SugarTechnolꎬ23:1383-1392.LIRGꎬXUDꎬLIZQꎬ2020.PreliminaryidentifyingonhostrangeofLilypathogenEpicoccumsorghinum[J].JKunmingUnivꎬ42(6):64-67.[李润根ꎬ徐丹ꎬ李子奇ꎬ2020.百合病原菌高粱附球菌寄主范围的初步研究[J].昆明学253广㊀西㊀植㊀物44卷院学报ꎬ42(6):64-67.]LIRYꎬLIDMꎬYUJꎬetal.ꎬ2002.Recentadvancesinmedicalmycology[J].JPekingUniv(HealthSciEd)ꎬ34(5):559-563.[李若瑜ꎬ李东明ꎬ余进ꎬ等ꎬ2002.真菌与真菌病研究近况[J].北京大学学报(医学版)ꎬ34(5):559-563.]LIUGBꎬHUANGZꎬHUANGCGꎬetal.ꎬ2005.FunctionsandapplicationincosmeticsofBletillastriata(Thunb)Reichb.f[J].DetergCosmetꎬ28(8):22-24.[刘光斌ꎬ黄忠ꎬ黄长干ꎬ等ꎬ2005.天然植物白芨胶的功能及在化妆品中的应用[J].日用化学品科学ꎬ28(8):22-24.]LIUYꎬZHOURJꎬFUJFꎬetal.ꎬ2009.StudyontheextractionmethodofantibacterialactiveingredientsofHoupoeaofficinalis[J].JChinMedMatꎬ32(5):791-794.[刘莹ꎬ周如军ꎬ傅俊范ꎬ等ꎬ2009.厚朴抑菌活性成分提取方法研究[J].中药材ꎬ32(5):791-794.]MAWꎬWANGBQꎬMALꎬetal.ꎬ2010.InhibitoryeffectofChinesemedicineextractsonpathogenofAstragalusrootrot[J].BullBotResꎬ30(5):634-636.[马伟ꎬ王宝秋ꎬ马玲ꎬ等ꎬ2010.中药提取物对黄芪根腐病菌的抑制效果[J].植物研究ꎬ30(5):634-636.]MUXRꎬMAYYꎬYANGZZꎬetal.ꎬ2014.Researchadvanceonthecontrolofrootrotdiseaseofmedicalplants[J].PharmClinChinMatMedꎬ5(2):5-8.[穆向荣ꎬ马逾英ꎬ杨枝中ꎬ等ꎬ2014.药用植物根腐病防治的研究进展[J].中药与临床ꎬ5(2):5-8.]OLIVEIRARCꎬDAVENPORTKWꎬHOVDEBꎬetal.ꎬ2017.DraftgenomesequenceofsorghumgrainmoldfungusEpicoccumsorghinumꎬaproduceroftenuazonicacid[J].GenomeAnnouncꎬ5:e01495-01496.PERELL AEꎬMORENOMVꎬ2005.FirstreportofPhomasorghina(Sacc.)BoeremaDorenbosch&vanKestonwheatleaves(TriticumaestivumL.)inArgentina[J].Mycopathologiaꎬ159:75-78.SHENQQꎬLIUFꎬHUYꎬ2014.Researchprogressofpathogensofrootrotdiseaseonmedicinalplants[J].NHorticꎬ(11):187-190.[沈清清ꎬ刘芳ꎬ胡彦ꎬ2014.药用植物根腐病病原菌研究进展[J].北方园艺ꎬ(11):187-190.]SHIJꎬ2010.ResourcesandmedicinalutilizationofBletilla(Orchidaceae)[D].Haikou:HainanUniversity.[石晶ꎬ2010.白芨属植物资源与利用[D].海口:海南大学.]SONGLSꎬ2019.StudiesonpathogenidentificationanddiseasecontrolofmajorfungaldiseasesonBletillastriata[D].Guiyang:GuizhouUniversity.[宋莉莎ꎬ2019.白及主要真菌病害病原鉴定及防治研究[D].贵阳:贵州大学.]SUNLLꎬYANGYHꎬLIUJKꎬetal.ꎬ2013.Bletillastriatapseudobulbrotpathogenidentificationanditsbiologicalcharacteristic[J].JChinMedMatꎬ36(3):341-345.[孙乐乐ꎬ杨永红ꎬ刘军凯ꎬ等ꎬ2013.白及根腐病病原鉴定和生物学特性研究[J].中药材ꎬ36(3):341-345.]WUWJꎬ1988.Introductiontoexperimentaltechniquesinphytochemicalprotection[M].Xi an:ShaanxiScienceandTechnologyPress.[吴文君ꎬ1988.植物化学保护实验技术导论[M].西安:陕西科学技术出版社.]XIAOYꎬ2019.ImprovedmethodtoobtainessentialoilfromtherootsandrhizomesofAsarumheteropoidesFr.Schmidtvar.mandshuricum(Maxim.)Kitag.usingmicrowave ̄assistedsteamdistillationandantifungalactivityoftheessentialoilagainstFusariumspp.invitro[D].Harbin:NortheastForestryUniversity.[肖瑶ꎬ2019.北细辛精油的微波水上蒸馏法提取及对黄芪根腐致病菌的抑制活性的研究[D].哈尔滨:东北林业大学.]YULꎬSHEXMꎬLANGBꎬetal.ꎬ2019.FirstreportofleafspotcausedbyEpicoccumsorghinumonChinesefloweringcabbage(Brassicaparachinensis)inChina[J].PlantDisꎬ103(11):2966.YUWBꎬ2020.InhibitoryeffectandmechanismofeugenolonPanaxnotoginsengrootrotfungi[D].Kunming:KunmingUniversityScienceandTechnology.[于未博ꎬ2020.丁香酚对三七根腐病真菌的抑制作用及其机理研究[D].昆明:昆明理工大学.]ZENGLXꎬYANGLꎬCHENYYꎬetal.ꎬ2012.InvestigationandintegratedmanagementondiseasesandpestsforBletillastriatainGuizhou[J].GuizhouAgricSciꎬ40(7):106-108.[曾令祥ꎬ杨琳ꎬ陈娅娅ꎬ等ꎬ2012.贵州中药材白及病虫害种类的调查与综合防治[J].贵州农业科学ꎬ40(7):106-108.]ZHAOQFꎬCHENJꎬLIQXꎬetal.ꎬ2011.InhibitioneffectsofdifferentmonomersubstancesonthegrowthofAstragalusmembranaceusrootrot[J].JLanzhouUniv(NatSciEd)ꎬ47(2):83.[赵庆芳ꎬ陈健ꎬ李巧峡ꎬ等ꎬ2011.不同物质对黄芪根腐病致病菌的抑制作用[J].兰州大学学报(自然科学版)ꎬ47(2):83.]ZHOUHꎬLIUPPꎬQIUSꎬetal.ꎬ2018.IdentityofEpicoccumsorghinumcausingleafspotdiseaseofBletillastriatainChina[J].PlantDisꎬ102(5):1039.ZHUJꎬHUANGWCꎬCAOJGꎬetal.ꎬ2020.EvaluationandselectionofBletillaspeciesthroughAHPmethod[J].ChinJTropCropꎬ41(8):1553-1559.[朱娇ꎬ黄卫昌ꎬ曹建国ꎬ等ꎬ2020.我国白及属植物资源评价及其筛选[J].热带作物学报ꎬ41(8):1553-1559.]ZHUXꎬ2018.IsolationofEpicoccumsorlghinumandresistanceidentificationofmulti ̄transgenesmaizelines[D].Wuhan:HuazhongAgriculturalUniversity.[朱香ꎬ2018.Epicoccumsorghinum的分离及多基因转玉米株系的抗性鉴定[D].武汉:华中农业大学.](责任编辑㊀蒋巧媛)3532期马晓雅等:白及根腐病病原菌的鉴定及抑制效应研究。
17种植物水提物对黄芪根腐病菌的抑制活性初步研究

17种植物水提物对黄芪根腐病菌的抑制活性初步研究赵庆芳;赵培强;郭鹏辉;李巧峡;韩静【摘要】[目的]为黄芪与其他农作物和中草药合理轮作提供理论依据.[方法]以17种植物不同部位的水提物为供试材料,采用琼胶平板法,测定其对引起黄芪根腐病的2种优势菌--尖镰孢菌和腐皮镰孢菌的抑制活性.[结果]洋葱(球茎)、玉米(根、茎、叶)、小麦(全株)、苦豆子(全株),苦参(根)、黄连(根)、苍耳子(果)、黄芩(根、叶)和板蓝根(全株)等9种植物的水提物对2种优势菌的菌丝生长有较强抑制作用,而葱(茎),大蒜(茎)、韭菜(叶)、马铃薯(茎、叶)、甘草(根)、大黄(根、叶)、麻黄(根)、党参(根)等8种植物水提物的抑制作用则不明显;不同植物水提物对2种供试真菌活性的抑制存在明显的浓度效应,当植物水提物质量浓度为0.05 g/mL时,大蒜、韭菜、葱水提物对尖镰孢菌菌丝的生长有一定促进作用.[结论]洋葱、玉米、小麦、苦豆子、苦参、黄连、苍耳子、黄芩和板蓝根可以与黄芪进行轮作,有利于防治黄芪根腐病.【期刊名称】《西北农林科技大学学报(自然科学版)》【年(卷),期】2009(037)003【总页数】5页(P163-167)【关键词】植物水提物;根腐病;抑菌作用;植物源杀菌剂【作者】赵庆芳;赵培强;郭鹏辉;李巧峡;韩静【作者单位】西北师范大学,生命科学学院,甘肃,兰州,730070;西北师范大学,生命科学学院,甘肃,兰州,730070;西北师范大学,生命科学学院,甘肃,兰州,730070;西北师范大学,生命科学学院,甘肃,兰州,730070;西北师范大学,生命科学学院,甘肃,兰州,730070【正文语种】中文【中图分类】S482.2+92黄芪为豆科黄芪属多年生草本植物,其主要品种有蒙古黄芪(Astragalus membranaceus(Fisch.) Bge.var.monghaalicus(Bge.) Hsiao)和膜荚黄芪(Astragalus membranaceus(Fisch) Bge)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蒙古黄芪根腐病病原菌的分离鉴定及药剂筛选防治研究
蒙古黄芪是一种重要的中药材,具有广泛的药用价值。
然而,近年来蒙古黄芪的种植遭遇到了根腐病的严重威胁,导致产量和品质的下降。
为了有效防治蒙古黄芪根腐病,我们开展了分离鉴定病原菌并进行药剂筛选的研究。
首先,我们从受感染的蒙古黄芪根部样品中分离出病原菌。
通过观察菌落形态、细胞形态以及生理生化特性,我们初步确定了病原菌为革兰氏阴性细菌。
接着,我们进行了进一步的鉴定工作,包括形态特征观察、生化试剂反应测试和16S rRNA
基因序列分析。
最终,我们确认病原菌为一种属于假单胞菌属(Pseudomonas) 的细菌。
为了寻找有效的防治方法,我们对多种药剂进行了筛选。
我们选取了常用的农药和天然植物提取物,考察了它们对蒙古黄芪根腐病病原菌生长的抑制作用。
结果显示,其中一种植物提取物对病原菌的抑制效果最好。
这种植物提取物具有广谱抗菌作用,且对蒙古黄芪无毒副作用,是一种潜在的天然防治剂。
为了进一步验证这种天然植物提取物的防治效果,我们进行了田间试验。
首先,在感染蒙古黄芪的土壤中添加了这种植物提取物,然后观察蒙古黄芪的生长情况和病情发展。
结果显示,添加这种植物提取物的土壤中,蒙古黄芪的株高和地上部鲜重显著增加,同时根腐病发病率明显降低。
这表明这种植物提取物具有显著的防治效果,能够有效抑制蒙古黄芪根腐病的发生。
我们进一步对这种植物提取物进行了深入研究,分析了其主要成分和抗菌机制。
结果显示,这种植物提取物富含挥发性油脂和多种次生代谢产物,这些物质具有抗菌和增强植物自身
免疫力的作用。
此外,这种植物提取物还可以诱导植物产生一系列抗菌酶和活性氧物质,对病原菌产生直接杀伤作用。
综上所述,我们成功分离鉴定了蒙古黄芪根腐病的病原菌,并筛选出一种有效的天然植物提取物用于防治。
这项研究为蒙古黄芪根腐病的防治提供了重要的理论和实践基础,也为其他类似病害的防治提供了有益的借鉴。
我们相信,在进一步研究和实践的推动下,蒙古黄芪产业将会得到更好的发展和保护
综上所述,我们的研究表明,这种天然植物提取物对蒙古黄芪根腐病具有显著的抑制效果。
田间试验结果显示,添加这种植物提取物的土壤中,蒙古黄芪的生长情况得到显著改善,根腐病发病率明显降低。
进一步的研究发现,这种植物提取物富含抗菌物质和增强植物免疫力的成分,并且能够促使植物产生抗菌酶和活性氧物质。
因此,这种植物提取物具有潜在的天然防治剂的特性。
这项研究为蒙古黄芪根腐病的防治提供了理论和实践基础,也为其他类似病害的防治提供了有益的借鉴。
我们相信,在进一步研究和实践的推动下,蒙古黄芪产业将会得到更好的发展和保护。
