高中化学 每日一题 钢铁的电化学腐蚀 新人教版
人教版高中化学选修4练习:第四章第四节金属的电化学腐蚀与防护 Word版含答案_最新修正版

第四章电化学基础第四节金属的电化学腐蚀与防护1.关于金属腐蚀的叙述中,正确的是()A.金属被腐蚀的本质是M+n H2O===M(OH)n+n2H2↑B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀D.常温下,置于空气中的金属主要发生化学腐蚀解析:金属腐蚀的本质主要是金属原子失电子被氧化,腐蚀的内因是金属的化学性质比较活泼,外因是金属与空气、水和其他腐蚀性的物质相接触,腐蚀主要有化学腐蚀和电化学腐蚀。
A中金属腐蚀的本质应包括化学腐蚀和电化学腐蚀,为M-n e-===M n+;B选项中Sn、Fe构成电化学腐蚀,主要是Fe-2e-===Fe2+,铁先被腐蚀。
常温下,空气中的金属主要发生电化学腐蚀中的吸氧腐蚀,难以和非金属氧化剂(Cl2、S)等反应,发生化学腐蚀。
答案:C2.下图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和饱和硫酸氢钠溶液,各加入生铁块,放置一段时间。
下列有关描述错误的是()A.生铁块中的碳是原电池的正极B.红墨水水柱两边的液面变为左低右高C.两试管中相同的电极反应式是Fe-2e-===Fe2+D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀解析:a、b试管中均发生铁的电化学腐蚀,在食盐水中的Fe发生吸氧腐蚀,正极为碳:2H2O+O2+4e-===4OH-,负极为铁:2Fe -4e-===2Fe2+,由于吸收O2,a管中气压降低;b管中的电解质溶液是显酸性的硫酸氢钠溶液,故发生析氢腐蚀,正极:2H++2e-===H2↑,负极:Fe-2e-===Fe2+,由于放出氢气,b管中气压增大,故U形管中的红墨水应是左高右低,B选项错误。
答案:B3.相同材质的铁在下图中各情形下最不易被腐蚀的是()解析:A中,食醋作电解质溶液,铁勺和铜盆是相互接触的两个金属极,形成原电池,铁是活泼金属作负极;B中,食盐水作电解质溶液,铁炒锅和铁铲都是铁碳合金,符合原电池形成条件,铁是活泼金属作负极,碳作正极;C中,铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀;D中,酸雨作电解质溶液,铁铆钉和铜板分别作负极、正极,形成原电池。
金属的电化学腐蚀与防护(基础)【化学人教版高中(新课标)同步测试】
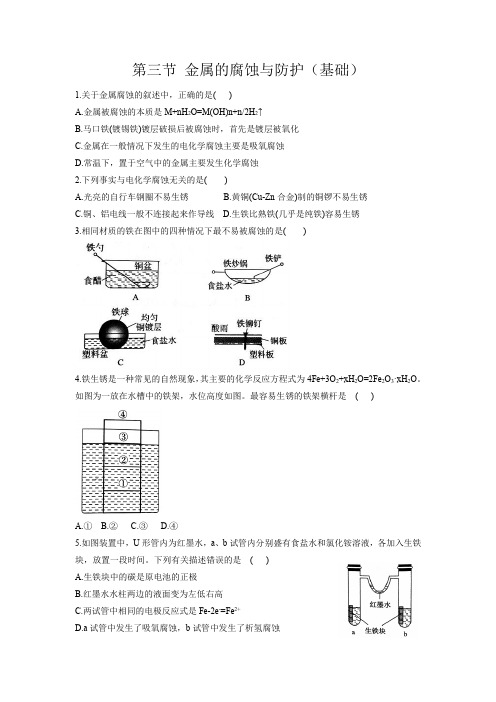
第三节金属的腐蚀与防护(基础)1.关于金属腐蚀的叙述中,正确的是( )A.金属被腐蚀的本质是M+nH2O=M(OH)n+n/2H2↑B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀D.常温下,置于空气中的金属主要发生化学腐蚀2.下列事实与电化学腐蚀无关的是( )A.光亮的自行车钢圈不易生锈B.黄铜(Cu-Zn合金)制的铜锣不易生锈C.铜、铝电线一般不连接起来作导线D.生铁比熟铁(几乎是纯铁)容易生锈3.相同材质的铁在图中的四种情况下最不易被腐蚀的是( )4.铁生锈是一种常见的自然现象,其主要的化学反应方程式为4Fe+3O2+xH2O=2Fe2O3·xH2O。
如图为一放在水槽中的铁架,水位高度如图。
最容易生锈的铁架横杆是( )A.①B.②C.③D.④5.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。
下列有关描述错误的是( )A.生铁块中的碳是原电池的正极B.红墨水水柱两边的液面变为左低右高C.两试管中相同的电极反应式是Fe-2e-=Fe2+D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀6.下列有关金属的保护方法的说法中正确的是( )A.常使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀仍很慢C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极法D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法7.结合如图判断,下列叙述正确的是( )A.I和Ⅱ中正极均被保护B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀8.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。
观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。
2020高中化学 第04章 电化学基础 专题4.4 金属的电化学腐蚀与防护试题 新人教版选修4

精品4-4 金属的电化学腐蚀与防护一、金属的电化学腐蚀 1.金属腐蚀:(1)概念:金属与周围的__________________物质发生氧化还原反应而引起损耗的现象。
(2)本质:金属本身失去电子变成阳离子的过程(发生________反应):M −ne− Mn+ 。
(3)金属腐蚀的类型。
①化学腐蚀 金属跟接触到的_______________(如SO2、Cl2、O2等)或_______________液体(如石油)等直接发生化学反 应而引起的腐蚀。
②电化学腐蚀 不纯的金属与电解质溶液接触时,会发生________反应,比较活泼的金属失去电子被________的腐蚀。
电化 学腐蚀比化学腐蚀更普遍,危害更大。
2.钢铁的电化学腐蚀: (1)腐蚀类型钢铁的析氢腐蚀示意图类型析氢腐蚀钢铁的吸氧腐蚀示意图 吸氧腐蚀发生条件水膜酸性较强水膜弱酸性、中性或碱性正极反应 负极反应总反应2H++2e− H2↑ Fe−2e− Fe2+ Fe+2H+ Fe2++H2↑O2+2H2O+4e− 4OH− 2Fe−4e− 2Fe2+2Fe+O2+2H2O 2Fe(OH)2最 终 生 成 铁 锈 ( 主 要 成 分 为 Fe2O3•xH2O) , 反 应 如 下 : _______________________ , 2Fe(OH)3 Fe2O3•xH2O+(3−x)H2O(2)钢铁的吸氧腐蚀实验 实验操作实验现象精品实验结论导管中____________________,铁 装置中铁、碳和饱和食盐水构成原钉表面有________生成电池,铁钉发生________腐蚀二、金属的防护 1.金属的电化学防护:(1)牺牲阳极的阴极保护法:利用________原理,让被保护金属作________,另找一种活泼性较强的金属作 ________。
如图所示:用实验验证牺牲阳极的阴极保护法: 实验名称验证牺牲阳极的阴极保护法实验装置实验原理 实验用品 实验步骤实验现象 实验结论锌电极:Zn-2e- Zn2+; 铁电极:2H++2e- H2↑。
年高中化学第三章第二节金属的腐蚀和防护练习(含解析)新人教版选修1

年高中化学第三章第二节金属的腐蚀和防护练习(含解析)新人教版选修11.钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为( )A.Fe-2e-===Fe2+B.2H++2e-===H2↑C.2H2O+O2+4e-===4OH-D.Fe-3e-===Fe3+答案:C2.下列事实中,与电化学腐蚀无关的是( )A.在空气中,光亮的银表面逐渐变暗B.为保护海轮的船壳,常在船壳上镶入锌块C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀D.镀锡的铁制品镀层部分受损后,露出的铁表面易被腐蚀答案:A3.铝广泛应用于电气工业、飞机制造等行业,铝在空气中能稳定存在的原因是( ) A.化学性质稳定B.还原性很强C.不与O2反应D.易与O2形成致密的氧化膜解析:铝易与O2形成致密的氧化膜,保护内部金属不与空气中O2等物质反应,所以铝在空气中能稳定存在。
答案:D4.下列金属防腐的措施中,使用外加电流的阴极保护法的是( )A.水中的钢闸门连接电源的负极B.金属护栏表面涂漆C.汽车底盘喷涂高分子膜D.地下钢管连接镁块答案:A5.如图所示的是铁钉在水中被腐蚀的两种实验结果:(1)当钢铁表面吸附的水膜酸性较强时,所对应装置图可能为______,铁为原电池的________极,其电极反应式为:____________。
碳为原电池的________极,其电极反应式为_______________________________________________________________________。
(2)当钢铁表面吸附的水膜酸性很弱或呈中性时,所对应装置图可能为_____,铁为原电池的_____极,其电极反应式为___________;碳为原电池的________极,其电极反应式为____________________________________________________________________。
高一化学金属的电化学腐蚀与防护试题答案及解析

高一化学金属的电化学腐蚀与防护试题答案及解析1.钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为A.Fe-2e-=Fe2+B.Fe-3e-=Fe3+C.O2+2H2O+4e-=4OH-D.2H++2e-= H2↑【答案】C【解析】钢铁发生吸氧腐蚀时,正极发生的反应是氧气得电子生成氢氧根离子,O2+2H2O+4e-=4OH-,死答案选C。
【考点】考查金属的电化学腐蚀的电极反应式2.各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为()。
A.②①③④B.④③①②C.④②①③D.③②④①【答案】C【解析】②③④实质均为原电池装置。
③中Fe为正极,被保护;②④中Fe为负极,均被腐蚀。
但相对来说,Fe和Cu的金属活动性差别较Fe和Sn的差别大,故Fe—Cu原电池中的Fe被腐蚀得更快;①中不能构成原电池,仅发生化学腐蚀反应。
3.钢铁在某酸雨区的潮湿空气中发生电化学腐蚀,其负极上的反应是A.O2+2H2O+4e-==4OH-B.2H++2e-==H2C.Fe-2e-==Fe2+D.4OH--4e-==2H2O【答案】C【解析】金属的电化学腐蚀中金属都是失去电子,做负极,所以答案选C。
【考点】考查钢铁电化学腐蚀的有关判断点评:该题是基础性试题的考查,也是高考中的常见考点。
主要是考查学生对金属腐蚀的熟悉掌握程度,以及灵活运用原电池原理解决实际问题的能力,有助于培养学生的应试能力,提升学生的学科素养。
4.下列与金属腐蚀有关的说法正确的是( )A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的【答案】B【解析】A.图a中,铁棒发生化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,故A 错误;B图b中开关由M置于N,Cu-Zn作正极,腐蚀速率减小,故B正确;C.图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,故C错误;D.图d中干电池放电时MnO2发生还原反应,体现还原性,故D错误。
2020高中化学 第四章 电化学基础 第四节 金属的电化学腐蚀与防护课后提升练习(含解析)新人教版选修4

金属的电化学腐蚀与防护[A篇对点强化训练]知识点一金属的电化学腐蚀1.钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法不正确的是( )A.此过程中可能涉及反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3B.钢铁被腐蚀的负极反应式为Fe-3e-===Fe3+C.钢铁设备上连接锌块可以防止腐蚀D.钢铁与外加直流电源的负极相连可以防止腐蚀答案 B解析钢铁发生电化学腐蚀的负极反应式为Fe-2e-===Fe2+,故B错误。
2.下列说法中错误的是( )A.黄铜制作的铜锣不易产生铜绿B.生铁比软铁芯更容易生锈C.铁质器件附有铜质配件,在接触处易生铁锈D.合金都比纯金属易被腐蚀答案 D解析黄铜中的锌、铜可以形成原电池,使铜受到保护,A项正确;生铁易形成原电池,而软铁芯(纯铁)不易形成原电池,B项正确;铁与铜易形成原电池,C项正确;不锈钢属于合金,但它不易生锈,D项错误。
3.我国某大城市某年夏季多次降下酸雨。
据环保部门测定,该城市整个夏季酸雨的pH 平均值为 3.2。
在这种环境中的铁制品极易被腐蚀。
对此条件下铁的腐蚀的叙述不正确的是( )A.此腐蚀过程有化学腐蚀也有电化学腐蚀B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-===4OH-C.在化学腐蚀过程中有氢气产生D.发生电化学腐蚀时的负极反应为Fe-2e-===Fe2+答案 B解析酸性环境发生的腐蚀为析氢腐蚀,其正极反应为2H++2e-===H2↑。
4.下列有关说法中正确的是( )A.在空气中纯银器表面因发生电化学腐蚀而渐渐变暗B.输油管道内在有原油中的含硫化合物参与情况下的腐蚀属于电化学腐蚀C.钢柱在水下部分比在空气与水交界处更容易腐蚀D.在金属器械上涂植物油可以预防金属腐蚀答案 D解析纯银器不能形成原电池,不会发生电化学腐蚀,A错误;输油管道内的腐蚀属于化学腐蚀,B错误;空气与水交界处氧气充足,易发生电化学腐蚀,C错误;D项操作可有效地将金属与空气隔绝开,D正确。
2024_2025学年高中化学课堂同步系列二每日一题金属的腐蚀含解析新人教版选修4

金属的腐蚀高考频度:★★★★☆难易程度:★★★☆☆下列有关金属腐蚀的说法中正确的是A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程C.钢铁腐蚀最普遍的是吸氧腐蚀,负极汲取氧气,产物最终转化为铁锈D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生【参考答案】D化学腐蚀与电化学腐蚀的区分与联系化学腐蚀电化学腐蚀(主要)定义金属与接触到的物质(一般是单质或非电解质)干脆发生化学反应而引起的腐蚀不纯金属(或合金)与接触到的电解质溶液所发生的原电池反应,较活泼金属原子失去电子而被氧化引起的腐蚀吸氧腐蚀(主要) 析氢腐蚀条件金属与非电解质干脆接触水膜中溶有O2,呈极弱水膜酸性较强酸性或中性现象无电流产生有微弱电流产生反应式(以铁腐蚀为例) 2Fe+3Cl 2===2FeCl3负极:Fe-2e-===Fe2+正极:2H2O+O2+4e-===4OH-正极:2H++2e-===H2↑联系两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍,危害更大1.下列关于金属腐蚀的说法正确的是A.金属在潮湿空气中腐蚀的实质是M+n H2O===M(OH)n+H2↑B.金属的化学腐蚀的实质是M-n e-===M n+,电子干脆转移给氧化剂C.金属的化学腐蚀必需在酸性条件下进行D.在潮湿的环境中,金属的电化学腐蚀肯定是析氢腐蚀2.下列事实与电化学原理无关的是A.金属铝在空气中不易被腐蚀B.铁制器件在潮湿空气中生锈C.镀锌铁片比镀锡铁片更耐腐蚀D.远洋海轮的外壳连接锌块可爱护轮船不受腐蚀3.如图所示,试管中放一铁钉,溶液为氯化钠溶液,数天后视察到的现象有。
说明铁钉发生了腐蚀,其中正极的电极反应式为,溶液中发生反应的化学方程式为。
4.金属腐蚀是金属材料运用过程中的一种普遍现象。
(1)金属腐蚀的本质是的过程。
用铝饭盒盛放醋酸,一段时间后饭盒被腐蚀,这种腐蚀属于,若用铝饭盒盛放食盐水,一段时间后,饭盒被腐蚀,这种腐蚀属于。
最新人教版高中化学《金属的电化学腐蚀与防护》教材习题点拨

教材习题点拨1.答案:负2Fe-4e-2Fe2+正O2+2H2O+4e-4OH-或4H++4e-2H2↑2.答案:(1)电化学腐蚀(吸氧腐蚀) Fe、C、NaCl溶液一起组成了原电池,发生了原电池反应(2)2Fe-4e-2Fe2+O2+2H2O+4e-4OH-Fe2++2OH-Fe(OH)2↓,4Fe(OH)2+O2+2H2O4Fe(OH)3,2Fe(OH)3Fe2O3·xH2O+(3-x)H2O3.C4.BD5.AC6.D7.答案:金属跟接触到的干燥气体(如O2、Cl2、SO2)或非电解质液体直接发生化学反应而引起的腐蚀,叫做化学腐蚀。
不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
金属腐蚀造成的危害甚大,它能使仪表失灵,机器设备报废,桥梁、建筑物坍塌,给社会财产造成巨大损失。
8.钢铁的析氢腐蚀与吸氧腐蚀的区别:----9.答案:镀锌铁板更耐腐蚀;分别取两块已破损的镀锌铁板、镀锡铁板,分别浸入NaCl溶液中,一段时间后,镀锡铁板表面有铁锈生成,而镀锌铁板无铁锈生成。
由于镀锡铁板中Fe、Sn和NaCl溶液一起组成了原电池,Fe作负极,Sn作正极,负极:2Fe-4e-2Fe2+,正极:O2+2H2O+4e -4OH-。
反应方程式为:2Fe+O2+2H2O2Fe(OH)2,4Fe(OH)2+O2+2H2O4Fe(OH)3,2Fe(OH)3Fe2O3·xH2O+(3-x)H2O。
而镀锌铁板中Fe、Zn和NaCl溶液一起组成原电池,Zn作负极,Fe作正极,因而无铁锈生成。
点拨:关键是判断出哪种金属作负极。
10.略。
新教材2024高中化学第四章化学反应与电能第三节金属的腐蚀与防护同步测试新人教版选择性必修1

第三节金属的腐蚀与防护【基础巩固】1.下列有关金属腐蚀的说法中正确的是 ( )A.金属的腐蚀肯定伴有电流的产生B.Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀C.发生化学能转化为电能的腐蚀时较活泼的金属总是作正极而被腐蚀D.发生电化学腐蚀时都有能量的转化,且被腐蚀的金属总是失电子解析:金属的腐蚀可分为化学腐蚀和电化学腐蚀,化学腐蚀是金属干脆与氧化剂反应,电子干脆转移给氧化剂,无电流产生;电化学腐蚀是最普遍的一种金属腐蚀,其原理与原电池原理相同。
答案:D2.下列各种镀有金属爱护层的铁板,镀层破损后在相同的环境中,铁板最易被腐蚀的是( )A.镀锌铁(白铁)B.镀锡铁(马口铁)C.镀铜铁D.镀银铁解析:镀有金属爱护层的铁板,在镀层破损时,与四周环境形成原电池。
A项中镀层破损时,锌作负极,铁作正极受到爱护;B、C、D项中镀层破损时,铁均作负极而被腐蚀,与正极金属的活动性相差越大,负极被腐蚀的速率越大,所以选D项。
答案:D3.(2024·广东云浮高二期末)将铁粉和活性炭的混合物用NaCl溶液潮湿后,置于如图所示装置中,进行铁的电化学腐蚀试验。
下列有关该试验的说法正确的是 ( )A.铁被氧化的电极反应式为Fe-3e-Fe3+B.铁腐蚀过程中化学能全部转化为电能C.活性炭的存在会加速铁的腐蚀D.以水代替NaCl溶液,铁不能发生吸氧腐蚀解析:A项,在铁的电化学腐蚀中,铁单质失去电子转化为二价亚铁离子,即负极反应式为Fe-2e-Fe2+,故错误;B项,铁的腐蚀过程中化学能除了转化为电能,还有一部分转化为热能,故错误;C项,活性炭与铁混合,在氯化钠溶液中构成了很多微小的原电池,加速了铁的腐蚀,故正确;D项,以水代替氯化钠溶液,水也呈中性,铁在中性或酸性很弱的条件下易发生吸氧腐蚀,故错误。
答案:C4.(2024·广东广州高二期末)肯定条件下,碳钢腐蚀与溶液pH的关系如下:pH 2 4 6 6.5 8 13.5 14 腐蚀快慢较快慢较快主要产物Fe2+Fe3O4Fe2O3Fe下列说法中错误的是 ( )A.在pH<4的溶液中,碳钢腐蚀的负极反应式为Fe-2e-Fe2+B.在pH>6的溶液中,碳钢主要发生吸氧腐蚀C.在pH>14的溶液中,碳钢腐蚀的正极反应式为O2+4OH-+4e-2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢解析:在pH<4的溶液中,碳钢主要发生析氢腐蚀,负极上电极反应式为Fe-2e-Fe2+,故A 项正确;在pH>6的溶液中,碳钢主要发生吸氧腐蚀,负极电极反应式为Fe-2e-Fe2+,正极电极反应式为O2+2H2O+4e-4OH-,故B项正确;在pH>14的溶液中,碳钢腐蚀的正极反应式为O2+2H2O+4e-4OH-,故C项错误;将碱性溶液煮沸除去氧气后,正极上氧气生成氢氧根离子的速率减小,所以碳钢腐蚀速率会减慢,故D项正确。
高中化学 4.4金属的电化学腐蚀与防护练习 新人教版选修4

4.4金属的电化学腐蚀与防护[学业水平层次(A)]1.下列各变化中,属于原电池反应的是( )A.在空气中,金属铝表面迅速氧化形成保护层B.白铁(镀锌)表面有划损时,也能阻止铁被氧化C.红热的铁丝与水接触,表面形成蓝黑色的保护层D.在空气中,金属银表面生成一层黑色物质【解析】镀锌铁表面划损时,锌作原电池负极被氧化。
A、C、D属于化学腐蚀。
【答案】 B2.下列关于钢铁锈蚀的叙述中,不正确的是 ( )A.钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物B.镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀C.铁锈的主要成分是Fe2O3·n H2O,为保护海轮的船壳,常在船壳上镶入锌块D.酸雨能使钢铁更容易发生析氢腐蚀【解析】钢铁锈蚀时铁作负极,失电子生成Fe2+,Fe2+与OH-结合生成Fe(OH)2,而后Fe(OH)2被氧化为Fe(OH)3,Fe(OH)3部分脱水成为氧化铁的水合物,A项错误;铁比银活泼,镀银铁制品破损后形成的原电池中铁为负极,腐蚀加快,B项正确;锌比铁活泼,形成原电池时锌为负极被腐蚀,保护铁,C项正确;酸性条件下钢铁易于发生析氢腐蚀,D项正确。
【答案】 A3.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( )A.正极的电极反应式为:2H++2e-===H2↑B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3C.此过程中铜并不被腐蚀D.此过程中电子从Fe移向Cu【解析】该图表示为吸氧腐蚀,其中铁铆钉为负极,电极反应式为Fe-2e-===Fe2+,铜板作正极,电极反应式为O2+4e-+2H2O===4OH-,当形成Fe(OH)2后,还有4Fe(OH)2+O2+2H2O===4Fe(OH)3这个反应,故A项错误,B、C、D三项均正确。
【答案】 A4.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。
高中化学 4.4金属的电化学腐蚀与防护习题 新人教版选

4.4金属的电化学腐蚀与防护 一、选择题(本题包括12小题,每小题5分,共60分)1.下列有关金属腐蚀的说法中正确的是( )①金属的腐蚀全部是氧化还原反应 ②金属的腐蚀可分为化学腐蚀和电化学腐蚀,只有电化学腐蚀才是氧化还原反应 ③因为二氧化碳普遍存在,所以钢铁的电化学腐蚀以析氢腐蚀为主 ④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化A .①③ B.②③C .①④ D.①③④【答案】 C【解析】 钢铁的电化学腐蚀以吸氧腐蚀为主。
2.普通铜器时间稍久容量出现铜绿,其主要成分是[Cu 2(OH)2CO 3]。
但有三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉而不生锈,下列对其原因的分析,最可能的是( )A .它们的表面都镀上了一层耐腐蚀的黄金B .环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去C .铜的金属活动性比氢小,因此不易被氧化D .它们是含一定比例金、银、锡、锌的铜合金【答案】 D【解析】 本题考查合金的性质,合金的性能优于成分金属,不易生锈,另外锌、锡对铜也有保护作用。
3.(双选)铁钉与碳棒用导线连接后,同时浸入0.01 mol·L -1的NaCl 溶液中,可能发生的反应是 ( )A .碳棒上放出氯气B .碳棒附近产生OH -C .碳棒上放出氧气D .铁钉被氧化【答案】 BD【解析】 铁钉和碳棒用导线连接后,同时浸入NaCl 溶液中,实质上是形成了原电池,据原电池工作原理,Fe 比C 活泼,因此铁被氧化;而NaCl 溶液呈中性,铁在中性溶液中发生吸氧腐蚀,碳棒为正极。
在碳棒上发生了还原反应:O 2+2H 2O +4e -===4OH -。
4.下列说法正确的是( )A .铅蓄电池放电时铅电极发生还原反应B .电解饱和食盐水在阳极得到氯气,阴极得到金属钠C .给铁钉镀铜可采用CuSO 4作电镀液D .生铁浸泡在食盐水中发生析氢腐蚀【答案】 C【解析】 铅蓄电池放电时铅电极作负极,负极发生氧化反应,A 错误;电解饱和食盐水的方程式为2NaCl +2H 2O=====电解H 2↑+2NaOH +Cl 2↑,H 2和NaOH 为阴极产物,B 错误;食盐水是中性溶液,该条件下发生铁的吸氧腐蚀,D 错误。
新教材高中化学第四章化学反应与电能第三节金属的腐蚀与防护基础训练含解析新人教版选择性必修第一册

第三节金属的腐蚀与防护基础达标练1.下列关于金属腐蚀和防护的叙述正确的是( )A.金属被腐蚀的本质是M+n H2O=n(OH)n+nH2↑2B.马口铁(镀锡铁)镀层破损后,仍然可以保护铁C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀D.常温下,置于空气中的金属主要发生化学腐蚀答案:C解析:金属腐蚀的本质是金属原子失去电子被氧化为金属阳离子;马口铁镀层破损后,Sn、Fe 形成原电池,铁先被腐蚀;常温下,空气中的金属主要发生电化学腐蚀中的吸氧腐蚀。
2.某城市整个夏季酸雨的pH平均值为3.2,在这种环境中的铁制品极易被腐蚀。
对此条件下铁的腐蚀的叙述不正确的是 ( )A.此腐蚀过程有化学腐蚀也有电化学腐蚀B.发生电化学腐蚀时,正极反应式为2 H2O+O2+4 e−=4 OH−C.在电化学腐蚀过程中有氢气产生D.发生电化学腐蚀时,负极反应式为Fe−2 e−=Fe2+答案:B解析:金属铁的腐蚀中,金属铁可以和溶液中的氢离子直接发生化学腐蚀,铁制品中含有铁和碳,再加上酸雨导致的酸性环境,具备了原电池的构成条件,也会发生电化学腐蚀,故A正确;发生电化学腐蚀时,碳作正极,溶液中的氢离子得电子生成氢气,正极反应式为2 H++2 e−= H2↑ ,故B错误,C正确;发生电化学腐蚀时,铁作负极,电极反应式为Fe−2 e−=Fe2+ ,故D 正确。
3.下列说法中,不正确的是( )A.生铁比纯铁更易生锈B.钢柱在水下的部分比在空气与水的交界处的部分更易生锈C.用锡焊接铁质器件,焊接处铁易生锈D.生铁在湿润环境中比在干燥环境中更易生锈答案:B解析:生铁易发生电化学腐蚀,因此生铁比纯铁更易生锈,故A正确;水下比空气与水的交界处空气少,钢柱在水下的部分的腐蚀速率比钢柱在空气与水的交界处的腐蚀速率慢,因此钢柱在空气与水的交界处易生锈,故B错误;用锡焊接铁质器件,形成原电池,铁作负极,因此焊接处铁易生锈,故C正确;生铁在干燥的空气中缺少电解质水,不易生锈,在湿润环境中易生锈,故D正确。
人教版高中化学选修4《金属的电化学腐蚀与防护》讲义(含答案)
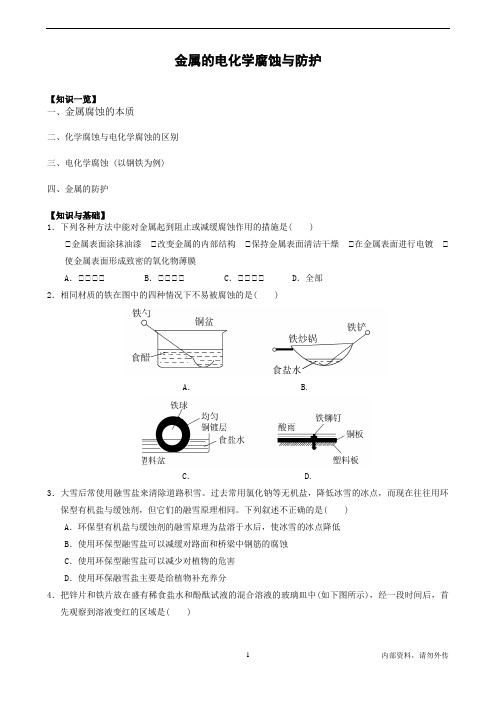
金属的电化学腐蚀与防护【知识一览】一、金属腐蚀的本质二、化学腐蚀与电化学腐蚀的区别三、电化学腐蚀 (以钢铁为例)四、金属的防护【知识与基础】1.下列各种方法中能对金属起到阻止或减缓腐蚀作用的措施是( )①金属表面涂抹油漆①改变金属的内部结构①保持金属表面清洁干燥①在金属表面进行电镀①使金属表面形成致密的氧化物薄膜A.①①①① B.①①①① C.①①①① D.全部2.相同材质的铁在图中的四种情况下不易被腐蚀的是( )A. B.C. D.3.大雪后常使用融雪盐来清除道路积雪。
过去常用氯化钠等无机盐,降低冰雪的冰点,而现在往往用环保型有机盐与缓蚀剂,但它们的融雪原理相同。
下列叙述不正确的是( )A.环保型有机盐与缓蚀剂的融雪原理为盐溶于水后,使冰雪的冰点降低B.使用环保型融雪盐可以减缓对路面和桥梁中钢筋的腐蚀C.使用环保型融雪盐可以减少对植物的危害D.使用环保融雪盐主要是给植物补充养分4.把锌片和铁片放在盛有稀食盐水和酚酞试液的混合溶液的玻璃皿中(如下图所示),经一段时间后,首先观察到溶液变红的区域是( )A .①和①附近B .①和①附近C .①和①附近D .①和①附近 5.下列有关金属腐蚀与防护的说法正确的是( )A .纯银器表面在空气中因化学腐蚀渐渐变暗B .当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用C .在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法D .可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 6.钢铁的锈蚀过程中,下列五种变化可能发生的是( )①Fe 由+2价转化为+3价 ①O 2被还原 ①H +被还原 ①有Fe 2O 3·xH 2O 生成 ①杂质碳被氧化除去 A .①① B .①① C .①①①① D .①①①①①7.目前脱氧保鲜剂已广泛用于食品保鲜、粮食及药材防虫、防霉等领域,含铁脱氧剂应用铁易被氧化的性质来完全吸收包装内的氧,从而对包装内的物品起到防氧化作用。
人教版高中化学选修四07金属的电化学腐蚀

高二选修化学反应原理单元练习之七金属的电化学腐蚀班级学号姓名一.选择题1.下列有关金属腐蚀的说法中正确的是:①金属的腐蚀全部是氧化还原反应;②金属的腐蚀可分为化学腐蚀和电化腐蚀,只有电化腐蚀才是氧化还原反应,③因二氧化碳普遍存在,所以钢铁的电化腐蚀以析氢腐蚀为主。
④无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化。
A. ①③B. ②③C. ①④D. ①③④2.以下现象与电化腐蚀无关的是A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比软铁芯(几乎是纯铁)容易生锈C.铁质器件附有铜质配件,在接触处易生铁锈D.银质奖牌久置后表面变暗3.表面镀有保护金属层的铁片,当镀层有破损时比普通铁片更不易腐蚀的是。
A.白铁(镀锌铁)B.马口铁(镀锡铁)C.镀镍铁D.镀铜铁4.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是A.④>②>①>③B.②>①>③>④C.④>②>③>①D.③>②>④>①5.镁铝合金在碱性溶液中开始反应缓慢,后反应加速,经分析是氧化膜及微电池作用的结果.下列叙述正确的是A.微电池负极为Mg B.微电池负极为AlC.铝的电极反应式为2H++2eˉ= H2↑D.镁的电极反应式为Mg-2eˉ= Mg 2+ 6.钢铁在潮湿空气中发生电化学腐蚀时,正极发生的主要反应是A.Fe-2eˉ= Fe2+ B.2H2O+O2+4eˉ= 4OHˉC.4OHˉ-4eˉ=2H2 O +O2D.2H++2eˉ= H27.下列事实不能用电化学理论解释的是A.轮船水线以下的船壳上装上一定数量的锌块B.银质奖章久置后表面变暗C.黄铜(铜锌合金)制作的铜锣不易产生铜绿D.纯锌与稀H2SO4反应滴入少量的CuSO4溶液后反应速率加快8.在铁制品上镀上一定厚度的锌层,以下设计方案正确的是A.锌作阳极,镀件作阴极,溶液中含有锌离子B.铂作阴极,镀件作阳极,溶液中含有锌离子C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌用阴极,镀件作阳极,溶液中含有锌离子9.为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是A.装置Ⅰ左侧的液面一定会下降B.左侧液面装置Ⅰ比装置Ⅱ的低C.装置Ⅱ中的铁钉腐蚀最严重D.装置Ⅲ中的铁钉几乎没被腐蚀10.下列过程需要通电才可进行的是:①电离;②电解;③电镀:④电化腐蚀。
人教版高中化学选修四第四节 金属的电化学腐蚀与防护同步练习 .docx

高中化学学习材料鼎尚图文收集整理第四节金属的电化学腐蚀与防护同步练习一、选择题(每题只有1个正确选项)1. 下列叙述不正确的是()A. 金属的电化腐蚀比化学腐蚀普遍B. 钢铁在干燥空气里不易腐蚀C. 用铝质铆钉接铁板,铁板易被腐蚀D. 原电池电路中电子由负极流入正极2. 以下现象与电化学腐蚀无关的是()A. 黄铜(铜锌合金)制作的锣不易产生铜绿B. 生铁比纯铁容易生锈C. 铁质配件附有铜质配件,在接触处易生铁锈D. 银质物品久置表面变暗3.铁钉和碳棒用导线连接后,浸入到0.01 mol·L-1NaCl溶液中,可能发生的是( )①碳棒上有氢气析出②碳棒附近产生OH-③碳棒上有氧气析出④铁钉被氧化A.①③B.①④C.②③D.②④4. 下列防腐措施中,利用原电池反应使主要金属得到保护的是()A. 用氧化剂使金属表面生成致密稳定的氧化物保护膜B. 在金属中加入一些铬或镍制成合金C. 在轮船的壳体水线以下部分装上锌锭D. 金属表面喷漆5. 下列有关金属腐蚀与防护的说法正确的是()A. 纯银器表面在空气中因电化学腐蚀渐渐变暗B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀6.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O===2Fe(OH)2;②4Fe(OH)2+O2+2H2O===4Fe(OH)3;③2Fe(OH)3===Fe2O3+3H2O。
下列说法正确的是( )A.反应①、②中电子转移数目相等B.反应①中氧化剂是氧气和水C.与铜质水龙头连接处的钢质水管不易发生腐蚀D.钢铁在潮湿的空气中不能发生电化学腐蚀7. 下列叙述正确的是()A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOHD. 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀8. 下列情况下,埋在地下的输油铸铁管道被腐蚀最慢的是()A. 潮湿疏松透气的土壤中B. 含铁元素较多的酸性土壤中C. 干燥致密不透气的土壤中D. 含碳量较高,潮湿透气的中性土壤中9. 为了使埋在地下的钢管不易生锈,设计了如下几种方案,将钢管①用导线与铅板连接②用导线与锌板连接③用导线与碳棒连接④与直流电源负极连接⑤直流电源正极连接,其中可采取的方法是() A. ②④ B. ①④ C. ②③ D. ①⑤10. 分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是()二、填空题11.如右图所示,水槽中试管内有一枚铁钉,放置数天观察:(1)试管内液面上升,则原溶液呈____________________,电极反应方程式:负极:________________,正极:__________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钢铁的电化学腐蚀
高考频度:★★★★☆难易程度:★★★☆☆
典例在线
如图为模拟铁生锈的实验。
铁粉中均匀混有少量炭粉,撒入内壁已分别用氯化钠溶液和稀醋酸润湿过的甲、乙两个具支试管中,打开止水夹片刻后,下列有关该实验的说法合理的是
A.甲装置导管口有气泡,乙装置导管内出现一段液柱
B.甲装置中发生的电化学腐蚀主要是析氢腐蚀
C.乙装置中发生的电化学腐蚀主要是吸氧腐蚀
D.乙装置导管口有气泡冒出
【参考答案】D
【试题解析】甲图中的电解质溶液呈中性,所以发生的是吸氧腐蚀,A、B两项均错;乙图中的电解质溶液呈酸性,发生的是析氢腐蚀,有气体产生,C项错,D项正确
解题必备
钢铁的电化学腐蚀
1.钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-===H2↑
B.Fe2++2e-===Fe
C.2H2O+O2+4e-===4OH-
D.Fe3++e-===Fe2+
2.用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生腐蚀的装置及得到的图像如下:
pH=2时锥形瓶中气体压强变化的曲线图和pH=4时锥形瓶中气体压强变化的曲线图分析图像,以下结论错误的是
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe-2e-===Fe2+
3.如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,放置一段时间。
下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中负极电极反应相同
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
4.为探究钢铁的吸氧腐蚀原理,设计了如图所示的装置,下列有关说法中错误的是
A.正极的电极反应方程式为O2+2H2O+4e-===4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.断开连接石墨和铁的导线,铁便不会生锈
5.市场上出售的“热敷袋”,其主要成分是铁屑、炭粉、木屑与少量氯化钠、水等。
它在使用之前需使塑料袋与空气隔绝。
使用时启开塑料袋上的小孔,轻轻揉搓就会发出热量来。
当使用完后还会发现有铁锈(Fe2O3的结晶水合物)生成,依上述现象回答:
(1)“热敷袋”放出的热量是利用铁发生了________反应放出热量。
(2)炭粉的主要作用是__________________________________________。
(3)加入氯化钠的作用是________________________________________。
(4)有关的电极反应式:正极_______________________,负极_______________________。
答案
1.【答案】C
【解析】钢铁发生吸氧腐蚀,正极反应为2H2O+O2+4e-===4OH-。
2.【答案】C
3.【答案】B
【解析】a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,a、b中均构成原电池,a中发生铁的吸氧腐蚀,气体减少;b中发生铁的析氢腐蚀,气体增多;生铁块中的碳
是原电池的正极,故A正确;红墨水柱两边的液面变为左高右低,故B错误;两试管中都是铁为负极,负极电极反应相同,故C正确;a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀,故D正确。
4.【答案】D
5.【答案】(1)氧化
(2)做正极
(3)做电解质溶液
(4)O2+2H2O+4e-===4OH-2Fe-4e-===2Fe2+
【解析】根据题意“热敷袋”使用时必须与空气接触,再从主要成分是铁屑、炭粉、木屑与少量氯化钠、水和使用完后发现有铁锈生成可判断出反应原理为铁的吸氧腐蚀。
