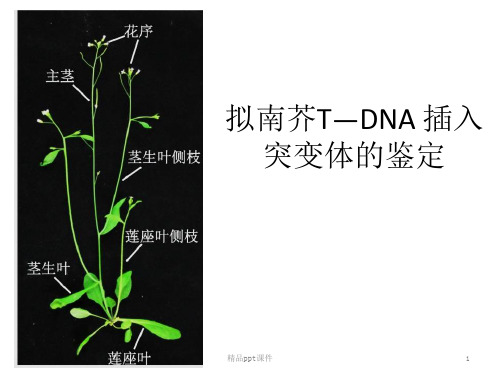
模式植物拟南芥T-DNA插入突变体的PCR鉴定资料讲解
t-DNA插入突变体检测

2.2.3.7.取出凝胶,放入EB(溴乙锭,强突变剂,剧毒慎碰)染液中染色10-15分钟;
2.2.3.8.之后放入凝胶成像仪中,观察DNA跑胶的情况。
3.结果
3.1.第一次
TPS法提取44号样品DNA,以DL2000为Marker。
DNA含有PO43-基团,在pH8.0 Buffer(本实验中为TAE)中带负电, 在电场中向正极移动。自由电泳时,由于不同大小的DNA片段的电荷密度大致相同,各核酸分子难以分开;选用适当浓度的琼脂糖凝胶作为支持物,使之具备一定的孔径,即可发挥分子筛效应,使大小不同的核酸片段迁移率出现较大差异,达到分离的目的;同样条件对Marker电泳;起到鉴定的作用。不同浓度的琼脂糖凝胶对应线状DNA分子分离范围不同。(如下图)
本次实验中,采用液CTAB(或者TSP法)提取拟南芥植株的DNA,然后PCR将所获DNA扩增,在之后采用琼脂糖凝胶电泳技术,分离处长度不一的DNA带,以确东样品是否为T-DNA插入突变纯和体。
PCR(Polymerase Chain Reaction),即聚合酶链式反应是体外核算扩增技术,具有特异、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至百万倍,使肉眼能直接观察和判断。(PCR基本原理如右图)
4.2.实验分析
4.2.1.加液氮碾磨叶片时,最好保持离心管中始终有液体氮存在,如果碾磨一段时间后中途要加液氮继续碾磨,一定注意,液氮沸腾时极易将已经碾磨好的叶片吹走;另一点,碾磨时要迅速,避免空气中的水汽在离心管上凝结。
4.2.2.DNA有一定的物理脆性,所以在提取过程中混匀时一定要缓慢的摇晃,切忌剧烈震荡。
拟南芥TDNA插入突变体的鉴定

遗传学实验报告拟南芥T-DNA插入突变体的鉴定一、实验目的:1、学习和掌握基本的植物DNA的CTAB提取法,掌握PCR、琼脂糖凝胶电泳等基本实验操作技能2、了解T-DNA插入突变体的鉴定原理,掌握其方法。
二、实验原理1、拟南芥(Arabidopsis thaliana)十字花科,植物遗传学、发育生物学和分子生物学的模式植物。
植株形态个体小,高度只有30cm左右;生长周期快,从播种到收获种子一般只需8周左右;种子多,每株可产生数千粒种子;形态特征简单,生命力强,用普通培养基就可作人工培养;遗传转化简单,转化效率高;基因组小,只有5对染色体,125MB;在2000年,拟南芥成为第一个基因组被完整测序的植物。
2、突变体突变体是遗传学研究的最重要材料。
突变体可以通过自然突变和人工诱变的方法获得。
拟南芥诱变常用方法有EMS诱变、T-DNA插入突变、激活标签。
由于T-DNA插入突变体便于对突变基因进行追踪,目前拟南芥、水稻中已经有大量的T-DNA插入突变体;SALK中心提供的拟南芥T-DNA插入突变体超过十万种。
3、T-DNA插入突变原理T-DNA,转移DNA(transferred DNA ),是根瘤农杆菌Ti质粒中的一段DNA序列,可以从农杆菌中转移并稳定整合到植物基因组。
人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,获得转基因植株。
除用于转基因以外,T-DNA插入到植物的基因中可引起基因的失活,从而产生基因敲除突变体,T-DNA大多为单拷贝插入,使其利于进行遗传分析。
4、T-DNA插入突变体PCR鉴定图 1 结果鉴定图 2 PCR引物设计三、实验材料1、材料:T-DNA插入的突变拟南芥植株;2、仪器:离心管,离心机,水浴锅,移液枪,PCR仪,电泳槽等;3、试剂:液氮,CTAB提取液,氯仿/异戊醇(24:1),无水乙醇,70%乙醇,10xTaq buffer,MgCl2,引物,琼脂糖,溴化乙锭(EB)。
拟南芥T-DNA插入突变体的鉴定

拟南芥T-DNA插入突变体的鉴定09生工吴超 200900140129一、实验原理T-DNA插入法是反向遗传学研究的重要手段。
T-DNA是农杆菌的一个大质粒,长度在25kb左右。
野生型农杆菌的T-DNA上带有激素合成基因,感染植物后会导致植物细胞快速增殖形成愈伤组织,失去分化能力。
所以一般实验使用改造后的农杆菌——T-DNA中导入了卡那霉素抗性基因和抗除草剂基因。
因此在农杆菌感染植物后可用除草剂来筛选转化子。
在转化子培养到F2代出现分离后,就需要对其基因型进行鉴定。
T-DNA插入突变体鉴定方法主要有两种:三引物法和双引物法。
在本实验中使用三引物法。
三引物法的原理如图1所示,即采用三引物(LP、RP、BP)进行PCR扩增。
野生型植株目的基因的两条染色体上均未发生T-DNA插入,所以其PCR产物仅有1种,分子量约900bp(即从LP到RP);纯合突变体植株目的基因的两条染色体上均发生T-DNA插入,T-DNA本身的长度约为25kb,过长的模板会阻止目的基因特异性扩增产物的形成,所以也只能得到1种以BP与LP或RP为引物进行扩增的产物,分子量约为400-700bp;杂合突变体植株只在目的基因的一条染色体上发发生了T-DNA插入,所以PCR扩增后可同时得到两种产物。
上述3种情况的电泳结果差异明显,能有效区分不同基因型的植株。
此法优点是可同时鉴定出纯和突变体并确证T-DNA的插入情况。
图1 T-DNA插入示意图CATB,即十六烷基三甲基溴化铵,是一种离子型表面活性剂。
能溶解细胞膜和核膜蛋白,使核蛋白解聚,从而使DNA得以游离出来。
并且CATB可在高离子强度的溶液里与蛋白质和大多数多聚糖形成复合物进而形成沉淀,但不沉淀核酸。
本实验使用CATB抽提DNA。
聚合酶链式反应(Polymerase Chain Reaction,PCR)是体外核酸扩增技术。
它具有特异性高、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至几万倍,使肉眼能直接观察和判断。
拟南芥T-DNA插入突变纯合体的鉴定

拟南芥T-DNA插入突变纯合体的鉴定余振洋(高山山、潘红芳)、09级生技1班、200900140156、2011/12/14摘要本实验通过CTAB法提取目的拟南芥的DNA,再用三引物法PCR扩增所需的目的基因后,用电泳检测该拟南芥是否为转基因的拟南芥,并判断其是纯合突变还是杂合突变。
关键词拟南芥;T-DNA;突变纯和体1.引言T-DNA是根癌农杆菌Ti质粒上的一段DNA序列,它能稳定地整合到植物基因组中并稳定地表达。
T—DNA在植物中一般都以低拷贝插入,多为单拷贝。
单拷贝T-DNA一旦整合到植物基因组中,就会表现出孟德尔遗传特性,在后代中长期稳定表达,且插入后不再移动,便于保存。
T—DNA插入突变在反向遗传学和功能基因组学研究中发挥着重要作用。
,T—DNA插入突变能方便地进行正向和反向遗传学研究,因而受到重视。
同时,基因组测序工作的完成使得从位点到表型的反向遗传学研究成为可能,从而使通过T—DNA插入技术构建突变体来研究功能的反向遗传学技术逐渐取代了传统的化学诱变、图位克隆等技术。
借助于农杆菌介导的遗传转化技术,T—DNA插入技术已被广泛应用于拟南芥等模式植物的突变体库构建中。
以T—DNA作为插入元件,不但能破坏插入位点基因的功能,而且能通过插入产生的功能缺失突变体的表型及生化特征的变化,为该基因的研究提供有用的线索。
由于插入的T—DNA序列是已知的,因此可以通过已知的外源基因序列,利用反向PCR、TAIL-PCR、质粒挽救等方法对突变基因进行克隆和序列分析,并对比突变的表型研究基因的功能。
还可以利用扩增出的插入位点的侧翼序列,建立侧翼序列数据库,对基因进行更全面的分析。
由此可见,T—DNA 插入标签技术已成为发现新基因、鉴定基因功能的一种重要手段。
CTAB法提取植物叶片中的DNA是我们常用的方法。
通常采用机械研磨的方法破碎植物的组织和细胞,由于植物细胞匀浆含有多种酶类(尤其是氧化酶类)对DNA的抽提产生不利的影响,在抽提缓冲液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降低这些酶类的活性。
实验十、模式植物拟南芥T-DNA插入突变体的鉴定-23页精选文档

模式植物拟南芥
拟南芥(Arabidopsis thaliana )又称为阿拉伯芥,是一种十字花 科植物,广泛用于遗传、发育和分子生物学的研究,已成为一种典 型的模式植物。该植物具有以下特点:
植株形态个体小,高度只有30cm左右,1个茶杯可种植好几棵; 生长周期快,每代时间短,从播种到收获种子一般只需8周左右; 种子多,每株可产生数千粒种子; 形态特征简单,生命力强,用普通培
养基就可作人工培养; 基因组小,只有5对染色体。 拟南芥是严格的闭花自花受粉植物,
基因高度纯合。易获通过理化处理 获得各种功能的突变体。
外成像仪
实验步骤-拟南芥的栽培
一.在播种前将种子进行消毒,然后置于4℃冰箱中,使 种子在湿润条件下春化2至3天。
二.将春化好的种子播种于有麦氏培养基(MS培养基)的 培养皿中,置于培养室内培养。
三.待幼苗长出后,再选择茁壮的幼苗移栽到土壤中,置 于培养室内培养。
实验步骤-拟南芥T-DNA插入突变体PCR鉴定法
1. CATB法提取DNA:液氮、2×CTAB抽提缓冲溶液、氯仿:异戊醇 =24:1、无水乙醇、70%乙醇、TE
2. PCR:ddH2O、Buffer、MgCl2、dNTP、引物(LP、RP、BP) 、DNA模版、Taq DNA聚合酶
3. 电泳:琼脂糖、Maker、Buffer、EB、TAE
❖ 仪器:离心机,水浴锅,移液器,PCR仪,电泳槽,紫
每小组按10倍准备混合体系; 每个同学需做一颗植株的鉴定(两管PCR)。
LP: JDM17-1NR2 RP: JDM17-1F2 BP: LBb1.3
PCR法鉴定T-DNA插入突变体1概论

Mix 17 ul
16℃ ∞
32 cycles
• 电泳检测
Mix 1: LP+RP Mix2: LB+RP
WT 没有插入
HM 纯合体
HZ 杂合体
鉴定原理
本次实验材料:
插入位点
Exon Intron UTR promoter
1100 bp 500 bp
实验安排
提取植物基因组
PCR反应鉴定
实验安排
提取植物基因组
• 每2个人一个小组,每小组提 1 个样品 • 每行一个大组,另提1个对照WT • 注意写好样品编号
实验安排
PCR反应鉴定
• 每小组做 1 管PCR反应 ( LP+RP+LB )
• 注意写好样品编号
实验安排
PCR反应鉴定
成分
用 量 ( ul )
primers
0.5+0.5 +0.5
2X Taq Mix
10
ddH2O
6
template
3
t2℃ 30s 30s 1:00 10:00
PCR法鉴定T-DNA插入突变体
T-DNA插入
• T-DNA,转移DNA(transferred DNA)是根瘤农 杆菌Ti质粒中的一段DNA序列,可以从农杆菌中转移 并稳定整合到植物基因组
• 将目的基因转入到经过改造的T-DNA区,借农杆菌 的感染实现外源基因向植物细胞的转移与整合,获得 转基因植株
• 除用于转基因以外,T-DNA插入到植物基因中能引 起基因的失活,从而产生基因敲除突变体
• T-DNA大多为单拷贝插入,使其利于进行遗传分析。
鉴定原理
BP: T-DNA载体上的插 入片段的左边界序列 >>>通用引物(LB)
拟南芥atcwinv1基因T-DNA插入纯合突变体PCR鉴定及表型观察

PCR d n iia i n a d Ph n t p c Ob e v to fa c i v I e tfc to n e o y i s r a i n o tw n l Ge e T— n DNA n e to a u a to r b do i I s r i n lM t n fA a i pss
u e o c m pa e p a s d t o r l ntmor hol i a if r nc s i he pe i ge a i e g owt nd r pr duc p og c ld f e e e n t rod ofve t tv r h a e o — tv o h. i e gr wt Ther s t h e uls s owe ha o p r d t he wid t pe t r i a i n r t fatwi l d t tc m a e o t l y he ge m n to a e o c nv a e a e y de r a e 5 v r g l c e s d by .88 pe c nt ge p n s; ompa e o h wid t e, li i e f ar- r e a oi t c r d t t e l yp bo tng tm o c
拟南芥突变体的功能鉴定及应用

拟南芥突变体的功能鉴定及应用拟南芥是一种模式植物,因其具有小型、短周期、基因底子丰富等特点,成为了植物学和遗传学领域的研究工具。
通过突变体的筛选,拟南芥成为了研究植物生长发育和基因功能的重要模式植物之一。
在拟南芥突变体筛选中,以T-DNA插入技术为主,通过敲定不同基因,以观察植物的生长发育状态,挖掘新的生物学机制。
拟南芥突变体是利用突变体筛选技术,自然形成的或通过基因操作人工获得,产生了某些特殊表型的植物。
以T-DNA插入技术为例,将T-DNA随机插入到植物基因组中,导致部分基因的功能紊乱,从而产生了特殊的表型表现。
因此,拟南芥突变体不仅具有丰富的基因型资源,也是研究基因功能、分子生物学和植物生长发育的重要材料,其发现和应用有直接联系。
因此,如何鉴定拟南芥突变体的功能尤为重要。
目前鉴定方法主要包括:表型分析、基因克隆、启动子分析、蛋白质相互作用网络分析、分子标记等技术手段。
表型分析是首先考虑的鉴定方法,通过比较突变体与野生型在不同生长条件下的表型差异,筛选出表现异常的突变体。
对鉴定有难度的突变体,使用其他鉴定方法,如基因克隆,会有更好的效果。
其中,启动子元素克隆有助于探究基因表达特异性。
蛋白质相互作用网络分析有用于探究基因调控网络方式。
分子标记在表型特征不明显时,如果phentoype特征无法激活突变体,可以发现突变原因及搜索对应的遗传切口。
同时,拟南芥突变体在研究中的应用也非常广泛。
例如:研究花器官发育中的关键基因,通过拟南芥突变体突变鉴定方法,筛选出相关基因,进而探究开花的分子机制。
利用拟南芥突变体进行耐盐性、耐旱性等方面的研究。
在探究植物防御基因的调节网络时,拟南芥突变体也广泛地使用。
此外,还可用作药物和环境污染物筛选的生物传感材料,如zinc、生物染色体修复等方面的研究。
拟南芥突变体是全面了解植物生物学机理的重要材料,是揭示生长发育和基因功能的主要途径之一。
随着逆境应对、营养吸收、发育调控等方向的研究的深入,对拟南芥突变体的催生和应用必将愈加广泛。
植物DNA提取——拟南芥

【实验目的】1、采用CTAB法从植物叶片中提取基因组DNA,并用PCR方法鉴定T-DNA插入纯合突变体和琼脂糖凝胶电泳。
2、掌握CTAB法从植物叶片中提取DNA的原理和方法。
3、掌握应用PCR技术扩增目的基因的原理和方法。
4、掌握琼脂糖凝胶电泳的操作和原理及分析方法。
【实验原理】DNA是分子生物学研究的基本材料,依不同实验目的采取相应的抽提DNA方法,获取数量、质量不等的DNA。
CTAB(十六烷基三甲基溴化铵,也称六癸基三甲基溴化铵)是一种非离子去污剂,用CTAB法抽提植物总DNA,操作简便、快速、产量高,但纯度稍次,适用于一般分子生物学操作。
在DNA提取过程中,第一步就是使组织细胞破裂后释放出DNA,第二步就是DNA与其他细胞组分如蛋白质、碳水化合物、膜和细胞壁相分离。
在这个方法中,植物细胞首先在液氮中冰冻,然后用研钵或植物粉碎机研磨,使组织细胞破裂后释放出D14A。
研磨好的组织置于预热的1.5×CTAB(高盐1.05mol/L NaCl)缓冲溶液中,加热至65℃。
此时CTAB可与核酸形成复合物,这种复合物在高盐(>0.7mol/L)溶液中是可溶的,并且可以稳定存在,而细胞壁纤维和大部分变性蛋白质则沉淀,从而从DNA中去除污染物,而部分蛋白质及多糖(酶抑制剂)仍溶于溶液中。
β-琉基乙醇可抑制多酚氧化酶的氧化,防止植物组织发黄变褐。
经过初次保温后,氯仿/异戊醇抽提就可除去仍溶于溶液中的蛋白质、多糖,最后用乙醇沉淀DNA(CTAB-核酸复合物在低盐溶液中因溶解度降低而沉淀),并洗去CTAB。
分离纯化核酸总的原则,一是要保证核酸一级结构的完整性;二是要排除其他分子的污染。
抽提的DNA中不应存在对酶有抑制作用的有机溶剂和过高浓度的金属离子,且其他生物大分子的污染应降到最低程度。
Ti质粒和T-DNA:Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移进植物细胞,并插入植物染色体DNA中。
模式植物拟南芥T

模式植物拟南芥T-DNA插入突变体的鉴定摘要当农杆菌侵染植物细胞时,土壤农杆菌的天然质粒—Ti质粒上T-DNA区段能自发转移进植物细胞,并插入染色体DNA中。
拟南芥的T-DNA插入变异是反向遗传学进行植物生物学研究的重要手段之一,在获得的Ti质粒转化植物细胞后代分离群体中,有T-DNA插入的纯合突变体,杂合突变体,和野生型,在突变体研究中,需要的材料是纯合突变体,所以必须从分离群体中将纯合突变体鉴定出来。
本实验以拟南芥植株的特定基因突变体作为实验材料,提取DNA,并通过PCR扩增及SDS-PAGE电泳分离检测鉴定,检测该拟南芥是否为转基因的拟南芥,并判断其是纯合突变还是杂合突变。
本次实验目的在于了解拟南芥T-DNA插入突变体鉴定的原理,掌握DNA提取技术、PCR技术以及电泳鉴定技术,对拟南芥的基因型做出判断。
关键词T-DNA插入突变体拟南芥 PCR 琼脂糖凝胶电泳1.引言1.1遗传研究途径(1)正向遗传学研究杂交或诱变→表型观察→遗传规律→确定存在的基因及数目→基因的功能及作用性质。
(2)反向遗传学研究在已知DNA序列的基础上,通过DNA重组、定点突变、插入/缺失等遗传修饰手段创造突变体并研究突变所造成的表型效应,从而研究基因的生物学功能,阐明生命的本质现象与规律。
拟南芥的T-DNA插入变异是反向遗传学进行植物生物学研究的重要手段之一。
1.2模式生物——拟南芥拟南芥广泛用于植物遗传学、发育生物学和分子生物学的研究,已成为一种典型的模式植物,其原因主要基于该植物具有以下特点:①植株形态个体小,高度只有30cm左右,1个茶杯可种植好几棵;②生长周期快,每代时间短,从播种到收获种子一般只需6周左右;③种子多,每株每代可产生数千粒种子;④形态特征简单,生命力强,用普通培养基就可作人工培养;⑤基因组小,只有5对染色体;⑥拟南芥是自花受粉植物,基因高度纯合,用理化因素处理突变率很高,容易获得各种代谢功能的缺陷型。
植物组织DNA的提取和鉴定

拟南芥T-DNA插入突变体的鉴定实验目的1.通过实验学习并掌握用CTAB来提取DNA的方法。
2.了解CTAB的成分及作用。
3.学习PCR的原理并掌握其方法。
4.学习琼脂糖凝胶电泳的原理与方法。
实验原理植物组织中绝大部分是核DNA,它和组蛋白、非组蛋白结合在一起,以核蛋白(即染色质或染色体)的形式存在于细胞核内。
CTAB(十六烷基三甲基溴化铵,简称CTAB):是一种阳离子去污剂,可溶解细胞膜,它能与核酸形成复合物,在高盐溶液中(0.7mol/L NaCl)是可溶的,当降低溶液盐的浓度到一定程度(0.3mol/L NaCl)时从溶液中沉淀,通过离心就可将CTAB与核酸的复合物同蛋白、多糖类物质分开,然后将CTAB与核酸的复合物沉淀溶解于高盐溶液中,再加入乙醇使核酸沉淀,CTAB能溶解于乙醇中。
DNA是遗传信息的载体和基本遗传物质,它在遗传变异、代谢调控等方面起着重要作用,是分子生物学和基因工程研究的对象,但无论是研究植物DNA的结构和功能,还是开展外源DNA的转化、转导的研究,首先要做的就是从植物组织中提取天然状态的高分子量的纯化DNA。
T-DNA,转移DNA(transferred DNA ),是根瘤农杆菌Ti质粒中的一段DNA 序列,可以从农杆菌中转移并稳定整合到植物基因组。
人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,获得转基因植株。
除用于转基因以外,T-DNA插入到植物的基因中可引起基因的失活,从而产生基因敲除突变体;T-DNA大多为单拷贝插入,使其利于进行遗传分析。
PCR基本原理:聚合酶链式反应(Polymerase Chain Reaction),简称PCR,是一种分子生物学技术,用于在体外快速扩增DNA,具有类似细胞内DNA的复制过程:由一对引物介导,通过温度的调节,使双链DNA变性为单链DNA、单链DNA能与引物复性(退火)成为引物-DNA单链复合物、以及在dNTPs存在下DNA聚合酶能使引物沿单链模板延伸成为双链DNA(引物的延伸);这种热变性-复性-延伸的过程,就是一个PCR循环;一般通过20-30个循环之后,就可获得大量的要扩增的DNA 片段。
拟南芥T-DNA插入突变
精品ppt课件
18
(3)筛选纯合突变体
实验方案设计
输入基因型号
精品ppt课件
19
(3)筛选纯合突变体
实验方案设计
查看含有相关基因的种子信息
精品ppt课件
20
(3)筛选纯合突变体
实验方案设计
引物设计
精品ppt课件
21
(3)筛选纯合突变体
实验方案设计
中间引物的设计
精品ppt课件
22
(3)筛选纯合突变体
精品ppt课件
6
2、反向遗传学的重要手段——T-DNA插入突变技术
the mechanism of T-DNA insertion
• In the plant cell, the T-DNA is coated with the single-stranded DNA-binding protein, VirE2.
不足之处是完成最终鉴定需进行两轮P C R 扩增。
精品ppt课件
27
精品ppt课件
28
4.3 电泳并观察结果
配制琼脂糖凝胶,将扩增后的样品加入凝胶 孔电泳,电泳后观察结果。
精品ppt课件
29
(3)筛选纯和突变体
5.结果分析
使用三引物法PCR检测,若电泳图上 出现一大一小两条带,则为突变杂合体;出 现一条小带,则为突变纯和体;出现一条大 带,则为野生型。
精品ppt课件
5
2、反向遗传学的重要手段——T-DNA插入突变技术
thtehememcehcahnainsimsmooff T--DDNAA iinnsseertriotnion
Proteins which are encoded by the virulence (vir)
拟南芥材料快速PCR鉴定

拟南芥材料快速PCR鉴定
实验方法
1、拟南芥基因组粗提缓冲液配置
50mM Tris-HCl (PH 7.5)
300mM NaCl
300mM 蔗糖
2、用镊子取一点点拟南芥叶片置于PCR小管,加入100μL的拟南芥基因组粗提
缓冲液,用黄色枪头捣碎,缓冲液变绿即可,99℃孵育10min。
3、加入缓冲液等体积的氯仿,震荡混匀,离心取2μL上清液作为模板进行PCR。
注意事项
T-DNA插入突变体和转基因株系的鉴定,图位克隆等实验经常需要对大批量的拟南芥材料进行PCR鉴定,本方法不需要提取高质量的DNA模板,因此能节约大量工作时间。
使用该方法,有以下几点需要注意:
1、拟南芥基因组粗提缓冲液配好后可以直接使用,但长期使用,需高温灭菌后用离心管分装,-20℃长期保存。
2、缓冲液体积可以随叶片大小调整。
若实验室有组织球磨仪,可将第二步改为,
将叶片置于2mL离心管中,加入100μL的缓冲液和2-3粒钢珠,20-30Hz破碎3min。
3、若Taq酶的扩增能力很强,则可省略第三步,第二步结束后取2μL直接进行
PCR反应。
4、使用该方法,100bp-2.5kb片段皆可成功扩增。
下图为T-DNA插入突变体的
鉴定,条带大小为1.2k左右。
t-DNA鉴定ppt课件

0.5ul 2ul
0.2ul
21
反应程序
PCR由变性--退火--延伸三个基 本反应步骤
变性— 退火— 延伸—
预变性94℃ 94℃ 53℃ 72℃ 循环35次
5min 40sec 50sec 80sec
72℃
10min
22
• LP • TCATCCACCATGG
AAGAAAAG • RP • TTGGATACGATGC
17
如何选择最合适的DNA聚合酶 -- DNA 聚合酶的特性
纯度 稳定性 酶活性
18
• 反应体系
H2O
10xTaq buffer (MgCl2free)
MgCl2 (25mM)
引物LP (10 uM)
•
引物RP (10 uM)
引物BP (10 uM)
dNTP (各2.5mM)
模板DNA(30-50ng/μl)
13
PCR标准反应体系
• DNA模板 • 引物 • 反应缓冲液 • dNTP • ddH2O • 耐热聚合酶
14
反应体系对PCR扩增的影响
DNA模板
•纯度 蛋白、多糖、酚类等杂质会抑制PCR反应 •完整性 模板降解会导致PCR扩增无产物 •浓度 加量过多导致非特异性扩增增加
引物
•特异性 长度适当、避免二级结构和二聚体 •完整性 避免反复冻融 •浓度 应适当,过高导致非特异性增加,过低则
Taq酶(5U/μl )
19
反应体系(三引物体系)
25ul体系
H2O
15ul
10xTaq buffer (MgCl2free) 2.5ul
MgCl2 (25mM)
2ul
引物LP (10 uM)
拟南芥

姓名沈一鸣班级生技3班同组人无科目遗传学实验题目拟南芥T-DNA插入突变体的鉴定组别无—————————————————————————————————————————————————————一、实验目的1. 学习用PCR方法检测生物遗传差异;2. 了解植物T-DNA插入突变体的鉴定原理。
二、实验原理拟南芥(Arabidopsis thaliana):十字花科,植物遗传学、发育生物学和分子生物学的模式植物拟南芥特点:1)植株形态个体小,高度只有30cm左右;2)生长周期快,从播种到收获种子一般只需8周左右;3)种子多,每株可产生数千粒种子;4)形态特征简单,生命力强,用普通培养基就可作人工培养;5)遗传转化简单,转化效率高;6)基因组小,只有5对染色体,125MB;7)在2000年,拟南芥成为第一个基因组被完整测序的植物突变体是遗传学研究的最重要材料。
自然突变突变体的获得人工诱变拟南芥诱变常用方法:EMS诱变、T-DNA插入突变、激活标签由于T-DNA插入突变体便于对突变基因进行追踪,目前拟南芥、水稻中已经有大量的T-DNA插入突变体;SALK中心提供的拟南芥T-DNA插入突变体超过十万种。
T-DNA插入突变原理:Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移,插入植物染色体DNA中,Ti质粒上的这一段能转移的DNA被叫做T-DNA(transferred DNA )。
人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,获得转基因植株。
T-DNA插入到植物染色体上的什么位置,是随机的。
如果T-DNA插入某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
T-DNA大多为单拷贝插入,使其利于进行遗传分析。
用PCR方法鉴定T-DNA插入纯合突变体:农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中,有T-DNA插入的纯合突变体,杂合突变体,和野生型。
模式植物拟南芥TDNA插入突变体的鉴定

T-DNA插入到植物染色体上的位置是随机的。如果T-DNA插入某个功 能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。利用 农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
2012.11.28
4
模式植物拟南芥
拟南芥全部基因组测序已经完成,每个单倍染色体组 (n=5)的总长只有7000万个碱基对(只有小麦染色 体组长的1/80),预测共有29,454个基因。这样科 学家就可以准确定位插入DNA的位置。
DIFF_TM 0.55 LP TCTAGGAAATCGATCGGGTTC
Len 21 TM 60.40 GC 47.62 SELF_ANY_COMPL 0.55
3'_COMPL 0.00 RP GAGAGCATGTAAGGATGCTGG
Len 21 TM 59.85 GC 52.38 SELF_ANY_COMPL 0.55
模式植物拟南芥T-DNA插 入突变体的鉴定
201L2.O11G.2O8
目录
实验设计思路和原理
拟南芥的栽培
拟南芥T-DNA插入突变体 的PCR鉴定
2012.11.28
1
实验设计的思路和原理
经典遗传学是从生物的性状、表型到遗传物质来研
究生命的发生与发展规律。
反向遗传学则是是在获得生物体基因组全部序列的
打开NCBI主页: http://www.ncbi.nl / 打开的页面如下: 在上面的search内查找 基因名称APETALA1:
从上面可以看到一共有19 个结果,其中第一个是拟 南芥中的,点击AP1:
根据上面的信息我们可以
得到基因在拟南芥内的系
统名称:AT1G69120
T-DNA插入双突鉴定

DNA 提取液
上层溶 液
洗涤 干燥
细胞裂 解
异丙醇 沉淀
DNA 溶液
具体步骤
提取缓冲液:200mM Tris-Hcl(PH7.4);
25mM EDTA(PH8.0); 250mM Nacl; 0.5%SDS (1) 取拟南芥两片叶子,置于1.5ml离心管中,加入700ml 提取缓冲液; (2)用研磨棒研磨植物材料,直至缓冲液变为绿色; (3)在台式离心机上12000 rpm离心10分钟; (4)离心后将上清转移至一个新的1.5 ml离心管中; (5)在上清中加入700ml异丙醇,混匀后放入-20℃ 30分钟 然后12000 rpm条件下,离心10分钟; (6)弃上清后,用70%乙醇润洗沉淀,并在室温过夜干燥; (7)100 ml dd H₂O
拟南芥T-DNA插入突变体的鉴定
实验目的
提取植物基因组DNA的方法 PCR操作方法 琼脂糖凝胶分离核酸方法
鉴定纯ห้องสมุดไป่ตู้子为进一步实验做准备
Ti-质粒与植物基因组的相互作用
Ti质粒和T-DNA
Ti质粒毒性区基因激活及 T-DNA复合物生成
T-DNA插入鉴定的原理
(以拟南芥为例)
叶片 研磨 离心 冰浴 离心
PCR-引物设计
/tdnaprimers.2 .html
以salk_080951为例: LP: TTCACAGTTTCAACGTTGTGG RP: GTAGCGTGATTTCGAGTTTGG
BP:
PCR-原理与程序
Condition 94 ℃ 5 min 94 ℃ 15sec 56 ℃ 15sec 72 ℃ 1 min 72 ℃ 10min 4 ℃ forever
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
▪ 第一管:
▪
10xTaq buffer
min,再转移上清入新管。 5. 向上清液中加等体积的冷异丙醇,小心混匀。-20 ℃ 放置30 min,12000 rpm离心10 min,
弃上清。 6. 用70%乙醇洗涤沉淀一次,12000 rpm稍离心,弃上清。 7. 将沉淀在超净工作台上吹干,或空气中晾干。加50 μl TE (pH 8.0)放4 ℃缓慢溶解。 8. 电泳检测DNA的浓度和质量。
▪
81.8 g NaCl
▪
0.2%(V/V)β-巯基乙醇
▪注:先将除巯基乙醇之外的药品配好,高压蒸汽灭菌后加入巯基乙醇
▪酚/氯仿/异戊醇: 25:24:1
▪氯仿/异戊醇: 24:1
▪TE缓冲液:Tris-HCl (pH 8.0) 10 mmol/L,EDTA 1 mmol/L
▪3 M NaAc(pH 5.2)
左引物 LP: TCATCCACCATGGAAGAAAAG 右引物 RP:
TTGGATACGATGCGAGTAACC 中间引物LB: TGGTTCACGTAGTGGGCCATCG 用LP+RP产生大带:1107bp 用LB+RP产生小带:560-860bp
三、实验步骤
▪ 实验材料:拟南芥T-DNA插入突变体分 离群体30个株号的植株。
3. 用PCR方法鉴定T-DNA插入纯合突变体
▪ 农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中, 有T-DNA插入的纯合突变体,杂合突变体,和野生型。在 突变体研究中,需要的材料是纯合突变体,所以必须从分 离群体中将纯合突变体鉴定出来。
▪ PCR方法为鉴定纯合突变体提供了有利手段。它利用三 个引物LP、RP和BP,其中LP和RP是植物基因组上TDNA插入位点两测的引物,BP是T-DNA区段上的引物。 经过PCR,在野生型植株,LP和RP这对引物扩增出分子 量较大的产物(野生型基因,大带);在杂合突变体, LP和RP能扩增出分子量较大的产物(野生型基因,大 带),另外BP和RP还能扩增出分子量较小的产物(小 带);在纯合突变体,只有BP和RP能扩增出分子量较小 的产物(小带)。因此,利用以上三种引物做PCR,根 据扩增结果能够容易地从群体中区分出纯合突变体。
▪ 实验方法:(每人做1个株号的检测)
(一) 拟南芥基因组DNA提取
1. 原理
▪ 分离动物、植物、微生物DNA是进行遗传操
作(基因组DNA序列分析、遗传标记分析、基 因克隆、基因定位)的第一个步骤。不同的研 究目的对DNA对纯度要求高; ▪ 用于PCR分析的DNA则应不含干扰PCR反应的 污染物; ▪ 用于遗传标记分析的DNA,纯度要求低但产量 则要高。
十三 模式植物拟南芥T:
▪ 1. 学习用PCR方法检测生物遗传差异; ▪ 2. 了解植物T-DNA插入突变体的鉴定原理。
二、实验原理
1. Ti质粒和T-DNA ▪ Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的
DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自 发转移,插入植物染色体DNA中,Ti质粒上的这一段能转 移的DNA被叫做T-DNA。人们根据这一现象,将Ti质粒进 行改造,将感兴趣的基因放进T-DNA区段中,通过农杆菌 侵染植物细胞,实现外源基因对植物的遗传转化。 2. T-DNA插入基因内部导致基因突变 ▪ T-DNA插入到植物染色体上的什么位置,是随机的。如果 T-DNA插入某个功能基因的内部,特别是插入到外显子区, 将造成基因功能的丧失。所以利用农杆菌Ti质粒转化植物 细胞,是获得植物突变体的一种重要方法。
▪ 酚/氯仿/异戊醇的作用是去除核酸制品中的蛋白质,并 有利于水相与有机相的分开,而且可以消除泡沫。
▪ 异丙醇或乙醇的作用是脱去DNA周围水分子,使DNA 失水而聚合沉淀。
2、药品
▪CTAB提取液(1000 ml)组成: 20 g CTAB
▪
100 ml 1 M Tris-HCl pH 8.0
▪
40 ml 0.5 M EDTA pH 8.0
3. DNA提取步骤
1. 用液氮将100 mg 幼嫩叶片研磨成细粉,置于1.5 ml 离心管中,加入预热至65℃的600 μl 的2×CTAB提取液,轻摇混匀。
2. 65℃水浴1 h,其间轻摇混匀。 3. 12000 rpm离心15 min,弃沉淀,取上清转移至另一1.5 ml 离心管中。 4. 向上清液加入等体积的氯仿/异戊醇(24:1),轻轻混匀10 min,然后12000 rpm离心15
提取动物、植物、微生物基因组的DNA所面 临的问题不尽相同,在这个实验中学习植物 总DNA提取与鉴定。
▪ 本实验采用CTAB法。 CTAB的主要作用是破膜。
CTAB属阳离子表面活性剂,能溶解膜蛋白与脂类,也 可解聚核蛋白。在高离子强度的溶液里,CTAB与蛋白 质和大多数酸性多聚糖以外的多聚糖形成复合物,但 是不能沉淀核酸。因此,CTAB可以用于从大量产生粘 多糖的有机体如植物以及某些革兰氏阴性菌(包括 E.coli的某些株)中制备纯化DNA 。
注意事项
▪ 1.研磨后应迅速加入提取液,因为提取液中含 EDTA,能够螯合Mg2+等二价阳离子,防止破碎 细胞中的DNA酶降解DNA。
▪ 2.提取过程中,避免剧烈震荡,以免对DNA造 成不必要的机械损伤。
▪ 3. 干燥DNA时,要注意过干或过湿都不利于 DNA的溶解。
(二) PCR反应
步骤
▪ 1. 按如下方法调制PCR反应液,因每管加样量少,可几人一组预混除模板DNA之外的 成分。分装后各人再加入自己的模板DNA。PCR管上注意写明株号和引物类型:
一个好的分离程序应符合三个标准: ①所得DNA的纯度满足下游操作要求; ②所得DNA应完整; ③所得DNA量足够。
DNA在化学上是稳定的,但它在物理上是易 碎的,高分子质量的DNA长而弯曲,即具有 极微弱的侧向稳定性,易受到最柔和的流体 剪切力的伤害,由吸液、振荡、搅拌所致的 水流能剪切断DNA双链。
