第4章红外吸收光谱法
仪器分析3—红外吸收光谱法

傅立叶变换红外光谱仪
样品池
红外光源
摆动的 凹面镜
迈克尔逊 干扰仪
参比池
摆动的 凹面镜
检测器 干涉图谱 计算机 解析 还原
M1 II
同步摆动
I M2
红外谱图
BS
D
仪器组成
第五节 红外光谱法应用
红外光谱法由于操作简单,分析速度 快,样品用量少,不破坏样品,特征性 强等优点,在有机定性分析中应用广泛。 利用红外光谱可对化合物进行鉴定或结 构测定。 但由于吸收较复杂,在定量分析方面 应用受到一定限制。
第四章 红外吸收光谱分析法(IR)
Infrared Absorption Spectrometry
第一节
红外光谱基本知识
1、红外线波长范围: 光学光谱区域:10nm ~1000μm; 其中:10nm ~400nm为紫外光区 400nm ~760nm为可见光区, 760nm ~ 1000μm为红外光区。 为表示方便,红外光不用nm(纳米) 而用微米( μm)表示其波长。
由原理图可见,红外分光光度计也主要 由光源、样品吸收池、单色器、检测器、 记录仪等部件构成。 1、光源:能斯特灯或硅碳棒
红外光谱仪中所用的光源通常是一种惰性固体,用 电加热使之发射高强度的连续红外辐射。 常用的是Nernst灯或硅碳棒。 Nernst灯是用氧化锆、氧化钇和氧化钍烧结而成的 中空棒和实心棒。工作温度约为1700℃,在此高温下导 电并发射红外线。但在室温下是非导体,因此,在工作 之前要预热。它的特点是发射强度高,使用寿命长,稳 定性较好。 硅碳棒是由碳化硅烧结而成,工作温度在1200-1500℃ 左右。
ε>100 非常强峰(vs) 20<ε<100 强 峰(s) 10<ε<20 中强峰(m) 1<ε<10 弱 峰(w)
第四章 红外光谱

电磁波的波长( )、频率( v)、能量(E)之间的关系:
2020/3/20
3
二、红外光谱的表示方法
红外光谱是研究波数在4000-400cm-1范围内不同
波长的红外光通过化合物后被吸收的谱图。谱图以波 长或波数为横坐标,以透过率为纵坐标而形成。
横坐标:波长/λ或波数/cm-1。 纵坐标:吸光度A或透过率T,
N为分子中成键原子的个数。
例1: H O H 为非线状分子,应有3N-6=9-6=3个峰。
2020/3/20
15
例2:O=C=O为线状分子,便有3N-5=9-5= 4个峰。
Why? ①νs O=C=O 不改变分子的偶极矩; ②δs O=C=O 与δw + O=C=O + 简并。
2020/3/20
16
1900~2500 cm-1,主要是:C≡C、C≡N 三键和 C=C=C、C=N=O 等累积双键的伸缩振动吸收峰。
(3) Y=Z双键伸缩振动区(第三峰区) :
1500~1900 cm-1,主要是:C=O、C=N、C=C等双 键存在。
2020/3/20
13
2)指纹区:
<1500 cm-1的低频区,主要是:C-C、C-N、 C-O等单键和各种弯曲振动的吸收峰,其特点是谱带 密集、难以辨认。
2020/3/20
1
4.1 基本原理
红外光谱就是当红外光照射有机物时,用仪器记录 下来的吸收情况(被吸收光的波长及强度等),用来进行 分析的方法。红外线可分为三个区域:
红外光谱法主要讨论有机物对中红区的吸收(振动能 级跃迁)。
2020/3/20
2
红外光谱的基本原理:
用不断改变波长的红外光照射样品,当某一波长的频 率刚好与分子中某一化学键的振动频率相同时,分子就会 吸收红外光,产生吸收峰。用波长(λ)或波长的倒数波 数(cm-1)为横坐标,百分透光率(T%)或吸收度(A) 为纵坐标做图,得到红外吸收光谱图(IR)。分子振动所 需能量对应波数范围在400 cm-1~4000 cm-1。
第四章 傅里叶红外光谱

4
10 ―――波数(cm-1)
―――波长 (µm)
(11)
1 2 )
4.2 润滑油的傅里叶红外光谱分析
4.2.2 红外光谱定量分析原理
分子基团对红Biblioteka 辐射的特征吸收是进行定量分析的基础
样品的吸光性通过分光计进行间接的测量
红外光照射样品后到达分光检测器的光强 强度 之比称为透过率 ,即:
子基团的特征吸收谱带也叫特征峰。吸收谱带极大值的波数位置 称为特征频率。进行基团定性时,是根据基团特征吸收峰来判断 基团的存在与否
(10)
4.2 润滑油的傅里叶红外光谱分析
波数是红外吸收光谱图横坐标常用的物理量之一,单位为cm-1。它 是描述红外线振动特性的物理量。波数与波长的换算关系是:
式中:
(22)
4.3 在用油红外光谱参数的识别
通常表征润滑油硝化的峰位在~1630 cm-1附近;典型值则为20A·cm-1,高值 >40 A·cm-1
图为新油和深度硝化在用油的红外光谱 对比(上谱线为深度硝化在用油,下谱 线为新油),硝化深度的急剧增加,意 味着因高温和燃烧条件恶化而生成了大 量的氮氧化物
(3)
4.1 傅里叶红外光谱仪法
4.1.1 傅里叶红外光谱仪的工作原理 红外光谱仪(FT-IR)主要由红外光源、 吸收池、分光系统、检测 系统等几部分组成 检测时,从光源发出的红外光,经过迈克尔逊干涉仪变成干涉光 (消除杂光),再让干涉光经过样品,到探测器,探测器检测到透 过油样的红外线强度,并将其转换成与油样成分、含量相对应的电 压值,然后利用计算机系统把干涉图进行数字变换,最后得到光谱 图 FT-IR光谱仪的核心光学部件为迈科尔逊干涉仪,干涉仪的使用, 提高了红外光谱仪的灵敏度和准确性
(完整版)红外吸收光谱法教案

第六章红外吸收光谱法
基本要点:
1.红外光谱分析基本原理;
2.红外光谱与有机化合物结构;
3.各类化合物的特征基团频率;
4.红外光谱的应用;
5.红外光谱仪.
学时安排:3学时
第一节概述
分子的振动能量比转动能量大,当发生振动能级跃迁时,不可避免地伴随有转动能级的跃迁,所以无法测量纯粹的振动光谱,而只能得到分子的振动-转动光谱,这种光谱称为红外吸收光谱。
红外吸收光谱也是一种分子吸收光谱。
当样品受到频率连续变化的红外光照射时,分子吸收了某些频率的辐射,并由其振动或转动运动引起偶极矩的净变化,产生分子振动和转动能级从基态到激发态的跃迁,使相应于这些吸收区域的透射光强度减弱。
记录红外光的百分透射比与波数或波长关系曲线,就得到红外光谱。
一、红外光区的划分
红外光谱在可见光区和微波光区之间,波长范围约为0.75 ~ 1000μm,根据仪器技术和应用不同,习惯上又将红外光区分为三个
1。
波谱分析第四章IR谱

2400-2100
1850-1650 1680-1500 1475-1000 1000-650
νC≡C νC≡N νc=C=C,N=C=O νc=O(醛、酮、酸、 酯、酰胺、酐) νC=C νC=N δC-H(饱和)νC-O νC-C νC-O-C γ≡C-H γAr-H γCH 2
★ 其中4000-1300 cm-1为官能团区,在这个区 域,每个红外吸收峰都和一定官能团相对应, 原则上每个吸收峰均可找到归属。 ★ 1300-400cm-1为指纹区,在此区域内红外 吸收峰很多,大量吸收峰仅显示了化合物的红 外特性,其中大部分不能找到归属,但这大量 的吸收峰表示了有机化合物分子的具体特征, 犹如人的指纹。 ☆ 两个不同的化合物在指纹区一定有不同的峰。 因此要注意的是:若把未知物IR谱与已知标准 谱图比较,不仅官能团区要吻合,指纹区也要 完全吻合才是同一化合物。
4.1.2红外光谱区域 习惯上按红外线波长,将红外光谱分成三 个区域: 近红外:0.78-2.5μm(12820-4000cm-1) 中红外:2.5-25μm(4000-400cm-1) 远红外:25-300μm(400-33cm-1)。 其中中红外区是IR谱研究的主要区域。
4.1.3红外光谱图表示法。实例说明。 纵坐标:百分透过率;(T﹪) 横坐标:吸收频率(cm-1)。
μ﹦q· d
式中:q表示正或负电荷电量,d表示正负电 荷中心距离。 例如:H2O是极性分子,正、负电荷中心距离 为d,三个原子在平衡位置总是不断的振动, 振动过程中,d的瞬时值随着化学键的伸长或 缩短而不断的发生变化,因此分子的偶极矩也 发生相应的改变,分子也就具有确定的偶极矩 变化频率。
红外吸收光谱法

图4.3 聚苯乙烯红外光谱图
四、紫外吸收光谱与红外吸收光谱的区别
1. 光谱产生的机制不同 紫外:电子光谱; 红外:振-转光谱
2. 研究对象和使用范围不同 紫外:研究不饱和化合物,具有共轭体系; 红外:凡是在振动中伴随有偶极矩变化的化合
物都是红外光谱研究的对象。可研究几乎所有的有 机物。
04:04:06
04:04:06
二、红外光区的划分
表4.1 红外光谱区划分
区
域
/m
/cm-1
能级跃迁类型
近红外(泛频区)
0.78~2.5
12820~4000
O-H、N-H和C-H键的 倍频吸收区
中红外(基本振动区) 2.5~50 4000~00~10
04:04:06
红外光谱的表示方法
红外光谱图:纵坐标为透光率(或吸光度),横坐标为波长 λ( m )和波数1/λ ,单位:cm-1。 / cm1 104
/ m
04:04:06
图4.1 苯酚的IR吸收光谱
04:04:06
图4.2乌桕油的IR光谱
04:04:06
04:04:06
分子的转动,骨架振 动
最常用的
2.5~15 4000~650
04:04:06
3. 红外光谱特点 1)红外吸收只有振-转跃迁,能量低; 2)应用范围广:除单原子分子及单核分子外,几乎所有有
机物均有红外吸收; 3)分子结构更为精细的表征:通过IR谱的波数位置、波峰
数目及强度确定分子基团、分子结构; 4)定量分析; 5)固、液、气态样均可用,且用量少、不破坏样品; 6)分析速度快。
五、红外光谱法的特点和应用
特点:与紫外-可见吸收光谱比较 (1) 除了单原子分子和同核双原子分子等少数 分子外,几乎所有化合物均可用红外吸收光谱法 进行研究。适用范围广。 (2)红外光谱可对物质的组成和结构特征提供 十分丰富的信息。其最重要和最广泛的用途是对 有机化合物进行结构分析。
红外光谱分析法

理论振动数( 峰数) 理论振动数 ( 峰数 )
设分子的原子数为n, 设分子的原子数为 , 对非线型分子,理 对非线型分子 理 论振动数=3n-6 论振动数 分子, 如H2O分子,其振 分子 动数为3 动数为 ×3-6=3 对线型分子, 对线型分子,理论 振动数=3n-5 振动数 分子, 如CO2分子,其理 论振动数为3 论振动数为 ×3-5=4
4000~400/cm-1
分子振动转动 (常用区) 常用区)
远红外(转动区 远红外 转动区) 转动区 (25-1000 m)
400~10/cm-1
分子转动
分区及波长范围
跃迁类型
3. 红外光谱特点 1)红外吸收只有振-转跃迁,能量低; )红外吸收只有振 转跃迁 能量低; 转跃迁, 2)应用范围广:除单原子分子及单核分子外,几乎所有有 )应用范围广:除单原子分子及单核分子外, 机物均有红外吸收; 机物均有红外吸收; 3)分子结构更为精细的表征:通过 谱的波数位置,波峰 )分子结构更为精细的表征:通过IR谱的波数位置 谱的波数位置, 数目及强度确定分子基团,分子结构; 数目及强度确定分子基团,分子结构; 4)定量分析; )定量分析; 5)固,液,气态样均可用,且用量少,不破坏样品; ) 气态样均可用,且用量少,不破坏样品; 6)分析速度快. )分析速度快. 7)与色谱等联用(GC-FTIR)具有强大的定性功能. ) 具有强大的定性功能.
2)多原子分子 ) 多原子分子的振动更为复杂 ,但可将其分解为多个简 但可将其分解为多个简 正振动来研究. 正振动来研究. 简正振动基本形式 伸缩振动ν 原子沿键轴方向伸缩, 伸缩振动ν:原子沿键轴方向伸缩,键长变化但键角不变 的振动. 的振动. 变形振动δ 基团键角发生周期性变化, 变形振动δ:基团键角发生周期性变化,但键长不变的振 弯曲振动或变角振动. 动.又称 弯曲振动或变角振动. 下图给出了各种可能的振动形式( 下图给出了各种可能的振动形式 ( 以甲基和亚甲基为 例).
第四章 红外分光光光度法(书后习题参考答案)

第四章 红外分光光光度法(书后习题参考答案)1.CO 的红外光谱在2 170cm -1处有一振动吸收峰.问(1)CO 键的力常数是多少?(2)14CO 的对应峰应在多少波数处发生吸收? 解:碳原子的质量2323100.210022.612--⨯=⨯=C m g氧原子的质量2323106.210022.616--⨯=⨯=O m g (1) σ =2071cm -1O C O C m m m m k c ⋅+=)(21πσ 2346210210)6.22(106.22)217010314.32()2(--⨯+⨯⨯⨯⨯⨯⨯⨯=+=O C O C m m m m c k σπ =18.6×105 dyn·cm -1=18.6N·cm -1(厘米克秒制)(2)14CO 2323103.210022.614-⨯=⨯=C m g2071106.23.210)6.23.2(106.1810314.3214623510≈⨯⨯⨯+⨯⨯⨯⨯⨯⨯=--σcm -1或O C O C O C O C m m m m m m m m +⋅⨯⋅+=1212141412σσ σ =2080cm -12.已知C―H 键的力常数为5N/cm ,试计算C―H 键伸展振动的吸收峰在何波数?若将氘(D )置换H ,C―D 键的振动吸收峰为多少波数.解:C-H 键:k =5N·cm -1=5.0×105dyn·cm -1碳原子的质量:m C =2.0×10-23g, 氢原子的质量:23231017.010022.61--⨯=⨯=H m g氘原子的质量: 23231034.010022.62--⨯=⨯=D m g 依2121)(21m m m m k c ⋅+=πσ得29961017.00.210)17.00.2(10510314.3214623510≈⨯⨯⨯+⨯⨯⨯⨯⨯⨯=--σcm -121991034.00.210)34.00.2(10510314.3214623510≈⨯⨯⨯+⨯⨯⨯⨯⨯⨯=--σcm -13.指出以下振动在红外光谱中是活性的还是非活性的分 子 振 动(1)CH 3一CH 3 C―C 伸缩振动(2)CH 3一CC13 C―C 伸缩振动(3)SO 2 对称伸缩振动(4)CH 2=CH 2 C―H 伸缩振动C CH H(5)CH 2=CH 2 C―H 伸缩振动C CH H(6)CH 2=CH 2 CH 2摆动 C CHH H(7)CH 2=CH 2 CH 2扭曲振动C CHH H H解:非红外活性:(1), (5), (7)红外活性:(2), (4), (6), (8)4.下面三个图形(图4-20)分别为二甲苯的三种异构体的红外光谱图。
红外吸收光谱法

作业题第四章红外分光光度法第一节概述填空题1、红外光区位于光区和光区之间,波长范围为,习惯上又可将其细分为、和三个光区,应用较多的是光区。
2、红外谱图纵坐标一般为,横坐标一般为。
简答题:红外分光光度法的特点。
第二节基本原理1、分子内部的运动方式有三种,即:、和,相应于这三种不同的运动形式,分子具有能级、能级和能级。
2、一般多原子分子的振动类型分为振动和振动。
3、乙烷的振动自由度是。
4、甲酸的振动自由度是。
判断题:1、对称结构分子,如H2O分子,没有红外活性。
()2、水分子的H-O-H对称伸缩振动不产生吸收峰。
()选择题:1、试比较同一周期内下列情况的伸缩振动(不考虑费米共振与生成氢键)产生的红外吸收峰, 频率最小的是( )A C-HB N-HC O-HD F-H3、判断下列各分子的碳碳对称伸缩振动在红外光谱中哪个是非活性的()A.CH3CH3 B. CH3CCl3C.C CHClHCl D.C CHClClH6、乙烯分子的振动自由度为:A.20B.13C.12D.6E.15答案:DADCCCDEB简答题:1、红外吸收光谱与紫外-可见吸收光谱在谱图的描述及应用方面有何不同?2、什么是红外非活性振动?3、分子吸收红外辐射而发生能级跃迁的必要条件是什么?4、峰位的影响应因素有哪些?5、红外吸收峰强度取决于什么?6、以亚甲基为例说明分子的基本振动模式。
7、特征区和指纹区各有何特点?它们在图谱解析中主要解决哪些问题?第三节红外光谱和分子结构的关系填空题:1、在苯的红外吸收光谱图中(1) 3300~3000cm-1处, 由________υ=CH ________________振动引起的吸收峰(2) 1675~1400cm-1处, 由________υC=C ________________振动引起的吸收峰(3) 1000~650cm-1处, 由__________γC-H ______________振动引起的吸收峰简答题:1、试用红外光谱法区别下列异构体:(1)CH3CH2CH2CH2OH CH3CH2OCH2CH3(2)CH3CH2COOH CH3COOCH3(3)O O2、试解释下列各组化合物羰基C=O伸缩振动吸收频率变化的原因。
红外吸收光谱分析法 红外谱图解析

顺式烯 乙烯基烯 亚乙烯基烯
08:12:21
R1 H R1 H R1 R2
1660cm-1
1660-1630cm-1
中强,尖
总结
ⅰ 分界线1660cm-1 ⅱ 顺强,反弱
ⅲ 四取代(不与O,N等相连)无υ
ⅳ 端烯的强度强
(C=C)峰
ⅴ共轭使υ
下降20-30 cm-1 (C=C)
H C C R R1 C C R2
08:12:21
υ υ
C C
2140-2100cm-1 (弱) 2260-2190 cm-1 (弱)
C C
c)C-H 变形振动(1000-700 cm-1 )
面内变形(=C-H)1400-1420 cm-1 (弱) 面外变形(=C-H) 1000-700 cm-1 (有价值)
R1 H R1 R2 R1 R2 C C R4
O—H,C—O
a)-OH 伸缩振动(>3600 cm-1) b)碳氧伸缩振动(1100 cm-1)
C Cα C Cα′ C C Cα″ β
υ
(C-O)
OH
υ
游 离 仲-OH 醇, 叔-OH 酚 酚-OH 伯-OH
(—OH) 3640cm-1 3630cm-1 3620cm-1 3610cm-1
1050 cm-1 1100 cm-1 1150 cm-1 1200 cm-1
第四章 红外吸收光谱分 析法
infrared absorption spec-troscopy,IR
一、红外谱图解析
analysis of infrared spectrograph
二、未知物结构确定
structure determination of compounds
第四章红外吸收光谱法3、CO的红外吸收光谱在2170cm-1处有一振动
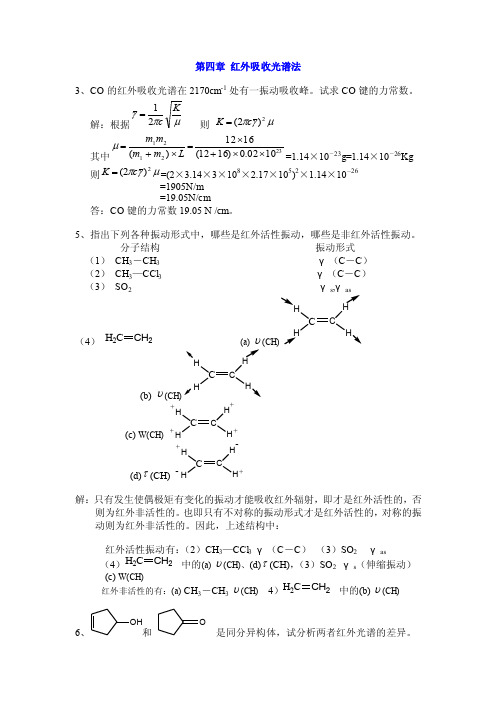
第四章 红外吸收光谱法3、CO 的红外吸收光谱在2170cm -1处有一振动吸收峰。
试求CO 键的力常数。
解:根据μπγKc 21= 则 μγπ2)2(c K = 其中2321211002.0)1612(1612)(⨯⨯+⨯=⨯+=L m m m m μ=1.14×10-23g=1.14×10-26Kg 则μγπ2)2(c K ==(2×3.14×3×108×2.17×105)2×1.14×10-26 =1905N/m=19.05N/cm答:CO 键的力常数19.05 N /cm 。
5、指出下列各种振动形式中,哪些是红外活性振动,哪些是非红外活性振动。
分子结构 振动形式(1) CH 3-CH 3 γ(C -C )(2) CH 3—CCl 3 γ(C -C )(3) SO 2 γs ,γ(4)H 2C CH 2 (a) υ(CH)CC(b) υ(CH)CH C (c) W(CH) C HHC H H ++++(d)τ(CH) C H H C H -++-解:只有发生使偶极矩有变化的振动才能吸收红外辐射,即才是红外活性的,否则为红外非活性的。
也即只有不对称的振动形式才是红外活性的,对称的振动则为红外非活性的。
因此,上述结构中:红外活性振动有:(2)CH 3—CCl 3 γ(C -C ) (3)SO 2 γas(4)H 2C CH 2 中的(a) υ(CH)、(d)τ(CH),(3)SO 2 γs (伸缩振动) (c) W(CH)红外非活性的有:(a) CH 3-CH 3 υ(CH) 4)H 2C CH 2 中的(b) υ(CH)6、OH 和 O是同分异构体,试分析两者红外光谱的差异。
答:由于OH中含有一个-OH 基团,因此在红外光谱中有一强吸收峰在3700~3100cm -1,且此分子中含有一个C=C 双键,因此在1680~1620cm -1也有一较弱的吸收峰。
仪器分析 第四章--红外吸收光谱法

章节重点:
分子振动基本形式及自由度计算;
红外吸收的产生2个条件;
各类基团特征红外振动频率;
影响红外吸收峰位变化的因素。
第八章 红外吸收光谱分 析法
第三节 红外分光光度计
1. 仪器类型与结构
2. 制样方法
3. 联用技术
1. 仪器类型与结构
两种类型:色散型 干涉型(傅立叶变换红外光谱仪)
弯曲振动:
1.4 振动自由度
多原子分子振动形式的多少用振动自由度标示。
三维空间中,每个原子都能沿x、y、z三个坐标方向独 立运动,n个原子组成的分子则有3n个独立运动,再除 掉三个坐标轴方向的分子平移及整体分子转动。
非线性分子振动自由度为3n-6,如H2O有3个自由度。 线性分子振动自由度为3n-5,如CO2有4个自由度。
某些键的伸缩力常数:
键类型: 力常数: 峰位:源自-CC15 2062 cm-1
-C=C10 1683 cm-1
-C-C5 1190 cm-1
-C-H5.1 2920 cm-1
化学键键强越强(即键的力常数K越大),原子折合 质量越小,化学键振动频率越大,吸收峰在高波数区。
1.2 非谐振子
实际上双原子分子并非理想的谐振子!随着振动量子 数的增加,上下振动能级间的间隔逐渐减小!
(1)-O-H,37003100 cm-1,确定醇、酚、酸 在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐 ,强吸收;当浓度较大时,发生缔合作用,峰形较宽。
注意区分: -NH伸缩振动:3500 3300 cm-1 峰型尖锐
(2)饱和碳原子上的-C-H -CH3 2960 cm-1 2870 cm-1 反对称伸缩振动 对称伸缩振动
第4章 红外吸收光谱法(无机)

3.振动的非谐性 振动的基频: 振动的基频: 0→1振动能级的跃迁 v 0→1 振动的倍频: 振动的倍频: 0 → 2、3、4….振动能级的跃迁 v 0→2、 v 0→3 、 v 0→4 振动的组频: 振动的组频: 基频的和 振动的差频: 振动的差频: 基频的差 v 10 → 1 + v 20 → 1 v 10 → 1 - v 20 → 1
κ µ
振动能级的跃迁, 基本振动频率或 当△V =1时,0→ 1振动能级的跃迁,称为基本振动频率或基频吸收带。 时 振动能级的跃迁 称为基本振动频率 基频吸收带。 例1: 由表中查知 C=C 键的 k= 9.5 ~9.9 (N/cm) ,令其为9.6, 计算正己 令其为9.6, 烯中C=C键伸缩振动频率,实测值为1652 C=C键伸缩振动频率 烯中C=C键伸缩振动频率,实测值为1652 cm-1
五、影响红外吸收峰强度的因素
1.红外吸收峰强度的分类 . ε >100 20<ε<100 10<ε< 20 1<ε<10 非常强吸收峰 强吸收峰 中强吸收峰 弱吸收峰 vs s m w
2. 红外吸收峰强度的影响因素 振动能级的跃迁几率 振动的基频(v0→1) 的跃迁几率大于振动的倍频(v0→2、v 振动的基频 的跃迁几率大于振动的倍频 的吸收峰强度比倍频(v ,因此基频( 0→3、v 0→4),因此基频 v 0→1) 的吸收峰强度比倍频 0→2、 v0→3、v0→4 )强。 强 振动能级跃迁时, 振动能级跃迁时,偶极矩的变化 同样的基频振动(v 偶极矩的变化越大 同样的基频振动 0→1),偶极矩的变化越大,吸收峰也 越强。 越强。 化学键两端连接原子的电负性相差越大, 化学键两端连接原子的电负性相差越大,或分子的对称 性越差,伸缩振动时偶极矩的变化越 偶极矩的变化越大 吸收峰也越强。 性越差,伸缩振动时偶极矩的变化越大,吸收峰也越强。 吸收峰强度: 反对称伸缩振动>对称伸缩振动 对称伸缩振动>变形振动 吸收峰强度: 反对称伸缩振动 对称伸缩振动 变形振动 vC=O> vC=C
仪器分析 第4章 红外吸收光谱法

4.2 基本原理
4.2.3 多原子分子的振动类型(P56)
伸缩振动 (υ):键长发生变化 1.简正振动基本形式 变形振动 (δ):键角发生变化
伸缩振动(υ)
对称伸缩振动(υs)
不对称伸缩振动(υas)
变形振动(δ)
面内变形振动(β)
面外变形振动(γ)
亚甲基的各种振动形式
2. 基本振动的理论数(分子振动自由度)
4.4 试样的处理和制备
4.4 试样的处理和制备
4.4.1 红外光谱法对试样的要求 (1)单一组分纯物质,纯度 > 98%; (2)样品中不含游离水; (3)要选择合适的浓度和测试厚度, 使大多数吸收峰透射比处于10%~80%。
4.4 试样的处理和制备
4.4.2 制样方法 1.气体样品的制备 2.液体和溶液样品的制备 3.固体样品的制备
分子振动自由度:多原子分子的基本振动
数目,也就是基频吸收峰的数目。
基频吸收峰:分子吸收一定频率的红外光后,
其振动能级由基态跃迁到第一
激发态时所产生的吸收峰。
2. 基本振动的理论数
线型分子振动自由度 = 3N – 5(如CO2)
非线型分子振动自由度 = 3N – 6(如H2O)
图5.12 CO2分子的简正振 动形式
来指导谱图解析。
基本概念
基团频率区: 在4000~1300cm-1 范围内的吸收峰,有一 共同特点:既每一吸收峰都和一定的官能 团相对应,因此称为基团频率区。
在基团频率区,原则上每个吸收峰都可以找到归属。
基本概念
指纹区: 在1300~400cm-1范围内,虽然有些吸收也对应 着某些官能团,但大量吸收峰仅显示了化合物 的红外特征,犹如人的指纹,故称为指纹区。
分析化学(仪器分析)第四章-仪器分析(IR)

30
第二节 红外吸收基本理论
振动过程中偶极矩发生变化(△≠0) 的分子振动能引起可观测的红外吸收光谱, 称之为红外活性的。 振动过程中偶极矩不发生变化(△=0) 的分子振动不能产生红外吸收光谱,称为非 红外活性的。
31
第二节 红外吸收基本理论
绝大多数化合物在红外光谱图上出现的峰数远 小于理论上计算的振动数,这是由如下原因引起的: (1)没有偶极矩变化的振动,不产生红外吸收; (2)相同频率的振动吸收重叠,即简并; (3)仪器不能区别频率十分接近的振动,或吸收带 很弱,仪器无法检测; (4)有些吸收带落在仪器检测范围之外。
33
第二节 红外吸收基本理论
(二)吸收谱带的强度
红外吸收谱带的强度取决于分子振动时偶极矩 的变化,红外光谱的强度与分子振动时偶极矩变 化的平方成正比。 偶极矩的变化与分子的极性以及分子结构的对 称性,也就是固有偶极矩有关。极性较强的基团 (如C=O,C-X等)吸收强度较大,极性较弱的 基团(如C=C、C-C、N=N等)吸收较弱。分子 的对称性越高,振动中分子偶极矩变化越小,谱 带强度也就越弱。
28
第二节 红外吸收基本理论
在倍频峰中,二倍频峰还比较强。三倍频峰以 上,因跃迁几率很小,一般都很弱,常常不能测到。 除此之外,还有合频峰(1+2,21+2, ),差频峰( 1-2,21-2, )等,这些 峰多数很弱,一般不容易辨认。倍频峰、合频峰和 差频峰统称为泛频峰,泛频峰一般都很弱。
11
第二节 红外吸收基本理论
根据Hooke定律,分子 简谐振动的频率的计算 公式为
12
第二节 红外吸收基本理论
式中k为化学键的力常数,定义为将两原子由 平衡位置伸长单位长度时的恢复力(单位为Ncm -1)单键、双键和三键的力常数分别近似为 5、 1 0和15 Ncm-1;c为光速(2.9981010cm s-1), 为折合质量,单位为g,且 影响分子振动频率的直接原因是原子质量和 化学键的力常数。
红外分光光度法

CH 2 909cm1
七、吸收峰峰位及影响因素
1、吸收峰峰位(位置) 即振动能级跃迁所吸收红外线的波长(T-)或波数(T-) , 是红外光谱鉴定中的主要依据。
max , max 或 max
1)基本振动频率
√ 1
= 2
k
√ √ 1
= 2C
k
’
= 1302
k
’
(cm-1)
C、氢键效应:使伸缩振动频率降低
分子内氢键:对峰位的影响大,不受浓度影响
七、吸收峰峰位及影响因素
C、氢键效应:使伸缩振动频率降低
分子间氢键:受浓度影响较大,稀释后,吸收峰位发生变化
七、吸收峰峰位及影响因素
D、杂化的影响
杂化轨道中s 轨道成分↑,键能↑,键长↓,↑
饱和C 原子 sp3杂化 CH(饱和) 3000cm1 不饱和C 原子 sp2或sp杂化 CH(不饱和) 3000cm1
• 特征峰仅代表基团的一种振动形式 • 相关峰的数目与基团的活性振动及光谱的波数范围有关 • 用一组相关峰才可以确定一个官能团的存在 • 用一组相关峰鉴定一个基团的存在,是解析IR图谱的原则
图示
CN 2247cm1
as CH 2
3090cm1
CC 1639cm1
CH 990cm1
ΔV 2 νL 2ν
V 3 L 3
泛频峰跃迁几率小,强度较弱, 难辨认→却增加了光谱特征性
2、特征峰(特征频率)与相关峰 (根据吸收峰的频率与基团结构之间的关系区分)
1)特征峰 可用于鉴别官能团存在、又容易辨认的吸收峰
2)相关峰 由一个官能团所产生的一组具有相互依存、相互佐证关 系的特征峰
第四章 红外光谱分析法
第四章红外光谱分析法§4—1红外光谱简介红外辐射泛指位于可见光和微波段之间的那一部分电磁波谱.对有机化学家最有实际用处的是只限于4000—666厘米-1(2.5-15.0微米)之间的范围.最近,对近红外区14290—4000(0.7一2.5微米)和远红外区700—200厘米-1(14.3—50微米)的兴趣正在增加.在红外光谱分析中,一个十分简单的分子也可以给出一个非常复杂的红外光谱图.有机化学家就是利用这种光谱图的复杂性,将一个未知化合物的光谱图与一个可靠的标准品的光谱图相互比较,两张光谱图中峰对峰的完全一致对于鉴定就是最好的证据.除了光学对映体外的任何两个化合物均不可能给出相同的红外光谱图.虽然,红外光谱图是整个分子的特性,但是不管分子其余部分的结构如何,结果是某一特定的原子基团总是在相同的或者几乎是相同的频率处产生吸收谱带.正是这种特征谱带的不变性使化学家可以,通过简单的观察并参考有关特征基团频率的综合图嵌来获得有用的结构信息.我们将主要依靠这些特征基团频率.由于我们并不单纯依靠红外光谱图进行鉴定,因此,并不需要对红外光谱图进行详细的分析.根据我们的总的计划,在这里将提出为达到下列目的,所必需的理论:即把红外光谱图与其它的光谱数据一起用来确定分子结构.因为大多数大学的和工业的实验室都把红外分光光度计作为有机化学家的一种常备的基本工具,在这一章中将比其它各章较详细地叙述仪器和样品制备.红外光谱法作为实用有机化学家的一种工具,从已经出版书籍的数目可以明显地看到.在这些书中,有的是全部地、有的是部分地讨论了红外光谱法的应用。
.一、红外光的表征近红外(泛频区)0.75-2.5微米;13334-4000波数中红外(基频区) 2.5 -25 微米4000-400 波数远红外(转动区)25-1000微米400-10 波数由于中红外区能最深刻地反映分子内部所进行的各种物理过程以及分子结构方面的各种特性,对于解决分子结构和化学组成各种问题最为有效。
红外光谱基本原理

22
二、红外光谱的分区
常见的有机化合物基团频率出现的范围:4000 600 cm-1 可分为:4000-1300cm-1的高波数段官能团区,以及1300cm-1 以下的低波数段指纹区。
官能团区的峰是由伸缩振动产生的,基团的特征吸收峰一般位于该区, 分布较稀疏,容易分辨。
6
红外光谱的表示方法
红外光谱图:
纵坐标为透光率T%,横坐标为波长λ(m )或波数1/λ(cm-1) 可以用峰数,峰位,峰形,峰强来描述。 应用:有机化合物的结构解析。 定性:基团的特征吸收频率; 定量:特征峰的强度;
7
第一节 红外光谱法的基本原理 一、产生红外吸收的条件
满足两个条件: (1)红外辐射光子的能量与分子振动能级跃迁所需能量相同。 (2)辐射与物质间有相互耦合作用(偶极距有变化)。
5
红外光谱与紫外可见光谱的区别
1.光谱产生的机制不同
分子振动和转动能级的跃迁;价电子和分子轨道上的电子在电子能级
上的跃迁。
2. 研究对象不同
在振动中伴随有偶极矩变化的化合物;不饱合有机化合物特别是具有 共轭体系的有机化合物。
3.可分析的试样形式不同,使用范围不同
气、液、固均可,既可定性又可定量,非破坏性分析;既可定性又可 定量,有时是试样破坏性的。
12
/ cm1 1 1 k 1307 k'
2c
Ar
k单位:dyn·cm-1;k’单位:N·cm-1,与键能和键长有关,
为双原子的原子质量折合质量: =m1·m2 /(m1+m2),
Ar为双原子的原子量的折合质量:Ar =M1·M2/ M1+M2 发生振动能级跃迁需要能量的大小取决于键两端原子的
红外吸收光谱法(重点难点讲解)

只有伴随有瞬间偶极矩变化的振动才能产生红外吸收
具有红外吸收的振动方式称为具有红外活性; 具有红外吸收的分子成为红外活性分子 分子是否有红外活性,与分子是否有永久偶极矩无关 如:CO2的永久偶极矩为0,但有红外活性 红外光谱研究的对象 ——振动中伴随有瞬间偶极矩变化的所有分子 除单原子分子和同核分子如H2等外的所有无机和有机物分子
红外吸收光谱法
Infrared spectroscopy
IR
1、红外光谱的基本原理
本 章 主 要 内 容
红外光谱产生的条件 分子的振动频率、振动类型及振动自由 度与红外光谱的关系 影响红外光谱强度及基团频率的因素
2、红外光谱仪
色散型红外光谱仪的结构及特点 傅立叶变换红外光谱仪的结构及特点 红外光谱仪的常用光源与检测器
二、双原子分子的振动
(2)基本振动公式
振动频率
——谐振子振动
化学键的键力常数(将两原子由平衡位置 伸长单位长度时的恢复力,单位为N· cm1)
k 与键的种类及成键原子有关
振动 频率 两原子的折合质量 单键:k = 4~6N· cm-1; 双键:k = 8~12N· cm-1 ; 叁键:k = 12~18N· cm-1;
3、红外光谱实验技术——样品制备
4、红外光谱法的应用
红外光谱解谱的一般步骤及方法 重要的基团频率
§10-1 引 言
一、红外吸收光谱法的定义
当样品受到频率连续变化的红外光照射时,分子吸收了某 些频率的辐射,产生分子振动和转动能级从基态到激发态 的跃迁,从而进行定性、定量和结构分析的分子吸收光谱 方法。
O-H、N-H和C-H键等 某些物质的定量分 的倍频及合频吸收; 析(较少使用), 特别适合原位、无 属于禁阻跃迁,吸收弱, 损及在线分析 峰重叠较明显 各种化学键的振动并伴 物质定性、定量及 随转动的基频吸收; 结构分子的主要光 谱区 强吸收度大。 分子的转动跃迁吸收; 无机物的结构分析 弱吸收。
第四章红外吸收

二是用于化学组成的分析
红外光谱最广泛的应用在于对物质的化学 组成进行分析,用红外光谱法可以根据光 谱中吸收峰的位置和形状来推断未知物结 构,依照特征吸收峰的强度来测定混合物 中各组分的含量,它已成为现代结构化学、 分析化学最常用和不可缺少的工具。
2 红外光区的划分
习惯上按红外线波长,将红外光谱分成三个区域: (1)近红外区:0.78~2.5μm(12 820~4 000cm-1),
电磁辐射范围:射线~无线电波所有范围; 相互作用方式:发射、吸收、反射、折射、散射、干 涉、衍射等; 光分析法在研究物质组成、结构表征、表面分析等方 面具有其他方法不可区代的地位;
三个基本过程:
(1)能源提供能量; (2)能量与被测物之间的相互作用; (3)产生信号。
基本特点:
(1)所有光分析法均包含三个基本过程; (2)选择性测量,不涉及混合物分离(不同于色谱分析); (3)涉及大量光学元器件。
电子能级间跃迁的同时,总伴随有振动和 转动能级间的跃迁(图10-1所示). 即电子光 谱中总包含有 振动能级和转动能级间跃迁 , 因而产生的谱线呈现宽谱带。所以分子光谱 是一种带状光谱,它包含若干谱带系,一个 谱带系含有若干谱带,同一谱带内又含有若 干光谱线.
4.1 红外吸收光谱分析概述
红外吸收光谱法:
第四章
红外吸收光谱
(Infrared absorption spectroscopy, IR)
一、光分析法及其特点
optical analysis and its characteristics
光分析法:基于电磁辐射能量与待测物质相互作用后 所产生的辐射信号与物质组成及结构关系所建立起来的分析 方法;
主要用于研究分子中的O—H、N—H、C—H键的振动 倍频与组频。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
但是,这些原子被化学键联结在一起,成为 一个整体,分子作为整体的运动状态可以分为三 类:平动、转动和振动。 由于分子重心向任何方向的移动都可以分解 为三个坐标方向的移动,因子,分子有三个平动 自由度。在非线形分子中,整个分子可以绕三个 坐标轴转动,故也有三个转动自由度。剩下的 3n-6个才是振动自由度。对于直线形分子,若键 轴是在X方向上,整个分子只能绕y和z轴转动, 故有3n-5个振动自由度。
08:38:17
红外光谱的表示方法
红外光谱图:纵坐标为透光率(或吸光度),横坐标为波长
λ( m )和波数1/λ
,单位:cm-1。
10 4 / cm / m
1
08:38:17
图4.1 苯酚的IR吸收光谱
08:38:17
图4.2乌桕油的IR光谱
08:38:17
图4.3 聚苯乙烯红外光谱图
最常用的
50~1000
2.5~15
200~10
4000~650
08:38:17
3. 红外光谱特点 1)红外吸收只有振-转跃迁,能量低;
2)应用范围广:除单原子分子及单核分子外,几乎所有有
机物均有红外吸收; 3)分子结构更为精细的表征:通过IR谱的波数位置、波峰 数目及强度确定分子基团、分子结构; 4)定量分析; 5)固、液、气态样均可用,且用量少、不破坏样品; 6)分析速度快。 7)与色谱等联用(GC-FTIR)具有强大的定性功能。
08:38:17
IR光谱用T-λ 曲线或T-曲线表示。纵坐标为
百分透射比T%,吸收峰向下,向上则为谷。横坐
标为波长λ (单位μ m)或波数 (单位cm-1)。
两者的关系是:/cm-1= 104/(λ /μ m) = 1/(λ /cm)
1。
中红外区的范围为4000-400cm-
用波数描述吸收谱带比较简单,且便于与Raman 光谱比较。
化学键 单键 双键 C-C C=C 键力常数N· cm-1 5 10 波数cm-1 1190 1683
三键
CC
15
2062
08:38:17
化学键的类型相同时,原子质量m大,化学键的 振动波数低。
化学键 单键 单键 基团 C-C C-H 波数cm-1 1190 2920
(二) 非谐振子 实际上双原子分子并非理想的谐振子
08:38:17
条件二:辐射与物质之间必须有耦合作用。即只有 能使偶极矩发生变化的振动形式才能吸收红外辐射 。
电场
无偶极矩变化
磁场
无红外吸收
红外吸收 偶极矩变化 (能级跃迁)
交变磁场
分子固有振动
图4.13
08:38:17
a
实际观察到的红外吸收峰数目小于理论上计算 的振动数,这是由如下原因引起的:
原子,即振动时同时伸长或缩短;在不对称的情
况下,振动时某些键缩短,某些键则伸长。
08:38:17
08:38:17
2. 弯曲振动(变角振动或变形振动):键 角发生周期性变化而键长不变。 面内弯曲:剪式振动,摇摆振动 面外弯曲:摇摆振动,扭曲振动 例如:亚甲基
08:38:17
(动画)红外四种振动方式
1 Ev (v )h (v = 0, 1, 2, · · · ) 2
式中, v 为振动量子数,ν为分子 振动频率。
08:38:17
在室温时,分子处于基态(v = 0),此时伸
缩振动振幅很小。当有红外辐射照射分子时,若
辐射光子所具有的能量恰好等于分子振动能级差
时,则分子吸收光子能量跃迁至振动激发态,导 致振幅增大。 分子的两个原子以其平衡点为中心,以很小 的振幅(与核间距相比)作周期性“简谐”振动, 其振动可用经典刚性振动描述。分子简谐振动频 率的计算公式为:
第四章 红外吸收光谱法 Infrared Absorption Spectrometry,IR
08:38:16
第一节
一、 定义
概
述
依据物质对红外辐射的特征吸收建立 起来的一种光谱分析方法。分子吸收 红外辐射后发生振动能级和转动能级 的跃迁,因而红外光谱又称分子振动转动光谱。
08:38:17
红外光谱属分子吸收光谱。样品受到频率 连续变化的红外光照射时,分子吸收其中一 些频率的辐射,分子振动或转动引起偶极 矩的净变化,使振-转能级从基态跃迁到激 发态,相应于这些区域的透射光强度减弱, 记录百分透过率T%对波数或波长的曲线, 即得红外光谱。
08:38:17
二、红外光区的划分
表4.1 红外光谱区划分
区 域 /m 0.78~2.5 /cm-1 12820~4000 4000~200 能级跃迁类型
近红外(泛频区)
O-H、N-H和C-H键的 倍频吸收区
分子的振动、转动 分子的转动,骨架振 动
中红外(基本振动区) 2.5~50
远红外(转动区)
图4.10
08:38:17
非线性分子(如H2O)的转动
理论振动数(峰数)
设分子的原子数为n
对于非线形分子,理论振动数=3n-6
如H2O分子,其振动数为3×3-6=3
对于线形分子,理论振动数=3n-5
如CO2分子,其理论振动数为3×3-5=4
08:38:17
图4.11 水分子的简正振动形式
m1m2 m1 m2
若原子的质量用原子质量单位(u,1u=1.66×10-24g) 表示,则成键两原子的折合质量应为:
m1m2 (m1 m2 ) 6.021023
08:38:17
从分子简谐振动方程可知,分子振动频率与化 学键的键力常数、原子质量有关系.
折合质量相同时,振动频率取决于化学键的 强度
08:38:17
3n=平动自由度十转动自由度十振动自由度
y
x z (a) (b)
图4.8
(c)
08:38:17
转动自由度是由原子围绕着一个通过其质心的轴转 动引起的。只有原子在空间的位置发生改变的转动 才能形成一个自由度 。 振动自由度=3n-(转动自由度+平动自由度)
z y x
图4.9
08:38:17
特点:与紫外-可见吸收光谱比较 (1) 除了单原子分子和同核双原子分子等少数 分子外,几乎所有化合物均可用红外吸收光谱法 进行研究。适用范围广。
(2)红外光谱可对物质的组成和结构特征提供
十分丰富的信息。其最重要和最广泛的用途是对
有机化合物进行结构分析。
08:38:17
(3)红外吸收可用于定量分析。但是由于 红外辐射能量较小,分析时需要较宽的光 谱通带,而物质的红外吸收峰又比较多, 难以找出不受干扰的检测峰,因此,定量 分析应用较少。 (4)红外吸收光谱是一种非破坏性分析 方法,对于试样的适应性较强。样品可以 是液体、固体、气体。
(1) 没有偶极矩变化的振动,不产生红外吸收; (2) 相同频率的振动吸收重叠,即简并; (3) 仪器不能区别那些频率十分接近的振动或因吸 收带很弱仪器检测不出;
(4) 有些吸收带落在仪器检测范围之外。
08:38:17
(二) 吸收谱带的强度
分子振动时偶极矩是否变化决定了该分子能
否产生红外吸收,而偶极矩变化的大小又决定了 吸收谱带的强弱。
08:38:17
二、红外吸收产生的条件和强度
分子吸收辐射产生振转跃迁必须满足两个条件: 条件一:辐射光子的能量应与振动跃迁所需能量 相等。 根据量子力学原理,分子振动能量Ev 是量子 化的,即 EV=(V+1/2)h 为分子 振 动频 率 ,V 为振动 量子 数 , 其 值 取 0,1,2,… 分子中不同振动能级差为 EV= Vh 也就是说 , 只有当 EV=Ea 或者 a= V时 ,才可 能发生振转跃迁。例如当分子从基态(V=0)跃迁 到第一激发态(V=1),此时V=1,即a= 。
频峰)。 由于分子的非谐振性质,各倍频峰并非正好是 基频峰的整数倍,而是略小一些。
除此之外,还有合频峰、差频峰等,统称泛频
峰) 分子振动的形式
振动的基本类型
1.伸缩振动
伸缩振动是指原子沿着价键方向来回
运动,即振动时键长发生变化,键角不变。 它又分为对称伸缩振动(s)和不对称伸缩振动 ( as)。在对称的情况下,两个氢原子同时离开碳
由基态振动能级(v = 0)跃迁至第一振动激发态 (v = 1)产生的吸收峰称为基频峰。其峰位等于分
子的振动频率。
由基态振动能级(v = 0)跃迁至第二振动激发态 (v = 2)产生的吸收峰称为二倍频峰(也叫第一倍频
峰 )。
08:38:17
由基态振动能级(v = 0)跃迁至第三振动激发
态(v =3)产生的吸收峰称为三倍频峰(也叫第二倍
08:38:17
图4.7 水分子和CO2的简正振动形式
08:38:17
(四)分子的振动自由度
多原子分子振动形式的多少可以用 振动自由度来描述。
振动自由度就是独立的振动数目。
在三维空间中,每个原子都能沿x, y,z三个坐标方向独立运动,对于由n个 原子组成的分子则有3n个独立运动,即 3n个运动自由度。
08:38:17
四、紫外吸收光谱与红外吸收光谱的区别
1. 光谱产生的机制不同
紫外:电子光谱;
红外:振-转光谱
2. 研究对象和使用范围不同
紫外:研究不饱和化合物,具有共轭体系; 红外:凡是在振动中伴随有偶极矩变化的化合 物都是红外光谱研究的对象。可研究几乎所有的有 机物。
08:38:17
五、红外光谱法的特点和应用
2
图4.12 CO2分子的简正振动形式
08:38:17
从图中可知,非线性分子绕x、y和z轴转动,均改 变了原子的位置,都能形成转动自由度。因此,非线 性分子的振动自由度为 3N—6 。理论上一个振动自 由度,在红外光谱上相应产生一个基频吸收带。
