初三化学溶液的浓度
初三化学溶液的浓度易错(难)过关测试
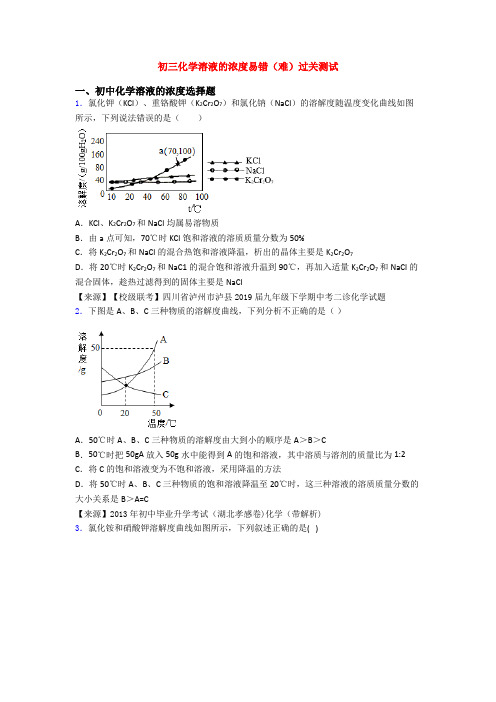
初三化学溶液的浓度易错(难)过关测试一、初中化学溶液的浓度选择题1.氯化钾(KCl)、重铬酸钾(K2Cr2O7)和氯化钠(NaCl)的溶解度随温度变化曲线如图所示,下列说法错误的是()A.KCl、K2Cr2O7和NaCl均属易溶物质B.由a点可知,70℃时KCl饱和溶液的溶质质量分数为50%C.将K2Cr2O7和NaCl的混合热饱和溶液降温,析出的晶体主要是K2Cr2O7D.将20℃时K2Cr2O7和NaC1的混合饱和溶液升温到90℃,再加入适量K2Cr2O7和NaCl的混合固体,趁热过滤得到的固体主要是NaCl【来源】【校级联考】四川省泸州市泸县2019届九年级下学期中考二诊化学试题2.下图是A、B、C三种物质的溶解度曲线,下列分析不正确的是()A.50℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>CB.50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶剂的质量比为1:2 C.将C的饱和溶液变为不饱和溶液,采用降温的方法D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C【来源】2013年初中毕业升学考试(湖北孝感卷)化学(带解析)3.氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )A.50℃时,氯化铵的溶解度大于硝酸钾B.a℃时,氯化铵与硝酸钾溶液的质量分数相等C.将60℃的硝酸钾饱和溶液降温会变为不饱和溶液D.40℃时,50g水中加入50g硝酸钾,充分搅拌,得到质量分数约为39%的硝酸钾溶液【来源】2015届山东省枣庄市薛城舜耕中学九年级学业水平模拟化学试卷(带解析) 4.下图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是A.P点表示甲、丙两种物质的饱和溶液质量相等B.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液C.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4D.将三种物质的溶液从t2℃降至t1℃,溶质质量分数最小的一定是丙物质【来源】江苏省徐州市2017年中考信息卷化学试题5.a、b、c 三种物质的溶解度曲线如下图所示。
初三化学复习 溶液的饱和与浓度

溶质的质量分数(A%)和溶解度(S)的关系
举例:20°C时,NaCl的S是36g
溶质质量=
溶剂质量=
饱液的溶质质量分数=
饱液质量=
溶质的质量分数(A%)和溶解度(S)的关系
举例:20% KNO3溶液 100g
溶质质量=
溶剂质量=
溶质是谁?溶剂是谁?
溶液质量=
溶质的质量分数(A%)和溶解度(S)的关系
KNO3,计算两种情况所得溶液的溶质质量分数。
a%、S的区别和联系:
a%
应用范围
m温度一定
温度不一定
一定温度下
是否饱和溶液
不一定饱和
一定饱和
单位
比
g (m质)
溶质的质量分数(A%)和溶解度(S)的关系
求一定温度下某饱和溶液的a% (溶质对应溶解度S):
%饱液 =
× %
+
求一定温度下某固体溶质的溶解度S:
as应用范围m质和和m液m质和和m剂是否温度一定温度不一定一定温度下是否饱和溶液不一定饱和一定饱和单位比gm质溶质的质量分数a和溶解度s的关系求一定温度下某饱和溶液的a溶质对应溶解度s
初三化学复习——溶液的饱和与
浓度
饱和溶液与不饱和溶液
饱和溶液与不饱和溶液
氢氧化钙
溶液的浓度:溶质的质量分数(A%)
质
=
⟹
求出
液 − 质
1、 20°C时,NaCl的S是36g,求100g NaCl饱和溶液
中含NaCl多少g?
2、 20°C时,将68g饱和NaCl溶液蒸干,可得18g
NaCl固体,求20°C时NaCl的S?
3、配置500g 10%的食盐水,需要NaCl固体和水各
化学初三溶液的浓度计算与应用

化学初三溶液的浓度计算与应用溶液浓度是化学中非常重要的概念,用于描述溶液中溶质相对于溶剂的含量。
在初三化学学习中,我们需要学会计算溶液的浓度,并且了解浓度对于化学实验和日常生活中的应用。
本文将详细介绍溶液的浓度计算方法以及浓度在不同领域的应用。
一、浓度的计算方法溶液的浓度常常使用质量浓度和摩尔浓度两种方式进行表示。
1. 质量浓度质量浓度是用溶质的质量与溶液的体积之比来表示的。
计算公式为:质量浓度(g/L)= 溶质的质量(g)/ 溶液的体积(L)2. 摩尔浓度摩尔浓度是用溶质的物质的物质的摩尔数与溶液的体积之比来表示的。
计算公式为:摩尔浓度(mol/L)= 溶质的摩尔数(mol)/ 溶液的体积(L)通过以上两种浓度计算方法,我们可以准确地表示溶液中溶质的含量和浓度。
二、浓度的应用1. 实验室中的应用在化学实验室中,浓度的计算和应用非常重要。
实验室中的试剂常常需要根据需要调整浓度,或者用浓溶液配制出稀溶液。
通过浓度的计算,我们可以准确控制溶液中溶质的含量,从而确保实验结果的准确性。
此外,浓度也与物质的反应有关,实验中常常需要根据反应方程式和浓度计算反应物的摩尔比例。
2. 工业生产中的应用浓度在工业生产中也有广泛的应用。
例如,制药工业中需要根据药物的需求计算药液的浓度,保证每一种药物的治疗效果;化工行业中的溶液配制和生产过程也需要根据浓度计算来控制反应,确保产品质量和安全。
3. 日常生活中的应用浓度的概念在我们的日常生活中也有实际的应用。
例如,家庭中需要根据食谱来控制食材的浓度,确保烹饪出合适的口感和味道;饮料和果汁的制造商也需要根据消费者的口味喜好调整产品的浓度。
总结而言,溶液的浓度计算以及浓度在实验室、工业生产和日常生活中的应用是我们初三化学需要重点关注的知识点。
通过学习浓度的计算方法,并应用于实际情境中,我们可以更好地理解和掌握化学知识,为将来的学习和工作打下坚实的基础。
(以上文中的质量浓度和摩尔浓度应适当进行替换,具体替换词根据需要自行判断。
初三化学溶液浓度计算梳理

初三化学溶液浓度计算梳理一、溶液浓度的概念及表示方法1.溶液浓度:溶液中溶质的质量或体积与溶液总质量或总体积的比值。
2.质量分数:溶质质量与溶液总质量的比值,无单位。
3.体积分数:溶液体积与溶液总体积的比值,无单位。
4.摩尔浓度:溶质物质的量与溶液总体积的比值,单位为mol/L。
二、溶液浓度计算公式1.质量分数计算公式:质量分数(ω)=溶质质量/溶液总质量×100%2.体积分数计算公式:体积分数(φ)=溶液体积/溶液总体积×100%3.摩尔浓度计算公式:c=n/V,其中c为摩尔浓度(mol/L),n为溶质物质的量(mol),V为溶液总体积(L)。
三、溶液稀释计算1.稀释前后溶质质量不变:稀释后溶液总质量×稀释后质量分数 = 稀释前溶液总质量×稀释前质量分数2.稀释前后溶液体积不变:稀释后溶液总体积×稀释后体积分数 = 稀释前溶液总体积×稀释前体积分数3.稀释前后溶质物质的量不变:稀释后溶液总体积×稀释后摩尔浓度 = 稀释前溶液总体积×稀释前摩尔浓度四、溶液混合计算1.质量混合:ω1ω2 = (m1ω1 + m2ω2) / (m1 + m2)2.体积混合:φ1φ2 = (V1φ1 + V2φ2) / (V1 + V2)3.摩尔混合:c1c2 = (n1c1 + n2c2) / (n1 + n2)五、常见溶液浓度换算1.从质量分数到摩尔浓度:c = (1000ρω) / M,其中ρ为溶液密度(g/mL),M为溶质摩尔质量(g/mol)。
2.从体积分数到摩尔浓度:c = φ / (1000ρ),其中ρ为溶液密度(g/mL)。
六、溶液浓度计算注意事项1.确保单位统一:质量单位为g,体积单位为mL,摩尔质量单位为g/mol。
2.注意溶液的密度:不同溶液的密度不同,需根据实际情况进行调整。
3.掌握四则运算法则:加减乘除,先乘除后加减,避免计算错误。
初三化学溶液的浓度单元检测题含答案解析

初三化学溶液的浓度单元检测题含答案解析一、初中化学溶液的浓度选择题1.氢氧化钡是合成酚醛树脂的催化剂,下表中列出了氢氧化钡在不同温度下的溶解度温度/℃04080溶解度/g 1.678.22101.4下列说法正确的是()A.升高温度可使氢氧化钡溶液由不饱和变成饱和B.40℃时,100g氢氧化钡饱和溶液中氢氧化钡的质量为8.22gC.40℃时和80℃时可配制溶质质量分数相等的氢氧化钡溶液D.40℃时,氢氧化钡溶液的溶质质量分数约为7.6%【来源】云南省红河州建水县勒白中学2019届九年级下学期中考二模化学试题2.甲、乙两种物质的溶解度曲线如图1所示。
下列说法中正确的是A.t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液B.t2℃时,甲、乙饱和溶液的溶质质量分数都为30%C.t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和D.t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙【来源】2015年初中毕业升学考试(福建厦门卷)化学(带解析)3.a,b两种物质的溶解度曲线如下图所示.下列说法不正确的是A.将℃时b的饱和溶液加水可变为不饱和溶液B.将℃时a的饱和溶液降温至℃,溶液质量不变C.℃时,两种物质的饱和溶液中溶质质量分数a bD.将℃时a、b的饱和溶液分别降温至℃,两溶液的溶质质量分数相等【来源】2015年初中毕业升学考试(北京卷)化学(带解析)4.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是()A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%【来源】2010年全国中考化学试题分类汇编考点20饱和溶液、溶解度5.甲、乙两种固体物质的溶解度曲线如图所示。
下列有关叙述中错误的是A.t2℃时甲的溶解度比乙的大B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大C.升高温度可将甲的饱和溶液变成不饱和溶液D.t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等【来源】2013-2014江苏省南京市鼓楼区中考一模化学试卷(带解析)6.下图是甲、乙两种固体物质在水中的溶解度曲线。
初中九年级(初三)化学 《配制一定物质的量浓度的溶液》

《配制一定物质的量浓度的溶液》教学案例课程背景:教师在讲解《化学1》第一章第三节中的“活动·探究”配制一定体积的溶液并表示其组成后,学生对所学习的实验内容往往认识不深,为了让学生对所学习的新知识有更进一步的认识和理解,并达到复习巩固的效果,就引导学生设计一个“配制90mL1mol/LNaOH溶液”实验方案。
教学片段:教师问:“要设计这个实验方案,第一步要作什么?”学生答:“计算!算出所需溶质的质量。
”学生在此前刚学会了这一种溶液组成的表示方法,也知道了n B=c B×V,这回觉得大有用武之地了,所以教师就请了一位学生到黑板上来写:n B=c B×V=1mol/L×0.09L=0.09mol,m B=0.09mol×40g/mol=3.6g。
教师接着问:“下一步呢?”学生答:“称3.6克NaOH固体。
”教师问:“想一想:这一步要用到哪些仪器和用品?”学生边答,教师在黑板上边写:托盘天平、药匙、砝码、两张大小相同的纸。
教师问:“还要用什么吗?”学生答:“没有了!”教师引导:“我们用的托盘天平上有一个游码,它所能称的质量范围是5克以内,我们现在要称的氢氧化钠质量为3.6克,还需要用砝码?”学生回答:“不需要!”教师继续问:“那两张大小相同的纸又有什么用?”学生回答:“左盘的纸是用来隔开称量物,防止托盘被污染,右盘上的纸是用来抵消左盘上那一张纸的质量。
”教师表扬:“答得很好!”话音刚落,就有一位同学站起来说:“老师,我觉得氢氧化钠好象不能放在纸上称吧?”教师看了一下这位同学,又看一看其他同学,说:“我觉得他讲的好象有一点道理,不知道其他同学有什么想法?”学生开始了他们的讨论,最后得出了结论:在初三的书上就有学到,氢氧化钠在空气中易吸水而潮解,如果放在纸上称,表面的氢氧化钠因潮解而形成的溶液会渗入纸中,造成称出来的氢氧化钠就没有3.6克。
教师表扬:“完全正确!那就得好好想一下:氢氧化钠固体应该怎么称了?”学生答:“放在烧杯里称!”教师问刚才回答的同学:“你说说看,要想称出3.6克的氢氧化钠固体,应该怎样操作?”学生答:“要先称一下空烧杯的质量,再称在烧杯中加入氢氧化钠以后的质量。
初三化学溶液的浓度易错(难)综合练习含答案解析

初三化学溶液的浓度易错(难)综合练习含答案解析一、初中化学溶液的浓度选择题1.甲、乙两物质的溶解度曲线如图所示。
下列叙述中,正确的是()A.甲溶解度一定大于乙溶解度B.2t℃时,甲和乙的饱和溶液中溶质质量分数相等C.2t℃时,在100g水中放入60g甲,其溶质的质量分数为37.5%D.2t℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和【来源】安徽省淮北市淮海中学2019年中考化学模拟试题()2.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是()A.t2℃时,甲、乙两种物质的溶解度相等B.甲的溶解度随温度的升高而增大C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙D.t1℃时,丙的饱和溶液中溶质的质量分数为40%【来源】2010年全国中考化学试题分类汇编考点20饱和溶液、溶解度3.如图是甲乙两种物质的溶解度曲线,下列说法正确的是()A.甲的溶解度大于乙的溶解度B.t℃时,甲乙饱和溶液中溶质的质量分数相等C.升高温度能使接近饱和的甲溶液变为饱和溶液D.10℃时,分别用100g水配制甲乙的饱和溶液,所需甲的质量大于乙的质量【来源】2012年江苏省泰州市初三5月适应性考试化学试题(带解析)4.右图是a、b、c 三种物质的溶解度曲线,下列分析不正确的是A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中充分溶解恰好得到a的饱和溶液(a物质不含结晶水) C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系b >c=aD.将c的饱和溶液变为不饱和溶液,可采用降温的方法【来源】[首发]山东省枣庄市薛城区2017届九年级中考模拟(5月)化学试题5.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。
[人教版][初三化学][第25讲 溶液的浓度]讲义(学生版)
![[人教版][初三化学][第25讲 溶液的浓度]讲义(学生版)](https://img.taocdn.com/s3/m/c3047584be23482fb5da4cbf.png)
第25讲溶液的浓度1.掌握溶液浓度的一种表示方法——溶质的质量分数;2.能进行溶质质量分数的简单计算;3.初步学会配制一定溶质质量分数的溶液;4.掌握溶质配制过程中的误差分析;1.溶液的浓度的概念;2.溶质质量分数的计算;3.一定溶质质量分数溶液的配制及误差分析;知识点一:溶质的质量分数(重点)一.溶质的质量分数(1)定义:溶液中溶质质量与溶液质量的比值叫做溶质的质量分数。
(2)数学表达式溶质的质量分数ω=溶质质量溶液质量×100%溶质的质量分数ω=溶质质量溶剂质量+溶质质量×100%(3)理解:①溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体溶液质量和溶质质量。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
⑤当溶剂中所溶解的溶质不止一种时,其中某溶质的质量分数,应是这种溶质质量占全部溶液质量的百分比。
⑥t℃时,某物质的溶解度为Sg,则t℃,该物质饱和溶液中饱和溶液溶质的质量分数ω=S100g+S×100%例1.有关溶质质量分数的说法正确的是()A.溶液中加入溶剂,溶质质量分数一定减小B.溶液中恒温加入溶质,溶质质量分数一定增大C.溶液降温,溶质质量分数一定增大D.溶液恒温蒸发溶剂,溶质质量分数一定减少练习1.常温下,将5g硝酸钾投入盛有45g水的烧杯中,用玻璃棒搅拌至无固体剩余,下列与此溶液相关的说法中不正确的是()A.该溶液中溶质是硝酸钾,溶剂是水,溶液的质量为50gB.该溶液中溶质的质量分数为10%C.从该溶液中取出10g,所取溶液中溶质的质量分数为2%D.取出10g后的剩余溶液中,溶质的质量为4g练习2.现有一瓶溶质质量分数为10%的食盐水,关于该食盐水的说法正确的是()A.溶质质量:溶剂质量=1:10B.溶质质量:溶液质量=1:10C.溶质质量:溶液质量=1:11D.溶剂质量:溶液质量=10:11例2.27.对“5%的食盐溶液”的含义解释错误的是()A.每100g食盐溶液中含5g食盐B.将5份质量的食盐溶解在95份质量的水中所得的溶液C.将食盐与水按1:19的质量比配成的溶液D.100g水中溶解5g食盐练习1.30.对“l0%的食盐溶液”含义的解释错误的是()A.100g该食盐溶液中含有l0g氯化钠B.将l0g食盐溶解在90g水中所得的溶液C.将氯化钠与水按l:9的质量比配制成的溶液D.100g水中溶解了10g氯化钠例3.下列做法能改变溶液中溶质的质量分数的是()A.把氯化钠的饱和溶液恒温蒸发B.把硝酸钾的饱和溶液升温C.把氯化钠的饱和溶液降温D.给蔗糖的饱和溶液中再加入少量蔗糖练习1.下列操作中,能改变硝酸钾饱和溶液的溶质质量分数的是()A.加硝酸钾B.加少量水C.温度不变蒸发水D.升温练习2.某温度氢氧化钙饱和溶液经下列变化后,溶质的质量分数不变的是()A.温度不变,蒸发水B.温度不变,加入溶剂C.升高温度D.加入溶质,降低温度知识点二:溶质质量分数的计算%=m稀×c稀%稀释公式:m浓×c浓原理:溶液稀释前后溶质的质量不变%=m浓×c浓%增浓公式:m稀×c稀原理:溶液增浓前后溶质的质量不变混合公式:m1×c1%+m2×c2%=m混×c混%原理:溶液混合前后溶质的总质量不变例1.化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸,要把40g上述浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是()A.196g B.156g C.155.2g D.8.16g 练习1.医院常用溶质质量分数为5%的双氧水溶液清洗伤口,若要配制5%的双氧水溶液1200g,需要30%的双氧水溶液的质量为()A.30g B.100g C.200g D.400g 练习2.把20g溶质质量分数为95%的酒精,稀释为溶质质量分数为50%的酒精,根据需加水的体积(水的密度为1g/cm3),为了减少实验误差,最好选用量筒的量程为()A.10mL B.50mL C.20mL D.100mL例2.将100g质量分数5%的食盐溶液变为质量分数10%,下列操作可行的是()A.加入5g食盐B.蒸发掉50g水C.加入100g质量分数5%的食盐溶液D.取出50g溶液练习1.现有W克溶质的质量分数为15%的A溶液,欲使其溶质的质量分数增至30%,可采取的方法有()A.蒸发掉溶剂的二分之一B.蒸发掉0.5Wg溶剂C.加入0.15WgA D.加入3gA练习2.溶质质量分数为10%的硝酸钠溶液100g,欲将其溶质质量分数增大一倍,可采用的方法是()A.加入固体硝酸钠10g B.蒸发掉水50gC.加入100g20%的硝酸钠溶液D.将溶液中溶剂水蒸发掉一半例3.已知硫酸的密度与硫酸的质量分数成正比,质量分数分别为90%和10%的两种硫酸等体积混合后,所得的硫酸中溶质的质量分数为()A.大于50%B.小于50%C.等于50%D.无法确定练习1.将90%的硫酸溶液和10%的硫酸溶液等体积混合,所得溶液的质量分数为()A.小于50%B.大于50%C.等于50%D.不能确定练习2.若将50g20%的NaOH溶液与200g10%的NaOH溶液混和,下列叙述不正确的是()A.混合溶液的质量的质量分数为15%B.溶液混合后溶质质量增加C.混合溶液的质量为250gD.混合溶液的溶质质量分数为12%知识点三:配制一定质量分数的溶液实验仪器:烧杯.玻璃棒.量筒.托盘天平.药匙.胶头滴管实验步骤:计算.称量(对固体溶质)或量取(对液体物质).溶解.装瓶,贴签。
中考化学化学溶液的浓度(大题培优)附详细答案

中考化学化学溶液的浓度(大题培优)附详细答案一、初中化学溶液的浓度1.如图为甲、乙两种盐的溶解度曲线,下列说法正确的是A.甲、乙两种物质的溶解度都不相等B.将接近饱和的甲溶液变为饱和溶液,可采用蒸发或降温的方法C.t1℃时,甲、乙两种物质的饱和溶液中,溶质的质量分数均为15%D.t2℃时,将30克乙物质放入100克水中,所得溶液的质量为130克【来源】2016届江苏省盐城市滨海县八巨初级中学九年级下学期开学考试化学试卷(带解析)【答案】B【解析】【分析】【详解】A、溶解度大小比较需要指明具体的温度,故A错误;B、甲的溶解度随温度升高而增大,故甲的不饱和溶液变为饱和溶液可以用蒸发或降温,故B正确;C、t1℃时,甲、乙两种物质的溶解度相同,所以它们的饱和溶液中,溶质的质量分数均为15g×100%<15%,故C错误;100g+15gD、t2℃时,乙物质的溶解度小于30g,此温度下,将30克乙物质放入100克水中,所得溶液的质量小于为130克,故D错误。
故选B。
2.T1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后观象如图一所示。
硝酸钾和氯化钾的溶解变曲线如图二所示。
下列说法错误的是A.烧杯乙中上层清液是饱和溶液B.烧杯甲中溶解的溶质是氯化钾C.烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数D.将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体不一定全部溶解【来源】湖北省黄石市2018年中考理综化学部分试题【答案】D【解析】根据所学知识和题中信息知,A、烧杯乙中上层清液一定是饱和溶液,有未溶解晶体,故A 正确;B、烧杯甲中溶解的溶质是氯化钾,T1℃时氯化钾溶解度大于硝酸钾,故B正确;C、烧杯甲溶液中溶质的质量分数大于烧杯乙溶液中溶质的质量分数,由于等质量的硝酸钾和氯化钾分别加入到100g水中,甲中全部溶解,乙中部分溶解,故C正确;D、将温度由T1℃升高到T2℃,充分搅拌,烧杯乙中固体一定全部容解,硝酸钾溶解度随温度的升高而增大,由于等质量的硝酸钾和氯化钾分别加入到100g水中,T1℃时氯化钾溶解度大于硝酸钾,氯化钾已全部溶解,T2℃时硝酸钾溶解度大于氯化钾,硝酸钾也一定会全部溶解,故D错误点睛∶溶解度曲线的意义①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。
初三化学溶液的浓度试题答案及解析

初三化学溶液的浓度试题答案及解析1.20℃时,硝酸钾的溶解度为31.6g,将20g硝酸钾投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数.【答案】24%【解析】此题容易错解成,造成错解的原因是误认为20g硝酸钾投进50g水中全部溶解.根据20℃时硝酸钾的溶解度可以算出50g水中最多能溶解15.8g硝酸钾,没有溶解的部分不能算作溶质的质量,故此题根据溶解的硝酸钾的质量进行计算或根据硝酸钾的溶解度直接求溶液中溶质的质量分数.解法一:溶液中溶质的质量分数.解法二:设20℃时,50g水中最多能溶解硝酸钾的质量为x.,x=15.8g溶液中溶质的质量分数答:该溶液中溶质的质量分数为24%.2.(2014重庆)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%).某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:(1)到工厂采集了电解槽中的NaOH溶液100g.NaOH中氧元素的质量分数是________.(2)在实验室用如图所示浓硫酸配制200g 24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数).(3)进行中和测定,向采集到的溶液中逐渐加入所配制的稀硫酸,并不断测定溶液的pH,当pH=7时,消耗稀硫酸160g.通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准.【答案】(1)40%(2)27mL(3)电解槽中NaOH溶液没有达到高浓度标准【解析】(1)NaOH中氧元素的质量分数为;(2)根据“稀释前后溶液中溶质质量相等”可列出等式进行计算,注意单位要一致;(3)根据硫酸与氢氧化钠反应的化学方程式,利用消耗掉的硫酸的质量首先求得氢氧化钠的质量,然后利用溶液中溶质质量分数的计算公式可求出100g氢氧化钠溶液中溶质的质量分数.(1)40%(2)设:取浓硫酸的体积为V.V×1.84g/mL×98%=200g×24.5%V=27mL(3)设:采集的烧碱溶液中NaOH的质量为x.2NaOH+H2SO4=Na2SO4+2H2O80 98x 160g×24.5%x=32g溶液中NaOH的质量分数32%<35%答:应取浓硫酸27mL;电解槽中NaOH溶液没有达到高浓度标准.3.现有20℃ NaCl的饱和溶液100g,欲改变溶液中溶质的质量分数,下列方法正确的是()A.温度不变,加入10g NaCl晶体B.温度不变,蒸发掉10g水C.温度不变,加入10g水D.温度不变,取出10g溶液【答案】C【解析】饱和溶液在该温度下再加入溶质也不溶解,溶质的质量分数不变;温度不变蒸发掉10g 水,得到的溶液还是同一温度下的饱和溶液,溶质的质量分数不变;温度不变加入10g水,改变了溶剂的质量,溶质的质量分数发生了改变;温度不变取出10g溶液,只是溶液的质量减少,溶质的质量分数不变.4.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是()A.B.C.D.【答案】A【解析】氯化钠的溶液蒸发水分,由不饱和溶液变为饱和溶液的过程中,溶剂质量减小,溶液中溶质质量分数(m%)增大,当氯化钠饱和溶液再蒸发水分时,仍为饱和溶液,溶质质量分数将不变.5.某同学在一定温度下进行硝酸钾的溶解实验,实验数据如下表:根据上述实验数据,下列叙述正确的是()A.实验1所得溶液的溶质质量分数为80%B.实验2所得溶液为饱和溶液C.实验4所得溶液的溶质质量分数比实验3大D.该温度下,硝酸钾饱和溶液的溶质质量分数为52.4%【答案】D【解析】由实验2和实验3可知该温度下100g水中最多溶解110g硝酸钾,实验1、2所得溶液是不饱和溶液,实验1所得溶液的溶质质量分数,故A、B不正确;实验3、4所得溶液都是该温度下的饱和溶液,溶质质量分数相等,其溶质质量分数为,所以C错误,D正确.6.(2014广东佛山)一种抗生素为粉末状固体,每瓶含0.5g,注射时应配成溶质质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水()A.1.5mLB.2mLC.3mLD.4mL【答案】B【解析】配制20%的溶液质量为0.5g÷20%=2.5g,则加入蒸馏水的质量为2.5g-0.5g=2g,由于水的密度是1g/mL,所以需水的体积是2mL.7.(2013湖南永州)向100g溶质质量分数为20%的NaCl溶液中加入3g NaCl固体和12g水,使其完全溶解,所得溶液中NaCl的质量分数是()A.20%B.22.5%C.25%D.30%【答案】A【解析】向100g溶质质量分数为20%的NaCl溶液中加入3g NaCl固体和12g水,使其完全溶解,所得溶液中NaCl的质量分数是.8.在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是()A.氯化钠的取用B.氯化钠的称量C.水的量取D.氯化钠的溶解【答案】C【解析】用量筒量取水时,眼睛的视线应与凹液面的最低处保持水平,故C的操作错误,其他各项的操作都是正确的.9.实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液.配制步骤为:(1)计算:需氢氧化钠固体________g,水________mL.(水的密度是1g/cm3)(2)称量:用质量为23.1g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在________盘.在下表所列的砝码中,选出所需砝码(打“√”表示选用):并在下列标尺中选出能正确表示游码位置的选项________(填字母).(3)溶解:将氢氧化钠固体溶于水,用________搅拌,使氢氧化钠全部溶解,冷却至室温.(4)装瓶:把配制好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中.【答案】(1)40 960 (2)左砝码/g100502020105【解析】烧杯质量为23.1g,需氢氧化钠40g,共63.1g,所以需50g砝码1个,10g砝码1个,3.1g用游码.10.(2014江苏盐城)实验室配制100g 10%的氯化钠溶液,有关实验操作不正确的是()A.用托盘天平称取10.0g氯化钠B.用量筒量取90.0mL的水C.将称取的氯化钠倒入量筒中溶解D.将配制的溶液装入试剂瓶中,贴上标签【答案】C【解析】称取的氯化钠不能倒入量筒中溶解,应在烧杯中溶解,故错.其他各项的操作都是正确的.11.常用抗生素“先锋Ⅵ”为粉末状固体,每瓶含“先锋Ⅵ”0.5g,注射时应配成质量分数不高于20%的溶液,则使用时每瓶至少需加入蒸馏水()A.1mLB.2mLC.3mLD.4mL【答案】B【解析】此题考查了有关溶液中溶质的质量分数的计算.至少可得溶液的质量为:0.5g÷20%=2.5g,加入蒸馏水的质量为:2.5g-0.5g=2g,即2mL.12.现有10%的硝酸钾溶液160g,分为质量相等的两份.(1)欲使其中一份溶质的质量分数增大一倍,求:①若用增加溶质的方法,需增加多少克硝酸钾?②若用蒸发溶剂的方法,需蒸发多少克水?③若用60%的硝酸钾溶液与其中一份混合的方法,需要加入60%的硝酸钾溶液多少克?(2)欲使其中一份溶质的量分数变为5%,需要加水多少克?【答案】(1)①设需增加硝酸钾的质量为x.80g×10%+x=(80g+x)×20%解得:x=10g②设需蒸发溶剂的质量为y.80g×10%=(80g-y)×20%解得:y=40g③设需加入60%的硝酸钾溶液的质量为z.80g×10%+z·60%=(80g+z)×20%解得:z=20g(2)设需加水的质量为m.80g×10%=(80g+m)×5%解得:m=80g答:(1)①需增加10g硝酸钾;②需蒸发40g水;③需要加入60%的硝酸钾溶液20g.(2)需要加水80g.【解析】解题时要找准溶质、溶液的质量:两个小题中溶液的质量均是80g.改变溶液中溶质的质量分数有多种方法,但无论采取哪种方法,溶液的稀释计算的原则都是在稀释前后溶液中溶质的质量不变.13.(2013恩施)实验室要配制溶质质量分数为10%的NaCl溶液.下图1是某同学的实验操作过程:(1)用图1中的序号表示配制溶液的正确操作顺序是________,a仪器的名称是________.(2)若③中游码标尺读数为1.2g,则称取NaCl的质量是________g.(3)根据(2)中NaCl的质量计算,该同学需要用水的体积是________mL(水的密度是1.0g/mL).(4)他按图2量取水的体积,若其他操作步骤均无误差,则其所配溶液溶质质量分数________(填“大于”“等于”或“小于”)10%.【答案】(1)②③①⑤④玻璃棒(2)5.8 (3)52.2 (4)小于【解析】(1)用NaCl固体配制溶液的过程是:从试剂瓶中取出NaCl固体→用托盘天平称量→将称好的NaCl固体倒入烧杯中→将量取的水倒入盛有NaCl固体的烧杯中→用玻璃棒搅拌使其全部溶解.(2)③中称量时NaCl固体和砝码的位置颠倒了,NaCl的实际质量为5g+2g-1.2g=5.8g.(3)该同学要配制的溶液质量为5.8g÷10%=58g,则所需水的质量为58g-5.8g=52.2g,水的体积为52.2mL.(4)图2仰视读数,量取水的实际体积大于52.2mL,则所配溶液溶质质量分数会偏小.14.(2013北京)配制50g溶质的质量分数为6%的氯化钠溶液,不需要的仪器是()A.蒸发皿B.玻璃棒C.烧杯D.量筒【答案】A【解析】配制氯化钠溶液时,量取一定体积的水用量筒,在烧杯中溶解氯化钠固体并用玻璃棒搅拌,而蒸发皿是不需要的.15. 每天补充适量的维生素C ,有利于提高人体免疫力.某维生素C 泡腾片,每片含1g 维生素C .将1片该泡腾片投入适量水中,最终得到250g 溶液.此溶液中维生素C 的质量分数为( )A .0.4%B .1%C .2.5%D .4%【答案】A【解析】略16. (2012盐城)酒精(C 2H 5OH )的某种水溶液,溶质和溶剂中氢原子的个数相等,则该溶液中溶质的质量分数为( )A .23%B .46%C .55%D .72%【答案】B【解析】根据酒精和水的化学式可知,要使酒精分子中所含的氢原子总数与水分子中所含的氢原子总数相等,则酒精分子与水的分子个数比为1︰3,假设酒精溶液中有1个酒精分子,就有3个水分子,则溶液中溶质的质量分数为:1×46/(1×46+3×18)×100%=46%.17. 将50g 20%的氯化钾溶液稀释到200g ,稀释后所得溶液中溶质的质量分数是( )A .1%B .5%C .10%D .20%【答案】B【解析】50g20%的氯化钾溶液中氯化钾的质量为:50g×20%=10g ,稀释前后溶液中氯化钾的质量不变,则稀释后所得溶液中氯化钾的质量分数为:.18. (2011达州)26g 黄铜(Cu —Zn 合金)与100g 稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8g .求:(1)黄铜中铜的质量分数;(2)反应后所得溶液中溶质的质量分数.(计算结果精确到0.1%)【答案】(1)75.0% (2)15.1%【解析】根据质量守恒定律计算生成氢气的质量:26g +100g -125.8g =0.2g ;根据化学方程式,由0.2gH 2计算出26g 黄铜中锌的质量和生成ZnSO 4的质量.反应后所得溶液的质量=100g +6.5g -0.2g =106.3g .解:产生的氢气的质量为0.2g .设黄铜中Zn 的质量为x .Zn +H 2SO 4=ZnSO 4+H 2↑65 161 2x y 0.2gx =6.5gy =16.1g黄铜中铜的质量分数:反应后所得溶液中溶质的质量分数答:黄铜中铜的质量分数为75.0%,反应后所得溶液中溶质的质量分数为15.1%.19.(2013咸宁)硝酸钾和氯化钠的溶解度曲线如下图所示.30℃时,分别将30g硝酸钾和氯化钠放入100g水中,充分溶解.下列结论中,不正确的是()A.两种溶液中溶质的质量分数相等B.通常情况下,采取降温的方法能将两种溶液都变成饱和溶液C.若将硝酸钾溶液降温到20℃,溶液中溶质和溶剂的质量比为3︰10D.若将硝酸钾溶液变为10℃时的饱和溶液,溶液中溶质的质量分数一定减小【答案】B【解析】此题考查溶解度曲线的意义及应用.根据溶解度曲线可知,30℃时.氯化钠和硝酸钾的溶解度都大于30g,此温度时分别将30g硝酸钾和氯化钠放入100g水中,充分溶解所形成的都是不饱和溶液,故溶质质量分数相等,A正确;硝酸钾的溶解度受温度变化影响较大,通常采取降温的方法将其变成饱和溶液,而氯化钠的溶解度受温度变化影响较小,不宜采用降温的方法将其变成饱和溶液,B错;由于20℃时硝酸钾的溶解度仍大于30g,因此,将硝酸钾溶液降温到20℃,仍是不饱和溶液,溶液中溶质和溶剂的质量比为3︰10,C正确;由于10℃时硝酸钾的溶解度小于30g,将硝酸钾溶液降温至10℃时就会变成饱和溶液,且有晶体析出,显然溶液中溶质的质量分数会减小,D正确.20.(2012义乌)汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3.若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克.求:(1)630克稀硫酸的体积是多少毫升?(2)需要浓硫酸多少克?【答案】(1)525毫升(2)180克【解析】本题应用了两个重要的公式:(1)溶液的质量=溶液的密度×溶液的体积;(2)溶质的质量分数,将公式进行变形来求解.问题(2)涉及溶液的稀释,解题依据是稀释前后溶质的质量不变.(1)630克稀硫酸的体积是:630克÷1.2克/厘米3=525厘米3,即525毫升.(2)需要浓硫酸的质量是:630克×28%÷98%=180克;答:630克稀硫酸的体积是525毫升;配制这种稀硫酸630克需要浓硫酸的质量是180克.。
初三化学九年级化学溶液之溶质的质量分数

答:这种硫酸的质量分数为19.6%
二、配制一定溶质质量分数的溶液
1.(固液法) 配制50g质量分数为6%的氯化钠溶液。 [实验步骤]
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠 和水的质量分别为:氯化钠 ;水 。 (2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。 (3)量取:用量筒量取所需的水(水的密度可近似看做1 g/cm), 倒入盛有氯化钠的烧杯中。 (4)溶解:用玻璃棒搅拌,使氯化钠完全溶解。搅拌加速溶解
6.60℃时,100g硝酸钾的饱和溶液,恒温下蒸发部分 溶剂,然后再将溶液逐渐冷却到40℃.能表示此过程 溶质质量分数a%与时间t关系的示意图的是( )
7.(计算题)73g质量分数为20%的盐酸与足量大理石反 应,生成二氧化碳的质量是多少?
龙湖中学 杜惠明 有问题请加QQ:40412177
抖音:631445238
57.硫酸和氢氧化钾反应 :
H2SO4 + 2KOH K2SO4 + 2H2O 58.硫酸和H)2
CuSO4 + 2H2O
59.硫酸和澄清石灰水反应 :
2H2SO4 + Ca(OH)2
CaSO4↓ + 2H2O
60. 硫酸和氢氧化铁反应 :
3H2SO4 + 2Fe(OH)3 Fe2(SO4)3 + 6H2O
温度/℃
10
20
30
60
溶解度/g KNO3
20.9
31.6
45.8
110
NH3
70
56
44.5
20
A.两种物质的溶解度均随温度升高而增大
溶液浓度的计算

溶液浓度的计算溶液浓度是指溶质在溶剂中的质量或体积的比例,通常用来描述溶液的浓度程度。
在化学和生物学实验中,准确计算溶液的浓度是非常重要的,因为它直接影响到实验的结果和解释。
本文将介绍几种常见的溶液浓度计算方法。
1. 质量浓度质量浓度,也称为质量百分数浓度,是指在溶液中溶质质量与溶液总质量之比。
其计算公式为:质量浓度(g/L)= 溶质质量(g)/ 溶液总质量(L)例如,如果有一个质量浓度为20 g/L的盐水溶液,其中溶质的质量为10 g,那么溶液总质量应为0.5 L。
2. 体积浓度体积浓度,也称为体积百分数浓度,是指在溶液中溶质体积与溶液总体积之比。
其计算公式为:体积浓度(%)= 溶质体积(ml)/ 溶液总体积(ml)× 100%例如,如果有一个体积浓度为10%的酒精溶液,其中溶质体积为50 ml,那么溶液总体积应为500 ml。
3. 摩尔浓度摩尔浓度,也称为物质浓度,是指在溶液中单位体积的溶质的物质量。
其计算公式为:摩尔浓度(mol/L)= 溶质物质量(mol)/ 溶液体积(L)例如,如果有一个摩尔浓度为0.1 mol/L的氢氧化钠溶液,其中溶质的物质量为0.01 mol,那么溶液体积应为0.1 L。
4. 摩尔分数摩尔分数是指在溶液中每一种物质的摩尔数量占总摩尔数量的比例。
其计算公式为:摩尔分数 = 每种物质的摩尔数量 / 溶液总摩尔数量例如,如果有一个摩尔分数为0.25的NaCl溶液,其中NaCl占总摩尔数量的四分之一。
5. 百分数浓度百分数浓度是指在溶液中每一种物质的质量或体积占溶液总质量或总体积的百分比。
其计算公式为:百分数浓度(%)= 每种物质的质量或体积 / 溶液总质量或总体积 ×100%例如,如果有一个百分数浓度为5%的葡萄糖溶液,其中葡萄糖的质量或体积占溶液总质量或总体积的五分之一。
通过以上几种常见的溶液浓度计算方法,我们可以准确地描述并控制实验中所使用溶液的浓度。
溶液的浓度教学反思

溶液的浓度教学反思一《溶液的浓度》这节课我主要是以学生的自学与交流为主,老师的解惑、纠正为辅,把课堂交给学生来完成的。
虽然所用时间较多,但效果还是比较理想的,我认识到初三学生的理解能力不容忽视。
同时,学生小组的讨论比老师直接灌输要更深刻,更容易接受。
教材中引入的溶质质量分数概念非常简单,计算公式也简洁明了.通过5分钟的自学与交流,学生可以完成对基本概念的理解;通过课后题的训练,学生能够完成计算公式的应用。
教师应注意强调:解这类题时必须弄清溶液的质量发生怎样的变化,溶液中溶质和溶剂分别是什么物质,溶质和溶剂的质量各是多少。
一般地,溶质的质量是指溶解的那部分溶质,如果没有没溶进溶剂里,就不能计算在内。
教材中有两道例题,可以交给学生通过自学与讨论来完成。
其中重要的地方老师可以让学生先来讲解,如有不正确的及时予以纠正。
同时,可以结合课后类似的题型进行巩固训练。
此时应强调:溶液稀释前后溶质的质量不变。
结合化学方程式,求某一溶液的溶质质量分数的计算,是初中化学中的一个难点,特别是发生化学变化时,是学生更容易搞混淆的,因而这类题,由老师带着学生反复读题,从题目中找出解题的关键点。
先做一道例题,紧接着一道类似练习。
然后讲授方法:根据质量守恒,反应前后溶液的质量应保持不变.如有变化,是因生成了沉淀或气体,将原来溶液的质量减去沉淀或气体的质量即为反应后溶液的质量.《溶液的浓度》这节课我主要是以学生的自学与交流为主,老师的解惑、纠正为辅,把课堂交给学生来完成的。
虽然所用时间较多,但效果还是比较理想的,我认识到初三学生的理解能力不容忽视。
同时,学生小组的讨论比老师直接灌输要更深刻,更容易接受。
教材中引入的溶质质量分数概念非常简单,计算公式也简洁明了.通过5分钟的自学与交流,学生可以完成对基本概念的理解;通过课后题的训练,学生能够完成计算公式的应用。
教师应注意强调:解这类题时必须弄清溶液的质量发生怎样的变化,溶液中溶质和溶剂分别是什么物质,溶质和溶剂的质量各是多少。
初三化学案例分析溶液的浓度计算

初三化学案例分析溶液的浓度计算为了解决化学实验中涉及到溶液浓度计算的问题,我们将通过一个案例分析的方式来详细介绍溶液的浓度计算方法。
本文将从基本概念开始,逐步引入相关公式和计算步骤,帮助大家理解和掌握浓度计算的方法。
1. 溶液的浓度概念及计量单位溶液的浓度是指单位体积溶液中溶质的含量。
常见的计量单位有质量分数、体积分数、摩尔浓度等。
2. 质量分数计算质量分数是指溶质质量与溶液总质量之比。
计算公式如下:质量分数=溶质质量/溶液总质量例如,某溶液中含有50g的氯化钠(NaCl),总质量为100g,则其质量分数为:质量分数=50g/100g=0.53. 体积分数计算体积分数是指溶质体积与溶液总体积之比。
计算公式如下:体积分数=溶质体积/溶液总体积例如,某溶液中含有20ml的乙醇(C2H5OH),总体积为100ml,则其体积分数为:体积分数=20ml/100ml=0.24. 摩尔浓度计算摩尔浓度是指单位体积溶液中溶质的摩尔数。
计算公式如下:摩尔浓度=溶质物质量(摩尔)/溶液体积(升)例如,某溶液中含有2mol的硫酸(H2SO4),总体积为1L,则其摩尔浓度为:摩尔浓度=2mol/1L=2mol/L5. 通过溶质与溶剂的量关系计算溶液浓度对于溶质与溶剂反应生成的溶液,可以通过计算反应方程式中溶质和溶剂的量关系来获得溶液的浓度。
6. 通过反应物溶解度计算溶液浓度溶解度是指在特定温度下单位体积溶液中溶质的最大溶解量。
可以通过反应物的溶解度数据来计算溶液的浓度。
7. 通过稀释计算溶液浓度稀释是指在已知浓度的溶液中加入溶剂来降低溶质的浓度。
计算公式如下:初始溶液浓度×初始溶液体积=最终溶液浓度×最终溶液体积例如,将50ml浓度为0.2mol/L的盐酸溶液稀释为0.1mol/L,则稀释后的体积为:50ml×0.2mol/L=Vml×0.1mol/L(V为最终溶液体积)V=100ml8. 总结通过本案例分析,我们详细介绍了溶液的浓度计算方法,包括质量分数、体积分数、摩尔浓度等。
人教版九年级下册化学教案:9.3溶液的浓度(第一课时)

人教版九年级下册化学教案: 9.3溶液的浓度(第一课时)1. 教学目标•理解溶液的浓度的概念;•掌握计算溶液的浓度的方法;•能够应用浓度计算相关问题。
2. 教学重点•溶液的浓度概念的理解;•溶液浓度的计算方法。
3. 教学难点•复杂情况下的溶液浓度计算;•计算中的单位换算。
4. 教学过程4.1 导入(5分钟)通过提问学生对于溶液的浓度的认识,引导学生了解溶液的浓度概念,例如:什么是溶液的浓度?浓溶液与稀溶液有何区别?4.2 提出问题(10分钟)提出一个具体的问题:如果将10克食盐溶解在100毫升水中,求溶液的浓度。
4.3 计算方法(15分钟)•引导学生理解溶液的浓度定义:溶质质量与溶液体积的比值;•根据问题中的数据,计算出溶质的质量为10克,溶液的体积为100毫升;•将溶质质量和溶液体积的比值带入浓度的计算公式:浓度 = 溶质质量 / 溶液体积;•按照计算公式计算出溶液的浓度为10克/100毫升。
4.4 单位换算(10分钟)•引导学生理解质量单位的换算关系:1克 = 1000毫克;•将溶质质量换算成毫克:10克 = 10 * 1000毫克 = 10000毫克;•将体积单位换算成升:100毫升 = 100 / 1000升 = 0.1升;•根据换算后的数据,重新计算溶液的浓度:浓度 = 10000毫克 / 0.1升 = 100000毫克/升。
4.5 实际应用(10分钟)提出一个实际应用问题:如果需要制备0.05克/毫升的盐酸溶液,需要多少克的盐酸溶解在100毫升水中?通过引导学生按照题目中的需求,使用溶液浓度的计算公式进行计算,得出所需溶质质量。
4.6 拓展应用(15分钟)提供更复杂的溶液浓度计算问题,引导学生应用所学知识解决问题。
4.7 小结(5分钟)对本节课所学内容进行总结,强化学生对于溶液浓度的理解和计算方法。
5. 课后作业•用不同的方法计算出下列溶液的浓度:–将5克NaOH溶解在200毫升水中;–将20克蔗糖溶解在400毫升水中。
初三化学溶液浓度表达方式比较

初三化学溶液浓度表达方式比较化学中,溶液的浓度是一个非常重要的概念,它表示了溶质在溶剂中的相对多少。
溶液浓度的表达方式有很多种,本文将对其中的几种常见表达方式进行比较,包括质量分数、体积分数、物质的摩尔浓度以及溶解度等。
一、质量分数质量分数是指溶质在溶剂中质量与溶液总质量之比。
通常用百分数表示,如10%的NaCl溶液表示每100克溶液中含有10克的NaCl。
质量分数的优势在于简单直观,容易理解和计算。
但是,它不受温度和压力的影响,只反映了溶质的相对多少,不能准确表示溶液中的溶质分子或离子的数量。
二、体积分数体积分数是指溶质在溶液中的体积与溶液总体积之比。
常用百分数表示,如3%的H2O2溶液表示每100毫升溶液中含有3毫升的H2O2。
与质量分数不同,体积分数受温度和压力的影响较大。
体积分数在某些实验和工业生产中具有重要的应用,但同样不能准确表示溶质分子或离子的数量。
三、物质的摩尔浓度物质的摩尔浓度是指单位体积(通常是1升)溶液中溶质的摩尔数。
用符号表示为C,单位为mol/L。
例如,1mol/L的NaOH溶液表示在1升溶液中含有1摩尔的NaOH。
摩尔浓度是描述溶液中溶质分子或离子数量最常用的方式,能够精确地表示溶液的浓度。
但是,摩尔浓度的计算相对较复杂,需要知道溶质的摩尔质量并进行相关计算。
四、溶解度溶解度是指溶液中能够溶解的最大物质量或最大物质的摩尔数。
它与溶液的温度和压力密切相关。
溶解度可以用质量浓度或摩尔浓度表示,一般情况下,我们会根据需要来选择适当的浓度单位。
溶解度是评价溶液浓度大小的重要指标,可用于判断溶液中是否饱和。
综上所述,根据实际需要选择适当的溶液浓度表达方式是非常重要的。
质量分数和体积分数简单直观,适用于常规实验和初级教学;摩尔浓度精确度高,适合于定量分析和深入研究;溶解度可以用来判断溶液是否饱和。
在实际应用中,我们可以根据实验目的、所需数据及实验条件等综合因素来选择合适的溶液浓度表达方式。
9.3广州市玉岩中学初三化学校本学案和校本作业_第9单元溶液_课题3溶液的浓度

_________________________________________________________________________________________________________【本节要点】 1.掌握一种溶液组成的表示方法——溶质的质量分数。
2.能进行有关溶质的质量分数的简单计算。
包括进行“溶液稀释和配置”的计算 【课前预习】 1.阅读课本第43页,溶液由溶质和溶剂两部分组成,所以溶液的质量=溶质的质量+溶剂的质量(1);溶液中溶质质量与溶液质量之比叫质量分数,表达式是_____________________________(2);也可以将上述(1)式带入(2)式,得____________________________________;溶质的质量分数都用百分数表示。
2.利用上述表达式,计算课本42页实验9-7中所得三种硫酸铜溶液的质量分数分别是______________、_______________、_______________。
3.已知20℃,氯化钠的溶解度是36g ,则该饱和溶液的质量分数是_______________,10g 氯化钠溶解在90g 水中,所得溶液是饱和溶液么_________,质量分数是___________;20g 氯化钠溶解在80g 水中,所得溶液是饱和溶液么__________,质量分数是___________;30g 氯化钠溶解在70g 水中,所得溶液是饱和溶液么____________,质量分数是_____________。
氯化钠溶液在20℃时的最大质量分数是________。
4.阅读课本第43页例题1,150kg 质量分数为16%的氯化钠溶液中,溶质氯化钠的质量是__________kg ,溶剂水的质量是_____________。
模仿计算,要配制1kg 质量分数为0.9%的生理盐水,需要溶质氯化钠的质量是___________,需要加水的质量是___________。
2020-2021中考化学综合题专题复习【化学溶液的浓度】专题解析含详细答案

2020-2021中考化学综合题专题复习【化学溶液的浓度】专题解析含详细答案一、初中化学溶液的浓度1.R 是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如右图所示某化学兴趣小组的同学进行了如下图所示实验则下列说法不正确的是A .t 2℃时,硝酸钾饱和溶液的溶质质量分数为37.5%B .R 是KNO 3C .②③中清液是饱和溶液D .①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小【来源】【全国市级联考】内蒙古呼和浩特市2018届九年级质量普查调研模拟考试化学试题【答案】D【解析】烧杯②中有100g 水,其中溶解了60gR 溶质,在 t 2℃时,硝酸钾的溶解度是60g,氯化铵的溶解度小于60g ,故R 是KNO 3。
A. t 2℃时,硝酸钾饱和溶液的溶质质量分数为6060100g g g×100%=37.5%,正确;B. R 是KNO 3,正确;C. ②中有100g 水,溶解了60g 的KNO 3,恰好是饱和溶液,③中有没有溶解的固体物质,是饱和溶液,正确;D. 因为不知道烧杯③中液体的温度,所以无法确定烧杯③中的上层清液中溶质质量分数,故无法比较①的溶液中溶质质量分数与③的上层清液中溶质质量分数的大小,错误。
故选D 。
点睛:解答此题的关键是理解溶解度、溶质质量分数、饱和溶液的概念。
2.下列物质中属于溶液的是A .碘酒B .牛奶C .米粥D .豆浆【来源】辽宁省大连市第八十中学2019届化学模拟【答案】A【解析】【分析】溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物;据此结合物质的组成进行分析判断【详解】A、碘酒是碘溶于酒精形成的,是均一、稳定的混合物,属于溶液;B、牛奶是不溶性的小液滴等分散到液体中形成的,不均一、不稳定,不属于溶液;C、米粥不是均一、稳定的混合物,不属于溶液;D、豆浆中的营养物质有的溶于水,有的不溶于水,豆浆不是均一、稳定的混合物,不属于溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学溶液的浓度经典教案主要知识点归纳:理解溶液浓度的概念。
(1)学会溶液中溶质的质量分数(质量百分比浓度)的概念和表示方法。
(2)学会用水稀释改变浓度的方法。
(3)学会用体积、密度进行换算质量,学会读标签,并会使用。
(4)理解溶液中溶质的质量分数(质量百分比浓度)和溶解度的区别和联系。
1、一定量的溶液里所含溶质的量叫做溶液的_______。
A. 浓度B. 密度C. 溶解度D. 溶解性2、往100 g 20%的食盐溶液中加入100 g水,则稀释前后________。
A. 溶剂的质量不变B. 溶液的质量不变C. 溶质的质量不变D. 溶液中溶质的质量分数不变3、一定温度下,某饱和溶液溶质的质量分数是A%,溶解度是S g/100g水。
从数值上看,A与S的关系是A____S(填“>”、“=”或“<”=。
4、矿泉水和蒸馏水在外观上都是无色、透明的,但矿泉水中含有对人体有益的矿物质。
按分散体系分类,矿泉水属于_______。
A. 悬浊液B. 溶液C. 纯净物D. 化合物5、某研究小组对本地区河流的水质情况进行调查,取水样后先进行过滤,其目的是___。
A. 除去水样中的其它物质B. 除去水样中的难溶性固体物质C. 使水样变为纯净水D. 对水样进行消毒处理6、下列说法中正确的是_______。
A. 在t℃时,90 g水中溶解10 g氯酸钾时达到饱和,所以氯酸钾在t℃时的溶解度是10 g/100 g水B. 硝酸钾在60℃的溶解度是110 g/100g水,110 g硝酸钾溶解在90 g水里,可得到60℃的硝酸钾饱和溶液200 gC. 在100 g水里最多溶解A物质36 g,则A物质的溶解度是36 g/100g水D. 在10℃时,50 g水里溶解10.5 g硝酸钾就不能再溶解,则硝酸钾在10℃时的溶解度是21 g/100 g水7、可乐等饮料中溶解有一定的二氧化碳,打开瓶盖会冒出许多气泡。
产生这一现象的原因是____________,导致二氧化碳的溶解度变______。
当气泡逸出后,瓶内的液体_____(填“是”或“不是”)二氧化碳的饱和溶液。
8、40℃时,A物质的溶液中溶质质量分数为40%,B物质溶液的质量分数为20%,将两种溶液在温度不变的情况下蒸发等质量的溶剂,析出的晶体的质量________。
A. A>BB. A<BC. A=BD. 无法确定9、在一定温度下,将少量生石灰放入一定量的饱和石灰水中,搅拌并冷却到原来温度。
下列说法中正确的是________。
A. 溶液浓度不变B. 溶质质量增加C. 溶剂质量不变D. 溶解度变大11、30℃时,老师在100 g饱和食盐水中加入8 g食盐,然后将其充分搅拌。
小敏认为溶液的质量增加了;小凤认为溶液的浓度增大了;小霞认为溶液中的溶质质量发生了改变;小娟认为溶液中溶质的溶解度发生了改变;她们的判断________。
12.现有100克质量分数为10%的食盐溶液,若使NaCl的质量分数增加一倍,应向此溶液中加入食盐_____克,或使溶液蒸发掉水_____克。
二、选择题1.在20℃时,向100克饱和食盐水(食盐的质量分数是26.5%)中加入5克食盐,在温度不变的情况下溶液中食盐的质量分数为()A 24.5%B 26.5%C 28.5%D 无法计算2.把30克质量分数为20%的氢氧化钠溶液,加水稀释到100克,取出稀释后溶液20克,此溶液中NaCl的质量分数为()A 5%B 6%C 3%D 2%3.把400克质量分数为20%食盐水稀释成质量分数为10%的溶液,需加水()A 100克B 200克C 400克D 800克4.20℃时NaCl在水中的溶解度是36g。
在该温度下,50g水中放入20gNaCl,溶解后所得溶液中NaCl的质量分数为()A 28.6%B 26.5%C 40%D 30%5.将溶质的质量分数为a%的溶液mg,稀释成溶质的质量分数为b%的溶液,需加水的质量为()A am/b gB m(a-b)/b gC a/mb gD (a-b)/m g7.某温度下,向一定量的水中不断加入食盐粉末并不断搅拌,能正确表示加入食盐的量(m)与所得溶液中NaCl的质量分数(a%)关系的图像是()8.20℃NaCl的溶解度是36g,在该温度下,将20gNaCl溶于100g水中配成溶液甲,取20g甲溶液,加入6gNaCl晶体,得到乙溶液,则甲、乙两溶液的溶质质量分数正确的一组是()A 甲—16.7% 乙—35.9%B 甲—20% 乙—35.9%C 甲—20% 乙—26.5%D 甲—16.7% 乙—26.5%9.在20℃时,A物质的不饱和溶液,浓度为10%,如再加入5gA或蒸发掉32.26g 水,都可成为饱和溶液,则20℃时,A的溶解度为()A 13.4gB 15.5gC 16.7gD 无法计算10.在100g稀中加入20%的溶液100g后浓度为12%,则原稀的浓度为()A 2%B 4%C 8%D 10%11.现有40℃时KNO3的饱和溶液82.0g,当温度下降至10℃时,溶液质量为60.5g,此时需加水102.4g才能把析出的晶体全部溶解,则40℃时KNO3的溶解度是A 32gB 64gC 40.5gD 21.5g12.将60℃的硫酸铜饱和溶液100克,冷却到20℃,下列说法正确的是A 溶液质量不变B 溶剂质量发生变化C 溶液为饱和溶液,浓度不变D 有晶体析出,溶剂质量不变13.某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。
若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是A 30%B ×100%C 26.5%D ×100%14.t℃时将一定质量的某物质的不饱和溶液分成三份,分别加热蒸发溶剂。
然后,把温度降至t℃。
已知从三份溶液中蒸发的溶剂分别为10g、20g、30g,析出晶体(不含结晶水)分别为a g、b g、c g,则a、b、c,三者的关系是()A c=2b-aB c=a+bC c=a+2bD c=2a+b答案答案:1.溶质质量与溶液质量的比值2.12.5 501.C 2.B 3.B 4.C 5.B 6.B 7.C 8.C 9.D 10.B 11.B 12.B 13.B 14.C 15.A (提示:第一份蒸发掉10 g水析出a g;第二份蒸发掉10 g水时,先析出a g,再蒸发掉10 g水时,又析出(b-a)g;第s三份蒸发掉10 g水时,先析出a g,又蒸发掉10 g水时,又析出(b-a)g,再蒸发掉10 g水时,再析出(b-a)g,所以共析出溶质c=a+(b-a)+(b-a)=2b-a )三、判断题下列说法是否正确?如不正确,应怎样改正?1.在20℃时,100克水溶解21克,这种溶液中溶质的质量分数是21%。
2.将50克质量分数为10%的NaCl溶液稀释成100克质量分数为5%的NaCl 溶液,稀释后溶液中溶质是稀释前溶液中溶质质量的一半。
答案:1.错:第一处错:指明溶液中溶质的质量分数时,无需给出温度条件第二处错:溶质的质量分数应改为:17.4%2.错:稀释前后,溶质的质量不变四、计算题1.蒸干15克NaCl溶液得到1.2克NaCl,计算原溶液中NaCl的质量分数。
2.在一定温度时,NaCl饱和溶液的质量是12g,把它蒸干后,得到3.2gNaCl,计算:(1)这一温度下NaCl的溶解度(2)该温度时NaCl饱和溶液中溶质的质量分数(3)配制该温度时NaCl饱和溶液1000g,需水和NaCl各多少g?3.在10℃时,,计算10℃时饱和溶液中溶质的质量分数。
在50℃时,饱和溶液中溶质的质量分数是33.3%,计算50℃时的溶解度。
4.在80g质量分数为15%溶液里加入20g水或20g,计算这两种方法制成的两种溶液中溶质的质量分数。
5.配500ml质量分数为10%NaOH(密度为),需NaOH和水各多少g?6.把100g质量分数为98%稀释成质量分数为10%,需水多少g?7.实验室需要配500g质量分数为10%的盐酸,需要质量分数为38%的盐酸(密度是)多少ml?8.100g某浓度的溶液恰好跟13g锌完全反应,试计算这种溶液中溶质的质量分数。
9.200ml质量分数为38%的盐酸跟足量的大理石反应,可生成多少L?(质量分数为38%盐酸的密度是,的密度按计算)。
10.30g可以跟150克溶液恰好完全反应,计算:(1)可制得多少g?把溶液蒸干,得到多少g?(2)这种溶液中溶质的质量分数是多少?(3)100g这种稀释成质量分数为20%的,需加水多少g?11.100g稀中滴入100g溶液,恰好完全反应,生成沉淀23.2g,求稀的百分比浓度,溶液的百分比浓度。
12.20℃时,把一定量20%的某物质的水溶液加热蒸发掉10g水,再降到20℃,析出2g溶质,溶液浓度变为24%,求20℃时,该物质的溶解度。
13.用60%的NaOH溶液与10%NaOH溶液混合,配制20%的NaOH溶液150g,求需60%的NaOH溶液和10%的NaOH溶液各多少g。
答案1.8%2.(1)36.4g (2)26.7% (3)需要水733g,NaCl267g3.10℃时的溶质的质量分数为24.8%,50℃时溶解度为49.9g。
4.若加20g水,溶质的质量分数为12%若加20g,溶质的质量分数为32%5.需要NaOH55g,水495g6.880g 7.111mL 8.19.6% 9.27.6L10.(1)产生0.92g,得到74.3g (2)30% (3)50g 11.9.8%,20.8% 12.31.6g 13.30g 120g。
