元素周期表的结构
元素周期表的结构与应用

元素周期表的结构与应用元素周期表是化学中极为重要的工具,它是化学元素按照一定规律排列的图表。
通过研究元素周期表的结构与应用,我们可以更好地理解化学元素的性质、相互关系和化学反应的规律。
本文将探讨元素周期表的结构、组成以及其在化学研究和应用中的重要性。
一、元素周期表的结构元素周期表的结构是按照元素的原子序数依次排列的。
每个元素由原子序数、元素符号、元素名以及一系列其他信息组成。
在传统的周期表中,元素按照升序排列,通过逐行增加原子序数的方式展示。
现代元素周期表则根据元素的化学性质和电子构型进行分类,使得具有相似性质的元素排列在一起。
以传统的周期表为例,第一横行(第一周期)有两个元素:氢(H)和氦(He)。
第二横行(第二周期)有8个元素:锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)和氖(Ne)。
这样逐行排列下去,直到第七周期。
在现代元素周期表中,元素被分类为主族元素、过渡金属、稀土元素、放射性元素等。
这种分类有助于我们理解元素之间的相似性和规律。
二、元素周期表的应用1. 预测元素性质元素周期表提供了预测元素性质的基础。
通过观察元素在周期表中的位置,我们可以初步判断元素的化学性质,如金属性、非金属性、半金属性质等。
这对于新发现元素的研究以及物质性质的预测都具有重要意义。
2. 分析元素间的关系元素周期表展示了不同元素之间的联系和规律。
在同一族的元素中,原子结构和化学性质存在某种规律性。
这有助于我们了解元素之间的相互关系,从而推断出元素在化学反应中的行为。
3. 辅助教学工具元素周期表是化学教学中不可或缺的工具。
通过学习元素周期表,学生可以更好地理解元素的性质和周期规律,并在化学实验中准确地选择和使用元素。
4. 指导新材料的研发元素周期表为新材料的研发和合成提供了指导。
通过研究元素周期表中元素的特性,科学家可以预测和设计新的合金、催化剂和其他功能材料。
这为新材料的合成和应用打下了基础。
元素周期表的基本结构与特点

元素周期表的基本结构与特点元素周期表是化学中一项重要的工具,用于组织和分类元素。
它以一种整洁、有序的方式呈现了所有已知元素的基本信息。
本文将介绍元素周期表的基本结构和特点。
1. 元素周期表的基本结构元素周期表按照一定规律将所有元素分类,并将其排列在一个方格状的表格中。
表格中的每个方格代表一个元素,按照从左到右和从上到下的顺序排列。
每个方格包含了元素的符号、原子序数、相对原子质量和元素名称等信息。
2. 周期与族元素周期表按照元素的物理和化学性质将元素分为周期和族。
周期是指元素在周期表中的水平行,共有7个周期。
第一周期只包含两个元素(氢和氦),而第七周期则是目前尚未被发现的超重元素。
族是指元素在周期表中的垂直列,共有18个族。
族数越小,元素的性质越相似。
3. 元素周期表的特点(1)周期性:元素周期表的主要特点是周期性,即元素的性质和周期号有关。
同一周期的元素具有相似的外层电子结构,因此它们的化学性质也相似。
例如,第一周期的元素都是气体,具有较低的沸点和熔点。
(2)原子序数增加规律:从左到右和从上到下,元素的原子序数逐渐增加。
原子序数是指元素原子核中的质子数量,也是元素的唯一标识。
原子序数的增加反映了元素化学性质的变化。
(3)周期表的分区:周期表根据元素的一些共同特征进行了分区。
主要分为主族元素、过渡金属、稀土金属和贵金属等。
这种分区方式有助于我们了解元素的特性和应用。
(4)元素周期表的扩展:随着科学技术的发展和新元素的发现,元素周期表不断扩展。
最初的周期表只包含了少数元素,而今天的周期表已经扩展到118个已知元素。
4. 元素周期表的应用元素周期表不仅仅是化学教学的基础工具,还具有广泛的应用价值。
它可以帮助科学家研究元素的性质和相互作用。
此外,周期表还在材料科学、药物研发、环境保护等领域发挥着重要作用。
通过对周期表的研究和应用,人们可以更好地理解元素和它们之间的关系,推动科学的发展。
总结:元素周期表作为化学领域的重要工具,具有整洁美观的排列结构和明确的信息呈现方式。
元素周期表(周期表结构)

22 40 72
23 41 73
24 42 74
25 43
27 45 77
30 48 80
75
76
7
104
105
106
107
108
109
110
111
112
过渡元素
66 98 67 99 68 100 69 101 70 102 71 103
57 89
58 90
59 91
60 92
61 93
Li、Ca
东师理想
5、在长式元素周期表中,元素A ,B位于同一周 期,A在ⅡA族;B在ⅢA族;A的原子序数为x , B的原子序数为y,则y不可能是(B ) A x+1 B x+10 C x+11 D x+25
解析: 若A,B同在第二或第三周期, x+1 若A,B同在第四或第五周期, x+11 若A,B同在第六或第七周期, x+25
iaiiaiiiaivavaviia第viii稀有气体元素纵行共七个主族ibivbvb三个纵行8910331818325566778818ivana14ia卤族元素卤族元素最外层电子数东师理想1111171710101919353511an8bn18cn32dn20元素的相对原子质量东师理想na11钠ne10氖mg12镁al13铝si14硅16硫cl17氯ar18氩19钾ca20钙iaiiaiiiaivavaviaviia族
东师理想
10、下表是元素周期表的一部分,数字 是该元素的原子序数,请填出其下一周期 元素的原子序数:
11
17
…… …….
19
35
11.在元素周期表中,所含元素种类 最多的是(D)形成化合物种类最多的 是(C ) A.Ⅷ族 B.ⅠA族 C.IVA族 D.ⅢB族 12.A、B为同主族的两元素,A在B的 上一周期,若A的原子序数为n,则B的 原子序数不可能为( D ) A.n+8 B.n+18 C.n+32 D.n+20
元素周期表各原子结构示意图
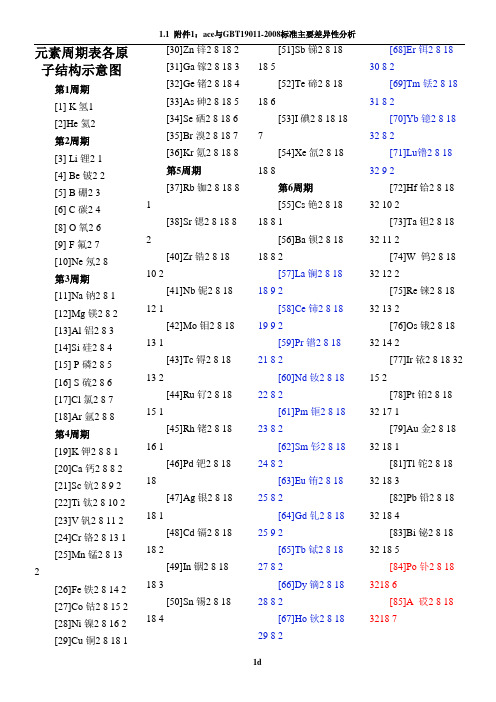
元素周期表各原子结构示意图第1周期[1] K 氢1[2]He 氦2第2周期[3] Li 锂2 1[4] Be 铍2 2[5] B 硼2 3[6] C 碳2 4[8] O 氧2 6[9] F 氟2 7[10]Ne 氖2 8第3周期[11]Na 钠2 8 1[12]Mg 镁2 8 2[13]Al 铝2 8 3[14]Si 硅2 8 4[15] P 磷2 8 5[16] S 硫2 8 6[17]Cl 氯2 8 7[18]Ar 氩2 8 8第4周期[19]K 钾2 8 8 1[20]Ca 钙2 8 8 2[21]Sc 钪2 8 9 2[22]Ti 钛2 8 10 2[23]V 钒2 8 11 2[24]Cr 铬2 8 13 1[25]Mn 锰2 8 13 2[26]Fe 铁2 8 14 2[27]Co 钴2 8 15 2[28]Ni 镍2 8 16 2[29]Cu 铜2 8 18 1[30]Zn 锌2 8 18 2[31]Ga 镓2 8 18 3[32]Ge 锗2 8 18 4[33]As 砷2 8 18 5[34]Se 硒2 8 18 6[35]Br 溴2 8 18 7[36]Kr 氪2 8 18 8第5周期[37]Rb 铷2 8 18 81[38]Sr 锶2 8 18 82[40]Zr 锆2 8 1810 2[41]Nb 铌2 8 1812 1[42]Mo 钼2 8 1813 1[43]Tc 锝2 8 1813 2[44]Ru 钌2 8 1815 1[45]Rh 铑2 8 1816 1[46]Pd 钯2 8 1818[47]Ag 银2 8 1818 1[48]Cd 镉2 8 1818 2[49]In 铟2 8 1818 3[50]Sn 锡2 8 1818 4[51]Sb 锑2 8 1818 5[52]Te 碲2 8 1818 6[53]I 碘2 8 18 187[54]Xe 氙2 8 1818 8第6周期[55]Cs 铯2 8 1818 8 1[56]Ba 钡2 8 1818 8 2[57]La 镧2 8 1818 9 2[58]Ce 铈2 8 1819 9 2[59]Pr 镨2 8 1821 8 2[60]Nd 钕2 8 1822 8 2[61]Pm 钷2 8 1823 8 2[62]Sm 钐2 8 1824 8 2[63]Eu 铕2 8 1825 8 2[64]Gd 钆2 8 1825 9 2[65]Tb 铽2 8 1827 8 2[66]Dy 镝2 8 1828 8 2[67]Ho 钬2 8 1829 8 2[68]Er 铒2 8 1830 8 2[69]Tm 铥2 8 1831 8 2[70]Yb 镱2 8 1832 8 2[71]Lu镥2 8 1832 9 2[72]Hf 铪2 8 1832 10 2[73]Ta 钽2 8 1832 11 2[74]W 钨2 8 1832 12 2[75]Re 铼2 8 1832 13 2[76]Os 锇2 8 1832 14 2[77]Ir 铱2 8 18 3215 2[78]Pt 铂2 8 1832 17 1[79]Au 金2 8 1832 18 1[81]Tl 铊2 8 1832 18 3[82]Pb 铅2 8 1832 18 4[83]Bi 铋2 8 1832 18 5[84]Po 钋2 8 183218 6[85]A 砹2 8 183218 7[86]Rn 氡2 8 18 32 18 8第7周期[87]Pr 钫2 8 18 32 18 8 1[88]Ra 镭2 8 18 32 18 8 2[89]Ac 锕2 8 18 32 18 9 2[90]Th 钍2 8 18 32 18 10 2[91]Pa 镤2 8 18 32 20 9 2[92]U 铀2 8 18 32 21 9 2[93]Np 镎2 8 18 32 22 9 2[94]Pu 钚2 8 18 32 24 8 2[95]Am 镅*2 8 18 32 25 8 2[96]Cm 锔*2 8 18 32 25 9 2[97]Bk 锫*2 8 18 32 27 8 2[98]Cf 锎*2 8 18 32 28 8 2[99]Es 锿*2 8 18 32 29 8 2[100]Fm 镄*2 8 18 32 30 8 2[101]Md 钔*2 8 18 32 31 8 2[102]No 锘*2 8 18 32 32 8 2[103]Lr 铹*2 8 18 32 32 9 2[104]Rf*[105]Db*[106]Sg*[107]Bh*[108]Hs*[109]Mt*[110]Ds*[111]Rg*[112]Uub*104-112号暂未列出57-71号为镧系元素89-103号为锕系元素红色(深红色)为放射性元素带*号为人造元素精品文档word文档可以编辑!谢谢下载!。
元素周期表的基本结构和特点

元素周期表的基本结构和特点元素周期表是化学领域中一项重要的工具,为科学家们研究和理解元素的性质以及元素之间的相互作用提供了基础。
本文将介绍元素周期表的基本结构和特点。
一、基本结构元素周期表主要由一张方形表格构成,表格中按照一定规律排列了所有已知的化学元素。
这些元素按照原子序数的顺序从左至右排列,并且根据元素的共性进行分类和分组。
每个元素都用一个简写或符号表示,这些符号通常由元素的拉丁名的前一个或前两个字母组成。
表格的水平行称为周期,垂直列称为族。
元素周期表共有七个周期和十八个族。
在周期表的左侧是金属元素,右侧是非金属元素。
金属元素通常位于周期表的中部,而非金属元素则位于两侧。
二、特点1. 周期性元素周期表将元素按照原子序数的增加顺序排列。
原子序数是指元素原子核中的质子个数或者是元素中电子的数目。
按照这个排列顺序,元素周期表可以看到元素性质的周期性变化。
2. 原子量元素周期表中的每一个元素都标有其对应的原子量。
原子量是指元素一个普通原子的相对质量。
在周期表中,原子量通常以小数形式表示,对应该元素不同同位素的平均质量。
3. 周期规律元素周期表中的元素具有明显的周期性规律。
例如,周期表中在同一周期的元素具有相似的电子排布和能级结构。
而在同一族的元素,由于共享相同的化学性质,常常表现出相似的反应性和化学行为。
4. 元素分类元素周期表将元素分为金属、非金属和类别不明的元素三大类。
金属元素通常具有良好的导电和热导性能,而非金属元素则主要以半导体或绝缘体的形式存在。
类别不明的元素则是指一些尚未被归类到金属或非金属的特殊元素。
5. 变价性元素周期表中的元素通常具有多种不同的氧化态,即变价性。
变价性指的是元素在化合物中能够失去或获得的电子数目。
由于元素周期表中的分组和周期划分得当,因此我们可以根据元素在周期表中的位置预测其可能的氧化态。
结论元素周期表作为化学中极为重要的工具,为科学家们提供了一个理解元素性质和元素之间相互作用的基础。
高考化学专题元素周期表

第3课时元素周期表一、元素周期表的结构1.元素周期表的编排原则(1)横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
(2)纵行原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
2.元素周期表的结构(1)周期①数目:元素周期表有7个横行,即有7个周期。
②分类短周期:第1、2、3周期,每周期所含元素的种类数分别为2、8、8。
长周期:第4、5、6、7周期,每周期所含元素的种类数分别为18、18、32、32。
③周期数=电子层数。
(2)族①数目:元素周期表有18个纵行,但只有16个族。
②分类主族,共7个(由长、短周期元素构成,族序数后标A)。
副族,共7个(只由长周期元素构成,族序数后标B)。
第Ⅷ族,包括8、9、10三个纵行。
0族,最外层电子数是8(He是2)。
③主族序数=最外层电子数。
(3)过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
(1)元素周期表的结构(2)列序数与族序数的关系①列序数<8,主族和副族的族序数=列序数;②列序数=8或9或10,为第Ⅷ族;③列序数>10,主族和副族的族序数=列序数-10(0族除外)。
例1下列关于元素周期表的说法正确的是()A.在元素周期表中,每一纵行就是一个族B.主族元素都是短周期元素C.副族元素都是金属元素D.元素周期表中每个长周期均包含32种元素考点元素周期表的结构题点元素周期表的结构答案 C解析A项,第8、9、10三个纵行为第Ⅷ族;B项,主族元素由短周期元素和长周期元素共同组成。
例2(2017·聊城高一检测)若把元素周期表原先的主副族及族号取消,由左至右改为18列,如碱金属元素为第1列,稀有气体元素为第18列。
按此规定,下列说法错误的是() A.只有第2列元素的原子最外层有2个电子B.第14列元素形成的化合物种数最多C.第3列元素种类最多D.第18列元素都是非金属元素考点元素周期表的结构题点元素周期表的结构答案 A解析周期表中各族元素的排列顺序为ⅠA、ⅡA、ⅢB→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA→ⅦA、0族,18列元素与以上对应,所以A项中为ⅡA族,最外层有2个电子,但He及多数过渡元素的最外层也是2个电子,故A项错误;第14列为碳族元素,形成化合物种类最多,故B项正确;第3列包括镧系和锕系元素,种类最多,故C项正确;第18列为稀有气体元素,全部为非金属元素,故D项正确。
元素周期表的结构与特点

添加标题
工业生产:元素周 期表在工业生产中 具有广泛应用,例 如在材料科学、石 油化工、制药等领 域,通过元素周期 表可以了解材料的 性质和特点,优化 生产工艺和提高产
品质量。
添加标题
环境保护:元素周 期表在环境保护中 也有应用,例如在 监测空气质量、水 质和土壤污染等方 面,通过元素周期 表可以了解污染物 的来源和性质,为 环境保护提供科学
01
02
03
04
PART 02
元素周期表的特 点
周期性
元素周期表中的元素按照原子序数从低到高排列,呈现出周期性的特点。
同一周期内的元素具有相同的电子层数和原子序数,表现出相似的化学性质。
不同周期的元素,随着原子序数的增加,元素的性质逐渐发生变化,呈现出明显的周 期性规律。
元素周期表中的元素按照族、列和周期的顺序进行分类,使得元素的性质和结构更加 清晰,方便了人们对元素的认识和利用。
工业生产
工业生产:利用元素周期表,可以预 测和选择合适的材料和工艺,提高生 产效率和产品质量。
科学研究:元素周期表是化学、物理 和材料科学等领域的重要工具,有助 于科学家发现新元素和探索物质性质。
环境保护:元素周期表可用于检 测和监测环境污染,评估环境质 量,制定环境保护措施。
医疗保健:元素周期表在医学领域的 应用包括药物研发、诊断和治疗等方 面,有助于提高医疗水平和治疗效果。
PART 03
元素周期表的应 用
科学研究
科学研究:元素周期表在科学研究领域中具有重要应用,如化学、物理、材料科学等。 工业生产:元素周期表在工业生产中具有广泛应用,如冶金、石油化工、制药等。 环境保护:元素周期表在环境保护领域中也有应用,如土壤修复、水处理等。 医学研究:元素周期表在医学研究中具有重要应用,如药物研发、疾病诊断和治疗等。
元素周期表
△ 与H2反应:2M+H2 = 2MH -1 +1
MH与H2O反应:MH+H2O = MOH+H2↑
0
请分析化合 价变化情况
(2)与水反应
实 验 切取绿豆
大小的一小块 钾投入冷水
现象:
反应剧烈,钾熔成小球在
液面快速游动,生成的氢气燃
烧,并发生轻微爆炸。反应后 溶液变红。 反应:
检验物质的方法
⑴ 颜色改变法
Na+ K+ 无色 酸能使紫色石蕊试液变红 碘遇淀粉变蓝 ⑵ 生成沉淀法 钾盐和钠盐均溶于水 Ag+ + Cl- =AgCl Ba2+ + SO42- = BaSO4 ⑶ 生成气体法 2H+ + SO32- = H2O +SO2 NH4+ + OH- = NH3 + H2O
碱性最强的最高价氧化物的水化物是CsOH
三 核素 同位素
1. 元素:具有相同核电荷数(或质子数)的同一类原子的总称。 2. 核素:具有一定数目的质子和一定数目的中子的一种原子。
3. 同位素:质子数相同而中子数不同的同一种元素的原子互称
为同位素,即同一元素的不同核素之间互称为同位素。
元 素
核素1 … 核素n
金属性强弱
⑵M(OH)m 的碱性 ⑶单质的还原性(或离子的氧化性) ⑷置换反应 ⑴与氢气反应生成气态氢化物的难易或稳定性 ⑸与同一非金属反应的难易
非金属性强弱
⑵Hn RO m酸性 ⑶单质还原性(或离子氧化性)
⑷置换反应
讨论及小结:
周期表之最
非金属性最强的元素是F 稳定性最强的气态氢化物是HF
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表的结构
元素周期表是化学中非常重要的一种工具,用于分类、归纳和展示
元素的性质。
它的结构是基于元素的原子核结构和电子排布的规律性。
本文将介绍元素周期表的结构和其背后的科学原理。
1. 原子核结构和元素周期表的关系
元素周期表的结构是建立在元素的原子核结构上的。
原子核由质子
和中子组成,质子数决定了元素的原子序数(Z),而中子数则决定了元
素的同位素。
元素周期表将元素按照原子序数的增序排列,从左至右
和从上至下,每一个元素都有一个唯一的原子序数,对应着一个特定
的元素。
2. 基本组成和排列方式
元素周期表由一系列水平排列的行和垂直排列的列组成。
水平排列
的行称为周期,垂直排列的列称为族。
周期表中第一行是1周期,第
二行是2周期,依此类推。
3. 元素周期表的分区
元素周期表还可以进一步分为主族元素、过渡金属元素、稀土元素
和放射性元素等几个不同的区域。
- 主族元素(1A到8A族)是元素周期表中最左侧和最右侧的元素。
它们具有相似的化学性质,因为它们的外层电子数相同。
- 过渡金属元素(1B到8B族)是位于元素周期表中间的一系列元素。
它们的特点是具有可变的氧化态以及形成彩色的化合物的能力。
- 稀土元素是位于元素周期表底部的两个行(第六周期和第七周期)中的一系列元素。
稀土元素具有特殊的电子排布和化学性质。
- 放射性元素是指具有不稳定原子核的元素,其中包括放射性衰变
和人工合成的元素。
4. 周期性规律
元素周期表的主体是按照原子序数的增序排列的。
这种排列方式是
基于以下两个重要的周期性规律:
- 周期性规律1:原子半径的变化。
原子半径随着周期数的增加而减小,随着族数的增加而增大。
这是由于核电荷数增加导致外层电子受
核吸引力增强的结果。
- 周期性规律2:电离能和电子亲和能的变化。
电离能是指从一个原子中去除一个电子所需要的能量,而电子亲和能是指向一个原子中添
加一个电子所释放出的能量。
这些能量随着周期数的增加而增大,随
着族数的增加而减小。
这些周期性规律让我们能够预测和解释元素的化学性质,从而更好
地理解元素周期表的结构和元素的行为。
总结起来,元素周期表的结构是基于元素的原子核结构和电子排布
的规律性。
它的分区和排列方式使得我们能够方便地查找和比较元素
的性质。
周期性规律进一步揭示了元素之间的关联性和趋势,为化学
研究和应用提供了重要的基础。
通过学习元素周期表的结构和其背后的科学原理,我们能够更好地
理解元素的性质和行为,拓展我们对化学世界的认识。
元素周期表作
为化学的基础工具,对于研究和应用各种化学现象都具有重要的意义。
让我们继续深入学习和探索,发现更多元素周期表的奥秘。
