高中化学必修一金属及其化合物必记方程式
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
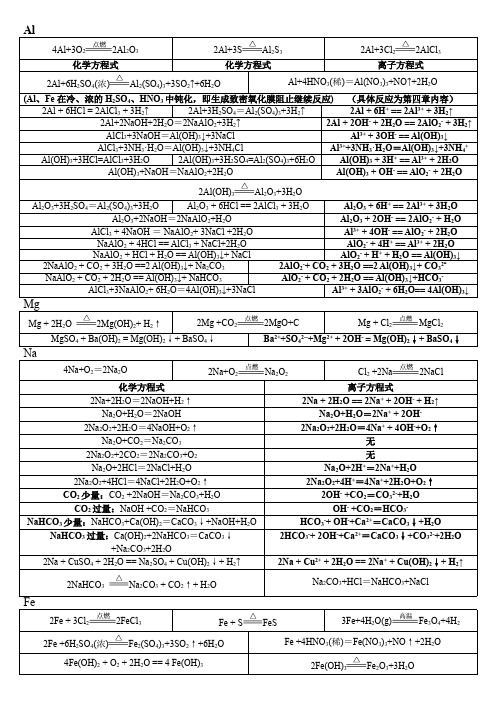
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
高三化学高考必记的化学方程式

高三化学高考必记的化学方程式一、非金属元素的反应1. 卤族元素(1)氯气H 2+Cl 2=====点燃2HCl2Fe +3Cl 2=====点燃2FeCl 3Cl 2+H 2O===HCl +HClO2NaOH +Cl 2===NaClO +NaCl +H 2O2Ca(OH)2+2Cl 2===Ca(ClO)2+CaCl 2+2H 2O6FeBr 2+3Cl 2===4FeBr 3+2FeCl 3(氯气少量)2FeBr 2+3Cl 2===2FeCl 3+2Br 2(氯气过量)[活学巧用] 氯水成分复杂,性质多样:强酸性——H +的性质;杀菌、漂白性——HClO 的性质;强氧化性——Cl 2的性质。
氯气溶于水,但不溶于饱和食盐水,因此可用饱和食盐水除去Cl 2中的HCl 。
Cl 2与NaOH 溶液的反应被用于实验室除去多余的Cl 2,常出现在框图推断中。
[易错警示] 氯气与FeBr 2溶液反应时,一定要注意二者量的关系,Cl 2首先氧化的是Fe 2+,然后氧化Br -;但Cl 2与FeI 2溶液反应时,首先氧化的是I -,然后氧化Fe 2+。
根据得失电子守恒可得出相应反应的离子方程式,如等物质的量的Cl 2与FeBr 2在溶液中反应时,其离子方程式为2Fe 2++2Cl 2+2Br -===2Fe 3++4Cl -+Br 2。
(2)含氯化合物2HClO=====光照2HCl +O 2↑Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClONaClO +2HCl===NaCl +Cl 2↑+H 2OMnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O[活学巧用] HClO 可作漂白剂和杀菌剂是由于HClO 具有强氧化性,长时间放置的氯水易变质是由于HClO 在光照条件下极易分解,所以新制的氯水需避光保存。
(3)卤素单质间的置换反应Cl 2+2NaBr===Br 2+2NaClCl 2+2NaI===I 2+2NaClBr 2+2KI===2KBr +I 2[活学巧用] 以上反应可用于比较Cl 2、Br 2、I 2氧化性(非金属性)的强弱或与CCl 4、淀粉溶液相结合用于溶液中Br -、I -的检验。
高中化学必修一第三章知识点总结

高中化学必修一第三章知识点总结一、金属及其化合物(一)金属的化学性质1. 金属与非金属的反应- 钠与氧气反应- 常温下:4Na + O_{2}=2Na_{2}O,氧化钠为白色固体。
- 加热时:2Na+O_{2}{}{=!=!=}Na_{2}O_{2},过氧化钠为淡黄色固体。
- 铝与氧气反应- 在常温下,铝能与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,4Al + 3O_{2}=2Al_{2}O_{3}。
这层薄膜可以阻止内部的铝进一步被氧化。
2. 金属与酸和水的反应- 钠与水反应- 化学方程式:2Na + 2H_{2}O = 2NaOH+H_{2}↑。
- 现象:“浮(钠的密度比水小)、熔(反应放热,钠的熔点低)、游(有气体生成)、响(反应剧烈)、红(溶液呈碱性,使酚酞变红)”。
- 铁与水蒸气反应- 化学方程式:3Fe + 4H_{2}O(g){高温}{=!=!=}Fe_{3}O_{4}+4H_{2}。
3. 铝与氢氧化钠溶液反应- 化学方程式:2Al+2NaOH + 2H_{2}O=2NaAlO_{2}+3H_{2}↑。
(二)几种重要的金属化合物1. 氧化物- 氧化钠和过氧化钠- 氧化钠(Na_{2}O)- 属于碱性氧化物,与水反应:Na_{2}O + H_{2}O = 2NaOH;与酸反应:Na_{2}O+2HCl = 2NaCl + H_{2}O。
- 过氧化钠(Na_{2}O_{2})- 与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH+O_{2}↑。
- 与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2},因此过氧化钠可用于呼吸面具和潜水艇中作为氧气的来源。
- 氧化铝(Al_{2}O_{3})- 两性氧化物,既能与酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O,又能与碱反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O。
必修一化学方程式化学必修一方程式总结

必修一化学方程式化学必修一方程式总结一:[必修一化学方程式]人教版化学《必修1》化学方程式归纳大总结!一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na + O2=(△)Na2O22.钠与水反应:2Na + 2H2O=2NaOH + H2↑_离子方程式:2Na + 2H2O=2Na++2OH-+ H2↑3.钠与硫酸反应:2Na +H2SO4=Na2SO4+H2↑4.氧化钠与水反应:Na2O+H2O=2NaOH5.过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3+O2↑6.过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑7.NaOH溶液中通入少量CO2:2NaOH+CO2= Na2CO3+H2O 离子方程式:2OH-+CO2= CO32-+H2O NaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3离子方程式:OH-+CO2= HCO3-8.①向碳酸钠溶液滴入少量稀盐酸:Na2CO3 + HCl = NaHCO3+ NaCl向稀盐酸滴入少量碳酸钠溶液:Na2CO3 + 2HCl = 2NaCl +H2O + CO2↑②除去碳酸氢钠溶液中混有的碳酸钠:Na2CO3+ H2O +CO2 =2NaHCO3③碳酸钠与氢氧化钙:Na2CO3+ Ca(OH)2=CaCO3↓ + 2NaOH④碳酸氢钠与盐酸:NaHCO3+HCl=NaCl+H2O+CO2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCO3+ Ca(OH)2=CaCO3↓+NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO3 + NaOH =(△) Na2CO3 + H2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCO3 =(△) Na2CO3 + H2O+CO2 ↑⑧鉴别碳酸钠和碳酸氢钠溶液:Na2CO3 + CaCl2=CaCO3↓ + 2NaCl二、镁的提取与应用1.与非金属O2、Cl2、S、N2等反应2Mg+O2 =(点燃) 2MgO Mg+Cl2=(点燃)MgCl2Mg+S=(△)MgS 3Mg+N2 =(点燃) Mg3N22.与热水反应:Mg+2H2O(热水)=(△)Mg(OH)2 + H2↑3.与稀硫酸反应:Mg+H2SO4=MgSO4+H2↑ 离子方程式:Mg+2H+=Mg2++H2↑4.与硫酸铜溶液反应:Mg+CuSO4=MgSO4+Cu 离子方程式:Mg+Cu2+=Mg2++Cu5.与CO2反应:2Mg+CO2=(点燃)C+2MgO6.向海水中加石灰乳使Mg2+沉淀:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2离子方程式Mg2++Ca(OH) 2=Mg(OH)2↓+Ca2+7.电解MgCl2:MgCl2(熔融) =(电解) Mg+Cl2↑三、铝及其化合物1.铝与氧气的反应:4Al + 3O2 =(点燃) 2Al2O32.铝与氧化铁反应(铝热反应):2Al + Fe2O3 =(高温) 2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑ 离子方程式:2Al + 6H+= 2Al3++ 3H2↑4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3 + 2NaOH =2NaAlO2+H2O 离子方程式:Al2O3 + 2OH-=2 AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+= Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3 +NaOH =NaAlO2+2H2O离子方程式:Al(OH)3 +OH-=AlO2-+2H2O9.氢氧化铝受热分解:_2Al(OH)3 =(△) Al2O3 +3H2O _10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=Al(OH)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH =NaAlO2 + 3NaCl+2H2O12.往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO313.电解氧化铝:2Al2O3 =(电解) 4Al+3O2↑四、铁及其化合物1.铁与氧气反应:3Fe + 2O2 =(点燃)Fe3O4铁与硫反应:Fe + S =(△) FeS2.铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+= Fe2++ H2↑铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu3.铁和水蒸气:3Fe + 4H2O(g) =(高温) Fe3O4+ 4H2_4.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O离子方程式:FeO+2H+=Fe2++H2O5.氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O6.CO还原氧化铁:Fe2O3+ 3CO=(高温)2Fe + 3CO27.氯化铁与氢氧化钠溶液:FeCl3+3NaOH = Fe(OH)3↓+3NaCl_离子方程式:Fe3++3OH-= F e(OH)3↓8.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:Fe2++2OH -= Fe(OH)2↓9.氢氧化铁加热分解:2Fe(OH)3=(△)Fe2O3+3H2O10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O2 + 2H2O =4Fe(OH)311.除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2 _离子方程式:2Fe3++ Fe = 3Fe2+12.FeCl2和Cl2反应:2FeCl2 + Cl2= 2FeCl3_离子方程式:_2Fe2++ Cl2 = 2Fe3++2Cl-13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+14.氯化铁与硫氰化钾溶液反应:Fe3+ + 3SCN-= Fe(SCN)3五、硅及其化合物1.硅与氧气加热:Si+O2=(△)SiO2硅与氟气:Si+2F2=SiF42.硅单质与氢氟酸反应:Si+4HF=SiF4+2H23.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑4.二氧化硅与氢氟酸反应:4HF+SiO2=SiF4↑+2H2O5.二氧化硅与氧化钙高温反应:SiO2+CaO=(高温)CaSiO36.二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3+ H2O7.二氧化硅与碳反应:SiO2 + 2C =(高温) Si + 2CO↑8.硅酸钠与盐酸反应:Na2SiO3+2HCl=H2SiO3↓+2 NaCl 离子方程式:SiO32-+2H+=H2SiO3↓9.往硅酸钠溶液中通入二氧化碳:Na2SiO3 +CO2+H2O == H2SiO3↓+ Na2CO310.二氧化硅与纯碱反应:SiO2+Na2CO3=(高温)Na2SiO3+CO2↑11.二氧化硅与石灰石反应:SiO2+CaCO3=(高温)CaSiO3+CO2↑12.加热硅酸:H2SiO3=(△)SiO2+H2O六、氯及其化合物1.实验室制氯气:MnO2+4HCl(浓) =(△) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl-=(△) Mn2++Cl2↑+2H2O2.钠在氯气中燃烧:2Na+Cl2 =(点燃)2NaCl铁在氯气中燃烧:2Fe+3Cl2 =(点燃) 2FeCl3铜在氯气中燃烧:Cu + Cl2 =(点燃) CuCl2氢气在氯气中燃烧:H2 + Cl2 =(点燃) 2HCl3.氯气和水反应:Cl2 + H2O = HCl+ HClO 离子方程式:Cl2 + H2O = H++Cl-+ HClO4.次氯酸光照分解:2HClO=(△)2HCl + O2↑5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O 离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2+ 2H2O8.漂白粉漂白原理:Ca(ClO)2 + CO2+ H2O =Ca CO3↓ + 2HClO9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2+ 2KCl离子方程式:Cl2 + 2Br-= Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2+ 2KCl 离子方程式:Cl2 + 2I-= I2 + 2Cl-溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr 离子方程式:Br2 +2I-= I2+2Br-11.氯化钠和硝酸银溶液:AgNO3 + NaCl =AgCl↓ + NaNO3离子方程式:Ag++Cl-=AgCl↓溴化钠和硝酸银溶液:AgNO3 + NaBr=AgBr↓ + NaNO3离子方程式:Ag++Br-=AgBr↓_碘化钠和硝酸银溶液:AgNO3 + NaI =AgI↓ + NaNO3离子方程式:Ag++I-=AgI↓七、硫及其化合物1.硫在空气中燃烧:S+O2=(点燃)SO2硫与氢气加热:S+H2=(△)H2S2.二氧化硫与水:SO2+H2O?H2SO3二氧化硫与氧化钙:SO2+CaO=CaSO3少量SO2与氢氧化钠:2NaOH+SO2=Na2SO3+H2O离子方程式:2OH-+SO2= SO32-+H2O过量SO2与氢氧化钠:NaOH+SO2=NaHSO3离子方程式:OH-+SO2= HSO3-3.SO2通入过量的澄清石灰水:Ca(OH)2+SO2=CaSO3↓+H2O过量的SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)24.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O5.SO2的催化氧化:2SO2 + O2? (催化剂、△) 2SO36.亚硫酸钠和硫酸反应:Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O7.Na2SO3与氧气反应:2Na2SO3+O2=2Na2SO48.三氧化硫和水反应:SO3+H2O=H2SO49.三氧化硫与氧化钙:SO3+CaO= CaSO410.三氧化硫与氢氧化钙:Ca(OH)2+SO3=CaSO4↓+H2O11.铜与浓硫酸反应:Cu + 2H2SO4(浓)=(△)CuSO4 + 2H2O+SO2 ↑12.碳与浓硫酸反应:C + 2H2SO4(浓)=(△) 2H2O+CO2↑+2SO2↑八、氮及其化合物1.氮气和氧气反应:N2 + O2=(放电)2NO2.工业合成氨:N2 + 3H2? (催化剂、高温高压) 2NH33.一氧化氮与氧气反应:2NO + O2=2NO24.NO2溶于水:3NO2 + H2O=2HNO3+ NO5.氨气溶于水:NH3 + H2O?NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O?NH4+ + OH-6.浓氨水受热分解:NH3·H2O=(△)NH3↑+H2O7.氨气和氯化氢:HCl + NH3 = NH4Cl8.氨的催化氧化:4NH3 +5O2=(催化剂、△) 4NO + 6H2O9.氯化铵受热分解:NH4Cl=(△)NH3+HCl10.碳酸氢铵受热分解:__ =(△)NH3 ↑+ H2O↑+ CO2 ↑11.硝酸铵和NaOH:NH4NO3 + NaOH =(△) NaNO3 + NH3↑+H2O 离子方程式:NH4++ OH-=(△)NH3↑+H2O12.实验室制氨气:2NH4Cl+ Ca(OH)2=(△)CaCl2 + 2NH3↑ + 2H2O13.浓硝酸与铜反应:4HNO3(浓)+Cu =(△) Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu =(△) Cu2++2NO2↑+2H2O14.稀硝酸与铜反应:8HNO3(稀)+3Cu =(△) 3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu =(△) 3Cu2++2NO↑+4H2O15.硝酸见光分解:4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)16.NH4+的检验离子方程式:NH4++ OH-=(△)NH3↑+H2O17.NO2、O2混合气通入水中无剩余气体:4NO2 + O2+ 2H2O = 4HNO318.NO、O2混合通入水中无剩余气体:4NO+ 3O2+ 2H2O = 4HNO3二:[必修一化学方程式]高一必修一化学方程式1、钠与氧气(常温):4Na + O2 = 2Na2O (加热)2Na + O2 △ Na2O2钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 离方:2、铁与水蒸气反应:3Fe + 4H2O(g) △ Fe3O4 + 4H23、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 离方:4、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 离方:过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O25、Na2CO3溶液加入过量盐酸:Na2CO3+2HCl=2NaCl+CO2↑+H2O 离方:NaHCO3和盐酸反应:NaHCO3+HCl=NaCl+CO2↑+H2O 离方:NaHCO3和NaOH反应:NaHCO3+ NaOH = Na2CO3+H2O 离方:NaOH 溶液中通入少量CO2:2NaOH + CO2 = Na2CO3 + H2O 离方:继续通入过量CO2:Na2CO3+CO2+H2O =2NaHCO3 离方:总:NaOH + CO2 = NaHCO3 离方:NaHCO3固体受热分2NaHCO3 Na2CO3+CO2↑+H2O6、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 离方:氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 离方:7、Al(OH)3的制备:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH4)2SO4 离方:氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O 离方:氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 离方:氢氧化铝加热分2Al(OH)3 △ Al2O3 + 3H2O8、氧化亚铁与盐酸反应:FeO + 2HCl = FeCl2 + H2O 离方:氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 离方:9、Fe(OH)3的制备:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl 离方:Fe(OH)2的制备:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 离方:Fe(OH)2被空气中的氧气氧化成Fe(OH)3:4Fe(OH)2 + O2+ 2H2O = 4Fe(OH)3 (现象:)氢氧化铁加热分2Fe(OH)3 △ Fe2O3 + 3H2O10、Fe3+向Fe2+转化(加铁粉):2FeCl3 + Fe = 3FeCl2 离方:Fe2+向Fe3+转化(加氯水):2FeCl2 + Cl2 = 2FeCl3 离方:11、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2H2O 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O 离方:二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3 工业制玻璃原理:SiO2 + Na2CO3 高温Na2SiO3 + CO2↑ SiO2 +CaCO3 高温CaSiO3 + CO2↑12、硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓离方:硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ 离方:硅酸受热分H2SiO3 △ SiO2 + H2O13、粗硅的制取:SiO2 + 2C 高温Si + 2CO↑ 14、硅单质与F2、HF、NaOH溶液:Si + 2F2 = SiF4 Si + 4HF = SiF4 + 2H2↑Si + 2NaOH + H2O = NaSiO3↓ +2H2↑ 15、氯气与金属反应:2Na + Cl2 点燃2NaCl 2Fe + 3Cl2 点燃2FeCl3 Cu + Cl2 点燃CuCl2氯气与非金属H2反应:H2 + Cl2点燃2HCl 氯气与水反应:Cl2 + H2O = HCl + HClO 离方:HClO光照下分2HClO 光照2HCl + O2↑制漂白液(或氯气尾气处理):Cl2 + 2NaOH = NaCl + NaClO + H2O 离方:制漂白粉(或漂粉精):2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 漂白粉长期置露在空气中失效:Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO ,2HClO 光2HCl + O2↑16、硫与非金属:S + O2 点燃SO2 H2+ S △ H2S 硫与金属:Fe + S △ FeS 2Cu + S △ Cu2S17、二氧化硫与水反应:SO2 + H2O H2SO3 二氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3 二氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2O 离方:二氧化硫与硫化氢气体反应:2H2S +SO2 = 3S↓ + 2H2O 二氧化硫通入氯水中:SO2 + Cl2 + 2H2O = 2HCl + H2SO4 (Cl2可换作Br2、I2)离方:二氧化硫被O2氧化:2SO2 + O2 2SO318、三氧化硫:SO3 + H2O= H2SO4 SO3 + Ca(OH)2 = CaSO4↓ + H2O19、氮气与氧气在放电下反应:N2 + O2 放电或高温2NO一氧化氮与氧气反应:2NO + O2 = 2NO2二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO有关NO、NO2、O2混合气体溶于水的计算:4NO2 + O2 +2H2O = 4HNO3 4NO + 3O2 +2H2O = 4HNO320、NH3在水中的反应:NH3 + H2O NH3·H2O NH4++ OH—NH3·H2O受热分NH3·H2O △ NH3↑ + H2O 氨气与氯化氢反应:NH3 + HCl = NH4Cl 21、氯化铵受热分NH4Cl △ NH3↑ + HCl↑ 碳酸氢氨受热分__ △ NH3↑ + H2O↑ + CO2↑ 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NaNO3 +NH3↑ + H2O (检验NH4+的方法:离方:22、实验室制取氨气:2NH4Cl + Ca(OH)2 △ CaCl2 + 2NH3↑+ 2H2O 工业合成氨:N2 + 3H2 2NH323、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + SO2↑+ 2H2O浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑+ 2H2O 24、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O 稀硝酸与铜反应:3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O离方:浓硝酸与木炭反应:C + 4HNO3(浓) = CO2↑+ 4NO2↑+ 2H2O.三:[必修一化学方程式]高中化学必修一化学方程式总结喜欢本篇文章,请随手点赞,欢迎分享到朋友圈文章转自网络,因无法查询出处无法标注来源,如有侵权,请联系管理员删除。
元素(金属、非金属)及其化合物化学方程式

金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。
高三化学金属及其化合物化学方程式大全

2Al 3+ + 3CO32- + 3H2O====2Al(OH) 3↓ + 3CO2↑
Al 3+ + 3HCO3-==== Al(OH) 3↓ + 3CO2↑
Al 3+ + 3HS- + 3H2O ====Al(OH) 3↓ + 3H2S↑
2Al 3+ + 3S2- + 6H2O ====2Al(OH) 3↓ + 3H2S↑
FeCl
2+Mg====Fe+MgC2 l
FeCl3
2FeCl3+Fe====3FeC2l 2FeCl 3+Cu====2FeC2l+CuCl2( 用于雕刻铜线路板 ) 2FeCl3+H2SO3+H2O====H2SO4+2FeCl2+2HCl 2FeCl3+Zn====2FeC2l+ZnCl2 2FeCl 3+H2S====2FeC2l+2HCl+S↓ 2FeCl3+2KI====2FeCl2+2KCl+I 2
Al
铝和非金属反应:
点燃
4Al+3O 2
2Al 2O3(纯氧 )
△
2Al+3S Al 2S3
△
2Al+3Cl 2 2AlCl 3
铝热反应:
高温
2Al+Fe2O3
Al2O3+2Fe
铝和酸反应 2Al + 6HCl====2AlCl 3 + 3H2↑ 2Al+3H 2SO4====Al 2(SO4)3+3H2↑
化学必修一化学方程式及离子方程式整理

化学必修一化学方程式及离子方程式整理化学是一门充满奥秘和神奇的科学,而化学方程式及离子方程式则是我们理解和描述化学反应的重要工具。
在化学必修一中,我们学习了众多的化学方程式和离子方程式,下面就来为大家进行一番整理。
一、金属及其化合物1、钠及其化合物(1)钠与氧气在常温下反应:4Na + O₂= 2Na₂O (化学方程式)4Na + O₂= 2Na⁺+ 2O²⁻(离子方程式)(2)钠在空气中燃烧:2Na + O₂点燃 Na₂O₂(化学方程式)2Na + O₂点燃 2Na⁺+ O₂²⁻(离子方程式)(3)钠与水反应:2Na + 2H₂O = 2NaOH + H₂↑ (化学方程式)2Na + 2H₂O = 2Na⁺+ 2OH⁻+ H₂↑ (离子方程式)2、铝及其化合物(1)铝与氧气反应:4Al + 3O₂= 2Al₂O₃(化学方程式)无离子方程式(2)铝与盐酸反应:2Al + 6HCl = 2AlCl₃+ 3H₂↑ (化学方程式) 2Al + 6H⁺= 2Al³⁺+ 3H₂↑ (离子方程式)(3)铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H₂O =2NaAlO₂+ 3H₂↑ (化学方程式) 2Al + 2OH⁻+ 2H₂O =2AlO₂⁻+ 3H₂↑ (离子方程式)3、铁及其化合物(1)铁与氧气反应:3Fe + 2O₂点燃 Fe₃O₄(化学方程式)无离子方程式(2)铁与盐酸反应:Fe + 2HCl = FeCl₂+ H₂↑ (化学方程式)Fe + 2H⁺= Fe²⁺+ H₂↑ (离子方程式)(3)铁与硫酸铜溶液反应:Fe + CuSO₄= FeSO₄+ Cu (化学方程式) Fe + Cu²⁺= Fe²⁺+ Cu (离子方程式)二、非金属及其化合物1、硅及其化合物(1)硅与氧气反应:Si + O₂高温 SiO₂(化学方程式)无离子方程式(2)硅与氢氧化钠溶液反应:Si + 2NaOH + H₂O = Na₂SiO₃+ 2H₂↑ (化学方程式) Si + 2OH⁻+ H₂O = SiO₃²⁻+ 2H₂↑ (离子方程式)2、氯及其化合物(1)氯气与氢气反应:H₂+ Cl₂点燃 2HCl (化学方程式)无离子方程式(2)氯气与水反应:Cl₂+ H₂O ⇌ HCl + HClO (化学方程式)Cl₂+ H₂O ⇌ H⁺+ Cl⁻+ HClO (离子方程式)(3)氯气与氢氧化钠溶液反应:Cl₂+ 2NaOH = NaCl + NaClO+ H₂O (化学方程式) Cl₂+ 2OH⁻= Cl⁻+ ClO⁻+ H₂O (离子方程式)3、硫及其化合物(1)硫与氧气反应:S + O₂点燃 SO₂(化学方程式)无离子方程式(2)二氧化硫与水反应:SO₂+ H₂O ⇌ H₂SO₃(化学方程式)无离子方程式(3)二氧化硫与氧气反应:2SO₂+ O₂催化剂加热 2SO₃(化学方程式)无离子方程式4、氮及其化合物(1)氮气与氧气反应:N₂+ O₂放电 2NO (化学方程式)无离子方程式(2)一氧化氮与氧气反应:2NO + O₂= 2NO₂(化学方程式)无离子方程式(3)二氧化氮与水反应:3NO₂+ H₂O = 2HNO₃+ NO (化学方程式) 3NO₂+ H₂O = 2H⁺+ 2NO₃⁻+ NO (离子方程式)在学习和记忆这些方程式时,我们可以通过理解反应的原理、抓住反应的特点以及多做练习来加深印象。
高中必修1金属和非金属化学方程式总结

金属及其化合物 一、钠和钠的化合物1、钠与水反应: 2Na+2H 2O =2NaOH+H 2↑2Na+2H 2O = 2Na ++2OH -+H 2↑ 2、钠与氧气反应:①常温反应 4Na+O 2 =2Na 2O②点燃或加热2Na+O 2Na 2O 23、钠与盐酸等酸反应: 2Na+2HCl = 2NaCl +H 2↑2Na+2H + = 2Na ++H 2↑4 、钠与氯气的反应:2 25、钠与硫的反应: 22S6、钠与碱溶液的反应实际上是与钠跟水的反应7、钠与盐溶液的反应 ①NaCl 溶液:实际上与水反应,反应的化学方程式:2Na+2H 2O = 2NaOH+H 2↑②CuSO4溶液:2Na+CuSO 4 +2H 2O = Cu(OH)2↓+H 2↑ + Na 2SO 4③NaHSO 4溶液:2Na + 2NaHSO 4 =2Na 2SO 4 + H 2↑④通常钠不能从盐溶液中置换出金属:若盐为熔融状态,钠可以置换出较不活泼的金属,如:4Na8、金属钠露置在空气中的变化过程4Na+O 2=2Na 2ONa 2O+H 2O = 2NaOH 2NaOH+CO 2=Na 2CO 3+H 2O9、氧化钠和水的反应:Na 2O+H 2O =2NaOH10、氧化钠和盐酸的反应:Na 2O+2HCl =2NaCl+H 2O 11、氧化钠和二氧化碳的反应:Na 2O+CO 2 =Na 2CO 3 12、过氧化钠和水的反应:2Na 2O 2+2H 2O =4NaOH+O 2↑ 13、过氧化钠和二氧化碳的反应:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 14、过氧化钠和盐酸的反应:2Na 2O 2+4HCl =4NaCl+2H 2O+O 2↑15、氧化钠和过氧化钠转化:2Na 222O 216、碳酸钠和盐酸反应:①Na 2CO 3+HCl =NaHCO 3+NaCl ②Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑ 17、碳酸钠和氢氧化钙反应:Na 2CO 3+Ca (OH )2=CaCO 3↓+2NaOH18、碳酸钠和可溶性盐反应:Na 2CO 3+CaCl 2=CaCO 3↓+2NaClNa2CO3+BaCl2=BaCO3↓+2NaCl19、碳酸氢钠和盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑20、碳酸氢钠和氢氧化钠、氢氧化钙反应:NaOH=Na2CO3+H2O2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O21、碳酸氢钠和盐反应:NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑22、碳酸氢钠受热分解:32CO3+H2O+CO2↑23、碳酸氢钠和碳酸钠转化:Na2CO3+H2O+CO2=2NaHCO332CO3+H2O+CO2↑NaHCO3+NaOH=Na2CO3+H2O 24、碳酸氢钠制法:NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl二、铝和铝的化合物1、铝与氧气反应:22O32、铝与盐酸等酸的反应:2Al+6HCl=2AlCl3+3H23、铝与氢氧化钠溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑4、氧化铝和盐酸反应:Al2O3+6HCl=2AlCl3+3H2O5、氧化铝和氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O6、氢氧化铝制备:Al3++3NH3•H2O=Al(OH)3↓+3NH4+7、氢氧化铝和酸的反应:Al(OH)3+3HCl=AlCl3+3H2O8、氢氧化铝和氢氧化钠的反应:Al(OH)3+NaOH=NaAlO2+2H2O氢氧化铝不稳定性:2Al(OH32O3+3H2O三、铁和铁的化合物1、铁与氧气反应:23O42、铁与水蒸气反应:3Fe+4H2O(g)3O4+4H2↑3、铁与盐酸等酸反应:Fe+2HCl=FeCl2+H2↑4、铁的氧化物分别与酸反应:FeO+2H+=Fe2++H2OFe2O3+6H+=2Fe3++3H2OFe3O4+8H+=Fe2++2Fe3++4H2O5、铁的氧化物与还原剂反应:Fe x O y+yCO Fe+yCO26、铁的氢氧化物与盐酸等酸反应:Fe(OH)2+2HCl=FeCl2+2H2OFe(OH)3+3HCl=FeCl3+3H2O 7、铁的氢氧化物制备:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4FeCl 3+3NaOH =Fe (OH )3↓+3NaCl8、转化:4Fe (OH )2+O 2+2H 2O =4Fe (OH )39、受热分解:2Fe (OH )3Fe 2O 3+3H 2O10、Fe3+的检验:Fe 3++3SCN -=Fe(SCN)3(血红色) 11、氧化性:2Fe 3++Fe =3Fe 2+ 2Fe 3++Cu =2Fe 2++Cu 2+ 12、还原性:2Fe 2++Cl2=2Fe 3++2Cl - 四、硅及其化合物1、硅与氧气、氟、氯气、碳反应:2=SiO 2 Si+2F 2=SiF 42 42、硅与氢氟酸、氢氧化钠反应:Si+4HF =SiF 4↑+2H 2↑Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑3、二氧化硅与氢氟酸反应:SiO 2+4HF =SiF 4↑+2H 2O4、二氧化硅与碱性氧化物反应:SiO 2+CaO CaSiO 35、二氧化硅与碱反应:SiO 2+2=Na 2SiO 3+H 2O6、二氧化硅与碳反应:SiO 2↑7、碳酸钙反应:SiO 2+Na 232SiO 3+CO 2↑SiO 2+CaCO3CaSiO 3+CO2↑8、硅酸和氢氧化钠反应:H 2SiO 3+2NaOH =Na 2SiO 3+2H 2O9、硅酸受热分解:H 2SiO 32+H 2O10、硅酸钠与酸反应:Na 2SiO 3+2HCl =2NaCl+H 2SiO 3(胶体) Na 2SiO 3+H 2O+CO 2=H 2SiO 3(胶体)+Na 2CO 3 Na 2SiO 3+2H 2O+2CO 2=H 2SiO 3(胶体)+2NaHCO 3 五、氯1、氯气与金属反应:Cl 22+Cu CuCl 23Cl 2 32、氯气与非金属反应:Cl 223、氯气、氟与水的反应:Cl 2+H 2O =HCl+HClO2↑ 2F 2+2H 2O =4H F +O 24、氯气与碱反应:Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 5、漂白液、漂白粉、漂白精长期露置空气中会发生反应:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO2NaClO+H2O+CO2=Na2CO3+2HClO2↑6、氯离子检验:先在被检验液中加稀硝酸酸化,再加硝酸银溶液,如产生白色沉淀可判断原溶液中含氯离子Ag++Cl-=AgCl↓7、卤素单质间置换:Cl2+2Br-=2Cl-+Br2Cl2+2I-=2Cl-+I2Br2+2I-=2Br-+I2六、硫和氮1、二氧化硫和水反应:SO2+H2O=H2SO32、二氧化硫和氧化钙反应:SO2+CaO=CaSO33、二氧化硫和氢氧化钠反应:SO2(少)+2NaOH=Na2SO3+H2OSO2(过)+NaOH=NaHSO34、二氧化硫和盐反应SO2(少)+2NaHCO3=Na2SO3+H2O+2CO2SO2(过)+NaHCO3=NaHSO3+CO25、二氧化硫和硫化氢反应:SO2+2H2S=3S↓+2H2O6、二氧化硫和卤素单质水溶液反应:SO 2+X 2+2H 2O=H 2SO 4+2HX(X=Cl 、Br 、I,F 除外)7、二氧化硫能被氧气氧化:2SO 238、三氧化硫与水、碱、碱性氧化物反应:SO 3+H 2O=H 2SO 4 SO 3+CaO=CaSO 4 SO 3+NaOH=Na 2SO 49 、氮气和氧气反应:N 2+O 2=2NO10、一氧化氮与氧气反应:2NO+O 2=2NO 211、二氧化氮与水反应:3NO 2+H 2O=3HNO 3+NO12、氮的氧化物溶于水的有关计算:3NO 2+H 2O=3HNO 3+NO 2NO+O 2=2NO 24NO 2+O 2+2H 2O=4HNO 3 4NO+3O 2+2H 2O=4HNO 3 七、氨硝酸硫酸1、氨:N2+3H2=2NH3(反应条件是高温高压和催化剂)2、氨与水的反应 NH3+H 2O =NH3•H 2O (可逆)3、氨水不稳定:NH3•H 2↑+H 2O4、氨与HCl 等酸的反应NH 3+HCl =NH 4Cl 2NH 3+H 2SO 4=(NH 4)2SO 4NH3+HNO3=NH4NO3NH3+H2O+CO2=NH4HCO3 5铵盐受热分解:NH43↑+HCl↑NH433↑+H2O↑+CO2↑6氨的催化氧化:4NH3+5O24NO+6H2O(条件是催化剂和加热)7氨的制法:2NH4Cl+Ca(OH2l2+2NH3↑+2H2O。
高一人教版化学元素化合物方程式总结

必修1化学方程式1、常温下钠与氧气反应:4Na + O2 = 2Na2O (白色)2、钠在空气中燃烧:2Na + O2△Na2O2(淡黄色)3、钠在氯气中燃烧:2Na + Cl2△2NaCl (白烟)4、钠与硫共热:2Na +S △2S5、钠与水反应:2Na + 2H2O = 2NaOH + H2↑6、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑7、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O28、铁在氧气中燃烧:3Fe+2O2点燃Fe3O49、铁与水蒸气反应:3Fe + 4H2O(g) △Fe3O4 + 4H210、2NaHCO3△Na2CO3 + CO2↑+ H2O11、Al与盐酸反应:2Al+6HCl===2AlCl3+3H2↑12、Al2O3与盐酸反应:Al2O3 + 6HCl===2AlCl3 + 3H2O13、Al(OH)3与盐酸反应:Al(OH)3 +3HCl=== AlCl3 + 3H2O14、Al与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O===2NaAlO2 + 3H2↑2Al + 2 OH- + 2H2O===2AlO2- + 3H2↑15、Al2O3与氢氧化钠溶液反应:Al2O3 + 2NaOH === 2NaAlO2 + H2OAl2O3 + 2OH-=== 2 AlO2- + H2O16、Al(OH)3与氢氧化钠溶液反应:Al(OH)3 + NaOH === NaAlO2 + 2H2O17、氧化亚铁与盐酸反应:FeO+2HCl=FeCl2 +H2O18、氧化铁与盐酸反应:Fe2O3 + 6HCl= 2FeCl3 + 3H2O19、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓(红褐色)20、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓(白色)生成的白色沉淀迅速变成灰绿色最终变成红褐色4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)321、实验室制取氢氧化铝(铝盐溶液加氨水):Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4Al3+ + 3NH3•H2O = Al(OH)3↓ + 3NH4+22、氢氧化铝加热分解:2Al(OH)3△Al2O3 + 3H2O23、氢氧化铁加热分解:2Fe(OH)3△3H2O + Fe2O3(红棕色粉末,俗称铁红)24、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3白色沉淀迅速变成灰绿色,最终变成红褐色25、FeCl3溶液与铁粉反应:2FeCl3 + Fe = 3FeCl22Fe3+ + Fe = 3Fe2+26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-27、FeCl3溶液与铜反应:2FeCl3 + Cu = 2FeCl2+CuCl22Fe3+ + Cu = 2Fe2++Cu2+28、除去碳酸氢钠溶液中的碳酸钠,方法:通过量CO2Na2CO3 +CO2 + H2O = 2NaHCO3 CO32- + CO2 + H2O = 2HCO3-29、锂在空气中燃烧:4Li + O2△2Li2O30、金属钾与水的反应:2K + 2H2O = 2KOH + H2↑31、氟气与氢气在暗处就能剧烈化合:F2 + H2 = 2HF32、氟气与水的反应:2F2 + 2H2O = 4HF +O2↑33、卤素单质间的置换反应:氯水与饱和溴化钠溶液:Cl2 + 2NaBr = Br2 + 2NaCl氯水与饱和碘化钾溶液:Cl2 + 2KI = I2 + 2KCl溴水与饱和碘化钾溶液:Br2 + 2KI = I2 + 2KBr34、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2H2O催化剂加热 35、二氧化硅与氧化钙高温反应:SiO 2 + CaO 高温CaSiO 336、二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O37、硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓38、氯气的实验室制法:MnO 2+4HCl (浓) △ MnCl 2+Cl 2↑+ 2H 2O 39、氯气与金属反应:2Fe + 3Cl 2点燃 2FeCl 3 (棕色烟) Cu + Cl 2 点燃CuCl 2 (棕黄色的烟) 2Na + Cl 2点燃 2NaCl (白烟) 40、氯气与氢气反应:H 2+Cl 2 △2HCl (苍白色火焰,有白雾生成)41、氯气与水反应:Cl 2 + H 2O = HCl + HClO次氯酸光照分解:2HClO HCl + O 2↑42、氯气与氢氧化钠溶液反应:Cl 2 + 2NaOH = NaCl + NaClO + H 2O43、氯气与消石灰反应制漂白粉:2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O44、漂白粉长期置露在空气中:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO45、硫的燃烧 S +O 2 点燃 SO 246、二氧化硫与水反应:SO 2 + H 2O H 2SO 347、二氧化硫与氧气反应:2SO 2+O 22SO 3 48、SO 3与氧化钙反应:SO 3+CaO =CaSO 449、三氧化硫与水反应:SO 3 + H 2O = H 2SO 450、二氧化硫与Ca (OH )2溶液反应:SO 2 + Ca (OH )2 = CaSO 3 +H 2O51、氮气与氧气在放电下反应:N 2 + O 2 2NO52、一氧化氮与氧气反应:2NO + O 2 = 2NO 253、二氧化氮与水反应:3NO 2 + H 2O = 2HNO 3 + NO54、合成氨反应:N 2+3H 2 催化剂 高温高压2NH 3 氨水受热分解:NH 3•H 2O △ NH 3↑ + H 2O光照 放电55、氨水显碱性的原因: NH3 + H2O NH3•H2O NH4+ + OH—56、氨气与氯化氢反应:NH3 + HCl = NH4Cl氯化铵受热分解:NH4Cl △NH3↑ + HCl↑57、碳酸氢氨受热分解:NH4HCO3△NH3↑ + H2O↑ + CO2↑58、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2O59、氨的催化氧化:4NH3+5O2催化剂△4NO+6H2O60、氨气的实验室制取法:2NH4Cl + Ca(OH)2△CaCl2 + 2H2O + 2NH3↑61、浓硫酸与铜反应:Cu + 2H2SO4(浓) △4+ 2H2O + SO2↑62、浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2↑+ 2SO2↑ + 2H2O63、浓硝酸与铜反应:Cu + 4HNO3(浓) ===Cu(NO3)2 + 2H2O + 2NO2↑64、稀硝酸与铜反应:3Cu + 8HNO3(稀)=== 3Cu(NO3)2 + 4H2O + 2NO↑选考1、向碳酸钠溶液中逐滴滴加稀盐酸,现象:开始无现象,然后有气泡生成,溶液中碳酸根离子的物质的量的变化趋势:先增大再减小,发生反应的离子方程式:CO32- + H+ = HCO3- HCO3- + H+ = CO2↑+ H2O2、向AlCl3溶液中逐滴加入NaOH溶液至过量,现象是:有白色沉淀生成,白色沉淀先逐渐增多,后逐渐减少直至消失;有关离子方程式:Al3+ + 3OH-=== Al(OH)3↓Al(OH)3 + OH-=== AlO2- + 2H2O3、向NaAlO2溶液中逐滴滴加稀盐酸至过量,现象是:有白色沉淀生成,白色沉淀先逐渐增多,后逐渐减少直至消失;有关离子方程式:AlO2- + 2H2O + H+ === Al(OH)3↓Al(OH)3 + 3H+=== Al3+ + 3H2O 4、向明矾溶液中加入氨水,现象是:有白色沉淀生成,有关离子方程式是:Al3+ + 3NH3•H2O = Al(OH)3↓ + 3NH4+5、向含1mol明矾的溶液中加入含2mol Ba(OH)2的溶液,化学方程式是:KAl(SO4)2 + 2Ba(OH)2 = KAlO2 + 2BaSO4↓+ 2H2O。
高中化学必修1金属和非金属及其化合物化学方程式汇总

高中化学必修1金属和非金属及其化合物化学方程式汇总9、“铝三角”(氢氧化铝的反应在上面已经提到,略):AlCl3+3NaOH(少量)=Al(OH)3↓+3NaClAl3++3OH-=Al(OH)3↓+AlCl3+4NaOH(过量)=2NaAlO2 + 2H2O +3NaClAl3++4OH- = AlO2- +2H2ONaAlO2+HCl(少量)+H2O=Al(OH)3↓+NaClAlO2- +H+ +H2O=Al(OH)3↓NaAlO2+4HCl(过量)=AlCl3+3NaCl+2H2OAlO2- +4H+ =Al 3+ + 2H2O10、明矾净水原理明矾溶于水后发生电离:KAl(SO4)2==K++Al3++2SO42-铝离子与水反应生成:Al(OH)3胶体:Al3++3H2O==Al(OH)3(胶体)+3H+三、铁及其重要化合物1、工业炼铁原理:Fe2O3+3CO 高温 2Fe+3CO22、铁与非金属反应:2Fe+3Cl2点燃 2FeCl33Fe+2O2点燃 Fe3O43、与水反应:3Fe+4H2O(g) 高温 Fe3O4+4H24、铁与酸反应:Fe+2HCl== FeCl2+H2↑Fe+2H+== Fe2++H2↑5、铁与盐溶液反应:Fe+CuSO4==Cu+FeSO4 Fe+Cu2+==Cu+Fe2+Fe+2FeCl3 == 3FeCl2Fe+2Fe3+ == 3Fe2+6、铁的氧化物Fe2O3 + 6H+ == 2Fe3+ + 3H2OFeO + 2H+ == Fe2+ + H2O7、Fe2+与Fe3+的检验①、Fe2+的检验:(1) 颜色:浅绿色 (2)加NaOH溶液:先产生白色沉淀,后变成灰绿色,最后成红褐色Fe2++2OH-== Fe(OH)2↓ (白色)4Fe(OH)2+O2+2H2O== 4Fe(OH)3(红褐色)(3) 先加KSCN溶液,不变色,再加新制氯水,溶液变成血红色2Fe2++Cl2==2Fe3++2Cl-②、Fe3+的检验(1)颜色:棕黄色(2)加KSCN溶液:溶液变成血红色(3)加NaOH溶液:红褐色沉淀 Fe3++3OH-== Fe(OH)3↓8、氢氧化铁受热分解:2Fe(OH)3△ Fe2O3 + 3H2O9、 Fe2+与Fe3+的转化(1)Fe2+→Fe3+2Fe2++Cl2==2 Fe3++2Cl-(2) Fe3+→Fe2+Fe+2Fe3+ == 3Fe2+四、硅及其重要化合物1、二氧化硅① 酸性氧化物:SiO2+2NaOH==Na2SiO3+H2OSiO2+CaO高温 CaSiO3② 弱氧化性:SiO2 +4HF==SiF4↑+2H2O2、硅酸盐Na2SiO3+2HCl==H2SiO3↓+2NaClNa2SiO3+ CO2+H2O==H2SiO3 ↓+Na2CO3(酸性:H2CO3 > H2SiO3)五、氯的重要化合物1、氯气与金属的反应2Fe+3Cl2点燃 2FeCl3Cu+Cl2点燃 CuCl22Na+Cl2点燃 2NaCl2、氯气与非金属的反应H2+Cl2 点燃 2HCl 2P+3Cl2点燃 2PCl3 2P+5Cl2点燃 2PCl5 3、氯气与水的反应Cl2+H2O == HCl + HClO(次氯酸)4、次氯酸光照分解:2HClO 光照 2HCl + O2↑5、Cl2与碱溶液的反应Cl2+2NaOH=NaCl+NaO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(制漂白粉)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO(漂白原理)(酸性:H2CO3 > HClO)六、硫及其重要化合物1、硫的可燃性S+O2点燃 SO22、2SO2 + O2 2SO33、与水反应:SO2+H2O H2SO3SO3+H2O == H2SO44、与碱反应:SO2 + Ca(OH)2= CaSO3 + H2OSO3 + Ca(OH)2= CaSO4 + H2O5、与碱性氧化物反应:SO2+CaO == CaSO3SO3+CaO == CaSO46、浓硫酸强氧化性C + 2H2SO4(浓) △ CO2↑+ 2SO2↑+ 2H2OCu+2H2SO4(浓)△ CuSO4+SO2↑十2H2O七、氮及其重要化合物1、合成氨: N2 + 3H22NH32、NH3①氨气与水:NH3 + H2O NH3·H2O NH4+ + OH -②氨气与酸:NH3+HCl=NH4ClNH3+HNO3=NH4NO33、铵盐与碱反应:NH4NO3+NaOH △ NaNO3+NH3↑+H2O2NH4Cl + Ca(OH)2△ CaCl2 + 2NH3↑+ 2H2O(实验室制氨气)4、铵盐不稳定性:NH4Cl △ NH3↑+HCl ↑ NH4HCO3△ NH3+H2O+CO2↑5、HNO3强氧化性:4HNO3(浓)+Cu==Cu(NO3)3+3NO2↑+2H2O8HNO3+3Cu==3Cu(NO3)3+2NO↑+4H2O6、雷雨发庄稼N2 + O2放电 2NO2NO + O2 == 2NO23NO2 + H2O == 2HNO3 + NO其它知识1、固体颜色:淡黄色固体: Na2O2 , S2、颜色反应:Na元素:黄色;K元素:紫色(透过蓝色钴玻璃)3、沉淀颜色:Mg(OH)2白色;Fe(OH)2 白色; Fe(OH)3 红褐色;Cu(OH)2蓝色4、离子溶液颜色:Fe2+浅绿色;Fe3+黄色;Cu2+蓝色5、气体颜色:NO2红棕色;Cl2黄绿色6、 Al 、Fe在冷的浓H2SO4、浓HNO3中发生钝化。
高中化学金属及化合物方程式

高中化学方程式金属及其化合物重要方程式一、金属钠及其化合物的方程式1、铁与水蒸气反应:3Fe+4H2O(g)△Fe3O4+4H22、铝在氧气中受热:4Al+3O2△2Al2O33、钠在氯气中燃烧: 2Na+Cl2点燃2NaCl4、钠和水反应:2Na+2H2O=2NaOH+H2↑离子方程式:2Na+2H2O=2Na+2OH-+H2↑5、钠和盐酸反应:2Na+2HCl=2NaCl+H2↑离子方程式:2Na+2H+=2Na++H2↑6、钠投入到硫酸铜溶液:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑离子方程式:2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑7、氧化钠和水反应: Na2O+H2O=2NaOH8、过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑9、氧化钠和CO2反应:Na2O+CO2=Na2CO310、过氧化钠和CO2反应: 2Na2O2+2CO2=2Na2CO3+O211、氧化钠和盐酸反应:Na2O+2HCl=2NaCl+H2O12、Na2O2和盐酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑13、沉淀法鉴别碳酸钠和碳酸氢钠原理: CaCl2+Na2CO3=CaCO3↓+2NaCl离子方程式:Ca2++CO32-=CaCO3↓14、加热法鉴别固体Na2CO3、NaHCO3原理:2NaHCO3△Na2CO3+H2O+CO2↑15、碳酸钠溶液和足量盐酸反应:Na2CO3+2HCl=NaCl+H2O+CO2↑离子方程式:CO32-+2H+=H2O+CO2↑16、碳酸氢钠和盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑离子方程式:HCO3-+H+=H2O+CO2↑17、碳酸钠溶液和氢氧化钙溶液反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH离子方程式:Ca2++CO32-=CaCO3↓18、碳酸氢钠溶液和足量氢氧化钙溶液反应:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O 19、碳酸氢钠溶液和少量氢氧化钙溶液反应:Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3 +2H2O离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O二、金属铝及其化合物的方程式1、铝和盐酸反应:2Al+6HCl=2AlCl3+3H2↑离子方程式:2Al+6H+=2Al3++3H2↑2、铝和NaOH溶液反应: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑3、氧化铝和盐酸反应:Al2O3+6HCl=2AlCl3+3H2O4、氧化铝和氢氧化钠反应:Al2O3+2NaOH=2NaAlO2+H2O5、氢氧化铝和盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O6、氢氧化铝和氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O7、氢氧化铝的制备:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+8、明矾净水原理: Al3++3H2O Al(OH)3(胶体)+3H+9、向氯化铝溶液中滴加氢氧化钠溶液至过量:Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2O10、向氢氧化钠溶液中滴加氯化铝溶液至过量:Al3++4OH-=AlO2-+2H2O3AlO2-+Al3++6H2O=4Al(OH)3↓11、向偏铝酸钠溶液中滴加盐酸至过量: AlO2-+H++H2O=Al(OH)3↓Al(OH)3+3H+=Al3++3H2O12、向盐酸中滴加偏铝酸钠溶液至过量:AlO2-+4H+=Al3++2H2O三、金属铁及其化合物的相互转化1、铁和水蒸气高温下反应:3 Fe+4H2O(g)高温Fe3O4+4H2铁在纯氧燃烧:3Fe + 2O2点燃Fe3O4铁在氯气中燃烧:2Fe+3Cl2 = 2FeCl3 铁和硫粉共热:Fe+S △FeS 2、铁和盐酸反应: Fe+2HCl= FeCl2+H2↑离子方程式: Fe+2H+= Fe2++H2↑铁和氯化铜反应:Fe+CuCl2= FeCl2+Cu 离子方程式: Fe+Cu2+= Fe2++Cu 3、氧化亚铁和盐酸反应:FeO+2HCl= FeCl2+H2O离子方程式:FeO+2H+= Fe2++H2O4、氧化铁和盐酸反应:Fe2O3+6HCl=2 FeCl3+3H2O离子方程式:Fe2O3+6H+= 2Fe2++3H2O5、氯化亚铁和氢氧化钠反应:FeCl2+2NaOH = Fe(OH)2↓+2NaCl离子方程式:Fe2++2OH-= Fe(OH) 2↓6、氢氧化亚铁和盐酸反应:Fe(OH)2 + 2HCl= FeCl2+2H2O离子方程式:Fe(OH)2+2H+= Fe2++2H2O7、氯化铁和氢氧化钠反应:FeCl3+3NaOH = Fe(OH)3↓+3NaCl离子方程式:Fe3++3OH-= Fe(OH) 3↓8、氢氧化铁和盐酸反应:Fe(OH) 3+3HCl= FeCl3+3H2O离子方程式:Fe(OH) 3+3H+=Fe3++3H2O)9、氯化亚铁和氯气反应:2FeCl2+Cl2=2FeCl3离子方程式:2Fe2++Cl2=2 Fe3++2Cl—10、铁和氯化铁反应:Fe+2FeCl3 = 3FeCl2离子方程式:Fe +2 Fe3+=3 Fe2+铜和氯化铁反应:Cu+2FeCl3=2FeCl2+CuCl2离子方程式:Cu+2 Fe3+=2 Fe2++Cu2+11、氢氧化铁受热分解:2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色(氢氧化亚铁转化为氢氧化铁)4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3铜及其化合物2Cu +O2==2CuO (红色变为黑色) 2Cu +S==Cu2SCu+ Cl2==CuCl2 (棕黄色烟) 2H2SO4(浓)+Cu==CuSO4+2H2O +SO2↑3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O2FeCl3+Cu===2FeCl2+CuCl2 (腐蚀铜线路板) 2AgNO3+Cu===2Ag+Cu(NO3)2CuO+2HCl=CuCl2+H2O CuO+H2==Cu+H2O(Cu的冶炼)CuO+CO==Cu+ CO2 3CuO+2NH3 3Cu + N2 + 3H2O Cu(OH)2+2HCl=CuCl2+2H2O Cu(OH)2 ==CuO + H2OCuCl2+H2S=CuS↓+2HCl CuCl2+2NaOH=Cu(OH)2↓+2NaClCuSO4+H2S=CuS↓+H2SO4 CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓CuSO4•5H2O===CuSO4+5H2O↑ CuSO4 + 5H2O=CuSO4•5H2O2Cu + O2 + H2O +CO2=Cu2(OH)2CO3 (铜绿的形成)Cu2(OH)2CO3 + 4HCl=2CuCl2 + 3H2O + CO2↑Cu 紫红色Cu2O 红色CuO 黑色CuSO4蓝色CuSO4•5H2O白色Cu2(OH)2CO3绿色Cu(OH)2蓝色。
必修一化学方程式总结

必修一化学方程式汇总一、钠及其化合物钠单质1、常温下,钠在空气中被缓慢氧化:4Na + O2 == 2Na2O(白色固体)2、加热或点燃下,钠与氧气反应:2Na + O2Na2O2(淡黄色固体)3、钠投入水中(现象:浮、熔、游、响、红):2Na + 2H2O == 2NaOH + H2↑4、钠投入盐酸或硫酸氢钠溶液:2Na + 2HCl == 2NaCl + H2↑2Na + H2SO4 == Na2SO4 + H2↑离子反应均为:2Na + 2H+ == 2Na+ + H2↑5、钠投入硫酸铜溶液(钠无法从溶液中置换其它金属单质)钠与水先反应: 2Na + 2H2O == 2NaOH + H2↑生成的氢氧化钠再与盐反应: 2NaOH+ CuSO4 == Cu(OH)2↓ + Na2SO4总反应:2Na + 2H2O + CuSO4 == Cu(OH)2↓ + Na2SO4 + H2↑氧化钠和过氧化钠1、氧化钠和水反应:Na2O + H2O == 2NaOH2、氧化钠和二氧化碳反应:Na2O + CO2 == Na2CO33、氧化钠和盐酸反应:Na2O + 2HCl == 2NaCl + H2O4、过氧化钠和水反应: 2Na2O2 + 2H2O == 4NaOH + O2↑5、过氧化钠和二氧化碳反应: 2Na2O2 + 2CO2 == 2Na2CO3 + O26、过氧化钠和盐酸反应:2Na2O2 + 4HCl == 4NaCl + 2H2O + O2↑7、氧化钠受热可与氧气反应生成过氧化钠:2Na2O + O22Na2O2氢氧化钠氢氧化钠俗称烧碱、苛性钠、火碱。
易溶于水,水溶液显强碱性1、氢氧化钠与酸反应:NaOH + HCl == NaCl + H2ONaOH + CH3COOH == CH3COONa + H2O2、氢氧化钠与酸性氧化物反应:NaOH溶液中通入少量CO2:2NaOH + CO2 = Na2CO3 + H2ONaOH溶液中通入过量CO2:NaOH + CO2 = NaHCO3碳酸钠和碳酸氢钠1、碳酸钠俗称纯碱、苏打。
金属及其化合物化学方程式汇总

.必修一金属及其化合物化学方程式一、金属钠及其化合物1、钠在空气中(1)钠块在空气中变暗:2Na +O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体)现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体(3)2Na2O+O2=2Na2O22、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2NaOH +H2↑2Na +2H2O =2Na++2OH-+H2↑3、钠与盐溶液反应(先水后盐)(1)与氯化钠溶液:本质上就是与水反应(2)与硫酸铜溶液:2Na +2H2O =2NaOH +H2↑2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4总:2Na +2H2O + CuSO4=Cu(OH)2↓+ Na2SO4+H2↑2Na +2H2O+ Cu2+ =Cu(OH)2↓+H2↑+ 2Na+(3)与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2 ↑2Na2O2+2H2O =4Na++4OH -+O2↑现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色)碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O +H2O =2Na++2OH -5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O2碱性氧化物Na2O与二氧化碳的反应Na2O+CO2===Na2CO36、过氧化钠与盐酸的反应2Na2O2+4HCl =4NaCl +2H2O+O2 ↑2Na2O2+4H+=4Na++2H2O+O2↑碱性氧化物Na2O与盐酸的反应Na2O +2HCl =2NaCl +H2O Na2O +2H+=2Na++H2O7、氢氧化钠(1)与酸性氧化物反应a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2OOH -+CO2 (少量)= CO32-+H2Ob 继续向该溶液中通入CO2:Na2CO3+H2O +CO2=2NaHCO3CO32-+H2O +CO2=2HCO3-c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3a+bOH -+CO2 (过量)= HCO3-d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2OCa2++ 2OH -+CO2 (少量)= CaCO3↓+H2Oe继续向该溶液中通入CO2:CaCO3+H2O +CO2=Ca(HCO3)2CaCO3+H2O +CO2=Ca2++ 2HCO3-f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+eOH -+CO2 (过量)= HCO3-CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠)①向盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑CO32-+2H+=H2O +CO2↑现象:立即有气泡产生②纯碱溶液中滴加盐酸,至过量△△.Na2CO3+HCl =NaHCO3+NaCl CO32-+H+ =HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑现象:先无明显现象,然后有气泡产生9、碳酸氢钠和盐酸反应(无论是向碳酸氢钠中滴加稀盐酸还是向盐酸中滴加碳酸氢钠,现象均为:立即有气泡产生)NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑10、碳酸钠与Ca(OH)2反应:Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓CO32-+Ca2+ = CaCO3↓11、碳酸氢钠与碱反应(1)与NaOH反应:NaHCO3 + NaOH== Na2CO3 + H2OHCO3-+OH -=H2O +CO32-(2)与Ca(OH)2反应Ca(OH)2 + NaHCO3(少)==CaCO3↓+ H2O+ NaOHCa2+ +OH -+HCO3-(少)==CaCO3↓+ H2OCa(OH)2 + 2NaHCO3(多)== CaCO3↓ + 2H2O+Na2CO3Ca2+ +2OH -+2HCO3-(多)== CaCO3↓ + 2H2O+CO32-12、碳酸钠与某些盐反应Na2CO3+CaCl 2== CaCO3↓+2NaCl CO32-+Ca2+ = CaCO3↓NaHCO3+CaCl 2== 不反应(可用于鉴别碳酸钠和碳酸氢钠)13、小苏打受热分解2NaHCO3=Na2CO3+H2O +CO2↑14、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)二、铝及其化合物1、与非金属4Al + 3O2 = 2Al2O32Al+3Cl2 == 2AlCl32Al + 3S == Al2S32、铝片与稀盐酸反应2Al +6HCl =2AlCl3 +3H2↑2Al +6H+=2Al3++3H2↑3 、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH-+2H2O =2AlO2-+3H2↑4、与盐溶液反应:置换出较不活泼的金属单质2Al+3CuSO4 ==Al2(SO4 )3+3Cu 2Al+3Cu2+ = 2Al3++3Cu5、与水不反应:6、Al2O3(两性氧化物)(1)与强酸反应Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+ = 2Al3++3H2O(2)与强碱反应Al2O3+2NaOH = 2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O7. Al(OH)3(两性氢氧化物)(1)Al(OH)3的制备:可溶性铝盐和氨水Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+(2)与强酸反应Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O (3)与强碱反应Al(OH)3+NaOH =NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O (4)加热分解2Al(OH)3△Al2O3 + 3H2O8、Al3+(1)少量强碱:AlCl3+3NaOH===Al(OH)3↓+3N aCl Al3++3OH-=Al(OH)3↓(2)过量强碱:AlCl3+4NaOH===NaAlO2 +3NaCl+2 H2OAl3++4OH-=AlO2-+2 H2O9、AlO2-(1)少量HCl:NaAlO2 +HCl+H2O=NaCl+Al(OH)3↓AlO2-+H++H2O=Al(OH)3↓(2)继续向该溶液中加入盐酸:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O△点燃△.(3)过量HCl:NaAlO2+4HCl=NaCl+AlCl3+2H2O AlO2-+4H+=Al3++2 H2O(4)通入少量CO2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(5)通入过量CO2CO2+NaAlO2+2H2O=Al(OH)3↓+Na HCO3 (工业制取氢氧化铝)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-10、KA1(SO4)2 (净水剂)(1)使硫酸根恰好沉淀完全: KA1(SO4)2+2Ba(OH)2==2BaSO4↓+KAlO2Al3++4OH-+2Ba2++2SO42-==2BaSO4↓+AlO2-(2)使铝离子恰好沉淀完全: 2KA1(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO42Al3++ 3 SO42- + 6OH—+ 3Ba2+==3Ba SO4↓+ 2Al(OH)3↓(3)净水原理:Al3++3H2O=== Al(OH)3(胶体)+3 H+11、相互滴加顺序不同而现象不同的几组反应:(可用于鉴别)①:AlCl3+ NaOH ②:NaAlO2 + HCl ③:Na2CO3+ HCl (NaHSO4)三、铁及铁的化合物1、铁的冶炼: 3CO+ Fe2O3== 2Fe+ 3CO22、与非金属:(1)2Fe + 3Cl2 === 2FeCl3(2)3 Fe + 2O2=== Fe3O4(3)Fe + S === FeS3、与水蒸气:3 Fe + 4 H2O(g) ====Fe3O4+ 4 H24、与非氧化性酸:Fe + 2 HCl === FeCl2+ H2↑Fe + 2 H+ == Fe2++ H2↑5、与盐:Fe + CuSO4 == FeSO4+Cu Fe + Cu2+===Fe2+ + Cu6、与碱不反应:7、铁的氧化物FeO(黑色)、Fe2O3(红棕色,俗名铁红)、Fe3O4(磁性氧化铁,黑色晶体)(1)FeO + 2 HCl === FeCl2 + H2O(非氧化性酸,不变价;遇HNO3变价,下同)FeO + 2 H+ == Fe2+ + H2O(2)Fe2O3 + 6HCl ===2 FeCl3 + 3 H2OFe2O3 + 6 H+ ===2 Fe3+ + 3 H2O(3)Fe3O4+ 8 HCl ===2 FeCl3 + FeCl2 + 4 H2OFe3O4+ 8 H+ === 2 Fe3+ +Fe2+ + 4 H2O用途:作油漆的颜料,炼铁的原料8、铁的氢氧化物(Fe(OH)2,Fe(OH)3)(1)制备:A:FeSO4 + 2 NaOH = Fe(OH)2↓+ Na 2SO4Fe2+ + 2 OH—= Fe(OH)2↓B:3NH3 .H2O + FeCl3 ==== Fe(OH)3↓+ 3 NH4CIFe3+ + 3NH3 .H2O =Fe(OH)3↓+ 3 NH4+(2)氢氧化亚铁不稳定性:4 Fe(OH)2 + O2 + 2 H2O= 4 Fe(OH)3(3)氢氧化铁不稳定性:2Fe(OH)3 ==== Fe2O3 + 3H2O(4)与酸:Fe(OH)3+ 3HCl ====FeCl3+ 3 H2O Fe(OH)3+ 3 H+ === Fe3+ + 3 H2O Fe(OH)2+ 2 HCl ==== FeCI2+ 2 H2O(非氧化性酸,不变价;遇HNO3变价)Fe(OH)2 + 2 H+ == Fe2+ + 2H2O9、Fe2+盐(还原性离子,易被氧化,保存需加少量Fe粉及相应酸)(1)与氯气:2FeCl2 + Cl2 = 2 FeCl3 2Fe2+ + Cl2 === 2Fe3+ + 2 CI—(2)FeSO4溶液和H2O2:2Fe2+ + H2O2 + 2H+== 2Fe3+ + 2H2O(3)FeSO4溶液和酸性KMnO4溶液:5 Fe2+ + MnO4—+8 H+=== Mn 2++ 4H2O+ 5Fe3+(4)FeSO4溶液在空气中变质:4Fe2+ + O2 + 4 H+=== 4Fe3+ + 2H2O10、Fe3+盐(氧化性离子,易被还原. 易水解,保存需加少量相应酸抑制水解.)(1) 2 FeCl3 + Fe =3 FeCl22Fe3+ + Fe === 3 Fe2+(2)2 FeCl3+ Cu === 2FeCl2+ CuCl22Fe3+ + Cu ==2Fe2++ Cu2+(3)Fe3+的检验:FeCl3 + 3 KSCN == 3 KCI+ Fe(SCN)3Fe3+ + 3SCN— === Fe(SCN)3(4)用途:净水剂Fe3+ +3 H2O=== Fe(OH)3(胶体)+ 3 H+高温点燃点燃△高温△.。
高中化学必修1化学方程式总结
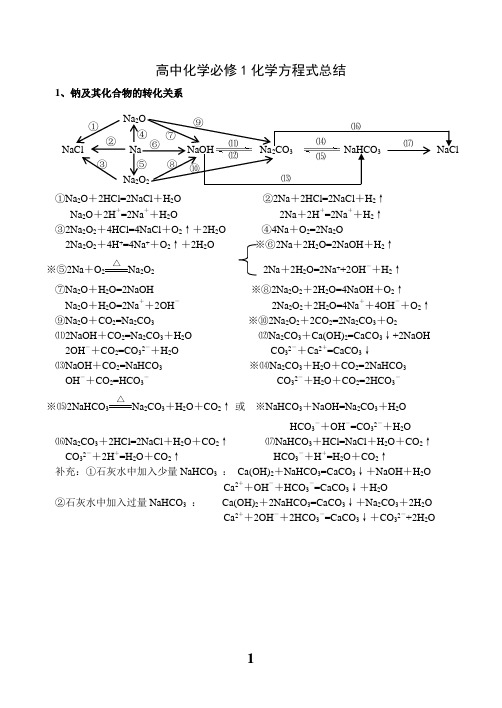
高中化学必修1化学方程式总结1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2ONaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④2、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2OAl Al 2O 3 A l (O H )3 KAl(SO 4)2NaAlO 2AlCl 3 ① ② ③ ④ ⑤ ⑥⑦⑧ ⑨⑩⑾⑿①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
必修一化学方程式归纳lw

必修一化学方程式归纳lw人教版《化学必修1》化学方程式归纳一、钠及其化合物1、钠与氧气:常温:4Na+O2=2Na2O点燃:2Na + O2Na2O22、钠与氯气:2Na+Cl22NaCl3、钠与水反应:2Na + 2H2O =2NaOH + H2↑离子方程式:2Na + 2H2O =2Na++2OH-+ H2↑4、钠与硫酸反应:2Na +H2SO4=Na2SO4+H2↑离子方程式:2Na + 2H+=2Na++H2↑5、钠与硫酸铜、氯化铁溶液反应的现象和方程式硫酸铜溶液:有气泡产生,蓝色沉淀生成2Na+CuSO4+2H2O === Cu(OH)2↓+Na2SO4+H2↑氯化铁溶液:有气泡产生,红褐色沉淀生成硫酸氢钠溶液:2Na + 2H+=2Na++H2↑氯化铵溶液:2Na + 2H2O+2NH4+2Na++H2↑+2NH3·H2O6、工业上制备钾:Na+KCl 熔融NaCl+K↑(平衡移动原理)工业上制备钛:4Na+TiCl4高温4NaCl+Ti7、工业上制备钠:2NaCl2Na+Cl28、氧化钠与水反应:Na2O+H2O=2NaOH离子方程式9、氧化钠与二氧化碳反应:Na2O+CO2==Na2CO310、氧化钠与盐酸:Na2O +2HCl = 2NaCl + H2O离子方程式11、过氧化钠与二氧化碳反应(防毒面具与潜水艇制氧气):2Na2O2 + 2CO2 = 2Na2CO3 +O2↑12、过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑13、过氧化钠与二氧化硫反应:2Na2O2 + 2SO2 = 2Na2SO414、过氧化钠与亚硫酸钠溶液: Na2O2 + H2O + Na2SO3==Na2SO4 +2NaOH离子方程式:15、过氧化钠与氯化亚铁溶液: 4Na2O2+4FeCl2+6H2O===4Fe(OH)3↓+O2↑+8NaCl离子方程式:16、NaOH溶液中通入少量CO2:2NaOH+CO2= Na2CO3+H2O离子方程式:2OH-+CO2= CO32-+H2ONaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3离子方程式:OH-+CO2= HCO3-17、氢氧化钙溶液中通入至CO2过量:先有白色沉底,后沉淀消失Ca(OH)2 +CO2=CaCO3 + H2OCaCO3 + H2O +CO2=Ca(HCO3)218、①向碳酸钠溶液滴入少量稀盐酸(开始无现象,后来产生气泡):Na2CO3 + HCl = NaHCO3 + NaCl 离子方程式CO32- + H+==HCO3-向稀盐酸滴入少量碳酸钠溶液(立即产生气泡):Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑向碳酸钠溶液滴入过量稀盐酸:Na2CO3+2HCl==2NaCl+H2O+CO2↑离子方程式:CO32-+2H+==H2O+CO2↑②除去碳酸氢钠溶液中混有的碳酸钠:Na2CO3 + H2O +CO2 =2NaHCO3③碳酸钠与氢氧化钙:Na2CO3 + Ca(OH)2=CaCO3↓ + 2Na OH④碳酸氢钠与盐酸:NaHCO3+HCl=NaCl+H2O+CO2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCO3+ Ca(OH)2=CaCO3↓ + Na OH+ H2O离子方程式:少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCO3+ Ca(OH)2=CaCO3↓ + Na2CO3 + 2H2O离子方程式:⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO3 + NaOH Na2CO3 + H2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCO3Na2CO3 + H2O +CO2 ↑⑧鉴别碳酸钠和碳酸氢钠溶液:Na2CO3 + CaCl2=CaCO3↓ + 2Na Cl⑨少量碳酸氢钙溶液滴入氢氧化钠溶液中:离子方程式:少量氢氧化钠溶液滴入碳酸氢钙溶液中:离子方程式:二、铝及其化合物1、铝与氧气的反应:4Al + 3O22Al2O32、铝与氧化铁反应(铝热反应):2Al + Fe2O3高温2Fe + Al2O33、铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式:2Al + 6H+= 2Al3++ 3H2↑4、铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5、氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O离子方程式:Al2O3+6H+=2Al3++3H2O6、氧化铝和NaOH溶液:Al2O3 + 2NaOH =2NaAlO2 +H2O离子方程式:Al2O3 + 2OH-=2 AlO2-+2H2O7、氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+= Al3++3H2O8、氢氧化铝和NaOH溶液:Al(OH)3 +NaOH=NaAlO2+2H2O离子方程式:Al(OH)3 +OH-=AlO2-+2H2O9、氢氧化铝受热分解:2Al(OH)3Al2O3+3H2O _10、硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+11、AlCl3溶液中加入少量NaOH溶液:----有白色沉淀生成AlCl3+3NaOH=A l(O H)3↓+3NaCl离子方程式:AlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH = NaAlO2 + 3NaCl+2H2O 离子方程式:12、往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2Al(O H)3↓+Na2CO3离子方程式:往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=A l(O H)3↓+NaHCO3离子方程式:13、往偏铝酸钠溶液中通入少量盐酸:NaAlO2+HCl +H2O=A l(O H)3↓+NaCl离子方程式:往偏铝酸钠溶液中通入足量盐酸:NaAlO2+4HCl = AlCl3+NaCl+2H2O离子方程式:14、工业制备铝:2Al2O34Al+3O2↑15、①明矾溶液中滴加Ba(OH)2至SO42-完全沉淀KAl(SO4)2+2Ba(O H)2=KAlO2+2BaSO4↓+KOH+H2OAl3+ + 2SO42- +2 Ba2+ + 4OH- = AlO2- +2 BaSO4↓ + 2H2O②明矾溶液中滴加Ba(OH)2至Al3+完全沉淀2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4+3H2 O2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 2AL(OH)3↓+ 3BaSO4↓ +3H2O三、铁及其化合物(一)铁单质(0价)3Fe + 2O2Fe3O4Fe + S FeS Fe + l2=Fel22Fe+3Cl22FeCl32Fe+3Br22FeBr33Fe + 4H2O(g) 高温Fe3O4 + 4H2Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+== Fe2++ H2↑Fe+CuSO4=FeSO4+Cu 离子方程式:Fe+Cu2+=Fe2++Cu (二)+2价铁氧化亚铁:FeO+2HCl == FeCl2+H2O 离子方程式:FeO+2H +Fe2++H2O 与硝酸反应:3FeO+10 H++NO3- ==3Fe3++NO +5 H2O 氢氧化亚铁:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 与硝酸:3Fe(OH)2+10 H++NO3- ==3Fe3++NO+8 H2O 亚铁盐:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 离子方程式:Fe2++2OH-= Fe(OH)2↓FeCl2 + Cl2 = 2FeCl3 离子方程式:2Fe2++ Cl2 = 2Fe3++2Cl-FeCl2 + Br2 = 2FeBr3与H2O2反应:2Fe2++2H++H2O2==2Fe3++2H2O与硝酸:3Fe2++4H++NO3-(稀)=3Fe3++2H2O+NO↑与酸性高锰酸钾溶液5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O:(二)+3价铁氧化铁:Fe2O3+6HCl=2FeCl3+3H2O 离子方程式:Fe2O3+6H+=2Fe3++3H2O与氢碘酸反应:Fe2O3+6H++2I- =2Fe2++I2 +3H2OFe2O3 + 3CO高温2Fe + 3CO2氢氧化铁:2Fe(OH)3Fe2O3+3H2O与氢碘酸:2Fe(OH)3+6H++2I- =2Fe2++I2 +6H2O铁盐:FeCl3+3NaOH = Fe(OH)3↓+3NaCl离子方程式:Fe3++3OH -= Fe(OH)3↓除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2 离子方程式:2Fe3++ Fe = 3Fe2+与Cu反应:2FeCl3+Cu=2FeCl2+CuCl2 离子方程式:2Fe3++Cu=2Fe2++Cu2+与硫氰化钾溶液反应:Fe3+ + 3SCN-= Fe(SCN)3与碘化钾:2KI+2FeCl3==2KCl+2FeCl2+I2 离子方程式:与二氧化硫:FeCl3+SO2+2H2O ==2FeCl2+2HCl+ H2SO4离子方程式四氧化三铁与盐酸反应:Fe3O4+8HCl==FeCl2+2FeCl3+4H2O四、硅及其化合物1、硅与氧气加热:Si+O2SiO2硅与氟气:Si+2F2=SiF42、硅单质与氢氟酸反应:Si+4HF=SiF4↑+2H23、硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑离子方程式:4、二氧化硅与氢氟酸反应:4HF+SiO2=SiF4↑+2H2O5、二氧化硅与氧化钙高温反应:SiO2+CaO高温CaSiO36、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O7、二氧化硅与碳反应:SiO2 + 2C 高温Si + 2CO↑8、硅酸钠与盐酸反应:Na2SiO3+2HCl=H2SiO3↓+2 NaCl离子方程式:SiO32-+2H+=H2SiO3↓9、往硅酸钠溶液中通入二氧化碳(少量):Na2SiO3 +CO2+H2O == H2SiO3↓+ Na2CO3离子方程式:足量二氧化碳:Na2SiO3+2CO2(过量)+2H2O=2NaHC O3+H2SiO3↓离子方程式:10、二氧化硅与纯碱反应:SiO2+Na2CO3高温Na2SiO3+CO2↑11、二氧化硅与石灰石反应:SiO2+CaCO3高温CaSiO3+CO2↑12、加热硅酸:H2SiO3SiO2+H2O五、氯及其化合物1、实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O离子方程式:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O高锰酸钾与浓盐酸反应:2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O离子方程式:氯酸钾与浓盐酸(离子方程式)次氯酸钠与浓盐酸(离子方程式)2、钠在氯气中燃烧:2Na+Cl2 2NaCl铁在氯气中燃烧:2Fe+3Cl2 2FeCl3铜在氯气中燃烧:Cu + Cl2CuCl2氢气在氯气中燃烧:H2 + Cl22HCl3、氯气和水反应:Cl2 + H2O = HCl + HClO 离子方程式:Cl2 + H2O = H++Cl-+ HClO4、次氯酸光照分解:2HClO 2HCl + O2↑5、氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.、氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7、工业生产漂白粉:2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O8、漂白粉漂白原理:Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO (CO2少量)离子方程式为:Ca2+ +2ClO-+CO2+H2O = 2HClO+CaCO3↓CO2过量:Ca(ClO)2 + 2 CO2 + 2 H2O = 2 HClO + Ca(HCO3)2 离子方程式为:ClO-+ CO2+H2O = HClO+ HCO3-9、向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO10、次氯酸钠溶液和二氧化碳:CO2 + NaClO + H2O = HClO + NaHCO3(无论量多量少)离子方程式:CO2+ClO-+H2O=HClO+HCO3-11、氯气通入溴化钾溶液:Cl2 + 2KBr = Br2 + 2KCl 离子方程式:Cl2 + 2Br-= Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl 离子方程式:Cl2 + 2I-= I2 + 2Cl-溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr 离子方程式:Br2 +2I-= I2+2Br-氯气通入亚硫酸钠溶液:Cl2 + SO32-+H2O==SO42-+ 2Cl-+ 2H+12、氯化钠和硝酸银溶液:AgNO3 + NaCl =AgCl↓ + NaNO3离子方程式:Ag++Cl-=A gCl↓(白色沉淀)溴化钠和硝酸银溶液:AgNO3 + NaBr=AgBr↓ + NaNO3离子方程式:Ag++Br-=AgBr↓ (浅黄色沉淀)碘化钠和硝酸银溶液:AgNO3 + NaI =AgI↓ + NaNO3离子方程式:Ag++I-=AgI↓(黄色沉淀)六、硫及其化合物1.硫在空气中燃烧:S+O2SO2硫与氢气加热:S+H2H2S2、硫与金属反应(最低价态)Fe+S FeS 2Na+S Na2S 2Cu+S Cu2S3、硫与热的氢氧化钠溶液3S+6NaOH 2Na2S+Na2SO?+3H2O:4、酸性氧化物的性质(1)二氧化硫与水:SO2+H2O H2SO3(2)二氧化硫与氧化钙:SO2+CaO=CaSO3(3)少量SO2与氢氧化钠:2NaOH+SO2=Na2SO3+H2O 离子方程式:2OH-+SO2= SO32-+H2O 过量SO2与氢氧化钠:NaOH+SO2=NaHSO3 离子方程式:OH-+SO2= HSO3-(4)SO2通入过量的澄清石灰水:Ca(OH)2+SO2=CaSO3↓+H2O 过量的SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)2(5)向亚硫酸钠溶液中通入二氧化硫:Na2SO3+SO2+H2O==2NaHSO3SO32-+SO2+H2O==2HSO3-5、二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O (体现SO2的氧化性)6、二氧化硫的还原性(主要)2SO3(1)SO2的催化氧化:2SO2 + O2催化剂加热(2)氯水中通入二氧化硫,漂白性消失(氯水褪色):Cl2+2H2O+SO2==H2SO4+2HCl 离子方程式:Cl2+2H2O+SO2==4H++SO42-+2Cl- (3)溴水中通入二氧化硫:SO2+Br2+2H2O===H2SO4+2HBr(4)碘水中通入二氧化硫SO2+I2+2H2O===H2SO4+2HI(5)酸性高锰酸钾中中通入二氧化硫:5 SO2 + 2 KMnO4 + 2 H2O = K2SO4 + 2 MnSO4 + 2 H2SO4离子方程式 5 SO2 + 2 MnO4- + 2 H2O = 2 Mn2+ + 4 H+ + 5 SO42-(6)Fe3+溶液中中通入二氧化硫:2Fe3+ + SO2 + 2H2O == 2Fe2+ + SO42- + 4H+(7)稀硝酸中中通入二氧化硫:2NO3- + 3SO2+ 2H2O = 3SO42- + 2NO + 4 H+(8)过氧化钠与二氧化硫:SO2+Na2O2==Na2SO47、实验室制取二氧化硫:Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O8、三氧化硫和水反应:SO3+H2O=H2SO49、三氧化硫与氧化钙:SO3+CaO= CaSO410、三氧化硫与氢氧化钙:Ca(OH)2+SO3=CaSO4↓+H2O11、三氧化硫与氢氧化钠:SO3+2NaOH=Na2SO4+H2O12、硫化氢与氧气反应:氧气少量:2H2S+O2==2S↓+2H2O(点燃)氧气足量:2H2S+3O2==2H2O+2SO2(点燃)13、铜与浓硫酸反应:Cu + 2H2SO4 (浓)CuSO4 + 2H2O+SO2 ↑14、碳与浓硫酸反应:C + 2H2SO4(浓)2H2O+CO2↑+2SO2↑七、氮及其化合物放电1、氮气和氧气反应:N2 + O2 2NO2、工业合成氨(人工固氮):N2 + 3H2催化剂2NH3、高温高压3、氮气和镁反应:3Mg+N2点燃Mg3N24、一氧化氮与氧气反应:2NO + O2=2NO25、NO2溶于水:3NO2 + H2O = 2HNO3 + NO6、NO2、O2混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4HNO37、NO、O2混合通入水中无剩余气体:4NO+ 3O2 + 2H2O = 4HNO38、氨气溶于水:NH3 + H2O NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O NH4+ + OH9、浓氨水受热分解:NH3·H2O △NH3↑+H2O10、氨气和氯化氢(有白烟生成):HCl + NH3 = NH4Cl11、氨的催化氧化:4NH3 +5O24NO + 6H2O12、氨水与二氧化碳:2NH3·H2O+CO2=(NH4)2CO3+H2O (CO2少量)当二氧化碳通入过量:NH3·H2O+CO2==NH4HCO313、氨气与氯气反应:有过量的氨气时:8NH3+3Cl2===N2+6NH4Cl有少量的氨气时:2NH3+3Cl2===N2+6HCl14、氨气与氧化铜反应:3CuO+2NH3△3Cu+3H2O+N215、氨水与氯化铁溶液反应:FeCl3 + 3NH3·H2O = Fe(OH)3↓ + 3NH4Cl离子方程式:Fe3+ + 3 NH3·H2O= Fe(OH)3↓ + 3NH4+16、氨水与氯化铜溶液反应:CuCl2 + 2 NH3·H2O = Cu(OH)2↓ + 2 NH4Cl离子方程式:Cu2+ + 2 NH3·H2O = Cu(OH)2↓ + 2NH4+17、氯化铵受热分解:NH4Cl NH3+HCl18、碳酸氢铵受热分解:NH4HCO3NH3↑+ H2O↑ + CO2↑19、硝酸铵和NaOH:NH4NO3 + NaOH NaNO3 + NH3↑+H2O离子方程式:NH4++ OH-NH3↑+H2O20、实验室制氨气:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑ + 2H2O21、浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O22、稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O23、稀硝酸与铁反应:铁过量:3Fe+8 H++ 2NO3-=3Fe2++H2O+2NO↑铁不足:Fe+4H++ NO3-=2H2O +Fe 3++NO↑24、稀硝酸与Fe2+反应:3Fe2+ + 4H+ + NO3- == 3Fe3+ + NO↑+ 2H2O24、浓硝酸与C反应:C+4HNO3 CO2↑+4NO2↑+2H2O25、硝酸见光分解:4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)_26、NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O。
高中化学必修一金属及其化合物必记方程式

高中化学必修一 金属及其重要化合物 方程式钠单质4Na+O 2=2Na 2O (常温) 2Na+O 2 点燃Na 2O 2 (加热燃烧)Cl 2 +2Na点燃2NaCl (钠在氯气中燃烧) 2Na+S =Na 2S(研磨条件下爆炸)2Na+2H 2O =2NaOH+H 2↑ 4Na+TiCl 4(熔融)=4NaCl+Ti (钠的强还原性,冶炼金属) 氧化钠Na 2O+H 2O =2NaOH 、 Na 2O+SO 3=Na 2SO 4Na 2O+CO 2=Na 2CO 3 、 Na 2O+2HCl =22Na 2O+O 2 △2Na 2O 2 (氧化钠不稳定)过氧化钠2Na 2O 2+2H 2O =4NaOH+O 2↑(此反应分两步Na 2O 2+2H 2O =2NaOH+H 2O 2;2H 2O 2=2H 2O+O 2↑。
H 2O 2的制备可利用类似的反应) 2Na 2O 2+2CO 2=2Na 2CO 3+O 2Na 2O 2+H 2SO 4=Na 2SO 4+H 2O 2(过氧化氢再分解为水和氧气,与盐酸反应也如此) 氢氧化钠2NaOH +CO 2=Na 2CO 3+H 2O(NaOH 过量) NaOH +CO 2=NaHCO 3 (CO 2过量)3NaOH+AlCl 3=A l (O H )3↓+3NaCl NaOH+Al(OH)3=NaAlO 2?+2H 2O4NaOH ??+?AlCl 3=?NaAlO 2?+?3NaCl ?+2H 2O 将上述两个反应合二为一。
碳酸钠和碳酸氢钠NaHCO 3+HCl =NaCl+H 2O+CO 2↑ Na 2CO 3+HCl =NaHCO 3+NaCl 2NaHCO 3△Na 2CO 3 + CO 2↑+ H 2O Na 2CO 3 + CO 2+ H 2O =2NaHCO 3NaHCO 3与CaCl 2不反应。
Na 2CO 3 +CaCl 2=2NaCl +CaCO 3↓NaHCO3(少量)+ Ca(OH)2=NaOH +CaCO3↓+ H2O Na2CO3+Ca(OH)2=2NaOH+CaCO3↓2NaHCO3(过量)+Ca(OH)2=Na2CO3+CaCO3↓+ 2H2O铁单质3Fe + 2O2点燃Fe3O42Fe + 3Cl2点燃2FeCl3 2Fe+3Br2=2FeBr3(Cl2、Br2的强氧化性,生成+3价)Fe+S△FeS Fe+I2△FeI2 (S、I2的弱氧化性,生成+2价)3Fe+4H2O(g)高温Fe3O4+4H2Fe+2HCl=FeCl2+H2↑Fe +H2SO4(稀)=FeSO4+H2↑Fe+CuCl2=FeCl2+Cu 铁的发生置换反应,均生成+2价。
高一化学必修一金属及其化合物方程式总结(K12教育文档)

高一化学必修一金属及其化合物方程式总结(word版可编辑修改)
编辑整理:
尊敬的读者朋友们:
这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高一化学必修一金属及其化合物方程式总结(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高一化学必修一金属及其化合物方程式总结(word版可编辑修改)的全部内容。
高一化学必修一金属及其化合物方程式总结。
化学必修一化学方程式归纳

化学必修一化学方程式归纳
化学必修一涉及的化学方程式主要包括氧化还原反应和非氧化还原反应。
以下是一些常见的化学方程式:
氧化还原反应:
1. 钠与氧气反应:4Na + O2 = 2Na2O
2. 钠与水反应:2Na + 2H2O = 2NaOH + H2↑
3. 钠与硫酸反应:2Na + H2SO4 = Na2SO4 + H2↑
4. 氧化铁与一氧化碳反应:Fe2O3 + 3CO = 2Fe + 3CO2
5. 氧化铝与氢氧化钠反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O
6. 铜与硝酸银反应:Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
7. 铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑
非氧化还原反应:
1. 二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 = CaCO3↓ + H2O
2. 二氧化硫与氧气反应:2SO2 + O2 = 2SO3
3. 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO
4. 甲烷燃烧:CH4 + 2O2 = CO2 + 2H2O
5. 氯气与水反应:Cl2 + H2O = HCl + HClO
6. 氨气与氯化氢反应:NH3 + HCl = NH4Cl
7. 硫化氢与氧气反应:2H2S + O2 = 2S↓ + 2H2O
以上仅是部分化学方程式,更多内容建议查阅化学教材或相关教辅,以获取全面的信息。
高中化学反应方程式

点燃点燃化学方程式一、金属:1.钠及其化合物:(必修一)(1)钠与氧气:4Na+O2==2Na2O;2Na2O+O2==2Na2O2(2)钠与水:2Na+2H2O==2NaOH+H2↑(3)钠与非金属单质:2Na+Cl2==2NaCl2Na+S==Na2S(4)钠与酸:2Na+H2SO4==Na2SO4+H2↑(5)氧化钠与酸(氧化钙与酸):Na2O+2HCl==2NaCl+H2OCaO+2HCl==CaCl2+H2O(6)氧化钠与水(氧化钙与水):Na2O+H2O==2NaOHCaO+H2O==Ca(OH)2(7)氧化钠与二氧化碳(氧化钙与二氧化碳): Na2O+CO2==Na2CO3CaO+CO2==CaCO3(8)过氧化钠与水:2Na2O2+2H2O==4NaOH+O2↑(9)过氧化钠与二氧化碳:2Na2O2+2CO2==2Na2CO3+O2↑(10)氢氧化钠与二氧化碳(二氧化碳不足)(氢氧化钙与二氧化碳): 2NaOH+CO2==Na2CO3+H2OCa(OH)2+CO2==CaCO3↓+H2O(11)氢氧化钠与二氧化碳(二氧化碳过量)(氢氧化钙与二氧化碳): NaOH+CO2==NaHCO3Ca(OH)2+CO2==Ca(HCO3)2(12)氢氧化钠与二氧化碳(二氧化碳与过氧化钠之比介于1/2和1之间): 2NaOH+CO2==Na2CO3+H2O;NaOH+CO2==NaHCO3(13)纯碱(苏打)与酸(写出离子方程式):Na2CO3+2HCl==2NaCl+CO2↑+H2OCO32-+2H+==CO2↑+H2O(14)小苏打与酸(写出离子方程式):NaHCO3+HCl==NaCl+CO2↑+H2OHCO3-+H+==CO2↑+H2O(15)小苏打与碱(写出离子方程式):NaHCO3+NaOH==Na2CO3+H2OHCO3-+OH-==CO32-+H2O加热点燃 点燃(16) 纯碱(苏打)转化为小苏打:Na 2CO 3+CO 2+H 2O==2NaHCO 3(17) 向纯碱中滴加酸(写出现象、化学方程式与离子反应方程式): 现象:开始没有气泡产生,一段时间后气泡产生Na 2CO 3+2HCl==2NaHCO 3CO 32-+2H +==2HCO 3-(18) 向酸中滴加纯碱(写出现象、化学方程式与离子反应方程式): 现象:一开始就有气泡放出Na 2CO 3+2HCl==2NaCl+CO 2↑+H 20CO 32-+2H +==CO 2↑+H 2O(19) 侯德榜制碱法原理:(选修)NaCl+NH 3+CO 2+H 2O==NaHCO 3+NH 4Cl2NaHCO 3==Na 2CO 3+CO 2↑+H 2O2. 镁及其化合物:(选修)(1) 镁与水:Mg+H 2O==Mg(OH)2+H 2↑(2) 镁与氧气:2Mg+O 2==2MgO (3) 镁与二氧化碳:Mg+CO 2==MgCO 3(4) 镁与酸:Mg+H 2SO 4==MgSO 4+H 2↑∆点燃 ∆ 电解 (5) 氧化镁与水(缓慢):MgO+H 2O==Mg(OH)2(6) 氧化镁与酸:MgO+H 2SO 4==MgSO 4+H 2O(7) 氢氧化镁加热分解:Mg(OH)2==MgO+H 2O3. 铝及其化合物:(必修一)(1) 铝在氧气中燃烧:Al+O 2==Al 2O 3(2) 铝与酸:2Al+6HCl==2AlCl 3+3H 2↑(3) 铝与碱:Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑(4) 铝热反应:(选修重点)2Al+Fe 2O 3==2Al 2O 3+2Fe(5) 氧化铝(三氧化二铝 两性氧化物)与酸: Al 2O 3+6H +==2Al 3++3H 2O(6) 氧化铝与碱:Al 2O 3+2NaOH==2NaAlO 2+3H 2↑(7) 氧化铝电解:(选修)Al 2O 3==4Al+3O 2↑∆ ∆ (8) “铝三角”之间的转化:(重点)(9) 制取Al(OH)3:(重点)① 氨气:Al 3++3NH 3H 2O==Al(OH)3↓+3NH 4+② 二氧化碳:AlO 2-+CO 2+H 2O==Al(OH)3↓+HCO 3-(10) 铝离子与偏铝酸根:Al 3++3AlO 2-+6H 2O==4Al(OH)3↓(11) 氢氧化铝受热分解:2Al(OH)3==Al 2O 3+3H 2O4. 铁及其化合物:(必修一)(1) 铁与水:3Fe+4H 2O(g)==Fe 3O 4+4H 2↑ Al(OH)3+ Al 3+ AlO 2- Al(OH)3→Al 3+Al(OH)3 + 3H + == Al 3+ + 3H 2OAl 3+→AlO 2-Al 3+ +4OH - ==AlO 2- + 2H 2OAlO 2-→Al(OH)3AlO 2- + H + +H 2O == Al(OH)3↓Al(OH)3→AlO 2-Al(OH)3 + OH - ==AlO 2- + 2H 2OAlO 2-→Al 3+AlO 2- + 4H + == Al 3+ + 3H 2OAl 3+→Al(OH)3Al 3+ + 3OH - == Al(OH)3↓∆ 点燃 点燃 (2) 铁与硫:(选修)Fe+S==FeS(3) 铁与氯气:2Fe+3Cl 2==2FeCl 3(4) 铁与氧气:3Fe+2O 2==Fe 3O 4(磁性氧化铁)(5) 铁与酸:Fe+2H +==Fe 2++H 2↑(6) “铁三角”之间的转化:(重点)(7) 氯化亚铁滴入氢氧化钠溶液中:FeCl 2+2NaOH==Fe(OH)2↓+2NaCl4Fe(OH)2+O 2+2H 2O==4Fe(OH)3↓FeFe+2 Fe+3Fe→Fe+2 Fe+ 2H + == Fe 2+ + H 2↑ Fe+2→Fe+3 2Fe 2+ + Cl 2 == 2Fe 3+ + 2Cl - Fe+3→Fe Fe 2O 3 + 3CO == 2Fe + 3CO 2 Fe→Fe+3 2Fe + 3Cl 2 == 2FeCl 3 Fe+3→Fe+2 2Fe 3+ + Fe == 3Fe 2+ Fe+2→Fe FeO + H 2 == Fe + H 2O高温高温∆点燃点燃点燃(8) 铁与稀硝酸(稀硝酸过量):(选修) Fe+4HNO 3==Fe(NO 3)3+2NO 2↑+2H 2O(9) 铁与稀硝酸(稀硝酸不足):(选修) 3Fe+8HNO 3==3Fe(NO 3)2+2NO ↑+4H 2O(10) 三价铁离子的检验:Fe3+3SCN -==Fe(SCN)3(血红色)(11) 氧化铁(与磁性氧化铁区分)与一氧化碳:(选修) Fe 2O 3 + 3CO == 2Fe + 3CO 2(12) 氧化亚铁与氢气:(选修)FeO + H 2 == Fe + H 2O(13) 氢氧化铁受热分解:2Fe(OH)3==Fe 2O 3+3H 2O5. 铜及其化合物:(1) 铜与氧气:2Cu+O 2==2CuO(2) 铜与硫:(选修)Cu+S==Cu 2S(3) 铜与氯气:Cu+Cl 2==CuCl 2(4) 铜与浓硫酸:Cu+2H 2SO 4==CuSO 4+SO 2↑+2H 2O∆∆ (5) 铜与浓硝酸:Cu+4HNO 3==Cu(NO 3)2+2NO 2↑+2H 2O(6) 铜与稀硝酸:3Cu+8HNO 3==3Cu(NO 3)2+2NO ↑+2H 2O(7) 铜绿(碱式碳酸铜)生成:(选修)2Cu+O 2+CO 2+H 2O==Cu 2(OH)2CO 3(8) 氢氧化铜分解:Cu(OH)2==CuO+H 2O(9) 无水硫酸铜干燥变色:(选修)CuSO 4(白色)+5H 2O==CuSO 45H 2O (蓝色)(10) 硫酸铜与强碱(离子方程式):Cu 2++2OH -==Cu(OH)2↓(11) 氧化铜受热分解:(选修)2CuO==Cu 2O+O 2↑点燃点燃 高温 高温 高温 高温 ∆ 二、非金属:1. 碳及其化合物(二氧化碳是分子晶体):(初中)(1) 碳的燃烧:① 不充分燃烧:2C+O 2==2CO② 充分燃烧:C+O 2==CO 2(2) 碳与氧化钙:(选修)3C+CaO==CaC 2+CO ↑(3) 碳与氧化铜:C+CuO==Cu+CO ↑C+2CuO==2Cu+CO 2↑(4) 碳与水蒸气:C+H 2O(g)==CO+H 2(5) 碳酸氢钙与氢氧化钠(氢氧化钠足量):(选修) Ca(HCO 3)2+2NaOH==CaCO 3↓+Na 2CO 3+2H 2O(6) 碳酸氢钙与氢氧化钠(氢氧化钠不足):(选修) Ca(HCO)2+NaOH==CaCO 3↓+NaHCO 3+H 2O2. 硅及其化合物(二氧化硅是原子晶体):(必修一)(1) 硅与氧气:Si+O 2==SiO 2(2) 硅与氟:Si+2F 2==SiF 4高温 高温 高温 高温 高温 点燃 点燃 (3) 硅与氟化氢(反常反应:唯一能反应的酸): Si+4HF==SiF 4↑+2H 2↑(4) 硅与氯气:Si+2Cl 2==SiCl 4(5) 二氧化硅与氧化钙:SiO 2+CaO==CaSiO 3(6) 二氧化硅与碳(反常反应):SiO 2+C==CO ↑+Si(7) 二氧化硅与氢氧化钠:SiO 2+2NaOH==Na 2SiO 3+H 2O(8) 四氯化硅与氢气:SiCl 4+H 2==Si+4HCl(9) 实验室制硅酸:Na 2SiO 3+CO 2+H 2O==Na 2CO 3+H 2SiO 3(胶体)(10) 二氧化硅与碳酸钠(反常反应): SiO 2+Na 2CO 3==Na 2SiO 3+CO 2↑3. 氯及其化合物:(必修一)(1) 钠与氯气:2Na+Cl 2==2NaCl (白烟)(2) 铜与氯气:Cu+Cl 2==CuCl 2(棕黄色烟)点燃点燃 光照或∆ ∆ 电解 电解 (3) 铁与氯气:2Fe+3Cl 2==2FeCl 3(棕褐色烟)(4) 氢气与氯气:H 2+Cl 2==2HCl(5) 磷与氯气(氯气不足):(选修)2P+3Cl 2==2PCl 3(6) 磷与氯气(氯气足量):(选修)2P+5Cl 2==2PCl 5(7) 氯气与强碱(制漂白剂):Cl 2+2NaOH==NaClO+NaCl+H 2O(8) 氯气与水(区分氯水与液氯):Cl 2+H 2O==HCl+HClO(9) 次氯酸分解:2HClO==2HCl ↑+O 2↑(10) 实验室制氯气:MnO 2+4HCl (浓)==MnCl 2+Cl 2↑+2H 2O(11) 氯化钠电解:(选修)2NaCl(aq )+2H 2O==2NaOH+H 2↑+Cl 2↑2NaCl(熔融)==2Na+Cl 2↑(12) 氯化氢与氨气:HCl+NH 3==NH 4Cl放热MnO 2 ∆ (13) 硝酸银与盐酸(氯离子的检验):AgNO 3+HCl==AgCl ↓+HNO 3(14) 氯气与亚硫酸根和水:Cl 2+SO 32-+H 2O==2H ++2Cl -+SO 42-(15) 氯气与二氧化硫和水Cl 2+SO 2+2H 2O==4H ++2Cl -+SO 42-(16) 卤素间的置换(写出离子方程式):(选修)2Br -+Cl 2==2Cl -+Br 22I -+Cl 2==2Cl -+I 22I -+Br 2==2Br -+I 2(17) 铁离子与碘离子:(选修)2Fe 3++2I -==2Fe 2++I 24. 氧、硫及其化合物:(必修一)(1) 氧气转化为臭氧:(选修)3O 2==2O 3(2) 过氧化氢分解:(选修)2H 2O 2==2H 2O+O 2↑(3) 实验室制氧气:(选修)2KClO 3==2KCl+3O 2↑(4) 双氧水与高锰酸:(选修)5H 2O 2+2MnO 4-+6H +==2Mn 2++5O 2↑+8H 2O点燃点燃 ∆ ∆ ∆ 高温、高压 催化剂 (5) 双氧水与亚铁离子在酸性条件下反应:(选修)H 2O 2+2Fe 2++2H +==2Fe 3++2H 2O(6) 硫的燃烧:S+O 2==SO 2(7) 硫与氢气:(选修)S+H 2==H 2S(8) 硫与铝:(选修)3S+2Al==Al 2S 3(9) 硫与铜:(选修)S+2Cu==Cu 2S (黑)(10) 硫与铁:(选修)S+Fe==FeS (黑)(11) 硫化氢与氢氧化钠:(选修)H 2S+2NaOH==Na 2S+2H 2O(12) 硫化钠与硫酸亚铁:(选修)Na 2S+FeSO 4==Na 2SO 4+FeS(13) 硫化亚铁与氢离子:(选修)FeS+2H +==Fe+H 2S ↑(14) 二氧化硫与水:SO 2+H 2O==H 2SO 3(15) 二氧化硫转化为三氧化硫:2SO 2+O 2 2SO 3点燃放点 (16) 二氧化硫与氢氧化钠:SO 2+2NaOH==Na 2SO 3+H 2O(17) 二氧化硫与硫化氢:SO 2+H 2S==S ↓+H 2O(18) 三氧化硫与水:SO 3+H 2O==H 2SO 4(19) 三氧化硫与氢氧化钠:SO 3+2NaOH==Na 2SO 4(20) 亚硫酸钠与氧气:2Na 2SO 3+O 2==2Na 2SO 4(21) 浓硫酸与碳:C+2H 2SO 4(浓)==CO 2↑+2SO 2↑+2H 2O(22) 亚硫酸根与硝酸反应:(选修)3SO 32-+2H ++2NO 3-==3SO 42-+2NO ↑+H 2O(23) 铜与浓硫酸:Cu+2H 2SO 4(浓)==CuSO 4+2SO 2↑+2H 2O5. 氮及其化合物:(1) 镁在氮气中燃烧:(选修)3Mg+N 2==Mg 3N 2(白色固体)(2) 氮的燃烧:N 2+O 2==2NO高温、高压催化剂 高温、高压催化剂 光照或∆(3) 工业合成氨:N 2+3H 2 2NH 3 (4) 氮化镁与水反应:(选修)Mg 3N 2+6H 2O==3Mg(OH)2+2NH 3↑(5) 氨被氧气氧化(四五四六反应):4NH 3+5O 2 4NO+6H 2O (6) 一氧化氮在空气中被氧化:2NO+O 2==2NO 2(7) 二氧化氮与水:3NO 2+H 2O==2HNO 3+2NO(8) 一氧化氮、氧气与水:4NO+3O 2+2H 2O==4HNO 3(9) 二氧化氮、氧气与水:4NO 2+O 2+2H 2O==4HNO 3(10) 二氧化氮与四氧化二氮的转化:(选修)2NO 2 N 2O 4(11) 二氧化氮与氢氧化钠:(选修)2NO 2+2NaOH==NaNO 3+NaNO 2+H 20(12) 一氧化氮、二氧化氮与氢氧化钠:(选修)NO 2+NO+2NaOH==2NaNO 2+H 2O(13) 硝酸分解:(选修)4HNO 3==4NO 2↑+O 2↑+2H 2O∆∆ ∆ ∆ (14) 铜与浓稀硝酸:Cu+4HNO 3==Cu(NO 3)2+2NO 2↑+2H 2O3Cu+8HNO 3==3Cu(NO 3)2+2NO ↑+2H 2O(15) 碳与浓硝酸:(选修)C+4HNO 3(浓)==CO 2↑+4NO 2↑+2H 2O(16) 氨气溶于水:NH 3+H 2O NH 3H 2O NH 4++OH -(17) 铵盐分解:NH 4Cl==NH 3↑+HCl ↑NH 4HCO 3==NH 3↑+CO 2↑+H 2O(NH 4)2CO 3==2NH 3↑+CO 2↑+H 2O(18) 实验室制氨气:2NH 4Cl+Ca(OH)2==2NH 3↑+2H 2O+CaCl 2三、离子反应方程式:(必修一)1.CO2与NaOH:(1)少量CO2:CO2+2OH-==CO32-+H2O(2)过量CO2:CO2+OH-==HCO3-特殊:当CO2通入苯酚钠溶液中,无论CO2少量还是过量,均生成碳酸氢钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学必修一 金属及其重要化合物 方程式
钠单质
4Na+O 2=2Na 2O (常温) 2Na+O 2 点燃
Na 2O 2 (加热燃烧)
Cl 2 +2Na
点燃
2NaCl (钠在氯气中燃烧) 2Na+S =Na 2S(研磨条件下爆炸)
2Na+2H 2O =2NaOH+H 2↑ 4Na+TiCl 4(熔融)=4NaCl+Ti (钠的强还原性,冶炼金属) 氧化钠
Na 2O+H 2O =2NaOH 、 Na 2O+SO 3=Na 2SO 4 Na 2O+CO 2=Na 2CO 3 、 Na 2O+2HCl =2NaCl+H 2O
2Na 2
O+O 2
△
2Na 2O 2 (氧化钠不稳定)
过氧化钠
2Na 2O 2+2H 2O =4NaOH+O 2↑(此反应分两步Na 2O 2+2H 2O =2NaOH+H 2O 2;2H 2O 2=2H 2O+O 2↑。
H 2O 2的制备可利用类似的反应) 2Na 2O 2+2CO 2=2Na 2CO 3+O 2
Na 2O 2+H 2SO 4=Na 2SO 4+H 2O 2(过氧化氢再分解为水和氧气,与盐酸反应也如此) 氢氧化钠
2NaOH +CO 2=Na 2CO 3+H 2O(NaOH 过量) NaOH +CO 2=NaHCO 3 (CO 2过量) 3NaOH+AlCl 3=A l (O H)3↓+3NaCl
NaOH+Al(OH)3=NaAlO 2+2H 2O
4NaOH+AlCl 3=NaAlO 2+3NaCl+2H 2O 将上述两个反应合二为一。
碳酸钠和碳酸氢钠
NaHCO 3+HCl =NaCl+H 2O+CO 2↑ Na 2CO 3+HCl =NaHCO 3+NaCl 2NaHCO 3
△
Na 2CO 3 + CO 2↑+ H 2O Na 2CO 3 + CO 2+ H 2O =2NaHCO 3
NaHCO 3与CaCl 2不反应。
Na 2CO 3 +CaCl 2=2NaCl +CaCO 3↓ NaHCO 3(少量)+ Ca(OH)2=NaOH +CaCO 3↓+ H 2O Na 2CO 3 +Ca(OH)2=2NaOH+CaCO 3↓ 2NaHCO 3(过量)+Ca(OH)2=Na 2CO 3+CaCO 3↓+ 2H 2O 铁单质 3Fe + 2O 2 点燃
Fe 3O 4
2Fe + 3Cl 2
点燃
2FeCl 3 2Fe+3Br 2=2FeBr 3 (Cl 2、Br 2的强氧化性,生成+3价)
Fe+S
△
FeS Fe+I 2 △
FeI 2 (S 、I 2的弱氧化性,生成+2价)
3Fe+4H 2O(g)
高温
Fe 3O 4+4H 2
Fe+2HCl =FeCl 2+H 2↑ Fe +H 2SO 4(稀)=FeSO 4+H 2↑ Fe+CuCl 2=FeCl 2+Cu 铁的发生置换反应,均生成+2价。
氧化亚铁
FeO+2HCl =FeCl 2+H 2O (溶于强酸,碱性氧化物的体现) 3FeO + 2Al △
Al 2O 3+3Fe (弱氧化性,铝热反应)
6FeO+O 2
△
2Fe 3O 4 (不稳定性、还原性,受热转化为Fe 3O 4)
氧化铁 Fe 2O 3 + 2Al 高温
Al 2O 3+2Fe (铝热反应)
Fe 2O 3 + 3CO △
2Fe+3CO 2(氧化性,被H 2 CO C Al 等还原为Fe )
Fe 2O 3+3H 2
△
2Fe+3H 2O (制还原铁粉)
Fe 2O 3+6HCl =2FeCl 3+3H 2O (溶于强酸,碱性氧化物的体现) 四氧化三铁 Fe 3O 4+4H 2
△
3Fe+4H 2O
Fe 3O 4+8HCl(浓) △
FeCl 2+2FeCl 3+4H 2O
氢氧化铁、氢氧化亚铁
4Fe(OH)2 +O 2 +2H 2O == 4 Fe(OH)3 (白色沉淀迅速变成灰绿色,最终变成红褐色) 2Fe(OH)3 △
Fe 2O 3+3H 2O (弱碱不稳定,受热分解成相应的氧化物和水)
亚铁盐
2FeCl 2 + Cl 2=2FeCl 3 FeCl 2+Mg =Fe+MgCl 2 FeCl 2+2NaOH =Fe(OH)2↓+2NaCl 铁盐
2FeCl 3+Fe =3FeCl 2 (归中反应) 2FeCl 3+Cu =2FeCl 2+CuCl 2(用于腐蚀含铜电路板) 2FeCl 3+H 2SO 3+H 2O =H 2SO 4+2FeCl 2+2HCl 2FeCl 3 + 2KI = 2FeCl 2 + 2KCl +I 2 FeCl 3+3NaOH =Fe(OH)3
↓+3NaCl
FeCl 3 + 3H 2O Fe(OH)3(胶体)+ 3HCl (铁盐溶于水产生胶体,可用于净水) 铝单质
4Al+3O 2
点燃
2Al 2O 3(纯氧,常温下也可被氧气氧化) 2Al+3Cl 2
△
2AlCl 3
4Al+3MnO 2
高温
2Al 2O 3+3Mn 2Al+Cr 2O 3
高温
Al 2O 3+2Cr
2Al+Fe 2O 3 高温
Al 2O 3+2Fe 2Al+3FeO △
Al 2O 3+3Fe
(Al 可与熔点较高的金属的氧化物发生置换反应,统称为铝热反应) 2Al+ 6HCl =2AlCl 3+3H 2↑ 2NaOH+2Al+2H 2O =2NaAlO 2+3H 2↑
氧化铝(两性氧化物)
Al 2O 3+3H 2SO 4=Al 2(SO 4)
3+3H 2O Al 2O 3+2NaOH =2NaAlO 2+H 2O 氢氧化铝(两性氢氧化物) 2Al(OH)3
△
Al 2O 3+3H 2O (弱碱<灵活看待>不稳定,受热分解成相应的氧化物和水)
Al(OH)3+3HCl=AlCl 3+3H 2O 2Al(OH)3+3H 2SO 4=Al 2(SO 4)3+6H 2O
Al(OH)3+NaOH =NaAlO 2+2H 2O 既可与强酸,又可与强碱反应,生成盐+ H 2O 铝盐
Al 2(SO 4)3+6NH 3·H 2O =2Al(OH)3↓+3(NH 4)2SO 4 AlCl 3+3NH 3·H 2O =Al(OH)3↓+3NH 4Cl AlCl 3+3NaOH =A l (O H)3↓+3NaCl AlCl 3+3NaAlO 2 + 6H 2O =4Al(OH)3↓ AlCl 3+4NaOH =NaAlO 2+ 3NaCl+2H 2O
Al 3+ + 3H 2O =Al(OH)3(胶体)+ 3H + (铝盐溶于水产生胶体,可用于净水) 偏铝酸盐
NaAlO 2+HCl+H 2O =Al(OH)3↓+NaCl
若HCl 过量,则继续反应使沉淀溶解:Al(OH)3+3HCl=AlCl 3+3H 2O 合二为一:NaAlO 2+4HCl=AlCl 3+NaCl +2H 2O 2NaAlO 2+CO 2+3H 2O =2Al(OH)3↓+Na 2CO 3
若Al(OH)3看成酸,则该反应为强酸制取弱酸的复分解反应,酸性H 2CO 3>Al(OH)3 3NaAlO 2+AlCl 3+6H 2O =4Al(OH)3↓
铝盐(Al 3+)与偏铝酸盐(AlO 2-),不能共存。
