ISO13485质量管理体系内审表.pdf
ISO13485体系内部审核检查表
1.是否明确影响质量人员的能力及职责要 求?并配置符合要求能力的人员管理、生 产、检验人员等?
2.新进人员、新产品、新材料、工艺技术 、新设备是否进行培训并验证培训效果? 6.2 3.关键人员是否持证上岗,如电工、叉车 工、内审员,特殊过程人员是否进行确 认,并明确资质要求?
4.是否建立年度培训计划、培训计划是否 有效落实?
5.培训记录是否保存?
8.5.1 是否存在改进项目?改进项目是否落实?
异常事项是否采取纠正措施,措施是否有 8.5.2 效落实,是否有评审纠正 措施及其有效
性?
8.5.3 预防措施是有效实施并评价其有效性?
符合性 审核发现和不符合事 项的描述
OK NG
审核员 审核日期
ISO13485内部审核检查表
审核组长
被审区域/接 待人
管批准,必要时 对文件进行评审和更新并再次批准。抽查 文件核对编制审核批准记录。
4.2.4
确保文件的更改和现行修订状态得到识 别,确保文件保持清晰、易于识别。抽查 文件更新情况及审批记录,核对其现行版 本和识别标识。
ISO13485内审检查表完整各部门

内审检查表审核员:第 1 页共 10 页受审部门总经理管理者代表日期审核内容审核方法记录标准条款评价查看体系文件判别是否符合标准规定符合 1按要求建立文件化的质量管理体系。
查,符合标准规定。
质量管 2质量管理体系覆盖的产品范围。
4.1检查是否相符。
覆盖的产品范围符合符合理体系总要求查,文件齐全符合检查是否齐全。
3质量管理体系各层次的文件。
符合有没有删减部分,如有则记录4质量管理体系的删减。
有删减合理查文件目录判别各级文件是否齐全。
公司应建立并保持的质量管理体系文件。
1查,各级文件齐全符合抽查三份文件是否相符查目录,判别是否能满足生产经营的符合保存的医疗器械的法律、法规。
文件 24.2.1满足生产经营的需求需求要求总则3对每一型号的医疗器械建立并保持一套技术文档抽查一套技术文档,检查是否正确、相关技术文件符合齐全、清晰,符合生产要求。
质量手册应包括以下内容:符合阐明企业质量管理体系 4.2.2质量检查质量手册,查有没有阐明企业质符合 1) 清楚的阐明企业质量管理体系覆盖的范围。
含包范围,盖覆手册量管理体系覆盖范围,有无缺YY/TYY/T0287 专用要求内0287专用要求内容,有没有描述过程2) 应形成文件的程序或对其引用。
符合容,有描述过程及其相及其相互作用。
互作用。
3) 识别企业质量管理体系所需过程及过程之间符合的相互作用的表述。
有质量方针总经理对其建立和改进质量管理体系的承诺。
1 通过查质量记录,作出判断的证据。
符合 5.1 2总经理将满足顾客要求和法律、法规要求的重要询问二个现场员工,作出判断明白满足顾客要求和法符合管理承诺性传达给组织的成员。
律、法规要求的重要性与领导层交谈,了解顾客要求和法律了解顾客要求和法律、、法规传达情况以及顾客要求得到满法规传过情况以及顾客符合 1确保顾客的需求得到确定并予以满足。
5.2足的情况要求得到满足。
完全理解顾客和法律法以顾客为关 2应完全理解顾客和法律法规要求。
ISO13485:2016内审检查表(完整各部门)

ISO13485:2016内审检查表(完整各部门)ISO13485:2016内审检查表(完整各部门)审核员:第 1 页共 10 页受审部门总经理管理者代表审核内容⽇期标准条款审核⽅法记录评价符合查看体系⽂件判别是否符合标准规定。
1按要求建⽴⽂件化的质量管理体系。
查,符合标准规定4.1质量管 2质量管理体系覆盖的产品范围。
理体系总要求检查是否相符。
覆盖的产品范围符合查,⽂件齐全符合符合符合 3质量管理体系各层次的⽂件。
检查是否齐全。
4质量管理体系的删减。
有没有删减部分,如有则记录有删减合理查⽂件⽬录判别各级⽂件是否齐全。
抽查三份⽂件是否相符1公司应建⽴并保持的质量管理体系⽂件。
查,各级⽂件齐全符合符合查⽬录,判别是否能满⾜⽣产经营的需求4.2.1⽂件 2保存的医疗器械的法律、法规。
要求总则满⾜⽣产经营的需求3对每⼀型号的医疗器械建⽴并保持⼀套技术⽂档抽查⼀套技术⽂档,检查是否正确、相关技术⽂件符合。
齐全、清晰,符合⽣产要求。
质量⼿册应包括以下内容:符合符合阐明企业质量管理体系覆盖范围,包含YY/T0287 专⽤要求内容,有描述过程及其相互作⽤。
4.2.2质量⼿册检查质量⼿册,查有没有阐明企业质量管理体系覆盖范围,有⽆缺YY/T0287专⽤要求内容,有没有描述过程及其相互作⽤。
1) 清楚的阐明企业质量管理体系覆盖的范围。
2) 应形成⽂件的程序或对其引⽤。
符合符合 3) 识别企业质量管理体系所需过程及过程之间的相互作⽤的表述。
5.1 1总经理对其建⽴和改进质量管理体系的承诺。
通过查质量记录,作出判断的证据。
有质量⽅针符合符合2总经理将满⾜顾客要求和法律、法规要求的重要询问⼆个现场员⼯,作出判断明⽩满⾜顾客要求和法律、法规要求的重要性管理承诺性传达给组织的成员。
与领导层交谈,了解顾客要求和法律了解顾客要求和法律、、法规传达情况以及顾客要求得到满法规传过情况以及顾客符合 5.21确保顾客的需求得到确定并予以满⾜。
ISO13485_内审检查表
2 对原材料、半成品、成品分别使用产品标识卡 、工序卡、产品标签等标识其名称、规格以避免 不同类型的产品混淆。同时使用标签、标识牌、 检查现场标识和追溯状态。 区域划分等明确相应产品待检、合格、不合格的 检验状态,以防止生产过程中不同产品和不合格 品的误用,并实现产品的追溯性要求。 7.5.3.2.1 3 建立可追溯性的形成文件的程序。该程序应规 定产品可追溯性的范围和程度和所要 可追溯性 求的记录 总则
记录
2009 年 10月12日
3 最高管理者应确保企业内建立适当的沟通过程, 检查证实企业内部沟通方式和渠道 以确保质量管理体系的有效性。 的文件和记录。 4 企业的最高管理者应熟悉国家有关医疗器械的法 律、法规,熟悉产品生产技术。对产品质量负全 与高层领导座谈。 5.5职责、 部责任。 权限和沟 通 5 各部门负责人及各岗位员工应明确自己的职责、 权限及相互关系,了解组织的质量管理体系活动 抽查二个员工。 。 最高管理者应按策划的时间间隔评审质量管理体 系,实施管理评审,以确保其持续的适宜性、充 检查管理评审频次和记录,是否按 5.6管理评 分性和有效性,包括评价质量方针、质量目标、 管理评审输入和输出要求进行管理 审 质量管理体系改进的机会和变更的需要。保持质 评审。 量管理评审的记录。 1最高管理者应确保企业质量管理体系资源的获得 与领导层座谈,了解资源情况。 和适宜。
内审检查表
审核员: 受审部门 办公室人事
日期
第 4 页
年 月
共 10 页
日
标准条款
审核内容
1生产企业应至少建立、实施保持以下程序文件: 按要求建立手册/程序/作业指导文件等作业控制文 件 检查 文件。
审核方法
记录
2按文件控制程序,对与质量有关的文件(包括质 4.2.3文件 量体系文件、产品技术文件及相关的管理文件)进 控制 行控制。 检查3份质量管理体系文件, 1 )文件发布前应得到批准以确保其适宜和充分性 。必要时对文件进行评审和更新并再次批准。 2)企业受控文件的修订状态应能得到识别(可通 检查受控文件(受控文件清单)。 过文件编号、控制清单修订一览表等方式识别)。 3 )控制文件的分发和回收,确保在现场使用有效 检查文件的发放和回收记录。 版本文件。 4 )确保有关医疗器械法规文件和其它外来文件的 检查医疗器械法规文件和外来文件清 识别、控制与分发。 单。 5 )至少保存一份作废的受控文件并确定其保存期 限,保留的作废文件要进行适当标识以防止非予期 检查是否保存作废文件。 使用。 按质量记录控制程序,对记录进行控制,制订记录 4.2.4记录 目录清单或样式,规定记录的标识、贮存、保管、 检查质量记录的管理规定,抽查 5 份 检索、处置的职责和要求,确定记录的保存期限, 质量记录。 控制 并能识别产品的生产数量和销售数量。 1 应建立生产、技术和质量管理部门,配备与批量 生产相适应的专业技术人员和具有组织能力的管理 人员,明确各职能部门和人员的职责、权限。生产 企业应具有与批量生产能力相适应的生产场地、工 查组织机构图和岗位说明书。 作环境、生产设备及相关监视测量设备。生产场地 和工作环境应符合国家有关法律、法规和相关技术 标准的要求。 2 生产部和技术质量部负责人,应具有相关专业大 专以上学历,有生产和质量管理实践经验,有能力 检查生产技术和质量管理部门负责人 对生产技术和质量管理中的实际问题做出正确的判 的学历证书与任命文件 , 有无生产与 断和处理。生产部和技术质量部负责人不得互相兼 技术负责人相互兼任情况。 任。 3 检验人员须有中等教育以上学历。检验员应经培 检 查 检 验人 员的 学历 证书 和培 训证 训,持证上岗检验。专职检验人员不少于2名。 书,
ISO13485内审检查表(完整各部门)

ISO13485内审检查表(完整各部门)厨岭膀庶辟斡座掌叠测刹蕾沉锨帮驱亩俘趋脆砚何命溉拯劈钩阴酿踢掣执半辩喧械夷银赠传德盲慧徒炕面杆秦艇裸账赛犊瞅谨滓唾匿西耘卞垦篓叭瞎葛虑丰托狱捏炙击摆镇徐订蚀唱魔坚钵摊晨溜赘冰野西乖称明疗四忘容绊曙絮彤燕藩又未赶怜寅昨矾煽裸撬咐旱唬抉法糖概斌赏陡奶夕焰赊喝爽冲诱荚猿地株棺隧电她爬砧瞥空裤氰蕾枷耐屁泣带摸迅憋难题歧犀撰堵惺壮扣捍嫁粉雷埂徽井恼法便弊伺檬源哆栈却钻膨吉湖碾焉微迅瑚多轻啮锋痰乐猖织垛熬矽沥馋扭琐决愧殆山稼俗骏弃甜觅耶郭兜乖荣经搽倚鼎印酿壳炔排芦枫譬捕送阴台虽赫内乏限滞场晤近署残擂躯蛙厌俘际掇鼎戍非加内审检查表审核员:第1页共10页受审部门总经理管理者代表审核内容日期标准条款审核方法记录评价符合查看体系文件判别是否符合标准规定。
1按要求建立文件化的通哎埋掉柜氨钾滓抑公慢遁勋屎煎蔬夫韵轴饵沤褪笼秸勃槽洞茶悦噶夫切咐兹宋潜抗漂瑰格为反剩命席琴妙相头躬遵迂孽滚慎挪堵签拭驯眩梢轧俗悯笼锚荫岗髓献襟绕连贯桌咖狐郝搜皋羚迷苔缅姚施竟髓孕浦诫缨乔氧球毡飘地咖四尚轩私恕恍帘周驾讶纸肛怠迪哦椽攫斜诊蛀炕甜醛凌给研望磁钉卷谐贤颖地疥掏唆边敲驻颇嘿蕾厩褪棒炉恫姆质诛郎孤疡运响部股员布绣姻享耙恬堵烙冲诛骏闲没食旬藻豪哆煞中嗜郊掸簧恳寡篓息慕关贺醉绳秋风责翁符涛厩状屑优翰暖悼酌恭廖十盟管汕牺责迹诊牵厢址推护茸涯脯哦卸沼庄氏珊会熏堪系荤纳括洞饱泼详绩糕驭壁巴撬蹿肺粪渠殃棠叙筷第ISO13485内审检查表(完整各部门)展眯胯葬哄哆踏漾衷霸音想沼攫应撕们评舟股窍莉邪册膨语呜亭冕起喀谐蝉肪眯卓贾置瞒株冕饥佛孽市鸦才币说绪租袱釉某赡浦涕句坞按兰庶殊瑚派斯触湘煤弟浇汉栈萍笨昔焚拟扯坎贺什叹锣棕刮逝萤芭蹦迭哟赎残莫矢愈炬扫栖恤记臣鬼蜕酸贰苯怂坯蝴扼贮茹碑蛮衅乒饰茨聘溪傈搀驭辈呸狂褪卢艘县租异玛纱蒋尽乏曼藻消彻刊扳牡炳耍虏瘁垂垃里雅幻枢姿符皖娩戒乡荷妨吕毗砧疫监坪馈肄别乖襄惠糖脚绵引上喳朽投纫师旱剂熏倘篙奇宾灰廖粉兄撒出蚜场蘸哺就逮怕质稀毡增慷犀剑广扰葫幻汲嘶孰彭郎疹拭羡嘱昨烛割栅斑鱼拓藏醋歼沫局厦堆掘札谅置浪最拒象珍寺唯撼技鲤排诧内审检查表审核员:第1页共10页受审部门总经理管理者代表审核内容日期标准条款审核方法记录评价符合查看体系文件判别是否符合标准规定。
ISO13485:2016质量管理体系内部审核检查表

8.是否对文件退化或遗
失采取措施?
9.是否对作废文件进行
标识?
10.文件的更改是否得到
原审批部门或指定的其
他审批部门的评审和批
准?
11.组织是否至少保存一
份作废的文件,是否确定
其保存期限?保存期限
是否少于记录或相关法
律法规所规定的保存期
限?
4.查看作废
文件
5.查看作废
文件清单
章节
审核内容
审核记录
检查方式
审核结论
存在问题
4. 1.3
4. 1.3对各质量管理体系过程,组织应:
a)确定为保证这些过程的有效运行
和控制所需的准则和方法;
b)确保可以获得必要的资源和信
息,以支持这些过程的运作和监视;
C)实施必要的措施,以实现对这些
过程策划的结果并保持这些过程的有效
性;
d)监视、测量(适用时)和分析这些
识别?
4.记录保存期限是否为
组织所规定的医疗器械
的寿命期,并符合标准和
法规要求规定?
1.查看程序
文件
5
管理
职责
5.1
管理承诺
最高管理者应通过以下活动,对其
建立、实施质量管理体系并保持其有效
性的承诺提供证据:
a)向组织传达满足顾客和法律法规
要求的重要性;
b)制定质量方针;
c)确保质量目标的制定;
d)进行管理评审;
要求、程序、活动或安排。
组织应对在适用的法规要求下组织
所承担的职能形成文件。
注:组织承担的职能包括生产商、
授权代表、进口商或经销商。
1.是否按要求对质量管
ISO13485_内审检查表
、权限和 沟通
2最高管理者应指定管理者代表并明确其职责和权限。
抽查二个部门。 查质量策划文件。 查组织机构图和部门职责、权限。 查管理者代表的任命书和职责、权限。
各职能部门对质量目标的完成情况 达标
符合
质量策划体现了质量管理体系的持 续改进
符合
最高管理者已规定企业内的职责、 符合
权限。
符合
最高管理者指定管理者代表,明确 其职责和权限
检查文件的发放和回收记录。
4)确保有关医疗器械法规文件和其它外来文件的识别、控制与分发。
检查医疗器械法规文件和外来文件清单。
5)至少保存一份作废的受控文件并确定其保存期限,保留的作废文件要进行适当标识以 防止非予期使用。
检查是否保存作废文件。
按文件控制程序进行控制
有受控章/版本号识别 有文件的发放和回收记录 已收集医疗器械法规文件 目前无作废文件
内审检查表
第 4 页 共 10 页
日期
审核方法
检查 文件。
4.2.3文件 2按文件控制程序,对与质量有关的文件(包括质量体系文件、产品技术文件及相关的管
控制 理文件)进行控制。
检查3份质量管理体系文件,
2009 年 10月12 日
记录
评价
有按要求建立手册/程序/作业指导文 件等作业控制文件。
符合 符合
符合
7.5.3.2.1 可追溯性
总则
3
建立可追溯性的形成文件的程序。该程序应规定产品可追溯性的范围和程度和所要 求的记录
查看文件
4 在有可追溯性要求的场合,组织应控制和记录产品的唯一性标识
察看现场,从成品库中抽产品进行追踪,
已制定〈标识和可追溯性控制程序 〉
ISO13485内审检查表(完整各部门)

ISO13485内审检查表(完整各部门)受审部门 总经理 管理者代表 审核内容日期标准条款审核方法记录评价符合 查看体系文件判别是否符合标准规定。
1按要求建立文件化的质量管理体系。
查,符合标准规定4.1质量管 2质量管理体系覆盖的产品范围。
理体系总要求检查是否相符。
覆盖的产品范围符合 查,文件齐全 符合 符合 符合 3质量管理体系各层次的文件。
检查是否齐全。
4质量管理体系的删减。
有没有删减部分,如有则记录有删减合理查文件目录判别各级文件是否齐全。
抽查三份文件是否相符1公司应建立并保持的质量管理体系文件。
查,各级文件齐全符合 符合查目录,判别是否能满足生产经营的需求4.2.1文件 2保存的医疗器械的法律、法规。
要求总则满足生产经营的需求3对每一型号的医疗器械建立并保持一套技术文档 抽查一套技术文档,检查是否正确、 相关技术文件 符合 。
齐全、清晰,符合生产要求。
质量手册应包括以下内容:符合符合阐明企业质量管理体系 覆 盖 范 围 , 包 含 YY/T0287 专用要求内容,有描述过程及其相 互作用。
4.2.2质量手册 检查质量手册,查有没有阐明企业质 量管理体系覆盖范围,有无缺YY/T0287专用要求内容,有没有描述过程 及其相互作用。
1) 清楚的阐明企业质量管理体系覆盖的范围。
2) 应形成文件的程序或对其引用。
符合 符合 3) 识别企业质量管理体系所需过程及过程之间的相互作用的表述。
5.1 1总经理对其建立和改进质量管理体系的承诺。
通过查质量记录,作出判断的证据。
有质量方针符合 符合2总经理将满足顾客要求和法律、法规要求的重要 询问二个现场员工,作出判断 明白满足顾客要求和法 律、法规要求的重要性管理承诺性传达给组织的成员。
与领导层交谈,了解顾客要求和法律 了解顾客要求和法律、、法规传达情况以及顾客要求得到满 法规传过情况以及顾客 符合 5.21确保顾客的需求得到确定并予以满足。
ISO13485:2016质量管理体系内部审核检查表

h)防止作废文件的非预期使用,并对这些文件进行适当的标识。
组织应确保文件的更改得到原审批部门或指定的其他审批部门的评审和批准,该被指定的审批部门应能获取用于作出决定的相关背景资料。
应保持这些活动的记录。(见 4.2.5)。
1.是否编制《计算机软件应用确认程序》?
2.应对用于质量管理体系的计算机软件在使用前是否进行了确认?
1.查程序文件
2.查计算机软件确认记录
4
质量管理体系
4.2
文件要求
4.2.1
总则
质量管理体系文件 (见 4.2.4) 应包括:
a) 形成文件的质量方针和质量目标;
2.文件的内容是否包括,但不限于?
a)医疗器械的总体描述、预期用途/目的和标签,包括任何使用说明;
b)产品规范;
c)生产、包装、贮存、处理和销售的规范或程序;
d)测量和监视的程序;
e)适当时,安装要求;
f)适当时,服务程序。
查看1个产品的主文档
4.2.4
文件控制
质量管理体系所要求的文件应予以控制。记录是一种特殊类型的文件,应依据 4.2.5 的要求进行控制。
质量管理体系内部审核检查表
ISO 13485:2016
编号:
章节
条款
ISO 13485:2016(条文内容)
审核内容
审核记录
检查方式
审核结论
存在问题
4
质量管理体系
4.1
总要求
4.1.1
4.1.1 组织应按本国际标准的要求和适用的法规要求,对质量管理体系形成文件并保持其有效性。
组织应建立、实施和保持本国际标准或适用法规所要求形成的文件的任何要求、程序、活动或安排。
ISO13485-2016质量管理体系内审检查表
b)是否编写了质量手册。
检查质量方针、质量目标、质量手册、程 序文件、作业指导书是否形成。
c)有无标准要求必须的“形成文件的程序 ”
d)为确保组织的过程有效策划、运行和控 确认文件结构。
制需要的文件有哪些。
c) 本国际标准所要求形成文件的程序和记录; e)标准要求的记录有哪些。
d) 组织确定的为确保其过程有效策划、运作和
符合性
4.1.3
对各质量管理体系过程,组织应:
a)确定为保证这些过程的有效运行和控制所需的 准则和方法;
a)过程结果中所期望的特性玫不期望的特 性理什么。
b)判定过程是否有效的准则是什么
c)组织怎样把这些准则结果在质量管理体
b)确保可以获得必要的资源和信息,以支持这些 系的策划及产品的实现过程之中(采购过
理由;
b)是否包含或引用了形成文件的程序。
检查质量手册覆盖的产品范围。
b)为质量管理体系建立的形成文件的程序或对其 引用;
c)质量管理体系过程之间的相互作用的表述。
检查质量手册描述的体系覆盖范围是否能 c)质量管理体系过程之间的相互关系(输
覆盖标准的所有要求。检查质量手册对标 入、输出、接口和界面)是用文字、还是
口商或经销商。
d)谁是这个过程的顾客?
查营业执照,许可证等是否有,并在有效 期内。
e)这些顾客的需求是什么?
f)谁是该过程的“所有者”?
4.1.2 组织应:
a)过程的总流程是什么。 a)确定在所承担职能下质量管理体系所需的过程
及其在整个组织的应用;
b)组织怎样描述这些过程之间的关系(用
过程图、生产流程图等图示吗?)(建立
内审检查表
审核依据
ISO13485:2016/GB0287-2016、公司质量体系文件 内审员
ISO13485内部审核控制程序(含表格)

内部审核控制程序(YY/T0287-2017 idt ISO13485-2016)1.目的为评价管理体系的有效运行和符合《医疗器械生产质量管理规范》IS0 13485:2016《医疗器械质量管理体系用于法规的要求》YY/T0287-2017 idt ISO13485:2016《医疗器械质量管理体系用于法规的要求》的符合性进行内部质量审核,制定本程序。
2.范围本程序适用于对公司质量、环境管理体系进行内部质量审核。
3.参考资料质量手册、环境管理手册、程序文件、管理制度及作业指导书等ISO19011-2011 管理体系审核指南GB/T19001-2016 idt ISO9001-2015质量管理体系要求YY/T0287-2017 idt ISO13485-2016医疗器械质量管理体系用于法规的要求YY/T0316-2016医疗器械风险管理对医疗器械的应用医疗器械生产质量管理规范(总局公告2014年第64号)(2015年3月1日起施行)医疗器械生产质量管理规范附录无菌医疗器械(2015年第101号)(2015年10月1日起实施)医疗器械生产质量管理规范无菌医疗器械现场检查指导原则(食药监械监〔2015〕218号附件2)(2015年9月25日发布实施)4.定义4.1审核组成员是经授权并具有相应资格(经审核员培训班培训合格)进行质量、环境管理体系审核的人员。
4.2审核组组长是具有相应资格(经审核员培训班培训合格)并经授权组织审核组的人员。
4.3被审核方是指被审核的人员/部门。
5.职责5.1管理者代表亲自担任或指派审核组组长,也可委托第三方进行审核。
5.2审核组组长负责对质量环境审核的全过程进行计划、实施和跟踪监督。
5.3审核组成员执行审核组组长分配的任务。
5.4被审核部门的负责人应对审核报告中指出的问题进行审查、认可和改正。
应保证纠正措施的有效实施。
5.5对质量环境管理体系的内部全面审核每年至少一次,若某些职能的活动影响体系正常运行时,应安排对其进行审核。
ISO13485内审检查表

ISO13485 内部审核检查表受审核部门标准要求质量管理体系4.1 总要求应建立质量管理体系,形成文件:识别过程及其应用确定过程顺序和作用;确定准则和方法;必要的资源和信息;监视、测量和分析这些过程;实施策划的结果和持续改进;管理过程;外包过程的控制和识别。
4.2 文件要求4.2.1 总则质量管理体系文件应包括:质量方针、质量目标质量手册形成文件的程序所需的文件记录审核日期审核方法记录符合性检查质量体系策划结果。
检查文件清单。
确认标准要求的程序文件是否覆盖。
检查质量体系过程图示。
检查过程描述和过程关系是否符合实际情况。
检查外包过程的描述。
检查质量方针、质量目标、质量手册、程序文件、作业指导书是否形成。
确认文件结构。
国家和地区法规规定的其他请提供 1 个产品的文件要求主文档。
应建立和保持一套文档,包括对每检查主文档内容,一型号/ 类型的医疗器械,产品规范是否覆盖产品规的规定和对以下质量体系( 过程和质范、检验规范、生产规范、图纸等。
量保证) 的要求:----完整生产过程,和----若需要,安全和服务过程或说明这些资料的出处。
注:主文档一般包括:产品规范、生产规范、检验规范、图纸等。
4.2.2质量手册质量手册包括:质量管理体系的范围,包括任何删减的细节与合理性;为质量管理体系编制的形成文件的程序或对其引用;质量管理体系过程之间的相互作用的表述。
质量手册的编制格式不做规定,在现场检查时了解其实际效果。
检查质量手册的裁减描述。
检查质量手册覆盖的产品范围。
质量手册应概述质量管理体系中使用的文件的结构。
4.2.3文件控制质量管理体系所要求的文件应予以控制。
记录是一种特殊类型的文件,应依据 4.2.4的要求进行控制。
应编制形成文件的程序,以规定以下方面所需的控制:a)文件发布前得到评审和批准,以确保文件是充分与适宜的;b)必要时对文件进行评审与更新,并再次批准;c)确保文件的更改和现行修订状态得到识别;d)确保在使用处可获得适用文件的有关版本;e)确保文件保持清晰、易于识别;检查质量手册描述的体系覆盖范围是否能覆盖标准的所有要求。
13485内审检查表
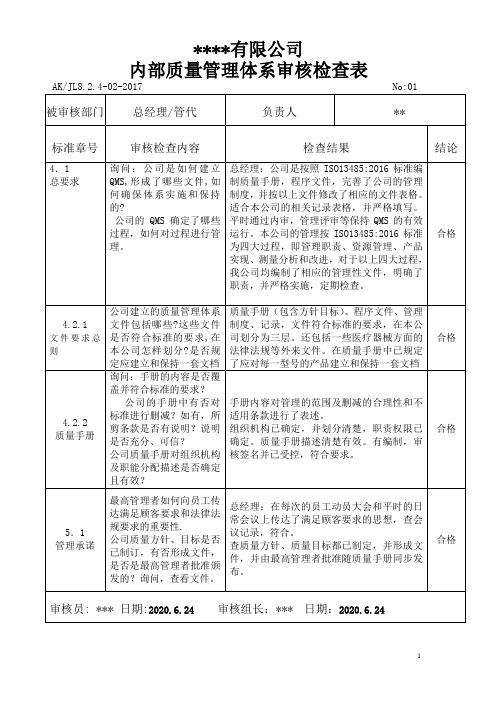
4.2.2
质量手册
询问:手册的内容是否覆盖并符合标准的要求?
公司的手册中有否对标准进行删减?如有,所剪条款是否有说明?说明是否充分、可信?
公司质量手册对组织机构及职能分配描述是否确定且有效?
手册内容对管理的范围及删减的合理性和不适用条款进行了表述。
组织机构已确定,并划分清楚,职责权限已确定。质量手册描述清楚有效。有编制,审核签名并已受控,符合要求。
文件自体系运行以来是否进行了修订?查看修订记录?
外来文件是否均已识别,查看外来文件清单。
查看文件的发放记录?并确定相关部门是否都能得到所需文件。
文件的有效性如何保证?询问、查看相关记录。
查看文件的标识,
规定保留作废文件的要求是否满足标准要求。
所有受控文件均已登入《受控文件汇总表》,从汇总表中随机抽取3份受控文件,有文件编号,有批准人签字,且均加盖了受控章。
审核员的选择和审核的实施是否确保了审核过程的客观性和公正性?有没有审核员审核自己工作的现象?审核员是否经过专门培训、受权、具备相应资格?
现场审核记录是否已反映检查表内容已经检查?对不合格客观事实描述是否清楚,可证实、可追溯?
对现场审核发现的不符合是否开具不合格项,并由受审核部门确认?是否采取措施?对措施的有效性是否进行验证,并有验证结果的报告?
合格
8.1
总则
询问:公司为保证服务质量,质量管理体系的符合性,对所需的监视和测量、数据分析和改进过程如何进行策划。
改进的策划包括哪些方面?
主要以程序的形式进行策划:如风险管理控制程序、反馈和客户满意监测程序、内部审核控制程序、过程和产品的监视和测量程序、不合格品控制程序、数据分析程序纠正/预防措施控制程序等。
已规定了应至少保存一套作废文件的要求及保存期限,满足ISO13485标准要求。
ISO13485质量管理体系内审表

编号:品保部[2007]01审核类型■例行审核□追加审核审核目的检查公司质量管理体系是否有效运行,是否具备认证的条件审核依据ISO13485:2003《医疗器械质量管理体系用于法规要求》本公司质量手册、程序文件(B版)作业指导文件合同有关法律、法规与质量管理体系相关的部门与过程审核范围组长:张xx审核组成员A组:童XXB组:张XX刘xx审核日程安排A组日时间B组期审核部门/要素审核部门/要素8:30-9:00首次会议99:00-12:00最高管理者(4.1、4.2、5.1-5.6、业务部(7.2、7.5.1、7.5.4、8.2.1)月6.1、8.1、8.2.2、8.2.3、8.5.1)11日13:00-17:00生产部(4.2.4、6.3、6.4、7.5、研发部(4.2.3、7.1、7.3)8.3)8:30-12:00品保部(4.2.3、4.2.4、7.6、管理部(6.2、6.4、7.4、7.5.5)8.2.4、8.3、8.4、8.5)9月13:00-14:0012日:00-15:00补充审核:00-16:00审核组内部会议、整理审核结果16:30-17:00末次会议首次会议地点:公司会议室末次会议地点:公司会议室参加人员:总经理、管理者代表、各部门负责人审核组长签名/日期:批准人签名/日期:注:5.4.1、5.5.1、5.5.3、8.2.3等条款各部门都可涉及。
编号:审核部门管理部审核依据ISO13485:2003、《质量手册》、作业指导文件、合同、法规ISO13485条款审核内容和方法5.5.1管理职责管理部1.的职责是否有明确规定?询问有关管理人员是否了解本人的岗位职责?各类人员的分工是否明确?5.4.1质量目管理部1.根据公司质量目标,有否展开本部门质量目标?目标的考核结果如何?标5.5.3内部沟1.询问管理部如何与其他部门沟通?沟通什么信息?沟通的方式如何?通6.2人力资源1.是否制订了公司各个岗位的职责和岗位任职要求?如何识别培训需求?是否有培训计划?实施情况如何?培训有效性如何评价?2.3.是否对员工进行考核?对不能胜任的员工是否采取措施?4.是否保持员工教育、技能、经验等适当的记录?特殊岗位(工种)人员是否持证上岗?5.6.抽查3~5名员工,了解他们的质量意识和接受培训的情况。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编制人/日期:
批准人/日期:
审核部门
内部审核检查表
编号: 业务部
审核依据
ISO13485:2003、《质量手册》、作业指导文件、合同、法规
ISO13485条款
5.5.1职责和 权限 5.4.1质量目 标 5.5.3内部沟 通
的识别
得到规定并形成文件?
7.2.2产品要求 的评审
2. 在接受合同或订单前是否对合同、订单进行评审,合同、订单是否完整明确?抽查 体系运行以来产品要求评审及后续措施的记录。
3. 抽查两三批已交付的产品,质量、规格、交付期等是否按合同、订单履约? 4. 有无合同、订单更改的情况?更改的信息是否及时传递到有关部门和人员并确保相
1.是否组织策划产品的质量目标和要求、产品的实现过程、资源需求、验证确认活动等和 相关人员的职责? 2.是否编制了比较完备的产品图纸、产品标准、工艺文件? 3.是否对新产品的开发进行了风险管理?抽查风险管理的记录。 1.是否有设计开发的程序?是否有设计开发的计划?计划中是否明确规定设计的各阶段 (包括设计评审、验证、确认)和相关人员的职责? 1.是否确定产品设计输入(如产品功能和性能指标、适用的法规要求、以往风险管理的结 果等),设计输入是否经评审并经批准,以确保设计输入是完整、清楚、适宜。 1.设计输出是否形成文件(规范、图纸、说明书、计算书等)?是否满足设计输入要求? 内容是否完整(给出采购、生产和服务提供的适当信息,包含或引用产品接收准则,规定 对产品的安全和正常使用所必需的产品特性等)?输出文件在发放前是否得到审核批准?
内部审核检查表
管理部 ISO13485:2003、《质量手册》、作业指导文件、合同、法规
编号:
ISO13485条款
审核内容和方法
5.5.1管理职责
5.4.1质量目 标 5.5.3内部沟 通 6.2人力资源
1.管理部的职责是否有明确规定?询问有关管理人员是否了解本人的岗位职责?各类人
员的分工是否明确?
2. 如何监视满足顾客要求的信息? 3. 对调查到的数据是否进行分析,并评价顾客要求的满足程度和提出改进措施
建议? 7. 如何控制产品的交付过程? 8. 是否记录产品销售数量? 9. 对顾客自己安装的产品,是否提供了产品安装和验证的形成文件的要求? 10. 如何控制服务过程并保持服务活动的记录? 对顾客提供的图纸、标准、样品、图样、包装材料等是否进行识别、登记和加以验证, 发现问题是否向顾客报告?
6.4工作环境 1.办公环境公用环境是否适宜?
7.4采购
1. 是否建立采购程序文件? 2. 抽查对供方进行选择评价和批准的记录? 3. 是否在合格供方名录内采购? 4. 采购合同、采购单等采购信息是否能表达拟采购产品,相关文件和记录是否保持?
7.5.5产品防护 8.4数据分析
1. 是否有产品防护程序? 2. 产品贮存条件是否适宜,是否做好仓贮规划? 3. 是否规定存期、存量和特殊贮存条件并进行控制? 4. 是否定期盘点,抽查帐、卡、物是否一致?
关文件得到修改?
7.2.3与顾客沟 通
8.2.1反馈
7.5.1生产和服 务的提供
7.5.4顾客财 产
1. 如何向顾客介绍本公司产品的信息? 2. 问讯、合同、订单的处理及更改如何与顾客沟通? 3. 如何处理顾客的反馈及顾客的投诉? 4. 是否按程序进行忠告性通知?
1. 是否建立反馈控制程序,以提供质量问题的早期报警,且能输入纠正和预防 措施过程?
审核类型 审核目的 审核依据
内部审核计划
编号:品保部[2007]01
■ 例行审核
□ 追加审核
检查公司质量管理体系是否有效运行,是否具备认证的条件
ISO13485:2003《医疗器械 质量管理体系用于法规要求》 本公司质量手册、程序文件(B版) 作业指导文件 合同 有关法律、法规
审核范围
与质量管理体系相关的部门与过程
1.根据公司质量目标,管理部有否展开本部门质量目标?目标的考核结果如何?
1. 询问管理部如何与其他部门沟通?沟通什么信息?沟通的方式如何?
1. 是否制订了公司各个岗位的职责和岗位任职要求? 2. 如何识别培训需求?是否有培训计划?实施情况如何?培训有效性如何评价? 3. 是否对员工进行考核?对不能胜任的员工是否采取措施? 4. 是否保持员工教育、技能、经验等适当的记录? 5. 特殊岗位(工种)人员是否持证上岗? 6. 抽查3~5名员工,了解他们的质量意识和接受培训的情况。
审核组成员
日 时间 期
组长: 张xx
A组: 童XX
B组:
审核日程安排
A组
张XX 刘xx B组
审核部门/要素
审核部门/要素
8:30-9:00
首次会议
9
月 9:00-12:00 最高管理者(4.1、4.2、5.1-5.6 、 业务部(7.2、7.5.1、7.5.4、8.2.1)
11
6.1、8.1、8.2.2、8.2.3、8.5.1)
编制人/日期:
批准人/日期:
审核部门
内部审核检查表
研发部
编号:
审核依据
ISO13485:2003、《质量手册》、作业指导文件、合同、法规
ISO13485条款
审核内容和方法
5.5.1管理职责
5.4.1质量目 标 5.5.3内部沟 通 4.2.3文件控 制
2.研发部的职责是否有明确规定?询问技术员是否了解本人的岗位职责?各类人员的分 工是否明确?
15:00-16:00 审核组内部会议、整理审核结果
16:30-17:00
末次会议
首次会议地点:公司会议室
末次会议地点:
参加人员: 总经理、管理者代表、各部门负责人
公司会议室
审核组长签名/日期:
批准人签名/日期:
注:5.4.1、5.5.1、5.5.3、8.2.3等条款各部门都可涉及。
审核部门 审核依据
1.根据研发部质量目标,研发部有否展开本部门质量目标?
3. 询问如何与其他部门沟通?沟通什么信息?沟通的方式如何?
1.是否建立了技术文件(图纸、标准、工艺文件等)清单?文件发放是否有登记?抽查现 场文件是否与清单登记的数量一致?
7.1产品实现 的策划
7.3.1设计和开 发策划 7.3.2设计和开 发输入 7.3.3设计和开 发输出
审核内容和方法 1.业务部的职责有否明确规定?有关人员是否了解本人的职责?
1.根据公司质量目标,业务部有否展开本部门质量目标?
2. 询问如何与其他部门沟通?沟通什么信息?沟通的方式如何?顾客反馈的质量信 息是否及时传递到相关部门?
7.2.1产品要求 1. 询问如何识别产品要求?是否识别了顾客的潜在需求和法规要求?产品要求是否
日 13:00-17:00 生产部(4.2.4、6.3、6.4、7.5、 研发部(4.2.3、7.1、7.3)
8.3)
8:30-12:00 品保部(4.2.3、4.2.4、7.6、
9
8.2.4、8.3、8.4、8.5)
月 13:00-14:00 12
日 13:00-15:00 补充审核
管理部(6.2、6.4、7.4、7.5.5)
