青蒿素的化学全合成
青蒿素合成

青蒿素是一种有效的抗疟药物,其化学结构为二氢青蒿素。
以下是青蒿素的合成过程:
1. 制备芳香醛:首先,通过苯甲酸和氯化亚铁的反应,制备出芳香醛。
2. 制备芳香酸:将芳香醛和氧化铬反应,制备出芳香酸。
3. 合成二氢青蒿素:将芳香酸和丙烯酸异丙酯反应,生成酯化产物。
然后,通过还原、环化、氧化、脱羧等反应,最终得到二氢青蒿素。
4. 转化为青蒿素:将二氢青蒿素与过氧化丙酮反应,进行环氧化反应,得到青蒿素。
需要指出的是,青蒿素的合成过程非常复杂,需要高超的化学技术和仪器设备,因此一般由专业化学厂商生产。
有机合成课件——Chapter 10 紫杉醇和青蒿素的全合成

O H OBz OAc (1)
R 4O
OR 5
O OR
O
OR
AcO
O OR
AcO
O OR
HO
OH (7)
H
OR2 OR3
O X
O
H
OR2 OR 3
O X
H O (5)
OR 2 OR 3
O X
H O
OAc
O
(6)
(4)
12
10.1 紫杉醇的全合成
逆合成分析
R 4O OR 5 OR A H OR 2 OR 3 NNHSO 2Ar (9) OR4 R 5O OR C O (10) OR 2 OR 3
O O
AcO
O OTES CSA, MeOH, 25 ° C, 10 min
10
10.1 紫杉醇的全合成
Nicolaou的全合成路线
美国加利福尼亚大学圣迭戈分校Kyfiacos Costa Nicolaou教授 领导的研究小组1994年10月报了一条紫杉醇全合成的路线。 Nicolaou法采非常简明的会聚式合成战略,先分别得到含六 元的A环化合物和C环化合物,然后通过反应将A环与C环连 接起来并形成在其中间的含有8元环的B环,这样就得到了含 有ABC环的化合物,最后完成D环的构建并连接上侧链。
O Ph Ph OH HO taxol NH O O AcO O OH
A
B
C
DO H OBz OAc
10.1 紫杉醇的全合成
逆合成分析
O Ph Ph OH HO NH O O AcO A O OH B C HO HO O H OAc OBz (2) HO O H OAc OBz (3) AcO O OR AcO O OR
青蒿素生物合成

青蒿素生物合成10生物技术(2)班曾庆辉201024112211青蒿素是我国科研人员从传统中医药黄花蒿中提取出来并自主研发的一种抗疟疾特效药[1]。
20世纪70年代,我国科技工作者从黄花蒿中分离提纯出一种抗疟活性单体——青蒿素,以后又确定了它的分子结构和构型。
1986年我国自主研发的蒿甲醚油针剂、青蒿琥酯钠盐的水针剂以及青蒿素栓剂等抗疟疾药作为一类新药在我国批准生产。
1995年蒿甲醚率先被收入国际药典,这是我国首次得到国际认可的自主研发新药。
目前,青蒿素系列抗疟药已有5种新药(青蒿素、青蒿琥酯、蒿甲醚、双氢青蒿素、复方蒿甲醚)共9种剂型上市并在世界各国销售,每年挽救了数百万重症疟疾患者的生命。
除了独特的抗疟作用外,青蒿素系列药物还具有抗血吸虫、肺吸虫、红斑狼疮、皮炎以及免疫调节,抗流感等多种疗效[2]。
但是,目前国际抗疟药市场上青蒿素类药物只占有很少的份额,其原因主要在于青蒿素原料缺乏。
由此,有研究者另辟蹊径,设想通过生物合成青蒿素。
时至今日,青蒿素的生物合成已经取得一定进展,介绍如下:早在20世纪80年代,中国科学院上海有机化学研究所汪猷院士领导的研究小组就利用放射性同位素标记的2-14C-青蒿酸与青蒿匀浆(无细胞系统)保温法证明,青蒿酸和青蒿 B 是青蒿素的共同前体[3]。
青蒿素生物合成途径仅见于青蒿,但其“上游”途径为真核生物所共有,可望通过“下游”途径重建,在真核微生物(如酵母)中全合成青蒿素。
过去10年来,青蒿素合成基因被国内外研究团队陆续克隆并导入酿酒酵母细胞,已成功合成青蒿酸及双氢青蒿酸等青蒿素前体。
由于酵母缺乏适宜的细胞环境,尚不能将青蒿素前体转变成青蒿素。
因此,青蒿依然是青蒿素的唯一来源,凸显出继续开展青蒿种质遗传改良的必要性。
同时,青蒿素生物合成的限速步骤尤其是终端反应机制已基本得到阐明,有助于开展青蒿素形成与积累的环境模拟及仿生,从而为彻底缓解青蒿素的供求矛盾创造先机[4]。
合成生物学及青蒿素合成
什麼是IGEM??
国际基因工程机器大赛IGEM
IGEM是International Genetically Engineered Machine competition(国际基因工程机器大赛)的缩写,是国际上合 成物学领域的顶级大学生科技赛事。合成生物学史近年来生命 科学领域的新兴方向,其目标是希望通过重组现有的基于DNA 序列的功能组件,如调控序列,RNA,蛋白质等,实现对生命 科学研究或者对生产生活有意义的新的菌种。这个方向直接搭 建起了基础生物研究和生产生活实践之间的桥梁,有些成果甚 至直接转化成产品,所以同时受到了学术界和工业界的关注。
青蒿素的生物合成
• 青蒿素是当今普遍使用的最有效抗疟疾药 物,与从植物青蒿中直接提取青蒿相比, 通过生物工程菌如酵母发酵生产青蒿素, 成本低很多。不仅如此,合成生物学的发 展不仅使得青蒿素的合成工艺更加简单, 而且也有助于扩展这种药物的药效。
青蒿素的生物合成
美国科学家合成青蒿素的前 体物质青蒿酸
合成生物学及青蒿素合成
Contents
1
合成生物学概述
2
合成生物学原理
3
青蒿素的合成
4
IGEM大赛
生命1.0版本
• 早在36亿年前,微小的生命就已经诞 生,他们通过自我复制繁殖个体,并 在遗传变异和自然选择下进化成了今 天成百上千的物种
• 生命学家将这种自然演化的有机体称 为生命1.0版本
生物大家族中的新成员
美国加利福尼 亚大学伯克利分校 化学工程学的教授 Jay Keasling及 其同事最近成功地 用转基因酵母合成 了青蒿素的前体物 质———青蒿酸, 有望大幅增加青蒿 素产量,有关论文 发表在《自然》杂 志上。
青蒿素——精选推荐
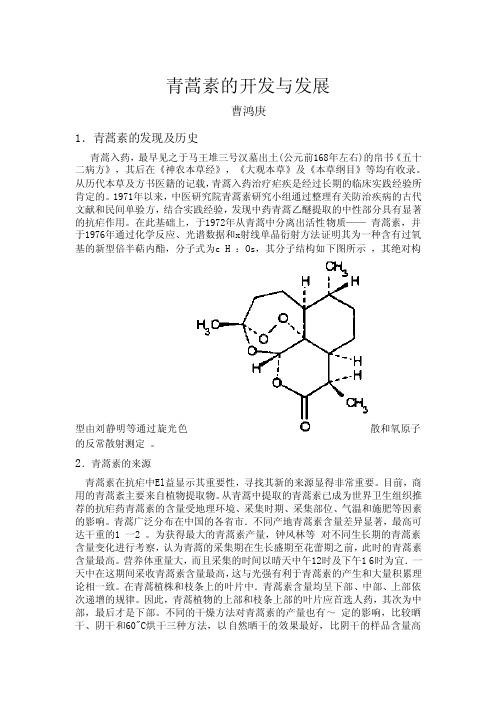
青蒿素的开发与发展曹鸿庚1.青蒿素的发现及历史青蒿入药,最早见之于马王堆三号汉墓出土(公元前168年左右)的帛书《五十二病方》,其后在《神农本草经》,《大观本草》及《本草纲目》等均有收录。
从历代本草及方书医籍的记载,青蒿入药治疗疟疾是经过长期的临床实践经验所肯定的。
1971年以来,中医研究院青蒿素研究小组通过整理有关防治疾病的古代文献和民间单验方,结合实践经验,发现中药青蒿乙醚提取的中性部分具有显著的抗疟作用。
在此基础上,于1972年从青蒿中分离出活性物质——青蒿素,并于1976年通过化学反应、光谱数据和x射线单晶衍射方法证明其为一种含有过氧基的新型倍半萜内酯,分子式为c H :Os,其分子结构如下图所示,其绝对构型由刘静明等通过旋光色散和氧原子的反常散射测定。
2.青蒿素的来源青蒿素在抗疟中El益显示其重要性,寻找其新的来源显得非常重要。
目前,商用的青蒿紊主要来自植物提取物。
从青蒿中提取的青蒿素已成为世界卫生组织推荐的抗疟药青蒿素的含量受地理环境、采集时期、采集部位、气温和施肥等因素的影响。
青蒿广泛分布在中国的各省市.不同产地青蒿素含量差异显著,最高可达干重的1 一2 。
为获得最大的青蒿素产量,钟风林等对不同生长期的青蒿素含量变化进行考察,认为青蒿的采集期在生长盛期至花蕾期之前,此时的青蒿素含量最高。
营养体重量大,而且采集的时间以晴天中午12时及下午1 6时为宜.一天中在这期间采收青蒿素含量最高,这与光强有利于青蒿素的产生和大量积累理论相一致。
在青蒿植株和枝条上的叶片中.青蒿素含量均呈下部、中部、上部依次递增的规律。
因此,青蒿植物的上部和枝条上部的叶片应首选人药,其次为中部,最后才是下部。
不同的干燥方法对青蒿素的产量也有~定的影响,比较晒干、阴干和60"C烘干三种方法,以自然晒干的效果最好,比阴干的样品含量高23.76 在人工栽培中稍加肥料,青蒿植株高大。
青蒿索的含量较野生的略高,且嫩叶比老叶的含量高。
青蒿素合成的新型催化反应研究

青蒿素合成的新型催化反应研究I. 引言青蒿素是一种有效的抗疟疾药物,是由青蒿植物中的青蒿素原产生的。
虽然青蒿素已经被广泛使用了多年,但是仍然存在不足之处,如药效不稳定和合成成本较高等问题。
因此,寻找一种更加高效、成本更低的合成方法尤为重要。
目前,关于青蒿素的合成已有很多研究成果,其中一些是通过催化反应来实现的。
II. 青蒿素的催化合成方法青蒿素的催化合成方法主要分为以下几种:1. 烷基化反应烷基化反应是青蒿素合成中最常使用的一种方法。
这种方法是利用碘化钠作为催化剂,将青蒿素原与某种烷基试剂进行反应得到青蒿素。
尽管这种方法已经在一定程度上改善了青蒿素的合成成本,但是这种方法存在着烷基化反应的副产物无法很好地去除的问题。
2. 氧化偶联反应氧化偶联反应是一种将原有单键转化为双键的反应,采用Pd 催化剂进行反应,主要优点是反应条件温和、反应产物纯度高且不易产生副反应,但是反应时间较长,合成的成本也较高。
3. 氧化联芳偶联反应氧化联芳偶联反应是一种反应,将芳香环上的羟基配体与另一个芳香环化合成新的大环。
这种反应利用Pd催化剂催化反应,并且可以在可控的条件下实现,比氧化偶联反应更加高效且成本更低。
4. 烯基化反应烯基化反应是一种利用铜和银作为催化剂,将青蒿素原进行烷基化反应,并在反应中去除烷基化副产物。
这种反应可以在常温常压下进行,在反应过程中生成的副产物可以在后续反应过程中被进一步去除。
以上几种方法都可以用于青蒿素的合成,具体的选择取决于实验室条件、反应条件及需要的产物纯度等因素。
III. 催化剂的选择在青蒿素的催化合成中,催化剂的选择是非常重要的。
催化剂通常是一个需要使用非常少量的物质,但是可以在反应中提高反应速率和选择性的化合物。
这些化合物可以降低反应温度、提高产物纯度、减少副反应的产生。
需要注意的是,催化剂的选择需要根据反应的需要进行。
例如,对于氧化偶联反应和氧化联芳偶联反应来说,Pd催化剂是一个较好的选择,因为它可以很好地催化反应,同时也可以控制反应的温度和时间,并且具有较高的收率和产物纯度。
青蒿素的合成路线

课题名称青蒿素的合成学生姓名学号一、前言 (3)二、路线设计(逆合成分析) (4)1、逆合成分析一: (4)2、逆合成分析二: (4)3、逆合成分析三: (4)4、逆合成分析四: (5)三、合成路线分析选择 (6)1、路线一 (6)2、路线二 (6)3、路线三 (7)4、路线四 (8)四、合成步骤 (9)五、总结 (11)六、参考文献 (12)青蒿素是我国学者在20世纪70年代初从药用植物黄花蒿中分离得到的抗疟有效成分,是含内过氧基团的倍半萜内酯化合物,是目前世界上最有效的治疗脑型疟疾和抗氯喹恶性疟疾的药物,由于具有速效和低毒的特点,已成为世界卫生组织推荐的治疗疟疾的首选药物。
近年来发现青蒿素除具有抗疟作用外,还有多种其他的药理作用,包括抗细菌脓毒症、放疗增敏、抗菌增敏、抗肿瘤等作用。
青蒿素的化学结构:目前药用青蒿素是从中药青蒿即植物黄花蒿的叶和花蕾中分离获得的,由于青蒿的采购、收获,直至工厂加工提取,环节较多,费时费力,而且不同采集地和不同采集期青蒿品质有很大差别。
同时,大量采集自然资源,必然会破坏环境和生态平衡,导致资源枯竭。
因此对青蒿素进行化学全合成研究,具有重要的经济和社会意义。
目前,青蒿素化学合成有全合成和半合成2种,全合成的原料主要是廉价易得的香茅醛(citronellal)、柠檬烯(isolimonene)、薄荷酮( pulegone)、β-蒎烯(β-pinene)、异胡薄荷醇(isopulegol)等,半合成原料主要是青蒿酸。
全合成原料:半合成原料:二、路线设计(逆合成分析)1、逆合成分析一:此路线是以香茅醛为原料进行合成青蒿素。
2、逆合成分析二:此路线是以异胡薄荷醇为原料进行合成青蒿素。
3、逆合成分析三:此路线是以环己烯酮为原料进行合成青蒿素。
4、逆合成分析四:此路线是以青蒿酸为原料半合成法来合成青蒿素。
三、合成路线分析选择1、路线一此方法是2010年Yadav等以香茅醛为原料的全合成路线,该路线通过脯氨酸衍生物和3,4-二羟基苯甲酸乙酯共催化的香茅醛和甲基乙烯基甲酮( MVK)的1,4 -不对称加成合成中间体2,随后经分子内羟醛缩合可得到不饱和醛酮中间体3。
青蒿素

青蒿素青蒿素是从复合花序植物黄花蒿(即中药青蒿)叶中提取得到的一种无色针状晶体,它的茎中不含药青蒿,化学名称为(3R,5aS,6R,8aS,9R,12S,12aR)-八氢-3,6,9-三甲基-3,12-桥氧-12H-吡喃〔4,3-j〕-1,2-苯并二塞-10(3H)-酮。
分子式为C15H22O5。
青蒿素是继乙氨嘧啶、氯喹、伯喹之后最有效的抗疟特效药,尤其是对于脑型疟疾和抗氯喹疟疾,具有速效和低毒的特点,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”。
基本性质通用名称:青蒿素英文名称:Artemisinin分子式:C15H22O5;分子量:282.33理化性质:无色针状晶体,味苦,在丙酮、、氯仿、苯及冰醋酸中易溶,在乙醇和甲醇、乙醚及石油醚中可溶解,在水中几乎不溶;熔点:156-157℃。
药动学:青蒿素是从中药青蒿中提取的有过氧基团的倍半萜内酯药物。
其对鼠疟原虫红内期超微结构的影响,主要是疟原虫膜系结构的改变,该药首先作用于食物泡膜、表膜、线粒体,内质网,此外对核内染色质也有一定的影响。
提示青蒿素的作用方式主要是干扰表膜-线粒体的功能。
可能是青蒿素作用于食物泡膜,从而阻断了营养摄取的最早阶段,使疟原虫较快出现氨基酸饥饿,迅速形成自噬泡,并不断排出虫体外,使疟原虫损失大量胞浆而死亡。
体外培养的恶性疟原虫对氚标记的异亮氨酸的摄入情况也显示其起始作用方式可能是抑制原虫蛋白合成。
一、制备化学制备化学合成青蒿素难度极大,1986年,中国科学院上海有机所以R(+)一香草醛为原料合成了青蒿素,国外也有类似工作,反应以(-)- 2-异薄勒醇为原料,通过光氧化反应引进过氧基,保留原料中的六元环,环上三条侧链烷基化,形成中间体,最后环合成含过氧桥的倍半萜内酯。
但过程均过于复杂,尚未显示出商业的可行性。
青蒿素的合成途径(一)半合成路线从青蒿酸为原料出发,经过五步反应得到青蒿素,总得率约为35~50%。
①:青蒿酸在重氮甲烷/碘甲烷/酸催化下与甲醇反应,再在氯化镍存在的条件下,被硼氢化钠选择性还原得到二氢青蒿酸甲酯;②:二氢青蒿酸甲酯在四氢呋喃或乙醚溶液中用氢化铝锂还原成青蒿醇;③:青蒿醇在甲醇/二氯甲烷/氯仿/四氯化碳溶液中被臭氧氧化后得到过氧化物,抽干后再在二甲苯中用对甲苯磺酸处理得到环状烯醚;④:环状烯醚溶解于溶剂中,在光敏剂玫瑰红/亚甲基蓝/竹红菌素等存在下进行光氧化合生成二氧四环中间体,再用酸处理得到脱羧青蒿素;⑤:脱羧青蒿素在四氧化钌氧化体系或铬酸类氧化剂的作用下氧化得到青蒿素。
青蒿素提取工艺

青蒿素提取工艺一、基本释义青蒿素英文别名Arteannuin、Artemisinine、Qinghaosu;熔点156-157℃ ( 水煎后分解);MDL号MFCD00081057;青蒿素分子式为C15H22O5,分子量282.33,组分含量:C 63.81%,H 7.85%,O 28.33%。
青蒿素是从植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物。
其对鼠疟原虫红内期超微结构的影响,主要是疟原虫膜系结构的改变,该药首先作用于食物泡膜、表膜、线粒体,内质网,此外对核内染色质也有一定的影响。
提示青蒿素的作用方式主要是干扰表膜-线粒体的功能。
可能是青蒿素作用于食物泡膜,从而阻断了营养摄取的最早阶段,使疟原虫较快出现氨基酸饥饿,迅速形成自噬泡,并不断排出虫体外,使疟原虫损失大量胞浆而死亡。
体外培养的恶性疟原虫对氚标记的异亮氨酸的摄入情况也显示其起始作用方式可能是抑制原虫蛋白合成。
二、提取工艺从青蒿中提取青蒿素的方法是以萃取原理为基础,主要有乙醚浸提法和溶剂汽油浸提法。
挥发油主要采用水蒸汽蒸馏提取,减压蒸馏分离,其工艺为:投料-加水-蒸馏-冷却-油水分离-精油;非挥发性成分主要采用有机溶剂提取,柱层析及重结晶分离,基本工艺为:干燥-破碎-浸泡、萃取(反复进行)-浓缩提取液-粗品-精制。
1、化学合成半合成路线:从青蒿酸为原料出发,经过五步反应得到青蒿素,总得率约为35~50%。
第一步:青蒿酸在重氮甲烷/碘甲烷/酸催化下与甲醇反应,再在氯化镍存在的条件下,被硼氢化钠选择性还原得到二氢青蒿酸甲酯;第二步:二氢青蒿酸甲酯在四氢呋喃或乙醚溶液中用氢化铝锂还原成青蒿醇;第三步:青蒿醇在甲醇/二氯甲烷/氯仿/四氯化碳溶液中被臭氧氧化后得到过氧化物,抽干后再在二甲苯中用对甲苯磺酸处理得到环状烯醚;第四步:环状烯醚溶解于溶剂中,在光敏剂玫瑰红/亚甲基蓝/竹红菌素等存在下进行光氧化合生成二氧四环中间体,再用酸处理得到脱羧青蒿素;第五步:脱羧青蒿素在四氧化钌氧化体系或铬酸类氧化剂的作用下氧化得到青蒿素。
青蒿素的化学全合成.总结

青蒿素的合成与研究进展摘要:青蒿素是目前世界上最有效的治疗疟疾的药物之一,存在活性好、毒副作用小、市场需求大、来源窄等特点。
目前,青蒿素的获取途径主要有直接从青蒿中提取、化学合成和生物合成。
本综述将针对近年来青蒿素的发展特点及合成方法进行论述。
关键词:青蒿素;合成方法;研究进展青蒿素是中国学者在20世纪70年代初从中药黄花蒿(Artem isia annua L1 )中分离得到的抗疟有效单体化合物,是目前世界上最有效的治疗脑型疟疾和抗氯喹恶性疟疾的药物, 对恶性疟、间日疟都有效,可用于凶险型疟疾的抢救和抗氯喹病例的治疗.青蒿素还具有抑制淋巴细胞的增殖和细胞毒性的用1;具有影响人体白血病U937细胞的凋亡及分化的作用2;还具有部分逆转MCF-7/ARD细胞耐药性作用3;还具有抑制人胃癌裸鼠移植瘤的生长的作用4;还具有一定的抗肿瘤作用5等.除此之外,青蒿素及其衍生物还具有生物抗炎免疫作用、生物抗肿瘤作用、抑制神经母细胞瘤细胞增殖的作用等。
世界卫生组织确定为治疗疟疾的首选药物,具有快速、高效、和低毒副作用的特征.6。
因在发现青蒿素过程中的杰出贡献,屠呦呦先后被授予2011年度拉斯克临床医学研究奖和2015年诺贝尔医学奖.1 青蒿素的理化性质及来源青蒿素的分子式为C15H22O5, 相对分子质量为282。
33.是一种含有过氧桥结构的新型倍半萜内酯,有一个包括过氧化物在内的1,2,4-三烷结构单元,它的分子中还包括7个手性中心,合成难度很大.中国科学院有机所经过研究,解决了架设过氧桥难题,在1983年完成了青蒿素的全合成.青蒿素也有一些缺点,如在水和油中的溶解度比较小,不能制成针剂使用等。
2青蒿中提取青蒿素青蒿素是从菊科植物黄花蒿中提取出来的含有过氧桥的倍半萜内酯类化合物,在治疗疟疾方面具有起效快、疗效好、使用安全等特点。
目前主要的提取方法有溶剂提取法、超临界提取法、超声波萃取法、微波萃取法、其他萃取法等。
青蒿素生物合成

青蒿素生物合成10生物技术(2)班曾庆辉201024112211青蒿素是我国科研人员从传统中医药黄花蒿中提取出来并自主研发的一种抗疟疾特效药[1]。
20世纪70年代,我国科技工作者从黄花蒿中分离提纯出一种抗疟活性单体——青蒿素,以后又确定了它的分子结构和构型。
1986年我国自主研发的蒿甲醚油针剂、青蒿琥酯钠盐的水针剂以及青蒿素栓剂等抗疟疾药作为一类新药在我国批准生产。
1995年蒿甲醚率先被收入国际药典,这是我国首次得到国际认可的自主研发新药。
目前,青蒿素系列抗疟药已有5种新药(青蒿素、青蒿琥酯、蒿甲醚、双氢青蒿素、复方蒿甲醚)共9种剂型上市并在世界各国销售,每年挽救了数百万重症疟疾患者的生命。
除了独特的抗疟作用外,青蒿素系列药物还具有抗血吸虫、肺吸虫、红斑狼疮、皮炎以及免疫调节,抗流感等多种疗效[2]。
但是,目前国际抗疟药市场上青蒿素类药物只占有很少的份额,其原因主要在于青蒿素原料缺乏。
由此,有研究者另辟蹊径,设想通过生物合成青蒿素。
时至今日,青蒿素的生物合成已经取得一定进展,介绍如下:早在20世纪80年代,中国科学院上海有机化学研究所汪猷院士领导的研究小组就利用放射性同位素标记的2-14C-青蒿酸与青蒿匀浆(无细胞系统)保温法证明,青蒿酸和青蒿 B 是青蒿素的共同前体[3]。
青蒿素生物合成途径仅见于青蒿,但其“上游”途径为真核生物所共有,可望通过“下游”途径重建,在真核微生物(如酵母)中全合成青蒿素。
过去10年来,青蒿素合成基因被国内外研究团队陆续克隆并导入酿酒酵母细胞,已成功合成青蒿酸及双氢青蒿酸等青蒿素前体。
由于酵母缺乏适宜的细胞环境,尚不能将青蒿素前体转变成青蒿素。
因此,青蒿依然是青蒿素的唯一来源,凸显出继续开展青蒿种质遗传改良的必要性。
同时,青蒿素生物合成的限速步骤尤其是终端反应机制已基本得到阐明,有助于开展青蒿素形成与积累的环境模拟及仿生,从而为彻底缓解青蒿素的供求矛盾创造先机[4]。
天然药物青蒿素的合成及研究进展

天然药物青蒿素的合成及研究进展摘要:青蒿素是目前治疗疟疾的特效药。
本文对自青蒿素发现以来的最新研究进展进行了比较详尽的综述。
内容包括:青蒿素的发现及历史,青蒿素的来源,青蒿素的全合成,青蒿素的生物合成以及植物组织培养生产青蒿素,并对青蒿素生物合成的发展前景进行了展望。
关键词:青蒿素全合成生物合成展望0. 引言青蒿素(artemisine )是从中药青篙(菊科植物黄花蒿的地上部分干燥物)中提取的有过氧基团的倍半萜内酯抗疟新药,是我国发现的第一个被国际公认的天然药物,在其基础上合成了多种衍生物,如双氢青蒿素、蒿甲醚、青蒿琥酯等。
青蒿素类药物毒性低、抗虐性强,被WTO 批准为世界范围内治疗脑型疟疾和恶性疟疾的首选药物[1] 。
而疟疾是严重危害人类健康的疾病之一,据世界卫生组织(WHO )统计,目前世界上仍有90 多个国家为疟疾流行区,全球每年发病人数达3亿〜5亿,年死亡人数达100万〜200万,其中80 %以上的病例发生在非洲,因此对青蒿素的需求量逐年增加。
但目前世界青蒿素药物生产主要依靠我国从天然青蒿中提取,产量受资源、环境和季节的限制,且生产成本高、产量低、难以满足市场需求。
青蒿素虽已能人工合成,但成本高、难度大,也未能投入生产。
因此,为增加青蒿素的资源,世界各国都在加紧开展青蒿素及其衍生物的开发研究,长期稳定地和大量地供应青蒿素成为各国科学家面临的严峻考验近几年,人们试图通过化学合成和生物合成技术来解决青蒿素的生产问题。
本文将对目前国际上青蒿素研究的现状从以下几个方面进行论述。
1.青蒿素的发现及历史青蒿作为药物可以从2000年前,长沙马王堆出土的医书《五十二病》记载中发现,当时是用作治疗痔疮的。
500年后,晋代葛洪《肘后备急方》记载,青蒿就用来进行抗疟治疗了,只不过以前都是把疟疾当成热病。
医药经典著作《本草纲目》也作了同样的记述。
我国对青蒿素的研究始于60年代中期,在周总理亲自批示下,先后组织60多个科研单位和500多员研究人员坚持不懈的深入研究,研究项目包括:新抗疟药物研治、驱蚊药物及措施等,其中包括从中草药中寻找新型药物及对其进行药效筛选。
青蒿素的制备

青蒿素(酸) 含量
培养时间
提纯方法
胞体干重4.5%
4-5天 简单
地上部分干重 0.16% 数月 复杂
总之,转基因酵母菌珠的单位生产效率比青蒿高了近 两个数量级。
THE END
Thank you!
940943高度特异的简并引物青蒿毛状体细胞的互补dna库pcr凝胶凝胶电泳回收等电泳回收等几个特定的p450片段一个青蒿p450基因片段与之对应的mrna完整p450cdnacyp71av1rtpcr转录blast分析法将这些片段与分析法将这些片段与向日葵和莴苣的向日葵和莴苣的ests比对s比对我们惊奇地发现有一个青蒿p450基因片段与来自以上基因片段与来自以上两种植物的未知功能两种植物的未知功能ests序列非常相似序列非常相似青蒿素酸含量胞体干重45地上部分干重016培养时间45天数月提纯方法简单复杂总之转基因酵母菌珠的单位生产效率比青蒿高了近两个数量级
代谢工程:通过基因工程的方法,人为在DNA分子水 平上,改变和控制细胞的代谢,使目的产物大量生成。 即利用重组DNA技术,对生物细胞内固有代谢途径进 行定向改造,赋予细胞新的代谢途径或增强已存在的 代谢途径,尽可能的提高目的代谢产物的代谢产率。
与青蒿一样,酵母是真核生物、 存在糖酵解过程以及甲羟戊酸 途径,但是酵母的生长代谢速 率较青蒿要高出许多,而且其 培养条件容易控制。所以相比 青蒿,酵母体内合成更高效、 高产。
2 J D Keasling. Production of the antimalarial drug precursor artemisinic acid in engineered yeast.Nature,2006, 440:940-943
3 P Covello. Molecular cloning of an aldehyde dehydrogenase implicated in ar temisinin biosynthesis in Artemisia annua . Botany, 2009, 87: 635–642
青蒿素的合成

青蒿素的合成
青蒿素,也叫青蒿素A、青霉素素,是一种从青蒿中提取的有效抗疟疾化合物。
青蒿素的发现和应用是中国科学家屠呦呦的谷物疗法的一部分。
青蒿素是一种非常重要的药物,因为疟疾是世界上最为致命的疾病之一,每年造成数百万人死亡。
青蒿素的合成方法主要是化学合成和半合成两种方法。
化学合成是指通过化学反应来合成青蒿素,这种方法效率较低,成本较高。
半合成是指在天然青蒿素的基础上进行改造,以获得更有效的药物。
半合成方法能够增加药物的效力和纯度,也是目前主要的制药方法。
青蒿素的半合成方法包括多个步骤,其中最重要的是通过合成来提取青蒿素的结构中的两个环。
合成的过程中需要使用多种化学物质和反应,需要高度的技术和研究。
目前,半合成方法已经成为用于制造青蒿素药物的主要方法,也可以通过这种方法来生产更有效的抗疟药物。
- 1 -。
青蒿素完全燃烧的化学方程式

青蒿素完全燃烧的化学⽅程式
分⼦式:C15H22O5,分⼦量:282.33。
C15H22O5+18O2=燃烧=15CO2+11H2O。
青蒿素,分⼦式为C15H22O5,相对分⼦质量282.34。
青蒿素是什么
青蒿素是治疗疟疾耐药性效果最好的药物,以青蒿素类药物为主的联合疗法,也是当下治疗疟疾的最有效最重要⼿段。
但是近年来随着研究的深⼊,青蒿素其它作⽤也越来越多被发现和应⽤研究,如抗肿瘤、治疗肺动脉⾼压、抗糖尿病、胚胎毒性、抗真菌、免疫调节等。
2015年10⽉,屠呦呦因创制新型抗疟药—青蒿素和双氢青蒿素的贡献,与另外两位科学家获2015年度诺贝尔⽣理学或医学奖。
过氧基团反应
青蒿素与三苯基磷反应可以证明青蒿素含有⼀个当量的过氧基,其做法是青蒿素在三苯基磷和⼆甲苯溶液中通氮⽓回流,再加甲醛及⽔搅拌,⽔洗有机层,合并⽔层及酸性溶液,加碱后,⽤⽆过氧化物⼄醚提取,⽆⽔硫酸钠⼲燥,除去⼄醚,测得三苯基磷重量,结果证明消耗三苯基磷克分⼦数与青蒿素相近。
青蒿素的生物合成途径

青蒿素的生物合成途径青蒿素是一种广泛应用于抗疟疾药物中的有效成分,具有强大的抗疟作用。
青蒿素的生物合成途径是指青蒿素在植物体内的合成过程。
本文将介绍青蒿素的生物合成途径,包括植物的生长环境、合成途径的关键酶和反应步骤等。
青蒿素主要来源于中药植物青蒿,也称为黄花蒿。
青蒿一般生长在湿润的环境中,如河边、湖边以及田间。
植物的生长环境对青蒿素的生物合成起着重要的影响。
青蒿素的生物合成途径是一个复杂的过程,涉及多个关键酶和反应步骤。
首先,青蒿素的合成主要依赖于青蒿素A和青蒿素B两个前体物质的合成。
青蒿素A和青蒿素B是由青蒿素酮合成的。
青蒿素酮是青蒿素合成途径中的第一个关键中间产物。
它是由青蒿素酮合酶催化青蒿素酮与二氧化碳结合而成的。
青蒿素酮合酶是青蒿素合成过程中的关键酶,它的活性直接影响着青蒿素的合成速率。
在青蒿素酮合成之后,青蒿素酮会被青蒿素酮还原酶催化还原成青蒿素醇。
青蒿素酮还原酶是青蒿素合成途径中的另一个关键酶,它的活性也对青蒿素的合成起着重要的作用。
在青蒿素醇形成之后,接下来的步骤就是青蒿素的醇化过程。
青蒿素醇首先会发生一个脱水反应,形成青蒿素醛。
然后,青蒿素醛会被青蒿素醛脱氢酶催化脱氢,生成青蒿素酮。
青蒿素酮是青蒿素合成途径中的最后一个关键中间产物,它是青蒿素的最终产物。
青蒿素的生物合成途径包括青蒿素酮的合成、还原和醇化过程。
这个过程涉及多个关键酶和反应步骤,每个步骤都对青蒿素的合成起着重要的作用。
青蒿素的生物合成途径是一个复杂而精细的过程,对于研究和开发抗疟疾药物具有重要的意义。
青蒿素的生物合成途径的研究不仅有助于揭示青蒿素的合成机制,还可以为合成更多青蒿素类似物提供理论依据。
此外,通过深入研究青蒿素的生物合成途径,我们还可以探索新的抗疟疾药物的研发途径,为人类的健康事业做出更大的贡献。
希望今后的研究能够进一步深入,揭示更多关于青蒿素生物合成途径的奥秘。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
青蒿素的合成与研究进展摘要:青蒿素是目前世界上最有效的治疗疟疾的药物之一,存在活性好、毒副作用小、市场需求大、来源窄等特点。
目前,青蒿素的获取途径主要有直接从青蒿中提取、化学合成和生物合成。
本综述将针对近年来青蒿素的发展特点及合成方法进行论述。
关键词:青蒿素;合成方法;研究进展青蒿素是中国学者在20世纪70年代初从中药黄花蒿( Artem isia annua L1 )中分离得到的抗疟有效单体化合物,是目前世界上最有效的治疗脑型疟疾和抗氯喹恶性疟疾的药物, 对恶性疟、间日疟都有效, 可用于凶险型疟疾的抢救和抗氯喹病例的治疗。
青蒿素还具有抑制淋巴细胞的增殖和细胞毒性的用1;具有影响人体白血病U937细胞的凋亡及分化的作用2;还具有部分逆转MCF-7/ARD细胞耐药性作用3;还具有抑制人胃癌裸鼠移植瘤的生长的作用4;还具有一定的抗肿瘤作用5等。
除此之外,青蒿素及其衍生物还具有生物抗炎免疫作用、生物抗肿瘤作用、抑制神经母细胞瘤细胞增殖的作用等。
世界卫生组织确定为治疗疟疾的首选药物, 具有快速、高效、和低毒副作用的特征。
6。
因在发现青蒿素过程中的杰出贡献,屠呦呦先后被授予2011年度拉斯克临床医学研究奖和2015年诺贝尔医学奖。
1 青蒿素的理化性质及来源青蒿素的分子式为C15H22O5, 相对分子质量为282. 33。
是一种含有过氧桥结构的新型倍半萜内酯,有一个包括过氧化物在内的1,2,4-三烷结构单元,它的分子中还包括7个手性中心,合成难度很大。
中国科学院有机所经过研究,解决了架设过氧桥难题,在1983年完成了青蒿素的全合成。
青蒿素也有一些缺点, 如在水和油中的溶解度比较小, 不能制成针剂使用等。
2 青蒿中提取青蒿素青蒿素是从菊科植物黄花蒿中提取出来的含有过氧桥的倍半萜内酯类化合物,在治疗疟疾方面具有起效快、疗效好、使用安全等特点。
目前主要的提取方法有溶剂提取法、超临界提取法、超声波萃取法、微波萃取法、其他萃取法等。
2.1有机溶剂萃取青蒿素水蒸气蒸馏(steam distillation,SD)法由于其具有设备简单,操作安全,不污染环境,成本低,避免了提取过程中有机溶剂残留对油质造成影响等特点,是有效提取中药挥发油的重要方法。
有机溶剂提取法是目前青蒿中许多有效成分的提取目前仍然常用的方法,常用的溶剂有醇类(甲醇、乙醇等) 、醚类(乙醚、石油醚等) 、烷类(环己烷、氯仿等) 。
Filip 等7人选用6 mL 的氯仿对 1 g 新鲜黄花蒿提取 1 min,通过HPLC-Q-TOF-MS 测定,青蒿素回收率大于97% 。
Yang 等8首先用甲醇提取青蒿叶与茎杆,然后用一系列有机溶剂提取,其中乙酸乙酯部分含有11 个类黄酮,4 个黄酮苷。
但溶剂提取存在提取率不高的问题,而且所用溶剂大多有毒有害,易对人和环境造成危害。
2.2 超临界CO2萃取青蒿素超临界流体萃取(su-percritical fluid extraction,SFE)技术是20 世纪60 年代兴起的一种新型分离技术,其具有选择分离效果好,提取率高,产物没有有机溶剂残留,有利于热敏性物质和易氧化物质的萃取等特点。
青蒿中挥发油、青蒿素及其他活性成分的CO2-SFE 提取,国内外已进行了大量的研究,但还没有进入产业化阶段。
Kohler9等采用CO2-SFE 技术从黄花蒿中提取青蒿素和青蒿酸,压力15 MPa,温度50 ℃,并用3%甲醇做夹带剂,在20 min 内完成了提取过程,而且效果优于传统的溶剂提取法。
何春茂等10对黄花蒿中萃取青蒿素的SFE工艺进行了优化研究,得到纯度超过95%的青蒿素。
2.3 分子蒸馏技术提取青蒿素目前分子蒸馏(molecular distillation,MD)已在化学工业和许多天然植物的挥发油的精制方面获得良好应用。
国内已经有人将MD技术应用于青蒿挥发油的精制中,李银塔11等用CO2-SFE 技术制得青蒿油浸膏,然后用MD 技术进行精制,所得青蒿油呈淡黄色,得率为0. 47% ,高于传统的SD 法; 所得精油经气质联用(GC-MS) 分析,检测出60 个成分,主体成分为萜类化合物。
2.4 HFC 134a溶剂萃取技术提取青蒿素HFC 134a化学名为1,1,1,2-四氟乙烷( 1,1,1,2-tetrafluoroethane)具有无毒、无色、不燃、热稳定性好等特点,化学性质稳定。
HFC 134a 对青蒿素有比较好的选择性,提取物中蜡质和分子量高的挥发油含量很少12。
HFC 134a溶剂萃取技术效率适中(62%) ,但设备投资与运行费用最低。
因此,HFC 134a 溶剂萃取技术是一种极具潜力的可规模化的青蒿素的分离和提取技术。
综上所述,青蒿有效成分提取分离技术中,溶剂提取法主要存在提取纯化效率不高,再应用和综合利用困难等问题; 基于此,许多现代分离方法受到越来越多的重视,CO2-SFE 技术在青蒿素及其挥发油的分离提取中显示出较强的优势,但是由于其设备投资大,维护费用高,工业化受到一定限制,HFC134a 溶剂提取技术也有很好的前景,可应用于青蒿中如挥发油、黄酮类化合物等其他成分提取。
总之,对青蒿中活性成分进行连续提取,有效提高青蒿利用率,减低成本,仍是值得研究和开发的领域。
3 生物合成青蒿素青蒿素是应用广泛的一线抗疟药。
青蒿分布地域狭窄, 青蒿素含量低(0.01%~0.5%).现在市售的青蒿素主要是从植物中提取出来的, 含量稀少和需求广泛导致青蒿素供应不稳定。
建立一种环境友好、廉价的生产青蒿素的方法将是未来解决青蒿素来源问题的有效方法。
近10年来, 为了从根本上解决青蒿素的供需矛盾, 国内外争相开展了青蒿素合成生物学及代谢工程研究, 一方面尝试在微生物体内重建青蒿素生物合成途径, 另一方面对青蒿中原有的青蒿素生物合成途径进行遗传改良。
3.1 从乙酰辅酶A到法呢基焦磷酸(FDP)生物合成青蒿素青蒿素的生物合成途径属于植物类异戊二烯代谢途径。
近年来的研究表明,植物类异戊二烯的生物合成至少存在两条途径,即甲羟戊酸途径和丙酮酸磷酸甘油醛途径。
青蒿素等倍半萜类的生物合成途径属于甲羟戊酸途径,该途径在细胞质中进行。
首先,由3个乙酰辅A 缩合生成3羟基3甲基戊二单酰辅酶A(HMGCoA) ,随后,在HMGCoA还原酶(HMGR) 的作用下,产生甲羟戊酸(MVA) 。
以后MVA经焦磷酸化及脱羧脱水作用,形成C5的异戊烯基焦磷酸(IPP) 。
在这个过程中,由于甲羟戊酸的形成是一个不可逆的过程,因此,HMGR 被认为是该途径中的第一个限速酶13。
然IPP与其异构体二甲基烯丙基焦磷酸(DAMPP) 在法呢基焦磷酸合酶(FDPS) 的催化下,通过亲电反应机制形成牛儿基焦磷酸(GPP),进而形成法呢基焦磷酸(FDP),如图(1)。
Akhila 等14通过放射性同位素示踪法研究了青蒿素的生物合成途径,提出青蒿素生物合成的框架为: 法呢基焦磷酸(FDP)青蒿酸二氢青蒿酸青蒿素。
在此过程中,首先由FDP 经过酶促反应形成一种未知的倍半萜类中间产物,该步反应被认为是青蒿素形成过程的重要限速步骤。
1999 年, Bouwmeester等15从青蒿叶片中分离到青蒿素生物合成途径的重要倍半萜类中间产物amorpha4, 11diene, 并进一步分离了催化morpha4, 11diene形成的酶, 该酶是催化青蒿素生物合成的关键酶。
. 图13.2 通过调节植物激素及发育基因表达促进青蒿素的合成细胞分裂素可刺激叶片生长, 而青蒿素主要由青蒿叶片合成. 因此, 提高青蒿中的细胞分裂素水平有可能促进青蒿素的合成. 叶和春小组曾将异戊烯基转移酶基因(ipt)导入青蒿, 结果使细胞分裂素水平提高2~3倍, 青蒿素含量增加30%~70%16.有关植物激素与青蒿素合成的相关性及其作用机理详见后述.为了阐明青蒿生长发育(尤其是生殖发育)与青蒿素高产的关系, 叶和春小组曾用拟南芥开花促进因子1基因(fpf1)及成花基因(CO)分别转化青蒿, 结果发现, 虽然青蒿开花时间大大提前(分别提前20和14d), 但青蒿素含量并无明显提高, 表明开花并非青蒿素高产的先决条件17。
4 化学合成青蒿素青蒿素是中国学者在20世纪70年代初从药用植物黄花蒿中分离得到的抗疟疾的有效成分是含内过氧基团的半萜内酯化合物。
由于具有速效和低毒性的特点,已成为世界卫生组织推荐的治疗疟疾的首选药物18。
今年来发现青蒿素除了具有抗疟疾作用外,还有多种其他的药理作用,包括抗细菌脓毒症、放疗增敏、抗菌曾敏、抗肿瘤19等作用。
虽然青蒿素主要来自于天然采集的野生植株和人工栽培青蒿,但是天然野生青蒿受地理环境和季节的限制以及资源的日益匮乏,难以获得持续的发展。
人工栽培占地大,耗时耗力,且植株易变异,也使得产量难以保证,因而开发新的青蒿素来源途径具有重要的实际意义。
所以,非常有必要研究青蒿素化学合成方法,实现工业化生产。
目前现有的青蒿素化学合成法有化学全合成和化学半合成法。
4.1 青蒿素的化学全合成4.1.1 香茅醛为原料1986年,周维善20等以香茅醛为原料经13步合成了青蒿素,实现了青蒿素的立体选择性的全合成如图(2)。
该方法首次采用在氧气和四碘四氯荧光素存在下对中间体12a 采用光氧化的方法引入过氧桥,随后通过高氯酸酸化以总收率不到1% 制得青蒿素。
该路线首次实现了青蒿素的立体选择性全合成,虽然该路线步骤长,总收率低,但这也为青蒿素的全合成研究奠定了坚实基础。
图22010年,Yadav21也报道了以香茅醛为起始原料的全合成路线(图3),该路线通过脯氨酸衍生物和3,4-二羟基苯甲酸乙酯共催化的香茅醛和甲基乙烯基甲酮(MVK)的1,4 不对称加成合成中间体2b,随后经分子内羟醛缩合可得到不饱和醛酮中间体3b。
3b与甲基格氏试剂加成,得到非对映异构体4b和4b'的混合物,该混合物在SnCl4存在下环烯化得到关键中间体5b。
化合物5b和9-BBN经立体选择性不对称硼氢化、氧化可以85%收率和90%制得伯醇6b。
6b经两步氧化成相应酸8b后再与碘甲烷甲酯化制得关键前体9b,9b最后经过光氧化反应等一共12步反应合成了青蒿素。
该路线关键前体9b的总收率可达13%,但由于最后一步光氧化的收率较低只有25%,总收率为5% 。
图34.1.2 环己烯酮为原料合成青蒿素2012年,Cook课题组22报道了一条非常简洁的青蒿素全合成路线(图4) ,他们以廉价易得的环己烯酮为起始原料,通过使用串联反应等策略,避免使用保护基,通过5步合成得到青蒿素,总收率可达10% 以上。
此路线合成主要步骤包括5步:首先,通过联苯亚膦酰胺为配体,三氟甲磺酸铜为催化剂催化二甲基锌对环己烯酮进行共轭加成,再一锅进行对巴豆基溴的烷基化,以61%的收率得到酮2j(trans-cis = 7∶1,91%ee) 。
