2020广东中考考点精练辑:专题四 化学计算
2020年广东省中考化学模拟试卷(四)(含答案和解析)

2020年广东省中考化学模拟试卷(四)说明:1. 全卷共2页,满分为100分,考试用时为60分钟。
2. 答卷前,考生务必用黑色字迹的签字笔或钢笔在答题卡填写自己的准考证号、姓名、考场号、座位号。
用2B铅笔把对应该号码的标号涂黑。
3. 选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试题上。
4. 非选择题必须用黑色字迹钢笔或签字笔作答。
答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔或涂改液。
不按以上要求作答的答案无效。
5. 考生务必保持答题卡的整洁。
考试结束时,将试卷和答题卡一并交回。
相对原子质量:H-1C-12N-14O-16Na-23S-32Cl-35.5Cu-64Zn-65Ag-108一、选择题(本大题包括15小题,每小题3分,共45分。
在每小题列出的四个选项中, 只有一个是正确的)1.中国文化源远流长,在历史长河中创造了很多奇迹,下列不涉及化学变化的是()A.陶瓷B.火药使用C.预报地震D.粮食酿醋2.下列物品所使用的主要材料属于有机合成材料的是()A.飞机外壳合金B.玻璃杯C.纯棉毛巾D.塑料脸盆3.下列事实及对这些事实的解释,二者不相符...的是()A.未走进花园已闻到花香——分子在不断地做无规则运动B.热胀冷缩——分子之间有间隔C.汽油挥发——分子体积变大D.糖是甜的,醋是酸的——不同分子性质不同4.锗是一种稀有金属,也是重要的半导体材料,不溶于水。
锗元素的部分信息见如图。
则下列说法错误..的是()A.x=2B.锗原子的质子数为32C.锗的相对原子质量是73 gD.锗原子的中子数为415.下列关于碳和碳的氧化物的说法正确的是()A.金刚石和石墨都是自然界最硬的物质B.过量二氧化碳可导致酸雨的形成C.二氧化碳和一氧化碳都是非金属氧化物D.一氧化碳能使燃着的木条熄灭6.水是生命之源,下列关于水说法不正确...的是()A.爱护水资源,一方面要防治水体污染,另一方面要节约用水B.“直饮水机”可将自来水净化为饮用水,其内部使用的活性炭主要起吸附作用C.生活中常用肥皂水检验饮用水是硬水还是软水;常用煮沸的方法降低水的硬度,并起到消毒杀菌的作用D.如图为电解水的实验装置图。
中考化学专题总复习:化学计算题
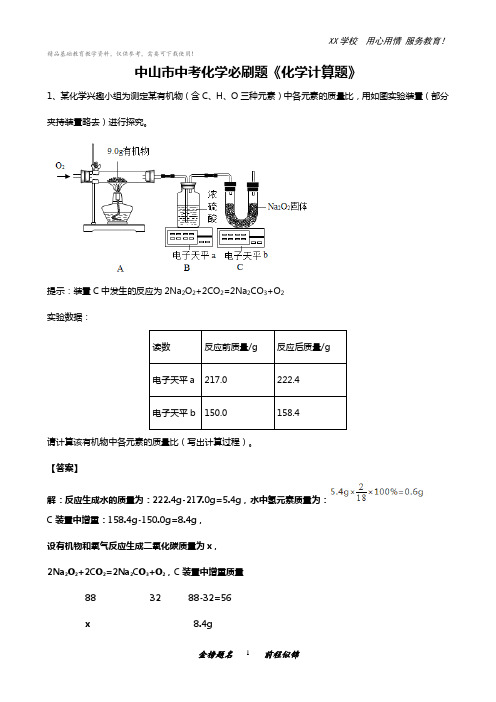
精品基础教育教学资料,仅供参考,需要可下载使用!中山市中考化学必刷题《化学计算题》1、某化学兴趣小组为测定某有机物(含C、H、O三种元素)中各元素的质量比,用如图实验装置(部分夹持装置略去)进行探究。
提示:装置C中发生的反应为2Na2O2+2CO2=2Na2CO3+O2实验数据:读数反应前质量/g 反应后质量/g电子天平a 217.0 222.4电子天平b 150.0 158.4请计算该有机物中各元素的质量比(写出计算过程)。
【答案】解:反应生成水的质量为:222.4g-217.0g=5.4g,水中氢元素质量为:C装置中增重:158.4g-150.0g=8.4g,设有机物和氧气反应生成二氧化碳质量为x,2Na2O2+2CO2=2Na2CO3+O2,C装置中增重质量88 32 88-32=56x 8.4gx=13.2g,二氧化碳中碳元素质量为:则有机物中氧元素质量为:9.0g-3.6g-0.6g=4.8g,该有机物中碳、氢、氧三种元素的质量比为:3.6g:0.6g:4.8g=6:1:8,答:该有机物中碳、氢、氧三种元素的质量比为6:1:8。
2、工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。
请回答下列问题:(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是g。
(2)该工业盐酸中HCl的质量分数是多少(写出计算过程)【答案】解:(1)由图可知,完全反应后生成沉淀的质量为2.14g。
(2)由图可知,与氯化铁反应的氢氧化钠溶液的质量为172g-160g=12g;设消耗的氢氧化钠的质量为xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107x 2.14gx=2.4g氢氧化钠溶液的溶质质量分数=与盐酸反应的氢氧化钠的质量为:160g×20%=32gHCl+NaOH═H2O+NaCl;36.5 40y 32gy=29.2g该工业盐酸中HCl的质量分数是:答案:(1)2.14。
(最新实用)2020中考化学二轮复习专题讲解《综合计算》高频考点重点精练

备战2020中考化学二轮复习专题讲解《综合计算》高频考点重点精炼(含答案带解析)1.碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,反应的化学方程为;充分加热24 g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3∶4,则该反应生成水和二氧化碳的质量之和为g。
答案Cu2(OH)2CO3 2CuO+H2O+CO2↑ 6解析碱式碳酸铜受热分解后生成氧化铜、水和二氧化碳,化学方程式为Cu2(OH)2CO32CuO+H2O+CO2↑;设混合物中铜元素的质量为a,反应后固体的总质量为x,则反应后固体中铜元素的质量也是a,故3∶4,得x=18 g,根据质量守恒定律,生成水和二氧化碳的质量之和为24 g-18 g=6 g。
2.实验室中发现一瓶因长期放置而被氧化的铝粉。
取6.0克铝粉样品,将100克硫酸溶液逐滴加入其中,固体质量随加入硫酸溶液质量的变化情况如下图所示,实验过程中测得产生氢气0.1克。
请计算:(1)样品中铝单质的质量。
(写出计算过程)(2)硫酸溶液的溶质质量分数为。
答案(1)解:设样品中铝单质的质量为x2Al+3H2SO4=======================Al2(SO4)3+3H2↑ (1分)54 6x 0.1 gx=0.9 g (1分)答:样品中铝单质的质量为0.9 g。
(2)24.5% (2分)解析 (1)根据铝和稀硫酸反应的化学方程式,找出铝和氢气的质量关系,列出关系式,计算出铝的质量。
(2)根据铝和稀硫酸反应的化学方程式,计算出反应消耗硫酸的质量;根据样品的质量和铝的质量求出氧化铝的质量,再根据氧化铝和硫酸反应的化学方程式,计算出氧化铝消耗硫酸的质量;最后根据题图找出完全反应时消耗硫酸溶液的质量,进而求出硫酸溶液的溶质质量分数。
3.为测定某石灰石矿中碳酸钙的含量,现称取12.5 g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4 g(假设生成的气体全部逸出)。
2020中考化学计算专题练习(含答案)

2020中考化学计算专题练习50题(含答案)1. 为测得AgNO3溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸与其反应,现取待测液50.0g,当加入10g稀盐酸溶液时,沉淀的质量达到最大值2.87g,求:(1)计算AgNO3溶液的溶质质量分数;(2)恰好完全反应时,所得溶液的溶质质量分数.(计算结果均保留1位小数)2.硫酸钡是一种不溶于水,也不和酸反应的固体,医疗上常用硫酸钡作透视肠胃的内服造影剂,俗称“钡餐”。
若“钡餐”中含有碳酸钡,就会致人中毒。
为测定某硫酸钡样品中碳酸钡的含量,取100g样品,向其中逐渐加入一定质量分数的稀硝酸至恰好完全反应,发生反应的化学方程式为:BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,测得共用去稀硝酸245.7g,反应后称得烧杯中物质的总质量为341.3 g.请计算:(1)反应生成的二氧化碳为g。
(2)所用的稀硝酸的溶质质量分数是多少?原样品中硫酸钡的质量分数是多少?(计算结果保留% 前一位小数)3.某实验室准备了木炭还原氧化化铜的混合粉末,小梅同学欲测定其中氧化铜的质量分数,取混合粉末180g进行加热,每加热一段时间称量剩余固体质量,剩余固体质量随时间的变化如右图所示,反应完毕后,她取少量粉末滴加稀硫酸并微热,无明显现象产生,另取少量粉末放在空气中加热并用澄清石灰水检验无明显现象发生:(1)写出加热混合粉末发生的导致固体质量减少的反应方程式;(2)计算混合粉末中氧化铜的质量分数;(写出计算过程)(3)该混合粉末中(填氧化铜或木炭)稍多于理论量,原因是。
4.取含杂质的碳酸钠样品6g,向其中加入一定质量的稀盐酸(杂质不与稀盐酸反应)。
加入稀盐酸的质量和生成气体质量的关系如图所示。
请计算:(1)生成气体的质量为g。
(2)求所用稀盐酸的溶质质量分数。
(3)求该样品中碳酸钠的质量分数(结果保留小数点后一位)。
5.将一定质量的金属锌投入到100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
2020届广东省中考必备化学总复习课件:专题四

(2)若向溶液C中加入过量的锌片,观察到的现象是
__锌__片__表__面__析__出__红__色__固__体______。 (3)混合物A中一定含有__Z_n_、__C_u_2_O__(填化学式)。 【拓展延伸】下列方法可用于鉴别锌铜合金与黄金
的是___B_C__D__(填字母)。
A. 观察颜色
B. 在空气中灼烧
实验操作
实验现象 实验结论
①取该溶液少许于试管中,向其中 溶液中没有白 猜想①不
滴加几滴___氢___氧__化__钠___溶液
色沉淀生成
成立
②用玻璃棒蘸取少许原溶液滴到pH 试纸上,并跟标准比色卡对照
溶液的pH ___小__于__7
猜想④成 立
小丽认为小明实验操作②不能证明猜想④成立,理 由是__(_N_H_4)__2S_O_4_的__水__溶__液__显__酸__性__,__溶__液__的__p_H_小__于__7__。 (3)请你设计实验方案,确认该溶液是硫酸铵溶液并 完成实验报告。
【结论】上层溶液中一定不含___H_+____(填离子符 号),理由是___上__层__溶__液__显__碱__性__,__氢__氧__根__离__子__与__氢__ _离__子__不__能__共__存_______。
【再探究】为探究上层溶液中含有哪些阴离子,帮
助小组同学完成如下实验:
实验操作
实验现象
图中“?”代表的离子是 ________(填离子符号)
结 生成物中有气体或有___沉__淀___或有水生成时,复分解反应 论 可以发生
【拓展与应用】将实验一、二、三反应后的上层清 液倒入同一洁净的烧杯中(沉淀不倒入)后续实验及 现象如图K6-4-7:
(1)无色溶液B的pH___<_____(填“<” “>”或 “=”)7。 (2)白色沉淀A是_硫__酸__钡___。 (3)无色溶液B中除了含有酚酞外,一定还含有的溶 质是__硝__酸__钠__、__硝__酸______。
最新2020届广东中考化学计算题专项复习(共64张PPT)教育课件

No
题型五 计算题
返回导航
2. (2011省卷)镁是叶绿素中唯一的考金点属特元素训,营植物缺镁时,通常的症状表现为叶片
失绿,严重时整片叶干枯。给农作物施加MgSO4和NH4MgPO4(磷酸镁铵)等镁肥, 可以促进光合作用,提高抗病能力。
(1)NH4MgPO4中含有_5_(_或__五__)_种元素,其相对分子质量是_1_3_7__。 (2)NH4MgPO4中Mg元素的质量分数是_1_7_._5_%___(精确到0.1%)。 (3)现要配制溶质质量分数为2%的MgSO4溶液500 kg进行喷施,需25% MgSO4溶液 的质量是_4_0___kg。 3. (2019梅州模拟)茶叶中含有茶氨酸(C7H14O3N2),它有降低血压、提高记忆力、保 护神经细胞、减肥等功效。请回答问题: (1)茶氨酸由_4_(_或__四__)_种元素组成,茶氨酸分子中碳、氢、氧、氮的原子个数比为 __7_∶__1_4_∶__3_∶__2__。 (2)茶氨酸中碳元素与氮元素质量比为__3_∶__1___。 (3)_5_8___g茶氨酸中含有16 g氧元素。
No
ቤተ መጻሕፍቲ ባይዱ
题型五 计算题
题考型点分特类训训营练
返回导航
类型 1 纯文字型
1. (2014省卷)我国民间有端午挂艾草的习俗。艾草含有丰富的黄酮素(化学式为: C15H10O2),有很高的药用价值。请回答: (1)黄酮素属于_有__机___化合物(填“有机”或“无机”)。 (2)黄酮素含有__3_(或__三__)_种元素,碳、氢的原子个数比为__3_∶__2_(填最简比)。 (3)黄酮素分子中碳元素的质量分数为_8_1_._1_%___(结果精确到0.1%)。
No
题型五 计算题
返回导航
2020届广东省中考必备化学总复习课件:阶段卷四(共33张PPT)

五、计算题(本大题包括1小题,共10分) 21. (10分)实验室欲测定一瓶标签破损的稀H2SO4的 溶质质量分数。现取10 g稀硫酸样品,将溶质质量 分数为5%的NaOH溶液逐滴加到样品中,边加边搅拌, 随着NaOH溶液的不断加入,溶液pH的变化如图S4-5 所示。试回答:
(1)a点溶液中含有的离子有___N_a_+_、__H_+、_______(填离 子符号)。 (2)当pH=7时,消耗NaOH溶液中的NaOH的质量为 __0_._8__g。 (3)计算稀H2SO4的溶质质量分数。
解:设10 g稀H2SO4样品中溶质的质量为x。 2NaOH+H2SO4==Na2SO4+2H2O 80 98
0.8 g x
x=0.98 g
稀H2SO4的溶质质量分数为
19. (11分)某实验活动中,老师给同学们表演了一 个魔术:大烧杯中放有一只燃着的蜡烛和一团包有 过氧化钠(Na2O2)的棉球,将一瓶二氧化碳倒入烧 杯中,蜡烛慢慢熄灭,然后棉球突然剧烈燃烧起来 了。这出乎意料的现象引起了同学们极大的兴趣, 请你参与同学们的讨论和探究。 蜡烛熄灭的原因是____二__氧__化__碳__既__不__能__燃__烧__,__也__不__ __能__支__持__燃__烧_______。 【提出问题】棉球为什么会燃烧呢?
阶段测试卷四(化学与社会发展)
(时间:60分钟 满分:100分)
可能用到的相对原子质量;H—1 C—12 O—16 Na—23 S—32 一、选择题(本大题包括15小题,每小题3分,共45分) 1. 下列属于天然有机高分子材料的是( B ) A. 塑料 B. 棉花 C. 涤纶 D. 不锈钢
2. 下列安全图标中,表示“禁止燃放鞭炮”的是 (B )
中考化学复习-质量守恒定律及相关计算

化学学科精讲精练——质量守恒定律及相关计算专题知识点一、质量守恒定律1.概念:参加反应的反应物质量总和等于反应生成的生成物质量总和2.适用范围:(1)只适用于化学变化(2)只适用于质量(3)只适用于参与反应的物质3.规律“五”不变:①反应物和生成物的总质量不变;②元素的种类不变;③元素的质量不变;④原子的种类不变;⑤原子的个数不变“二”一定变:①物质的种类一定变;②构成物质的粒子一定变“一”可能变:物质的状态和分子数可能变二、化学方程式1.书写步骤(1)写:正确写出反应物、生成物、反应条件,并用横线连接(2)配:在反应物和生成物前配正确的序数(3)改:改横线为等号(4)标:正确标出“↑”“↓”(5)查:检查所写方程式是否符合质量守恒定律2. “↑”“↓”的适用条件(1)“↑”:反应物中无气体参与,生成物中有气体(2)“↓”:在溶液中的反应,生成难溶于水的沉淀3.化学方程式的含义(1)宏观:反应物在反应条件下生成生成物(2)数量:几个反应物分子在反应条件下生成生成物分子(3)质量:几份反应物在反应条件下生成几份生成物三、化学方程式的计算——书写步骤1.设:设所求量为x注:①通常求什么设什么;②x 后不带单位2.写:写出正确的化学方程式3.列:上:系数×相对分子质量中:实际质量下:列比例式4.解:解出x 的值5.答:写出答案例题(2019•鼓楼二模)在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。
某兴趣小组进行如下实验探究B 装置中剩余固体成分。
【查阅资料】①四氧化三铁能与盐酸反应生成氯化亚铁、氯化铁和水。
②氯化铁能与铁反应生成氯化亚铁。
③氧化亚铁和氧化铁不能被磁铁吸引,铁和四氧化三铁能被磁铁吸引。
【初步探究】装置中剩余固体全部是黑色的,并且都能被磁铁吸引。
【猜想与假设】猜想1:固体成分是四氧化三铁;猜想2:。
【探究与结论】小华取少量黑色固体于试管中,加入足量的稀盐酸,她认为若固体全部溶解,没有气泡冒出,则猜想1 正确;若固体全部溶解,有气泡冒出,则猜想2 正确。
2020广东中考化学复习综合计算练习汇编(无答案)

2020广东中考化学复习综合计算练习汇编1.某探究小组同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定。
取50 g废水于烧杯中,加入足量BaCl2溶液,过滤、洗涤、干燥,得BaSO4固体11.65 g。
请回答:(1)50 g废水中H2SO4的质量是多少?(2)若改用KOH溶液来测定50 g废水中H2SO4的含量,结果可能会 (选填“偏低”“偏高”或“不变”),原因是。
2.在锥形瓶中加入80.0 g质量分数为10%的硫酸铜溶液,塞好橡胶塞。
将几根铁钉用砂纸打磨干净后在天平上称得质量为56.0 g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起放在天平上称量,记录所称得质量m1。
将上述铁钉浸到硫酸铜溶液中,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为m2。
(1)m1 m2(选填“>”“=”或“<”)。
(2)锥形瓶的质量为 (用含m1或m2的代数式表示)。
(3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。
3.取NaOH和NaCl的混合物3.63克放入烧杯中,加水溶解配制成70克溶液。
向该溶液滴加溶质质量分数为7.3%的稀盐酸,测得溶液pH与滴入稀盐酸的质量关系如图所示。
(1)当滴入稀盐酸的质量为11.2克时,溶液的pH 7(填“>”“<”或“=”);此时溶液中的溶质是(填化学式)。
(2)当pH=7时,计算该溶液中溶质的质量分数。
(写出计算过程)4.某市售某浓盐酸试剂瓶标签上的有关数据如图1所示。
小张同学取5 mL该浓盐酸加入锥形瓶中,加水稀释后,再逐滴滴加溶质质量分数为5%的NaOH溶液,反应过程中溶液的酸碱度变化如图2所示。
(1)小张同学所取的5 mL浓盐酸的质量为克。
(2)通过计算,判断该浓盐酸中HCl的质量分数是否与试剂瓶标签上的数据相符(写出计算过程)。
5.向盛有Fe2O3粉末的烧杯中加入过量的稀硫酸,充分搅拌,粉末完全溶解;再向所得溶液中逐滴加入NaOH溶液,生成沉淀与加入NaOH溶液之间的质量关系如图所示。
广东省2020年中考化学试题含答案解析

广东省2020年中考化学试题含答案解析一、选择题(共15题)1、下列过程发生了化学变化的是A.冰雪融化B.汽油挥发C.大米酿酒D.玻璃破碎2、下列广东美食中富含淀粉的是A.客家豆腐B.广式腊肠C.深井烧鹅D.陈村米粉3、酒精运输车合适位置应张贴的标志是A. B.C. D.4、下列物质属于空气污染物的是A.氧气B.氮气C.水蒸气D.二氧化硫5、 Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。
Na2CO3属于A.氧化物B.盐C.有机物D.混合物6、公园里能闻到花香,合理的解释是A.分子体积变大B.分子在不断运动C.分子数目变多D.分子发生了分解7、合成材料的应用与发展,大大方便了人类的生活。
下列物品是用有机合成材料制作的是A.塑料桶B.纯羊毛衫C.铅笔芯D.青铜铸像8、稀土有“工业的维生素”的美誉。
钇是一种重要的稀土元素,下列说法中错误的是A.钇属于金属元素B.钇的原子序数是39C.钇的相对原质量是88.91克D.钇原子的核外电子数为399、下列除杂方法正确的是选项物质(括号内为杂质)方法A K2CO3溶液(K2SO4)加BaCl2溶液,过滤B N2(O2)将气体通过灼热的铜网C NaOH溶液(Na2CO3)加入稀硫酸D ZnSO4溶液(CuSO4)加入过量的铁粉,过滤A.A B.B C.C D.D 10、化学与生产、生活密切相关,下列说法错误的是A.人体缺碘会引起贫血B.碳酸氢铵(NH4HCO3)是一种氮肥C.炒菜时油锅着火,用锅盖盖灭D.铁制品表面刷漆可防止生锈11、 20gKOH加入100g水中,配制成溶液。
下列说法错误的是A.KOH在水中解离出K+和OH-B.一个K+带一个单位正电荷C.该溶液的溶质质量分数为20%D.向该溶液中滴入酚酞指示剂,溶液变红12、如图是KNO3的溶解度曲线,下列说法正确的是A.溶液从b点降温到a点,有晶体析出B.60℃时,b、c点对应的都是饱和溶液C.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液D.60℃时,向50g水中加入60gKNO3,形成不饱和溶液13、实验室用氯酸钾固体(二氧化锰作催化剂)制取氧气,下列装置组合正确的是A.①③ B.①⑤ C.②③ D.②④14、 2020年我国在抗击新冠肺炎战役中取得了阶段性重大成果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题四化学计算
类型1 有关化学式的计算
1.(2019安徽省)我国科学家最近成功合成了世界上首个全氮阴离子盐(化学式为H25N34O3Cl),该物质是超高能材料,在航空航天上可做推进剂。
下列有关该物质的说法正确是()
A.属于有机物 B.由四种非金属元素组成
C.H25N34O3Cl中原子总数为62 D.氢、氮、氧、氯的原子个数比为1:7:8:17
2. (2019广州市)从地沟油中提炼生物柴油是垃圾资源化的方法之一。
生物柴油主要成分是硬脂酸甲酯(C19H38O2),下列有关硬脂酸甲酯的说法正确的是()
A.C、H、O三种元素的质量比为19:38:2 B.相对分子质量为(12×19+1×38+16×2)
C.C、H、O三种原子的个数比为12:1:16 D.氧元素的质量分数为×100%
3.(2019广元市)2019年5月17日,我国首台80吨液氧甲烷发动机“天鹊”(TQ—12)20秒试车成功。
该发动机具有性能高、安全性好、易操作、可重复使用等特点。
其中甲烷为推进剂,液氧为助燃剂。
下列有关甲烷说法不正确的是()
A.甲烷由1个碳元素和4个氢元素组成 B.一个甲烷分子由1个碳原子和4个氢原子构成
C.甲烷中碳元素与氢元素的质量比是3∶1 D.点燃混有空气的甲烷,可能会发生爆炸
4.(2019齐齐哈尔)维生素C又称——抗坏血酸,化学式为C6H8O6,是一种抗氧化剂,保护身体免于自由基的威胁。
请回答下列问题:
(1)维生素C的相对分子质量为;
(2)维生素C中碳元素和氢元素的质量比为(填写最简整数比);
(3)88g维生素C中含有的碳元素的质量是g。
5.(2019香洲区模拟)肥皂是最常用的生活日用品。
肥皂的主要成分是高级脂肪酸的钠盐,例如硬脂酸钠。
硬脂酸钠的分子结构简式如右图。
请回答:Array
(1)从组成上可知硬脂酸钠属于(填“有机物”或“无机物”)。
(2)硬脂酸钠中碳、氢、氧的原子个数比为。
(3)硬脂酸钠的相对分子质量是。
(4)硬脂酸钠中钠元素的质量分数是 (精确到0.1%)。
6.(2019南海区模拟)右图为某化肥磷酸氢二钾的包装说明, 请根据信息回答下列问题: (
1)磷酸
氢
二
钾的化学
式为 K
2
H P O 4,则磷酸氢二铵的化
学式为 (
2)磷酸氢二钾中,金属元素与氧元素的质量比为 。
(
3)一包这样的化肥,最少含有磷元素的质量为 公斤(只需列出算式) 类型
2 有关化学方程式的计算 1.(2019怀化)取NaOH 和NaCl 的混合物3.63克放入烧杯中,加水溶解配制成70克溶液。
向该溶液滴加溶质质量分数为7.3%的稀盐酸,测得溶液pH 与滴入稀盐酸的质量关系如图所示。
(1)当滴入稀盐酸的质量为11.2克时,溶液的pH 7(填“>”“<”或“=”);此时溶液中的溶质是 (填化学式)。
(2)当pH =7时,计算该溶液中溶质的质量分数。
(写出计算过程)
2.(2019永州)为探究CuO 和C 反应的最佳质量比(忽略副反应),化学兴趣小组取 CuO 和C 的混合物17.2g ,按不同的质量比进行实验,实验结果如图所示,横坐标表示混合物中
CuO所占的质量分数,纵坐标表示生成物中Cu的质量。
(1)分析可知,CuO和C的最佳质量比对应图中的点。
(2)计算a点时,产生CO2的质量(写出详细计算过程)。
3.(2019通辽)取一定量氯化镁溶液于烧杯中,将100g的氢氧化钠溶液平均分成五次加入烧杯中。
在化学反应过程中对烧杯中的溶液和沉淀进行了多次过滤并称量。
加入的氢氧化钠溶液和生成沉淀的质量关系记录如下表。
实验次数第1次第2次第3次第4次第5次加入的氢氧化钠溶液质量/g 20 20 20 20 20
沉淀总质量/g 2.9 5.8 8.7 11.6 11.6
分析上表中的数据,完成下列问题:
(1)第次加完氢氧化钠溶液时,氯化镁和氢氧化钠恰好完全反应,此时生成沉淀质量为g。
(2)恰好完全反应时,称量所得氯化钠溶液质量为168.4g,求原氯化镁溶液中溶质的质量分数(请写出计算过程)。
4.(2019青岛)某化学拓展课堂的主题是:探秘氯化钠样品。
主题Ⅰ:探究氯化钠样品中杂质的成分
已知所提供的氯化钠样品中,可能含有硫酸钠、氯化镁、氯化钙中的一种或几种杂质。
甲同学的实验探究过
程记录如下:
根据以上实验信息,甲同学得出结论:此氯化钠样品中含有的杂质是硫酸钠。
【实验分析】
(1)步骤①中加入适量NaOH 溶液的目的是。
(2)乙同学认为步骤③中不需要加入足量稀盐酸,你是否同意他的观点?(填“同意”或“不同意”),请说明原因。
主题Ⅱ:测定氯化钠样品中氯化钠的质量分数
确定了氯化钠样品中杂质的成分后,甲同学对样品中氯化钠的质量分数进行测定。
称取20.0g 氯化钠样品于烧杯中,加足量的水充分溶解,再向其中加入氯化钡溶液至不再产生沉淀为止,沉淀经过滤、洗涤、干燥后称量,其质量为 2.33g。
请计算该样品中氯化钠的质量分数。
(写出计算步骤,计算结果精确到 0.1%)
5.(2019滨州)将1.17 g氯化钠固体放入烧杯中,加入51.7g水充分溶解后得到常温下氯化钠的不饱和溶液,再向所得溶液中逐滴滴入100 g一定溶质质量分数的硝酸银溶液。
实验过程中生成沉淀的质量与滴入硝酸银溶液的质量关系如图所示:
(1)B点时,溶液中所含硝酸银的质量为。
(2)A点时,所得溶液中溶质质量分数为多少?(计算结果精确到0.1%)
6.(2019东莞模拟)往 12 克大理石中加入 200 克质量分数为
7.3℅的稀盐酸,充分反应后生成二氧化碳质量为 4.4克,求:
(1)大理石中碳酸钙的质量分数,要求写出计算过程:
(2)将反应后的物质过滤,所得溶液①中所含溶质的物质名称是。
(3)若往溶液①不断加入10℅的碳酸钠溶液,请在“下图”坐标中画出相应的曲线图(横坐标为某盐(或盐的溶液)的质量,请设定具体物质名称,并标出曲线中必要的数据)。
(4)往溶液①中不断加入10℅的碳酸钠溶液,恰好完全反应时所得溶液的溶质质量分数是(结果保留至0.1℅)。
0 的质量/g
7. (2019潮南区模拟) 在电解水的实验中,常向水里加入少量Na2SO4(已知通电时Na2SO4不发生变化)。
若水电解装置中盛有4.82%的Na2SO4溶液100g,通电一段时间后切断电源,水的质量减少了3.6g。
回答以下问题:
(1)电解水常向水里加入少量Na2SO4 的作用是:。
(2)计算此时生成O2的物质的量(根据化学方程式列式计算)并计算此时溶液中溶质Na2SO4的质量分数为多少?
(3)电解水时,有时会观察到正极产生的气体比理论值偏少,试推测可能的原因。
