腺相关病毒知识
腺病毒知识点总结

腺病毒知识点总结1. 腺病毒的分类腺病毒目前已知包括了六个属,分别为腺病毒属(Mastadenovirus)、阿卡洛病毒属(Atadenovirus)、索哈病毒属(Siadenovirus)等。
其中腺病毒属包括高度致病性的人类腺病毒、犬腺病毒等。
2. 腺病毒的结构腺病毒的外壳由蛋白质构成,内含双链DNA。
典型的腺病毒粒子呈多面体或类似无规则聚合的形状,直径约70-90纳米,表面均匀分布有纤维状的突起。
腺病毒粒子内含有DNA、蛋白质和酶。
3. 腺病毒的感染机制腺病毒通过呼吸道、消化道、眼部粘膜等途径进行感染。
一旦腺病毒进入人体,通过与细胞表面相关受体结合,进入细胞内。
腺病毒感染后,宿主细胞会被利用来合成病毒的DNA 和蛋白质,在宿主细胞内进行繁殖和增殖,破坏并利用宿主细胞的资源。
4. 腺病毒的致病性腺病毒引起的疾病种类繁多,常见的包括呼吸道感染、结膜炎、胃肠道感染、脑膜炎等。
不同种类的腺病毒可引起不同的疾病。
例如,腺病毒D型和E型主要引起呼吸道感染,腺病毒F型主要引起眼部感染。
5. 腺病毒的预防措施目前,预防腺病毒感染的主要措施包括加强个人卫生、保持良好的生活习惯、接种疫苗等。
通过保持清洁卫生,避免接触患者体液,保持良好的生活习惯,如良好的饮食习惯、充足的睡眠等,有助于预防腺病毒感染。
此外,疫苗接种也是预防腺病毒感染的有效手段。
目前,已有一些疫苗用于预防特定种类的腺病毒感染。
总之,腺病毒是一类广泛存在的病原体,对人类和动植物造成了严重威胁。
了解腺病毒的分类、结构、感染机制、致病性和预防措施等知识,有助于人们更好地认识腺病毒,预防和控制腺病毒感染,保障公共健康。
希望通过本文的介绍,读者能够更全面地了解腺病毒及其相关知识。
腺病毒的分子进化和流行病学

腺病毒的分子进化和流行病学腺病毒是一类广泛存在于人类、动物和植物中的病毒,由于其感染力强、传播性广、病程短暂等特点,腺病毒感染在医学和公共卫生领域一直备受关注。
本文将重点探讨腺病毒的分子进化和流行病学,以期对该病毒的防治和治疗提供一定的参考。
一、腺病毒的分子进化腺病毒是一类非包膜RNA病毒,其基因组由单股线性的RNA组成。
腺病毒包含7个不同的基因型,分别为A、B、C、D、E、F、G型。
其中,A、B、C、D型是人类最主要的腺病毒感染病原体,而E、F、G型则主要感染动物。
腺病毒的分子进化主要通过基因重组和点突变进行。
在基因重组方面,腺病毒的基因组非常灵活,可以轻松地进行基因重组以适应环境的改变。
例如,在病毒的品系亚型之间,可能会发生基因重排的现象,使得该病毒产生了新的基因型。
同时,腺病毒还可以通过点突变来适应环境的压力。
研究表明,腺病毒的基因型随着时间的推移,会发生一定的点突变,使得其在基因组上发生变化,对宿主的感染能力也发生变化。
二、腺病毒的流行病学腺病毒的流行病学研究要从其宿主和传播方式入手。
腺病毒在人类的感染很普遍,感染的方式有很多,可以通过空气、水、食物等多种方式传播。
腺病毒的感染主要分为肠道感染和呼吸道感染两种类型。
其中,肠道感染主要通过食物、饮水等途径传播,呼吸道感染则主要通过空气传播。
此外,腺病毒还可以在动物中传播,不同基因组的腺病毒可以感染不同类别、不同物种的动物,包括人类、猕猴、类人猿、啮齿类动物、鸟类等。
人类除了是腺病毒的主要宿主之一,还是许多病毒接种计划的接种对象。
总之,腺病毒的流行病学研究是极其重要的,不仅可以对腺病毒的防治起到积极的作用,还能通过对研究不同基因型、传播途径、病毒定量等方面的数据进行综合分析,探究腺病毒分子进化的规律及趋势。
三、腺病毒的防治及治疗腺病毒的防治和治疗是一个复杂的过程,需要通过多种方法来进行。
首先,要加强环境卫生和个人卫生,防止腺病毒的传播。
其次,针对不同基因型的腺病毒,可以开发不同类型的疫苗进行防治。
腺病毒总结

腺病毒总结引言腺病毒是一类广泛存在于人类和其他动物体内的病毒,可以引起多种疾病。
腺病毒具有多样的血清学类型,根据不同的类型和基因组组合,腺病毒可以引发不同的临床表现。
本文将对腺病毒进行总结,包括病毒的结构、感染机制、临床表现、预防措施等内容。
腺病毒的结构腺病毒是非包膜的DNA病毒,属于腺病毒科。
腺病毒颗粒呈正二十面体对称性,直径为70-90纳米。
腺病毒的基因组是一条双链DNA,长度约为26-45千碱基对。
腺病毒的基因组含有多个基因,编码多种蛋白质,其中包括纤维蛋白、排毒素等。
腺病毒的感染机制腺病毒主要通过经口途径传播,从而引起感染。
一旦进入宿主体内,腺病毒通过定着于宿主细胞上的腺病毒受体结合,从而进入宿主细胞内。
腺病毒的基因组在宿主细胞内被释放,并开始复制。
腺病毒具有不同的基因型和亚型,不同的类型和亚型具有不同的感染能力和临床表现。
腺病毒的临床表现腺病毒引发的疾病种类繁多,常见的包括呼吸道感染、肠道感染、眼部感染等。
腺病毒感染主要表现为发热、咳嗽、喉痛、流涕、恶心、呕吐、腹泻等症状。
腺病毒感染的严重程度因病毒类型、感染剂量、宿主免疫状况等因素而异。
严重的腺病毒感染可以导致中枢神经系统病变、心肌炎等并发症。
腺病毒的预防与控制腺病毒感染的预防主要包括以下几方面措施:1.保持良好的卫生习惯,勤洗手,注意咳嗽和打喷嚏时的口鼻遮掩。
2.避免接触已感染人群的分泌物和排泄物,尤其是病儿的鼻液、咳嗽物和粪便。
3.注意食品卫生,避免食用生的或未煮熟的食物,以及水源卫生的问题。
4.加强个体和集体免疫,通过接种腺病毒疫苗增强免疫力。
此外,在腺病毒感染季节,尽量避免去人员密集的地方,特别是儿童集中的场所,减少感染的风险。
对于病毒感染的病例,应及时就医并进行隔离治疗,以防止病毒的传播。
结论腺病毒是一类常见的感染性病毒,可以引起多种临床疾病。
了解腺病毒的结构、感染机制、临床表现以及预防措施,对于预防和控制腺病毒感染具有重要的意义。
腺病毒感染

临床表现-呼吸系统
腺病毒感染引起的呼吸道感染主要发生在儿童中,大多数无症状或者 症状轻,常见疾病为:鼻炎、咽炎、扁桃体炎、支气管炎等。在6月-2岁 的婴幼儿可以发生致死性肺炎和毛细支气管炎,有人报道可以导致百日 咳样综合征。
实验室检测
腺病毒感染的儿童中几乎一半以上有白细胞增高,可超过15×10^9/L, 血沉高于正常,CRP 高于正常,而在其他病毒感染时,白细胞稍高或正 常 ,CRP 及血沉大部分正常,我国腺病毒3、7型肺炎时白细胞计数大多 不高,尿中可以出现微量蛋白质。
诊断
一 、临床诊断:腺病毒感染常常只能依靠临床诊断、体征和流行病学, 病毒诊断其实很重要,典型临床症状加流行病学史可初步诊断,但对于 散发的需确诊必须找到病原学诊断。 二 、病原学诊断:病毒分离以及抗体检测,检查标本可以来自咽拭子、 刮片、大小便、脑脊液及组织活检,大便因其排毒时间长,故其诊断意 义不如急性期采取标本处理。 三 、血清学检测:测得病人血清特异性抗体晚期较早期上升4倍或4倍以 上有诊断价值。
临床表现-泌尿系
出 血性膀胱炎:在儿童出血性膀胱炎的病人中,20-50 % 左右的患儿尿液 可分离出此病毒,以11 、21型多见,病人血清抗体上升,从尿液脱落细 胞可以找到腺病毒,临床表现以急性膀胱炎症状为主,尿痛、尿频、遗 尿、可伴随发热,在肾移植病人中可分离出病毒,故认为病毒可能非上 行感染所致,可能来自血液病毒。
病毒侵入细胞后引起至少3种作用。 1.溶解性感染:病毒侵入人细胞,通过溶解细胞作用,使细胞死亡。 2.慢性潜伏性感染:常在淋巴细胞内出现,潜伏感染时病毒量极少, 临床症状不明显,机制尚不明确。
腺病毒感染科普宣传PPT

腺病毒感染的误区
不需隔离
有些人认为腺病毒感染不需要隔离,实际上传播 性较强,感染者应适当隔离。
尤其是在家庭或学校环境中,避免交叉感染。
腺病毒感染的误区
疫苗误区
目前尚无针对腺病毒的特效疫苗,公众需了解这 一点。
预防措施依然是抵御腺病毒感染的主要手段。
谢谢观看
腺病毒感染科普宣传
演讲人:
目录
1. 什么是腺病毒? 2. 腺病毒感染的症状有哪些? 3. 如何预防腺病毒感染? 4. 腺病毒感染的治疗方法 5. 腺病毒感染的误区
什么是腺病毒?
什么是腺病毒?
定义
腺病毒是一种常见的病毒,属于腺病毒科,能够 引起多种感染。
腺病毒主要影响呼吸系统、消化系统和眼睛等部 位。
腺病毒感染的常见症状包括发热、咳嗽、喉咙痛 、流感样症状等。
部分患者可能还会出现腹泻、呕吐等消化系统症 状。
腺病毒感染的症状有哪些?
严重症状
在某些情况下,腺病毒感染可能导致严重的肺炎 或其他严重并发症。
特别是在免疫力低下的人群中,风险更高。
腺病毒感染的症状有哪些?
儿童感染
儿童感染腺病毒的风险更高,症状可能更为明显 。
可饮用清水、淡盐水或电解质饮料。
腺病毒感染的治疗方法
就医建议
如症状严重或持续不改善,建议及时就医,进行 相关检查。
医生会根据具体情腺病毒感染的误区
非空气传播
很多人误认为腺病毒是通过空气传播的,实际上 它主要通过接触传播。
保持环境卫生和个人卫生是预防的关键。
如何预防腺病毒感染?
健康生活
保持健康的生活方式,增强免疫力,保证充足的 睡眠和均衡的饮食。
适度锻炼和减压也有助于提高身体抵抗力。
知识分享:腺相关病毒(AAV)表达系统

知识分享:腺相关病毒(AAV)表达系统【维真⽣物】提供AAV现货和AAV包装服务,已助⼒多位客户在顶级期刊发表⽂章。
产品说明书【详见维真⽣物官⽹→(腺相关病毒包装+腺相关病毒制备+腺相关病毒案例分享+腺相关病毒技术⼿册),或联系官⽹在线客服索要相关内容的链接。
】本产品仅限⽤于研究,严禁⽤于疾病诊断。
本产品仅供购买⽅内部研究使⽤,未经维真⽣物公司书⾯许可,严禁转售。
产品有限责任担保维真⽣物保证您收到的产品符合产品⽬录上的规格。
本担保规定了维真⽣物更换产品的责任。
维真⽣物不提供其他任何形式的对于产品商业或健康⽤途的保证。
维真⽣物不对任何由于使⽤或不正确使⽤本公司产品造成的直接、间接的、衍⽣的或偶然的损害所产⽣的后果负责。
腺相关病毒安全操作规范1. 请在BL2⽣物安全⼆级⽣物安全柜中操作病毒。
2. 操作病毒和转染细胞时,请务必穿着实验服,佩戴⼝罩和⼿套。
3. 请⼩⼼操作,避免产⽣⽓雾或飞溅。
被病毒污染的超净⼯作台,请⽴即⽤70%⼄醇加1% SDS溶液擦拭⼲净。
接触病毒的枪头、离⼼管、培养板、培养液请使⽤新鲜配制的10%漂⽩粉进⾏消毒操作后丢弃。
4. ⽤显微镜观察细胞感染情况时,请先拧紧培养瓶或盖紧培养板,⽤70%⼄醇擦拭培养瓶外壁后,显微镜下观察拍照。
观察完毕,请⽤70%⼄醇再次擦拭显微镜实验台。
5. 离⼼病毒时,应使⽤密封性好的离⼼管,或⽤封⼝膜封⼝后进⾏离⼼,请尽量使⽤组织培养室内的离⼼机。
6. 实验完毕脱掉⼿套后,请⽴即⽤肥皂和⽔清洗双⼿。
个⼈保护措施1. 使⽤⼀次性⼿套。
2. 在注射病毒或是其后的解剖时,使⽤⼀次性⼿术服或是相当的⾐物,如果是感染细胞时,可以穿着实验服。
3. 佩戴护⽬镜或是⾯罩。
4. 所有的操作应当是在 Class II ⽣物安全柜中进⾏。
如果实验条件不能满⾜,则应当在空⽓稳定的空间中操作,减少操作时间和病毒与外界接触的时间。
不慎接触病毒时的急救1. 病毒飞溅或是⽓溶胶与⼈体接触–眼,⽪肤或是粘膜⽤⼤量清⽔冲洗眼睛或是其他接触的部位⾄少15 分钟。
腺相关病毒知识(汇编)

第一节AAV病毒的生活周期腺病毒伴随病毒(adeno-associated virus, AAV)是微小病毒科(Parvoviridae)家族的成员之一。
这一家族成员是一类微小、无被膜及具有二十面体结构的病毒。
病毒颗粒的直径在20~26nm之间,含有大小在4. 7~6kb之间的线状单链DNA基因组。
从昆虫到人类都已分离到微小病毒。
AAV病毒属于依赖性病毒类(De pendovirus),最初是在纯化的腺病毒液中发现的一种污染成分(Atchinson et al. 1965), 顾而得名。
从鸟类到许多哺乳动物包括人的体内都分离到各种血清型的AAV病毒。
大多数成年人都感染过AAV病毒,但尚未发现该病毒是任何疾病的致病因素。
在多数情况下,AAV在培养的正常细胞中不发生产毒性感染,只有在有辅助病毒包括腺病毒或疱疹病毒共同感染时才发生产毒性感染(Hoggan et al. 1966; Buller et al. 1981)。
因此,AAV病毒长期以来被认为是一种缺陷性病毒。
进一步的研究发现AAV病毒并非缺陷性病毒,而是在正常细胞中偏向于建立潜伏感染,仅在宿主细胞受到刺激时才被诱发进行感染性增殖。
AAV的生活周期有两种不同的胞内期。
在无辅助病毒存在时,AAV病毒颗粒进入细胞,脱衣壳后AAV的调节蛋白发生有限的表达,并抑制病毒基因的进一步表达和病毒DNA的复制。
这种负调节作用的结果是促进病毒基因组整合到宿主的基因组中建立潜伏感染。
AAV病毒偏向于整合到人基因组19号染色体q臂的特定位置(Kotin et al. 1990,1991,1992; Samulski et al. 1993)。
研究被AAV病毒潜伏感染的细胞发现,AAV对细胞表型往往有微弱影响,并影响细胞对刺激的反应能力(Yalkinoglu et al. 1988; Yakobson et al. 1987,1989; Bantel-Schaal et al. 1992, 1991)。
腺病毒感染科普讲座PPT课件

01
优先选择具有明确抗病毒效果的药物,如阿昔洛韦等,但需关
Hale Waihona Puke 注药物副作用。对症治疗药物
02
针对发热、咳嗽等症状选用合适的药物,如解热镇痛药、止咳
药等。
免疫调节药物
03
对于免疫低下患者,可适当使用免疫调节药物,但需遵医嘱。
康复期患者管理建议
定期随访
康复期患者应定期进行随访,以便及时发现并处 理潜在问题。
腺病毒感染科普讲座
汇报人:xxx 2023-1-26
contents
目录
• 腺病毒基本知识 • 腺病毒感染临床表现与诊断方法 • 腺病毒感染预防与控制措施 • 治疗方法与康复管理 • 心理干预与社会支持网络构建 • 总结回顾与展望未来进展方向
01 腺病毒基本知识
腺病毒定义与分类
腺病毒定义
腺病毒是一种无包膜的双链DNA病 毒,具有多种血清型,可引起人类和 动物感染。
生活调整
保持规律作息,合理饮食,适当锻炼,增强免疫 力。
心理疏导
关注患者心理状况,必要时进行心理疏导,帮助 患者积极面对康复过程。
05 心理干预与社会支持网络 构建
患者心理变化特点分析
焦虑和恐惧
患者可能对疾病的治疗和预后感到不确定,导致焦虑和恐惧情绪 。
抑郁和失落
腺病毒感染可能给患者带来身体和心理上的痛苦,导致抑郁和失 落情绪。
易感人群
儿童、老年人、免疫力低下人群等是腺病毒的易感人群。
危害程度
腺病毒感染可引起多种疾病,如呼吸道感染、结膜炎、胃肠 炎等,严重时可导致死亡。不同血清型腺病毒的致病力和危 害程度有所差异。
02 腺病毒感染临床表现与诊 断方法
临床表现及分型
2023年最新的腺病毒

2023年最新的腺病毒腺病毒防治相关知识认识腺病毒一、什么是病毒?生物病毒是一类个体微小,结构简单,只含单一核酸(DNA/RNA),必须在活细胞内寄生并以复制方式增殖的非细胞型微生物。
不同病毒的大小变动于20~450纳米之间。
老百姓常听到的病毒有冠状病毒(引起非典),HIV(引起艾滋病),HBV(引起乙肝)。
二、什么是腺病毒?腺病毒为DNA病毒,属腺病毒科。
因能致淋巴结(腺)、咽及结膜炎症,又称腺―咽―结膜病毒(简称APC病毒)。
是一种没有包膜的直径为70~90 nm的颗粒,由252个壳粒呈廿面体排列构成,大小相当于一根头发丝直径的800分之一。
腺病毒可以导致多种疾病,甚至可以导致动物发生肿瘤。
约1/3的人腺病毒与人类疾病有关,主要有:呼吸道感染、流行性结膜炎(俗称:红眼病)、病毒性胃肠炎、急性出血性膀胱炎等,其中腺病毒引起的呼吸道疾病和红眼病最为常见。
三、腺病毒急性传染病的传染源有哪些?怎么传染的?一般来说,传染源为病人和隐性感染者(身上有病毒但是没有发病的人),病毒由呼吸道(大家所说的飞沫和痰)和眼结膜分泌物(大家所说的眼屎、眼泪)、粪便及尿排出体外,经空气飞沫、密切接触及粪―口途径传播。
四、哪些人群容易得腺病毒急性传染病?腺病毒在全球广泛流行,尤其会侵袭婴幼儿和免疫低下人群。
这次在北京战区流行爆发的是腺病毒55型,是一个比较新的病毒类型,人群普遍缺乏抵抗力而容易感染。
病人的密切接触者是本病的高位人群。
五、哪些情况属于密切接触者?密切接触者是指:诊疗、护理过病人;探视过病人;直接接触病人的分泌物;与病人共同生活或在同一办公室共同工作过,或者共同进餐、娱乐,或者乘坐同一交通工具时近距离接触。
诊断与治疗一、腺病毒所致传染病的表现有哪些?不同血清型的腺病毒引起的临床表现不同,可分以下类型:1 急性上呼吸道感染。
有发热、流清鼻涕、咽痛、咳嗽、声音嘶哑等。
半数病例咽部出现白色渗出物及颈淋巴结肿大,多于3~4天后退热,全身症状减轻,但咳嗽等呼吸道症状可持续1~2周。
腺病毒防治知识宣传手册

腺病毒防治知识宣传1. 什么是腺病毒?腺病毒是一种无外壳的双链DNA病毒,在自然界中分布广泛。
易引起人体呼吸、消化和泌尿等多系统感染,以呼吸道感染较为常见。
2. 腺病毒的传染源是什么?腺病毒感染者和隐性感染者是主要传染源。
潜伏期一般3~8天,潜伏期末至发病急性期传染性最强。
3. 人是如何感染腺病毒的?主要通过空气飞沫传播,如病人打喷嚏或咳嗽传染给健康人。
密切接触(手-鼻)传播也是重要传播途径,如用脏手揉眼睛、鼻子等也可感染。
4. 哪些人容易感染腺病毒?各个年龄人群均可感染腺病毒,但婴幼儿、老年人以及免疫功能低下者较容易感染。
集体生活的幼儿、学生或新兵由于生活环境封闭聚集也容易发生群体性感染。
5. 什么季节易出现腺病毒感染暴发流行?冬春季节气温较低,人群多在室内活动,环境相对密闭,通风不畅,易于病毒传播。
因此,冬春季容易出现腺病毒感染暴发流行。
6. 腺病毒有哪些临床表现?腺病毒引起的急性呼吸道感染、急性角膜结膜炎等可导致人群暴发或流行。
病人多以轻症为主,表现出发热、咳嗽、咽痛、头痛和全身不适等症状,少数有恶心、腹泻。
大部分经过治疗后能够康复,少数可发展为重症肺炎。
7. 腺病毒有什么药物可以预防和治疗?疫苗预防:4型和7型腺病毒有口服疫苗,效果较好。
但近年流行的55型腺病毒是一种新型重组病毒,目前尚无针对性疫苗。
一般治疗与病情监测:卧床休息,注意维持水、电解质平衡,密切观察病情变化,定期复查。
对症治疗:①体温高于38.5℃,给予冰敷、酒精擦拭、降温毯等物理降温措施。
效果不佳者可予化学药物降温。
②咳嗽剧烈者可给予镇咳药。
③大量出汗者注意补液及纠正水、电解质失衡。
8.如何预防腺病毒感染?1、避免接触出现发热、咳嗽、流涕等症状的呼吸道疾病病人。
2、避免前往人群拥挤的场所。
3、注意个人卫生,经常使用肥皂和清水洗手,尤其在咳嗽或打喷嚏后;注意开窗通风,保持室内空气流通;每天要多饮水,劳逸结合,坚持体育锻炼,保证睡眠,生活规律,合理膳食,增强机体抵抗力。
第三节 腺病毒
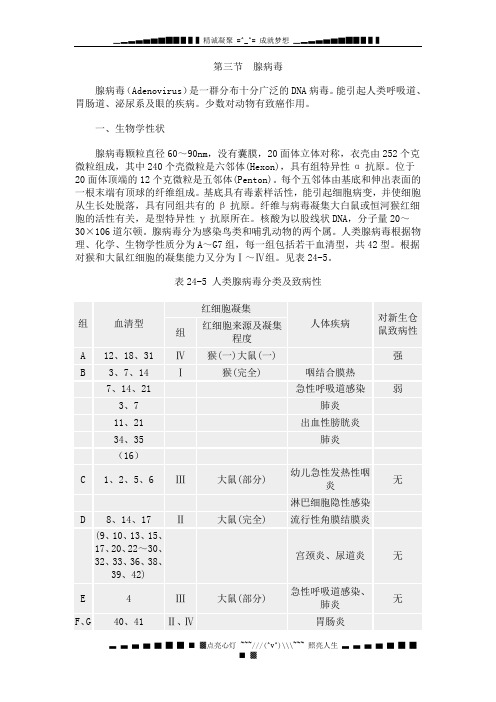
第三节腺病毒腺病毒(Adenovirus)是一群分布十分广泛的DNA病毒。
能引起人类呼吸道、胃肠道、泌尿系及眼的疾病。
少数对动物有致癌作用。
一、生物学性状腺病毒颗粒直径60~90nm,没有囊膜,20面体立体对称,衣壳由252个克微粒组成,其中240个壳微粒是六邻体(Hexon),具有组特异性α抗原。
位于20面体顶端的12个克微粒是五邻体(Penton)。
每个五邻体由基底和伸出表面的一根末端有顶球的纤维组成。
基底具有毒素样活性,能引起细胞病变,并使细胞从生长处脱落,具有同组共有的β抗原。
纤维与病毒凝集大白鼠或恒河猴红细胞的活性有关,是型特异性γ抗原所在。
核酸为以股线状DNA,分子量20~30×106道尔顿。
腺病毒分为感染鸟类和哺乳动物的两个属。
人类腺病毒根据物理、化学、生物学性质分为A~G7组,每一组包括若干血清型,共42型。
根据对猴和大鼠红细胞的凝集能力又分为Ⅰ~Ⅳ组。
见表24-5。
表24-5 人类腺病毒分类及致病性*括弧中型别的一般不致病人类腺病毒不能在鸡胚中增殖,上皮样人细胞系HeLa细胞和人胚原代细胞培养最敏感,能引起细胞肿胀、变圆、聚集成葡萄串状的典型细胞病变。
腺病毒对酸碱度及温度的耐受范围较宽,36℃7天病毒感染力无明显下降。
对脂溶剂和酶类均抵抗作用,但56℃30分钟可将其灭活。
二、致病性与免疫性人腺病毒中部分型别有致病性,最常的是1~7型。
幼儿急性上呼吸道感染约5%由腺病毒引起,成人感染很少发生于呼吸道。
腺病毒致病情况见表24-5。
传播以粪一口为主途径,也可通过呼吸道或污染物品传播。
病毒在咽、结膜尤其是小肠上皮细胞内增殖,偶尔波及其他脏器,隐性感染常见。
疾病一般为自限性,感染后可获得长期持续的型特异性免疫力,中和抗体损伤作用重要。
A、B组病毒在某些新生动物可诱发肿瘤,对人未发现致癌作用。
三、微生物学检查(一)病毒分离自急性期病人咽、直肠、结膜等处采取标本,迅速接种敏感细胞,根据特征性细胞突变及抗原性鉴定病毒。
什么是腺病毒

什么是腺病毒
腺病毒是一类寄生于动物和人类的病毒,属于腺病毒科。
这种病毒在寄主细胞
内复制自身,引发一系列疾病。
腺病毒最常见的类型包括腺病毒5型、腺病毒7
型等,它们可以引发呼吸道感染、肠道感染和眼部感染等疾病。
腺病毒的特征
腺病毒是一种非常常见的病原体,易于传播。
它通过飞沫传播等途径感染人体,尤其容易在人口密集的地方传播。
腺病毒感染后,潜伏期较短,通常数天之内症状就会出现。
腺病毒感染的症状
腺病毒感染会引发不同的症状,主要表现为发热、咳嗽、流涕、喉咙痛、头痛、疲劳等。
严重的腺病毒感染还可能导致肺炎、腹泻等并发症。
如何预防腺病毒感染
为了预防腺病毒感染,我们可以采取以下措施:
1.注重个人卫生,勤洗手,尤其在接触食物、外出后要洗手。
2.避免和已感染腺病毒的人密切接触,尤其是在疫情流行期间。
3.保持室内空气流通,勤通风,保持室内清洁。
4.提高免疫力,多吃水果蔬菜,合理作息,增强体质。
腺病毒的治疗
目前尚无特效的抗病毒药物可以治疗腺病毒感染,治疗主要是对症支持疗法,
如饮食调理、适当的休息、多喝水等。
对于症状较重的患者,医生会根据具体情况采取相应的治疗措施。
综上所述,腺病毒是一种常见的病毒感染,预防措施尤为重要。
在日常生活中,注意个人卫生、保持良好的生活习惯,有助于降低感染的风险,有效控制腺病毒传播。
腺病毒感染(专业知识值得参考借鉴)

腺病毒感染(专业知识值得参考借鉴)一概述腺病毒引起的急性传染病,易侵犯呼吸道及消化道黏膜、眼结膜、泌尿道和淋巴结。
主要表现为急性上呼吸道感染(急性呼吸道感染由腺病毒引起者占2%~4%),其次为眼部和胃肠道感染。
人群普遍易感,多见于儿童。
约半数患者为隐性感染。
婴幼儿易患腺病毒肺炎,病情重,病死率高。
无特效治疗。
根据人群血清特异性抗体调查和病毒分离,可知腺病毒感染十分广泛。
传染源为患者和隐性感染者,病毒由呼吸道和眼结膜分泌物、粪便及尿排出体外,经空气飞沫、密切接触及粪―口途径传播。
二病因发现腺病毒有6个亚型(A~F)和55个不同的血清型(按病毒基因组分型)。
已知约20余种血清型可感染人类。
病毒为直径70~80纳米的20面体衣壳,内核含双股DNA。
对热和酸不稳定。
由于不含脂质,对胆盐等脂质溶解剂抵抗力强,故能在肠道中存活。
不同亚型可引起不同感染。
三临床表现此病的潜伏期为4~5天,成人和儿童的临床表现不同。
1.成人临床表现(1)流行性角膜结膜炎一般来说8、19型腺病毒可引起此病流行,其他型一般只是散发病例。
潜伏期较长,一般为3~24天,而且早期病症并不明显,表现为多累及双眼,眼刺激症状和分泌物增多,可持续1~4周;而角膜损伤可持续数月,少见失明,较常见的是通过家庭传播,可通过污染的公用毛巾,污染的手、眼药水等传播。
(2)呼吸道感染一般有发热、咳嗽、咽痛、流涕、肺部啰音。
X线检查的结果,较多为单侧的间质性肺炎或肺实变改变,一般为下肺野,也可能伴随着少量胸膜渗出。
比较少发生继发细菌感染,近10年已经逐渐发现致死病例,通常病程也比较短,一般是1~2周。
2.儿童临床表现(1)出血性膀胱炎一般表现为无明显季节性,且在男孩子中多见,大多由腺病毒11、21型引起。
有3~7天,可能还会伴随着尿频、血尿、尿急及排尿困难、肉眼血尿,镜下血尿可持续2周左右。
(2)呼吸道感染婴儿腺病毒感染最常见的症状为鼻炎。
暴发性支气管炎和肺炎在这个年龄组中可能会发生。
小儿腺病毒感染科普知识

小儿腺病毒感染科普知识腺病毒感染引起肺炎在小儿当中比较常见,且腺病毒性肺炎属于小儿肺炎中特别严重的一种类型之一,那么腺病毒是什么?感染以后又应该如何进行防治呢?下面一起来了解一下。
1、认识腺病毒腺病毒属于双链DNA病毒,其主要是由没有外套膜的二十面体衣壳与核蛋白组成。
传染源主要是腺病毒感染者。
飞沫(最主要的方式)、粪-口(接触感染者的粪便)、密切接触(如手接触到被污染的物体,没有洗手又摸眼睛、鼻子、口等)是主要的传播途径,并且传播途径宿主范围广,对人致病性低;在增值、非增值细胞中感染与表达基因且能有效进行增值、滴度高;其与人类基因同源、可以同时表达多个基因、能在悬浮培养液中扩增不整合到染色体中,没有插入致突变性。
腺病毒因为感染的部位不同引发分类方法也很多,比如按照感染人群不同被分为成人感染、儿童感染,其中儿童容易感染的腺病毒肺炎最常见。
本病毒的检查方法包括体格检查、影像学检查、实验室检查(血常规、尿常规、血生化、血气分析、外周血淋巴细胞亚群)、病原学相关检查(如病毒核酸检测、病毒的分离和培养、血清病毒特异性抗体)等,对人的身体健康危害比较大、传播速度快,感染主要在冬春季节流行。
此外,由于婴幼儿机体缺乏针对腺病毒的保护性抗体,通常最容易感染且比成人感染症状较严重,人感染后会引起多种临床表现、疾病(比如肝脏、眼睛、膀胱、胃肠道、呼吸道都会感染),一些患者会出现比较严重的情况(如患有免疫功能受损或者基础疾病相对更容易出现重症),所以感染病毒后一定要及时进行治疗,日常也要从卫生、饮食等生活方式上进行预防。
2、感染腺病毒后的临床症状有哪些发热,感染后发病初期就会出现高热的症状(一般在39℃以上),其中症状相对比较轻的小儿症状(包含体温)通常一周后就会逐渐恢复正常,而重症小儿高热持续时间比较长(2到4周,这其中个别患儿的体温可能会超过40℃)。
咳嗽、喘息,发病初期会出现轻度阵咳、频繁咳嗽,一些患儿的咳嗽会逐日加重,甚至发生喘息的情形。
预防腺病毒感染指南

预防腺病毒感染指南一、了解腺病毒腺病毒是一种 DNA 病毒,有多种亚型。
它可以通过呼吸道飞沫传播、接触传播以及粪口途径传播。
腺病毒感染可发生在任何年龄段,但儿童、免疫功能低下者和老年人更容易受到感染,且症状可能更严重。
腺病毒感染后的症状因个体差异和感染亚型而异。
常见的症状包括发热、咳嗽、喉咙痛、流鼻涕、眼结膜炎、腹泻等。
在某些情况下,腺病毒还可能引起肺炎、脑炎、心肌炎等严重并发症。
二、个人卫生习惯1、勤洗手保持良好的手部卫生是预防腺病毒感染的关键。
经常用肥皂和流动水洗手,尤其是在进食前、如厕后、接触公共物品后。
洗手时要彻底揉搓双手,包括手指、手掌、手背和手腕,至少持续 20 秒。
如果没有肥皂和水,可以使用含酒精的手部消毒剂。
2、避免用手触摸眼睛、口鼻我们的手经常接触各种物品,可能会沾染病毒。
避免用手直接触摸眼睛、口鼻,能够减少病毒进入体内的机会。
3、咳嗽和打喷嚏的礼仪当咳嗽或打喷嚏时,用纸巾或肘部遮住口鼻,避免飞沫传播病毒。
使用后的纸巾应立即扔进垃圾桶,并及时洗手。
4、个人物品的清洁定期清洁和消毒个人物品,如手机、电脑键盘、眼镜、钥匙等。
可以使用消毒湿巾或含有消毒剂的溶液进行擦拭。
三、环境卫生1、保持室内通风经常开窗通风,保持室内空气新鲜。
新鲜的空气有助于稀释室内可能存在的病毒颗粒,降低感染风险。
2、定期清洁和消毒定期对居住环境进行清洁和消毒,尤其是经常接触的表面,如桌面、椅子扶手、门把手、水龙头等。
可以使用稀释的漂白剂溶液或其他有效的消毒剂进行消毒。
3、避免前往人员密集、通风不良的场所人员密集、通风不良的场所容易传播病毒。
尽量避免前往这些地方,尤其是在腺病毒流行季节。
四、饮食与健康生活方式1、均衡饮食保持均衡的饮食,摄入足够的营养物质,有助于增强免疫力。
多吃新鲜的蔬菜、水果、全谷物、优质蛋白质等,少吃油腻、辛辣、刺激性食物。
2、充足睡眠保证充足的睡眠,让身体有足够的时间休息和恢复。
睡眠不足会影响免疫系统的功能,增加感染的风险。
腺病毒的感染与防治PPT课件

咽结合膜热
以发热、咽炎、结膜炎为特征 ,常伴有颈部淋巴结肿大。
急性出血性膀胱炎
主要表现为尿频、尿急、尿痛 等膀胱刺激症状,以及镜下血
尿或肉眼血尿。
其他类型
包括胃肠炎、心肌炎、脑炎等 ,临床表现多种多样。
重症患者特征及预后
重症患者特征
多见于5岁以下儿童,尤其是2岁以下婴 幼儿;持续高热超过3天,精神萎靡或烦 躁不安;频繁咳嗽,气促明显,甚至出 现呼吸困难和发绀;心率增快,出现心 音低钝或奔马律;肝脏进行性肿大,伴 有压痛;外周血白细胞计数明显升高或 降低,C反应蛋白等炎症指标明显升高。
腺病毒分类
根据血清型和基因组的不同,腺 病毒可分为多个种类,包括A-F组 ,每组又包含多个血清型。
腺病毒传播途径
空气传播
水传播
腺病毒可通过飞沫、气溶胶等空气传 播方式传播,感染者在咳嗽、打喷嚏 或说话时产生的飞沫可携带病毒。
腺病毒还可能在游泳池、浴室等潮湿 环境中通过水传播,感染者在水中排 泄后,病毒可在水中存活一段时间。
勤洗手
经常用肥皂和清水洗手, 特别是在接触公共场所或 动物后。
戴口罩
在公共场所、医院等环境 中,应佩戴口罩,防止病 毒通过飞沫传播。
避免接触
避免与生病的人密切接触 ,减少感染风险。
公共场所卫生管理要求
定期清洁消毒
对公共场所如学校、幼儿园、医 院、商场等,要定期进行清洁和
消毒。
保持通风
确保公共场所通风良好,有助于降 低病毒在空气中的浓度。
可通过病毒学检测进行鉴别。
支原体肺炎
支原体肺炎与腺病毒肺炎在影像 学上表现相似,但支原体肺炎起 病较缓、病程较长,可通过血清
学检测和PCR技术进行鉴别。
腺相关病毒操作手册

腺相关病毒操作手册一、腺相关病毒(Adeno-Associated Viral Vector,AAV)简介腺相关病毒属微小病毒科(parvovirus),为无包膜的单链线状DNA病毒。
AA V的基因组约4700bp,包括上下游两个开放读码框架(ORF),位于分别由145个核苷酸组成的2个反向末端重复序列(ITR)之间。
基因组中有3个启动子(P5、P19和P40)和2个开放阅读读框(ORF),rep和cap,如图1所示。
rep编码4个重叠的多功能蛋白,即Rep78、Rep68、Rep52和Rep40,其中Rep78与Rep68参与AA V的复制与整合,Rep52和Rep40具有解螺旋酶和ATP酶活性,与Rep78、Rep68共同参与单链基因组的复制;cap编码的VP1、VP2、VP3是装配成完整病毒所需要的衣壳蛋白,它们在AA V病毒整合、复制和装配中其重要作用。
图1.AA V基因结构二、腺相关病毒的优点1.安全性高:迄今从未发现野生型AA V对人体致病,重组AA V基因组序列上去除了大部分的野生型AA V基因组元件,进一步保证了安全性;2.免疫原性低:AA V2的基因组仅4681个核苷酸,便于用常规的重组DNA技术进行操作,而且进行动物实验时造成的免疫反应小;3.宿主范围广:能感染分裂细胞和非分裂细胞;4.表达稳定:能介导基因的长期稳定表达;5.物理性质稳定:在60℃不能被灭活,能抗氯仿;(汉恒--AAV包装)三、重组腺相关病毒载体系统简介AAV是一种复制缺陷型微小病毒,其增殖复制需要腺病毒或疱疹病毒的辅助。
AAV无辅助病毒系统(AAV Helper-Free System)可以在无辅助病毒的条件下生产出重组腺相关病毒。
在AAV Helper-Free System中,生产具有感染性的AAV病毒颗粒所需的腺病毒基因产物(如:E2A,E4等基因)大部分由pHelper质粒提供,其余的腺病毒基因产物由稳定表达腺病毒E1基因的AAV-293宿主细胞提供。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节AAV病毒的生活周期腺病毒伴随病毒(adeno-associated virus, AAV)是微小病毒科(Parvoviridae)家族的成员之一。
这一家族成员是一类微小、无被膜及具有二十面体结构的病毒。
病毒颗粒的直径在20~26nm之间,含有大小在4. 7~6kb之间的线状单链DNA基因组。
从昆虫到人类都已分离到微小病毒。
AAV病毒属于依赖性病毒类(De pendovirus),最初是在纯化的腺病毒液中发现的一种污染成分(Atchinson et al. 1965), 顾而得名。
从鸟类到许多哺乳动物包括人的体内都分离到各种血清型的AAV病毒。
大多数成年人都感染过AAV病毒,但尚未发现该病毒是任何疾病的致病因素。
在多数情况下,AAV在培养的正常细胞中不发生产毒性感染,只有在有辅助病毒包括腺病毒或疱疹病毒共同感染时才发生产毒性感染(Hoggan et al. 1966; Buller et al. 1981)。
因此,AAV病毒长期以来被认为是一种缺陷性病毒。
进一步的研究发现AAV病毒并非缺陷性病毒,而是在正常细胞中偏向于建立潜伏感染,仅在宿主细胞受到刺激时才被诱发进行感染性增殖。
AAV的生活周期有两种不同的胞内期。
在无辅助病毒存在时,AAV病毒颗粒进入细胞,脱衣壳后AAV的调节蛋白发生有限的表达,并抑制病毒基因的进一步表达和病毒DNA的复制。
这种负调节作用的结果是促进病毒基因组整合到宿主的基因组中建立潜伏感染。
AAV病毒偏向于整合到人基因组19号染色体q臂的特定位置(Kotin et al. 1990,1991,1992; Samulski et al. 1993)。
研究被AAV病毒潜伏感染的细胞发现,AAV对细胞表型往往有微弱影响,并影响细胞对刺激的反应能力(Yalkinoglu et al. 1988; Yakobson et al. 1987,1989; Bantel-Schaal et al. 1992, 1991)。
AAV生活周期的另一种胞内期是产毒性感染,往往在有辅助病毒(腺病毒或疱疹病毒)感染时发生。
辅助病毒的感染可以在AAV感染之前、同时或之后进行。
腺病毒(Ad)和单纯疱疹病毒(HSV)中与辅助功能有关的基因都已确定。
腺病毒中参与提供辅助功能的基因包括E1a, E1b, E2a, E4和VA RNA(Muzyczka 1 992),但不包括与腺病毒DNA复制直接相关的E2b基因产物(DNA聚合酶和末端酶)。
1型单纯疱疹病毒(HSV-1)提供辅助功能的情形则有些不同,不仅涉及与HSV病毒基因调节有关的基因包括ICP0和ICP4,还需要HSV病毒DNA复制的所必需的基因产物包括HSV螺旋酶-引物酶复合物(UL5,UL8,UL52)和主要DNA结合蛋白UL29的参与(Weindler F et al. 1991)。
这种在辅助功能方面的不同可能反映了腺病毒感染和疱疹病毒感染期间对宿主DNA合成机制的不同影响。
目前的关于AAV工作模式有以下要点:(1)AAV是一种生活周期以潜伏感染为主的病毒;(2)通过潜伏感染, 病毒基因组得以同细胞共存;(3)只要宿主细胞正常,AAV基因表达就处于抑制而维持潜伏状态;(4)如果细胞受到刺激,细胞内环境发生改变而表达应激基因;(5)导致细胞应激反应基因表达的调节状况也使得AAV基因表达,从而使AAV病毒复制;(6)产生子代病毒并释放,又感染新的正常宿主细胞,建立新的潜伏状态。
用某些可损伤基因的因素如紫外线照射、γ射线照射、各种化学致癌剂或某些代谢抑制剂处理某种类型的哺乳动物细胞,可使之在无辅助病毒存在的情况下能够发生AAV产毒性感染。
虽然这种情形比有辅助病毒存在时每个细胞产生AAV病毒的量要低几个数量级,但上述实验提示AAV病毒并不是一种缺陷性病毒,而是一种强烈偏向于潜伏的病毒。
返回标题第二节AAV病毒的基因组结构和功能人2型腺病毒伴随病毒(AAV-2)的基因组为4681 个核苷酸的单链DNA,全部序列已测定。
正链和负链DN A均可被包装到AAV病毒颗粒中。
AAV-2基因组的结构如图3-1所示。
基因组的两末端为145bp的倒转末端重复序列(inverted terminal repeat, ITR)。
ITR序列之间为AAV病毒的编码区,左侧的ORF编码4种Re p蛋白;右侧的ORF编码3种Cap蛋白。
一.ITR的结构和功能AAV 病毒ITR的序列和结构见图3-2。
每个ITR长145bp。
其中前125bp可形成一个T形的发夹结构,由两个小回纹结构(palindrome)(图2 B和C)组成,旁边为一个较大的回纹结构(A)。
ITR的序列可有两种构型:flip(B回纹接近3’端)或flop(C回纹接近3’端)。
一个特定分子AAV的两个末端形成flip或flop 的机率都相等。
单链形式的AAV ITR容易形成如图2所示的T型发夹结构,还可能形成另外的构型。
ITR序列是AAV病毒的复制、整合、拯救和包装所必需的顺式作用元件。
二.Rep基因的结构和功能Rep基因编码至少4种非结构蛋白:Rep78, Rep 68, Rep 52, Rep 40。
由p5启动子起始的2种mRNA翻译成Rep78和Rep68;p19启动子起始的2种mRNA翻译成Rep52和Rep40(图3.1)。
Rep52和Rep40蛋白C末端的氨基酸序列分别与Rep78和Rep68相同。
Rep 78和Rep68蛋白与AAV基因表达的正负调控有关。
这两种蛋白都可以和ITR中的特定序列( 5’-GCTCGCTCGCTC-3’)结合。
类似的序列在AAV的3个启动子上游均可找到。
当ITR自我折叠时可加强这种结合作用。
Rep78/Rep68具有ATP酶和螺旋酶的功能。
当其与ITR结合时便成为在124位点核苷酸处特异切割的缺口酶,识别的位点是5’-T/TGG。
这两种蛋白对于AA V生活周期的每一时期都是必需的。
在非允许条件下(没有辅助病毒和刺激因素),Rep蛋白只有微量表达,这种表达又能抑制其进一步的表达。
另外,在非允许条件下Rep的表达似乎可抑制AAV基因组以直接方式复制。
近来的研究证明Rep蛋白的表达对位点特异性整合是必需的。
相反,在允许条件下,Rep蛋白的表达对AAV病毒从整合状态的拯救、各种AAV基因的表达和AAV DNA的复制都是必需的。
Rep52和Rep40参与了病毒的装配,它们在病毒双链DNA合成中是不需要的,但在单链DNA和病毒颗粒的累积中则是必需的。
三.Cap基因的结构和功能Cap基因编码衣壳蛋白,其转录从p40启动子开始,形成约2.6kb和2.3kb mRNA,拼接后分别编码三个结构蛋白VP1、VP2和VP3(图2) ,分子量分别为87、73和61kDa,在成熟毒粒中的比例为1:1:10。
没有VP1时,VP2和VP3就可以包装子代单链DNA。
但这样的毒粒感染性较低,提示VP1在病毒颗粒的稳定性或感染性上是需要的。
VP2在病毒样空颗粒的装配中起重要作用。
VP3 似乎需要与其它两个中的一个一起,完成核定位任务。
返回标题第三节重组AAV的产生原理及常规制备、检测方法在基因治疗研究中,重组逆转录病毒和重组腺病毒在基因转移载体中一直占主导地位。
但近年来这一情况有所改变,用AAV作基因转移载体已成为基因治疗研究的热点。
这是由于AAV具有以下特点:(1)安全性好。
迄今从未发现野生型AAV对人体致病;重组AAV去除了野生型AAV基因组的96%,进一步保证了安全性;(2)宿主范围广。
不仅可转导分裂细胞,而且可转导静止期细胞;(3)野生型AAV可整合到人基因组19号染色体q臂的特定位置,利用这一特点,有可能研制出具有特异性整合功能的AAV载体;(4)AAV-2的基因组仅4681个核苷酸, 便于用常规的重组DNA技术进行操作;(5)物理性质稳定。
在60°C不能被灭活, 能抗氯仿;(6)重组AAV(rAAV)可长期稳定地表达外源基因。
一.重组AAV的产生原理目前在基因治疗研究中所用的AAV载体均由2型AAV改造而来。
AAV-2的ITR中包含了复制、包装、拯救及整合的信号,这使rAAV的产生成为可能:外源基因表达盒可完全取代AAV的编码序列,rep和cap基因产物则可由另一个质粒反式提供。
参照野生型AAV的生活周期,表达外源基因的rAAV的产生需要4种成分参与:1. 载体DNA。
载体DNA质粒包括了145bp的AAV ITR序列,外源基因的表达单位(通常由转录启动子、目的基因和多聚腺苷酸序列组成)位于两个ITR之间。
2. AAV的复制蛋白(Rep)和外壳蛋白(Cap)。
通常由携带它们相应基因的质粒(称为包装质粒)反式提供。
3. 宿主细胞。
多种细胞可用作产生重组AAV的宿主细胞,包括293细胞、HeLa细胞和KB细胞等,其中29 3细胞用磷酸钙转染的效率最高,因此最常用。
4. 辅助病毒。
常用的辅助病毒为腺病毒,疱疹病毒则较少用到。
腺病毒的辅助功能由E1a、E1b、E2a、E4 orf6和VA RNA基因提供;HSV-1的辅助功能由UL5、UL8、UL52和UL29等基因提供。
在辅助病毒存在的条件下,Rep蛋白可以将含有外源基因表达单位的rAAV基因组从载体质粒上拯救出来,并加以复制,得到大量复制形式的rAAV DNA。
随后,Cap蛋白可将单链的rAAV基因组包装成感染性的病毒颗粒。
二.重组AAV的常规制备及纯化方法rAAV载体的常规制备过程见图3.3。
通常采用磷酸钙共转染的方法,将载体质粒和包装质粒共转染经腺病毒感染的HeLa或293细胞(Hermonat and Muzyczka, 1984; Samulski et al., 1987,1989)。
当细胞在腺病毒感染下完全病变后(通常为感染后48-72 h),收集细胞,低速离心、去上清。
此时绝大部分rAAV存在于细胞内,去掉上清没有明显损失。
将细胞团块冻融3~4次,裂解液在55~60°C加热30~60min以灭活腺病毒。
低速离心去除细胞碎片后,将rAAV的粗提物用若干次氯化铯平衡梯度离心进行纯化。
如果rAAV基因组与野生型AAV基因组的大小一致,则密度为1.41 g/cm3,可以与密度为1.35 g/cm3的腺病毒明显分离。
对于转导培养的细胞,用rAAV的粗提物即可;但如果用于动物实验,则需进行若干次氯化铯平衡梯度离心进行纯化,因为即使污染了很少量的腺病毒(无论灭活与否)都能造成病毒接种部位的局部炎症反应。
在rAAV制备过程中,需注意以下问题:1.rAAV 的基因组长度(包括两个ITR在内)应接近野生型AAV基因组4681bp的长度,即外源基因表达盒(包括启动子、目的基因及多聚腺苷酸序列)不超过4.3 kb。
