高中化学铁的化合物练习题
人教版(2019)高中化学必修第一册第三章铁金属材料《第一节铁及其化合物》课时练习

人教版(2019)高中化学必修第一册第三章铁金属材料《第一节铁及其化合物》课时练习一、单选题1.铁片放入下列某溶液中,铁片溶解而且溶液质量增加,也无气体产生,此溶液是( )A .稀H 2SO 4B .AgNO 3C .Fe 2(SO 4)3D .CuSO 42.铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。
某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。
下列说法不正确的是( )A .通过调节分液漏斗的活塞以控制①中气泡产生快慢B .装置①的作用是干燥氢气C .装置②、③中的药品可分别是无水硫酸铜、无水氯化钙D .无需加③装置3.下列离子方程式正确的是A .腐蚀法制作印刷线路板:Fe 3++Cu=Fe 2++Cu 2+B .氯气溶于水:Cl 2+H 2O=2H ++Cl -+ClO -C .AlCl 3溶液中加入过量稀氨水:Al 3++4NH 3∙H 2O=-2AlO +4+4NH +2H 2OD .NaHCO 3溶液中加入足量Ba(OH)2溶液:-3HCO +Ba 2++OH -=BaCO 3↓+H 2O4.下列反应中,改变反应物之间的相对用量,会改变反应产物的是()A.NaOH溶液与CO2B.实验室制Cl2C.Na与H2O D.Fe与Cl25.将H2S和空气的混合气体通入制造印刷电路板的废液中(含FeCl3、FeCl2、CuCl2),可变废为宝回收S,转化关系如图所示。
下列说法错误的是A.该过程的总反应为:2H2S+O2=2S+2H2OB.由图示转化可知氧化性:O2>Fe3+>SC.在转化过程中,废液里的FeCl3、FeCl2、CuCl2可循环利用D.转化过程中涉及到的反应均为氧化还原反应6.下列溶液中一定能大量共存的离子组是A.含有大量H+的溶液:Na+、Al3+、SO24-、Cl-B.滴加酚酞显红色的溶液:Na+、Ba2+、SO24-、HCO3-C.含有大量Fe3+的溶液:K+、Mg2+、SCN-、NO3-D.含有大量ClO-的溶液:H+、Fe3+、SO24-、Cl-7.向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。
人教版(2019)高中化学必修第一册《3.1 铁及其化合物》练习卷(1)

人教版(2019)高中化学必修第一册《3.1 铁及其化合物》练习卷(1)一、单选题(本大题共10小题,共30.0分)1.下列关于铁的说法正确的是()A. 纯铁为灰黑色,所以铁属于黑色金属B. 铁在硫蒸气中燃烧生成Fe2S3C. 纯铁的抗腐蚀能力非常强,铁在干燥的空气里不易被氧化D. 铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在2.下列有关实验的说法正确的是()A. 为测定熔融氢氧化钠的导电性,可在石英坩埚中熔化氢氧化钠固体后进行测量B. 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤C. 制备Fe(OH)3胶体,通常是将NaOH加入FeCl3溶液中D. 某溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32−3.铁的常见化合价有+2价和+3价。
据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。
该化合物可以表示为()A. FeO·3Fe2O3B. FeO·2Fe2O3 C. 2FeO·3Fe2O3D. 2FeO·Fe2O34.下列关于铁的氧化物说法不正确的是()A. 铁的氧化物通常状况下都是有色固体B. 四氧化三铁是一种复杂的铁的氧化物,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+C. 氧化铁是铁锈的主要成分,因此氧化铁俗称为铁锈D. 工业上常使用铁的氧化物作原料冶炼铁5.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是()A. 只有④B. 只有③C. ③和④均错D. 全部错误6.要证明某溶液中不含Fe3+而含有Fe2+,所采用的最佳方法是()A. 加入适量的氯水,再加入少量KSCN溶液B. 加入少量KSCN溶液,再加入适量的氯水C. 加入少量KSCN溶液,再加入适量的铁粉D. 加入适量的氢氧化钠溶液,观察颜色的变化7.向FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后仍有固体存在,则下列判断不正确的是()A. 剩余固体中一定含CuB. 充分反应后的溶液中一定含Fe2+C. 向充分反应后的溶液中加入KSCN,溶液一定不为红色D. 充分反应后的溶液中一定含有Cu2+8.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是()A. NaOHB. KMnO4C. KSCND. 苯酚9.已知下列三组实验:①向KMnO4晶体上滴加浓盐酸,产生氯气;②向FeCl2溶液中通入少量氯气,溶液变黄色;③取实验②中生成的溶液滴在淀粉KI试纸上,试纸变蓝色.则下列判断不正确的是()A. 实验①能够证明Cl−具有还原性B. 上述实验不能证明Fe2+具有氧化性C. 上述实验能够证明氧化性:MnO4−>Cl2>Fe3+>I2D. 由上述实验不能判断氯气能使湿润的淀粉KI试纸变蓝10.下列实验操作正确的是()A. 用图1示装置制备Cl2B. 将混合气体通过装有NaOH溶液的洗气瓶除去Cl2中混有的HClC. 用图2示装置分离CH3COOC2H5与饱和Na2CO3溶液D. 称取1.06 g Na2CO3固体,置于100 mL容量瓶中,加水稀释,配制0.10mol⋅L−1的Na2CO3溶液二、实验题(本大题共4小题,共40.0分)11.某同学欲在实验室中完成Fe与水蒸气反应的实验,实验装置如图甲、乙所示。
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案
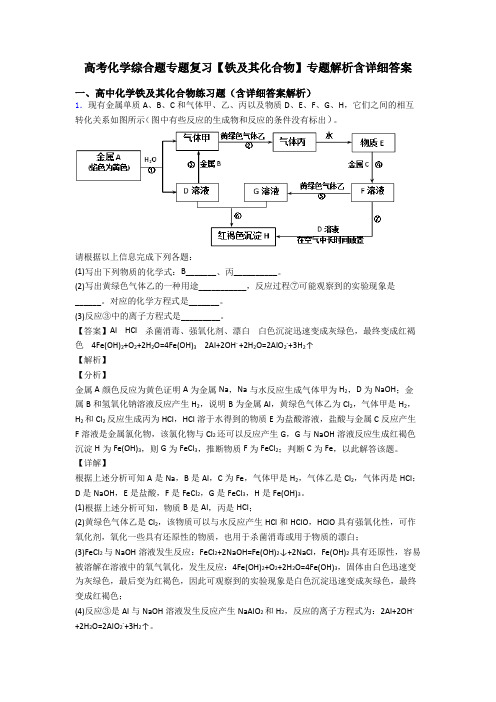
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
高考化学铁及其化合物的综合题试题附答案

高考化学铁及其化合物的综合题试题附答案一、高中化学铁及其化合物1.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义,下列是回收金属铜和刻蚀液再生的流程图,回答下列问题:(1)沉淀A中含有的单质是_________。
(2)通入的气体C的化学式是________。
(3)滤液与气体C反应生成刻蚀液的离子方程式:_________________。
【答案】Fe、Cu Cl2 2Fe2++Cl2=2Fe3++2Cl-【解析】【分析】废液中含有Fe2+、Fe3+、Cu2+,废液中加入过量铁屑后发生反应:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;过滤后得到的沉淀A为Fe、Cu;滤液中含有Fe2+,滤液中通入气体C,得到刻蚀液FeCl3溶液,则气体C为氯气;沉淀A与过量盐酸反应,Fe与盐酸反应生成氯化亚铁,而铜不反应,则沉淀B为Cu,据此进行解答。
【详解】根据上述分析可知沉淀A为Fe、Cu,沉淀B为Cu,滤液含有Fe2+,气体C为Cl2。
(1)废液中含有Fe2+、Fe3+、Cu2+,向废液中加入过量Fe屑,发生反应Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu,所以沉淀A中含有过量的Fe和反应产生的Cu,即沉淀A中含有的金属单质是Fe、Cu;(2)A中含有Fe、Cu,向A中加入盐酸,铁溶解生成FeCl2,而Cu不溶解,过滤得到沉淀B 是Cu,向含有FeCl2的滤液中通入Cl2,发生反应:2FeCl2+Cl2=2FeCl3;(3)Cl2与FeCl2反应产生FeCl3,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
【点睛】本题考查了无机推断,明确常见元素及其化合物性质为解答关键,题目侧重考查学生对基础知识的掌握,有利于提高学生的分析、理解能力及灵活应用能力。
2.D、E为中学化学常见的单质,在一定条件下C、D间能发生反应。
高中化学《铁及其化合物》练习题(含解析)

高中化学《铁及其化合物》练习题学校:___________姓名:___________班级:_________________一、单选题1.珊瑚是由无数珊瑚虫分泌出的石灰质长期积淀而形成的。
红珊瑚之所以是红色,最有可能的是含有 ( )A .NO 2B .Fe 3O 4C .Fe 2O 3D .Al 2O 32.下列关于物质用途的叙述中不正确的是( )A .Na 2O 2可用作呼吸面具中的供氧剂B .硅胶多孔,吸水能力强,可做食品干燥剂C .Al(OH) 3可作治疗胃酸过多的一种药剂D .四氧化三铁俗称铁红,可用于作油漆、红色涂料3.化学与生产、生活、环境密切相关,下列有关说法错误的是( )A .氧化铁可用于红色油漆和涂料B .明矾可用于自来水的杀菌消毒C .N95活性炭口罩可用于防霾,其原理是吸附原理D .氨气易液化,汽化时会吸收大量热,可做制冷剂4.下列试剂的保存方法错误..的是( ) A .实验室少量的钠保存在煤油中B .浓硝酸保存在无色细口玻璃瓶中C .存放FeSO 4溶液时加入少量铁粉D .NaOH 溶液保存在橡皮塞的试剂瓶中5.将m g 铁和氧化铁的混合物加入100mL 浓度为11mol L -⋅盐酸中,恰好完全反应,放出标准状况下的气体0.448L 。
滴加KSCN 溶液,溶液不变色。
则下列判断正确的是( )A .原混合物中()23Fe O :(Fe)3:1n n =B .无法计算原混合物的质量C .收集产生的气体刚好能与20.224L Cl 完全反应D .向溶液中通入20.025mol Cl ,可以将2Fe +完全转化为3Fe +6.1.12克铁粉加入25mL 2mol/L 的氯化铁溶液中,正确的是( )A .溶液中[Fe 2+]<[Fe 3+]B .溶液中[Fe 2+]>[Fe 3+]C .部分Fe 3+被氧化D .在反应后的溶液中加入KSCN 溶液,会出现血红色沉淀7.下列有关溶液组成的描述合理的是()+、Cl-、I-A.无色溶液中可能大量存在Fe3+、NH4-、Cl-B.酸性溶液中可能大量存在Na+、ClO-、SO24-C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-、SCN-D.FeCl3溶液中可能大量存在Mg2+、Al3+、MnO48.N A代表阿伏加德罗常数的值。
高考化学铁及其化合物综合练习题附答案

高考化学铁及其化合物综合练习题附答案一、高中化学铁及其化合物1.有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如下实验:请回答:(1)X的化学式_________________,挖出后在空气中容易发黄的原因______________。
(2)写出溶液分二等份,加KSCN无明显现象后,滴加双氧水的两个离子方程式:___________________,_________________。
【答案】Fe2(OH)2CO3或Fe(OH)2·FeCO3 +2价铁元素被空气氧化为+3价铁元素2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-= Fe(SCN)3【解析】【分析】⑴先计算分解生成的水的物质的量,再计算CO2的物质的量,根据现象得出含有亚铁离子并计算物质的量,根据比例关系得出化学式。
⑵滴加双氧水是Fe2+与H2O2反应生成Fe3+,Fe3+与3SCN-反应生成血红色。
【详解】⑴分解生成的水是1.8g,物质的量是0.1mol;无色无味气体是CO2,物质的量是0.1mol;黑色固体用稀硫酸溶解后分为两等分,滴加KSCN溶液没有实验现象,然后滴加双氧水变为血红色,则含有亚铁离子;另一份加入足量的氢氧化钠溶液得到沉淀,过滤洗涤并充分灼烧后得到8g固体,该固体是氧化铁,物质的量是0.05mol,其中铁元素的物质的量是0.1mol,则黑色固体中亚铁离子的物质的量是0.2mol,所以氧化亚铁是0.2mol,X中相当于含有0.1氢氧化亚铁和0.1mol碳酸亚铁,所以化学式为Fe2(OH)2CO3或Fe(OH)2·FeCO3,挖出后在空气中容易发黄的原因是+2价铁元素被空气氧化为+3价铁元素;故答案为:Fe2(OH)2CO3或Fe(OH)2·FeCO3;挖出后在空气中容易发黄的原因是+2价铁元素被空气氧化为+3价铁元素。
(完整版)高中化学铁及其化合物专题练习

铁及其化合物一、选择题(本题包括10小题,每小题5分,共50分)1.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是()①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中A.②③①④B.③②①④C.③①②④D.①②③④2.已知下述三个实验中均有化学反应发生。
下列判断正确的是()A.实验①中铁钉只做还原剂B.实验②中Fe2+既显氧化性又显还原性C.实验③中发生的是置换反应D.上述实验证明氧化性:Fe3+>Fe2+〉Cu2+3.在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN 溶液,无明显现象,下列叙述不.正确的是()A.白色沉淀是BaSO4和BaSO3B.溶液的酸性增强C.白色沉淀是BaSO4D.FeCl3全部被还原为FeCl24.某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是()A.Fe3+B.Mg2+C.Fe2+D.Al3+5.下列离子方程式书写正确的是()A.FeO固体放入稀硝酸溶液中:FeO+2H+===Fe2++H2OB.过量的铁粉与稀硝酸溶液反应:Fe+4H++NO错误!===Fe3++NO↑+2H2OC.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2OD.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O6.某学生设计了如图所示的方法,鉴定盐A的组成成分。
由此分析,下列结论中正确的是( )A.A中一定有Fe3+B.C中一定有Fe3+C.B为AgI沉淀D.A一定为FeBr2溶液7.高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。
湿法制备的主要反应方程式为2Fe(OH)3+3ClO -+4OH-===2FeO2-,4+3Cl-+5H2O。
2020-2021高考化学综合题专练∶铁及其化合物含答案

2020-2021高考化学综合题专练∶铁及其化合物含答案一、高中化学铁及其化合物1.下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质。
(1)①的化学式为_______,⑤和⑥反应的化学方程式为_______________。
(2)实验室由⑧制取⑨的离子方程式为____________________;⑨转变为⑩的化学方程式为____________________。
由⑨转变为⑩的反应现象为__________________。
【答案】Al2O3 2Al+Fe2O32Fe+Al2O3 Fe2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀逐渐变为灰绿色最后变为红褐色【解析】【分析】①到⑩分别代表反应中的一种物质,且它们均为中学化学中的常见物质,①能与酸或碱反应,且①电解生成氧气,则①为Al2O3,②中含AlO2-离子,③中含Al3+离子,④为Al(OH)3,⑤为单质Al,⑤⑥发生铝热反应,⑦为Fe,⑧中含Fe2+离子,⑨为Fe(OH)2,⑩为Fe(OH)3,Fe(OH)3受热分解产生⑥是Fe2O3,然后结合物质的性质及化学用语来解答。
【详解】根据上述分析可知:①为Al2O3,②为AlO2-,③为Al3+,④为Al(OH)3,⑤为Al,⑥为Fe2O3,⑦为Fe,⑧为Fe2+,⑨Fe(OH)2,⑩为Fe(OH)3。
(1)由上述分析可知,①为Al2O3,⑤和⑥反应的化学方程式为2Al+Fe2O3Al2O3+2Fe;(2)实验室由Fe2+变为Fe(OH)2的操作方法是向其中加入NaOH溶液,因此由⑧制取⑨发生的离子反应为Fe2++2OH-=Fe(OH)2↓;由于Fe(OH)2不稳定,容易被溶解在其中的氧气氧化变为Fe(OH)3,则由⑨转变为⑩的离子方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,由⑨转变为⑩的反应现象为白色沉淀会逐渐由白色变为灰绿色,最后变为红褐色。
高中化学-铁的重要化合物
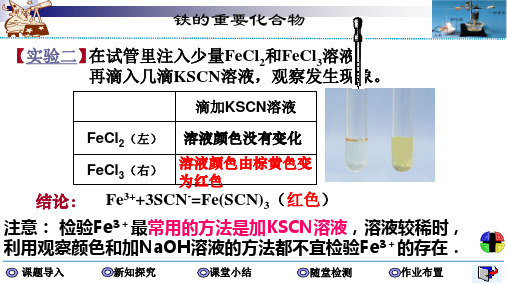
铁三角
Fe0 还原性
H+、Cu2+ 还原剂
C、H2、
还
原 Zn、Fe、Cu、
Fe2+ 剂 强氧 Cl2、KMnO4
氧化性 还原性
化剂 H2O2、 HNO3
还原剂 C、CO、
Fe3+
氧化性
铁的重要化合物
随堂检测
1、要证明某溶液中不含Fe3+而可能含有Fe2+。进行实验操 作的顺序有:①加入足量氯水,②加入足量高锰酸钾溶液, ③加入少量硫氰化钾溶液,其中顺序正确的是 ( )
沉降
溶液接近透明
有明显沉降溶液半 透明
沉淀沉在底部 溶液 接近透明
结
明矾和硫酸铁溶液可以和悬浮于水中的泥沙形
成絮状不溶物沉降下来,使水澄清,可用做净水剂。
论
4.铝、铁的混合物溶于足量的盐酸中,再加入过量的 NaOH
溶液,在空气中静置,当红褐色沉淀不再增加,将沉淀滤
出并充分灼烧,得到的固体残留物恰好跟原混C合物的质量
铁粉, KSCN溶液
不显红色
2Fe3++Fe=3Fe2+
氯水,振荡 溶液显红色 2Fe2++Cl2=2Fe3++2Cl-
课题导入
新知探究
课堂小结
随堂检测
作业布置
铁的重要化合物
思考题:为何在新配制的氯化亚铁溶液中,一般要 加入铁粉?请用方程式表示原因。
防止Fe2+被氧化
Fe+2Fe3+ === 3Fe2+
相等,则此合金中铝的质量分数为
(
)
A.22.2% B.75.7% C.30.0% D.80.6%
解析 根据题意,物质之间的转化如下图。 Al、Fe 合金—H—+→盐过—量—O→H-Fe(OH)3↓—— △→Fe2O3
高中化学铁的练习.总结精品

高二化学测试题—铁与其化合物一、选择题:(每小题只有一个选项符合题意)1、、、、四种金属中两种组成的混合物12 g,与足量盐酸反应放出H20.5 g,则混合物中必定含有的金属是A.钠B.镁C.铝D.铁2、将5.32 g纯溶于足量稀H24中,在加热条件下用2.53 g3去氧化溶液中的2+,充分反应后余下的2+还原0.0092才能完全氧化,则3的还原产物中N的化合价是A.–3 B.+4 C.+3 D.+23、将8.4 g铁粉与3.2 g硫粉混合隔绝空气加热,使之充分反应,再将反应后的物质与足量的稀硫酸反应,可得到气体体积(标况下)是A.1.12 L B.2.24 L C.3.36 L D.以上都不对4、全部氮的氧化物都能跟灼热的铁粉按下式反应:4+ 33O4+ 22若将0.2通过50 g灼热的铁粉,反应完全后恰好生成0.1 N2和0.13O4,则的分子式为A.-B.2 C.N2O D.N2O55、将适量铁粉放入FeCl3溶液中,完全反应后,溶液中Fe3+和Fe2+浓度相等,则已反应的Fe3+与未反应的Fe3+的物质的量之比是A.2:3 B.3:2 C.1:2 D.1:16、有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是A.22.2% B.30% C.75.5% D.80.6%7、向K24和3的混合溶液中滴入()2溶液,当42-离子完全沉淀时,3+离子也同时被完全沉淀,则原混合溶液中K 24 和3 的物质的量浓度之比为A 、3:1B 、3:2C 、2:1D 、2:3 8、2 的盐酸和硫酸各100 ,分别加入等质量的铁粉,反应结束后,所生成的气体质量比为2∶3,则往盐酸中加入铁粉的质量是 A .2.8 g B .5.6 g C .8.4 g D .11.2 g9、某金属与足量的稀硫酸反应,生成该金属的三价正盐和氢气。
高中化学---铁和铁的化合物例题和解答

课时作业31 铁和铁的化合物时间:45分钟 总分值:100分一、选择题(15×4分=60分)1.以下有关纯铁的描述正确的选项是( )A .熔点比生铁的低B .与一样浓度的盐酸反响生成氢气的速率比生铁的快C .在潮湿空气中比生铁容易被腐蚀D .在冷的浓硫酸中可钝化【解析】 生铁是铁与碳的合金,由于合金的熔点低于组成成分任一物质的熔点,故A 不正确。
生铁与盐酸反响时,铁、碳在盐酸中形成无数微小的原电池,使反响速率比纯铁要快,B 不正确。
同样道理,生铁在潮湿空气中Fe 、C 形成原电池发生析氢或吸氧腐蚀,腐蚀速率远比纯铁要快,C 不正确。
金属铁、铝在常温下皆在浓硫酸、浓HNO 3中发生钝化,D 正确。
【答案】 D2.用即热饭盒盛装食物,可以得到热烘烘的饭菜。
原因是即热饭盒的底部装入了混有镁、铁粉末的高密度聚乙烯,进展简单的操作后,水和镁就会发生剧烈的化学反响,放出的热量便可使食物变热。
其中铁可能是( )A .一种反响物B .催化剂C .起导热作用D .增大镁与水分子的接触时机【解析】 此题考察催化剂原理。
依题意,镁粉与铁粉混合在水中发生剧烈反响放出热量,而镁单独与水反响比较缓慢,说明反响物没有变化,但反响速率加快了,可推知,铁可能是催化剂。
【答案】 B3.以下金属冶炼的反响原理,错误的选项是( )A .2NaCl(熔融)=====通电2Na +Cl 2↑B .MgO +H 2=====△Mg +H 2OC .Fe 3O 4+4CO=====高温3Fe +4CO 2D .2HgO=====△2Hg +O 2↑【解析】 Na 、Mg 均为十分活泼的金属,因此采用电解熔融NaCl 、熔融MgCl 2的方法冶炼。
Fe 为较活泼金属,通常采用热复原法冶炼,复原剂可以用H 2、CO 、Al 等;Hg 为很不活泼金属,一般用热分解法冶炼。
【答案】 B4.以下化合物中,不能由化合反响而得到的是( )A .NH 3B .Fe(OH)3C .FeCl 3D .Al(OH)3 【解析】4Fe(OH)2+O 2+2H 2O===4Fe(OH)3;2Fe +3Cl 2=====△2FeCl 3。
2020-2021高考化学铁及其化合物综合经典题附答案

2020-2021高考化学铁及其化合物综合经典题附答案一、高中化学铁及其化合物练习题(含详细答案解析)1.在下列物质转化关系中,反应的条件和部分产物已略去。
已知:甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
回答下列问题:(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,写出该物质的电子式:_______,该化合物中存在的化学键有:_________。
与甲在同一周期的金属元素(包括甲),按单质熔点由高到低的顺序排列依次为:_______(元素符号)。
(2)反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置是_______;写出反应Ⅱ的化学方程式_______。
(3)通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性_______(填“强”或“弱”),比较二者金属性强弱的依据还可以是_______(写出一种即可)。
(4)下列关于第三周期金属元素的单质及其化合物的说法正确的是_______(选填答案编号)a.工业上一般用电解法进行冶炼,获取单质b.金属阳离子都具有相同的电子排布式c.氢氧化物都能容易分解得到相应的氧化物d.金属氯化物都是电解质,都属于离子化合物【答案】离子键、共价键 Al、Mg、Na 第四周期Ⅷ族高温Fe3O4+H2强 NaOH是强碱,而Fe(OH)3是弱碱 ab3Fe+4H2O−−−→【解析】【分析】已知反应Ⅲ是工业制盐酸的反应,则丙为H2,丁为HCl;反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则甲为金属钠;反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为铁。
据此解答。
【详解】(1)由以上分析知,甲为金属钠,则焰色反应为黄色的物质为NaOH,电子式为,该化合物中存在的化学键有离子键、共价键。
与甲在同一周期的金属元素有Na、Mg、Al三种,它们的离子带电荷数依次增多,离子半径依次减小,所以按单质熔点由高到低的顺序排列依次为Al、Mg、Na。
3.1 铁及其化合物 练习【新教材】人教版(2019)高中化学必修一

3.1 铁及其化合物基础知识点练习知识点1 铁单质1.常温下,下列物质可以用铁制容器盛装的是( )A. 浓硫酸B. 浓盐酸C. 硫酸铜溶液D. 硝酸银溶液答案 A2.下列叙述正确的是( ) A.纯铁为灰黑色B.铁锈的主要成分是34Fe O ,不能保护内层金属C.铁在干燥的空气里不易被氧化D.在加热条件下铁与氯气反应生成2FeCl 和3FeCl答案 C3.下列关于铁与水反应的描述错误的是( ) A.铁与水蒸气反应的产物是黑色的23Fe OB.红热的铁能与水蒸气反应,产生的气体可在空气中燃烧C.铁与水蒸气的反应是氧化还原反应D.常温下,Fe 与2H O 不反应,但能与空气中的22O H O 、共同作用发生反应答案 A4.把铁片投入到下列溶液中,铁片质量减少,且没有气体产生,此溶液是( ) A.4FeSO 溶液 B.24H SO 溶液 C.()243Fe SO 溶液D.3AgNO 溶液答案C知识点2 铁的氧化物4.司南是中国古代劳动人民在长期的实践中对磁石磁性认识的发明,《论衡》中记载有“司南之杓,投之于地,其柢指南”。
下列说法正确的是( )A.“杓”的主要成分是四氧化三铁B.纯净的铁在常温下与水反应可得到磁性氧化铁C.磁性氧化铁为23Fe O 和FeO 的混合物 D .Fe 、23Fe O 、34Fe O 均具有磁性答案 A5.下列关于铁的氧化物说法不正确的是( ) A.铁的氧化物通常状况下都是有色固体B.四氧化三铁是一种复杂的铁的氧化物,它与盐酸反应后的溶液中同时存在2+Fe 和3+FeC.氧化铁是铁镑的主要成分,因此氧化铁俗称为铁锈D.工业上常使用铁的氧化物作原料冶炼铁答案 C6.铁的常见化合价有+2价和+3价。
据研究,铁在浓HNO 3中发生钝化时,可生成一种化学式为Fe 8O 11的化合物,它可以看作由FeO 和Fe 2O 3组成的复杂氧化物。
该化合物可以表示为( )A .FeO·3Fe 2O 3B .FeO·2Fe 2O 3C .2FeO·3Fe 2O 3D .2FeO·Fe 2O 3答案 C知识点3 铁的氢氧化物7. 某同学欲利用下图装置制取能较长时间存在的Fe (OH )2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。
3.1 铁及其化合物同步练习 高一化学人教版必修第一册

第三章铁、金属材料第一节铁及其化合物课后练习2021-2022学年高中化学人教版2019必修第一册一、单选题(共17题)1.某固体X,可能含有BaCl2、NaHCO3、Fe2O3、Cu、NaAlO2中的一种或几种,进行如下实验:①取一定量样品溶于水中,得到固体A和溶液B;②向A中加入足量稀盐酸,得到澄清溶液C。
下列说法错误的...是()A. 固体A可能溶于NaOH溶液B. 溶液C能与NaHCO3溶液反应产生沉淀C. 向溶液C中加入KSCN溶液,若不变色,则混合物X不含Fe2O3D. 向溶液B中加入NaOH溶液,若出现白色沉淀,则X中必定有BaCl2和NaHCO32.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( )A. FeOB. Fe2O3C. Fe3O4D. Fe2(SO4)33.下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )A. AB. BC. CD. D4.证明某溶液中只含Fe2+而不含Fe3+的实验方法是()A. 只滴加KSCN溶液B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色C. 先滴加氯水,再滴加KSCN溶液后显红色D. 滴加NaOH溶液,产生白色沉淀5.证明溶液中是否有Fe2+,其正确的操作顺序是()①加少许酸化的KMnO4溶液②加少许氯水③滴加少许KSCN溶液A. ①②B. ②③C. ①②③D. ③②6.某溶液含有K+、Fe3+、SO42-、OH-、I-中的几种。
取样,滴加KSCN溶液后显血红色。
为确定该溶液的组成,还需检验的离子是( )A. K+B. I-C. SO42-D. OH-7.检验储存在密封性不佳的试剂瓶中的硫酸亚铁是否变质,可以加入的试剂是()A. 硫氰化钾B. 硝酸银C. 盐酸酸化的氯化钡D. 硝酸酸化的硝酸钡8.为了检验某FeCl2溶液是否变质,可向溶液中加入()A. KSCN溶液B. 铁片C. HCl溶液D. 石蕊溶液9.铁的常见化合价有+2价和+3价。
2023年人教版新教材安徽省高中化学学业水平考试复习测评(七)铁及其化合物
合格演练测评(七)(铁及其化合物)姓名:__________班级:__________正确率:__________A.Fe2O3——红棕色B.Na2O2——淡黄色C.Fe2(SO4)3——黄绿色D.FeSO4溶液——浅绿色答案:C2.在常温下,下列溶液不能溶解铁的是()A.稀硫酸B.FeCl3溶液C.CuCl2溶液D.浓硫酸答案:D3.能使FeSO4与KSCN混合溶液变为红色的试剂是() A.稀硫酸B.新制氯水C.硝酸银溶液D.澄清石灰水答案:B4.铁在一定条件下分别与O2、水蒸气反应的相同产物是() A.FeO B.Fe2O3C.Fe3O4D.Fe(OH)3答案:C5.下列关于铁与水蒸气反应的叙述不正确的是()A.是氧化还原反应B.铁是还原剂C.需在高温条件下进行D.产物是氧化铁和氢气答案:D6.下列各组离子在溶液中能大量共存且为无色的是()A.H+、Cl-、Ag+、NO-3B.Na+、CO2-3、Cl-、Ca2+C.Fe3+、SO2-4、Na+、Cl-D.H+、Ba2+、Cl-、NO-3答案:D7.(2019年1月·广东学考·单选Ⅰ)下列条件下,铁制品最容易生锈的是()A.全浸在纯水中B.半浸在盐水中C.露置在干燥空气中D.半浸在有机溶剂中答案:B8.下列说法不正确的是()A.铁与纯氧气和水蒸气反应都能生成四氧化三铁B.铁在高温下与水蒸气的反应是置换反应C.铁与盐酸反应生成氯化铁和氢气D.铁与盐酸或水蒸气反应,都作还原剂答案:C9.下列金属单质中,能从CuSO4溶液中置换出铜的是() A.汞B.银C.钠D.铁答案:D10.(2019年6月·广东学考·单选Ⅱ)铁元素在地壳中含量丰富。
下列有关说法不正确的是()A.不锈钢属于铁合金B.用KSCN溶液可检验溶液中的Fe3+C.铁制品腐蚀过程中铁被还原D.浸在有机溶剂中答案:C11.下列反应能通过置换反应生成铁的是()①Zn+FeCl2(溶液)②Na+FeSO4(溶液)③Fe2O3+CO(高温)④Fe3O4+H2(高温)A.①③④B.①②③C.①④D.①②③④答案:C12.向盛有Fe2(SO4)3溶液的试管中滴入几滴KSCN溶液后,溶液呈()A.红色B.黄色C.无色D.浅绿色答案:A13.下列物质,受热后不能分解的是()A.NaOH B.Fe(OH)3C.Al(OH)3D.NaHCO 3答案:A14.下列有关氢氧化亚铁及其制备方法的叙述不正确的是()A.氢氧化亚铁易被空气氧化B.氢氧化亚铁为灰绿色絮状沉淀C.可利用上图所示装置制备氢氧化亚铁D.实验中所用氢氧化钠溶液应预先煮沸答案:B15.为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的()A.铜粉B.铁粉C.锌粉D.H2SO4答案:B16.某同学欲探究铁及其化合物的性质,他的下列实验方案可行的是()A.在常温下将铁片加入浓硫酸中:探究铁的活泼性B.将热的NaOH溶液滴入FeCl3溶液中:制备Fe(OH)3胶体C.在蒸发皿中加热蒸干FeSO4溶液:制备FeSO4·6H2O晶体D.将Cu粉加入Fe(NO3)3溶液中:验证Fe3+的氧化性强于Cu2+答案:D17.苹果汁饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色变为棕黄色,榨汁时加入维生素C可有效防止这种现象发生,说明维生素C具有()A.氧化性B.还原性C.酸性D.碱性答案:B18.把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为()A.1∶1 B.1∶2C .3∶2D .2∶3答案:D 19.等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下充分反应,则在相同的条件下,产生氢气的体积比是( )A .1∶1B .3∶4C .2∶3D .4∶3答案:B20.(2018年6月·广东学考·单选Ⅱ)铁块在O 2中加热一段时间后增重了20 g 说明此过程中至少( )A .消耗了20 g O 2B .生成20 g FeOC .生成20 g Fe 3O 4D .生成20 g Fe 2O 3 答案:A21.A 、B 、C 是中学化学中常见的单质,A 是金属单质,B 、C 是气体单质。
高考化学铁及其化合物(大题培优 易错 难题)含详细答案

高考化学铁及其化合物(大题培优易错难题)含详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:已知①A、B、C、D、G含有同种元素。
②纯A(单质)B溶液D固体G溶液颜色银白色黄色红棕色浅绿色③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:(1)写出D的化学式:___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
(3)写出反应A→B的化学方程式:_________________________________。
(4)B→F的离子方程式为________;G与次氯酸反应的离子方程式为________________________________。
【答案】Fe2O3先产生白色沉淀,迅速变为灰绿色,最后变为红褐色 2Fe+3Cl22FeCl3 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ H++2Fe2++HClO=2Fe3++Cl-+H2O【解析】【分析】结合框图,D固体呈红棕色,则其为Fe2O3;A、B、C、D、G含有同种元素,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,则B为FeCl3,G中含有Fe2+,A为Fe。
由“B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G”,则F为H2SO4,G为FeSO4;E是通常情况下密度最小的气体,则E为H2。
由B→C→D的转化可推知,C为Fe(OH)3。
【详解】(1)由以上分析可知,D为氧化铁,其化学式:Fe2O3。
答案为:Fe2O3;(2)FeSO4生成Fe(OH)3,可先加碱、后氧化,所出现的现象为先产生白色沉淀,迅速变为灰绿色,最后变为红褐色。
高考化学知识点复习《铁及其化合物》真题练习含答案

高考化学知识点复习《铁及其化合物》真题练习含答案一、单选题1.(2023年7月黑龙江省普通高中学业水平合格性考试)长江以南的低山丘陵区普遍存在着红色土壤,有人说主要因其含铁质(三价铁)相对较多。
某研究小组设计简单实验验证该说法是否正确,应选择的试剂是 A .KClB .KNO 3C .K 2SO 4D .KSCN 【答案】D【解析】验证土壤中是否含有Fe 3+,可以使用KSCN 溶液检验,向蒸馏水中加入少量的土壤后搅拌,土壤中的离子可以进入到蒸馏水中,过滤后得到澄清溶液,向溶液中滴加KSCN 溶液,若溶液变成红色,则说明土壤中含有Fe 3+,故答案选D 。
2.(2023年黑龙江省春季普通高中学业合格考试)向盛有()43Fe SO 溶液的试管中,滴入几滴KSCN 溶液,溶液呈A .无色B .红色C .白色D .蓝色 【答案】B【解析】向盛有()43Fe SO 溶液的试管中,滴入几滴KSCN 溶液,溶液中的反应为:3+-3Fe 3SCN Fe(SCN)+=,生成血红色溶液。
答案选B 。
3.(2023年1月辽宁省普通高中学业水平合格性考试)下列关于铁及其化合物的叙述错误的是 A .铁具有导电、导热、延展性B .氧化铁常用作涂料、油漆的红色颜料C .用铜粉除去2FeCl 溶液中含有的少量3FeCl 杂质D .实验室制备氢氧化亚铁的关键是防止氧气的干扰【答案】C【解析】A .铁是一种金属单质,具有导电、导热、延展性,A 正确;B . 氧化铁是红棕色粉末,常用作涂料、油漆的红色颜料,B 正确;C .氯化铁溶液和铜反应得到氯化亚铁和氯化铜,用铜粉除去2FeCl 溶液中含有的少量3FeCl 杂质时会引入新杂质氯化铜,C 不正确;D .氢氧化亚铁具有还原性,易发生:22234Fe(OH)+O +2H O=4Fe(OH) ,实验室制备氢氧化亚铁的关键是防止氧气的干扰,D 正确;答案选C 。
4.(2023年1月辽宁省普通高中学业水平合格性考试)下列可用于检验3Fe +的试剂是A .稀盐酸B .KCl 溶液C .4CuSO 溶液D .KSCN 溶液 【答案】D【解析】铁离子与稀盐酸、KCl 溶液和4CuSO 溶液均不反应,铁离子能发生特征反应:3-3Fe 3SCN Fe(SCN)++,所得溶液呈血红色,故可以用KSCN 溶液检验3Fe +,故选D 。
专题7:铁及其化合物精选试题(高中复习必备)

专题7:铁及其化合物一、单选题(共10题;共20分)1.下列有关铁及其化合物的说法中正确的是()A. 赤铁矿的主要成分是Fe3O4B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤D. Fe3+与KSCN溶液产生红色沉淀2.下列说法错误的是()A. 钠在空气燃烧时先熔化,再燃烧,最后所得的产物是Na2O2B. 铝因在空气中形成了一薄层致密的氧化膜,保护内层金属,故铝不需特殊保护C. 铁因在潮湿的空气中形成的氧化物薄膜疏松,不能保护内层金属D. SiO2是酸性氧化物,不与任何酸发生反应3.下列变化不能通过一步反应直接完成的是()A. Fe→Fe3+B. Fe→Fe3O4C. Al(OH)3→Al2O3D. Al→Al(OH)34.一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2.则A、C可能是()①Fe、FeCl3②C、CO2③AlCl3、NaAlO2④NaOH、NaHCO3⑤S、SO3⑥Na2CO3、CO2.A. ②③④⑥B. ②③④⑤⑥C. ①②③④⑥D. ①②③④⑤⑥5.一定条件下,下列各组物质能一步实现如图所示转化关系的是()A. AB. BC. CD. D6.常温下,将一定量的铁粉加入到50 mL10mol/L硝酸(①)中,待其充分反应后,收集到的气体换算成标准状况下的体积为4.2L(②),所得溶液能够使淀粉碘化钾溶液变蓝(③),该溶液也能使酸性高锰酸钾褪色(④)。
下列说法正确的是()A. ①中数据表明,硝酸是浓硝酸,因此Fe已经钝化B. ②中数据表明,生成的气体中只有NO2C. ③中现象表明,硝酸一定有剩余D. ④中现象表明,溶液中一定含有Fe2+7.FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是()A. 溶液中一定含Cu2+B. 溶液中不一定含Fe2+C. 剩余固体一定含Cu和FeD. 加入KSCN溶液一定不变红色8.铜片和铁片(均少部分被氧化)一起放入足量的盐酸中充分反应。
高考化学复习高三化学练习(铁和铁的化合物).docx

高中化学学习材料(灿若寒星**整理制作)高三化学练习(铁和铁的化合物)1.按图所示进行化学反应,完全反应后左边试管中剩余的固体为A.Fe(OH)3B.Fe(OH)2C.Fe2O3D.Fe3O42.往浅绿色的Fe(NO)2溶液中逐滴加入稀盐酸,溶液的颜色A.颜色变浅B.变为深绿色C.没有改变D.变棕黄色3.某学生设计了如下图中的方法对A盐进行鉴定:由此分析,下列结论中,正确的是A.A中一定有Fe3+B.C中一定有Fe3+C.B为AgI沉淀D.A一定为FeBr2溶液4.通过下列有关操作和现象,可以确定溶液中一定有Fe3+离子存在的是A.加入足量铁粉后,溶液变成浅绿色B.滴入KI溶液后,溶液呈棕黄色C.滴入NaOH溶液后,析出的沉淀由白色逐渐变为灰绿色,最后变为红褐色D.滴加KSCN溶液后,变为红色5.在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是A.若滤出的固体中只有铜,则溶液中一定含有的阴离子是Fe2+,一定不含Cu2+B.若滤出固体中含铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+D.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Cu2+和Fe2+,一定不含Fe3+6.将铁屑溶于过量的稀盐酸后,再加入少量的下列物质,不会有Fe3+生成的是①硫酸②氯水③硝酸锌④氯化铜A.只有④B.①④C.①③④D.①②③④7.烧过菜的铁锅未及时洗涤(残液中含NaCl),第二天使出现红棕色锈斑(失水后的产物)。
下列整个过程可能发生的变化不符合事实的是A .Fe -3e -=Fe 3+B .2H 2O+O 2+4e -=4OH -C .4Fe(OH)2+O 2+2H 2O=4Fe(OH)3D .Fe 2++2OH -=Fe(OH)2 8.向混有Fe 2O 3的铁屑中加入足量的稀硫酸直至固体全部溶解所得溶液中不含Fe 3+,生成的Fe 2+和H 2的物质的量之比为4:1,则原混合物中Fe 2O 3和Fe 的物质的量之比为A .4:1B .3:1C .1:2D .1:19.a mol FeS 与b mol FeO 投入到V L c mol/L 的硝酸溶液中充分反应,产生NO 气体,所得澄清溶液成分可看作是Fe(NO 3)3、H 2SO 4的混合液,则反应中未被还原的硝酸可能为A .(a+b)×63 gB .(a+b) ×126gC .(a+b) molD .1)39V (mo b a c +- 10.在硫酸铁溶液中加入a g Cu ,完全溶解后,又加入b g Fe ,充分反应后得到c g 残余固体,且a>c ,则下列判断正确的是A .最后得到的溶液中含有Fe 3+B .残余固体为铁、铜混合物C .最后得到的溶液中不含有Cu 2+D .残余固体全部是铜11.I 电子工业中常用FeCl 3溶液腐蚀印刷电路板上的部分铜皮。
高考化学提高题专题复习铁及其化合物练习题附详细答案

高考化学提高题专题复习铁及其化合物练习题附详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.在一定条件下,A、B、C、D、E物质相互转化关系如图所示(反应条件和部分产物略),其中A、B、C为单质。
(1)若A为金属,B、C常温下均为气体,D为黑色晶体,E为一种生活中必不可少的物质,则这五种物质的化学式为:A为__,B为__,C为__,D为__,E为__。
(2)A和E在一定条件下反应生成D的化学方程式为__。
【答案】Fe O2 H2 Fe3O4 H2O 3Fe+4H2O(g)Fe3O4+4H2【解析】【分析】A、B、C为单质,若A为金属,B、C常温下均为气体,D为黑色晶体,Fe和H2O反应生成黑色的Fe3O4,Fe和O2反应生成黑色的Fe3O4,氢气和氧气反应生成H2O,符合转化关系,则A是Fe、B是O2、C是H2、E是H2O、D是Fe3O4,据此分析解答。
【详解】A、B、C为单质,若A为金属,B、C常温下均为气体,D为黑色晶体,Fe和H2O反应生成黑色的Fe3O4,Fe和O2反应生成黑色的Fe3O4,氢气和氧气反应生成H2O,符合转化关系,则A是Fe、B是O2、C是H2、E是H2O、D是Fe3O4;(1)通过以上分析知,这五种物质的化学式为:A为Fe,B为O2,C为H2,D为Fe3O4,E为H2O;(2)在高温条件下,Fe和水蒸气反应生成四氧化三铁和氢气,所以A和E在一定条件下反应生成D的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。
2.A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。
试推断:(1)A:__、B:__、C:__、D:__、E:__;(2)固体C加热得到A的化学反应方程式__;(3)得到红褐色沉淀E的化学反应方程式__。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁的化合物
1.把生铁冶炼成碳素钢要解决的主要问题是
A.除去生铁中的各种杂质,把生铁提纯
B.适当降低生铁里的含碳量,除去大部分硫、磷等有害杂质
C.用还原剂把铁的氧化物还原成铁D.加入合金元素改善生铁性能
2.制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,剩余固体不可能是
A.有铜无铁
B.有铁无铜
C.铁、铜都有
D.铁、铜都无
3.下列实验操作中,仪器需插入液面下的是
A.分液时,分液漏斗的长颈插入下层液体里B.用水吸收氯化氢的导气管
C.制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中
D.往NaOH溶液中滴加酚酞
4.人体血红蛋白中含有Fe2+,如果误服亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变
为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这
说明维生素C具有
A.酸性B.碱性C.氧化性D.还原性
5.下列反应中,其产物的颜色按红、红褐、淡黄和蓝色顺序排列的是
①金属钠在纯氧中燃烧②FeSO4溶液滴入NaOH溶液,并在空气中放置一段时间
③向FeCl3溶液中滴入KSCN溶液④无水CuSO4放入医用酒精中
A.②③①④B.③②①④C.③①②④D.①②③④
6.把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe
的物质的量之比为
A.1︰1 B.2︰5 C.4︰1 D.3︰1
7.把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,过滤出沉淀,经洗涤、干
燥、灼烧得到a g红色粉末。
则原合金中铁的质量分数是
A.70% B.52.4% C.47.6%D.30%
8.写出下列方程式,是离子反应的只写离子方程式
由Fe2O3制备Fe(OH)3,
FeCl3溶液和铁粉反应:____________________ ____ _ ___ _____________________ ___
FeCl3溶液和铜片反应:______________________ _________ ___________________ FeCl2溶液中加入氯水:______________________ __________ ________________ 9.某课外活动小组设计了如图所示的实验装置进行实
验,回答下列问题:(1)开始实验时夹子e是打开的,
锥形瓶A中发生反应的离子方程式为:
试剂瓶B中可以观察到的现象
是。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到
的现象是,B中反应的离子
方程式是。
(3)如果开启活塞f放掉约2
3
液体,此时试剂瓶B中可能出现的现象是,B中反应的化学方程式
是。
10.某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。
请你填出该同学实验中出现以下现象时的应得结论:
①若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,结论
是。
②若滴入酸性高锰酸钾溶液后不褪色,滴入KSCN溶液变红,结论
是。
③若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液变红,结论
是。
