最新94重要有机化合物的紫外吸收光谱汇总
94种化合物高效液相色谱分析中紫外吸收波长的选择

农 药AGROCHEMICALS 第49卷第8期2010年8月Vol. 49, No. 8Aug. 201094种化合物高效液相色谱分析中紫外吸收波长的选择吴国旭1,翟立红2,毕富春3(1.天津渤海职业技术学院 环境工程系,天津 300402; 2.河北省廊坊市诺农生物工程有限公司,河北 廊坊 065000;3.南开大学 元素有机化学研究所,天津 300071)摘要:研究了94种化合物在高效液相色谱分析中对紫外光波吸收波长的选择,并找出了这些化合物的最大吸收波长和适宜分析波长。
化合物的残留分析可选择最大紫外吸收波长;化合物常规定量分析可选择适宜分析波长,它可以简化操作步骤及减少分析时间。
关键词:化合物;紫外吸收波长;高效液相色谱法中图分类号:TQ450.7 文献标志码:A 文章编号:1006-0413(2010)08-0581-04Selection of UV Absorption Wavelength for 94 Pesticide Analysis by HPLCWU Guo-xu 1, ZHAI Li-hong 2, BI Fu-chun3(1.The Department of Environmental Engineering, Tianjin Bohai College of Professional Technology, Tianjin 300402, China;2.Hebei Langfang Nuonong Bioengineering Co., Ltd., Langfang 065000, Hebei, China;3.Institute of Elemental Organic Chemistry, Nankai University, Tianjin 300071, China)Abstract: The selection of UV absorption wavelength of 94 chemicals by HPLC was studied. The maximum and appropriate absorption wavelengths of the chemicals were chose out. The maximum absorption wavelengths were appropriate for the residue analysis of chemicals. The appropriate absorption wavelengths were appropriate for quantitative analysis of chemicals. The utilizing appropriate absorption wavelengths of chemicals could simply operating steps of analytical methods and reduce operating time. Key words: chemicals; UV absorption wavelength; HPLC随着科学技术的发展,高效液相色谱仪在农药分析中广范使用,特别是紫外可变波长检测器的普及,使农药分析技术得到极大提高。
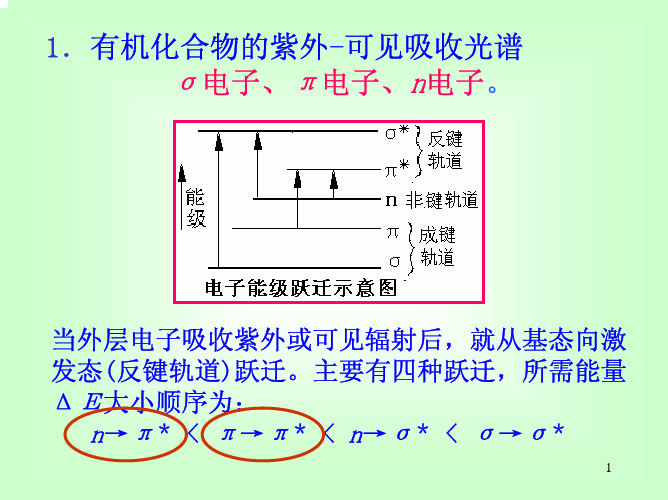
紫外吸收光谱

第二矗紫外吸收光谱2·i波(光)谱分析的一般原理一定频率或波长的电磁波(光)与物质内部分子、电子或原子核等相互作用,物质吸收电磁波的能量,从低能级跃迁到较高能级。
被吸收的电磁波频率(或波长)·取决于高低能级的能级差(见图2-1)。
通过测量被吸收的电磁·波的频率(或波长)和强度,可以得到被测物质的特征波谱,特征波谱的频率(或波长)反映了被测物质的结构特征,被用来作定性分析,波谱的强度则与物质的含量有关,可用于定量分析。
利用物质对电磁波的选择性吸收对其进行分析的方法统称为波(光)谱分析。
高能级图2-1波谱分析的一般原理2·1·]电磁波的基本性质和分类电磁波具有波粒两象性。
光的衍射、干涉及偏振等现象证明了其波动性,电磁波的波动性还体现在它有波长、频率等类似于机械波的特性。
电磁波的波长、频率与光速存在着特定的关系:"·A=。
·(2-1)式中步为频率成为波长籧为光速。
频率一般用赫兹(Hz)为单位;波长用长度单位表示,例如纳米(nm)、微米(pm)、厘米(cm)、米(m)等,视波长大小选择其中的某一种。
光速等于3X1O'。
cm·s1。
电磁波的粒子性早已力量子理论所证明,而光电效应则是粒子性的最有力的实验证明。
量子理论认为光(即电磁波)是由称作光子或光量子的微粒组成的,光子具有能量,其能量大小由下式决E=bu=hcA(2-2)式中E为光子的能量肌为Planck常数,其值为6·624X1O""j·s,其余同式(2-1)。
由式(2-2) 可知光子的能量与频率成正比,与波长成反比。
波长愈长,频率愈低,能量愈小。
已知电磁波的波长后,很容易求出其光子的能量,例如大二300且甲的紫外光的光子能量为:E=hc忱=6·624X1O刊(J·S)X3X1O1o(cm·S@l)「300XlO-,(cm)=6·62XlO-l,J电磁波的波长从10-,nm~l0OOm,覆盖了非常宽的范围,为了便于研究,根据波长大小将电磁波划分为若千个区域(见表2-1)。
有机化合物的紫外-可见吸收光谱
O O
(共轭双键)
一些含有n电子的基团,本身没有生色功能,但当 它们与生色团相连时,就会发生n—π共轭作用,增 强生色团的生色能力,这样的基团称为助色团。
: : :
助色团:-NH2,-OH,-X (孤对电子)等
2
:
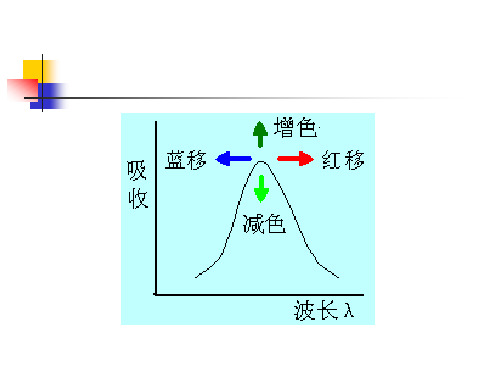
红移和蓝移
3
有机化合物的紫外光谱解析
了解共轭程度、空间效应、氢键等;可对饱和与不饱 和化合物、异构体及构象进行判别。 ⑴ 在200~750nm波长范围内若无吸收峰,则可能是 直链烷烃、环烷烃、饱和脂肪族化合物或仅含一个双 键的烯烃等。若有低强度吸收峰(ε=10~100 L·mol1·cm-1),(n→π跃迁),则可能含有一个简单非共轭且 含有n电子的生色团,如羰基。 ⑵ 若在250~300 nm波长范围内有中等强度的吸收峰 则可能含苯环。
滴定剂与待 测物均吸收
产物吸收
Vsp
Vsp
24
8.5.4 络合物组成的测定
1. 摩尔比法: 固定cM ,改变cR
A
1:1 1.0 2.0
3:1 3,0 c(R)/c(M)
25
2. 等摩尔连续变化法:
M:R=1:1
cM + cR = c(常数)
M:R=1:2
0.5 cM/c cM/c
0 0.2 0.4 0.6 0.8 1 0 0.2 0.4
6
电荷转移吸收光谱
分子中金属离子轨道上的电荷吸收光能后转移到 配体的轨道上,或按反方向转移,这种跃迁称为电 荷转移跃迁,所产生的吸收光谱称为荷移光谱。 本质上属于分子内氧化还原反应 ε一般都较大(104左右),适于微量金属的检测 例:Fe3+与SCN-形成血红色配合物,在490 nm处 有强吸收峰。其实质是发生了如下反应: [Fe3+-SCN-]2+ +hν= [Fe2+-SCN]2+
紫外-可见吸收光谱法全

8. B带
芳香族化合物ππ*跃迁产生的特征精细结 构吸收带。
特点: ➢ 230~270nm 呈 一 宽 峰 , 中 心 为 255nm 左 右 ,
且具有精细结构;(用于识别芳香族化合 物) ➢ε~200 L·mol-1·cm-1; ➢ 于极性溶剂中可能消失。
9. E带 也是芳香族化合物ππ*跃迁产生的特征吸 收带。可分为E1和E2带。 特点: E1带约为180nm(ε> 104 L·mol-1·cm-1 ); E2带约为200nm(ε~ 7000L·mol-1·cm-1 )。
测定同一化合物在不同极性溶剂中n* 跃迁吸收带,就能计算其在极性溶剂中氢键 的强度。
例:在水中,丙酮的n*吸收带为264.5 nm,
能量452.99 kJ·mol-1;在己烷中,该吸收带为
279 nm,能量为429.40 kJ·mol-1。
丙酮在水中形成的氢键强度为452.99 - 429.40 =
9.1.2 无机化合物的紫外-可见吸收光谱 9.1.2.1 电荷转移跃迁(强吸收) 1. 金属配合物或水合离子
(FeSCN)2+、Cl-(H2O)n 2. 谱峰位置与给受电子能力有关。
Mn+-Lb- hν M(n-1)+-L(b-1)-
电子受体 电子给体
9.1.2.2 配位场跃迁 d-d跃迁和f-f跃迁 特点:ε小,一般位于可见区。
4. 溶剂的选择 ➢ 尽量选用非极性溶剂或低极性溶剂; ➢ 溶剂能很好地溶解被测物,且形成的溶
液具有良好的化学和光化学稳定性; ➢ 溶剂在样品的吸收光谱区无明显吸收。
9.1.4.3 pH的影响
9.2 紫外-可见分光光度计 9.2.1 仪器的基本构造
光源 单色器 吸收池 检测器 信号指示系统
最新94重要有机化合物的紫外吸收光谱

2.饱和脂肪酸及其衍生物
含有羰基,且助色团(OH,Cl,Br,OR,NR2,SH 等)直接与羰基碳原子相连,n—π共轭。
π→π*跃迁所需能量ΔΕ 变小,发生红移;
n→π* 跃 迁 所 需 能 量 ΔΕ变大,发生蓝移; 与醛酮差异大,易区分。
2021/2/13
2021/2/13
3.不饱和醛、酮
R带(n→π*)将由单独羰基的λmax=270~290 nm(κmax<100
L·mol-1·cm-1 ) 红 移 到 λmax=310~330 nm(κmax<100 L·mol-
1·cm-1
)。 2021/2/13
不饱和醛、酮
当共轭双键数目,π→π*跃迁吸收带(K带)红移有时 会掩盖弱的n→π*跃迁吸收带(R带);
极性溶剂和取代基(如烷基)使π→π*跃迁吸收带(K带) 发生红移,使n→π*跃迁吸收带(R带)发生蓝移;
取代基和溶剂对α,β—不饱和羰基化合物(包括不饱 和酸酯)π→π*跃迁λmax的影响也可由伍德沃德-菲泽规则 来估算 。
2021/2/13
按伍德沃德-菲泽规则计算α,β-不饱和羰 基化合物λmax
2021/2/13
2. 取代苯衍生物的紫外-可见吸收光谱
单取代苯衍生物的E2带和B带都产生红移且有一定增 色效应。尤其对含n电子的取代基,由于n-π共轭效应,使 π→π*跃迁所需能量ΔE降低,所以红移距离更大。
2021/2/13
(1) 烷基取代苯衍生物
苯环上有烷基取代时,苯的B吸收带(254nm)要 发生红移,E2带没有明显变化。
C=O,C=C 发色团。
孤立 时: “加合” ;
共轭(α,β—不饱和醛及酮)时:C=C的π→π*跃迁能量 ΔΕ变小。
化合物紫外吸收光谱

三、芳族化合物的紫外吸收光谱 苯是最简单的芳香族化合物,它的紫外吸收光 谱有三个吸收带,其吸收波长分别为184nm(E1带 ε =47000)、203nm(E2或K带ε =7000 )和 256nm(B带ε ≈200))。B带的吸收强度比较弱, 在非极性溶剂中或呈气体状态时出现精细结构。当 苯环上的一个氢原子或两个氢原子被其他基团取代 时,吸收带波长将发生变化。除个别取代基外,绝 大多数取代基都能使吸收带红移,E1带将移动185220nm、E2带将移到205-250nm、B带将移到260290nm。当取代基含有n电子时,则在275-330nm 范围将出现R吸收带。
B、邻位和间位二取代苯
邻位和间位二取代苯的K吸收带波长为两个取代 基单独产生的波长的红移之和。
3、酰基苯衍生物
R2 -C6H4 -COR K吸收带波长λ/nm
R1为烷基时的基本值 R1为H时的基本值 R1为OH时的基本值 R2为下列基团时 烷基 -OH -OR -O-Cl -Br -NH2 -NHAc -NR2
基本值 烷基取代 环外双键 计算值 测量值
217 4×5nm 5nm 242nm 243nm
B、环状共轭二烯π →π *跃迁的吸收波长的计算方法
同环二烯基本值 异环二烯基本值 烷基或环残余取代 环外双键 烷氧基取代 -OR 含硫基团取代 -SR 胺基取代 -NRR’ 卤素取代 酰基取代 -OCOR 增加一个共轭双键 π →π *跃迁λ /nm 253 214 5 5 6 30 60 5 0 30
邻位 3 7 11 0 2 13 20 20
246 250 230 间位 3 7 20 0 2 13 20 20
对位 10 25 78 10 15 58 45 85
NHCOCH3
紫外吸收光谱

R带与K带
R带: R带相当于n →π* 跃迁所吸收的能量产生的吸收带。 含有杂原子的不饱和基团,如-C=O、-N=N- 、-NO、-NO2 等发色团的特征。 特点:(1)吸收较弱; (2)波长较长270-300nm K带: 由于共轭双键中π → π* 跃迁所产生的吸收带称为K带。 特点:(1)吸收强度大,摩尔吸光系数大(104-105之间) (2)波长在217-280nm之间。 (3)利用紫外吸收光谱是否有K吸收带,作为判断共 轭体系的重要依据。
讨论:
(4)吸收光谱波长分布由产生谱带跃迁能级间的能量差决定, 反映分子内部能级分布状况,是物质定性依据; (5)吸收谱带强度与分子偶极矩变化、跃迁几率有关,提供分 子结构信息。通常将在最大吸收波长处测得的摩尔吸光系数 ε max作定性依据。不同物质λ max可能相同,但ε max不一定
相同;
(6)吸收谱带强度与该物质分子吸收光子数成正比,定量分析
紫外吸收光谱
电子跃迁与分子吸收光谱
物质分子内部三种运动形式: (1)电子相对于原子核的运动; (2)原子核在其平衡位置附近的相对振动;
(3)分子本身绕其重心的转动。
分子具有三种不同能级:电子能级、振动能级和转动能级 三种能级都是量子化的,且各自具有相应的能量。 分子的内能:电子能量Ee 、振动能量Ev 、转动能量Er 即: E=Ee+Ev+Er
生色团 烯 炔 羧基 酰胺基 羰基 偶氮基 硝基 亚硝基 硝酸酯
溶剂 正庚烷 正庚烷 乙醇 水 正己烷 乙醇 异辛酯 乙醚
二氧杂环己烷
/nm 177 178 204 214 186 339,665 280 300,665 270
emax
紫外吸收光谱

紫外吸收光谱的基本知识 紫外吸收光谱的基本原理 影响紫外吸收光谱的因素
各类有机化合物的紫外吸收光谱
紫外吸收光谱的应用
一、紫外吸收光谱的基本知识
1.概述
紫外吸收光谱:分子价电子能级跃迁。
分子中价电子经紫外或可见光照射时,电子从低能级跃
迁到高能级,此时电子就吸收了相应波长的光,这样产 生的吸收光谱叫紫外吸收光谱。 波长范围:10-800 nm. (1) 远紫外光区: 10-200nm
C
n<p
O
C
C
p
n >p p
n
n
p p
p
n
p
p
C
O 非极性
C
极性
max(氯仿)
C
p
极性
max(水)
非极性
max(甲醇)
n → p*跃迁:兰移; ;e
max(正己烷)
p → p*跃迁:红移; ;e 237 309 243 305
pp* np*
即: E=Ee+Ev+Er ΔΕe>ΔΕv>ΔΕr
能级跃迁
电子能级间跃迁 的同时,总伴随有振 动和转动能级间的跃 迁。即电子光谱中总 包含有振动能级和转 动能级间跃迁产生的
若干谱线而呈现宽谱
带。
讨论:
(1) 转动能级间的能量差Δ Ε r:0.005~0.050eV,跃 迁产生吸收光谱位于远红外区。远红外光谱或分子转动光 谱; (2) 振动能级的能量差Δ Ε v约为:0.05~1eV,跃迁 产生的吸收光谱位于红外区,红外光谱或分子振动光谱; (3) 电子能级的能量差Δ Ε e较大1~20eV。电子跃迁产
只能被真空紫外分光光度计检测到;
紫外吸收光谱

化合物
1,3-丁二烯 1,3,5-己二烯
溶剂
己烷 异辛烷
max/nm
217 268 304 334 364
emax
21,000 43,000 — 121,000 138,000
1,3,5,7-辛四烯 环己烷
1,3,5,7,9-癸四烯 1,3,5,7,9,11- 十 二 烷基六烯
用不同波长的单色光照射, 测吸光度;
吸收曲线的讨论:
①同一种物质对不同波长光的 吸光度不同。吸光度最大处对应 的波长称为最大吸收波长λ max ②不同浓度的同一种物质,其吸收曲线形状相似λmax不变。 而对于不同物质,它们的吸收曲线形状和λmax则不同。 ③吸收曲线可以提供物质的结构信息,并作为物质定性分析的 依据之一。
,但ε max不一定相同;
(6)吸收谱带强度与该物质分子吸收的光子数成正比,定量分
析的依据。
一、紫外吸收光谱的产生
formation of UV
1.概述
紫外吸收光谱:分子中价电子能级跃迁。 波长范围:100-800 nm. (1) 远紫外光区: 100-200nm
(2) 近紫外光区: 200-400nm
讨论:
④不同浓度的同一种物质,在某一定波长下吸光度 A 有差异,在λ max处吸光度A 的差异最大。此特性可作作
为物质定量分析的依据。
⑤在λ max处吸光度随浓度变化的幅度最大,所以测定
最灵敏。
基本术语
生色团: 分子中可吸收光子产生电子跃迁的基团 最有用的紫外—可见光谱是由π→π*和n→π*跃迁 产生的。这两种跃迁均要求有机物分子中含有不饱 和基团。简单的生色团由双键或叁键体系组成,如 乙烯基、羰基、亚硝基、偶氮基—N=N—、乙炔基 、腈基—C≡N等。
紫外光谱总结

紫外光谱总结第1章紫外光谱紫外可见光谱(Ultraviolet and Visible Spectroscopy, UV-Vis)是由分⼦吸收能量激发价电⼦或外层电⼦跃迁⽽产⽣的电⼦光谱。
其波长范围为10~800 nm,⼜可以细分为三个波段:可见光区(400~800nm):有⾊物质在此区段有吸收;近紫外区(200~400nm):芳⾹族化合物或具有共轭体系的物质在此区域有吸收;远紫外区/真空紫外区(10~200nm):空⽓中的O2、N2、CO2和⽔蒸⽓在此区域有吸收,对测定有⼲扰,需要在真空条件下测定。
近紫外区是紫外光谱的主要研究对象,即通常所说的紫外光谱。
市售的紫外分光光度计测试波段较宽,⼀般包括紫外和可见光谱范围。
由于分⼦中价电⼦能级跃迁的同时伴随着振动能级和转动能级的跃迁,电⼦光谱通常不是尖锐的吸收峰,⽽是⼀些平滑的峰包,如图1所⽰。
图1紫外-可见吸收光谱(S. He, G. S. Wang, C. Lu, X. Luo, B. Wen, L. Guo and M. S. Cao, ChemPlusChem, 2013, 78,250-258.)1.1 紫外光谱的基本原理1.1.1 紫外吸收的产⽣光是电磁波,其能量(E)的⾼低可以⽤波长()或频率()来表⽰:式中:c——光速();h——普朗克(Planck)常量()光⼦的能量与波长成反⽐,与频率成正⽐,即波长越长,能量越低;频率越⾼,能量越⾼。
表1列出了不同电磁波段的相应波长范围以及分⼦吸收不同能量电磁波所能激发的分⼦能级跃迁。
波长范围波谱区名称跃迁类型光谱类型0.0005~0.1nm γ射线原⼦核反应莫斯鲍尔谱0.1~10nm X射线内层电⼦X射线电⼦能谱10~200nm 远紫外外层电⼦真空紫外吸收光谱200~400nm 近紫外外层电⼦紫外可见吸收光谱400~760nm 可见外层电⼦0.76~2.5µm近红外分⼦振动红外吸收光谱、拉曼光谱2.5~50µm中红外分⼦振动、转动50~1000µm远红外分⼦振动、转动0.1~100cm 微波分⼦转动电⼦⾃旋电⼦⾃旋共振1~1000m ⽆线电波原⼦核⾃旋核磁共振1.1.2 朗伯-⽐尔定律朗伯-⽐尔定律是吸收光谱的基本定律,也是吸收光谱定量分析的理论基础。
各类化合物的紫外吸收光谱

在气态或非极性溶剂中,
苯及其许多同系物的B谱带有
许多的精细结构,这是由于
当苯环上有取代基时,
振动跃迁在基态电子上的跃 迁上的叠加而引起的。
在极性溶剂中,这些精 细结构消失。
苯的三个特征谱带都会发生 显著的变化,其中影响较大 的是E2带和B带。
23
稠环芳烃及杂环化合物
稠环芳烃,如萘、蒽、芘等,均显示苯的三个吸收带,但是 与苯本身相比较,这三个吸收带均发生红移,且强度增加。随 着苯环数目的增多,吸收波长红移越多,吸收强度也相应增加。
6
1、直链共轭二烯*跃迁吸收波长计算方法
母体共轭二烯基本值 双键上烷基取代 环外双键
217 nm +5 nm +5 nm
环的外向双键:指碳碳双键的两个sp2杂化的碳 原子中,其中之一是环原子的一员。
7
例1 max=217nm(基数)+2×5nm +5nm =232nm 观察值max=235nm
2
2、饱和羰基化合物
在羰基化合物中除有电 子和电子外,羰基的氧原子 上还有一对孤对电子-n电子。 因此存在着四种跃迁*、 *、n*、n*。前三 种跃迁落在测量范围之外。
孤立羰基化合物研究最 多 的 是 n* 跃 迁 , 其 吸 收 谱 带 出 现 在 2 7 0 — 3 0 0 nm 附 近,一般呈低强度吸收 (ε10~20)的宽谱带,其吸收 位置的变化对溶剂很敏感, 称之为R带。
羧酸及羧酸的衍生物虽然也有n*吸收带,但是羧酸 及羧酸的衍生物的羰基上的碳原子直接连结含有未共用电子 对的助色团,如-OH、-Cl、-OR等。
由于这些助色团上的n电子与羰基双键的电子产生n- 共轭,导致*的能级有所提高,但这种共轭作用并不能改变 n轨道的能级。
因此实现n*跃迁所需的能量变大,使n*吸现方式做保护处理对用户上传分享的文档内容本身不做任何修改或编辑并不能对任何下载内容负责
有机化合物的紫外-可见吸收光谱

O O
(共轭双键)
¾一些含有n电子的基团,本身没有生色功能,但当 它们与生色团相连时,就会发生n—π共轭作用,增 强生色团的生色能力,这样的基团称为助色团。
: : :
助色团:-NH2,-OH,-X (孤对电子)等
2
:
红移和蓝移
3
有机化合物的紫外光谱解析
了解共轭程度、空间效应、氢键等;可对饱和与不饱 和化合物、异构体及构象进行判别。 ⑴ 在200~750nm波长范围内若无吸收峰,则可能是 直链烷烃、环烷烃、饱和脂肪族化合物或仅含一个双 键的烯烃等。若有低强度吸收峰(ε=10~100 L·mol1·cm-1),(n→π跃迁),则可能含有一个简单非共轭且 含有n电子的生色团,如羰基。 ⑵ 若在250~300 nm波长范围内有中等强度的吸收峰 则可能含苯环。
AH
+
β3
H+
OH-
FeR3
β3=1021.3
c(R)≈[R´]=10-4mol·L-1
[FeR ] β 3 3 β 3′ = = [Fe ′][R ′]3 α Fe(A) ⋅ α 3 R(H)
[FeR 3 ] lg = lg β 3 − lg α Fe(A) − 3lg α R(H) + 3lg[R′] [Fe′]
4
(3)若在210~250 nm波长范围内有强吸收峰, 则可能含有2个共轭双键;若在260~300 nm波长 范围内有强吸收峰,则说明该有机物含有3个或3个 以上共轭双键。 (4)若该有机物的吸收峰延伸至可见光区,则该 有机物可能是长链共轭或稠环化合物。
5
2.金属配合物的紫外-可见吸收光谱
金属配合物的生色机理主要有三种类型: ⑴ 配体微扰的金属离子d-d电子跃迁和f-f电子跃 迁: ε很小,对定量分析意义不大 ⑵ 金属离子微扰的配体内电子跃迁 与成键性质有关,若静电引力结合,变化一般很 小。若共价键和配位键结合,则变化非常明显。 ⑶电荷转移吸收光谱 在分光光度法中具有重要意义
紫外光谱(UV)

→ *跃迁:红移; ;
h
21
轨道极性: n >π* >π
π*
π*
Δ En π
Δ Ep
Δ En n
非极性溶剂
Δ Ep
非极性溶剂
极性溶剂
极性溶剂
极性增大使π—π*红移,n—π*跃迁蓝移,精细结构消失,吸收峰减少,并使吸收 曲线趋于平滑。
h
22
溶剂效应对丙酮紫外吸收的影响
n—π*跃迁蓝移
1-己烷 2-95%乙醇 3-水
紫外光谱
学习要求 概述 紫外吸收光谱的基本原理 影响紫外吸收光谱的主要因素 各类有机化合物的紫外光谱 紫外分光光度计结构与实验技术 紫外吸收光谱的应用
h
1
学习要求: 1.了解用价键和分子轨道理论描述有机分子中电 子激发的一般过程。区别π-π*和n-π*的跃迁。 2、了解紫外吸收光谱基本原理 。 3、理解K带、B带、R带、红移、蓝移等术语。 4、熟悉各类化合物的紫外光谱吸收特征。 5、初步掌握紫外光谱在有机化合物结构鉴定中 的应用。 重点:紫外光谱在有机化合物结构鉴定中的应用 难点:电子跃迁的类型及其吸收带与分子结构之间关系
Io g ε= 4 .0 9
一般 ε> 5000为强吸收 为强带 = 1000~5000为中吸收 < 1000为弱吸收 为弱带
h
14
影响摩尔吸光系数ε的因素: 分子偶极矩变化、跃迁几率。电子跃迁类型
n* 跃迁,吸收强度很弱: < 100 。禁阻跃迁。
n 轨道与 轨道在空间取向不同。由于 n 轨道的电子与 π 电
h
SR 45 85
C l 5 20
29
2、 使n—π*最大吸收向短波位移(蓝移)。
紫外光谱-解析
电子能级和跃迁示意图
返回 各种跃迁所所需能量(ΔE)的大小次序为:
s s* n s*p p* n p *
金属配合物的紫外—可见吸收光谱
金属离子与配位体反应生成配合物的颜色一般不同于游 离金属离子(水合离子)和配位体本身的颜色。金属配合物的 生色机理主要有三种类型:
⑴配位体微扰的金属离子d一d电子跃迁和f一f电子跃迁
如果在260~300nm有中强吸收(ε=200~1000), 则表示有B带吸收,体系中可能有苯环存在。如果苯 环上有共轭的生色基团存在时,则ε可以大于10000。
如果在250~300nm有弱吸收带(R吸收带) ε<100, 则可能含有简单的非共轭并含有n电子的生色基团,如 羰基等。
简单的不饱和化合物
δ烷基取代
计算值
18 256nm (254nm)
溶剂校正
溶甲氯二乙己环水
剂醇仿氧醚烷己
六
烷
环
Δ
0 +1 +5 +7 +11 +11 -8
λn
m
芳环化合物的紫外吸收光谱
苯的紫外吸收光谱 (溶剂:异辛烷)
硝基苯(1),乙酰苯(2),苯甲酸甲酯 (3)的紫外吸收光谱(溶剂 庚烷)
芳环化合物的紫外吸收光谱
237 nm(238 nm)
(2)非骈环双烯基本值
4个环残基或烷基取代 环外双键 计算值
217
+5×4 +5
242 nm (243 nm)
(3)同环共轭双烯基本值 253
5个烷基取代
+5×5
3个环外双键
+5×3
延长一个双键
+30×2
AcO
计算值
紫外-可见分子吸收光谱法

NN
溶剂与溶质之相互作用增强 C H
溶质分子的振动受到限制
水中 环己烷中
振动引起的精细结构消失
蒸汽中
500
555
对称四嗪的吸收光谱
/nm
b. 溶剂极性对π →π*跃迁谱带的影响
➢ 溶剂极性增大时,由π →π*跃迁产生的吸收 带发生红移。
c. 溶剂极性对n →π*跃迁谱带的影响
➢ 溶剂极性增大,由n →π*跃迁产生的吸收谱 带发生蓝移。
(4)多通道分光光度计
以光二极管阵列作检测器
光源
透镜
光二极管阵列
试样池
光栅
三、光吸收定律
1、朗伯-比尔定律
A lg T lg I0 bc 或 A lg T lg I0 abc
I
I
2、吸光度的加和性
当溶液中含有多种对光产生吸收的物质,且各组分之
间不存在相互作用时,则该溶液对波长λ光的总吸光度A总
➢ 根据分子轨道理论,这三种电子的能级高 低为: σ<π<n <π*<σ*
三种价电子可能产生六种形式电子跃迁:
σ→ σ*, σ→ π*, π→ σ*对应的吸收光谱处于 远紫外区,研究少。
(1) n → σ* 跃迁:
➢ 吸收光谱出现在远紫外光区和近紫外光区 ➢ 某些含有氧、氮、硫、卤素等杂原子的基 团(如—NH2、—OH、—SH、—X等)的 有机物可产生n → σ* 跃迁。 例如:CH3OH:λmax=183 nm 、CH3NH2:λmax=213 nm
② 吸收峰通常位于200~400nm之间。
(7) K带
➢ 由共轭体系的π →π*跃迁产生的吸收带。
特点:
ε ① 强度大,一般 > 104 L ·mol-1 ·cm-1 ;
常见有机化合物的紫外可见吸收光谱ppt课件

火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
溶液的颜色与光吸收的关系
完全吸收
光谱示意 复合光 表观现象示意
完全透过
吸收黄色光
物质呈现颜色与吸收光波长的关系见下表。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
第一节 基本原理
一、光的基本特性 1.光的波动性 光是一种电磁波,电磁波可以用周期T(s)、
频率( עHz)、波长λ(nm)和波数σ(cm-1) 等参数描述。它们之间的关系为: =1/T=c/λע /cעσ=1/λ=
互作用。
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
4.偏离朗伯一比尔定律的原因
定量分析时,通常液层 厚度是相同的,按照比尔 定律,浓度与吸光度之间 的关系应该是一条通过直 角坐标原点的直线。但在 实际工作中,往往会偏离 线性而发生弯曲。
透光度T (透射比)Transmittance
定义透光度:
T It I0
T 取值为0.0 ~ 1.0 全部吸收 ~~~~ 全部透射
吸光度A (Absorbance)
定义吸光度 :
A 取值为 0.0 ~∞
二者关系为:
A lg I 0 It
全部透射~~~全部吸收
A = lg(1/T) = -lgT
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
取代基和溶剂对α,β—不饱和羰基化合物(包括不饱 和酸酯)π→π*跃迁λmax的影响也可由伍德沃德-菲泽规则 来估算 。
2020/8/13
按伍德沃德-菲泽规则计算α,β-不饱和羰 基化合物λmax
2020/8/13
2.饱和脂肪酸及其衍生物
含有羰基,且助色团(OH,Cl,Br,OR,NR2,SH 等)直接与羰基碳原子相连,n—π共轭。
π→π*跃迁所需能量ΔΕ 变小,发生红移;
n→π* 跃 迁 所 需 能 量 ΔΕ变大,发生蓝移; 与醛酮差异大,易区分。
2020/8/13
2020/8/13
3.不饱和醛、酮
C=O,C=C 发色团。
孤立 时: “加合” ;
共轭(α,β—不饱和醛及酮)时:C=C的π→π*跃迁能量 ΔΕ变小。
K 带 ( π→π*) 将 由 单 个 乙 烯 键 的 λmax=165 nm(κmax≈104 L·mol-1·cm-1) 红 移 到 λmax=210~250nm(κmax≈ 104 L·mol1·cm-1 );
R带(n→π*)将由单独羰基的λmax=270~290 nm(κmax<100
L·mol-1·cm-1 ) 红 移 到 λmax=310~330 nm(κmax<100 L·mol-
1·cm-1
)。 2020/8/13
不饱和醛、酮
当共轭双键数目,π→π*跃迁吸收带(K带)红移有时 会掩盖弱的n→π*跃迁吸收带(R带);
217 +5×4 +5×2 247nm(247nm)
例6 同环共轭双烯基本值 253
5个烷基取代 3个环外双键
+5×5 +5×3 AcO
延长一个双键
+30×2
计算值
353nm(355nm)
2020/8/13
9.4.4 芳烃化合物
1.苯
芳香族化合物在近紫外区显示特征的吸收光 谱,右图是苯在异辛烷中的紫外光谱,吸收带 为:184nm(ε 68 000),203.5nm(ε 8 800) 和254nm(ε 250)。分别对应于E1带,E2带和 B带。B带吸收带由系列细小峰组成,中心在 254.5nm,是苯最重要的吸收带,又称苯型带 。B带受溶剂的影响很大,在气相或非极性溶 剂中测定,所得谱带峰形精细尖锐;在极性溶 剂中测定,则峰形平滑,精细结构消失。
在K带之中。
羰基双键与苯环共扼:K带强,苯 的E2带与K带合并,红移; 取代基使B带简化;
氧上的孤对电子:
R带,跃迁禁阻,弱。
C H3 C
O
p p* ; K带 2020/8/13
np* ; R带
苯环上发色基团对吸收带的影响
2020/8/13
3.稠环芳烃化合物
稠环芳烃有更大的共轭体系,紫外吸收均比苯环移向长 波长方向,可达可见光区;精细结构比苯环更明显。
若苯胺变成了盐酸盐,此 时n电子消失,不存在n-π共轭 ,吸收带的红移和增色效应消 失,故苯胺盐酸盐的紫外吸收 和苯相近。
而苯酚相对于中性溶液其 酚盐的紫外光谱,吸收带均发 生红移和增色效应。
2020/8/13
2020/8/13
(3)发色团取代苯衍生物
具有双键的基团的取代,它与苯环共轭在200~ 250 nm出现K带,使B带发生强烈红移,有时B带被淹没
λmax=λ基+Σniλi
λ基 是由非环和六元环共轭二烯母体结构决定的基准 值。
λi和ni是由双键上取代基的种类和个数决定的校正项 。
2020/8/13
λmax=λ基+Σniλi
• 分子中与共轭体 系无关的孤立双键 不参与计算;
• 不在双键上的取 代基不进行校正;
• 环外双键是指在某 一环的环外并与该 环直接相连的双键 (共轭体系中)。
94重要有机化合物的紫外吸收 光谱
2020/8/13
9.4.2 不饱和脂肪烃
单烯烃、多烯烃和炔烃等,都含有π电子,产生π→π*跃 迁。双键共轭使最高成键轨道与最低反键轨道之间的能量 差减小,波长增加。
2020/8/13
伍德沃德-菲泽(Wood Ward-Fieser)规则
共轭多烯(不多于四个双键)π→π*跃迁吸收带的最 大 吸 收 波 长 , 可 以 用 经 验 公 式 伍 德 沃 德 - 菲 泽 ( Wood Ward-Fieser)规则来估算。
甲苯峰显著红位移是 由于烷基C-H键的σ电子 与 苯 环 产 生 σ-π 超 共 轭 引 起的,同时烷基苯的B吸 收带的精细结构减弱或消 失。
Hale Waihona Puke 2020/8/13(2)助色团取代苯衍生物
含有n电子的基团取代:-OH、-NH2等,与苯环发生 n—π共轭效应,使E带和B带发生红移,强度也增加, 且B带精细结构消失。
2020/8/13
2. 取代苯衍生物的紫外-可见吸收光谱
单取代苯衍生物的E2带和B带都产生红移且有一定增 色效应。尤其对含n电子的取代基,由于n-π共轭效应,使 π→π*跃迁所需能量ΔE降低,所以红移距离更大。
2020/8/13
(1) 烷基取代苯衍生物
苯环上有烷基取代时,苯的B吸收带(254nm)要 发生红移,E2带没有明显变化。
2020/8/13
内容选择
9.1 紫外-可见吸收光谱法基础 9.2 紫外-可见分光光度计 9.3 吸收带类型与溶剂效应 9.4 典型有机化合物的紫外-可见吸收光谱 9.5 紫外-可见吸收光谱在有机 化合物结构分析中的的应用
乙醇溶剂中
λmax=λ基+Σniλi
2020/8/13
按伍德沃德-菲泽规则计算α,β—不饱和 羰基化合物λmax
2020/8/13
计算α,β—不饱和羰基化合物λmax
2020/8/13
计算α,β—不饱和羰基化合物λmax
2020/8/13
例5 链状共轭双键 4个烷基取代 2个环外双键 计算值
2020/8/13
2020/8/13
2020/8/13
2020/8/13
2020/8/13
9.4.3 羰基化合物
醛、酮、脂肪酸及其衍生物酯、酰氯、酰胺等 σ→σ*跃迁, n→σ*跃迁, n→π*跃迁, π→π*跃迁。
2020/8/13
1.饱和醛、酮
特征谱带:n→π*跃迁(R带): λmax= 270~300 nm,弱带(κ= 10~50 L·mol-1·cm-1); n→σ*跃迁:λmax= 170~190nm(κ = 103~105 L·mol-1·cm1 ); π→π*跃迁: λmax<150nm。
