分子与原子的关系
原子离子 分子关系

原子离子分子关系原子、离子和分子是物质的基本组成部分,它们之间存在着密切的关系。
本文将从不同角度探讨原子、离子和分子之间的关系。
一、原子原子是物质的最小单位,由质子、中子和电子组成。
原子的质子和中子位于原子核中,而电子则绕着原子核运动。
原子的种类由其原子核中质子的数量决定,称为元素。
不同元素的原子具有不同的性质。
二、离子离子是带电的原子或原子团。
当原子失去或获得一个或多个电子时,就会形成正离子或负离子。
正离子带有正电荷,因为它失去了一个或多个电子,而负离子带有负电荷,因为它获得了一个或多个电子。
离子的形成通常是由于原子与其他原子发生化学反应。
三、分子分子是由两个或多个原子通过化学键结合而成的粒子。
分子可以由相同的原子组成,称为单质分子,例如氧气(O2)和氮气(N2)。
分子也可以由不同的原子组成,称为化合物分子,例如水(H2O)和二氧化碳(CO2)。
分子的形成是通过共用电子对来实现的,原子之间共享电子以形成稳定的化学键。
原子、离子和分子之间的关系密切相连。
离子是原子失去或获得电子后形成的,而分子是由原子通过共用电子对结合而成的。
离子和分子都是化学反应的产物,它们之间的形成与化学键的形成密切相关。
在化学反应中,原子可以通过失去或获得电子来形成离子,进而与其他原子结合形成分子。
化学键的形成是通过电子的共用或转移来实现的。
不同的原子之间可以通过共价键或离子键结合,形成不同类型的分子。
例如,氯原子可以通过获得一个电子形成氯离子(Cl-),而钠原子可以通过失去一个电子形成钠离子(Na+)。
当氯离子和钠离子相遇时,它们之间会发生离子键的形成,形成氯化钠(NaCl)分子。
在这个过程中,氯离子和钠离子通过电荷吸引力结合在一起。
总结起来,原子、离子和分子是物质的基本组成部分。
原子是构成物质的最小单位,离子是原子失去或获得电子形成的带电粒子,分子是由原子通过化学键结合而成的粒子。
它们之间的关系密切相连,通过化学反应和化学键的形成相互转化。
原子和分子的概念和相互作用

原子和分子的概念和相互作用一、原子的概念原子是物质的基本单位,由原子核和核外电子组成。
原子核位于原子的中心,由质子和中子组成,质子带正电,中子不带电。
核外电子绕原子核高速运动,电子带负电。
原子核和核外电子之间的电磁力相互作用保持着原子的稳定性。
二、分子的概念分子是由两个或两个以上原子通过化学键连接在一起构成的稳定粒子。
分子是保持物质化学性质的最小粒子。
分子中的原子之间通过共享或转移电子形成化学键,包括共价键、离子键和金属键等。
三、原子的相互作用1.电磁相互作用:原子核中的质子带正电,核外电子带负电,它们之间存在电磁相互作用。
在原子内部,正电荷的质子与负电荷的电子之间相互吸引,使原子保持稳定。
2.强相互作用:原子核中的质子之间存在一种很强的相互作用力,称为强相互作用。
这种力使得质子能够聚集在一起,形成原子核。
3.弱相互作用:原子核中的中子与质子之间存在一种较弱的相互作用力,称为弱相互作用。
这种力在某些核反应中起作用,如β衰变。
四、分子的相互作用1.范德华力:分子之间的瞬时偶极矩引起的吸引力,是一种较弱的相互作用力。
范德华力存在于所有分子之间,包括非极性分子和极性分子。
2.氢键:分子之间的一种特殊类型的静电作用力,发生在带有部分正电荷的氢原子与带有部分负电荷的氮、氧或氟原子之间。
氢键比范德华力强,对物质的物理性质有显著影响。
3.离子键:由正负电荷的离子之间的吸引力形成的化学键。
离子键通常存在于离子化合物中,如氯化钠(NaCl)。
4.共价键:原子之间通过共享电子形成的化学键。
共价键可以是单键、双键或三键,如水分子(H2O)中的氧氢键。
5.金属键:金属原子之间的一种特殊类型的相互作用力,金属原子失去部分外层电子,形成金属离子和自由电子。
金属离子与自由电子之间的吸引力形成金属键,使金属具有独特的物理性质。
五、原子和分子的相互作用对物质性质的影响1.熔点:分子间相互作用力越强,物质的熔点越高。
如离子晶体(如食盐)的熔点高于分子晶体(如冰)。
分子量与氮原子个数的关系

分子量与氮原子个数的关系分子量是指化学物质中分子的相对质量。
原子量是指原子的相对质量。
分子量通常是原子量的若干倍数,因为一个分子通常含有多个原子。
氮是化学元素中的一种,其化学符号为N,原子序数为7。
氮分子的化学式为N2,表示氮分子由两个氮原子组成。
因此,氮分子的分子量为2倍氮原子的原子量。
氮原子的原子量是14.01,因此氮分子的分子量为2倍的14.01,即28.02。
这就是氮分子的分子量。
分子量与氮原子个数的关系可以用以下公式表示:分子量=氮原子个数×氮原子的原子量根据这个公式,如果知道氮原子的个数,可以计算出氮分子的分子量。
例如,如果有3个氮原子组成的分子,那么分子量为3倍氮原子的原子量。
分子量= 3 × 14.01 = 42.03同样地,如果有5个氮原子组成的分子,分子量为5倍氮原子的原子量。
分子量= 5 × 14.01 = 70.05可以看出,氮原子个数越多,分子量也越大。
氮分子在化学中有着重要的作用。
它是大气中的主要成分之一,占据了大约78%的体积。
氮分子在大气中是以N2的形式存在的,而且绝大部分物质都不与氮反应,所以氮在大气中是相对稳定的。
然而,氮分子在某些特殊的条件下可以转化为具有高能量的反应物。
例如,在闪电的作用下,大气中的氮分子会发生电离和解离,形成一系列化合物,如氮氧化物(NOx)和氨(NH3)等。
这些物质对环境和人体健康具有一定影响。
此外,氮分子也是生命中不可或缺的组成部分。
氮是蛋白质、核酸、维生素等生物大分子的组成元素,是植物和动物体内重要的营养元素。
植物通过根系吸收土壤中的氮,合成蛋白质和其他有机化合物。
动物则通过食物摄入植物或其他动物来获取氮,并利用氮合成自身所需的有机物质。
不仅如此,氮化合物还广泛应用于农业、化工、医药等领域。
氨、硝酸等氮化合物是肥料和农药的重要成分,可以提高植物的生长速度和产量。
而硝化甘油等含氮有机化合物则是制造爆炸物和药物的原料。
分子、原子、离子及元素的关系
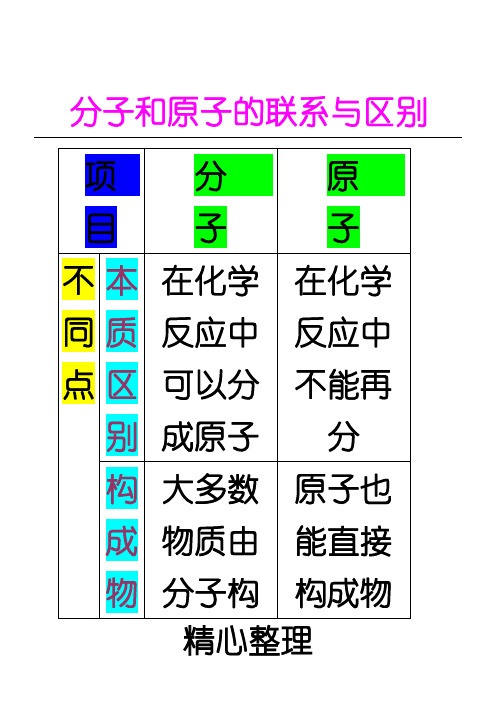
项分 目子 不 本 在化学 同 质 反应中 点 区 可以分
别 成原子 构 大多数 成 物质由
原 子 在化学 反应中 不能再 分 原子也 能直接
精心整理
物 分子构 构成物
质 成 质,但分
情
子是由
况
原子构
成的
相 1、 质量和体积都
同
很小
点 2、 都在不停地运
动
3、 粒子间由间隔
精心整理
稳定
结构
稀 =8 难得 极
有 (氦 失电 难
气为 子 发
体 2) (常 生
元
称为 化
素
稳定 学
结反
构) 应
精心整理
离子与原子的
比较
粒子 原
离
种类 子
子
阳离 阴离
子子
粒 核内 核内 核内
区 子 质子 质子 质子
结 数= 数> 数<
精心整理
构 核外 核外 核外 电子 电子 电子
别 数数 数 粒 不显 带正 带负 子 电性 电 电 电 性 用元 用阳 用阴 符 素符 离子 离子 号 号表 符号 符号
阴离子
失电子
失电子 构分 成裂
系
分
子
元素与原子的比较 精心整理
元
原
素
子
概 具有相同 化学变化
念 核电荷数 中的最小
(即核内 粒子
质子数)
的一类原
子的总称
区 只讲种 既将种
分 类,不讲 类,又讲
精心整理
个数 个数 使 用于描 用于描述 用 述物质 物质的微 范 的宏观 观构成 围 组成 举 水由氢元 每个水分 例 素和氧元 子由两个
分子的亚结构

分子的亚结构是指分子内部原子与原子之间的相互关系。
它包括分子中的共价键、键角、极性、电子云分布等。
在分子中,原子通过共价键相互连接,形成了一种骨架结构。
共价键是分子中最重要的键,它是由两个原子之间的一个单电子共享所形成的。
在形成共价键时,原子中的电子会在两个原子核之间的连线上自由地移动,这就是所谓的电子云分布。
这些电子云会在分子表面上呈现出一种电子雾,其形状和大小取决于原子的种类、距离和键角等因素。
键角是两个原子之间的夹角,它对分子的形状和稳定性有着重要的影响。
在某些情况下,改变键角可以显著地改变分子的形状和性质。
例如,在二氧化碳分子中,碳原子和两个氧原子之间的键角是180度,这使得二氧化碳分子呈现出直线型结构。
而在一氧化碳分子中,由于碳原子和氧原子的距离更近,导致键角变小为110度,这使得一氧化碳分子呈现出弯曲的结构。
分子的极性是指分子中正负电荷中心的不重合。
在极性分子中,正负电荷的中心不会重合,这会导致分子中的电子云分布不均匀。
分子的极性可以影响分子的物理和化学性质,例如沸点、熔点、溶解性和稳定性等。
此外,分子的形状和大小也会影响其性质。
分子的形状可以是球形、线性、棒状、环状等,而大小则取决于原子的数量和种类。
这些因素都会影响分子的性质和行为方式。
总的来说,分子的亚结构是决定分子性质和行为方式的关键因素之一。
了解分子的亚结构可以帮助我们更好地理解分子的行为方式,从而更好地设计和合成具有特定性质的材料和药物。
因此,分子的亚结构研究是化学和生物学等领域的重要课题之一。
分子与原子之间的关联

分子与原子之间的关联分子与原子之间的关联导语:分子和原子是化学领域中最基本的概念,它们之间存在紧密的关联。
本文将从深度和广度的角度,探讨分子与原子之间的关系,帮助读者全面理解这一概念。
一、分子和原子的基本概念1. 原子的定义和性质原子是物质中最基本的单位,由带正电荷的质子、带负电荷的电子和中性的中子组成。
原子的性质取决于其原子序数、质子数、电子数等特征。
2. 分子的定义和性质分子是由两个或多个原子通过化学键结合而成的稳定结构体。
分子可以是同种元素的原子组成的,也可以是不同元素的原子组成的。
分子的性质由其成员原子的性质和结构决定。
二、分子与原子的互相影响1. 化学键的形成与断裂分子中的原子通过化学键结合在一起,形成稳定的分子结构。
不同类型的化学键,如共价键、离子键和金属键,影响着分子的性质和化学反应。
而化学反应中的键的断裂又会导致分子结构的改变。
2. 原子的电子构型与分子的稳定性原子的电子配置决定了分子的稳定性。
原子可以通过共享、获得或失去电子,以满足稳定的八个外层电子。
氢原子通过与另一个氢原子共享电子形成氢分子,增强了稳定性。
三、分子与原子的性质与功能1. 分子的形状与多样性分子的形状对其性质和功能起着重要的影响。
分子的形状可以决定分子间的相互作用、极性、溶解度等特征。
不同形状的分子具有不同的化学和生物活性。
2. 分子之间的相互作用分子之间存在着各种相互作用,如分子间力、氢键等。
这些相互作用可以影响分子的聚集形态、溶解性质和化学反应进程。
分子间的相互作用也对生物分子的折叠和物质的相态变化起着重要作用。
3. 分子在生命中的作用分子在生命的各个层面中发挥着重要作用。
生物大分子,如DNA、蛋白质等由分子组成,它们通过分子间的相互作用、结构特性和功能属性,参与了生物体内的生命活动。
分子生物学的发展,深化了我们对生命分子的认识。
四、总结与回顾本文通过深入探讨了分子与原子之间的关联。
首先介绍了分子和原子的基本概念,然后分析了它们之间的相互影响,包括化学键的形成与断裂、原子的电子构型与分子的稳定性等。
初中化学易错辨析 分子和原子
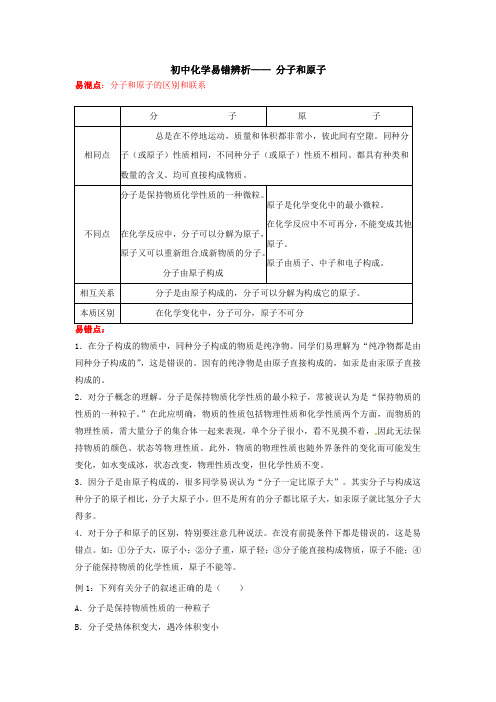
初中化学易错辨析——分子和原子易混点:分子和原子的区别和联系易错点:1.在分子构成的物质中,同种分子构成的物质是纯净物。
同学们易理解为“纯净物都是由同种分子构成的”,这是错误的。
因有的纯净物是由原子直接构成的,如汞是由汞原子直接构成的。
2.对分子概念的理解。
分子是保持物质化学性质的最小粒子,常被误认为是“保持物质的性质的一种粒子。
”在此应明确,物质的性质包括物理性质和化学性质两个方面,而物质的物理性质,需大量分子的集合体一起来表现,单个分子很小,看不见摸不着,因此无法保持物质的颜色、状态等物理性质。
此外,物质的物理性质也随外界条件的变化而可能发生变化,如水变成冰,状态改变,物理性质改变,但化学性质不变。
3.因分子是由原子构成的,很多同学易误认为“分子一定比原子大”。
其实分子与构成这种分子的原子相比,分子大原子小。
但不是所有的分子都比原子大,如汞原子就比氢分子大得多。
4.对于分子和原子的区别,特别要注意几种说法。
在没有前提条件下都是错误的,这是易错点。
如:①分子大,原子小;②分子重,原子轻;③分子能直接构成物质,原子不能;④分子能保持物质的化学性质,原子不能等。
例1:下列有关分子的叙述正确的是()A.分子是保持物质性质的一种粒子B.分子受热体积变大,遇冷体积变小分子原子相同点总是在不停地运动,质量和体积都非常小,彼此间有空隙。
同种分子(或原子)性质相同,不同种分子(或原子)性质不相同。
都具有种类和数量的含义。
均可直接构成物质。
不同点分子是保持物质化学性质的一种微粒。
在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子。
分子由原子构成原子是化学变化中的最小微粒。
在化学反应中不可再分,不能变成其他原子。
原子由质子、中子和电子构成。
相互关系分子是由原子构成的,分子可以分解为构成它的原子。
本质区别在化学变化中,分子可分,原子不可分C.分子是构成物质的唯一粒子D.分子是不断运动的错因会诊错选A是对分子的概念不理解;错选B是对分子的基本性质没有掌握;错选C是不知道分子只是构成物质的一种粒子,除分子外,构成物质的粒子还有原子、离子等。
分子原子离子及元素的关系

分子和原子的联系与区别元素原子的结构特征与元素化学性质的关系离子与原子的比较分子、原子和离子的比较元素与原子的比较分子、原子及元素练习题一、选择题1、下列物质中含有氧分子的是A.水B.液氧C.氧化汞D.二氧化碳2、下列关于水的组成叙述,正确的是A.水是由氧气和氢气组成B.水是由氢分子和氧原子构成C.水是由氢元素和氧元素组成D.水是由两个氢原子和一个氧原子构成3、新装修的房屋常有一股异味,利用分子的性质解释该现象,最合理的是A.分子在不断运动B.分子的质量很小C.分子间有间隙D.分子的体积很小4、“墙脚数枝梅,凌寒独自开,遥知不是雪,为有暗香来;”诗人在远处就能闻到梅花香味的原因是A.分子很小B.分子是可分的C.分子间有一定的间隙D.分子是在不断运动的.5、原子的质量主要集中在A.质子B.中子C.电子D.原子核6、居里夫人在1898年从几吨含铀的废料中提炼出镭;镭原子的核电荷数为88,相对原子质量为226,下列说法关于镭原子的说法中错误的是A.质子数为88B.中子数为88C.电子数为88D.质子数与中子数之和为2267、某营养品说明书上标明:每片含钙200mg、铁4mg、锌5mg,这里所标示的钙、铁、锌是指A.原子B.元素C.分子D.离子8、下列能决定元素元素化学性质的是A.电子数B.中子数C.最外层电子数D. 质子数.9、2005年10月12日,我国载有两名航天员的“神舟6号”飞船在长征2号F捆绑式大推力火箭的运载下,进入太空;火箭的燃料是偏二甲肼化学式为C2H8N2,下列关于偏二甲肼组成的叙述正确的是A.由2个碳元素、4个氢分子以及1个氮分子组成B.由碳、氢、氧三种元素组成B. C.由2个碳原子、8个氢原子、2个氮原子构成 D.组成元素碳、氢氧的质量比为1: 4:110、关于氧气和铁的构成,下列说法中正确的是A.由氧元素和铁元素构成B.由氧分子和铁原子构成C.由氧原子和铁原子构成D.由氧分子和铁分子构成11、下列说法中错误的是A.水是由氢元素和氧元素组成的B.原子是构成物质的一种基本微粒C.由同种元素组成的纯净物叫做单质D.含有氧元素的化合物就是氧化物12.下列各组物质中,都是由分子构成的是A.水、二氧化碳B.氧气、铝C.铜、食盐D.氢气、氦气13、一定量的单质某气体其体积随压强和温度的变化的原因是A.气体分子个数发生变化B.气体分子本身大小发生变化C.气体分子间的间隔发生变化D.构成分子的原子个数发生变化14、向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验说明①分子处于不断运动之中;②分子大,原子小;③分子可以再分,原子不能再分;④分子间有一定的间隔;A. ①②B. ②③C. ①③D.①④15、下列关于分子、原子、离子的说法中,错误的是A.在化学反应中分子能再分,原子不能再分B.分子、原子、离子都能构成物质C. 分子、原子都能保持所构成的物质的性质D.水这种物质是由氢、氧两种原子直接构成的16、下列叙述中,正确的是A.氧分子的保持氧气化学性质的最小粒子B.氮分子是保持氮气物理性质的一种粒子C.液态空气是由空气分子构成的物质D.氮气和氧气混合后,它们的化学性质都会改变17、保持水化学性质的最小粒子是A.氢原子和氧原子 B.氢分子和氧原子 C.水分子 D.水原子18、用分子的观点分析下列变化,属于化学变化的是A.一种物质的分子运动到另一种物质的分子中间去了B.分子运动的速度变慢了C.分子改变了,由一种分子变成了另一种分子D.分子间的间隔变大了19、下列现象不能用分子运动论解释的是A.把两块表面干净平滑的铝片压紧就不容易将它们拉开B.氧化汞受热分解生成汞和氧气C.医院里充满了药味D.在室内,同样表面积的热水比冷水蒸发的快20、下列说法正确的是A.混合物一定是由多种分子构成的B.纯净物一定是由一种分子构成的C.由多种分子构成的物质一定是混合物D.由多种元素组成的物质一定是混合物二、填空题1、用数字和元素符号表示:4个氮原子________ 硅元素________6个水分子_________ 5个镁离子_________2、加油站里汽油已放入贮存罐贮存好了,但在离油罐一定距离内仍要“严禁烟火”,其原因是______________________________________________________________________;3、液态氧和氧气的状态不同,化学性质____________,原因是____________________________________________________________;4、选择“元素”、“原子”或“分子”三个化学名词填空:⑴分子是由__________构成的;⑵同种__________组成的纯净物是单质;⑶不同种_____ _______构成的物质是混合物;⑷不同种___________组成的纯净物是__________;5、氧化镁、二氧化硫、氧化汞中都含有___________,它们都属于_____________;6、在硝酸铵NH4NO3、二氧化碳、二氧化锰、氧气、蒸馏水、空气、铁中:⑴含有氧分子的物质是___________;⑵含有氧元素的物质是___________________;⑶属于单质的物质是________________;⑷属于化合物的物质是________________;⑸属于氧化物的物质是____________________;7、康泰克等以前治疗感冒的常用药品因含有的PPA对人体有比较严重的副作用而被禁用;PPA的化学式为C9H13ON,它是由__________种元素组成,每个PPA分子中共含有________个原子;8、S和S2-属于_______种元素,因为它们的________________;S和S2-属于_________ 种粒子,因为它们的________________;两者的相对原子质量___________,因为它们的_____________________;9、下列现象分别说明了分子的哪一点性质⑴100ml酒精与100ml水混合小于200ml____________________________________⑵烧杯中装有空气,但我们却看不到_______________________________________⑶液化气泄露会闻到液化气味_____________________________________________⑷氧气可以支持燃烧,液氧也可以做为火箭发射的助燃剂______________________________________________________。
分子和原子(微观角度)

THANKS FOR WATCHING
感谢您的观看
高分子材料
高分子化合物由长链分子构成,广泛应用于塑料、橡胶、 纤维等材料领域,具有优异的物理性能和化学稳定性。
纳米材料
纳米尺度的分子和原子表现出独特的物理和化学性质,可 用于制造高效催化剂、光电子器件和药物传递系统等。
复合材料
通过将不同性质的材料复合在一起,可以创造出具有优异 性能的复合材料,如航空航天材料、体育器材和建筑材料 等。
原子由质子、中子和电子组成,其中 质子和中子位于原子的中心,称为原 子核,电子则围绕原子核旋转。
原子的构成
质子数(Z)
位于原子核中,决定元素的种类。
中子数(N)
位于原子中,不决定元素的种类, 但影响原子质量。
核外电子数(E)
围绕原子核旋转的带负电的粒子, 其数量与质子数相等,但电性相反。
原子的性质
有一些分子可以通过特定的构象变化 来改变其形状,如DNA的双螺旋结构。
分子的运动
分子运动是指分子在 空间中的随机运动, 包括平动、转动和振 动。
分子的运动对于化学 反应速率和扩散过程 具有重要影响。
分子的运动速度取决 于温度,温度越高, 分子运动速度越快。
分子的光学和热学性质
分子的光学性质包括吸收光谱、发射光 谱和散射光谱等。
04 分子的性质
分子的质量
分子质量是组成分子的原子质量的总和。
分子质量的单位是道尔顿(Da),1 Da = 1 g/mol。
分子质量的测定对于化学研究和工业生产具有重要意义,如确定化学式、计算分子 结构等。
分子的形状
分子形状主要取决于分子中原子的连 接方式,包括单键、双键、三键等。
分子形状对于化学反应和分子间相互 作用具有重要影响。
分子原子离子及元素的关系

分子和原子的联系与区别元素原子的结构特征与元素化学性质的关系离子与原子的比较分子、原子和离子的比较元素与原子的比较分子、原子及元素练习题选择题一、下列物质中含有氧分子的是、1()水 B.液氧 C.氧化汞 D.二氧化碳 A.下列关于水的组成叙述,正确的是() 2、水是由氧气和氢气组成 B.水是由氢分子和氧原子构成A.C.水是由氢元素和氧元素组成D.水是由两个氢原子和一个氧原子构成新装修的房屋常有一股异味,利用分子的性质解释该现象,最合理的是()、3分子在不断运动 B.分子的质量很小 C.分子间有间隙 D.分子的体积很 A.小“墙脚数枝梅,凌寒独自开,遥知不是雪,为有暗香来。
”诗人在远处就能闻到梅花、4香是因原的味()分子很小 B.分子是可分的 C.分子间有一定的间隙 D.分子是在不断运动 A.的 .5、原子的质量主要集中在()质子 B.中子 C.电子 D.原子核 A.1898年从几吨含铀的废料中提炼出镭。
镭原子的核电荷数为88,相对居里夫人在、6原子质量为226,下列说法关于镭原子的说法中错误的是()A.质子数为88B.中子数为88C.电子数为88D.质子数与中子数之和为2267、某营养品说明书上标明:每片含钙200mg、铁4mg、锌5mg,这里所标示的钙、铁、锌是指()原子 B.元素 C.分子 D.离子 A.8、下列能决定元素元素化学性质的是()A.电子数B.中子数C.最外层电子数D. 质子数 .9、2005年10月12日,我国载有两名航天员的“神舟6号”飞船在长征2号F捆绑式大推力火箭的运载下,进入太空。
火箭的燃料是偏二甲肼(化学式为C2H8N2),下列关于偏二甲肼组成的叙述正确的是()由2个碳元素、4个氢分子以及1个氮分子组成 B.由碳、氢、氧三种元素组成 A.C.由2个碳原子、8个氢原子、2个氮原子构成D.组成元素碳、氢氧的质量比 B.为1: 4:110、关于氧气和铁的构成,下列说法中正确的是()A.由氧元素和铁元素构成B.由氧分子和铁原子构成C.由氧原子和铁原子构成D.由氧分子和铁分子构成11、下列说法中错误的是()水是由氢元素和氧元素组成的 B.原子是构成物质的一种基本微粒A.C.由同种元素组成的纯净物叫做单质D.含有氧元素的化合物就是氧化物下列各组物质中,都是由分子构成的是12.()水、二氧化碳 B.氧气、铝 C.铜、食盐 D.氢气、氦气 A.13、一定量的单质某气体其体积随压强和温度的变化的原因是()A.气体分子个数发生变化B.气体分子本身大小发生变化C.气体分子间的间隔发生变化D.构成分子的原子个数发生变化14、向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验说明①分子处于不断运动之中;②分子大,原子小;③分子可以再分,原子不能再分;④分子间有一定的间隔;()A. ①②B. ②③C. ①③D.①④15、下列关于分子、原子、离子的说法中,错误的是()在化学反应中分子能再分,原子不能再分 B.分子、原子、离子都能构成物质 A.C. 分子、原子都能保持所构成的物质的性质D.水这种物质是由氢、氧两种原子直接构成的下列叙述中,正确的是() 16、氮分子是保持氮气物理性质的一种 B.氧分子的保持氧气化学性质的最小粒子 A.粒子C.液态空气是由空气分子构成的物质D.氮气和氧气混合后,它们的化学性质都会改变17、保持水化学性质的最小粒子是()氢原子和氧原子 B.氢分子和氧原子 C.水分子 D.水原子.A用分子的观点分析下列变化,属于化学变化的是() 18、 A.一种物质的分子运动到另一种物质的分子中间去了 B.分子运动的速度变慢了C.分子改变了,由一种分子变成了另一种分子D.分子间的间隔变大了下列现象不能用分子运动论解释的是()、19把两块表面干净平滑的铝片压紧就不容易将它们拉开 B.氧化汞受热分解生成 A.汞和氧气C.医院里充满了药味D.在室内,同样表面积的热水比冷水蒸发的快20、下列说法正确的是()A.混合物一定是由多种分子构成的 B.纯净物一定是由一种分子构成的C.由多种分子构成的物质一定是混合物 D.由多种元素组成的物质一定是混合物二、填空题1、用数字和元素符号表示: 4个氮原子________ 硅元素________6个水分子_________ 5个镁离子_________加油站里汽油已放入贮存罐贮存好了,但在离油罐一定距离内仍要“严禁烟火”,其、2原因是_______________________________________________________________ _______。
分子原子离子的关系

分子原子离子的区别与联系
区别:
1、性质不同
2、特性不同
联系:
分子由原子构成,原子失电子变成阳离子,原子得电子变成阴离子,阴离子失电子变成原子,阳离子得电子变成原子。
分子:保持物质化学性质的最小粒子。
原子:化学变化中的最小粒子。
离子:带电荷的原子或原子团。
一、性质不同
1、分子:由组成的原子按照一定的键合顺序和空间排列而结合在一起的整体,这种键合顺序和空间排列关系称为分子结构。
2、原子:化学反应不可再分的基本微粒,原子在化学反应中不可分割。
3、离子:原子由于自身或外界的作用而失去或得到一个或几个电子使其达到最外层电子数为8个或2个(氦原子)或没有电子(四中子)的稳定结构。
二、特性不同
1、分子:分子质量和体积都很小;分子总是在不断运动着的。
温度升高,分子运动速度加快;分子之间有间隔。
2、原子:原子的质量非常小;不停地作无规则运动;原子间有间隔;同种原子性质相同,不同种原子性质不相同。
3、离子:在化合物的原子间进行电子转移而生成离子的过程称为电离,电离过程所需或放出的能量称为电离能。
电离能越大,意味着原子越难失去电子。
《分子和原子》 讲义

《分子和原子》讲义一、引入在我们生活的这个物质世界里,从微小的一滴水到广阔的宇宙,一切都是由物质构成的。
而要深入理解物质的本质,就不得不提到分子和原子这两个重要的概念。
二、分子分子是保持物质化学性质的最小粒子。
这意味着一种物质如果被分割到分子的层面,它的化学性质仍然能够得以保持。
比如说,水是由水分子构成的。
当我们把水不断分割,一直到得到一个个水分子时,这些水分子依然具有水的化学性质。
分子具有一些特性。
首先,分子的质量和体积都很小。
一滴水中所含的水分子数量多得难以想象。
其次,分子在不断地运动。
比如,我们能闻到花香,就是因为花中的香气分子在空气中不停地运动,进入了我们的鼻腔。
而且,分子之间存在间隔。
气体分子之间的间隔较大,容易被压缩;液体和固体分子之间的间隔相对较小,不容易被压缩。
不同的物质由不同的分子构成。
氧气由氧分子构成,氢气由氢分子构成,二氧化碳由二氧化碳分子构成。
三、原子原子是化学变化中的最小粒子。
在化学变化中,分子可以再分,而原子不能再分。
原子的结构包括原子核和核外电子。
原子核又由质子和中子组成。
质子带正电荷,中子不带电,核外电子带负电荷。
原子的质量主要集中在原子核上。
虽然原子很小,但它也有自己的质量和体积。
不同种类的原子,质子数、中子数和核外电子数都不同。
这决定了原子的种类和性质。
四、分子和原子的关系分子和原子有着密切的联系。
分子是由原子构成的。
例如,一个水分子是由两个氢原子和一个氧原子构成的;一个氧分子由两个氧原子构成。
在化学变化中,分子可以分解成原子,原子又可以重新组合成新的分子。
五、分子和原子在生活中的应用分子和原子的知识在生活中有很多实际的应用。
在工业生产中,利用化学反应将分子分解为原子,或者将原子重新组合成新的分子,从而制备出各种有用的物质。
在环境保护方面,了解分子和原子的性质有助于我们更好地处理污染物。
比如,通过特定的方法将有害物质的分子分解为无害的原子或小分子。
在医疗领域,药物的作用机制往往涉及到分子和原子层面的变化。
分子 原子 离子关系

分子原子离子关系
分子、原子和离子是化学中常见的概念,它们之间存在着密切
的关系。
首先,让我们从原子开始。
原子是构成物质的基本单位,由质子、中子和电子组成。
质子带有正电荷,中子没有电荷,而电子带
有负电荷。
原子中的质子和中子位于原子核中,而电子则围绕原子
核运动。
原子的种类由其原子序数(即质子数)决定,不同种类的
原子具有不同的化学性质。
当原子失去或获得一个或多个电子时,就会形成离子。
离子是
带电的原子或原子团,它们可以是正离子(失去了一个或多个电子,带正电荷)或负离子(获得了一个或多个电子,带负电荷)。
离子
的形成通常发生在化学反应中,其中原子之间发生电子转移。
分子是由两个或更多的原子以共用电子对形式结合而成的,是
物质的最小单位。
在分子中,原子通过共价键相互连接。
分子可以
是由相同元素的原子组成(如氧气分子O2),也可以是由不同元素
的原子组成(如水分子H2O)。
因此,原子是构成分子和离子的基本单位。
分子是由原子通过
共价键结合而成的,而离子是由原子通过电子转移形成的带电粒子。
它们之间的关系是密切相互联系的,化学反应中常常涉及到这三者
之间的转化和相互作用。
九上化学(人教版)课件-原子、分子与离子的区别与联系
联系
分裂
分子是由原子构成的,分子
原子
重新组合
2.原子与离子的区别与联系
结构 区 电性 别
符号
联系
原子
离子
阳离子
阴离子
核内质子数= 核内质子数>核 核内质子数<核
核外电子数 外电子数
外电子数
电中 性
带正 电
带负 电
在元素符号右上
用元素符号表 方标出数目和
示,如:Mg、 “+”号,如:
S
Mg2+、H+、Al3+
B.“热胀冷缩”说明分子体积随温度的变化而变化
C.在化学变化中,分子可以再分,原子不可再分
D.在原子中,原子数一定等于核外电子数,但不一定等于中子数
5.能证明分子在化学变化中可以再分的事实是( C )
A.石蜡熔化
B.水分蒸发
C.过氧化氢分解
D.轮胎爆胎
6.利用分子的知识解释,选择合适的选项(填序号)。 A.分子在不断运动,温度越高运动越快 B.分子很小 C.分子间有间隔,压强、温度变化时分子间隔发生变化
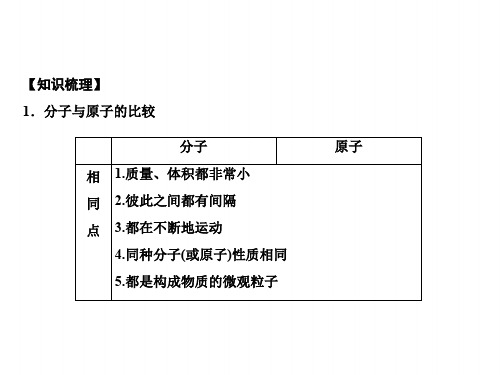
【知识梳理】 1.分子与原子的比较
分子 相 1.质量、体积都非常小 同 2.彼此之间都有间隔 点 3.都在不断地运动
4.同种分子(或原子)性质相同 5.都是构成物质的微观粒子
原子
1.由分子构成的物质,分 1.原子是化学变化中的
不 子是保持其化学性质的最 最小粒子
同 小粒子 2.在化学变化中,原子
点 2.在化学变化中,分子可 不可再分
和Na+
ቤተ መጻሕፍቲ ባይዱ
( B) A.电子数 C.电子层数
B.质子数 D.所带电荷数
,其中相同的是
知识点3:分子、原子、离子的联系与区别 10.(武汉中考)下列说法正确的是( A ) A.花香四溢说明分子在不断运动 B.分子在化学变化中不能再分 C.不同元素的本质区别是中子数不同 D.原子不能直接构成物质 11.下列对分子、原子、离子的认识,正确的是( B ) A.原子是最小的粒子,不可再分 B.温度越高,分子运动速率越快 C.离子不能直接构成物质 D.固体难压缩,说明固体分子间无间隔
分子原子中子质子的关系

分子原子中子质子的关系
分子、原子和中子、质子之间的关系是物质世界中基本粒子的组合和相互作用。
在这个描述中,我们使用一些常见的术语来代替真实的名称和引用。
1. 分子是由不同的原子组成的。
原子是构成分子的基本单位。
分子可以由一个或多个原子组成。
2. 原子由三种基本粒子组成,包括质子、中子和电子。
这些粒子存在于原子的不同部分。
3. 质子是原子中带有正电荷的粒子。
它们位于原子核的中心,与中子一起组成了核子。
4. 中子是原子中带有中性电荷的粒子。
它们也位于原子核的中心,与质子一起组成了核子。
5. 质子和中子的质量相对较重,通常被称为核子。
它们的质量大约相等,都远远高于电子的质量。
6. 电子是带有负电荷的粒子,其质量远远轻于质子和中子。
电子绕着原子核的外部轨道运动,形成了电子云。
7. 分子的稳定性和性质取决于其中原子和电子的组合方式以及它们之间的相互作用。
请注意,以上描述只是对分子、原子和其中包含的粒子的一般性说明,真实的粒子名称和引用可能有所不同。
粒子物理学是研究这些基本粒子及其相互作用的领域,对于更深入的了解,请参考相关的科学文献和资料。
分子和原子的提出

分子和原子的提出一、分子的提出分子是物质的基本单位之一,它是由一组原子通过化学键连接而成的。
分子的概念最早由化学家道尔顿在1803年提出。
道尔顿通过一系列实验证明了物质是由不可再分的微小粒子构成的,并且这些粒子之间可以通过化学反应重新组合形成新的物质。
他将这些不可再分的微小粒子称为原子,将由原子组成的粒子称为分子。
道尔顿的分子概念对化学学科的发展起到了重要的推动作用。
它揭示了物质组成的微观结构,为后来的化学研究提供了基础。
分子的提出使化学学科从宏观到微观有了更深入的认识,为化学反应的研究和物质的分析提供了理论依据。
二、原子的提出原子是组成物质的最基本的微观粒子,它是不可再分的。
原子的概念最早可以追溯到古希腊时期的哲学家们。
但是直到19世纪初,原子的存在还没有得到广泛的认可和证实。
直到英国化学家道尔顿提出了原子学说,才使得原子的概念得到了更加明确的阐述和认知。
道尔顿的原子学说认为,所有的物质都由不可再分的微小粒子组成,这些粒子称为原子。
原子具有质量,不同的物质由不同种类的原子组成,原子之间通过化学键连接形成分子。
这一学说为后来的化学研究提供了基础,也为物质的分析和化学反应的研究提供了理论依据。
随着科学的发展和仪器技术的进步,人们对原子的认识也逐渐深入。
现代原子论认为,原子是由原子核和电子组成的。
原子核位于原子的中心,其中包含着质子和中子。
质子带正电荷,中子不带电荷。
电子则以轨道的形式绕着原子核运动,电子带负电荷。
原子的提出使得人们对物质的本质有了更加深入的认识。
它揭示了物质的微观结构,为化学学科的发展提供了理论基础。
原子学说的提出也为物质的分析和化学反应的研究提供了重要的指导。
三、分子与原子的关系分子和原子是密不可分的,它们之间存在着紧密的联系。
分子是由原子通过化学键连接而成的,它是物质的基本单位之一。
原子是构成分子的最基本的微观粒子,它们以特定的方式组合在一起形成分子。
在物质的化学反应过程中,原子之间发生着化学键的形成和断裂,从而使得分子的结构发生改变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子与原子的关系
分子与原子是化学中两个重要的概念,它们之间有着密不可分的关系。
本文将从分子和原子的定义、性质、相互转化等方面展开,探讨它们
之间的关系。
一、分子和原子的定义
分子是由两个或两个以上原子通过化学键结合而成的,具有一定的稳
定性和独立性的物质单位。
原子是构成物质的最小粒子,具有化学性
质和物理性质。
二、分子和原子的性质
1. 分子的性质
(1)分子具有一定的稳定性和独立性,可以在一定条件下存在。
(2)分子的性质与其组成原子的种类、数量、结合方式等有关。
(3)分子的化学性质主要表现为分子间的相互作用,如化学键的形成、断裂等。
2. 原子的性质
(1)原子是构成物质的最小粒子,具有化学性质和物理性质。
(2)原子的性质与其原子序数、电子结构等有关。
(3)原子的化学性质主要表现为原子间的相互作用,如电子的转移、共用等。
三、分子与原子的相互转化
1. 分子的形成
分子的形成是由两个或两个以上原子通过化学键结合而成的。
分子的形成需要满足一定的条件,如原子间的电子互相吸引,能量足够等。
2. 分子的分解
分子的分解是指分子内部化学键的断裂,使分子分解为原子或离子。
分子的分解需要满足一定的条件,如能量的输入、化学反应等。
3. 原子的组合
原子的组合是指两个或两个以上原子通过化学键结合而成的分子。
原子的组合需要满足一定的条件,如原子间的电子互相吸引,能量足够等。
4. 原子的分离
原子的分离是指分子内部化学键的断裂,使分子分解为原子或离子。
原子的分离需要满足一定的条件,如能量的输入、化学反应等。
四、分子与原子的关系
分子和原子是密不可分的关系,它们之间相互转化,相互影响。
分子是由原子组成的,原子通过化学键结合而成分子。
分子的性质与其组成原子的种类、数量、结合方式等有关。
原子的性质与其原子序数、电子结构等有关。
分子和原子之间的相互转化是化学反应的基础,化学反应的过程就是分子和原子之间的相互转化过程。
总之,分子和原子是化学中两个重要的概念,它们之间有着密不可分的关系。
分子是由原子组成的,原子通过化学键结合而成分子。
分子和原子之间的相互转化是化学反应的基础,化学反应的过程就是分子和原子之间的相互转化过程。
我们应该深入了解分子和原子的性质和相互转化,以便更好地理解化学反应的本质。
