第十章杂环化合物
杂环和脂类化合物

O
对-氨基苯磺酰胺本身就有抑菌作用。当 N1上的 H 原 子被某些基团取代时,抗菌作用增强;若 N4 上的 H 被取
代,则抗菌能力降低甚至丧失。因为具有N4游离氨基的磺 胺与细菌繁殖所需的对氨基苯甲酸结构极为相似,使 酶难以识别而达到抑菌作用。
如 N4 上的取代基易在体内分解而恢复成 -NH2 时 ,则仍具有原来的抗菌作用。
软脂酸(16:0) CH3(CH2)14CO2H
硬脂酸(18:0) CH3(CH2)16CO2H
44 12C 62.9 16C 69.9 18C
花生酸(20:0) CH3(CH2)18CO2H
75.2 20C
脂类中重要的不饱和脂肪酸
名称
结构式
结构特点
油酸 CH3(CH2)7CH=CH(CH2)7CO2H
EPA CH3CH2(CH=CHCH2)5(CH2)2COOH 20C,5=
5,8,11,14,17—二十碳五烯酸 (20:5ω3,6,9,12,15)
DHA CH3CH2(CH=CHCH2)6CH2COOH
22C,6=
4,7,10,13,16,19—二十二碳六烯酸(22:6ω3,6,9,12,15,18)
杂环和脂类化合物
第十章 杂环化合物(Heterocyclic Compouds)
“杂环”就是组成环的原子除C外,还含有其它元素的原子 ,这些非碳原子统称为杂原子。原则上二价以上的元素都可以 成为杂原子,但最常见的是O、S和N。
前面学过的内酯、内酰胺、环氧化合物、环状酸酐等:
N-H
因其性质与相应的脂肪族化合物较相似,因此并 入脂肪族化合物中讨论,而不列为杂环化合物。
purine
第二节 五元杂环化合物
一、呋喃、噻吩、吡咯
有机化学精品课件——杂环化合物

05
有机化学与绿色化学
有机化学的发展趋势
1 2 3
新的合成方法
例如,定向合成、组合合成和高选择性催化等 新技术的开发和应用,极大地推动了有机化学 的发展。
新的反应性和反应机制
例如,电化学和光化学反应以及超分子和纳米 反应器等新技术的应用,为有机化学提供了新 的反应性和反应机制。
总结词
杂环化合物在分子生物学领域具有广泛的应用,涉及多种生物学实验技术。
详细描述
杂环化合物可以作为药物分子、基因治疗剂、分子探针等应用于分子生物学研究中。生物学实验技术包括细胞 培养、基因克隆和表达、蛋白质分离和分析等。这些技术可以用来研究杂环化合物在生物体内的吸收、分布、 代谢和排泄等特性。
杂环化合物的应用研究实验
合成方法
通过取代反应
杂环化合物可以通过取代反应合成,如卤代烃、醇、羧酸等 中的杂原子被其他原子取代。
通过成环反应
某些杂环化合物可以通过成环反应合成,如氨基酸、腺苷等 。
02
杂环化合物的种类与性质
含氮杂环化合物
吡啶
弱碱,碱性来自于氮原子上的孤对电子,可参与多种有机反应。
咪唑
碱性较弱,作为配体参与有机反应。
抗疟活性
青蒿素及其衍生物是具有抗疟活性的重要杂环化合物,通过干扰疟原虫的细胞膜 结构和功能,导致疟原虫死亡。
04
有机化学实验技术
杂环化合物的合成实验
总结词
有机化学实验技术中,杂环化合物的合成 实验是掌握杂环化合物性质的重要环节。
VS
详细描述
杂环化合物的合成实验涉及到多种反应类 型,如缩合反应、取代反应、加成反应等 。在实验过程中需要用到各种不同的试剂 和溶剂,如酸、碱、氧化剂、还原剂等。 实验操作也有一定难度,需要掌握一定的 实验技能和操作技巧。
第10章 其他类有机化合物简介

3 4
碳水化合物的结构和分类 单糖
低聚糖 多糖
有机化学
一、碳水化合物的结构和分类
1. 碳水化合物的结构
从化学结构上看,碳水化合物是多羟基醛、多羟基酮, 或者是能水解成多羟基醛或多羟基酮的化合物,即分子中含 有下列结构:
2. 碳水化合物的分类
碳水化合物一般根据它能否水解,以及水解后的产物可
分为三大类。 ①单糖 ②低聚糖
葡萄糖是醛糖,分子中含醛基,所以有醛基的化学性质,
易发生氧化反应和还原反应等。
有机化学
二、单糖
(3)葡萄糖的制法和用途 2. 果糖 (1)果糖的来源和结构
(2)果糖的性质和用途 果糖可用作食物、营养剂和防腐剂。它在人体内极 易转变为葡萄糖,在食品工业中也可作调味剂。
有机化学
三、低聚糖
1. 蔗糖
蔗糖是自然界中分布最广的二糖,它广泛存在于植 物的茎、叶、根、种子和果实内,其中以甘蔗和甜菜含 量最多,故称为蔗糖或甜菜糖。 2. 麦芽糖
纤维素是自然界中分布最广、含量最丰富的有机高分子
多糖类化合物。它们是构成植物细胞壁的主要成分,也是构 成植物基干的基础。
有机化学
第三节 高分子化合物
1 2
3 4
概述 高分子化合物的结构和特性
高分子化合物的合成 合成高分子材料
有机化学
一、概述
1. 高分子化合物的含义 高分子化合物实际上是由许多链节结构相同而聚合度不同
有机化学
四、合成高分子材料
高分子合成材料主要指塑料、合成纤维、合成橡胶三大合
成材料及涂料、黏合剂、离子交换树脂等。这些新型的合成材
料,一般具有密度小、强度高、弹性好,可塑性、绝缘性和耐 腐性好等特点,是一般天然材料所没有的,所以在工业、农业 、航空、医疗卫生以及人民日常生活等方面都有广泛的应用。 1. 塑料 以合成的或天然的高分子化合物为基本成分,在加工过程 中可塑制成型,而产品最后能保持形状不变的材料。多数塑料
电子教案与课件:有机化学B幻灯片 第十章杂环化合物

叶,略加粉碎,装入纸袋中,上下端封好,装入脂肪 提取器中(装置如图10-1),圆底烧瓶中加入60ml氯 仿,几粒沸石,用水浴加热,连续提取8~10次(提 取时,溶剂蒸汽从导气管上升到冷凝管中,被冷凝成 液体后,滴入提取器中,萃取出茶叶中的可溶物,此 时溶液呈深草青色,当液面上升到与虹吸管一样高时 ,提取液就从虹吸管流入烧瓶中,这为一次虹吸)。 茶叶每次都能被纯粹的溶剂所萃取,使茶叶中的可溶 物质富集于烧瓶中。待提取器中的溶剂基本上呈无色 或微呈青绿色时(一般8~10次),可以停止提取, 但必须待提取器中的提取液刚刚虹吸下去后,方可停 止加热。
• 含结晶水的咖啡因系无色针状结晶,味苦,能溶于水 、乙醇、氯仿等。在100℃时即失去结晶水,并开始升 华,120℃时升华相当显著,至178℃时升华很快。无 水咖啡因的熔点为234.5℃。
H
N
N
N
N
嘌呤
O H3C N
CH3 N
O
N
N
CH3 咖啡因
升华
• 升华是纯化固体有机物的方法之一。
• 某些物质在固态时有相当高的蒸气压,当加热 时不经进液态而直接气化,蒸气遇次则凝结成 固体,这个过程叫做升华。
• 2. 茶叶袋的上下端也要包严,防止茶叶沫漏出,堵 塞虹吸管
• 3. 升华一步,一定要小火加热,慢慢升温,最好是 酒精灯的火焰尖刚好接触石棉网,徐徐加热10-15分 钟。如果火焰太大,加热太快,滤纸和咖啡因都会炭 化变黑;如果火焰太小,升温太慢,会浪费时间,在 部分咖啡因还没有升华,影响收率
【实验步骤】
• 伍德沃德1917年4月10日生于美国马萨诸塞州的波士顿 。从小喜读书,善思考,学习成绩优异。1933年夏,只 有16岁的伍德沃德就以优异的成绩,考入美国的著名大 学麻省理工学院。在全班学生中,他是年龄最小的一个 ,素有“神童”之称,学校为了培养他,为他一人单独 安排了许多课程。他聪颖过人,只用了3年时间就学完 了大学的全部课程,并以出色的成绩获得了学士学位。 伍德沃德获学士学位后,直接攻取博士学位,只用了一 年的时间,学完了博士生的所有课程,通过论文答辩获 博士学位。
第十章杂环化合物

O O
O
H
H
H
H
O OH2
O HO
H O
O
OO
催化加氢:
H2, Ni
O
O THF
四氢呋喃(THF),bp 67℃ ,性质与乙醚相似, 是重要的化学溶剂。
2、糠醛
糠醛的化学性质与苯甲醛相似。可以发生交叉 羟醛缩合反应、Cannizzaro反应、Perkin反应。
dil.NaOH
O
CHO CH3CHO
mp26℃,bp 243℃。难溶于水,易溶于有机溶剂。
N
喹啉
N
异喹啉
来源: 煤焦油和骨油。
制备: Skraup合成法
CH2OH CHOH CH2OH
H2SO4 2H2O
CHO CH C6H5NH2
CH2
C6H5NO2
N
H2SO4
H2O
N H
H C O CH2
CH2 NH
H HO C
CH CH2 NH
五元杂环化合物亲电取代活性顺序: 吡咯>呋喃>噻吩>苯
三、六元杂环化合物的性质
六元杂环化合物发生亲电取代反应主要在β-位。 可以从反应中间体的稳定性给予说明。
α位
E
N
β位
H NE
H E
N
H N
E
H NE
H 不稳定共H振结 构式
E
E
N
N
1、吡啶
吡啶有特殊臭味的无
色液体,bp 115℃,可与
N
水、乙醇、乙醚等混溶。
N
PCl3
NO2 N
HNO3
N
H2SO4
O
NO2
N O
有机化学精品课件——杂环化合物

杂环化合物在材料科学中具有广泛的应用,因为它们可以提供优良的物理和化学性能。例如,聚酰亚胺、聚醚醚酮等杂环高分子材料在航空航天、电子和汽车等领域广泛应用。
杂环化合物作为材料合成的关键组分,能够提高材料的耐热性、耐腐蚀性和机械性能等,同时降低生产成本和提高生产效率。
杂环化合物的研究进展与展望
05
在亲电反应机理中,试剂的性质和杂环化合物上的取代基的性质都会影响反应的进程和产物的生成。因此,在选择合适的试剂和反应条件时,需要考虑这些因素。
亲核反应机理是指反应过程中,试剂首先进攻杂环化合物上的电子云密度较高的部位,从而形成负碳离子中间体。然后,负碳离子中间体再与试剂发生反应,形成新的键,最终生成产物。
杂环化合物的应用
04
杂环化合物在药物合成中具有广泛的应用,因为它们具有独特的化学结构和生物活性。例如,嘧啶衍生物在抗肿瘤药物中发挥重要作用,喹啉衍生物具有抗菌和抗癌活性。
杂环化合物作为药物合成中的关键中间体,可用于合成多种类型的药物,如抗高血压药物、抗病毒药物和抗癌药物等。
VS
杂环化合物在农药合成中具有不可替代的地位,因为它们可以提供高效、低毒、低残留的农药。例如,吡啶衍生物可用于合成除草剂和杀虫剂,嘧啶衍生物可用于合成杀菌剂和杀虫剂。
杂环化合物作为农药合成的关键组分,能够提高农药的生物活性、选择性和稳定性,从而降低对环境和人体的危害。
杂环化合物在染料合成中具有重要作用,因为它们可以提供鲜艳的色彩和优良的染色性能。例如,偶氮染料和酞菁染料等杂环染料在纺织品、皮革和纸张等领域广泛应用。
杂环化合物作为染料合成的关键组分,能够提高染料的色牢度和稳定性,同时降低生产成本和对环境的污染。
杂环化合物的物理性质与其结构密切相关,如熔点、沸点、溶解度等。
杂环化合物

13
①
卤代
Br2 S 乙 酸 Br2 O
O O
S
Br
, 0℃
O Br Br
Br Br N H Br
Br2 N H 乙 醇, 0℃
14
② 硝化
硝化剂:温和的乙酰基硝酸酯( CH3COONO2 ),且控 制低温条件。
CH3COONO2
O
-5 ~ -30 ℃
O
NO2
15
③ 磺化
磺化剂:
+
N
3
SO -
H HO C H C OH CHO △
水解
△
戊糖
稀酸
-3H2O
2.化性
① 催化加氢
H CH C-H OH OH
O
CHO
② 氧化
25
③ 歧化
④ 安息香缩合 ⑤ 合成四氢呋喃作为溶剂
3. 糠醛遇苯胺醋酸盐 溶液显深红色。 4. 用途:① 糠醛是良好的溶剂; ② 广泛用于油漆及树脂工业; ③ 合成苯酚糠醛塑料。
δ
γ
δ δ
亲电试剂进攻部位
β α
δ +
δ — δ — δ —
0.87
N
1.01
0.84
1.01
碱性与成盐
N
1.43
N
0.84
36
③亲核取代 比苯容易 进入α位
+
N
NaNH2
C6H5NMe2
H2O
回流
N
NHNa
N
NH 2
④ 氧化 吡啶环对氧化剂稳定
HNO3
COOH N COOH
N
CH 3 N
△
KMnO4 -
δ 6.99 δ 7.18 δ 6.22 δ 6.68 δ 6.24
含氮有机化合物和杂环

NO2
Fe / HCl 或Sn / HCl
NH2
12
2. 腈和酰胺的还原
RCN
H2 / Pt LiAlH4
RCH2NH2
O H3C C NH 2
H2/Ni
CH3CH2NH2
13
3. Hofmann降解反应
O R C NH2
Br2 / NaOH or Cl2 / NaOH
RNH2 + NaBr + Na2CO3
O
CH3CCl
NO 2
NHCOCH 3
HNO3 / H2SO4
NHCOCH 3
H2O / OH-
NH 2
NO 2
NO 2
21
4. 与亚硝酸反应
拓展
亚硝酸钠
亚硝酸钠是一种有毒的氧化剂,大量进入血液
后,将血红蛋白中的二价铁氧化为三价铁,形成高 铁血红蛋白血症,失去携氧能力,造成机体组织细 胞缺氧症状,严重影响中枢神经系统,可引起呼吸 困难、循环衰竭。在腌咸肉或加工熟食卤味时,有 时为了使肉色鲜红而加入亚硝酸盐,如加入过量, 同样会引起中毒。另外,食用富含亚硝酸盐的食物 还与一些肿瘤发生有关。据调查发现,食管癌高发 区居民食腌菜者较普遍,食管癌的发病率与食腌菜 量相关,在这些腌制的咸菜中含有大量的亚硝酸盐。
第十章 含氮有机化合物
1
胺
含
氮 重氮化合物、偶氮化合物
有
机 酰胺
化
合 物
含氮杂环
生物碱
2
第一节 胺 一. 胺的分类和命名
1.分类
3
名称 伯胺 仲胺 叔胺 季铵盐 季铵碱
分子式
RNH2 R2NH R3N R4N+XR4N+OH-
第十章 胺及杂环化合物
胺 amines
胺可以看作氨 (NH3) 的烃基衍生物,是生物界 最丰富的一类化合物
Viagra ®
(普鲁卡因)
胺对有机化学家来说同样是重要的一类化合物
10.1.1 胺的分类和命名
胺的分类
氨 (NH3,ammonia) 的一个或多个氢被烃基取 代所得到的化合物称为胺 (amine)
(氨)
(吗啡)
(阿托品)
大多数生物碱都是 氨基酸的代谢产物
大多数生物碱都具有显著的生物活性
(抗痉挛药)
Atroperum
(颠茄)
(罂粟)
Cinchona ledgeriana
(金鸡纳树)
(抗疟疾药)
Lycoris radiata
(石蒜)
(抗重症肌无力药)
脂肪胺 叔胺 > 仲胺 > 伯胺 > NH3 > 苯胺 酰胺
溶剂化效应
溶剂与溶解于其中的分子 或离子之间的相互作用称 为溶剂化效应
氢键
R
+
N
H H H
:OH2 :OH2 :OH2
--- 共轭酸 (铵正离子) 的稳定性
伯胺 > 仲胺 > 叔胺
空间效应
氮原子上连接的烃基对氮原子上孤对电子的屏蔽作用 烃基的数目越多或体积增大,胺的碱性降低
碱性
氮原子上的孤对电子 没有参与大 p 键的形 成,有一定的自由度
吡啶的碱性弱于氨/胺 (sp3),这是因为sp2杂化 轨道上s成分较多,距核较近,因而该氮原子 孤对电子受核束缚较强 吡啶碱性强于苯胺
吡啶的反应
• 亲电取代反应
活性比苯低,较难反应
取代基多进入b位 (3位)
• 还原反应 (比苯易还原)
NH2
CH3CH2NH2
杂环化合物

吡嗪 (pyrazine)
8 7 6 5 9
吡喃 (pyran)
1 2 3 1 6
稠 杂
6 7 8
N
N
3
5
N N
7
N
1
N
2
N1 H
N
2
4
8
10
4
环
喹啉 (quinoline)
异喹啉
(isoquinoline)
吲哚 ( indole )
吖啶 (acridine)
嘌呤 (purine)
2、命名: 采用IUPAC原则,以45个杂环化合 物的俗名为基础作为命名的依据 ,英文 译音,汉字加“口”旁。
苯环与杂环稠合
稠杂环 杂环与杂环稠合
杂环种类 五
4 5 3 4 5 3
重
4 5 1
要
3
杂
4 5
环
N S
1 2 3 4 5 1 3 4 5 1
N N H
2
3
单
元 杂 环
元 杂 环
O
1
2
S
1
2
N H
2
N H
N2
呋喃 (furan)
4 5 3
噻吩 (thilphene)
4 5 3
吡咯 (pyrrole)
NH2 N N N H N
5、鸟嘌呤(guanine) 2-氨基-6-氧嘌呤称为鸟嘌呤(G)
O H N H2N N N H N H2N N N N H OH N
小 结 杂环化合物的分类 杂环化合物的命名 作 业
6 7 8
N-甲基-2-巯基咪唑 5-乙基噻唑 2,4-二羟基嘧
(3)、特定名称的稠杂环,有其固定的编号顺序 5 4
杂环化合物

杂环化合物杂环化合物杂环化合物是一种含有环的化合物,这个环由一种以上原子所组成。
一般将杂环化合物分为两类:一类是脂肪族杂环化合物,另一类是具有方向性的杂环化合物。
杂环化合物在日常生活中应用广泛。
是合成药物,合成染料,合成材料的重要原料之一。
是一大类有机化合物。
在理论上和实际中都有十分重要意义。
杂环化合物已经成为芳香性杂环化合物的代名词。
杂环化合物数目很多,根据环的大小,杂原子的多少和单环、稠环来分类。
最常见的和最稳定的是五元和六元单杂环及其相应的稠杂环,咋换上的编号一般是从杂原子开始,从阿拉伯数字1、2、3表示顺次,如同环中含有不同杂原子时,按O\S\N先后顺序排列进行编号,若有取代基则要考虑到取代基编号最小。
五元杂环--五元杂环中含有两个杂原子,其中一个必须是N原子(称固定氮原子)的叫做唑,第二个原子为氧原子的叫恶唑;第二个原子为硫原子的叫噻唑,第二个原子为氮原子的叫咪唑或吡唑,命名时还要标出两个杂原子的位置。
即为1,2-唑六元杂环含有两个杂原子的六元环有三种情况:杂原子互为邻位、间位、和对位。
含有两个氮原子的叫二嗪。
如”吡啶“含一个氮原子的吡啶稠杂环稠杂环是两个以上环稠合而成,其中一个是基本环,另一个是附加环,命名时附加环在前,基本环在后。
单环都可以作为基本环,个别稠杂环是基本环,如吲哚(苯并吡咯),喹啉(苯并吡啶),嘌啉(嘧啶并吡唑)由芳环与杂环组成的稠杂环。
杂环优先(即杂环为基本环),如:苯并呋喃、苯并咪唑,由两个杂环组成的稠杂环,大环优先于小环。
环数相同时,N、O、S杂原子顺序确定。
如;吡咯并吡啶,噻吩并吡咯。
环上杂原子数目多的优先,杂原子数目相同时,杂原子种类多的优先例如:吡啶并嘧啶、咪唑并恶唑、咪唑并噻唑。
环上杂原子数目及种类都相同时,同环杂原子编号低的优先。
(2)稠环共用边的标记。
附加环按其杂环的编号顺序编号,并以阿拉伯数字1、2、3.。
将各原子进行标记,苯环上的原子不需要编号,命名时在附加环名称的后面加一个并字。
有机化学杂环化合物

+ (C5H8O4)n
H2O
稀 H2SO4 加热
n C5H10O5 戊醛糖
HO CH CH OH H CH CH CHO OH OH
稀 H2SO4 -3 H2O
O CHO 糠醛
显色反应
下面的显色反应可用来定性检验糠醛:
NH2
+2
O CHO 糠醛
CH3COOH
- H2O
CHCHC OH来自NH CHCH N
..
.
.
. .. N . 未共用电子对占据
sp2杂化轨道,与
环共平面,不能参
与环系的共轭
吡啶的结构
吡啶和吡咯的结构比较
孤对电子在 p轨道上
孤对电子在sp2 杂化轨道上
17.2.2 呋喃、噻吩和吡咯和吡啶的性质
呋喃是无色液体,沸点32℃,具有类似氯仿的气 味,微溶于水,易溶于乙醇、 乙醚等有机溶剂。呋喃 能使盐酸浸过的松木片显绿色,此现象可检验呋喃的存 在。
物的英文读音,选用同音汉字,并以“口”字旁 表示杂环化合物。
O
S
N
H
呋喃 噻吩 吡咯 Furan thiophene pyrrole
N
吡啶 pyridine
N
N 喹啉 puinoline
S
噻唑 thiazole N
N H
咪唑 imidazole
N
吲哚 indole
环上有取代基的杂环化合物,命名时以杂环为
+ KOH (固 体)
N H
+ H2O
N K
吡啶环上的氮原子的一对未共用电子对处于 sp2杂化轨道上,它并不参与环上的共轭体系,因 此能与质子结合,具有弱碱性。
10-3 简单的稠环芳烃

上页
下页
返回
帮助
10–3 §10 3简单的稠环芳烃
60℃,H2SO4
第十章 环烃和杂环化合物
SO3H (>95%)
165℃
165℃,H2SO4
SO3H
(85%)
α-萘磺酸易生成,但β-萘磺酸比前者稳定,磺化反 应可逆的特点使萘的磺化反应在化工生产中,有着重要的 应用。 知识窗 稠环芳烃中,有许多具有致癌性。如3,4-苯并芘, 5,10-二甲基-1,2-苯并蒽,1,2,5,6-二苯并蒽等。
上页 下页 返回 帮助
10–3 §10 3简单的稠环芳烃
二、稠环芳烃的结构
第十章 环烃和杂环化合物
萘的分子式为C 分子结构如图所示。 萘的分子式为C10H8。分子结构如图所示。
0.1424nm 0.1365nm 0.1404nm 0.1393nm
图10-4 萘分子的模型及键长
上页
下页
返回
帮助
10–3 §10 3简单的稠环芳烃
返回
帮助
10–3 §10 3简单的稠环芳烃
第十章 环烃和杂环化合物
其中的1、4、5、8位是等同的,称为α位;2、3、6、7 位也是等同的,称为β位。一元取代萘有两种不同的异构体: α─取代萘和β—取代萘。如:
Br
Br
1-溴萘 (α─溴萘)
2-溴萘 (β─溴萘)
知识窗
上页
下页
返回
帮助
10–3 §10 3简单的稠环芳烃
上页
下页
返回
帮助
H H H H H H H H H H
知识窗
上页
下页
返回
帮助
10–3 §10 3简单的稠环芳烃
三、稠环芳烃的性质
杂环化合物大全

杂环化合物大全【药师学习百科】——第5期杂环一概念与碳环相对,指的是成环的原子不仅包括碳,还包括氮、氧或硫等原子。
简单的杂环环系从3到10元不等;可以是脂环(如四氢咲喃),也可以是芳环(如毗口定)。
复杂的杂环系可以由2个或更多简单环并合而成(如□引噪)。
杂环化合物的系统命名法如下把杂环看作碳环中碳原子被杂原子替换而形成的环,称为“某杂(环的名称)”:给杂原子编号,使杂原子的位置号尽量小。
其他官能团视为取代基。
杂环化合物大全(部分学员对基本杂环方面知识还有所欠缺,本人特整理此表,志于全面,欢迎补充)3N2◎氢唳烟酸烟六毗、酸烟胺异脐宀0丿212〃•毗扁4C5H60C5H6S毗一杂子含个原毗喃噬喃喀唳含两个杂原子蝶唳52 N8N167H-D票吟65NN3NH口丫唳8 976N45 1* 8 4N9吩嗪109N83 746吩囉嗪9876121034非杂环>环戊二烯或C5H6 o5一、大多数药物可根据药名提示联想其具有的结构(药名与结构)二、通过具有的结构认识化学名,即看见化学名,知道是什么药物。
三、根据结构分析得岀理化性质。
由此,基本上就掌握了该药的主要性质。
有少部分药物的药名与结构之间找不出任何的联系,这种情况只好下工夫记忆了。
四、药物的用途,通常指的是它属于哪类药物,例如口引噪美辛为非辎体抗炎药,咲喙米为利尿药。
考題一般不要求知道更具体的用途。
另外,执业药师考题上,要求我们记药物的结构式,并不是要求我们默写出每个药物的结构式,而是看到结构式能够知道它是哪个药物,这比默写出结构式要容易了。
例一毗罗昔康一)、药名提示:1、“毗”提示有毗唉环;2、“昔康"为U 2-苯并嚷嗪结构。
二)、结构分析:1、具芳香轻基:三氯化铁反应:2、具酰胺:易水解;需密封,阴凉保存。
例二布洛芬一)、药名提示:1、“布”(Butyl〉提示为丁基:2、“洛芬”是芳基丙酸的词尾。
二)、结构分析:具竣基:呈酸性,溶于緘,与乙醇成酯后,具异强肪酸铁反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
色液体,bp 115℃,可与
N
水、乙醇、乙醚等混溶。
来源:煤焦油
性质:碱性;亲电取代反应活性与硝基苯相似; 取代发生在β位。亲核取代反应发生在α位。
(1)碱性
吡啶N上孤对电子处于Sp2杂化轨道中,未参与
共轭,显示一定的碱性,强于苯胺,弱于氨。
(2)亲电取代反应
Br2
H2SO4
N
HNO3 H2SO4
2、六元杂环的芳性
吡啶环与苯环很相似,成环六个原子都以SP2杂 化,处于同一平面中,每个原子各提供一个单电子, 形成π66,符合(4n+2)Huckel规则。氮原子上处于 SP2杂化轨道中的孤对电子未参与共轭或成键。
由于N的电负性比C强,
环上电子云密度比苯
N
低,吡啶的亲电取代 反应活性相当于硝基
苯。
bp131℃,微溶于水,易溶于有机溶剂。吡咯环比 苯环稳定性差,易被氧化。
鉴别:吡咯蒸气遇浸过盐酸的松木片显红色。
制备; O
NH3
Al2O3
450 ℃
N
H
吡咯是一个很弱的碱,也是一个很弱的酸,为 什么?
KOH N H
H2O N K
由于吡咯环的不稳定,亲电取代反应通常以NBS (N-溴代丁二酰亚胺)作溴代试剂;以醋酸硝基酯 作硝化试剂;以N-磺酸吡啶作磺化试剂。亲电取代 反应发生在α-位。
CH3
N
H
N
HNO3 (
) SOCl2 (
) NH3 Br2/NaOH (
)
N
CH3
COOH
N
,
COCl
N
,
NH2 N
下列叙述错误的是 ( ) A. 呋喃、吡咯、噻吩均比苯更容易进行亲电 取代反应。 B. 苯中混有少量噻吩,可以用浓硫酸除去。 C. 吡咯的碱性比吡啶弱。 D. 芳香性的顺序是呋喃>吡咯>噻吩。
N(CH3)3
-NH2 NH3 [(CH3)4N]OH
N
N
H
Br N
N
N Br
Br
N
CH3 N
NH2 N
使用格氏试剂法完成
COOH
S
S
作业(书318页)
⒉ ⒌ 7.(1)(5)(6)(7)(8) 9.
整个大π体系与苯环相似,但五元杂环为π65 富电子体系,与苯环的π66比较,显然五元杂环的 电子云密度更高。发生亲电取代反应呋喃的活性 相当于苯酚,吡咯的活性相当于苯胺。 五元杂环化合物的共振能为: 呋喃 67KJ/mol 吡咯 88KJ/mol 噻吩 117KJ/mol
从五元杂环化合物的NMR谱可以看出,环上H 受离域电子环流的影响,H的化学位移δ≈7,与苯 环上的H相当。
O
CH2 CH C CH3 C CH COOEt
O
CH3
EtOH
OH
CH2 CH C CH3 C CH COOEt
O
CH3
O
CH2 CH2 C CH3 CH3 C CH COOEt
O
NaOH
O
O
CH3CCH2CH2CH2CCH3
反应:
KMnO4
N
HNO3
N H2SO4
COOH CO2 N COOH
D
从大到小比较下列化合物发生亲电取代反应的速率, 并解释原因。
O
N
N
H
CH3
亲电取代活性:吡咯>呋喃>甲苯>苯>吡啶,五元杂 环化合物为富电子芳杂环,活性强于苯,吡咯因N的 电负性若于O,吡咯碳环上电子云密度大于呋喃,活 性更强;吡啶为缺电子芳杂环,弱于苯;甲基的供电子 性使甲苯的活性强于苯.
从大到小写出下列化合物的碱性
二、五元杂环化合物的性质
五元杂环化合物亲电取代反应主要发生在2位上。 可以从中间体稳定性作出解释。
β
E
N
α
H
H E
N H
H
N H
E
H E
N H
H
N H
E
H NE H
#进攻α-位共振结构较多,中间体稳定性好。
1、呋喃
呋喃:无色液体,bp 32℃,难溶于水,易溶于
有机溶剂。
鉴别:浸过盐酸的松木片显绿色
卤代反应:
2 Br2
O
Br
硝化反应:
CH3COONO2
O -5~-30℃
磺化反应:
C5H5N SO3
O ClCH2CH2Cl O
O NO2
SO3 N H
HBr O Br
H
O SO3H
酸介质下开环反应:
H
O
H H H2O
O
发生Diels—Alder反应:
O
O O
O
H
H
H
H
O OH2
O HO
H O
O
N
H2SO4
H2O
N H
H C O CH2
CH2 NH
H HO C
CH CH2 NH
如何合成8-羟基喹啉?
N OH
NH2 OH
Michael加成反应 碳负离子与α,β不饱和羰基化合物的共轭加
成称为Michael加成。反应类似1,4-加成,经重 排,保留羰基。
O
O
CH2 CH C CH3 CH3CCHCOOEt
(1)制法:
( C5H8O4 )n H , H2O
戊聚糖
CHO ( CHOH )3
戊C醛H2糖OH
3H2O
ZnO-Cr2O3-MnO2
CHO
O
糠醛
400℃
O
Cu , 喹啉
COOH O
CO2 O
(2)化学性质 呋喃芳性较差,容易开环,并且在强酸性介质
中会发生自身聚合。所以在发生亲电取代反应时, 要避免使用酸性介质。
Br N
SO3H
N NO2
N
γ-位取代:
O CH3COOH
N
PCl3
NO2 N
HNO3
N
H2SO4
O
NO2
N O
(3)亲核取代反应
NaNH2 N
H2O
NHNa N
N
NH2
C6H5Li
LiH
N
N
Cl KOH N
OH N
4、氧化还原反应
N CH3
CH3
KMnO4
OH
N
COOH
V2O5
COOH
烟酸
N
第十章 杂环化合物
一、杂环化合物的结构和芳香性 二、五元杂环化合物的性质 三、六元杂环化合物的性质
构成环的原子除碳原子外还有其它非碳原子, 这类环状化合物称为杂环化合物。最常见的杂原 子有O、S、N、P等。(杂原子为成环原子) 例如:
CONHNH2
O2N
N
雷米封
O
CH N N
O
O
痢特灵
CH2OH
N 异烟酸
H2/Pt
N
N 哌啶
H
2、喹啉 喹啉为无色油状液体,bp 238℃;异喹啉
mp26℃,bp 243℃。难溶于水,易溶于有机溶剂。
N
喹啉
N
异喹啉
来源: 煤焦油和骨油。
制备: Skraup合成法
CH2OH CHOH CH2OH
H2SO4 2H2O
CHO CH C6H5NH2
CH2
C6H5NO2
O
呋喃
( furan
S
噻吩
thiophene
N H
吡咯
pyrrole
N
吡啶
pyridine )
N
吲哚
H
indole
N
喹啉 quinoline
一、杂环化合物的结构与芳香性
1、五元杂环的芳性
呋喃、噻吩、吡咯是含一个杂原子的五元杂环
化合物,五个成环原子共处于一个平面。以呋喃为
例:
O
每个碳原子都以SP2杂化, 都有一个垂直于分子平面 的P轨道,它们相互平行, 侧面交盖,形成闭合共轭 体系,符合(4n+2) HuckeH
N2Cl
C2H5OH, H2O
CH3COONa
H3C N N=N H
H2SO4
(
)
S
室温
S SO3H
N
HNO3
H2SO4 (
) Fe/HCl (
) NaNO2 (
HCl
H3C
NH2
)
(
CH3COONa
)
NO2
N
,
NH2
N
,
N2Cl
N
,
NH2 NN
N CH3
N
N H
CH3I
(
)
+
I- N
吲哚是一个稠环化合物,mp 52℃,bp 253℃。 亲电取代反应主要发生在五元环上。为什么?
N H
三、六元杂环化合物的性质
六元杂环化合物发生亲电取代反应主要在β-位。 可以从反应中间体的稳定性给予说明。
α位
E
N
β位
H NE
H E
N
H N
E
H NE
H 不稳定共H振结 构式
E
E
N
N
1、吡啶
吡啶有特殊臭味的无
HO
CH2OH
CH3 N VB6
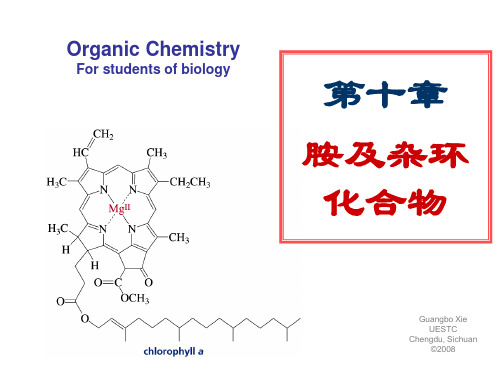
杂环化合物在人们的现实生活中有着极其重要的 地位。绝大多数药物和半数以上的其它有机化合物 为杂环化合物。碳水化合物、叶绿素、血红素、吗 啡、黄连素、异烟肼、喜树碱、维生素等等,它们 分子中都含有杂环。
本章仅以五元、六元芳杂环的基本结构为例, 简要说明芳杂环的结构和性质的关系,而对非芳杂 环不作讨论。下列杂环是本章讨论的基本结构。
