淀粉酶的制备及活力测定共26页
项目二-淀粉酶的制备及活力测定

五、实验结果
编号 吸光值 计算用的吸光值
I-1 0.022 0
I-2 0.047 0.025
I-3 0.115 0.093
(三)α-淀粉酶活力测定: ① 取试管3支 ② 于每管中各加入酶液1mL,在70℃±0.5℃恒温 水浴中准确加热15min,钝化β-淀粉酶。取出 后迅速用流水冷却。 ③ 在对照管中加入4mL0.4mol/L氢氧化钠。 ④ 在4支试管中各加入1mLpH5.6柠檬酸缓冲液。 ⑤ 将4支试管置于恒温水浴中,40℃±0.5℃保温 15min,再向各管分别加入40℃下预热的1%淀 粉液2mL,摇匀,立即放入40℃恒温水浴准确计 时保温5min。取出后向测定管迅速加入 4mL0.4mol/L氢氧化钠,终止酶活动,准备测糖。
(一)麦芽糖标准曲线的制作:取7支干净 的具塞刻度试管,编号,按表加入试剂。 摇匀,置沸水浴中煮沸5min。取出后流水 冷却,加蒸馏水定容至25ml。以1号管作 为空白调零点,在520nm波长下比色测定, 记录吸光度。以麦芽糖含量为横坐标,吸 光度值为纵坐标,绘制标准曲线。
管号 麦芽糖 标准液 蒸馏水 麦芽糖 含量 3,5二硝基 水杨酸
淀粉酶的制备及活力测定
指导老师:
一、淀粉酶
• 淀粉酶是水解淀粉和糖原的酶类总称,通 常通过淀粉酶催化水解织物上的淀粉浆料, 由于淀粉酶的高效性及专一性,酶退浆的 退浆率高,退浆快,污染少,产品比酸法、 碱法更柔软,且不损伤纤维。淀粉酶的种 类很多,根据织物不同,设备组合不同, 工艺流程也不同,目前所用的退浆方法有 浸渍法、堆置法、卷染法、连续洗等,由 于淀粉酶退浆机械作用小,水的用量少, 可以在低温条件下达到退浆效果,具有鲜 明的环保特色。
操作项目 I-1 淀粉酶原液 钝化β-淀粉 酶 3,5-二硝基 水杨酸 2.0 1.0
生物化学实验淀粉酶活力测定 PPT

七、考虑题
• 1、为什么要将试管中的淀粉酶原液置70℃水浴中 保温15min?
• 2、为什么要将各试管中的淀粉酶原液和1%淀粉 溶液分别置于40℃水浴中保温?
三、仪器和试剂
• 主要仪器: • (1)离心机 • (2)分光光度计 • 试剂 • (1)标准麦芽糖溶液(2mg/mL) • (2)1%3,5-二硝基水杨酸试剂 • (3)1%淀粉
四、操作步骤
1、标准曲线的制作(每2组4人做1标准曲线)
编号
1#(空白)
2#
3#
4#
5#
6#
2mg/mL麦芽糖标准液(mL)
表1-1不同谷物淀粉的比旋光度
品种
品种
小麦
182、7ຫໍສະໝຸດ 马铃薯黑麦184、0
小米
大麦
181、5
荞麦
水稻
185、9
燕麦
195、4 171、4 179、5 181、3
玉米
184、6
[α]D20
实验二 氨基酸的纸上层析
一、实验目的
通过对氨基酸的分离,学习纸层析法的基本原理及操作方法。
二、实验原理
纸层析是以滤纸作为惰性支持物的分配层析,滤纸纤维上的- OH具有亲水性,因此能吸附一层水作为固定相,而通常把有机 溶剂作为流动相。有机溶剂自上而下流动,称为下行层析;自 下而上流动,称为上行层析。流动相流经支持物时与固定相之 间连续抽提,使物质在两相之间不断分配而得到分离。
1、主要仪器: (1)旋光仪 (2)电子天平(感量0、0001g) 2、试剂:
⑴1%盐酸溶液 ⑵30%硫酸锌溶液。 ⑶15%亚铁氰化钾溶液。
四、实验步骤
1、样品的处理 在电子天平上称取小麦粉2、5000g置于三角瓶中→加
淀粉酶的制备及活力测定

( 4 ) 1 % 淀 粉 溶 液 : 称 取 1 g 淀 粉 溶 于
100mL0.1mol/L pH5.6的柠檬酸缓冲液中。
( 5 )
0.4M NaOH
实训步骤
1 、称取 1g 萌发 3 天的小麦种子,置于
研钵中。 2. 加入少量的石英砂和 2mL 的蒸馏水, 研磨匀浆。 3. 将匀浆倒入离心管中,用 6mL 蒸馏 水分次将残渣洗入离心管。提取液在 室温下放置提取 15 至 20 分钟。每隔数 分钟搅动一次,使其充分提取。
[3] 何国庆 , 丁立孝 . 食品酶学 . 北京 : 化学工业出版社 2009 [4] 周晓云编著.酶技术.北京:石油工业出版社,1995 [5] 罗贵民.酶工程.北京:化学工业出版社,2003 [6] /question/266186296.htm l
实训原理:
淀粉酶活力的大小与产生的还原糖的量成正比。用标准浓度 的麦芽糖溶液制作标准曲线,用比色法测定淀粉酶作用于淀 粉后生成的还原糖的量,以单位重量样品在一定时间内生成 的麦芽糖的量表示酶活力。
淀粉酶存在于几乎所有植物中,特别是萌发后的禾谷类种子, 淀粉酶活力最强,其中主要是α- 淀粉酶和β- 淀粉酶。两种 淀粉酶特性不同,α - 淀粉酶不耐酸,在pH3.6 以下迅速钝化。 β-淀粉酶不耐热,在70℃15min钝化。
( 3 )如果条件允许,各实验小组可采用不同材料,
参考文献:
[1] Gardner H W.Recent investigations into the lip oxygenase pathway of plants.Biochem Biophysical Ac ta.1991 [2] 莎娜,赵立超,陈永泉.α-淀粉酶对甘薯果脯废糖液澄 清效果的研究
生化实验04-淀粉酶活性的测定

四、实验步骤
1、麦芽糖标准曲线的制作 A540=0.264x-0.052 (x为mg麦芽糖) 2、酶液制备
称取1g萌发的小麦种子 加少量蒸馏水 研磨 转入100 mL容量瓶 定容 放置15min 过滤 淀粉酶原液(酶液Ⅰ) 取酶液Ⅰ 10 mL于50 mL容量瓶,用蒸馏水定容 至刻度,摇匀,即为淀粉酶稀释液(酶液Ⅱ)
实验04
一、目的
二、原理
淀粉酶的作用机制及产物显色原理: α-淀粉酶 (内切酶) 淀粉 β-淀粉酶 (外切酶) 麦芽糖等 寡聚糖 麦芽糖 3,5-二硝 基水杨酸 3-氨基-5硝基水杨酸
(棕红色)
淀粉酶活性大小的表示方法:
淀粉酶活性的大小与产生的还原糖的量成正比。以单 位质量样品单位时间生成的还原糖的量表示。
பைடு நூலகம்
3、酶活力的测定
取4支干净的具塞刻度试管,编号,按下表操作:
操作项目
Ⅰ-1 淀粉酶原液(酶液Ⅰ)/mL 钝化β-淀粉酶 淀粉酶稀释液(酶液Ⅱ)/mL 3,5-二硝基水杨酸/ mL 预保温 1%淀粉溶液/ mL( 40。C ) 保温 3,5-二硝基水杨酸/ mL 0 0 2.0 1.0 Ⅰ-2 1.0
测定α-淀粉酶和β-淀粉酶: α-淀粉酶不耐酸, β-淀粉酶不耐热,本实验采用70。 C保温15min钝化β-淀粉酶而测出α-淀粉酶。总活力 减去α-淀粉酶活力则为β-淀粉酶活力。
三、材料、仪器设备及试剂
材料:萌发的小麦种子(芽长1cm)
仪器设备:分光光度计、恒温水浴、刻度试管、
容量瓶
试剂:
1、标准麦芽糖溶液(1mg/mL) 2、3,5-二硝基水杨酸(含NaOH) 3、1%淀粉溶液
空白管:
2 mL蒸馏水 + 2 mL3,5-二硝基水杨酸,沸水浴 5min,定容至20 mL
淀粉酶的制备及活力测定

• 3、酶活力的测定:取5支干净的试管,编号,按表 进行操作
反应顺序 样品(重 复3个)
标准空白
样品空白
样品稀释液 (ml)
蒸馏水 依次加入淀粉 溶液(ml) 依次加入DNS 试剂(ml) 加入蒸馏水至 总体积(ml)
1
0 0 60℃预热5min 1.5
1
1
0
1.5
1.5
混合60℃保温30min 1.5 1.5 1.5
二、实验原理
• α -淀粉酶是内切酶,酶的作用点仅限于淀粉链的α -1,4 糖苷键,对α -1,6糖苷键不能作用,但能越过α -1,6糖 苷键,将α -1,4糖苷键随机切断成长短不一的短链糊精, 而使淀粉对碘呈蓝紫色的特异性反应逐渐变红棕色。 • 在酶解的最初阶段,α -淀粉酶对淀粉的水解速度很快,但 当水解到一定程度后,水解虽在继续进行,水解速度却变得 缓慢。该酶的最小作用底物是麦芽三糖以上的低聚糖,对麦 芽三糖的作用很弱,对麦芽糖没有水解能力。 • 枯草芽孢杆菌(Bacillus subtilis)是当今工业酶制剂的主要生 产菌种之一,主要用于生产淀粉酶、蛋白酶和脂肪酶等。 • 本实验利用高产α -淀粉酶的枯草芽孢杆菌T2生产α -淀粉 酶用于制备淀粉水解糖。
三、材料、试剂与仪器
• 实验材料:萌发的小麦种子(芽长1厘米左右) • 仪器:722光栅分光光度计,恒温水浴锅,离心机,容量 瓶,小台秤,研钵,具塞刻度试管,试管,移液器,烧杯 • 试剂:① 1%淀粉溶液(称取1克可溶性淀粉,加入80ml蒸 馏水,加热熔解,冷却后定容至100ml); ② pH5.6的柠檬缓冲液: • A液(称取柠檬酸20.01克,溶解后定容至1L) • B液(称取柠檬酸钠29.41克,溶解后定容至1L) • 取A液5.5ml、B液14.5ml混匀即为pH5.5柠檬酸缓冲液;
淀粉酶的活力测定与制备 打印

淀粉酶的制备与活力测定基础知识淀粉酶是水解淀粉(包括糖原、糊精)中糖苷键的一类酶的统称,广泛存在于动植物和微生物中。
它是研究较多、生产最早、产量最大和应用最广的一类酶。
1.α-淀粉酶的结构目前,已对很多不同种类和来源的α-淀粉酶(黑曲霉、米根霉、人和猪胰腺、人唾液腺、大麦种子和地衣芽孢杆菌)的晶体结构进行了X-射线衍射研究,并得到了高分辨率的晶体结构图。
研究表明所有α-淀粉酶均为分子量在50ku 左右的单体,由经典的三个区域(A、B、C)组成:中心区域A由一个(β/α)8圆筒构成;区域B由一个小的β-折叠突出于β3和α3之间构成;而C-末端球型区域C则由一个Greek-key基序组成,为该酶的活性部位,负责正确识别底物并与之结合。
为保持α-淀粉酶的结构完整性和活性,至少需要一个能与之紧密结合的Ca2+,而Cl-往往是α-淀粉酶的变构激活因子,并且在所有Cl-依赖性的α-淀粉酶中,组成催化三联体的残基都是严格保守的[10]。
2.α-淀粉酶的性质早在1967年,Jones 和Varner就对小麦中α-淀粉酶的活性进行了研究[11]。
不同来源的α-淀粉酶的酶学和理化性质有一定的区别,它们的性质对在其工业应用中的应用影响也较大,在工业生产中要根据需要使用合适来源的酶,因此对淀粉酶性质的研究也显得比较重要。
2.1底物特异性α-淀粉酶和其它酶类一样,具有反应底物特异性,不同来源的淀粉酶反应底物也各不相同,通常α-淀粉酶显示出对淀粉及其衍生物有最高的特异性,这些淀粉及衍生物包括支链淀粉、直链淀粉、环糊精、糖原质和麦芽三糖等。
2.2最适 pH和最适温度反应温度和pH对酶活力影响较大,不同来源的α-淀粉酶有各自的最适作用pH和最适作用温度,通常在最适作用pH和最适作用温度条件下酶相对比较稳定,在此条件下进行反应能最大程度地发挥酶活力,提高酶反应效率。
因此,在工业应用中应了解不同的酶最适pH和最适温度,确定反应的最佳条件,最大限度地提高酶的使用效率是很重要的。
淀粉酶的制备及活力测定方案

1
2
3
2、加蒸馏水1ml
加NaOH1ml
加HCl1ml
1
2
3
3、各加可溶性淀粉溶液2ml
1
2
3
4、放入60º C热水中
5、加斐林试剂2ml
1
2
3
60º C热水
60º C热水 温度条件保持5min
60º C热水
6、煮沸1min
1 2 3
实验器材
• 1.菌种:枯草芽孢杆菌JD-32生产法 • 2.仪器:培养皿、试管、发酵罐、灭菌 锅、振荡培养箱、高速冷冻离心机
工艺流程
保藏菌种
斜面活化
摇瓶种子 培养
厚层通风 发酵
种子罐扩 大培养
粗制品 沉淀 收集滤液 过滤
烘干 抽提 麸曲
离心洗涤沉淀ຫໍສະໝຸດ 风干粉碎精制品
实验步骤
1.培养基 的制备 与灭菌
三、实验步骤
• (一)麦芽糖标准曲线的制作:取7支干净的具塞刻度试管,编号,按表(详 教材)加入试剂。摇匀,置沸水浴中煮沸5min。取出后流水冷却,加蒸馏水 定容至20ml。以1号管作为空白调零点,在540nm波长下比色测定。以麦芽 糖含量为横座标,吸光度值为纵座标,绘制标准曲线.(二)酶液制备:称取 1g萌发3天的小麦种子(芽长约1cm),置于研钵中,加少量石英砂和2ml蒸 馏水,研磨成匀浆。将匀浆倒入离心管中,用6ml蒸馏水分次将残渣洗入离心 管。提取液在室温下放置提取15~20min,每隔数min搅动1次,使其充分提 取。然后在3000rpm下离心10min,将上清液倒入100ml容量瓶中,加蒸馏水 定容至刻度,摇匀,即为淀粉酶原液。吸取上述淀粉酶原液10ml,放入50ml 容量瓶中,用蒸馏水定容至刻度,摇匀,即为淀粉酶稀释液。(三)酶活力 的测定:取6支干净的具塞刻度试管,编号,按表(详教材)进行操作。(四) 结果计算:淀粉酶活力=C×VT/(W×Vs×T)(mg/g/min)。式中,C为从标准曲 线上查得的麦芽糖含量(mg);VT为淀粉酶原液总体积(ml);Vs为反应 所用淀粉酶原液体积(ml);W为样品重量(g);t为反应时间(min)。
淀粉酶活力的测定方法

淀粉酶活力的测定方法淀粉酶主要包括α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶和R-酶,它们广泛存在于动物、植物和微生物界。
不同来源的淀粉酶,性质有所不同。
植物中最重要的淀粉酶是α -淀粉酶和β-淀粉酶。
α -淀粉酶随机作用于直链淀粉和支链淀粉的直链部分α -1,4糖苷键,单独使用时最终生成寡聚葡萄糖、α-极限糊精和少量葡萄糖。
Ca 2+能使α-淀粉酶活化和稳定,它比较耐热但不耐酸,pH 3.6 以下可使其钝化。
β-淀粉酶从非还原端作用于α-1,4糖苷键,遇到支链淀粉的α -1,6键时停止。
单独作用时产物为麦芽糖和β-极限糊精。
β-淀粉酶是一种巯基酶,不需要Ca 2+及Cl —等辅助因子,最适pH偏酸,与α -淀粉酶相反,它不耐热但觉耐酸,60 ℃保温15min可使其钝化。
通常提取液中α -淀粉酶和β-淀粉酶同时存在。
可以先测定(α + β)淀粉酶总活力,然后在60 ℃加热15 min ,钝化β-淀粉酶,测出α -淀粉酶活力,用总活力减去α - 淀粉酶活力,就可求出β- 淀粉酶活力。
淀粉酶活力大小可用其作用于淀粉生成的还原糖与3,5- 二硝基水杨酸的显色反应来测定。
还原糖作用于黄色的3,5- 二硝基水杨酸生成棕红色的3- 氨基-5- 硝基水杨酸,生成物颜色的深浅与还原糖的量成正比。
以每克样品在一定时间内生成的还原糖(麦芽糖)量表示酶活大小。
1 酶活测定方法(1)标准曲线的制作(见下表)①取7支20 ml具塞刻度试管,预先洁净灭菌干燥,编号,按表加入试剂。
②摇匀,至沸水浴中煮沸5 min。
取出后流水冷却,加蒸馏水定容至20 ml,以1号管作为空白调零点,在520 nm的波长下比色测定吸光度值。
并建立通过吸光度值求麦芽糖含量的回归方程。
表1 标准麦芽糖溶液成分表及OD测定值试剂 1 2 3 4 5 6 7 麦芽糖标准液(mL)0 0.2 0.6 1.0 1.4 1.8 2.0 H2O(mL) 2.0 1.8 1.4 1.0 0.6 0.2 0 3,5-二硝基水杨酸(mL) 2.0 2.0 2.0 2.0 2.0 2.0 2.0 麦芽糖含量(mg)0 0.2 0.6 1.0 1.4 1.8 2.0 OD520(2)粗酶液淀粉酶活力测定①待测粗酶液的制备:发酵24 h后发酵液4000 r/ min离心10 min,去除菌体,在上清液中加入65%饱和度的硫酸铵,待硫酸铵充分溶解后于4℃盐析2h,然后5000r/min离心20min,得到初步纯化的淀粉酶。
实验一α-淀粉酶活力的测定

结果处理与计算
数据处理
根据实验数据,我们计算了酶活力、 反应速率等参数。
图表绘制
我们使用图表展示了实验结果,以便 更直观地分析数据。
结果分析
酶活力比较
通过比较不同浓度酶液的酶活力,我们可以得出酶活力与酶浓度 之间的关系。
反应速率分析
通过分析反应速率,我们可以了解酶促反应的动力学特征。
结论总结
综合以上分析,我们可以得出实验一α-淀粉酶活力测定的结论, 并为其应用提供依据。
用紫外可见分光光度计在540nm波长处测定各管 的吸光度值。
数据记录与处理
01
记录实验数据,计算α-淀粉酶活力。
02
根据实验数据绘制标准曲线和酶 活性曲线。
04
结果分析
数据记录
实验数据
在实验过程中,我们记录了不同浓度 酶液处理后的反应时间、温度、pH值 等数据。
实验误差
在实验过程中,我们尽量减小误差, 如使用精确的测量工具、多次测量取 平均值等。
05
实验总结与讨论
实验总结
01
实验原理
本实验通过测定α-淀粉酶催化淀粉水解生成可溶性糖的速率,从而确定
酶活力的大小。
02 03
实验步骤
准确称取适量淀粉和底物溶液,加入试管中,加入适量酶液,在适宜温 度下恒温水浴一定时间,然后加入碘液和氢氧化钠溶液终止反应,最后 用斐林试剂进行滴定。
实验结果
通过滴定结果计算出α-淀粉酶活力的大小。
DNS溶液
称取3,5-二硝基水杨酸6.3g,溶解于50mL蒸馏水中,加入2mol/L氢氧化钠溶液 16.8mL,再加入20%酒石酸钾钠溶液10mL和2mol/L硫酸溶液20mL,混合均匀后 加热至80℃,不断搅拌,直至溶液呈透明。冷却后用蒸馏水定容至100mL,避光保 存。
实验一α淀粉酶活力测定

缓冲液
④
5 mL
淀粉液
20 mL
混合液
2.0 mL
⑥
酶液
0.5 mL
50mL
10 mL 溶解
煮沸
冷却 100 mL
30 s
⑦
60 s
⑤
1. 5 mL
碘液
90 s 120 s
0.5 mL
60℃ 60℃,5 min
60℃
180 s 210 s
[实验结果计算]
α-淀粉酶活力
1 g酶粉(或l mL酶液)在60℃、pH6.0条件下, 以1 h(60 min) 液化可溶性淀粉的克数(或毫克数)为1酶活 力单位,即1IU,单位为可溶性淀粉量(g) /mL·min。
实验一α-淀粉酶活力的测定
[实验性质]验证性实验 [实验学时]2学时 [实验目的](1)掌握淀粉酶糖化淀粉的原理; (2)掌握淀粉酶的性质及作用;
[实验原理]
α-淀粉酶催化淀粉水解生成小分子可溶性糊 精和少量的麦芽糖、葡萄糖,这些产物与碘 反应呈现不同的颜色。通过呈色反应,可了 解底物的降解速率,并以此可反映酶活力。
α-淀粉酶制剂的酶学特性及其应用
概述:中温α-淀粉酶采用枯草芽孢杆菌(Bacillus Subtilis)经 深层发酵提炼而成。广泛应用于酒精、啤酒、味精、淀粉糖、 发酵工业的液化以及纺织、印染退浆等。
原理:能水解淀粉分子中的α-1.4葡萄糖苷键,任意切断成长 短不一的短链糊精及少量的低分子糖类,直链淀粉和支链淀 粉均以无规则的形式进行分解,从而使淀粉糊的粘度迅速下 降,即“液化”作用,故又称液化酶。
中文摘要、中文关键词、英文摘要、英文关键词、前言、材 料与方法、结果与讨论、结论、参考文献等顺序。 2. 报告书的篇幅要求2000字以上。 3. 参考文献必须5篇以上,并至少有一篇英文。 4. 提交时间限为每周一 下午3点。先交到课代表,由课代表汇 总之后按时送到任课老师办公室。 5. 领取的报告书要妥善保管,期末考试时作参考。
淀粉酶

首页> 实验> 植物实验> 淀粉酶活性的测定淀粉酶活性的测定2005-12-05 00:00:00 来源:评论:0一、原理淀粉酶(amylase)包括几种催化特点不同的成员,其中α-淀粉酶随机地作用于淀粉的非还原端,生成麦芽糖、麦芽三糖、糊精等还原糖,同时使淀粉浆的粘度下降,因此又称为液化酶;β-淀粉酶每次从淀粉的非还端切下一分子麦芽糖,又被称为糖化酶;葡萄糖淀粉酶则从淀粉的非还原端…一、原理淀粉酶(amylase)包括几种催化特点不同的成员,其中α-淀粉酶随机地作用于淀粉的非还原端,生成麦芽糖、麦芽三糖、糊精等还原糖,同时使淀粉浆的粘度下降,因此又称为液化酶;β-淀粉酶每次从淀粉的非还端切下一分子麦芽糖,又被称为糖化酶;葡萄糖淀粉酶则从淀粉的非还原端每次切下一个葡萄糖。
淀粉酶产生的这些还原糖能使3,5-二硝基水杨酸还原,生成棕红色的3-氨基-5-硝基水杨酸。
淀粉酶活力的大小与产生的还原糖的量成正比。
可以用麦芽糖制作标准曲线,用比色法测定淀粉生成的还原糖的量,以单位重量样品在一定时间内生成的还原糖的量表示酶活力。
几乎所有植物中都存在有淀粉酶,特别是萌发后的禾谷类种子淀粉酶活性最强,主要是α-和β-淀粉酶酶不。
Α-淀粉耐酸,在pH3.6以下迅速钝化;而β-淀粉酶不耐热,在70℃15min则被钝化。
根据它们的这种特性,在测定时钝化其中之一,就可测出另一个的活力。
本实验采用加热钝化β-淀粉酶测出α-淀粉酶的活力,再与非钝化条件下测定的总活力(α+β)比较,求出β-淀粉酶的活力。
二、材料、仪器设备及试剂(一)材料:萌发的小麦种子(芽长约1cm)。
(二)仪器设备:1. 分光光度计;2. 离心机;3. 恒温水浴(37℃,70℃,100℃);4.具塞刻度试管;5. 刻度吸管;6. 容量瓶。
(三)试剂(均为分析纯):1. 标准麦芽糖溶液(1mg/ml):精确称取100mg麦芽糖,用蒸馏水溶解并定容至100ml;2. 3,5-二硝基水杨酸试剂:精确称取1g3,5-二硝基水杨酸,溶于20ml2mol/L NaOH溶液中,加入50ml蒸馏水,再加入30g酒石酸钾钠,待溶解后用蒸馏水定容至100ml。
实验一α淀粉酶活力测定

颜色变化终点要照像,并多媒体型实验结果 单独标注班级和小组名提交或图片型实验结果 直接写入在实验报告书里。
[实验报告书书写要求]
1. 实验报告书的编写要参考教师提出的写作格式规范。 2. 即:题目、作者(包括同组成员)、单位(班级和组别)、
缓冲液
④
5 mL
淀粉液
20 mL
混合液
2.0 mL
⑥
酶液
0.5 mL
50mL
10 mL 溶解
煮沸
冷却 100 mL
30 s
⑦
60 s
⑤
1. 5 mL
碘液
90 s 120 s
0.5 mL
60℃ 60℃,5 min
60℃
180 s 210 s
[实验结果计算]
α-淀粉酶活力
1 g酶粉(或l mL酶液)在60℃、pH6.0条件下, 以1 h(60 min) 液化可溶性淀粉的克数(或毫克数)为1酶活 力单位,即1IU,单位为可溶性淀粉量(g) /mL·min。
实验步骤实验步骤样品测定步骤混合液缓冲液淀粉液606030min605minml20ml603005ml05mlml20ml80ml10ml50ml1000250ml150ml淀粉酶50ml溶解10ml可溶性淀粉20g煮沸冷却100ml2淀粉液淀粉酶活力淀粉酶活力ml酶液在60ph60条件下以1h60min液化可溶性淀粉的克数或毫克数为1酶活力单位即1iu单位为可溶性淀粉量gmlmin
1、在饴糖、酶法味精上的应用 淀粉浆浓度为16-17B,调PH至6.2-6.4,并加入 0.2%氯化钙(按原料重量计算),然后将淀粉酶加入淀粉浆中(每克原料用酶6-8个 单位),充分混合后,加热至85 -90℃,液化30分钟左右。 2、在啤酒生产上的应用 使用大米、玉米为辅料时先磨粉通过40目以上筛孔, 在糊化锅中调浆后加淀粉酶,加酶量在6个单位/克原料左右,在85 -90℃液化30 分钟。 3、在纺织品退浆上的应用 使用精制的液体淀粉酶作为退浆剂,适用于不耐高 温的丝绸、化纤、棉毛织品的退浆工艺,加酶量在0.2%(2000u/g)左右,在水浴 50 -80℃ 20-40分钟。 4、其它工业 一般控制在加酶量在每克淀粉6-8个酶活力单位,钙离子浓度 150ppm。 储存:本品系生物活性物质,日光、温度、湿度要引起酶失活。应防止太阳直晒, 宜放在低温干燥处。
淀粉酶活力测定方法
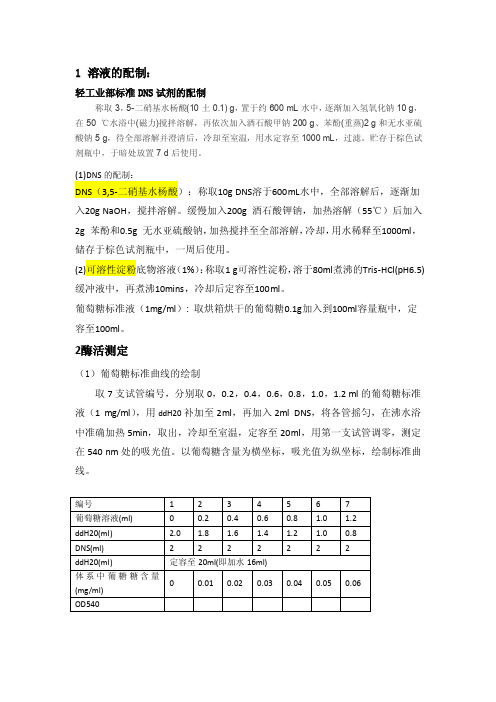
1 溶液的配制:轻工业部标准DNS试剂的配制称取3,5-二硝基水杨酸(10土0.1) g,置于约600 mL水中,逐渐加入氢氧化钠10 g,在50 ℃水浴中(磁力)搅拌溶解,再依次加入酒石酸甲钠200 g、苯酚(重蒸)2 g和无水亚硫酸钠5 g,待全部溶解并澄清后,冷却至室温,用水定容至1000 mL,过滤。
贮存于棕色试剂瓶中,于暗处放置7 d后使用。
(1)DNS的配制:DNS(3,5-二硝基水杨酸):称取10g DNS溶于600mL水中,全部溶解后,逐渐加入20g NaOH,搅拌溶解。
缓慢加入200g 酒石酸钾钠,加热溶解(55℃)后加入2g 苯酚和0.5g 无水亚硫酸钠,加热搅拌至全部溶解,冷却,用水稀释至1000ml,储存于棕色试剂瓶中,一周后使用。
(2)可溶性淀粉底物溶液(1%):称取1 g可溶性淀粉,溶于80ml煮沸的Tris-HCl(pH6.5)缓冲液中,再煮沸10mins,冷却后定容至100ml。
葡萄糖标准液(1mg/ml): 取烘箱烘干的葡萄糖0.1g加入到100ml容量瓶中,定容至100ml。
2酶活测定(1)葡萄糖标准曲线的绘制取7支试管编号,分别取0,0.2,0.4,0.6,0.8,1.0,1.2 ml的葡萄糖标准液(1 mg/ml),用ddH20补加至2ml,再加入2ml DNS,将各管摇匀,在沸水浴中准确加热5min,取出,冷却至室温,定容至20ml,用第一支试管调零,测定在540 nm处的吸光值。
以葡萄糖含量为横坐标,吸光值为纵坐标,绘制标准曲线。
(2)DNS法取2个试管,分别为对照管和样品管。
将两试管中各加入Tris缓冲液800 μl 和底物溶液100 μl,37℃水浴保温5min,然后在对照管中加入灭活的纯化酶液(沸水浴煮沸10min)100 μl,样品管中加入纯化酶液100 μl,立即混匀计时,在37℃水浴中准确反应30min后加入等体积的DNS(1ml)终止反应,沸水浴显色5min,冷却后,定容至10ml,在540nm分光光度计测定吸光值,每个样品重复三次,取平均值。
淀粉酶活性测定实验报告(完整版)

报告编号:YT-FS-2637-32淀粉酶活性测定实验报告(完整版)After Completing The T ask According To The Original Plan, A Report Will Be Formed T o Reflect The Basic Situation Encountered, Reveal The Existing Problems And Put Forward Future Ideas.互惠互利共同繁荣Mutual Benefit And Common Prosperity淀粉酶活性测定实验报告(完整版)备注:该报告书文本主要按照原定计划完成任务后形成报告,并反映遇到的基本情况、实际取得的成功和过程中取得的经验教训、揭露存在的问题以及提出今后设想。
文档可根据实际情况进行修改和使用。
淀粉酶活性的测定一、研究背景及目的酶是高效催化有机体新陈代谢各步反应的活性蛋白,几乎所有的生化反应都离不开酶的催化,所以酶在生物体内扮演着极其重要的角色,因此对酶的研究有着非常重要的意义。
酶的活力是酶的重要参数,反映的是酶的催化能力,因此测定酶活力是研究酶的基础。
酶活力由酶活力单位表征,通过计算适宜条件下一定时间内一定量的酶催化生成产物的量得到淀粉酶是水解淀粉的糖苷键的一类酶的总称,按照其水解淀粉的作用方式,可分为α-淀粉酶和β-淀粉酶等。
α-淀粉酶和β-淀粉酶是其中最主要的两种,存在于禾谷类的种子中。
β-淀粉酶存在于休眠的种子中,而α-淀粉酶是在种子萌发过程中形成的。
α-淀粉酶活性是衡量小麦穗发芽的一个生理指标,α-淀粉酶活性低的品种抗穗发芽,反之则易穗发芽。
目前,关于α-淀粉酶活性的测定方法很多种,活力单位的定义也各不相同,国内外测定α-淀粉酶活性的方法常用的有凝胶扩散法、3 ,5-二硝基水杨酸比色法和降落值法。
这3 种方法所用的材料分别是新鲜种子、萌动种子和面粉,获得的α-淀粉酶活性应该分别是延二、实验原理萌发的种子中存在两种淀粉酶,分别是α-淀粉酶和β-淀粉酶,β-淀粉酶不耐热,在高温下易钝化,而α-淀粉酶不耐酸,在pH3.6下则发生钝化。
淀粉酶活力测定实验报告

淀粉酶活力测定实验报告淀粉酶活力测定实验报告实验三、淀粉酶活性的测定实验报告实验四、淀粉酶活性的测定一、实验目的:1、了解α - 淀粉酶和β - 淀粉酶的不同性质及其淀粉酶活性测定的意义;2、学会比色法测定淀粉酶活性的原理及操作要点。
二、实验原理:淀粉酶存在于几乎所有植物中,特别是萌发后的禾谷类种子,淀粉酶活力最强,其中主要是α-淀粉酶和β-淀粉酶。
根据α-淀粉酶和β-淀粉酶特性不同,α-淀粉酶不耐酸,在pH3.6以下迅速钝化;β-淀粉酶不耐热,70? 15min 则被钝化。
测定时,使其中一种酶失活,即可测出另一种酶的活性。
淀粉在淀粉酶的催化作用下可生成麦芽糖,利用麦芽糖的还原性与3,5-二硝基水杨酸反应生成棕色的3-氨基-5-硝基水杨酸,测定其吸光度,从而确定酶液中淀粉酶活力(单位重量样品在一定时间内生成麦芽糖的量)。
三、实验用具:1、实验设备研钵,具塞刻度试管,离心管,分光光度计,酸度计,电热恒温水浴锅,离心机,电磁炉。
2、实验材料与试剂(1)0.1mol/l pH5.6的柠檬酸缓冲液:A液:称取柠檬酸20.01g,定容至1000ml;B液:称取柠檬酸钠29.41g,定容至1000ml;取A液55ml与B液145ml混匀。
(2)1%可溶性淀粉溶液:1g淀粉溶于100ml 0.1mol/l pH5.6的柠檬酸缓冲液;(3)1%3,5-二硝基水杨酸试剂:称取3,5-二硝基水杨酸1g、NaOH 1.6g、酒石酸钾钠30g,定容至100ml水中,紧盖瓶塞,勿使CO2进入;(4)麦芽糖标准溶液:取麦芽糖0.1g溶于100ml水中;(5)pH 6.8的磷酸缓冲液: 取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8,加水稀释至1000ml即得。
(6)0.4mol/L的NaOH溶液;(7)1%NaCl溶液。
(8)实验材料:萌发的谷物种子(芽长约1cm)四、操作步骤1、酶液提取:取6.0g浸泡好的原料,去皮后加入10.0mL 1%的NaCl 溶液,磨碎后以2000r/min 离心10min,转出上清液备用。
淀粉酶活性的测定

淀粉酶活性的测定
1、实验试剂:
(1)1%淀粉磷酸缓冲液称取1.0g的可溶性淀粉,加热溶于磷酸缓冲液,冷却后定容至100ml
(2)磷酸缓冲液(ph6.9)称取0.712g Na2HPO4.2H2O 和0.07nacl溶于150ml 的蒸馏水,用浓正磷酸将ph调制6.9,并用蒸馏水定容至200ml.
(3)2mol/l的NaOH溶液称取8g的NaOH溶于蒸馏水,100ml容量瓶定容. (4)显色剂称取1.0g的3,5二硝基水杨酸滴入少许蒸馏水,20ml的NaOH (2mol/l),溶解后取30.0g的酒石酸钾钠溶于该溶液,然后用蒸馏水定容至100ml (5)麦芽糖溶液称取180mg一水麦芽糖溶于蒸馏水,定容至100ml.
2、实验仪器:.
容量瓶:100ml(5)200(1)
烧杯:100ml(6)500ml (1)
移液管:10ml(2)1ml(3)
试管:若干
3、实验步骤:
(1)不同酶量
(2)平行实验(酶量30ul)。
淀粉酶活力的测定

淀粉酶活力测定一、实验目的以所筛选出的芽孢杆菌为实验菌株,通过种子扩大培养,选出生长力旺盛的菌株进行液体摇瓶发酵。
通过测定不同发酵时间生产的酶活,来初步估计发酵最佳时期和终点。
通过本实验要掌握测定酶活的方法。
二、实验原理淀粉酶是能够分解淀粉糖苷键的一类酶的总称,包括α-淀粉酶、β-淀粉酶、糖化酶和异淀粉酶。
芽孢杆菌主要用来产生α-淀粉酶和异淀粉酶,其中α-淀粉酶又称淀粉1,4-糊精酶,能够切开淀粉链内部的α-1,4-糖苷键,将淀粉水解为麦芽糖、含有6 个葡萄糖单位的寡糖和带有支链的寡糖与DNS试剂共热呈阳性反应,产生红棕色;而异淀粉酶又称淀粉α-1,6-葡萄糖苷酶、分枝酶,此酶作用于支链淀粉分子分枝点处的α-1,6-糖苷键,将支链淀粉的整个侧链切下变成直链淀粉。
通过发酵实验,我们可以以酶活为依据,初步估计发酵的最佳时期和发酵终点。
酶活力也称酶活性,是以酶在最适温度、最适pH等条件下,催化一定的化学反应的初速度来表示。
本实验是以一定量的淀粉酶液,于37°C、pH6.8的条件下,在一定的初始作用时间里将淀粉转化为还原糖,然后通过与DNS试剂作用,比色测定,求得还原糖的生成量,从而计算出酶反应的初速度,即酶的活力。
这里规定,一个淀粉酶活力单位定义为在37°C、pH6.8的条件下,每分钟水解淀粉生成1mg还原糖所需的酶量。
三、实验材料及设备1、筛选出来的产淀粉酶芽孢杆菌。
2、菌种:从商丘师院土壤中分离出的产淀粉酶的芽孢杆菌3、种子培养基:蛋白胨1 % ,酵母浸出物0. 5 % ,氯化钠1 % , pH自然4、发酵培养基:按正交试验所选的最佳方案来配置5、仪器:控温摇床、高压蒸汽灭菌锅、电子天平、分光光度计、烧杯、玻璃棒、锥形瓶、离心机、刻度试管:25mL×4、容量瓶: 100mL×1、烧杯:250mL×1、滴管 2支、洗耳球2支、洗瓶、试管架、移液管架、移液管、玻棒:各1支四、试剂的配制1、培养基的配制按上述配方称量、溶解、灭菌2、淀粉溶液(0.5%)称取5g可溶性淀粉,溶于1000mL热水中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13、遵守纪律的风气的培养,只有领 导者本 身在这 方面以 身作则 才能收 到成效 。—— 马卡连 柯 14、劳动者的组织性、纪律性、坚毅 精神以 及同全 世界劳 动者的 团结一 致,是 取得最 后胜利 的保证 。—— 列宁 摘自名言网
15、机会是不守纪律的。——雨果
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
